Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un sondeo de la fuerza directa para medir la integración mecánica entre el núcleo y el citoesqueleto
En este artículo
Resumen
En este protocolo, se describe un método de la micropipeta para aplicar directamente una fuerza controlada al núcleo en una célula viva. Este ensayo permite interrogatorio de nucleares propiedades mecánicas en la célula viva, adherente.
Resumen
Las propiedades mecánicas del núcleo determinan su respuesta a fuerzas mecánicas generadas en las células. Porque el núcleo es molecularmente continuo con el citoesqueleto, se necesitan métodos para sondear su comportamiento mecánico en las células adherentes. Aquí, discutimos la sonda fuerza directa (DFP) como una herramienta para aplicar la fuerza directamente al núcleo en una célula adherente de viva. Atribuimos una micropipeta estrecha a la superficie nuclear con la succión. La micropipeta es traducida fuera del núcleo, que hace que el núcleo se deforman y traducir. Cuando la fuerza restauradora es igual a la fuerza de succión, el núcleo se separa y elásticamente se relaja. Porque precisamente se conoce la presión de succión, se conoce la fuerza en la superficie nuclear. Este método ha revelado que las fuerzas de la nano-escala son suficientes para deformar y traducir el núcleo de las células adherentes e identificaron elementos citoesqueléticos que permiten el núcleo resistir las fuerzas. El DFP puede utilizarse para analizar las contribuciones de los componentes celulares y nucleares para propiedades mecánicas nucleares en las células vivas.
Introducción
Patologías como el cáncer implican alteraciones nuclear forma y estructura1,2, que generalmente están acompañados por una descalcificación de los núcleo3,4. Nuclear resistencia a la deformación mecánica se ha caracterizado generalmente por aplicación de una fuerza en núcleos aislados5.
El núcleo en las células está conectado molecularmente con el citoesqueleto por el vinculador del nucleoesqueleto y citoesqueleto (LINC) complejo6,7,8,9. Como resultado, el núcleo está integrado mecánicamente con el citoesqueleto y, a través de adherencias de sustrato celular, la matriz extracelular. Mecánicamente el núcleo interior de las células adherentes de sondeo puede proporcionar la penetración en esta integración mecánica. Los métodos para manipular los núcleos en las células vivas incluyen micropipeta aspiración10,11y microscopía de fuerza atómica12,13,14. Recientemente hemos descrito un sondeo de la fuerza directa (DFP) que aplica fuerzas mecánicas directamente sobre el núcleo de una vida celular adherente15.
Aquí describiremos el procedimiento para utilizar un sistema de microinyección que está comúnmente disponible en las instalaciones de microscopía para aplicar una fuerza mecánica de nano-escala conocida, directamente al núcleo en una célula adherente. Un femtotip (punta de micropipeta del diámetro del μm 0,5) es montado y conectado al sistema de microinyección por un tubo. La punta, colocada en un ángulo de 45° con respecto a la superficie de la placa de cultivo, se baja hasta adyacente a la superficie nuclear. El tubo entonces se desconecta y abierto a la atmósfera, que crea una presión negativa de succión en la superficie nuclear y sella la punta de la micropipeta contra la superficie nuclear. A través de la traducción de la punta de una micropipeta, el núcleo es deforme y eventualmente (dependiendo de la magnitud de fuerza aplicada), separado de la micropipeta. Esta separación se produce cuando las fuerzas de restauración (resistencia), ejercidas por el núcleo y la célula, igualan a la fuerza de la succión aplicada por la micropipeta. Análisis se pueden realizar midiendo el desplazamiento del núcleo, la cepa de longitud (ecuación 1), o la deformación de la zona (figura 1A).
Protocolo
1. preparar las células para la proyección de imagen
Nota: La punta de prueba de fuerza directa (DFP) se puede utilizar para cualquier tipo de células adherentes. Aquí, fibroblastos de ratón 3T3 NIH se utilizan como la línea celular de modelo para este protocolo.
- Células de fibroblastos 3T3 NIH la cultura en el medio modificado Eagle de Dulbecco (DMEM) suplementado con 10% suero bovino de donante y 1% de penicilina-estreptomicina en un fondo de cristal de 35 mm plato hasta confluencia deseada. Mantener las células a 37 ° C y 5% CO2.
- Asegúrese de cubrir todos platos de fondo de cristal de 35 mm con 5 μg/mL de fibronectina (o proteína similar de ECM), antes de sembrar las células 3T3 de NIH para la proyección de imagen.
Nota: Las células deben ser completamente extendidas y adherente en el plato para el experimento. No hay restricciones en cuanto a la confluencia del método DFP trabajar.
- Asegúrese de cubrir todos platos de fondo de cristal de 35 mm con 5 μg/mL de fibronectina (o proteína similar de ECM), antes de sembrar las células 3T3 de NIH para la proyección de imagen.
- Inmediatamente antes del experimento, se lavan las células dos veces con PBS, seguido de un lavado solo con medio de cultivo completo.
- Añadir 3 mL de medio de cultivo completo en el plato de fondo de vidrio.
2. microscopia y adquisición de imágenes
Nota: Un invertido fluorescencia microscopio (o equivalente) con instrumental quirúrgico instalado en el brazo lateral, según las recomendaciones del fabricante. El microscopio también debe ser equipado con una cámara de medio ambiente para mantener la temperatura a 37 ° C y el nivel de CO2 al 5%. También se requiere un instrumental quirúrgico y microinyector conectado al microscopio. Una inmersión de aceite 40 x / 1.3 NA o 60 x / 1.49 NA (u objetivos equivalentes) se recomiendan para los experimentos. El microscopio debe montarse sobre una tabla de aislamiento de vibración.
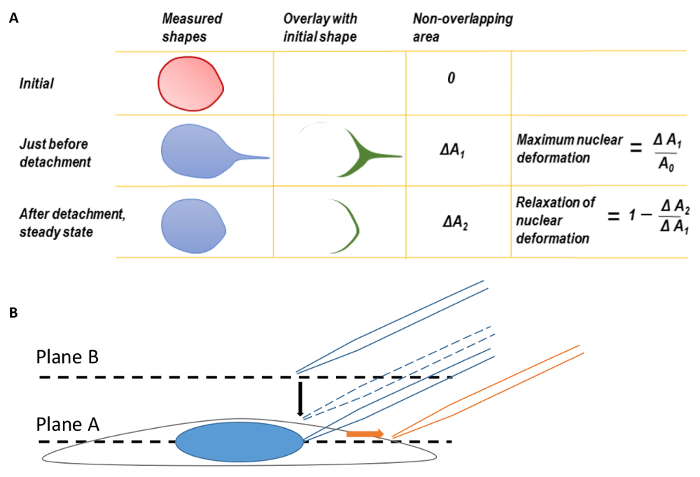
Figura 1 . Deformación nuclear y enfoque del microscopio
A. máxima deformación nuclear y relajación de la deformación nuclear. Antes de calcular la máxima deformación nuclear, los bordes posteriores de las formas nucleares fueron primero coincidió para corregir para la traducción de núcleo deformado. La forma del núcleo en el momento de desprendimiento de la punta de una micropipeta se superpuestos en la forma nuclear inicial antes de tirar. Se midió la diferencia de área entre las dos formas como ΔA1. La máxima deformación nuclear se define como ΔA1 dividido por el área nuclear original. Del mismo modo, un segundo parámetro, ΔA2, puede ser definido por la superposición de la forma nuclear de estado estacionario final después del desprendimiento de la micropipeta en la forma nuclear original. B. centrar el celular en el plano A y luego mover el plano focal hasta plano B para encontrar la punta de la micropipeta. Durante la proyección de imagen, la micropipeta fue traducida a la derecha (dirección de la flecha naranja). Esta figura ha sido modificada de Neelam et al. 15. haga clic aquí para ver una versión más grande de esta figura.
- Encienda la microinyectora según el protocolo del fabricante.
- Utilizando un gotero de aceite de inmersión, aplique una sola gota de aceite de inmersión sobre la lente del objetivo.
- Sujete el plato firmemente en el soporte del plato y el soporte de plato en la etapa de carga.
Nota: Las células deben mantenerse a 37 ° C y 5% de CO2 durante todo el experimento. - Ajuste la altura del objetivo para traer las células en el foco (A plano, figura 1B).
- Mover la platina del microscopio para encontrar una célula de interés.
- Gire la palanca de mando en el micromanipulador para mover el soporte de la pipeta a la posición superior. Carga de la micropipeta de punta de 0,5 μm de diámetro en el soporte de pipeta.
- Para evitar la adherencia de la célula a la micropipeta, tratamiento previo de la punta de la micropipeta con 0,3 mg/mL solución de PLL-g-PEG durante 1 h a temperatura ambiente. Prueba de adherencia tocando la micropipeta al núcleo sin ninguna presión de succión, y luego traducir la micropipeta lejos del núcleo. La falta de adherencia se puede discernir de una completa falta de deformación nuclear y traducción.
Nota: Por favor, siga las sugerencias de la fabricación para abrir el paquete.
- Para evitar la adherencia de la célula a la micropipeta, tratamiento previo de la punta de la micropipeta con 0,3 mg/mL solución de PLL-g-PEG durante 1 h a temperatura ambiente. Prueba de adherencia tocando la micropipeta al núcleo sin ninguna presión de succión, y luego traducir la micropipeta lejos del núcleo. La falta de adherencia se puede discernir de una completa falta de deformación nuclear y traducción.
- Levantar el plano focal objetivo sobre el plano A y la parte superior de la celda al plano B ajustando el control de estabilidad (figura 1B, consulte el paso 2.4).
- Establezca el instrumental quirúrgico para controlar el grueso . Lentamente llevar la micropipeta hasta plano B observando la silueta de la micropipeta, hasta que la micropipeta se quede totalmente enfocada.
- Una vez que la punta de la micropipeta está en foco, establezca el micromanipulador para controlar bien .
- Bajar el objetivo para el plano ecuatorial de la célula (plano A, figura 1B) y baje la micropipeta a alrededor de 15 μm sobre plano A (figura 1B, micropipeta discontinua).
- Ajuste la presión de compensación (Pc) en la microinyectora a presión deseada; Espere unos segundos para estabilizar la presión.
Nota: El punto de ajuste de la presión óptima depende de tipo de la célula y los objetivos específicos del experimento. Para la mayoría de los casos, 300 hPa sería un buen punto de partida. - Asegúrese de que no esté obstruida la micropipeta utilizando el ajuste de limpiar en el panel de instrumental quirúrgico y comprobación para asegurarse de que las burbujas de aire surgen desde la punta de la micropipeta.
- Inserte la punta en la célula reduciendo gradualmente la micropipeta hasta que la punta es tocar ligeramente la superficie nuclear.
Nota: Al bajar la micropipeta, la silueta de la punta de la micropipeta se convertirá en clara ya que viene en foco. Antes de la micropipeta toca el núcleo, aumentar el foco objetivo y alinear la punta de la micropipeta con núcleo (misma coordenada de x-y, z-plano superior). Volver la atención hacia el plano ecuatorial del núcleo (A plano, figura 1B) y poco a poco baje la punta de la micropipeta. - Desconectar el tubo de suministro de presión del sistema de microinyección, abriendo así el extremo del tubo una micropipeta a la atmósfera para crear un sello entre la punta de la micropipeta y la membrana nuclear. Este paso crea una presión negativa igual a Pc en la superficie nuclear.
- Adquisición de imágenes con el software de colección de imágenes de microscopios. Establezca una adquisición de avi (video) o nd-adquisición (imágenes) en el software de colección de la imagen.
Nota: Para cualquier adquisición de software de imágenes, crear imágenes de video en tiempo real o adquisiciones de Time-lapse de imágenes con un intervalo de tiempo corto. - Alternar al fluorescente correspondiente canal la proyección de imagen (es decir, GFP, RFP, etc.) y comienza la proyección de imagen.
- Traducir la punta de la micropipeta lejos del cuerpo de la célula (a la derecha, figura 1B) hasta que el núcleo se desprende de la micropipeta.
Nota: Tire de la punta a lo largo de la dirección de x positiva (a la derecha en el campo de visión). El tipo de tracción puede ser programado y controlado por la computadora o el joystick puede ser movido manualmente. No hemos encontrado ninguna correlación entre la tracción velocidad y deformación nuclear15 sugiriendo una respuesta elástica principalmente a la fuerza.
3. Análisis de los datos
- Realizar análisis de imagen con cualquier software de procesamiento de imágenes básica disponible. El grado de deformación nuclear puede cuantificarse por la cepa de longitud (Ɛ) o la deformación de la zona (figura 1A). Cuantificar la tensión longitud utilizando la ecuación 1, donde L y L0 representan las longitudes del núcleo de deformación máxima y la posición inicial, respectivamente.
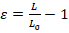 (Ecuación 1)
(Ecuación 1)
Resultados
Figura 2A muestra el forzamiento de un núcleo de fibroblasto de ratón NIH 3T3. Como la punta de la micropipeta es traducida a la derecha, el núcleo se deforma y finalmente se separa de la punta de la micropipeta. La tensión de la longitud del núcleo se considera que aumentan con el aumento de fuerza de la succión (figura 2B). El borde delantero del núcleo (micropipeta tirando borde) forma una protuberancia nuclear y el bor...
Discusión
Medición de la integración mecánica del núcleo con el citoesqueleto es un reto para métodos más actuales, como la micropipeta aspiración16, porque requieren cualquiera de los dos núcleos aislados (donde el núcleo es desacoplado de citoesqueleto) o núcleos en células suspendidas (donde están ausentes las fuerzas extracelulares, tales como las fuerzas de tracción,). Fuerza se ha aplicado al núcleo mediante la aplicación de tensión biaxial a adherente de las células a una membrana
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado por los NIH R01 EB014869.
Materiales
| Name | Company | Catalog Number | Comments |
| FluoroDish | WPI | FD35 | |
| SYTO 59 | ThermoFisher Scientific | S11341 | |
| Femtotips | Eppendorf | 930000043 | |
| InjectMan NI2 | Eppendorf | NA | discontinued, current equivalent model: InjectMan 4 |
| FemtoJet | Eppendorf | NA | Current model FemtoJet 4i |
| Plan Fluor oil immersion 40x | Nikon | NA | |
| Apo TIRF oil immersion 60x | Nikon | NA | |
| Donor Bovine Serum (DBS) | ThermoFisher Scientific | 16030074 | NIH 3T3 serum |
| Dulbecco's Modification of Eagle's (DMEM) | Mediatech cellgro | MT10013CVRF | NIH 3T3 medium |
| Penicillin-Streptomycin | Mediatech | MT30004CIRF | NIH 3T3 medium supplement |
| Immersion Oil Type LDF Non-Fluorescing | Nikon | 77007 | Immersion oil for objective lens |
Referencias
- Chow, K. H., Factor, R. E., Ullman, K. S. The nuclear envelope environment and its cancer connections. Nature Reviews Cancer. 12 (3), 196-209 (2012).
- Zink, D., Fischer, A. H., Nickerson, J. A. Nuclear structure in cancer cells. Nature Reviews Cancer. 4 (9), 677-687 (2004).
- Bank, E. M., Gruenbaum, Y. The nuclear lamina and heterochromatin: a complex relationship. Biochemical Society Transactions. 39 (6), 1705-1709 (2011).
- Lammerding, J., et al. Lamins A and C but not lamin B1 regulate nuclear mechanics. Journal of Biological Chemistry. 281 (35), 25768-25780 (2006).
- Dahl, K. N., Engler, A. J., Pajerowski, J. D., Discher, D. E. Power-law rheology of isolated nuclei with deformation mapping of nuclear substructures. Biophysical Journal. 89 (4), 2855-2864 (2005).
- Crisp, M., et al. Coupling of the nucleus and cytoplasm: role of the LINC complex. Journal of Cell Biology. 172 (1), 41-53 (2006).
- Sosa, B. A., Rothballer, A., Kutay, U., Schwartz, T. U. LINC complexes form by binding of three KASH peptides to domain interfaces of trimeric SUN proteins. Cell. 149 (5), 1035-1047 (2012).
- Tapley, E. C., Starr, D. A. Connecting the nucleus to the cytoskeleton by SUN-KASH bridges across the nuclear envelope. Current Opinion in Cell Biology. 25 (1), 57-62 (2013).
- Arsenovic, P. T., et al. Nesprin-2G, a Component of the Nuclear LINC Complex, Is Subject to Myosin-Dependent Tension. Biophysical Journal. 110 (1), 34-43 (2016).
- Rowat, A. C., Lammerding, J., Ipsen, J. H. Mechanical properties of the cell nucleus and the effect of emerin deficiency. Biophysical Journal. 91 (12), 4649-4664 (2006).
- Rowat, A. C., Foster, L. J., Nielsen, M. M., Weiss, M., Ipsen, J. H. Characterization of the elastic properties of the nuclear envelope. Journal of the Royal Society Interface. 2 (2), 63-69 (2005).
- Pagliara, S., et al. Auxetic nuclei in embryonic stem cells exiting pluripotency. Nature Materials. 13 (6), 638-644 (2014).
- Liu, H., et al. In situ mechanical characterization of the cell nucleus by atomic force microscopy. ACS Nanotechnology. 8 (4), 3821-3828 (2014).
- Krause, M., Te Riet, J., Wolf, K. Probing the compressibility of tumor cell nuclei by combined atomic force-confocal microscopy. Physical Biology. 10 (6), 065002 (2013).
- Neelam, S., et al. Direct force probe reveals the mechanics of nuclear homeostasis in the mammalian cell. Proceedings of the National Academy of Sciences of the United States of America. 112 (18), 5720-5725 (2015).
- Pajerowski, J. D., Dahl, K. N., Zhong, F. L., Sammak, P. J., Discher, D. E. Physical plasticity of the nucleus in stem cell differentiation. Proceedings of the National Academy of Sciences of the United States of America. 104 (40), 15619-15624 (2007).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. Journal of Clinical Investigation. 113 (3), 370-378 (2004).
- Chancellor, T. J., Lee, J., Thodeti, C. K., Lele, T. Actomyosin tension exerted on the nucleus through nesprin-1 connections influences endothelial cell adhesion, migration, and cyclic strain-induced reorientation. Biophysical Journal. 99 (1), 115-123 (2010).
- Neelam, S., Dickinson, R. B., Lele, T. P. New approaches for understanding the nuclear force balance in living, adherent cells. Methods. 94, 27-32 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados