Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Alcanzar presiones moderadas en recipientes sellados usando hielo seco sólido CO2 fuente
En este artículo
Resumen
Aquí presentamos un protocolo para la realización de reacciones en los vasos de reacción simple bajo presiones bajas a moderadas de CO2. Las reacciones pueden realizarse en una variedad de recipientes simplemente por administrar el dióxido de carbono en forma de hielo seco, sin necesidad de equipo costoso o elaborado o configuraciones.
Resumen
En este documento se presenta una estrategia general para llevar a cabo reacciones bajo leves a moderadas presiones de CO2 con hielo seco. Esta técnica evita la necesidad de equipo especializado para lograr presiones modestas y puede utilizarse incluso para alcanzar presiones más altas en el equipo más especializado y resistentes vasos de reacción. Al final de la reacción, los frascos pueden ser fácilmente despresurizados abriendo a temperatura ambiente. En el ejemplo presente CO2 sirve como un supuesto grupo directivo así como una forma de apaciguar los sustratos amina, previniendo así la oxidación durante la reacción organometálicas. Además de ser fácilmente añadida, el grupo directivo también se quitará al vacío, evitando la necesidad de purificación extensa quitar el grupo directivo. Esta estrategia permite la arilación de γ-C(sp3)-H facile de Aminas alifáticas y tiene el potencial para ser aplicado a una variedad de otras reacciones base de aminas.
Introducción
El uso de compuestos gaseosos en las reacciones químicas normalmente requiere equipo especializado y procedimientos1,2. A escala de banco, algunos gases pueden añadirse directamente de un tanque usando un regulador de alta presión3. Un método alternativo consiste en condensar el gas bajo condiciones criogénicas4,5. Aunque útiles, estas estrategias requieren el uso de reactores de presión especializados con válvulas, que pueden ser costos prohibitivos para el funcionamiento de numerosas reacciones en paralelo. Esto por lo tanto puede reducir grandemente la tasa en que la reacción puede continuar la proyección. Como resultado, químicos han encontrado deseable introducir estos compuestos usando métodos alternativos. Amoníaco puede añadirse a las reacciones con sales de carboxilato de amonio diferentes, aprovechando el débil equilibrio entre estas sales y amoniaco libre6. Transferencia de la hidrogenación es una estrategia importante para las reacciones de reducción de olefinas, carbonilo y grupos nitro que evita el uso de gas de hidrógeno inflamable con compuestos como el formiato de amonio o hidracina como portadores de H27. Otro gas de interés en esta área es monóxido de carbono8 -CO puede ser generado en situ por liberación de complejos de metal carbonilo9,10, o también puede ser generada por decarbonylation de fuentes como la formates y formamides11,12,13 o cloroformo14,15.
Un gas que no ha disfrutado de un desarrollo importante en este sentido es dióxido de carbono16. Una de las razones es que muchas transformaciones que implican CO2 también requieren presiones y altas temperaturas y así son automáticamente relegadas a reactores especializado17,18. Esfuerzos recientes para desarrollar catalizadores más reactivos, sin embargo, han facilitado la ejecución muchas de estas reacciones bajo presión atmosférica de CO219,20,21,22. Recientemente hemos descubierto una reacción en la que dióxido de carbono podría utilizarse para mediar la γ-C (sp3) – H cetonas Aminas alifáticas23. Esta estrategia se esperaba que combinan los beneficios de un enfoque de grupo de dirección estática incluyendo amida24,25,26,27,28, sulfamida 29 , 30 , 31 , 32,33,de tiocarbonilo34o hidrazona35-basado dirigir grupos (química robusticity), con la facilidad de un Grupo Directivo transitorio (economía de menor paso)36, 37,38,39.
Aunque la reacción podría ocurrir bajo presión atmosférica de CO2, la necesidad de una configuración de Schlenk pantalla reacciones probó prohibitivo lenta. Además, aumentando la presión ligeramente conducida a mejora rendimiento de la reacción, pero podría no ser fácilmente logrado usando una línea de Schlenk. Por lo tanto buscamos una estrategia alternativa, y posteriormente identificado ese hielo seco podría ser fácilmente utilizado como una fuente sólida de CO2 que se podría añadir a una variedad de recipientes de reacción para introducir la cantidad necesaria de dióxido de carbono para lograr moderada presiones (figura 1). Aunque subutilizado en síntesis, una estrategia similar es bastante común como un método para generar líquido CO2 para cromatografía y extracción aplicaciones40,41,42,43, 44. Utilizando esta estrategia permitió que nuestro grupo rápidamente grandes números de pantalla de las reacciones en paralelo, mientras que la capacidad de acceso moderado CO2 presiones de entre 2-20 atmósferas fueron fundamental para mejorar los rendimientos de las reacciones. En estas condiciones, primaria (1 º) y aminas secundarias (2°) pueden ser arylated con ricos en electrones y electrones pobre aryl halides.
Protocolo
PRECAUCIÓN: 1) los siguientes protocolos han sido consideradas como seguros a través de ensayos repetidos. Sin embargo, se debe ejercer precaución al sellar los frascos, a lo largo de la reacción, y especialmente al abrir las reacciones, como la inhomogeneidad en la reacción frascos pueden llevar a fallas del equipo. Frascos deben inspeccionarse antes de defectos físicos a utilizar. Frascos deben colocarse detrás de algún tipo de escudo blast o marco de la campana inmediatamente después de sellado para evitar incidentes si los frascos no. 2) aunque hay poca posibilidad de asfixia debido a las pequeñas cantidades de CO2 utilizado, las reacciones deben configurarse como abierto en un área bien ventilada o en una campana de humos. 3) hielo seco es un criógeno y puede causar daño tisular grave. Debe por lo tanto tener cuidado mientras manipula a fin de evitar la congelación, como limitar el contacto directo o el uso de Guantes criogénicos. 4) hielo seco se condensará el vapor de agua, lo que significa que antes de usar el hielo seco debe mecánicamente exfoliado para asegurar la masa de CO2 (s) solamente. Esto puede lograrse simplemente frotar el hielo seco entre los dedos, o con más seguridad, frotando entre los dedos con una capa protectora como un guante o una toalla.
1. reacción en un Vial de 7,5 mL (aire no excluido)
- Añadir una barra de agitación a un vial de 7,5 mL seco.
- Añadir acetato del paladio (6,7 mg, 0.03 mmol) al vial.
- Añadir trifluoroacetate plata (99,9 mg, 0.45 mmol) al vial.
- Añadir yoduro de fenilo (92,3 mg, 0.45 mmol) al vial.
- Añadir terc-amina de amilo (26,3 mg, 0.30 mmol) al vial.
- Agregar ácido acético (1,0 mL) al frasco.
Nota: La proporción del volumen de la solución al frasco de tamaño es importante, como la sublimación inmediata de CO2 con la adición de hielo seco puede desplazar mecánicamente solvente si es mucho se utiliza en relación con el tamaño del recipiente de reacción. - Añadir agua desionizada (21,7 μL, 12.1 mmol) al vial.
- Pesan hielo seco (26,3 mg, 0.60 mmol), y añadir el hielo seco para el vial, garantizando también inmediatamente el sello del frasco con una tapa con revestimiento de PTFE .
Nota: Toda la operación debe realizarse en aproximadamente 5 segundos para evitar que la sublimación y escapar de la pequeña cantidad de CO2 añadido (esto es más lento por la formación de acético congelado en el hielo seco). La cantidad de CO2 añadido será un valor aproximado, y en nuestras manos una desviación de pocos mg es permisible. - Agitar el frasco de reacción sellada durante 15 minutos a temperatura ambiente.
- El recipiente de la reacción de transferencia a un plato precalentado a 110 ° C y agitar durante 14 horas antes de permitir que se enfríe.
- En refrigeración, abra con cuidado el frasco para ventilación CO2.
- Quitar todos los volátiles en vacío.
Nota: Esta operación se puede realizar en el vial o la solución se puede transferir a un matraz de fondo redondo mayor. - Añadir 1,2 M HCl(aq) (6 mL) a la mezcla de reacción y mezclar abierto al aire durante 15 minutos.
- Transferencia de la fracción acuosa en un embudo de separatory, con adicional 1.2 M HCl (4 mL) y el extracto con una mezcla de éter dietílico 1:1 / hexanes (3 x 8 mL).
Nota: Este lavado orgánico contiene yoduro de fenilo exceso y otros subproductos neutrales y puede eliminarse. - Neutralizar y hacer básica la solución acuosa por la adición de saturados NH4OH(aq) (10 mL es un buen punto de partida).
- Extraer la capa acuosa con diclorometano (2 x 10 mL).
- Seco las fracciones orgánicas combinadas sobre Na2para que4, entonces el filtro en una muestra de Tara del frasco.
- Evaporar el disolvente en vacío, el producto (2-metil-4-fenil-butanamine) como un aceite amarillo.
2. reacción en un Vial de 7,5 mL (purga de condiciones – aire excluido)
- Añadir una barra de agitación a un vial de 7,5 mL seco.
- Añadir acetato del paladio (6,7 mg, 0.03 mmol) al vial.
- Añadir trifluoroacetate plata (99,9 mg, 0.45 mmol) al vial.
- Añadir yoduro de fenilo (92,3 mg, 0.45 mmol) al vial.
- Añadir terc-amina de amilo (26,3 mg, 0.30 mmol) al vial.
- Agregar ácido acético (1,0 mL) al frasco.
Nota: La proporción del volumen de la solución al frasco de tamaño es importante, como la sublimación inmediata de CO2 con la adición de hielo seco puede desplazar mecánicamente solvente si es mucho se utiliza en relación con el tamaño del recipiente de reacción. - Añadir agua desionizada (21,7 μL, 12.1 mmol) al vial.
- TARE el frasco en un equilibrio, añadir aproximadamente 98 mg de hielo seco y luego permitir que el CO2 sublimar apagado hasta conseguir una masa final de aproximadamente 26 mg, seguido inmediatamente sellar el frasco con una tapa con revestimiento de PTFE.
Nota: Si deseable, este paso se puede realizar con una mayor masa de hielo seco para excluir más aire del frasco. Cabe mencionar que esto puede introducir el agua y así puede no ser la estrategia más eficaz para el agua reacciones sensibles. - Agitar el frasco de reacción sellada durante 15 minutos a temperatura ambiente.
- El recipiente de la reacción de transferencia a un plato precalentado a 110 ° C y agitar durante 14 horas antes de permitir que se enfríe.
- En refrigeración, abra con cuidado el frasco para ventilación CO2.
- Quitar todos los volátiles en vacío.
Nota: Esta operación se puede realizar en el vial o la solución se puede transferir a un matraz de fondo redondo mayor. - Añadir 1,2 M HCl(aq) (6 mL) a la mezcla de reacción y revuelva abierto al aire durante 15 minutos.
- Transferencia de la fracción acuosa en un embudo de separatory, con adicional 1.2 M HCl (4 mL) y el extracto con una mezcla de éter dietílico 1:1 / hexanes (3 x 8 mL).
Nota: Este lavado orgánico contiene yoduro de fenilo exceso y otros subproductos neutrales y puede eliminarse. - Neutralizar y hacer básica la solución acuosa por la adición de saturados NH4OH(aq) (10 mL es un buen punto de partida).
- Extraer la capa acuosa con diclorometano (2 x 10 mL).
- Seco las fracciones orgánicas combinadas sobre Na2para que4, entonces el filtro en una muestra de Tara del frasco.
- Evaporar el disolvente en vacío, el producto (2-metil-4-fenil-butanamine) como un aceite amarillo.
3. reacción en un frasco de 40 mL (aire no excluido)
- Agregar una barra de agitación en un frasco de 40 mL seco.
- Añadir acetato del paladio (33,5 mg, 0,15 mmol) al vial.
- Añadir plata trifluoroacetate (499,5 mg, 2.25 mmol) al vial.
- Añadir yoduro de fenilo (461,5 mg, 2.25 mmol) al vial.
- Añadir amina tert-amílico (131,5 mg, 1,5 mmol) al vial.
- Agregar ácido acético (5,0 mL) al frasco.
Nota: La proporción del volumen de la solución al frasco de tamaño es importante, como la sublimación inmediata de CO2 con la adición de hielo seco puede desplazar mecánicamente solvente si es mucho se utiliza en relación con el tamaño del recipiente de reacción. - Añadir agua desionizada (108,5 μL, 6.02 mmol) al vial.
- Pesan hielo seco (131,5 mg, 3.0 mmol) y añadir el hielo seco al frasco, mientras asegurándose de sellar también inmediatamente el frasco con una tapa con revestimiento de PTFE.
Nota: Toda la operación debe realizarse en aproximadamente 5 segundos para evitar que la sublimación y escapar de la pequeña cantidad de CO2 añadido (esto es más lento por la formación de acético congelado en el hielo seco). La cantidad de CO2 añadido será un valor aproximado, y en nuestras manos una desviación de pocos mg es permisible. - Agitar el frasco de reacción sellada durante 15 minutos a temperatura ambiente.
- El recipiente de la reacción de transferencia a un plato precalentado a 110 ° C y agitar durante 14 horas antes de permitir que se enfríe.
- En refrigeración, abra con cuidado el frasco para ventilación CO2.
- Quitar todos los volátiles en vacío.
Nota: Esta operación se puede realizar en el vial o la solución se puede transferir a un matraz de fondo redondo mayor. - Añadir 1,2 M HCl(aq) (30 mL) a la mezcla de reacción y mezclar abierto al aire durante 15 minutos.
- Transferencia de la fracción acuosa en un embudo de separatory, con adicional 1.2 M HCl (20 mL) y el extracto con una mezcla de éter dietílico 1:1 / hexanes (3 x 8 mL).
Nota: Este lavado orgánico contiene yoduro de fenilo exceso y otros subproductos neutrales y puede eliminarse. - Neutralizar y hacer básica la solución acuosa por la adición de saturados NH4OH(aq) (10 mL es un buen punto de partida).
- Extraer la capa acuosa con diclorometano (2 x 20 mL).
- Seco las fracciones orgánicas combinadas sobre Na2para que4, entonces el filtro en una muestra de Tara del frasco.
- Evaporar el disolvente en vacío, el producto (2-metil-4-fenil-butanamine) como un aceite amarillo.
4. reacción en un tubo de presión (aire no excluido) de 35 mL
- Agregue una barra de agitación a un tubo de presión seco 35 mL.
- Añadir acetato del paladio (6,7 mg, 0.03 mmol) en el tubo de presión.
- Añadir plata trifluoroacetate (132,5 mg, 0,6 mmol) en el tubo de presión.
- Añadir yoduro de fenilo (183,6 mg, 0,9 mmol) en el tubo de presión.
- Añadir 2-metil -N-(3-methylbenzyl) butan-2-amina (57,4 mg, 0,3 mmol) en el tubo de presión.
- Añadir ácido acético (1,0 mL) al frasco, seguido de 1,1,1,3,3,3,-hexafluoroisopropanol (1,0 mL).
Nota: La proporción del volumen de la solución al frasco de tamaño es importante, como la sublimación inmediata de CO2 con la adición de hielo seco puede desplazar mecánicamente solvente si es mucho se utiliza en relación con el tamaño del recipiente de reacción. - Añadir agua desionizada (21,7 μL, 1,2 mmol) en el tubo de presión.
- Pesan hielo seco (1,32 g, 30 mmol), y añadir el hielo seco para el tubo de presión, garantizando sello también inmediatamente el tubo de presión con el correspondiente tapón de Teflon .
Nota: Toda la operación debe realizarse en aproximadamente 5 segundos para evitar que la sublimación y escapar de la pequeña cantidad de CO2 añadido (esto es más lento por la formación de acético congelado en el hielo seco). La cantidad de CO2 añadido será un valor aproximado, y en nuestras manos una desviación de pocos mg es permisible. - Agitar el recipiente de reacción cerrado durante 15 minutos a temperatura ambiente.
- El recipiente de la reacción de transferencia a un plato precalentado a 90 ° C y agitar durante 24 horas antes de permitir que se enfríe.
- Al enfriamiento, poner una toalla o guante acolchado sobre la tapa y abra con cuidado el tubo de presión para ventilación CO2.
- Quitar todos los volátiles en vacío.
Nota: Esta operación se puede realizar en el tubo de presión con un adaptador apropiado, o la solución se puede transferir a un matraz de fondo redondo mayor. - Añadir 1,2 M HCl(aq) (12 mL) a la mezcla de reacción y mezclar abierto al aire durante 15 minutos.
- Transferencia de la fracción acuosa en un embudo de separatory, con adicional 1.2 M HCl (8 mL) y el extracto con una mezcla de éter dietílico 1:1 / hexanes (3 x 8 mL).
Nota: Este lavado orgánico contiene yoduro de fenilo exceso y otros subproductos neutrales y puede eliminarse. - Neutralizar y hacer básica la solución acuosa por la adición de saturados NH4OH(aq) (10 mL es un buen punto de partida).
- Extraer la capa acuosa con diclorometano (2 x 10 mL).
- Seco las fracciones orgánicas combinadas sobre Na2para que4, entonces el filtro en una muestra de Tara del frasco.
- Evaporar el disolvente en vacío, confiriéndole al producto (2-Methyl-N-(3-methylbenzyl)-4-phenylbutan-2-amine) como un aceite amarillo.
Resultados
Después de estos protocolos, es posible cargar una cubeta de reacción con una cantidad adecuada de dióxido de carbono para lograr reacciones químicas que requieren CO2 atmósferas. La presión alcanzada en el paso 1 se calcula que aproximadamente 3 atmósferas (véase la discusión para la determinación de este valor), aunque debido a la solvatación parcial, la presión observada en las cercanías de 2 atmósferas a temperatura ambiente y debe ser aproximadamente 2,6 atm?...
Discusión
Usando el van der Waals ecuación de estado, la presión aproximada de estos sistemas puede ser calculado45
Ecuación 1: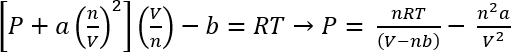
En las condiciones en el protocolo 1, podemos suponer 26,3 mg de CO2 da n = 5.98 x 10-4 moles
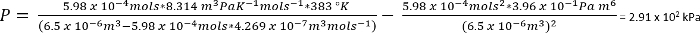
Como ...
Divulgaciones
El uso de CO2 como un grupo directivo para la activación de C-H de sustratos básicos Lewis es actualmente el foco de la patente Provisional de Estados Unidos #62/608, 074.
Agradecimientos
Los autores desean reconocer la financiación de puesta en marcha de la Universidad de Toledo, así como los fondos de la Fundación de la sociedad americana de química Herman Frasch en apoyo parcial de esta obra. Sr. Thomas Kina es reconocido por su ayuda con el desarrollo de un adecuado medidor de presión para medir la presión de reacción. Sr. Steve Modar es agradeció a discusiones útiles.
Materiales
| Name | Company | Catalog Number | Comments |
| 7.5 mL Sample Vial with Screw Cap (Thermoset) | Qorpak | GLC-00984 | Can be reused. |
| 40 mL Sample Vial with Screw Cap (Thermoset) | Qorpak | GLC-01039 | Can be reused. |
| Pressure Tube, #15 Thread, 7" Long, 25.4 mm O.D. | Ace Glass | 8648-06 | Can be reused. |
| Pie-Block for 2 Dram Vials | ChemGlass | CG-1991-P14 | Can be reused. |
| Pie-Block for 10 Dram Vials | ChemGlass | CG-1991-P12 | Can be reused. |
| 3.2 mm PTFE Disposable Stir Bars | Fisher | 14-513-93 | Can be reused. |
| C-MAG HS 7 Control Hotplate | IKA | 20002695 | |
| Analytical Weighing Balance | Sartorius | QUINTIX2241S | |
| Double-Ended Micro-Tapered Spatula | Fisher Scientific | 21-401-10 | |
| Hei-VAP Advantage - Hand Lift Model with G5 Dry Ice Condenser Rotary Evaporator | Heidolph | 561-01500-00 | |
| Bump Trap 14/20 Joint | ChemGlass | CG-1322-01 | |
| tert-Amyl amine | Alfa Aesar | B24639-14 | Used as received. |
| 2-Methyl-N-(3-methylbenzyl)butan-2-amine | N/A | N/A | Prepared from reductive amination of tert-amyl amine and 3-tolualdehyde in the presence of sodium borohydride in methanol. |
| Palladium Acetate | Chem-Impex International, Inc. | 4898 | Used as received. |
| Silver Trifluoroacetate | Oakwood Chemicals | 007271 | Used as received. |
| Phenyl Iodide | Oakwood Chemicals | 003461 | Used as received. |
| Acetic Acid | Fisher Chemical | A38 | Used as received. |
| 1,1,1,3,3,3-Hexafluoroisopropanol | Oakwood Chemicals | 003409 | Used as received. |
| Deionized Water | Obtained from in-house deionized water system. | ||
| Dry Ice | Carbonic Enterprises Dry Ice Inc. | Non-food grade dry ice. | |
| Concentrated Hydrochloric Acid | Fisher Chemical | A144SI | Diluted to a 1.2 M solution prior to use. |
| Diethyl Ether, Certified | Fisher Chemical | E138 | Used as received. |
| Hexanes, Certified ACS | Fisher Chemical | H292 | Used as received. |
| Saturated Ammonium Hydroxide | Fisher Chemical | A669 | Used as received. |
| Dichloromethane | Fisher Chemical | D37 | Used as received. |
| Sodium Sulfate, Anhydrous | Oakwood Chemicals | 044702 | Used as received. |
| 250 mL Separatory Funnel | Prepared in-house by staff glassblower. | ||
| 100 mL Round Bottom Flask | Prepared in-house by staff glassblower. | ||
| Scientific Disposable Funnel | Caplugs | 2085136030 | |
| Borosilicate Glass Scintillation Vials, 20 mL | Fisher Scientific | 03-337-15 | |
| 5 mm O.D. Thin Walled Precision NMR Tubes | Wilmad | 666000575 | |
| Chloroform-d | Cambridge Isotope Laboratories, Inc. | DLM-7 | Used as received. |
Referencias
- Verboom, W. Selected Examples of High-Pressure Reactions in Glass Microreactors. Chemical Engineering and Technology. 32 (11), 1695-1701 (2009).
- Schettino, V., Bini, R. Constraining Molecules at the Closest Approach: Chemistry at High Pressure. Chemical Society Reviews. 36, 869-880 (2007).
- Hemminger, O., Marteel, A., Mason, M. R., Davies, J. A., Tadd, A. R., Abraham, M. A. Hydroformylation of 1-Hexene in Supercritical Carbon Dioxide Using a Heterogeneous Rhodium Catalyst. 3. Evaluation of Solvent Effects. Green Chemistry. 4, 507-512 (2002).
- Mo, F., Dong, G. Regioselective Ketone α-Alkylation with Simple Olefins via Dual Activation. Science. 345 (6192), 68-72 (2014).
- Schultz, A. G., Kirincich, S. J., Rahm, R. Asymmetric Organic Synthesis. Preparation and Birch Reduction-Alkylation of 2-Methyl-3,4-Dihydroisoquinolin-1-ones. Tetrahedron Letters. 36 (26), 4551-4554 (1995).
- Dong, L., Aleem, S., Fink, C. A. Microwave-Accelerated Reductive Amination Between Ketones and Ammonium Acetate. Tetrahedron Letters. 51 (39), 5210-5212 (2010).
- Wang, D., Astruc, D. The Golden Age of Transfer Hydrogenation. Chemical Reviews. 115 (13), 6621-6686 (2015).
- Morimoto, T., Kakiuchi, K. Evolution of Carbonylation Catalysis: No Need for Carbon Monoxide. Angewandte Chemie International Edition in English. 43 (42), 5580-5588 (2004).
- Iranpoor, N., Firouzabadi, H., Motevalli, S., Talebi, M. Palladium-Free Aminocarbonylation of Aryl, Benzyl, and Styryl Iodides and Bromides by Amines Using Mo(CO)6 and Norbornadiene. Tetrahedron. 69 (1), 418-426 (2013).
- Ren, W., Yamane, M. Mo(CO)6-Mediated Carbamoylation of Aryl Halides. Journal of Organic Chemistry. 75 (24), 8410-8415 (2010).
- Wang, H., Dong, B., Wang, Y., Li, J., Shi, Y. A Palladium-Catalyzed Regioselective Hydroesterification of Alkenylphenols to Lactones with Phenyl Formate as CO Source. Organic Letters. 16 (1), 186-189 (2014).
- Zhang, Y., Chen, J. -. L., Chen, Z. -. B., Zhu, Y. -. M., Ji, S. -. J. Palladium-Catalyzed Carbonylative Annulation Reactions Using Aryl Formate as a CO Source: Synthesis of 2-Substituted Indene-1,3(2H)-Dione Derivatives. Journal of Organic Chemistry. 80 (21), 10643-10650 (2015).
- Wan, Y., Alterman, M., Larhed, M., Hallberg, A. Dimethylformamide as a Carbon Monoxide Source in Fast Palladium-Catalyzed Aminocarbonylations of Aryl Bromides. Journal of Organic Chemistry. 67 (17), 6232-6235 (2002).
- Gockel, S. N., Hull, K. L. Chloroform as a Carbon Monoxide Precursor: In or Ex Situ Generation of CO for Pd-Catalyzed Aminocarbonylations. Organic Letters. 17 (13), 3236-3239 (2015).
- Zhao, H., Du, H., Yuan, X., Wang, T., Han, W. Iron-Catalyzed Carbonylation of Aryl Halides with Arylborons Using Stoichiometric Chloroform as the Carbon Monoxide Source. Green Chemistry. 18, 5782-5787 (2016).
- Chen, P., Xu, C., Yin, H., Gao, X., Qu, L. Shock Induced Conversion of Carbon Dioxide to Few Layer Graphene. Carbon. , 471-476 (2017).
- Iijima, T., Yamaguchi, T. Efficient Regioselective Carboxylation of Phenol to Salicylic Acid with Supercritical CO2 in the Presence of Alumnium Bromide. Journal of Molecular Catalysis A: Chemical. 295 (1-2), 52-56 (2008).
- Jevtovikj, I., Manzini, S., Hanauer, M., Rominger, F., Schaub, T. Investigations on the Catalytic Carboxylation of Olefins with CO2 Towards α, β-Unsaturated Carboxylic Acid Salts: Characterization of Intermediates and Ligands as well as Substrate Effects. Dalton Transactions. 44, 11083-11094 (2015).
- Juliá-Hernández, F., Moragas, T., Cornella, J., Martin, R. Remote Carboxylation of Halogenated Aliphatic Hydrocarbons with Carbon Dioxide. Nature. 545, 84-88 (2017).
- North, M., Pasquale, R. Mechanism of Cyclic Carbonate Synthesis from Epoxides and CO2. Angewandte Chemie International Edition. 48 (16), 2946-2948 (2009).
- Yeung, C. S., Dong, V. M. Beyond Aresta's Complex: Ni- and Pd-Catalyzed Organozinc Coupling to CO2. Journal of the American Chemical Society. 130 (25), 7826-7827 (2008).
- Zhu, D. -. Y., Fang, L., Han, H., Wang, Y., Xia, J. -. B. Reductive CO2 Fixation via Tandem C-C and C-N Bond Formation: Synthesis of Spiro-Indopyrrolidines. Organic Letters. 19 (16), 4259-4262 (2017).
- Kapoor, M., Liu, D., Young, M. C. Carbon Dioxide Mediated C(sp3)–H Arylation of Amine Substrates. J. Am. Chem. Soc. , (2018).
- Zhang, Y. -. F., Zhao, H. -. W., Wang, H., Wei, J. -. B., Shi, Z. -. J. Readily Removable Directing Group Assisted Chemo- and Regioselective C(sp3)-H Activation by Palladium Catalysis. Angewandte Chemie International Edition. 54 (46), 13686-13690 (2015).
- He, G., Chen, G. A Practical Strategy for the Structural Diversification of Aliphatic Scaffolds Through the Palladium-Catalyzed Picolinamide-Directed Remote Functionalization of Unactivated C(sp3)-H Bonds. Angewandte Chemie International Edition. 50 (22), 5192-5196 (2011).
- Nack, W. A., Wang, X., Wang, B., He, G., Cheng, G. Palladium-Catalyzed Picolinamide-Directed Iodination of Remote ortho-C-H Bonds of Arenes: Synthesis of Tetrahydroquinolines. Beilstein Journal of Organic Chemistry. 12, 1243-1249 (2016).
- Feng, P., Li, M., Ge, H. Room Temperature Palladium-Catalyzed Decarboxylative ortho-Acylation of Acetanilides with α-Oxocarboxylic Acids. Journal of the American Chemical Society. 132 (34), 11898-11899 (2010).
- Coomber, C. E., Benhamou, L., Bučar, D. -. K., Smith, P. D., Porter, M. J., Sheppard, T. D. Silver-Free Palladium-Catalyzed C(sp3)-H Arylation of Saturated Bicyclic Amine Scaffolds. Journal of Organic Chemistry. 83 (5), 2495-2503 (2018).
- Mei, T. -. S., Wang, X., Yu, J. -. Q. Pd(II)-Catalyzed Amination of C-H Bonds Using Single-Electron or Two-Electron Oxidants. Journal of the American Chemical Society. 131 (31), 10806-10807 (2009).
- Xie, W., Yang, J., Wang, B., Li, B. Regioselective Ortho Olefination of Aryl Sulfonamide via Rhodium-Catalyzed Direct C-H Bond Activation. Journal of Organic Chemistry. 79 (17), 8278-8287 (2014).
- Rodriguez, N., Romero-Revilla, J. A., Fernández-Ibáñez, M. &. #. 1. 9. 3. ;., Carretero, J. C. Palladium-Catalyzed N-(2-pyridyl)sulfonyl-Directed C(sp3)-H γ-Arylation of Amino Acid Derivatives. Chemical Science. 4, 175-179 (2013).
- Zheng, Y., Song, W., Zhu, Y., Wei, B., Xuan, L. Pd-Catalyzed Acetoxylation of γ-C(sp3)-H Bonds of Amines Directed by a Removable Bts-Protecting Group. Journal of Organic Chemistry. 83 (4), 2448-2454 (2018).
- Jain, P., Verma, P., Xia, G., Yu, J. -. Q. Enantioselective Amine α-Functionalization Via Palladium-Catalysed C-H Arylation of Thioamides. Nature Chemistry. 9, 140-144 (2017).
- Tran, A. T. Practical Alkoxythiocarbonyl Auxiliaries for Ir(I)-Catalyzed C-H Alkylation of Azacycles. Angewandte Chemie International Edition. 56 (35), 10530-10534 (2017).
- Huang, Z., Wang, C., Dong, G. A Hydrazone-Based exo-Directing Group Strategy for β-C-H Oxidation of Aliphatic Amines. Angewandte Chemie International Edition. 55 (17), 5299-5303 (2016).
- Xu, Y., Young, M. C., Wang, C., Magness, D. M., Dong, G. Catalytic C(sp3)-H Arylation of Free Primary Amines via an in situ Generated Exo-Directing Group. Chemie International Edition. 55 (31), 9084-9087 (2016).
- Liu, Y., Ge, H. Site-Selective C-H Arylation of Primary Aliphatic Amines Enabled by a Catalytic Transient Directing Group. Nature Chemistry. 9, 26-32 (2017).
- Wu, Y., Chen, Y. -. Q., Liu, T., Eastgate, M. D., Yu, J. -. Q. Pd-Catalyzed γ-C(sp3)-H Arylation of Free Amines Using a Transient Directing Group. Journal of the American Chemical Society. 138 (44), 14554-14557 (2016).
- Yada, A., Liao, W., Sato, Y., Murakami, M. Buttressing Salicylaldehydes: A Multipurpose Directing Group for C(sp3)-H Bond Activation. Angewandte Chemie International Edition. 56 (4), 1073-1076 (2017).
- Baldwin, B. W., Kuntzleman, T. S. Liquid CO2 in Centrifuge Tubes: Separation of Chamazulene from Blue Tansy (Tanacetum annum) Oil via Extraction and Thin-Layer Chromatography. Journal of Chemical Education. 95 (4), 620-624 (2018).
- McKenzie, L. C., Thompson, J. E., Sullivan, R., Hutchison, J. E. Green Chemical Processing in the Teaching Laboratory: A Convenient Liquid CO2 Extraction of Natural Products. Green Chemistry. 6, 355-358 (2004).
- Hudson, R., Ackerman, H. M., Gallo, L. K., Gwinner, A. S., Krauss, A., Sears, J. D., Bishop, A., Esdale, K. N., Katz, J. L. CO2 Dry Cleaning: A Benign Solvent Demonstration Accessible to K-8 Audiences. Journal of Chemical Education. 94, 480-482 (2017).
- Barcena, H., Chen, P. An Anesthetic Drug Demonstration and an Introductory Antioxidant Activity Experiment with "Eugene, the Sleepy Fish.". Journal of Chemical Education. 93, 202-205 (2016).
- Bodsgard, B. R., Lien, N. R., Waulters, Q. T. Liquid CO2 Extraction and NMR Characterization of Anethole from Fennel Seed: A General Chemistry Laboratory. Journal of Chemical Education. 93, 397-400 (2016).
- Fishbane, P. M., Gasiorowicz, S. G., Thornton, S. T. . Physics for Scientists and Engineers. , (2005).
- Rumpf, B., Xia, J., Maurer, G. Solubility of Carbon Dioxide in Aqueous Solutions Containing Acetic Acid or Sodium Hydroxide in the Temperature Range from 313 to 433 K and at Total Pressures up to 10 MPa. Industrial & Engineering Chemistry Research. 37, 2012-2019 (1998).
- Luo, J., Larrosa, I. C-H Carboxylation of Aromatic Compounds Through CO2 Fixation. ChemSusChem: Chemistry & Sustainability, Energy & Materials. 10, 3317-3332 (2017).
- Manjolinho, F., Arndt, M., Gooßen, K., Gooßen, L. J. Catalytic C-H Carboxylation of Terminal Alkynes with Carbon Dioxide. ACS Catalysis. 2, 2014-2021 (2012).
- Banerjee, A., Dick., G. R., Yoshino, T., Kanan, M. W. Carbon Dioxide Utilization via Carbonate-Promoted C-H Carboxylation. Nature. 531, 215-219 (2016).
- Fei, H., Sampson, M. D., Lee, Y., Kubiak, C. P., Cohen, S. M. Photocatalytic CO2 Reduction to Formate Using a Mn(I) Molecular Catalyst in a Robust Metal-Organic Framework. Inorganic Chemistry. 54, 6821-6828 (2015).
- Chabolla, S. A., Yang, J. Y. For CO2 Reduction, Hydrogen-Bond Donors Do the Trick. ACS Central Science. 4, 315-317 (2018).
- Kim, D., Kley, C. S., Li, Y., Yang, P. Copper Nanoparticle Ensembles for Selective Electroreduction of CO2 to C2-C3 Products. Proceedings of the National Academy of Sciences of the United States of America. , C2-C3 (2017).
- Liu, Q., Wu, L., Jackstell, R., Beller, M. Using carbon dioxide as a building block in organic synthesis. Nature Communications. 6, 5933-5945 (2015).
- Hâncu, D., Green, J., Beckman, E. J. H2O2 in CO2 Sustainable Production and Green Reactions. Accounts of Chemical Research. 35, 757-764 (2002).
- Ballivet-Tkatchenko, D., Camy, S., Condoret, J. S., Lichtofouse, E., Scwarzbauer, J., Robert, D. Carbon Dioxide, a Solvent and Synthon for Green Chemistry. Environmental Chemistry. , 541-552 (2005).
- Hyatt, J. A. Liquid and Supercritical Carbon Dioxide as Organic Solvents. Journal of Organic Chemistry. 49, 5097-5101 (1984).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados