Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Medida de alto rendimiento de membrana plasmática resellado eficacia en células de mamíferos
En este artículo
Resumen
Aquí describimos un análisis basado en la fluorescencia de alto rendimiento que mide la membrana plasmática resellado eficiencia mediante análisis fluorométrico y proyección de imagen en células vivas. Este ensayo puede utilizarse para la detección de drogas o genes diana que regulan el cierre de membrana plasmática en células de mamíferos.
Resumen
En su entorno fisiológico, células de mamíferos a menudo son sometidas a tensiones mecánicas y bioquímicas que resultan en daño de la membrana plasmática. En respuesta a estos daños, maquinarias moleculares complejas rápidamente volver a cerrar herméticamente la membrana plasmática para recuperar su función de barrera y mantener la supervivencia celular. A pesar de 60 años de investigación en este campo, todavía no tenemos un conocimiento profundo de la célula resellado maquinaria. Con el objetivo de identificar los componentes celulares cierre de membrana del plasma de control o fármacos que pueden mejorar el servicio, hemos desarrollado un ensayo de alto rendimiento basado en la fluorescencia que mide la membrana plasmática resellado eficacia en células de mamíferos cultivadas en microplacas. Como sistema modelo para el daño de la membrana plasmática, las células se exponen a la bacterianas formadoras de poro toxina listeriolysin O (LLO), que forma grandes 30-50 nm de diámetro proteínico poros en colesterol membranas. El uso de un lector de microplacas de varios modos de funcionamiento con control de temperatura permite mediciones spectrofluorometric rápido y sensible en combinación con brightfield y de imágenes de microscopía de fluorescencia de las células vivas. Análisis cinético de la intensidad de fluorescencia emitida por un fluorocromo membrana de unión a ácidos nucleicos impermeant reflejan el grado de membrana heridos y el cierre a nivel de la población de células, lo que permite el cálculo de la celda resellado eficiencia . Imágenes de microscopía de fluorescencia permite la enumeración de las células, que constitutivamente expresan una quimera fluorescente de la nuclear de la proteína histona 2B, en cada pocillo de la microplaca para tener en cuenta posibles variaciones en su número y permite la eventual identificación de poblaciones celulares distintas. Este ensayo de alto rendimiento es una poderosa herramienta pretende ampliar nuestra comprensión de los mecanismos de reparación de la membrana mediante proyección de genes host o exógeno agregado compuestos eso membrana del plasma de control resellado.
Introducción
Células de mamífero están sujetos a estrés mecánico, osmótico y bioquímico, resultando en la pérdida de la integridad de la membrana plasmática. Sin cierre rápido y eficiente, las células dañadas sucumbirían rápidamente a la muerte programada o necrótica. Desde la década de 1960, esfuerzos por entender la membrana plasmática resellado proceso han sido motivados por las devastadoras consecuencias asociadas con sus disfunciones. De hecho, enfermedades como miembro-rodea Distrofia Muscular, diabetes, síndrome de Chediak-Higashi se han ligado a membrana del plasma deficiente reparación debido a mutaciones en el gene codificación dysferlin, producción de productos finales de glicación avanzada o defectos en el regulador de tráfico lisosomal gen CHS1, respectivamente1,2,3,4,5,6. Sin embargo, hasta la fecha, nuestra comprensión de la membrana de cierre es todavía limitado7. Estudios iniciales han demostrado que la membrana resellado se inicia por la afluencia de extracelular Ca2 + a través de la membrana plasmática dañada8,9,10. Desde entonces, varios no-excluyentes Ca2 +-dependiente de mecanismos han sido propuestos para sellar las células. La hipótesis de parche propone que cerca de la herida, vesículas intracelulares se fusionan unos con otros y la membrana de plasma dañada para actuar como un parche11,12,13,14. Un segundo modelo propone que exocitosis dependiente de calcio de lisosomas en la herida sitio lanza la esfingomielinasa ácida lysosomal de la enzima, que convierte la esfingomielina a ceramida en el prospecto externo de la membrana plasmática. Este repentino cambio en la composición de lípido produce endocitosis ceramida-conducido de la región dañada15,16,17. Por último, el tercer mecanismo propuesto consiste en un papel para la endosomal clasificación compleja necesaria para que el transporte (TRASVESTIS) para promover la formación de vesículas de exteriores que brote fuera de la membrana plasmática18. Sólo un conjunto limitado de proteínas fue identificado en estos modelos, y su maquinaria debe ser aclarado aún más.
Aquí describimos un análisis de alto rendimiento que medidas de la membrana plasmática resellado eficacia en células de mamífero adherentes sujeto a daño mediadas por recombinante listeriolysin O (LLO)19. LLO es una toxina formadora de poros (PFT) secretada por el patógeno intracelular facultativo Listeria monocytogenes20,21,22 y pertenece a MACPF/CDC (complejo de ataque a membrana, perforin, y Superfamilia cytolysin dependiente de colesterol). MACPF son mamífero poro-formando las proteínas implicadas en las defensas inmunitarias, que son las toxinas bacterianas principalmente producción por patógenos gram-positivos que dañan las células del huésped para promover sus estilos de vida patógenos23. CDC se sintetiza como monómeros solubles en agua o dímeros que se unen al colesterol presentan en la membrana plasmática y oligomerize en un prepore complejo de subunidades hasta 50. El complejo del prepore luego reorganiza para insertar β-filamentos a través de la bicapa lipídica, formando un poro barril β que se extiende por 30-50 nm de diámetro24,25,26,27. Estos poros grandes permiten flujos de iones y componentes celulares pequeños dentro y fuera de la célula; sin embargo, algunos estudios han propuesto que los poros de tamaños más pequeños son también formado28,29,30. Entre la CDC, LLO muestra características únicas incluyendo la agregación irreversible de dependiente de pH y temperatura, que es propicia para el análisis de alto rendimiento31,32. LLO se puede Agregar al medio de cultivo de células a 4 ° c, una temperatura permisiva para su unión a las células, pero no a la formación de lo complejos del poro. Inicio de formación de poro se puede sincronizar luego por aumento de la temperatura a 37 ° c, permitiendo para la eficiente difusión de las moléculas de toxina en el plano de la membrana a oligómeros de forma y para la remodelación conformacionales implicados en la generación de poro. Por lo tanto, después el interruptor de temperatura, la cinética de daño celular depende de la cantidad de toxina a la membrana plasmática. Lo importante, LLO soluble (no limitado a la membrana plasmática) rápidamente e irreversiblemente agregados cuando la temperatura alcance 37 ° c, que alivia la necesidad de eliminar las moléculas de la toxina no unida y limita la extensión del daño de la membrana con el tiempo. Por último, porque LLO se une al colesterol y forma poros en las membranas ricas en colesterol, este ensayo es sensible a una amplia gama de células de mamíferos. Es importante tener en cuenta que LLO afecta a la célula huésped señalización principalmente a través de formación de poro, con algunas excepciones en que celda independiente del poro de señalización puede ocurrir33,34,35,36 ,37,38,39. Por lo tanto, no puede ser excluido que LLO señalización actividades pueden influir en el proceso de reparación de la membrana.
Este análisis evalúan directamente el grado de herir la célula mediante la medición de la incorporación de una célula impermeant fluorocromo (p. ej., yoduro de propidio) que entra en las células heridas pasivo y se convierte en altamente fluorescente cuando se asocia a ácidos nucleicos . Por lo tanto, se puede mantener el fluorocromo en el medio de cultivo celular durante todo el experimento, permitiendo análisis en tiempo real de células herir. La intensidad de la fluorescencia del tinte de unión a ácidos nucleicos aumentará con la concentración de la toxina y, para una determinada concentración de toxina, se incrementará con el tiempo hasta que se forman todos los poros y las células se reparan completamente o hasta que se alcanza la saturación. La afluencia de extracelular Ca2 + a través de los poros de la membrana es un evento de la condición sine qua non para volver a sellar. Por lo tanto, la eficacia de la mismo-resellado puede ser evidenciada indirectamente comparando células heridas en medio de cultivo con Ca2 + (condición permisiva de reparación) para herir en un Ca2 +-medio libre (condición restrictiva de reparación). Debido a la intensidad de la fluorescencia del tinte de unión a ácidos nucleicos es directamente proporcional a la concentración de células en cada pozo, es importante para las células de la semilla en la misma concentración en todos los pocillos. También es importante enumerar las células en cada pozo antes y después del ensayo para asegurar que la separación de la célula no ocurre, como flotando, agregadas células pueden ocultar lecturas de fluorescencia que pueden complicar la interpretación de los datos. Para enumerar las células, las células que expresan las histonas nucleares localizados 2B-GFP (GFP-H2B) fueron utilizadas en este ensayo. Control de temperatura, varios modos de funcionamiento, los lectores de microplacas combinan medidas rápidas, alto rendimiento (utilizando un formato de 96 o 384 pocillos de la placa) de las intensidades de fluorescencia con imagen de microscopía de células vivas a 37 ° C. Este último puede utilizarse para enumerar el número de células y observar la posible formación de poblaciones celulares distintas.
En definitiva, este ensayo proporciona a los usuarios la capacidad de ampliar su conocimiento de la complejidad de los mecanismos de reparación de la membrana mediante la detección de las moléculas del anfitrión o exógeno agregados compuestos que pueden controlar la membrana de reparación. El siguiente protocolo se describen los pasos experimentales para medir la eficiencia mismo-resellado de las células expuestas a LLO y evaluar los efectos de un determinado medicamento o tratamiento celular en eficiencia mismo-resellado.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. preparación
- Galjanoplastia de la célula
Nota: Humanas células epiteliales cervicales, HeLa y HeLa expresando histona 2B-GFP (GFP-H2B), fueron utilizadas en el presente Protocolo, pero este análisis pueden ser adaptado a otras células de mamífero19.- Separar las células adherentes de un frasco de cultivo celular 75 cm2 , lavar las células con 2 mL de tripsina-EDTA 0.25%. Reemplazar la tripsina usada con 2 mL de tripsina-EDTA fresco 0.25%.
- Incube las células a 37 ° c durante 5 minutos hasta que las células redondeadas y separadas del frasco.
- Resuspender las células en 8 mL de medio de cultivo (DMEM con 10% suero bovino fetal inactivado con calor, 100 U/mL de penicilina y estreptomicina 100 de μg/mL).
- Determinar la concentración de células usando un hemocitómetro y 10 μl de suspensión celular.
- Diluir las células en el medio de crecimiento a una concentración de 2,5 x 105 células/mL.
- Vierta la suspensión en una cuenca de pipeta estéril y mezclar bien la suspensión con una pipeta serológica de 10 mL.
- Usando una micropipeta multicanal de 12 y 200 μL puntas, distribuir las células HeLa (2.5 x 104 células/100 μL/pocillo) en triplicado (o cuadruplicado) en una placa de cultivo de tejidos tratados poliestireno de fondo plano de 96 pozos, claro, negro.
Nota: Un arreglo de placas se presenta como un ejemplo en la figura 1. - Cultura de las células durante 24 h en una incubadora de cultivo celular humidificado a 37 ° c y 5% CO2.
- Preparación de solución madre
- Preparar 1 L de un stock de 10 x de buffer M (usado para preparar M1 y M2) mediante la adición de 95 g de solución de sal equilibrada Hanks, 0,476 g de MgCl2 (5 mM) y g 23,83 de HEPES (100 mM) en 900 mL de agua. Ajustar el pH a 7,4 y subir el volumen a 1 L. filtro esterilizar.
- Preparar 50 mL de un 50 x stock (1,25 M) de la glucosa mediante la adición de 11,26 g de D-(+)-glucosa a un total de 50 mL de agua. Filtro de esterilizar la solución.
- Preparar 50 mL de 100 x stock (120 mM) de calcio mediante la adición de 0,666 g de CaCl2 para un total de 50 mL de agua. Filtro de esterilizar la solución.
- Preparar 50 mL de una 10 x stock (50 mM) de glicol de etileno-bis(2-aminoethylether)-N, N, N', N', ácido etilendiaminotetraacético (EGTA) mediante la adición de 0,951 g de EGTA en 40 mL de agua. Aumentar el pH a 8 con NaOH disolver el EGTA, y luego subir el volumen a 50 mL. Filtro de esterilizar la solución.
- Para una sola placa de 96 pocillos, preparar 50 mL de medio 1 (M1, contiene Ca2 +), 50 mL de medio 2 (M2, Ca2 +-libre) y 15 mL de medio 2 complementado con EGTA, por consiguiente:
- Para M1, añadir 5 mL de 10 x Buffer M, 0,5 mL de 100 x CaCl2y 1 mL de glucosa x 50 a 43,5 mL de agua.
- Para M2, añadir 5 mL de 10 m de Buffer y 1 mL de glucosa x 50 a 44 mL de agua.
- Para M2/EGTA, añadir 1,5 mL de 10 x Buffer M y 1,5 mL de 10 x EGTA a 12 mL de agua.
Nota: Todas las soluciones que contienen yoduro de propidio (PI) deben estar preparadas directamente antes de agregar a las células.
- Placa lector e imágenes citómetro ajustes
Nota: Utilice un lector de placas de varios modos de funcionamiento equipado con dos unidades de detección: un spectrofluorometer y un citómetro de proyección de imagen. Limitar la exposición de fluorescencia para evitar fotoblanqueo los fluoróforos.- Caliente previamente el lector de la placa a 37 ° C antes de realizar el ensayo.
- Establecer los parámetros para el análisis cinético en consecuencia del modo de configuración :
- Elige monocromador, FL (fluorescencia)y cinética para la configuración óptica, modos de leer y leer tipo, respectivamente.
- En la Configuración de longitud de onda, seleccione un 9 y 15 nm de excitación y emisión bandpass, respectivamente. Para los ensayos utilizando yoduro de propidio (PI), establecen las longitudes de onda de excitación y emisión a 535 nm 617, respectivamente.
- En Tipo de la placa, seleccione 96 pocillos para el formato de placa y una configuración de la placa correspondiente a una placa de pared negro inferior transparente.
- Área de lectura, destacar los pozos que serán analizados a lo largo de la cinética.
- PMT y óptica, preselección los destellos por leer a 6 y marque la casilla para leer desde la parte inferior.
- Bajo tiempo, introduzca 00:30:00 en el cuadro de Tiempo Total de ejecución de un ensayo cinético de 30 min e inserte 00:05:00 para el intervalo.
Nota: Cada vez el punto y una longitud de onda, el tiempo de lectura de una placa completa de 96 pocillos es 30 s. - Confirmar la configuración especificada en la Información de configuración a la derecha y seleccione Aceptar. Prensa leer para iniciar el kinetic ejecutar.
- Configurar los parámetros de proyección de imagen en consecuencia del modo de configuración:
- Elegir Minimax, la proyección de imageny punto final para la configuración óptica, modos de leer y leer tipo, respectivamente.
- En longitudes de onda, seleccione transmite luzy uno o ambos los cuadros de fluorescencia correspondiente a longitudes de onda de excitación y emisión de 456/541 nm (GFP) y 625/713 nm (PI).
- Usar las mismas opciones para el Tipo de placa y Área de lectura tal como se define en los pasos 1.3.2.3 y 1.3.2.4.
- Bien el área Configuración, seleccione el número de sitios dentro de un pozo a ser reflejada.
Nota: 12 sitios corresponden a una imagen de todo bien. - En la Configuración de la adquisición de imágenes, seleccionar los tiempos de exposición para transmitir luz, 541 (GFP) y 713 (PI). Para GFP, la imagen todo bien con un tiempo de exposición de 20 ms/imagen. Para transmitir luz (TL) y fluorescencia de PI, adquirir una imagen única del centro de cada pocillo con tiempos de exposición de 8 y 20 ms, respectivamente.
- Confirmar la configuración especificada en la información de configuración a la derecha y seleccione Aceptar. El tiempo de la adquisición de imágenes de toda la superficie de cada pozo (12 imágenes/pocillo) de una placa de 96 pocillos y para una longitud de onda es de ~ 15 minutos pulse leer para iniciar la proyección de imagen.
Nota: El tiempo de la adquisición de un único imagen/pozo de una placa de 96 pocillos requiere ~2.5 min/placa para una longitud de onda. Los parámetros descritos anteriormente corresponden a los equipos específicos en nuestro laboratorio. Spectrofluorometric medidas: una lámpara de flash de xenón mostrando 1.0 nm incremento excitación longitudes de onda (250-850 nm) con un ajustable 9 o 15 nm paso de banda, un detector de tubo fotomultiplicador con > 6 log rango dinámico y una emisión de nm ajustable de 15 o 25 paso de banda. Citometría de imagen: una fuente de luz de iluminación de luz blanca, 460 nm y longitudes de onda de excitación nm 625 con una banda de nm 20, filtros de emisión centrados en 541 nm (108 nm de paso de banda) y 713 nm (123 nm de paso de banda), respectivamente, y un objetivo de X 4, junto a un 1.25 megapíxeles dispositivo acoplado de carga 12 bits.
2. ensayo
Nota: En el momento del ensayo, las células deben ser confluente de 70-90%. Durante los pasos de lavado, el medio debe retirarse y aplicado a la pared lateral del pozo (no directamente sobre las células). Mantener la temperatura de LLO a < 4 ° c para evitar su agregación hasta el paso 3.1.5.
- Preparar un stock de 30 μm PI en M1 y un stock de 30 μm PI m2 pre-calentado a 37 ° c.
- Lave suavemente las células en la placa 1 utilizando una micropipeta multicanal de 12 y 200 μL consejos, como sigue:
- Para las condiciones permisivas de reparación, eliminar el medio de cultivo y lavado que las células dos veces con 200 μL/pocillo M1 calentadas previamente a 37 ° c. Reemplazar el medio con 100 μL/pocillo de M1 caliente que contiene 30 μm PI.
- Para reparar condiciones restrictivas, eliminar el medio de crecimiento y lave las células una vez con 200 μL/pocillo caliente M2 que contiene 5 mM EGTA al quelato Ca2 +, seguido de un lavado con 200 μL/pocillo M2. Reemplazar el medio con 100 μL/pocillo caliente M2 que contiene 30 μm PI.
- Después de que el medio de crecimiento ha sido lavado y reemplazado con medio que contiene yoduro de propidio, directamente hacia paso 2.1.3.
- Placa de la imagen 1 bajo luz transmitida, GFP y PI como se detalla bajo 1.3.3 (pre-cinético). Este paso tarda 15-20 minutos.
- Durante el período de 15 min en el paso 2.1.3, preparar la placa 2 utilizando una micropipeta multicanal de 12 y 200 μL puntas como sigue:
- Coloque una microplaca de polipropileno fondo redondo de 96 pozos en el hielo. Configurar la placa utilizando un diseño experimental correspondiente a la placa 1 (figura 1).
- Para las condiciones de reparación permisiva, añadir 100 μL/pocillo de M1 helada que contiene 60 μm PI, seguido por la adición de 100 μL/pocillo de M1 helada que contiene 4 x LLO o no para el control.
- Para las condiciones restrictivas del reparación, añadir 100 μL/pocillo de helada M2 que contiene 60 μm PI, seguido por la adición de 100 μL/pocillo de helada M2 que contiene 4 x LLO o no para el control.
- Después de la proyección de imagen placa 1 (paso 2.1.3), inmediatamente Coloque en hielo, con papel de aluminio para separar la placa de contacto directo con hielo. Permiten que la placa 1 se enfríe durante 5 minutos.
- Usando una micropipeta multicanal de 12 y 200 μL puntas, transfiera 100 μl de cada pocillo en la placa 2 (paso 2.1.4) a los pocillos correspondientes de la placa 1. Para distribuir correctamente la toxina en los medios de comunicación de la placa 1, inserte las puntas por debajo del menisco y expulse suavemente el volumen sin la introducción de burbujas.
Nota: No tomar con pipeta hacia arriba y hacia abajo, esto sin darse cuenta puede separar las células. - Dejar la placa durante un 1 minuto adicional permitir que la toxina se unen a las células y transferir inmediatamente la placa 1 para el lector de placas para el ensayo cinético mediante el modo de spectrofluorometer (paso 1.3.2).
- Al final del ensayo cinético, inmediatamente imagen placa 1 (post-cinético) usando paso 1.3.3.
3. Análisis: Enumeración de células
- Determinar el número de celular basado en la fluorescencia nuclear utilizando el software de enumeración celular de microplacas.
- Dentro de ajustes, seleccione nuevo análisisy en la sección de categoría dentro de la Configuración de análisis de imagen seleccione Análisis de objeto discreto con 541 como la longitud de onda para encontrar objetos.
- Dentro de la opción de encontrar objetos, utilizando el dibujar en las imágenes buscando método, seleccionar núcleos bajo la pestaña de configuración y pulse aplicar.
- Pulse OK y leer para iniciar la célula contando algoritmo.
- Como alternativa, si no tal herramienta está disponible, utilizar un software de análisis de imagen como el ImageJ para enumerar las células.
- En ImageJ, abra el archivo de imagen como una pila.
- Convertir la pila para imágenes de escala de grises de 8 bits haciendo clic en la imagen en la barra de menú, se ciernen sobre el tipo y seleccione 8-bit.
- Restar el fondo: haga clic en imagen en la barra de menú, pase sobre ajustey seleccione Brillo y contraste. Ajustar el valor mínimo para eliminar el ruido de fondo y seleccione aplicar.
- Umbral para crear imágenes binarias: haga clic en imagen en la barra de menú, pase sobre ajustey seleccione umbral. Seleccione fondo oscuro, ajuste los valores de umbral mínimo y máximo y haga clic en aplicar.
- En el caso de superposición de núcleos, puede utilizarse una herramienta de Cuenca para núcleos de segmento. Haga clic en proceso en el menú, se ciernen sobre binario y seleccione cuenca.
Nota: Esto separará automáticamente núcleos conectados. - Analizar las imágenes enmascaradas mediante la aplicación de criterios especificados por el usuario (tamaño y circularidad) para refinar la identificación de núcleos y excluyen restos celulares.
- Haga clic en analizar en el menú y luego analizar las partículas. Establecer el tamaño deseado (pixel ^ 2) y circularidad (un valor de 1 es un círculo perfecto) que son suficientes para incluir células/núcleos individuales.
- En el cuadro de lista desplegable Mostrar, seleccione la opción u opciones que desea, compruebe resumay haga clic en Aceptar para obtener un recuento.
4. Análisis: Curvas cinéticas
- Transferencia de los datos cinéticos desde el software de lector de placa a un software de datos analíticos.
- Para cada condición experimental, un promedio de las intensidades de fluorescencia de las repeticiones en cada punto, junto con la correspondiente desviación estándar y error estándar de la media para cada condición experimental.
- Para cada condición experimental, trazar la correspondiente curva de cinética: intensidad de PI (eje y) frente al tiempo (eje x).
- Para calcular la eficiencia mismo-resellado de una condición de tratamiento dado, calcular el área bajo la curva (AUC) de los + LLO en M1 (AUC(M1)) y + LLO en M2 (AUC(M2)). Utilizar el enfoque propuesto a continuación evaluar la eficiencia (E) de cierre:
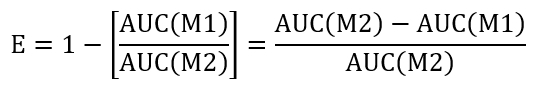
- Realizar una comparación entre el tratamiento control y prueba mediante la determinación del ratio de eficiencia (REff) indicados a continuación:
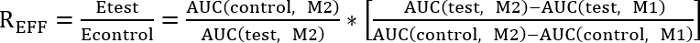
REFF = 1, prueba de tratamiento no tiene ningún efecto en la reparación de
REFF < 1, prueba tratamiento inhibe la reparación
REFF > 1, prueba de tratamiento mejora la reparación - Calcular el área bajo la curva mediante la siguiente ecuación:
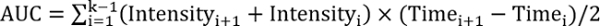 , donde k es el número total de visitas de seguimiento.
, donde k es el número total de visitas de seguimiento.
Access restricted. Please log in or start a trial to view this content.
Resultados
Precisión de conteo celular: células HeLa se utilizan con frecuencia como una línea de células de mamífero modelo para explorar los mecanismos de reparación de la membrana. Al evaluar la reparación de la membrana a nivel de población de la célula, es importante a las células de la placa en la misma concentración en todos los pocillos para interpretación de datos adecuado. También es importante verificar en el momento de la prueba de que el número de células es equivalente a...
Access restricted. Please log in or start a trial to view this content.
Discusión
Este ensayo mide la eficiencia de cierre de membrana a nivel de población celular con capacidad de alto rendimiento. Puede ser utilizado para detectar componentes celulares o las bibliotecas de drogas que pueden afectar la reparación de la membrana. El ensayo descrito utiliza un formato de placa de 96 pocillos, pero puede ser adaptado para placas de 384 pocillos para un mayor rendimiento. Una ventaja de este ensayo es su capacidad para obtener medidas de fluorescencia de las células vivas adherente en tiempo real sin ...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Reconocemos el Dr. Jesse Kwiek (The Ohio State University) para que amablemente nos permite utilizar su plataforma de detección de varios modos de funcionamiento para algunos experimentos preliminares. En este artículo de investigación fue apoyado por el Instituto Nacional de alergias y enfermedades infecciosas de los institutos nacionales de salud con el número de concesión RO1AI107250 a Stephanie Seveau. El contenido es responsabilidad exclusiva de los autores y no representan necesariamente las opiniones oficiales de los institutos nacionales de salud.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| SpectraMax i3x Multi-Mode Microplate Reader | Molecular Devices | i3x | |
| MiniMax 300 Imaging cytometer | Molecular Devices | 5024062 | |
| TO-PRO-3 | ThermoFisher Scientific | T3605 | |
| Propidium Iodide | ThermoFisher Scientific | P3566 | |
| HeLa | ATCC | CCL2 | |
| HeLa H2B-GFP | Millipore | SCC117 | |
| Trypsin-EDTA 0.25% | ThermoFisher Scientific | 25200056 | |
| 96-well Corning flat bottom black polystyrene tissue culture treated plate | Corning | 3603 | |
| Hanks' balanced Salts | Sigma-Aldrich | H4891 | |
| EGTA | ISC BioExpress | 0732-100G | |
| HEPES | Fisher Scientific | BP310-500 | |
| D-(+)-Glucose, HybriMax | Sigma-Aldrich | G5146-1KG |
Referencias
- Demonbreun, A. R., McNally, E. M. Plasma Membrane Repair in Health and Disease. Current Topics in Membranes. 77, 67-96 (2016).
- Howard, A. C., McNeil, A. K., McNeil, P. L. Promotion of plasma membrane repair by vitamin E. Nature Communications. 2, 597(2011).
- Howard, A. C., et al. A novel cellular defect in diabetes: membrane repair failure. Diabetes. 60 (11), 3034-3043 (2011).
- Lozano, M. L., et al. Towards the targeted management of Chediak-Higashi syndrome. Orphanet Journal of Rare Diseases. 9, 132(2014).
- Vainzof, M., et al. Dysferlin protein analysis in limb-girdle muscular dystrophies. Journal of Molecular Neuroscience. 17 (1), 71-80 (2001).
- Huynh, C., et al. Defective lysosomal exocytosis and plasma membrane repair in Chediak-Higashi/beige cells. Proceeding of the National Academy of Sciences of the United States of America. 101 (48), 16795-16800 (2004).
- Cooper, S. T., McNeil, P. L. Membrane Repair: Mechanisms and Pathophysiology. Physiological Reviews. 95 (4), 1205-1240 (2015).
- Steinhardt, R. A., Bi, G., Alderton, J. M. J. M. Cell membrane resealing by a vesicular mechanism similar to neurotransmitter release. Science. 263 (5145), 390-393 (1994).
- De Mello, W. C. Membrane sealing in frog skeletal-muscle fibers. Proceedings of the National Academy of Sciences of the United States of America. 70 (4), 982-984 (1973).
- Fishman, H. M., Tewari, K. P., Stein, P. G. Injury-induced vesiculation and membrane redistribution in squid giant axon. Biochimica et Biophysica Acta. 1023 (3), 421-435 (1990).
- Davenport, N. R., Bement, W. M. Cell repair: Revisiting the patch hypothesis. Communicative & Integrative Biology. 9 (6), 1253643(2016).
- McNeil, P. L., et al. Patching plasma membrane disruptions with cytoplasmic membrane. Journal of Cell Science. 113 (11), 1891-1902 (2000).
- Terasaki, M., Miyake, K., McNeil, P. L. Large plasma membrane disruptions are rapidly resealed by Ca2+-dependent vesicle-vesicle fusion events. Journal of Cell Biology. 139 (1), 63-74 (1997).
- Bi, G. Q., Alderton, J. M., Steinhardt, R. A. Calcium-regulated exocytosis is required for cell membrane resealing. Journal of Cell Biology. 131 (6 Pt. 2), 1747-1758 (1995).
- Tam, C., et al. Exocytosis of acid sphingomyelinase by wounded cells promotes endocytosis and plasma membrane repair. Journal of Cell Biology. 189 (6), 1027-1038 (2010).
- Rodriguez, A., et al. Lysosomes behave as Ca2+-regulated exocytic vesicles in fibroblasts and epithelial cells. Journal of Cell Biology. 137 (1), 93-104 (1997).
- Reddy, A., Caler, E. V., Andrews, N. W. Plasma membrane repair is mediated by Ca(2+)-regulated exocytosis of lysosomes. Cell. 106 (2), 157-169 (2001).
- Jimenez, A. J., et al. ESCRT machinery is required for plasma membrane repair. Science. 343 (6174), 1247136(2014).
- Pathak-Sharma, S., et al. High-Throughput Microplate-Based Assay to Monitor Plasma Membrane Wounding and Repair. Frontiers in Cellular and Infection Microbiology. 7, 305(2017).
- Hamon, M. A., et al. Listeriolysin O: the Swiss army knife of Listeria. Trends in Microbiology. 20 (8), 360-368 (2012).
- Seveau, S. Multifaceted activity of listeriolysin O, the cholesterol-dependent cytolysin of Listeria monocytogenes. Subcellular Biochemistry. 80, 161-195 (2014).
- Osborne, S. E., Brumell, J. H. Listeriolysin O: from bazooka to Swiss army knife. Philosophical Transactions of the Royal Society of London B: Biological Sciences. 372 (1726), (2017).
- Lukoyanova, N., Hoogenboom, B. W., Saibil, H. R. The membrane attack complex, perforin and cholesterol-dependent cytolysin superfamily of pore-forming proteins. Journal of Cell Science. 129 (11), 2125-2133 (2016).
- Tweten, R. K. Cholesterol-dependent cytolysins, a family of versatile pore-forming toxins. Infection and Immunity. 73 (10), 6199-6209 (2005).
- Koster, S., et al. Crystal structure of listeriolysin O reveals molecular details of oligomerization and pore formation. Nature Communications. 5, 3690(2014).
- Duncan, J. L., Schlegel, R. Effect of streptolysin O on erythrocyte membranes, liposomes, and lipid dispersions. A protein-cholesterol interaction. Journal of Cell Biology. 67 (1), 160-174 (1975).
- Morgan, P. J., et al. Subunit organisation and symmetry of pore-forming, oligomeric pneumolysin. FEBS Letters. 371 (1), 77-80 (1995).
- Leung, C., et al. Stepwise visualization of membrane pore formation by suilysin, a bacterial cholesterol-dependent cytolysin. eLife. 3, (2014).
- Marchioretto, M., et al. What planar lipid membranes tell us about the pore-forming activity of cholesterol-dependent cytolysins. Biophysical Chemistry. 182, 64-70 (2013).
- Palmer, M., et al. Assembly mechanism of the oligomeric streptolysin O pore: the early membrane lesion is lined by a free edge of the lipid membrane and is extended gradually during oligomerization. European Molecular Biology Organization Journal. 17 (6), 1598-1605 (1998).
- Bavdek, A., et al. pH dependence of listeriolysin O aggregation and pore-forming ability. Federation of European Biochemical Society Journal. 279 (1), 126-141 (2012).
- Schuerch, D. W., Wilson-Kubalek, E. M., Tweten, R. K. Molecular basis of listeriolysin O pH dependence. Proceeding of the National Academy of Sciences of the United States of America. 102 (35), 12537-12542 (2005).
- Cassidy, S. K., O'Riordan, M. X. More than a pore: the cellular response to cholesterol-dependent cytolysins. Toxins (Basel). 5 (4), 618-636 (2013).
- Lam, J., et al. Host cell perforation by listeriolysin O (LLO) activates a Ca(2+)-dependent cPKC/Rac1/Arp2/3 signaling pathway that promotes L. monocytogenes internalization independently of membrane resealing. Molecular Biology of the Cell. , (2017).
- Gekara, N. O., Weiss, S. Lipid rafts clustering and signalling by listeriolysin O. Biochemical Society Transactions. 32 (Pt 5), 712-714 (2004).
- Magassa, N., Chandrasekaran, S., Caparon, M. G. Streptococcus pyogenes cytolysin-mediated translocation does not require pore formation by streptolysin O. European Molecular Biology Organization Reports. 11 (5), 400-405 (2010).
- Baba, H., et al. Induction of gamma interferon and nitric oxide by truncated pneumolysin that lacks pore-forming activity. Infection and Immunity. 70 (1), 107-113 (2002).
- Carrero, J. A., Vivanco-Cid, H., Unanue, E. R. Listeriolysin o is strongly immunogenic independently of its cytotoxic activity. Public Library of Science One. 7 (3), e32310(2012).
- Coconnier, M. H., et al. Listeriolysin O-induced stimulation of mucin exocytosis in polarized intestinal mucin-secreting cells: evidence for toxin recognition of membrane-associated lipids and subsequent toxin internalization through caveolae. Cell Microbiology. 2 (6), 487-504 (2000).
- Suzuki, T., et al. DNA staining for fluorescence and laser confocal microscopy. Journal of Histochemistry and Cytochemistry. 45 (1), 49-53 (1997).
- Bink, K., et al. TO-PRO-3 is an optimal fluorescent dye for nuclear counterstaining in dual-colour FISH on paraffin sections. Histochemistry and Cell Biology. 115 (4), 293-299 (2001).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Birmingham, A., et al. Statistical methods for analysis of high-throughput RNA interference screens. Nature Methods. 6 (8), 569-575 (2009).
- Zhang, X. D. A pair of new statistical parameters for quality control in RNA interference high-throughput screening assays. Genomics. 89 (4), 552-561 (2007).
- Zhang, X. D. A new method with flexible and balanced control of false negatives and false positives for hit selection in RNA interference high-throughput screening assays. Journal of Biomolecular Screening. 12 (5), 645-655 (2007).
- Idone, V., et al. Repair of injured plasma membrane by rapid Ca2+-dependent endocytosis. Journal of Cell Biology. 180 (5), 905-914 (2008).
- Davenport, N. R., et al. Membrane dynamics during cellular wound repair. Molecular Biology of the Cell. 27 (14), 2272-2285 (2016).
- Defour, A., Sreetama, S. C., Jaiswal, J. K. Imaging cell membrane injury and subcellular processes involved in repair. Journal of Visualized Experiments. (85), (2014).
- Lee, J. J. A., et al. Cell Membrane Repair Assay Using a Two-photon Laser Microscope. Journal of Visualized Experiments. (131), (2018).
- Weisleder, N., et al. Visualization of MG53-mediated cell membrane repair using in vivo and in vitro systems. Journal of Visualized Experiments. (52), (2011).
- Corrotte, M., et al. Toxin pores endocytosed during plasma membrane repair traffic into the lumen of MVBs for degradation. Traffic. 13 (3), 483-494 (2012).
- Kuismanen, E., Saraste, J. Low temperature-induced transport blocks as tools to manipulate membrane traffic. Methods in Cell Biology. 32, 257-274 (1989).
- Togo, T., et al. The mechanism of facilitated cell membrane resealing. Journal of Cell Science. 112, 719-731 (1999).
- Johnson, S. A., et al. Temperature-dependent phase behavior and protein partitioning in giant plasma membrane vesicles. Biochimica et Biophysica Acta. 1798 (7), 1427-1435 (2010).
- Lam, J. G. T., et al. Host cell perforation by listeriolysin O (LLO) activates a Ca(2+)-dependent cPKC/Rac1/Arp2/3 signaling pathway that promotes Listeria monocytogenes internalization independently of membrane resealing. Molecular Biology of the Cell. 29 (3), 270-284 (2018).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados