Method Article
Un modelo con ratones Syngeneic células B linfoma de evaluación preclínica de las células de T automóvil CD19
En este artículo
Resumen
Aquí, presentamos un protocolo para la producción y los ensayos preclínicos murinas CD19 coche de células de T por transducción retroviral y utilización como terapia contra establecido syngeneic A20 linfoma en ratones BALB/c con o sin lymphodepleting acondicionamiento previo.
Resumen
El sorprendente éxito clínico de CD19 antígeno quimérico del receptor (CAR)-terapia con linfocitos T ha llevado a la aprobación de los receptores de antígeno quimérico de generación de dos segundos (coches) para el linfoma de la leucemia linfoblástica aguda (toda) andnon-Hodgkin (NHL). El foco del campo está ahora en emular estos éxitos en otras neoplasias hematológicas donde se observan menos impresionantes tasas de respuesta completa. Más ingeniería de las células de T automóvil o administración simultánea de otras modalidades del tratamiento puede superar con éxito obstáculos para la terapia acertada en otras configuraciones de cáncer.
Por lo tanto se presenta un modelo en el que otros pueden llevar a cabo pruebas pre clínicas de células CD19 coche T. Resultados en este modelo bien probado de linfoma de células B están probable que sean informativa terapia de coche T-cell en general.
Este protocolo permite la producción reproducible de ratón células de T de coche a través de la transfección del fosfato de calcio de las células de productor Plat-E con construcciones retrovirales MP71 y pCL-Eco plásmido de embalaje seguido de colección de partículas retrovirales secretadas y transducción de señales mediante centrifugación y fragmento de la fibronectina humana recombinante. Validación de transducción retroviral y confirmación de la capacidad de las células de T automóvil matar objetivo linfoma células ex vivo, mediante citometría de flujo, luminometry y enzima-ligado del inmunosorbente ensayo (ELISA), también se describe.
Protocolos para las pruebas de coche T células en vivo en lymphoreplete y ratones syngeneic lymphodepleted, linfoma sistémico, establecido se describen. Actividad contra el cáncer se controla por en vivo bioluminiscencia y enfermedad la progresión. Mostramos resultados típicos de la erradicación del linfoma de células B establecido al utilizar 1st o 2nd generación coches en combinación con acondicionamiento previo de lymphodepleting y una minoría de ratones lograr remisiones de largo plazo al utilizar coche T células que expresan IL-12 en ratones lymphoreplete.
Estos protocolos pueden utilizarse para evaluar las células CD19 coche T con diferentes modificaciones adicionales, combinaciones de células T de coche y otros agentes terapéuticos o adaptados para el uso de las células de T automóvil contra antígenos diferentes.
Introducción
Terapia de células T antígeno quimérico del receptor (CAR) ha demostrado sorprendente éxito clínico en el tratamiento de CD19+ tumores malignos lleva a la aprobación de tisagenlecleucel para la leucemia linfoblástica aguda recidivante1 y axicabtagene ciloleucel para grandes progresiva de células B linfoma non-Hodgkin2 en 2017.
La importancia de las interacciones entre el cáncer y el sistema inmune en la progresión de la enfermedad y mecanismos terapéuticos se está convirtiendo en cada vez más reconocida3,4,5. Por ejemplo, está bien documentado que el microambiente del tumor (TME) es inundada con los factores que pueden suprimir las funciones efectoras de las células inmunes6,7,8. Alternativamente cebado de células inmunes endógenas y epitopo puede ser clave en la erradicación del tumor y la resistencia de largo plazo a tumor reto9,10. Ambos de estos fenómenos no se puede evaluar en los modelos xenogeneicos que carecen de un sistema inmune. Asimismo, sistemas de utilización de las proteínas transgénicas no reflejan con precisión el desafío de romper la tolerancia inmunológica necesaria para el epitopo que se separa de11,12. Por lo tanto, un modelo syngeneic con un sistema inmune completamente funcional es fundamental para el modelado de estos aspectos importantes de cáncer enfermedad progresión e inmune terapéutica.
Una advertencia importante de la terapia de coche T-cell es lymphodepleting acondicionamiento previo necesario para el éxito terapéutico13,14. Esto se consigue normalmente en los pacientes mediante la administración de quimioterapia antes de la infusión de las células de T de coche15,16. Como un método estándar, con el fin de imitar lymphodepletion utilizado en el entorno del paciente, administrar 5 Gy de irradiación de cuerpo entero (TBI) para lograr la lymphodepletion antes de la administración de células T auto terapéuticas ratones sistémico linfoma A20.
Lymphodepleting acondicionamiento previo no es un problema para la mayoría de los pacientes, toxicidad que viene con agentes quimioterapéuticos significa que pacientes del estado de bajo rendimiento no son elegibles para la terapia del coche T-cell. Para crear un sistema de prueba que representa a los pacientes elegibles para lymphodepletion, hemos establecido un modelo de ratón syngeneic de lymphoreplete en que modelo de terapia de coche T-cell del linfoma. En este modelo, demostró que la secreción de IL-12 desde dentro de las células de T automóvil podría conducir a la erradicación del linfoma establecido con una tasa de éxito de ~ 25%17. Por otra parte, demostramos que las células inmunes endógenas estaban involucradas en la erradicación del cáncer.
Aquí describimos en detalle el protocolo para la producción de células de ratón coche T, establecimiento de linfoma en ratones syngeneic y tratamiento del linfoma de células T de coche con o sin el uso de lymphodepleting acondicionamiento previo. Esto puede utilizarse para los estudios de combinación de células de T automóvil con otros agentes, prueba las células de T automóvil con otros transgenes o para el uso de otras estrategias de terapia o inmunoterapia celular adoptiva contra linfoma.
Protocolo
Todos los experimentos con animales se realizaron bajo los auspicios de la ley de animales (procedimientos científicos) de 1986 y en Reino Unido Comité de coordinación para las pautas de la investigación del cáncer. Todos los estudios en animales fueron realizados en el Instituto de Manchester de CRUK y aprobados por el bienestar de los animales local y ética revisar cuerpo (CRUK MI AWERB).
1. preparaciones
- Maxiprep pMP71 retroviral construcción de plásmidos y pCL-Eco retrovirus empaquetado plásmidos18.
Nota: pMP71 codifica mCherry y el coche separados por una secuencia de FMDV2A. Esto es intercambiable con otras construcciones retrovirales. pCL-Eco codifica gag, pol y las proteínas de envoltura ecotropic. - Preparar medio de células T completo (TCM) para el cultivo de células de ratón T con Medio RPMI 1640, 10% FCS, 1% 100 x penicilina-estreptomicina-glutamina (PSG).
Nota: La solución contiene 100 UI/mL de penicilina, 100 μg/mL de estreptomicina y 2 mM de L-glutamina), 50 μM β-mercaptoetanol y ácido-(2-hydroxyethyl)-1--1-ácido de 25 mM 4 (HEPES). - La cultura A20 células en RPMI 1640, 10% FCS y 0,05 mM β-mercaptoetanol a 37 ° C, 5% CO2.
- Cultura de las células de platino-E (Plat-E) en medio de eagle modificado completa de Dulbecco (DMEM) (DMEM con suero de ternera fetal 10% (FCS), 2 mM L-glutamina, 1 puromicina μg/mL y 10 μg/mL blasticidin) a 37 ° C, 5% CO2.
Nota: PLAT-E las células derivan de células 293T y expresan proteínas retrovirales de gag, pol y ecotropic envolvente. - Preparar la transfección soluciones 1 y 2 inmediatamente antes de la transfección. Preparar la solución 1 (pH 7.9) contienen DMEM + 10% FCS + 25 mM HEPES, solución 2 (pH 7.1) que contenga DMEM + 25 mM HEPES.
- Preparar solución de fragmento de fibronectina humana recombinante de 10 μg/mL por dilución con solución salina estéril tamponada con fosfato (PBS) y almacenar a-20 ° C hasta su uso.
- Estéril filtrar todos los medios a través de 0,2 μm filtros antes de su uso (excluyendo fragmento de fibronectina humana recombinante).
2. retroviral transducción de células T
- Día 1: Preparación para transfección
- Semilla 7,5 x 106 platino-E (Plat-E) células en platos de cultivo de tejidos2 de 15 cm en 18 mL de DMEM completo e incubar durante una noche a 37 ° C, 5% CO2.
- Día 2: Transfección de Plat-E empaquetado retroviral de células
- Preparar 20,4 μg de pcl-Eco vector packaging ADN, 39,6 μg de DNA plasmídico codificación retroviral coche construir y 150 μL de 1 M de CaCl2 a volumen final de 3 mL de solución de la transfección 2 por plato de 15 cm2 al ser transfectadas. Vortex de 10 s y reposo por 5 min.
- Retire los medios DMEM de los platos de 15 cm2 y reemplace con 12 mL de solución de transfección 1.
PRECAUCIÓN Al cambiar los medios de comunicación, pueden secar los platos de 15 cm2 en el centro. Esto puede causar la muerte sustancial de células transfected Plat-E. Trabajar rápidamente y retire los medios de comunicación de sólo 1-2 placas a la vez. - Añadir 3 mL de solución de transfección 2 que contiene ADN y CaCl2 en cada plato2 de 15 cm mediante goteo, uniformemente a través de cada placa. Placas de la roca suavemente con un movimiento de lado a lado para 10 s. incubar a 37 ° C, 5% CO2 durante la noche.
- Día 3: Preparación de que contiene virus de sobrenadante para la transducción
- Reemplazar los medios de comunicación de las células de la placa E transfected con 18 mL TCM de completar y devolución a la incubadora.
PRECAUCIÓN Cuándo cambiar los platos de2 medios 15 cm puede secar en el centro. Esto puede causar la muerte sustancial de células transfected Plat-E. Trabajar rápidamente y retire los medios de comunicación de sólo 1-2 placas a la vez.
- Reemplazar los medios de comunicación de las células de la placa E transfected con 18 mL TCM de completar y devolución a la incubadora.
- Día 3: Aislamiento y en vitro de la activación de las células T del bazo de ratón
- Retire los bazos de ratones BALB/c de 6-8 semanas de edad como se describió anteriormente por Parkinson et al. 19 y sumergirlos en estéril, helada, PBS en un tubo cónico de 50 mL.
- Utilice unas pinzas para transferir un bazo a un tubo de microcentrífuga de 1,5 mL y homogeneizar con un mortero de fuerza mínima.
- Utilice una pipeta de 1000 μL y ~ 800 μL PBS para transferir homogeneizado a un colador de célula de poro 100 μm colocado en un tubo de 50 mL que contiene 5 mL de PBS para lograr una suspensión unicelular. Repita el paso 2.4.2 para los bazos adicionales. No exceda 3 bazos por tubo.
PRECAUCIÓN Esplenocitos pasado por filtro pueden formar grumos si deja de pie. Manualmente agitar tubos intermitentemente si procesar varios bazos para evitar la aglutinación de la célula. Quedan fragmentos en el colador de la célula puede ser más puré utilizando un émbolo de una jeringa de 5 mL con fuerza mínima. - Superior a 20 mL con PBS. La suspensión de células de 20 mL en 20 mL de medio de gradiente de densidad (Tabla de materiales) en un tubo de 50 mL de la capa. Centrifugue la suspensión resultante superpuesta a 800 x g durante 20 min con ningún freno aplicado.
- Cosecha de las células en la capa de interfaz utilizando una pipeta Pasteur estéril y transfiéralo a un tubo de 50 mL. Superior a 50 mL con PBS y centrifugue a 800 x g por 10 min para lavar. Deseche el sobrenadante y resuspender las células en TCM completa.
- Contar el número de células usando un hemocitómetro.
- Cultivo de células con una densidad de 5 x 106 células/mL en TCM completa con 30 ng/mL de anticuerpo anti-CD3ε (clon 2 145 C 11), 30 ng/mL de anticuerpo anti-CD28 (clon 37.51), 100 U/mL recombinante humano IL-2 y recombinante de 2 ng/mL murino IL-7. Utilizar un frasco de cultivo de tejidos de tamaño adecuado para el volumen de las células cosechadas.
Nota: Que presenta células de antígeno–se requieren para la activación de células T por anticuerpos CD3 y CD28, si trabajando con linfocitos T purificados es necesario placas de capa con los anticuerpos, o utilizan granos magnéticos (Tabla de materiales) - Incubar los esplenocitos de ratón a 37 ° C, 5% CO2 durante la noche.
- Día 3: Preparación de placas para la transducción
- Fragmentan de capa placas de 6 pocillos de cultivo de tejidos no con 2 mL de fibronectina humana recombinante de 10 μg/mL e incuban durante una noche a 4 ° C.
- Día 4: Transducción de células de ratón T
- Transferencia fibronectina humana recombinante fragmento de placas cubiertas fresco cultivo de tejidos no bien 6 placas. Incubar las placas durante la noche a 4 ° C para la Ronda 2 de transducción de señales.
- Añadir 2 mL de TCM en cada pocillo de las placas originales de fragmento-revestidas de fibronectina humana recombinante y deja durante 30 min a temperatura ambiente para bloquear la fijación no específica.
- Coseche el sobrenadante que contiene el retrovirus de células transfected Plat-E en platos de cultivo de tejidos de 15 cm y volver a colocar con 18 mL de TCM completa.
PRECAUCIÓN Trabajar rápidamente para evitar la desecación de las células E Plat.
Nota: Éxito de la transfección puede comprobarse en esta fase por microscopía de fluorescencia si utilizando un gen marcador fluorescente como mCherry (figura 1). - Filtrar el sobrenadante que contiene el retrovirus a través de 0,45 μm filtro para eliminar restos celulares. Eliminar TCM fibronectina humana recombinante fragmento recubierto con placas 6-bien y añadir 2,5 mL de sobrenadante filtrado de retrovirus que contienen o a cada pocillo (uso completo TCM para transfección falsa). Etiqueta cada uno así como la adición de retrovirus o media falsa.
- Centrifugue las placas a 1200 x g durante 30 min a temperatura ambiente.
- Mientras que las placas están girando, recoger las células de T activadas y contar usando un hemocitómetro.
- Transducción de señales se lleva a cabo con 5 x 106 activado esplenocitos en un total de 5 mL/pozo. De pellets la cantidad necesaria de esplenocitos de mock/transducción en tubos separados por centrifugación a 500 x g durante 5 minutos.
- Resuspender los esplenocitos en una densidad de 5 x 106 células por 2,5 mL de sobrenadante filtrado de retrovirus que contiene de paso 2.6.4 o TCM como control negativo. Añadir recombinante humano Il de-para las 2 (hIL-2) y ratón recombinante de IL-7 (mIL-7) a una concentración final de 200 UI/mL y 4 ng/mL respectivamente.
- Recoger las placas de 6 pozos de la centrifugadora en la terminación del paso 2.6.5 y añadir 2,5 mL/pocillo suspende de nuevo esplenocitos en pocillos adecuados para hacer un volumen final de 5 mL/pozo y una concentración final de 100 U/mL hIL-2 y 2 ng/mL mIL-7.
- Centrifugue las placas a 1200 x g durante 90 minutos a temperatura ambiente. Después de la centrifugación, incubar las placas a 37 ° C, 5% CO2 durante la noche.
- Día 5: Ronda 2 de transducción de señales
- Recoger el fragmento de la fibronectina humana recombinante de las placas como esto puede ser usado de nuevo. Repita los pasos 2.6.2 - 2.6.5.
- Mientras que las placas están girando, recoger las células de la 1st redondo de transducción mediante una pipeta Pasteur. Lave cada pocillo con 2 mL de PBS, Remolino y recoger cualquier célula remanente en cada pozo.
Nota: Pipetee hacia arriba y hacia abajo para resuspender las células sedimentadas. Recoger cada grupo control/transducción en tubos separados. - Tubos de centrífuga a 500 x g durante 5 min Resuspenda las células en 2,5 mL por pozo de transducción con 200 UI/mL IL-2 y 4 ng/mL IL-7. Repita los pasos 2.6.7 - 2.6.8.
- Extraer células de la centrifugadora e incubar a 37 ° C, 5% CO2 para las celdas de 4 h. recoger transduced en pasos 2.7.2-2.7.3.
- Contar las células, centrifugar a 500 x g durante 5 min y vuelva a suspender en TCM completa a una densidad de 1 x 106 células/mL, 100 U/mL hIL-2 y 2ng/mL 7 mIL. Transferir a un matraz de cultivo convenientemente tamaño e incubar a 37 ° C, 5% CO2.
- Añadir nueva TCM los medios de comunicación que contiene 100U/mL hIL-2 y 2ng/mL 7 mIL cada 2 días, manteniendo una densidad celular de 1 x 106 células/mL.
Nota: Esplenocitos cosechados contienen una variedad de tipos celulares. Bajo estas condiciones de cultivo, las células T no mueren en el transcurso de 2-3 días. Después de ~ 4 días en cultivo celular, el número de células T es normalmente equivalente a la cantidad total de esplenocitos cosechados en el día 0.
3. medición de la eficiencia de la transducción de señales
- El día 4 post de transducción, recoge una muestra de las células de T de transduced o no-transduced (aproximadamente 3 x 105 células). Centrifugue la suspensión de células a 500 x g durante 5 min, eliminar el sobrenadante, lave las células concentradas una vez con PBS y centrifugar nuevamente.
- Deseche el sobrenadante y añadir 100 μL de PBS con un tinte reactivo conveniente amina (por ejemplo, manchas de vivo/muerto, dilución 1 en 100) por pozo. Incubar por 15 min a temperatura ambiente en la oscuridad.
- Lavar dos veces con PBS, centrifugar a 500 x g por 5 min, descartar el sobrenadante e incubar con 50 μL de tampón FACS que contiene anticuerpos de anti-ratón CD16/CD32 para el receptor de Fc bloqueo (dilución 1 en 100). Incubar 10 min a 4 ° C.
- Directamente añadir 50 μL de anticuerpo manchas master mix que contiene anti-mouse BV786 CD4 y CD8 BV711 anticuerpos (concentración final de 1 μL/pozo en tampón FACS). Incubar durante 30 min a 4 ° C en oscuridad. Repetir el lavado 3.3. Resuspenda las células en tampón de PFA 1% y mantener el en la oscuridad a 4 ° C hasta su análisis por citometría de flujo.
- Analizar las células con citómetro adecuado equivalente usando la fluorescencia BV711, BV785 y mCherry como marcadores de subconjunto de linfocitos CD4 y CD8 y auto expresión gating respectivamente (figura 2).
4. in vitro validación de coche T cell actividad
- Semilla syngeneic destino CD19+ las células del tumor con o sin expresión de la luciferasa a una densidad de 1 x 104 células en 100 μL de TCM/pozo en un fondo de U 96 pocillos placa de cultivo de tejidos.
- Añadir 1 x 104 células/pocillo de CD19 coche T en un volumen de 100 μL/pozo para lograr una unidad de efectos relación objetivo (e: t) de 1:1.
Nota: E: t ratios deberían establecerse para cada coche construir y línea celular de destino. - Uso T células solas y solos como controles negativos de las células tumorales y las células T estimuladas por acetato de forbol miristato (PMA) (50 ng/mL) y ionomycin (1 μg/mL) como control positivo para la liberación de interferón gamma (IFNγ). Co de la cultura las células a 37 ° C, 5% CO2 para 16-24 h.
- Después de co-cultivo, Centrifugue las placas a 500 x g durante 5 min y recoger el sobrenadante para su posterior análisis IFNγ y la IL - 12 p 70 ELISA.
Nota: Esto puede ser almacenado a-80 ° C. - Vuelva a suspender los pellets de células en 100 μL de PBS con luciferin (concentración final de 1,5 mg/mL). Incubar las placas durante 10 min a 37 ° C. Luego medir la luminiscencia de cada pozo con un luminómetro adecuado.
Nota: Tiempos de exposición deben optimizarse para densidad y líneas celulares. Resultados representativos se muestran en la figura 3a. Citotoxicidad de ex vivo de células T auto puede modificarse a luciferin expresa por co-cultivo con líneas celulares que expresan el antígeno Diana. Como las células de T automóvil matan células diana, luciferin es liberado, por lo tanto una reducción en la señal luminometry se correlaciona con la muerte celular. Células no-transduced a menudo pueden tener un efecto sobre la viabilidad de las células blanco, particularmente sobre períodos de incubación. Medir la concentración de murino IFNγ y la IL - 12p 70 en el sobrenadante según protocolos de ELISA del fabricante. Resultados representativos se muestran en la (figura 3b y 3C). Activación ex vivo coche de células de T por co-cultivo con líneas celulares que expresan el antígeno objetivo puede ensayarse mediante el análisis de contenido de sobrenadante mediante ELISA. La relación de coche T cell a las células diana y duración del período de la cultura deben ser optimizados para cada coche construcción línea de célula blanco y analito. PMA y ionomycin tratamiento puede utilizarse como control positivo para confirmar la calidad de las células T y su capacidad de respuesta.
5. evaluar la actividad de lucha contra el cáncer en ratones
-
Protocolo n ° 1
- Realizar 100 mg/kg intravenoso (IV) entrega ciclofosfamida en ratones BALB/c de 6 a 8 semanas. Esto permite el engraftment tumor sin significativa lymphodepletion17 (figura 4).
Nota: Establecer A20 linfoma puede tomar más de 2 meses con una tasa de tomar subóptima. Esto puede mejorarse mediante el uso de ciclofosfamida 1 día antes de la entrega de las células del linfoma. Para estudiar lymphoreplete ratones, identificamos una dosis de la ciclofosfamida que puede aumentar la eficiencia de linfoma sin causar lymphodepletion. - Al día siguiente, inyectar 100 μl de 5 x 105 syngeneic A20 de células B linfoma células modificadas para expresar la proteína fluorescente verde y luciferasa (GFP) en ratones por la inyección intravenosa (IV).
- Permitir que los ratones a desarrollar linfoma sistémico para ~ 17 días.
- Inyección intraperitoneal (IP) de 100 μL de luciferin 30 mg/mL y la proyección de imagen usando una bioluminiscencia en vivo sistema de imagen para confirmar la presencia de linfoma sistémico.
- Utilizar separadores para evitar el desbordamiento de la señal en ratones adyacentes. Exponer ratones durante 1 min en el lado ventral con una región de tamaño constante de interés.
- Unidades relativas de luz (RLU) se muestran como fotones por segundo (p/s). Configuración debe optimizarse para cada modelo de tumor; Utilice una exposición que puede recoger con la detección temprana de tumores, pero no conduce a la saturación como tumores llegar a extremos.
- Registro RLU total para cada ratón con una constante tamaño de región de interés. (Figura 5a y b).
- Inyectar un linfoma de dosis única de 1 x 106 células de T automóvil por inyección IV en ratones lymphoreplete establecido.
Nota: (importante) Niveles de dosificación debe ser establecida para cada coche construir usando un horario de escalada de dosis para asegurar que cualquier posible toxicidad derivados de las células de T automóvil se caracteriza y puede abordarse. Aunque células de anti-ratón CD19 coche T no muestran efectos tóxicos, las células de T del coche pueden dar lugar a toxicidades inesperadas. Donde no está idéntico múltiples coches construcciones y eficiencia de la transducción de señales, el número total de células T administrada debe tener igual por la adición de células T no-transduced en preparaciones celulares. - Seguimiento de la progresión de la enfermedad semanalmente a través de la inyección del IP de 100 μL de luciferin 30 mg/mL y la proyección de imagen usando una bioluminiscencia en vivo imágenes de sistema (figura 5C).
- Estrechamente controlar ratones para detectar signos de toxicidad y eutanasia cualquier ratones que muestran signos tempranos de parálisis de extremidades (HLP) o carga tumoral patológico antes de que cualquier sufrimiento puede surgir.
Nota: Toxicidad de linfoma A20 puede incluir parálisis de extremidades a través de la invasión del tumor de las meninges. Compruebe regularmente los signos tempranos de marcha alterada. Asimismo, pueden surgir tumores grandes de IP que puede conducir a molestias por conducta alterada. - Seguimiento de la supervivencia de los ratones de 60-100 días (Figura 5D). Realizar la eutanasia por un método de programación-1 al término del experimento.
- Realizar 100 mg/kg intravenoso (IV) entrega ciclofosfamida en ratones BALB/c de 6 a 8 semanas. Esto permite el engraftment tumor sin significativa lymphodepletion17 (figura 4).
-
Protocolo 2
- Entregar ciclofosfamida de 200 mg/kg a 6 a 8 semanas de edad ratones BALB/c por cola inyección en la vena en 100 μL de PBS por ratón.
- Al día siguiente, inyectar de 5 x 105 syngeneic A20 células B células del linfoma expresan luciferasa y GFP en 100 μL PBS mediante cola inyección en la vena.
- Permitir que los ratones a desarrollar linfomas sistémicos de ~ 7-14 días
- Inyección del IP de 100 μL de luciferin 30 mg/mL y la proyección de imagen usando una bioluminiscencia en vivo sistema de imagen para confirmar linfoma sistémico.
- Realizar 5 Gy irradiación de cuerpo entero (TBI) a 0,02 Gy/min para lymphodepletion.
Nota: Pacientes sometidos a tratamientos de coche T-cell se someten a una variedad de regímenes para lograr lymphodepletion antes de la administración de células T de coche que aumenta significativamente el engraftment de eventualmente las células de T del coche. Esto puede ser replicado en ratones con irradiación corporal total (TBI) (figura 6). - Al día siguiente, inyecte 1 x 106 células de T del coche en 100 μL de PBS a través de cola vena inyección en ratones estableció los tumores.
- Recoger hemorragias de sangre las muestras via cola vena después de 7 días.
- Añadir el tampón de lisis de eritrocitos a cada muestra de sangre, y luego prepararse para citometría de flujo como se describe en la sección 3. Analizar la persistencia de células T del coche en la circulación mediante citometría de flujo (figura 2).
Nota: Además de contar cuentas inmediatamente antes de la citometría permite determinación del número de células de T automóvil por mililitro de sangre. - Monitorear el progreso de la enfermedad como se describe en pasos 5.1.5 - 5.1.8 (figura 7).
Resultados
Para la transducción de alta eficiencia de células T, es necesario obtener partículas retrovirales frescas. Transfección de la línea celular de Plat-E con pCL-Eco productor plasmid y plásmido de retrovirus pMP71 da lugar a la secreción de partículas retrovirales en el sobrenadante de la célula. Cuando un gen marcador fluorescente, como mCherry, está codificado en los retrovirus, exitosa transfección puede confirmarse por microscopía de fluorescencia (figura 1). Sobrenadante que contiene el virus de células transfected Plat-E se utiliza para transducir las células T a través de 2 rondas de spin-fection de fibronectina fragmento recubierto de placas. La eficiencia de transducción puede determinarse 4 días post transducción mediante citometría de flujo. Con éxito transduced las células expresan el gen marcador codificado en los retrovirus (figura 2). Eficiencia de transducción entre ~ 50-90% de eficiencia con los receptores de primera generación a ~ 10-40% con el coche se construye cerca de la capacidad de empaquetado retroviral. Mientras que la expresión del gen marcador muestra transducción retroviral exitoso, es fundamental para mostrar la funcionalidad de las células de T de coche en relación con las células eso antígeno objetivo expresa en su superficie. Líneas de celulares objetivo modificadas para luciferase expres pueden utilizarse en luciferase ensayos para probar el grado de matar células por coche T las células directamente (Figura 3A). La liberación de citoquinas efectoras de las células de T de coche en co-cultivo con células blanco, determinadas por ELISA, también puede ser utilizada como una medida indirecta de la citotoxicidad de células T auto (figura 3B y 3C).
Las células de T automóvil producidas en el presente Protocolo pueden evaluarse en ratones lymphoreplete estableciendo sistémico linfoma A20 con una dosis de 100 mg/kg de ciclofosfamida (inyectado por vía intravenosa), 1 día antes de la inyección IV de las células 5 x 105 A20 (figura 4). Inyección de IP con captura de imagen y luciferin utilizando a un toner de bioluminiscencia en vivo puede utilizarse para monitorear la carga del tumor usando un tiempo de retorno de la inversión y la exposición constante a lo largo (figura 5A-C). Las células de T automóvil modificadas que expresa IL-12 son capaces de erradicar el linfoma sistémico con lymphodepleting acondicionamiento previo dando supervivencia libre de enfermedad en aproximadamente el 25% de los ratones (figura 5). Lymphodepleting preacondicionamiento, alcanzado por 5 Gy TBI 1 día antes de la administración IV de células T auto mejora considerablemente el engraftment (figura 6). En este modelo, las células de T automóvil de primera generación son capaces de erradicar el linfoma A20 sistémico, por lo general inducen la supervivencia libre de enfermedad en el 100% de los ratones (figura 7).
Figura 1. Confirmación de la exitosa transfección de células Plat E. PLAT-E las células transfected con retroviral construir coches y pMP71 y ADN de plásmido pcl-Eco packaging vector. Expresión del gen marcador fluorescente mCherry demuestran exitosa transfección. A) microscopía de campo brillante, B) microscopía de fluorescencia y C) se muestran imágenes combinadas. Magnificación = 50 X. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2. Determinar la eficacia de transducción mediante citometría de flujo. Citometría de flujo se utiliza para determinar la eficiencia de la transducción de las células de ratón T el día 4 post de transducción, usando a UV Zombie vivo/muerto, mCherry, BV711 y BV785 para la detección de la vida, auto construir, las células CD4 y CD8, respectivamente. Resultados representativos de A) no-transduced, B) mCherry.αmCD19.mCD3z y C) mCherry.αmCD19.mCD3z.mIL12 se muestra con compuerta de 1) 2 camisetas) vivir células 3) CD4 y CD8 4) y 5) evaluación de las células positivas mCherry expresando su coche. Haga clic aquí para ver una versión más grande de esta figura.
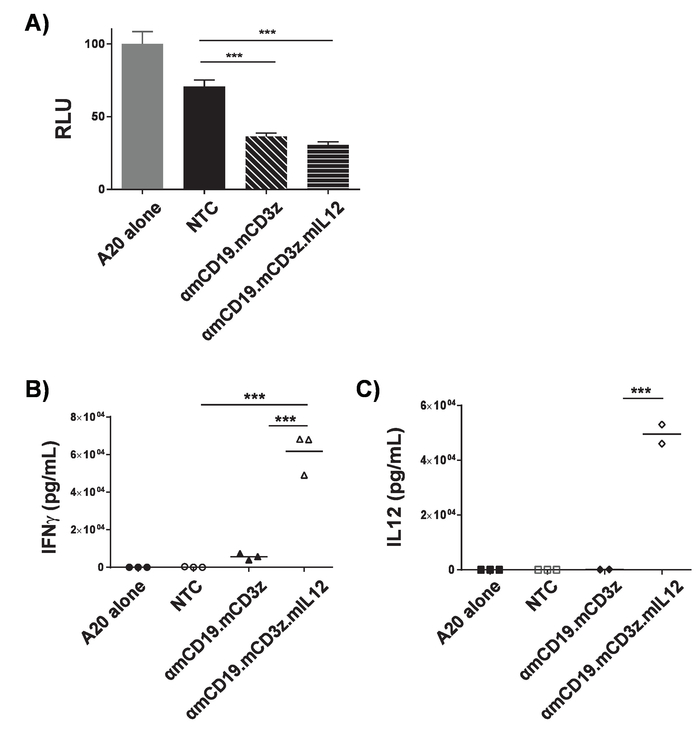
Figura 3. Validación de la actividad de células T auto. ΑmCD19 coche T células eran Co cultivadas con células de linfoma A20 modificadas para luciferase expres (1 x 104: 1 x 104) durante 16 horas en una placa de fondo U 96 pocillos. Después de co-cultivo, las células fueron peleteadas y se recogió el sobrenadante. A) las células se resuspendió en PBS y luminometry se utilizó para evaluar la viabilidad de las células diana. Sobrenadante de cocultivo se evaluó la presencia de IFNγ (B) y la IL-12 (C). Deben optimizarse la relación de coche T cell a las células diana y duración del período de la cultura de construir para cada coche y línea celular de destino. PMA y ionomycin tratamiento puede utilizarse como control positivo para confirmar la calidad de células T y su capacidad para responder. Barras de error indican SD. estadístico análisis se realizaron mediante ANOVA unidireccional. p < 0,001). Esta figura ha sido modificada desde17. Haga clic aquí para ver una versión más grande de esta figura.
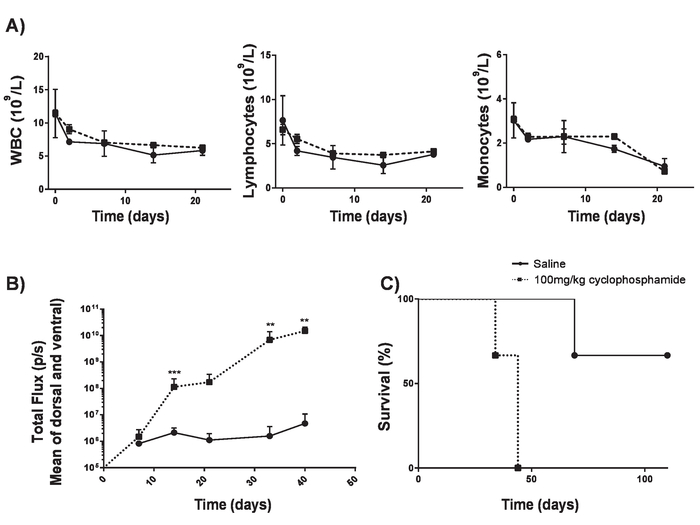
Figura 4. Establecimiento de linfoma A20 sin lymphodepletion. Ciclofosfamida puede aumentar la eficacia de la inducción de linfoma sin causar lymphodepletion. A) cuentas de sangre de los ratones BALB/c 6-8 semanas de edad después de la entrega IV de 100 mg/kg de ciclofosfamida. Barras de error indican SD B) carga de linfoma de ratones BALB/c de 6-8 semanas de edad después de la entrega IV de 100 mg/kg de ciclofosfamida o solución salina en el día -1 y IV entrega de las células 5 x 105 A20 en el día 0 medidos con un luminómetro. C) la supervivencia de ratones en B). Barras de error indican SD. estadístico análisis se realizaron mediante ANOVA de 2 vías. ** p < 0.01, *** p < 0.001). Esta figura ha sido modificada de Kueberuwa et al. 17. haga clic aquí para ver una versión más grande de esta figura.
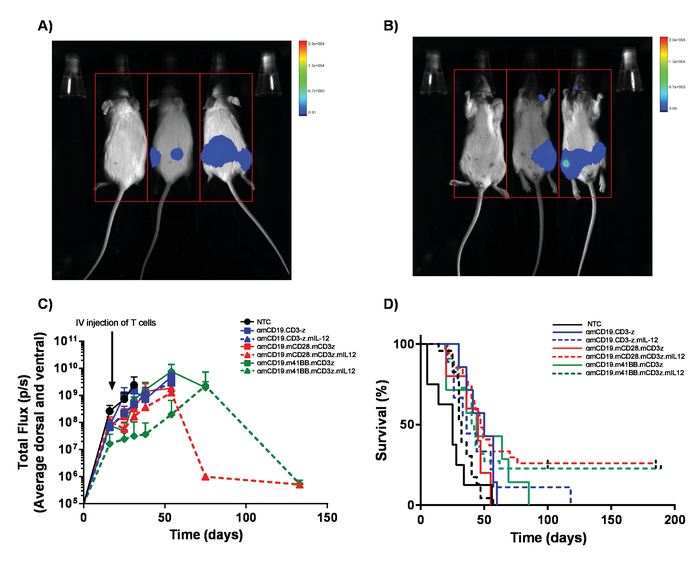
Figura 5. Monitoreo de carga de linfoma y la supervivencia. Ratones con linfoma A20 expresan luciferasa reciben 100 μl intraperitoneal (IP) inyecciones de luciferin 30 mg/mL y fueron reflejadas mediante una bioluminiscencia en vivo sistema de imagen. A) ratones fueron expuestos durante 1 min en el lado ventral e inmediatamente volcó a imagen dorsal para recoger a las masas de tumor en ambos lados de los cuerpos (B). C) resultados representativos de la carga de linfoma de ratones BALB/c recibir diferentes células de coche T αmCD19 sin lymphodepletion. Barras de error indican SEM. D) tasa de supervivencia de los ratones de la misma. Esta figura ha sido modificada de Kueberuwa et al. 17. haga clic aquí para ver una versión más grande de esta figura.
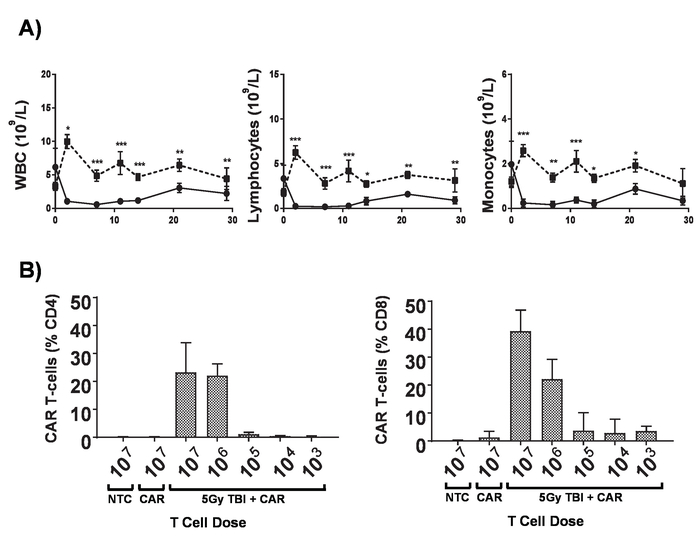
Figura 6. Efectos de lymphodepletion. A) cuentas de sangre de los ratones BALB/c 6-8 semanas de edad después de recibir 5 Gy TBI en una dosis de 0,02 Gy/min; barras de error Mostrar estadística SD. análisis por ANOVA de dos vías. p < 0.05, ** p < 0.01, *** p < 0.001. B) monitoreo de CD4+ y CD8 de las células en la sangre periférica de ratones+ T coche por citometría de flujo para la mCherry marcador gen 7 días post administración. Barras de error indican SD Esta figura ha sido modificada de Kueberuwa et al. 17. haga clic aquí para ver una versión más grande de esta figura.
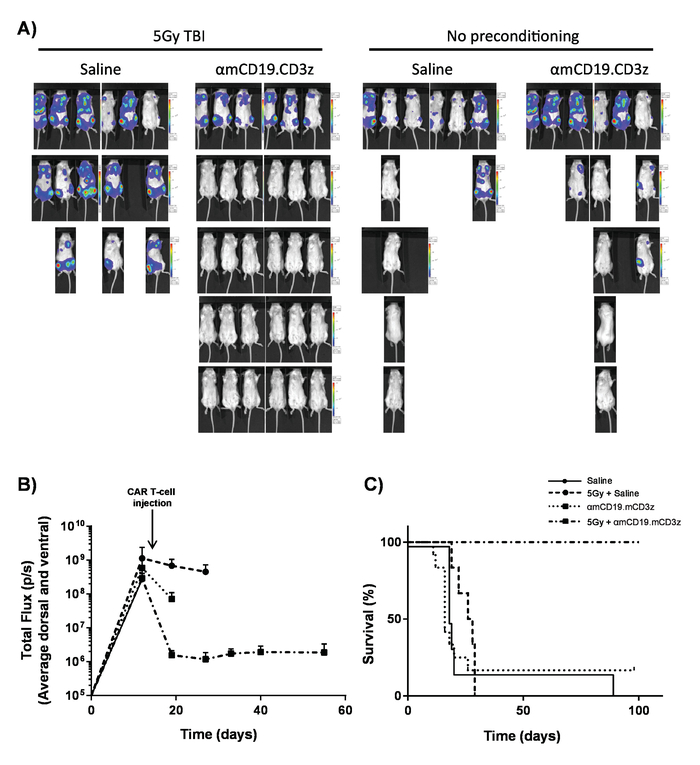
Figura 7. Actividad de las células de T automóvil con acondicionamiento previo del lymphodepleting. Resultados típicos que muestran el efecto de 5 Gy TBI el día antes de la administración de coche T-cell. A) proyección de imagen y (B) muestra gráfica de la proyección de imagen de ratones después de 100 μl intraperitoneal (IP) las inyecciones de luciferin 30 mg/mL usando una bioluminiscencia en vivo sistema de imagen. Barras de error indican SEM. C) la supervivencia de los ratones de la misma. Esta figura ha sido modificado fromKueberuwa et al. 17. haga clic aquí para ver una versión más grande de esta figura.
Discusión
Modelos de ratón syngeneic permiten pruebas de progresión de la enfermedad y la terapia mientras se mantiene un sistema inmune intacto. Esto es fundamental cuando se trata de terapias que interactúan con el sistema inmunitario y, en particular para los agentes inmunoterapéuticos.
El protocolo descrito aquí tiene dos flujos de trabajo fundamentales, el primero de ellos es modificar genéticamente células T de ratón para expresar coches. Esto requiere de 7 días desde el inicio a la validación de la transducción. Concomitante con la producción de células T del coche es el establecimiento de linfoma sistémico en ratones. Si la producción de células T auto no, o ser de calidad insuficiente, por lo general no hay suficiente tiempo para producir las células de reemplazo antes de ratones sucumben a linfoma. Por lo tanto es fundamental que los investigadores usando estos modelos exactamente realizan estudios de tumor de dosificación y enfermedad progresión para tiempo con éxito la producción de células T auto de administración terapéutica.
Típicas razones para la baja eficiencia de transducción de células T incluye eficiencia de transfección deficiente de las células del productor, normalmente causada por la pureza de plásmido pobre o incorrecta determinación del pH de los medios de comunicación de la transfección. Se recomienda comprobar la eficiencia de la transfección de la célula productora antes de proceder con el protocolo completo como transfección deficiente limita la eficiencia de la transducción de la célula de T. Fragmentos de fibronectina humana recombinante pueden ser recogidos y almacenaron a-20 ° C para su reutilización, sin embargo, múltiples resultado de congelar-deshiela en eficiencia de transducción reducida. Procesamiento rápido de bazos de ratón después de que colección es también importante para la obtención de altos rendimientos de células T viables.
Cabe señalar que el protocolo descrito aquí utiliza A20 células expresan luciferasa. Esto es preferido ya que le proporciona la capacidad para medir la carga del tumor sistémico por proyección de imagen de bioluminiscencia. Sin embargo, en presencia de un sistema inmune funcional, respuestas a luciferase podrían sesgar los resultados. Previamente hemos probado las reacciones inmunes de ratones con marcador los transgenes17de sobrevivir. Es clave para replicar experimentos claves A20 células libres de los transgenes a validar que estos no juegan un papel significativo en la erradicación del tumor por las células inmunes.
Mientras agentes clínicos sólo pueden ser usado en vivo en ratones deficientes inmune, el uso de células de ratón coche T contra las células cancerosas de ratón nos permite evaluar la contribución del sistema inmune a progresión de enfermedad o eficacia terapéutica. Este protocolo podría ser utilizado para la evaluación preclínica de coches dirigidos a linfoma de células B u otros coches con modificaciones tales como la secreción de IL-12 como se describe aquí. Debe ser observado que aunque la interacción entre las células inmunes puede ser evaluada en modelos de ratón syngeneic, pueden no exactamente recapitulan la interacción en los seres humanos en vivo. De particular cuenta, humano y ratón CARs puede variar en la estructura que puede tener consecuencias posteriores; activación y la célula cultura las condiciones óptimas para el crecimiento de las células T son diferentes20, distribución tisular de la expresión del antígeno objetivo puede variar entre los seres humanos y ratones y experimentado toxicidad puede ser radicalmente diferentes. Por lo tanto, es esencial utilizar ex vivo y xenogeneicos modelos para corroborar resultados.
En Resumen, el lymphoreplete modelo de linfoma y lymphodepleted syngeneic recapitulan a pacientes con y sin quimioterapia y radioterapia previa. Esto proporciona un sistema modelo en el que imitan la configuración clínica para permitir la prueba de una gama de estrategias terapéuticas que serán importantes con la próxima ola de nuevos agentes de terapia inmune.
Con el uso de acondicionamiento previo, se tendrá en cuenta que todos los ratones claro normalmente el linfoma. Con up a tasas de 90% de respuesta completa en los seres humanos, esto es representativo. Sin embargo, los retos para la terapia de células CD19 coche T dependerá evitar la alta frecuencia de recaídas observada que a menudo son CD19. Las recaídas han no se ha observado en este modelo hasta y a menudo más allá de 100 días. Modificaciones a las recaídas en la clínica podrían ayudar con los retos de futuro de la terapia de CD19 coche T-cell.
Divulgaciones
David Gilham trabaja para Celyad que participa en la producción de células T del coche. El resto de los autores no tienen nada que revelar.
Agradecimientos
Nos gustaría agradecer a Bloodwise por financiar esta investigación (grant 13031) y el Manchester CRUK biológica unidad, proyección de imagen y citometría y biología molecular base servicios recursos para apoyar este trabajo.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.2 µm syringe filter | Appleton Woods | FC121 | |
| 0.45 µm syringe filter | Appleton Woods | FC122 | |
| 1.5ml pestle and microtube | VWR | 431-0098 | |
| 100X penicillin-streptomycin-glutamine (PSG) | Gibco | 10378016 | |
| 2-Mercaptoethanol (50 mM) | Gibco | 31350-010 | |
| Blasticidine S hydrochloride | Sigma- Aldrich | 15205 | |
| Bottle Top Filter (0.2 µm) | Scientific Laboratory Supplies | FIL8192 | |
| Brilliant Violet 711 anti-mouse CD8a Antibody | BioLegend | 100759 | 1 in 100 staining dilution. Clone 53-6.7 |
| Brilliant Violet 785 anti-mouse CD4 Antibody | BioLegend | 100552 | 1 in 100 staining dilution. Clone RM4-5 |
| Calcium chloride dihydrate | Sigma- Aldrich | C7902 | |
| Cell counting beads – CountBright absolute counting beads | Molecular Probes | C36950 | |
| Cell Strainer 100μm | VWR | 734-0004 | |
| Cyclophosphamide Monohydrate | Merck | 239785-1GM | |
| Dulbecco’s Modified Eagle medium (DMEM) - High Glucose | Sigma Aldrich | D6546 | |
| Dynabeads | Gibco | 11131D | |
| Ficoll Paque Plus | GE Healthcare | GE17-1440-03 | Sold by Sigma- Aldrich |
| Flow cytometer - LSR Fortessa x20 | BD Biosciences | 658222R1 | |
| Foetal Bovine Serum | Gibco | 10270 | |
| Haemacytometer | Appleton Woods | HC001 | |
| HEPES solution | Sigma- Aldrich | H0887 | |
| IL-12 p70 Mouse Uncoated ELISA Kit | Invitrogen | 88-7121-76 | |
| IL2, Proleukin | Novartis | PL 00101/0936 | |
| in vivo bioluminescence imaging system – in vivo xtreme II imaging system | Bruker | T149094 | |
| Ionomycin Calcium Salt | Sigma- Aldrich | I0634 | |
| Live/dead stain - Zombie Violet Fixable Viability Kit | BioLegend | 423114 | 1 in 100 staining dilution |
| Luminometer - Lumistart Omega | BMG Labtech | 415-301 | |
| Murine IFN-γ ELISA kit | Diaclone | 861.050.010 | |
| Paraformaldehyde | Sigma- Aldrich | 16005 | |
| pCL-Eco | Novus Biologicals | NBP229540 | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma- Aldrich | P8139 | |
| Platinum E cell line | Cell Biolabs | RV-101 | (RRID:CVCL_B488) |
| Purified NA/LE Hamster Anti-Mouse CD28 | BD Biosciences | 553294 | Clone 37.51 |
| Purified NA/LE Hamster Anti-Mouse CD3ε | BD Biosciences | 553057 | Clone 145-2C11 |
| Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block) | BD Biosciences | 553142 | 1 in 100 staining dilution. Clone 2.4G2 |
| Puromycin Dihydrochloride | Sigma- Aldrich | P8833 | |
| Recombinant human fibronectin fragment - RetroNectin Reagent | TaKaRa | T100B | |
| Recombinant Mouse IL-7 (carrier-free) | BioLegend | 577806 | |
| Red cell lysis buffer | eBioscience | 004-4333-57 | |
| RPMI 1640 Medium | Lonza | BE12-167F | |
| Trypsin - EDTA solution | Sigma- Aldrich | T3924 | |
| XenoLight D-Luciferin | Perkin Elmer | 122799 |
Referencias
- . Food and Drugs Administration Biologics Licence Application Approval letter Available from: https://www.fda.gov/downloads/BiologicsBloodVaccines/CellularGeneTherapyProducts/ApprovedProducts/UCM574106.pdf (2017)
- . Food and Drugs Administration Biologics Licence Application Approval letter Available from: https://www.fda.gov/downloads/biologicsbloodvaccines/cellulargenetherapyproducts/approvedproducts/ucm581259.pdf (2017)
- Liu, Y., Zeng, G. Cancer and Innate Immune System Interactions: Translational Potentials for Cancer Immunotherapy. Journal of Immunotherapy. 35 (4), 299-308 (2012).
- Janssen, L. M. E., Ramsay, E. E., Logsdon, C. D., Overwijk, W. W. The immune system in cancer metastasis: friend or foe. Journal for ImmunoTherapy of Cancer. 5 (1), 79 (2017).
- Pandya, P. H., Murray, M. E., Pollok, K. E., Renbarger, J. L. The Immune System in Cancer Pathogenesis: Potential Therapeutic Approaches. Journal of Immunology Research. 2016, 13 (2016).
- Vinay, D. S., et al. Immune evasion in cancer: Mechanistic basis and therapeutic strategies. Seminars in Cancer Biology. 35, S185-S198 (2015).
- Gajewski, T. F., Meng, Y., Harlin, H. Immune Suppression in the Tumor Microenvironment. Journal of Immunotherapy. 29 (3), 233-240 (2006).
- Munn, D. H., Bronte, V. Immune suppressive mechanisms in the tumor microenvironment. Current opinion in immunology. 39, 1-6 (2016).
- Vanderlugt, C. L., Miller, S. D. Epitope spreading in immune-mediated diseases: implications for immunotherapy. Nature Reviews Immunology. 2, 85 (2002).
- Hardwick, N., Chain, B. Epitope spreading contributes to effective immunotherapy in metastatic melanoma patients. Immunotherapy. 3 (6), 731-733 (2011).
- Makkouk, A., Weiner, G. Cancer Immunotherapy and Breaking Immune Tolerance-New Approaches to an Old Challenge. Cancer research. 75 (1), 5-10 (2015).
- Jackson, S. R., Yuan, J., Teague, R. M. Targeting CD8(+) T-cell tolerance for cancer immunotherapy. Immunotherapy. 6 (7), 833-852 (2014).
- Brentjens, R. J., et al. Lymphodepletion and tumor burden govern clinical responses in patients with B-cell malignancies treated with autologous, CD19-targeted T cells. Journal of Clinical Oncology. 29 (15_suppl), 2534 (2011).
- Brentjens, R. J., et al. Safety and persistence of adoptively transferred autologous CD19-targeted T cells in patients with relapsed or chemotherapy refractory B-cell leukemias. Blood. 118 (18), 4817 (2011).
- Hay, K. A., et al. Kinetics and Biomarkers of Severe Cytokine Release Syndrome after CD19 Chimeric Antigen Receptor-modified T Cell Therapy. Blood. 130, 2295-2306 (2017).
- Zhang, T., et al. Efficiency of CD19 chimeric antigen receptor-modified T cells for treatment of B cell malignancies in phase I clinical trials: a meta-analysis. Oncotarget. 6 (32), 33961-33971 (2015).
- Kueberuwa, G., Kalaitsidou, M., Cheadle, E., Hawkins, R. E., Gilham, D. E. CD19 CAR T Cells Expressing IL-12 Eradicate Lymphoma in Fully Lymphoreplete Mice through Induction of Host Immunity. Molecular Therapy - Oncolytics. 8, 41-51 (2018).
- Engels, B., et al. Retroviral vectors for high-level transgene expression in T lymphocytes. Human Gene Therapy. 14 (12), 1155-1168 (2003).
- Parkinson, C. M., et al. Diagnostic Necropsy and Selected Tissue and Sample Collection in Rats and Mice. Journal of Visualized Experiments: JoVE. (54), e2966 (2011).
- Kueberuwa, G., et al. CCR7(+) selected gene-modified T cells maintain a central memory phenotype and display enhanced persistence in peripheral blood in vivo. Journal for Immunotherapy of Cancer. 5, 14 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados