Method Article
Uso de proteínas de fusión recombinantes en una plataforma de ensayo fluorescente proteasa y su renaturalización en gel
En este artículo
Resumen
Aquí, presentamos el procedimiento detallado de una plataforma de ensayo de proteasa recientemente desarrollado utilizando N-terminal hexahistidine/maltosa-proteína y sustratos recombinantes fusionado a la proteína fluorescentes Unidos a la superficie de níquel nitrilotriacético perlas de agarosa magnética ácido. Un posterior análisis en gel de las muestras de ensayo separados por electroforesis dodecyl del gel del sulfato-poliacrilamida del sodio también se presenta.
Resumen
Las proteasas son enzimas estudiadas intensivamente debido a su papel esencial en varias vías biológicas de organismos vivos y en la patogenia; por lo tanto, son objetivos importantes de la droga. Hemos desarrollado una plataforma de ensayo magnético-agarosa-grano-basado para la investigación de la actividad proteolítica, que se basa en el uso de substratos de la proteína de fusión recombinante. Para demostrar el uso de este sistema de ensayo, un protocolo se presenta en el ejemplo de virus de inmunodeficiencia humana tipo 1 (VIH-1) proteasa. La plataforma de ensayo introducido puede ser utilizada eficientemente en la caracterización bioquímica de las proteasas, incluyendo mediciones de actividad enzimática en mutagénesis, cinética, inhibición o estudios de especificidad, y que puede ser conveniente para alto rendimiento cribado del sustrato o puede ser adaptado a otras enzimas proteolíticas.
En este sistema de ensayo, los sustratos aplicados contienen maltosa vinculante proteínas (MBP) etiquetas y N-terminal hexahistidine (sus6), sitios de la hendidura para el tabaco etch virus (TEV) y las proteasas del VIH-1 y una proteína fluorescente C-terminal. Los sustratos pueden producir eficientemente en células de Escherichia coli y purificaron fácilmente usando granos recubiertos - quelato - níquel (Ni). Durante el ensayo, el clivaje proteolítico de sustratos de grano Unido conduce a la liberación de fragmentos fluorescentes escote, que puede ser medida por fluorimetría. Además, las reacciones de la hendidura pueden ser analizadas por electroforesis del gel de la sulfato-poliacrilamida de sodio dodecyl (SDS-PAGE). También se describe un protocolo para la renaturalización en gel de los componentes del ensayo, como parcial renaturalización de proteínas fluorescentes permite su detección basado en peso molecular y de la fluorescencia.
Introducción
Las enzimas proteolíticas pertenecen a los grupos más intensivamente investigados enzima debido a su importancia en las vías metabólicas y en aplicaciones industriales, así como. Su papel clave en enfermedades virales, la regulación de la coagulación, cáncer y cardiovasculares y enfermedades neurodegenerativas proteasas objetivos prominentes en el campo del descubrimiento de fármacos. Por lo tanto, la caracterización detallada de la especificidad de sustrato y perfiles de inhibidor de la proteasa (PR) de interés es fundamentales y se realizan preferiblemente por ensayos bioquímicos rápidos, costo-eficiente y robusto1,2, 3.
Hoy en día, la gran mayoría de proteasa in vitro ensayos en el campo del descubrimiento de fármacos para perfiles compuestos son homogéneo, fluorescente basados en péptidos y alto rendimiento screening (HTS)-plataformas compatibles4. Por otra parte, péptidos marcados no sólo son adecuados para la investigación de la biblioteca, pero también ofrecen excelentes herramientas para la determinación de la enzima parámetros cinéticos en los substratos seleccionados. En otros casos, donde no es posible etiquetado del sustrato, ensayos de separación pueden proporcionar una solución posible para evaluar las propiedades cinéticas de las reacciones proteolíticas3.
Generalmente, los ensayos in vitro de la proteasa se basan en el uso de dos tipos de sustrato: corta péptidos o proteínas enteras. En esos casos, donde la ruptura de secuencias peptídicas cortas reflejan las propiedades de escote suficientemente, son aplicables los métodos estándar siguientes: (i) examen de sustratos estándar de proteína como la insulina oxidada cadena B, (ii) pruebas sustratos disponibles en el mercado de otras proteasas, (iii) bibliotecas de péptidos sintéticos y fluorescencia etiquetada creadas por química combinatoria, o (iv) de detección mediante métodos genéticos, por ejemplo, biológico Mostrar tecnologías5, 6. Además de la clasificación convencional, otras novedosas plataformas están también disponibles para la generación de sustrato (por ejemplo, la formación de péptidos derivados del proteoma bibliotecas7 o subtipos especiales de métodos genéticos, como la fusión recombinante sustratos a base de proteína8,9,10,11,12).
Todos los análisis y tipos de sustrato antes mencionados tienen sus propias ventajas y limitaciones, y el desarrollo de formatos de ensayo combina y mejora las ventajas de las plataformas conocidas todavía está en demanda. Aquí se describe un protocolo para un ensayo fluorescente basado en la separación de la proteasa, que utiliza sustratos recombinantes. Estas proteínas de fusión consisten en su6 y etiquetas MBP fusionados a un sitio de la hendidura del control de la TEV, que es seguido por la secuencia de sustrato de interés que está conectado directamente a una proteína fluorescente C-terminal (FP) (figura 1A). La clonación de una secuencia de ADN que codifica para un sitio de la hendidura de interés dentro del cartucho de' clonación' puede ser realizada por una reacción de la ligadura sola en el plásmido de expresión, que ha sido linealizado previamente por endonucleasas de restricción.
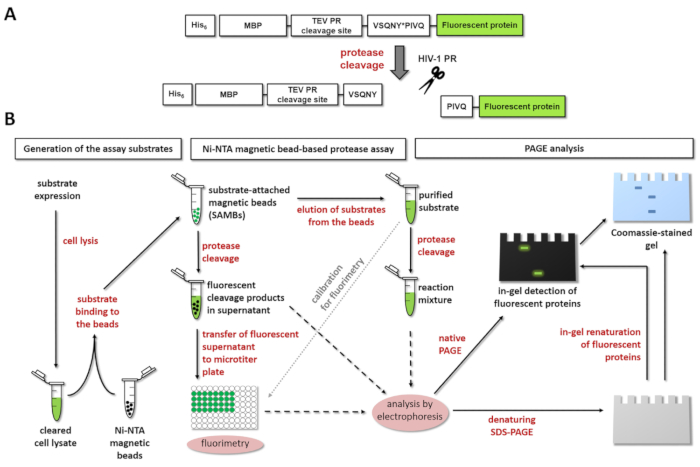
Figura 1: Principio de la prueba de la proteasa fluorescente. Proteasa (A) la representación esquemática de un sustrato fluorescente y su escote por el virus de inmunodeficiencia humana tipo 1 (VIH-1) se muestra. La flecha indica la posición de la hendidura dentro de la secuencia de sitio de clivaje de matriz/cápside de proteasa VIH-1 (VSQNY * PIVQ). (B) los fluorescentes substratos pueden utilizarse para analizar reacciones enzimáticas por el ensayo basado en grano magnético de Ni-NTA y por electroforesis en gel de poliacrilamida, así, como se muestra en el diagrama de flujo de trabajo. Haga clic aquí para ver una versión más grande de esta figura.
Aunque proteolíticos ensayos utilizando la proteína recombinante similar sustratos que contienen una etiqueta de afinidad, un sitio de clivaje proteolítico y un proteína fluorescente-tener ya se han descrito8,9,10, el sistema presentado aquí tiene la intención de integrar y mejorar las ventajas de estos métodos. Una diferencia importante es que los sustratos de la proteína de fusión en esta plataforma de análisis están equipados con MBP para mejorar la solubilidad de proteína13 y contienen un sitio de la hendidura de control para TEV PRs. Por otra parte, los sustratos contienen proteínas fluorescentes de nueva generación, que son muy estables y tienen una forma monomérica para prevenir la agregación de sustrato. Además de la aplicación previamente publicada de formas mTurquoise2 y arce-fusionados con14, aquí también mostramos resultados obtenidos con el uso de un sustrato recombinante que contiene un monómero mejorado etiqueta fluorescente de la proteína amarilla fluorescente (mEYFP). Por este medio nos demuestran la compatibilidad del sistema con otras proteínas fluorescentes y representan algunos tipos generales de resultados que pueden ser adquiridos por el ensayo de la proteasa.
Las proteínas de fusión recombinantes se expresan en células de e. coli BL21(DE3) y se utilizan como substratos para el ensayo en un ácido nitrilotriacético níquel (Ni-NTA)-cubierto de forma magnética agarosa-grano-conexión. Los productos de hendidura terminal C se liberan de la superficie del grano en el sobrenadante con escote por la proteasa de interés. Después de la separación del sobrenadante (que contiene la enzima y los productos de la hendidura) de las bolas magnéticas, la fluorescencia puede ser medida para determinar las propiedades de la hendidura de la enzima. En contraste con los métodos anteriormente descritos, en el sistema presentado aquí, las cantidades de sustrato y productos de hendidura terminal C son únicamente cuantificó basado en un procedimiento de calibración detallada del sustrato. El sistema de ensayo puede ser apoyado por un análisis de SDS-PAGE de las muestras de ensayo; una posterior visualización fluorescente de en gel puede ser aplicada inmediatamente después de la electroforesis o después de la renaturalización en gel de los componentes fluorescentes nondenatured y desnaturalizados, respectivamente14.
La flexibilidad y la estructura de la cinta' clonación' permite una inserción y costo-eficiente de una gran variedad de secuencias en la construcción y, por lo tanto, promueve la generación de bibliotecas de sustrato. Puesto que todos los pasos de análisis son automatización y HTS-compatible, el sistema puede ser especialmente atractivo para, por ejemplo, proteasa especificidad mediciones y estudios de mutagénesis o se puede también utilizar eficazmente para la detección de inhibidor de la proteasa industrial o desarrollo de drogas antivirales.
Parámetros cinéticos de la enzima (kcat, Km) pueden ser determinados por el análisis desarrollado basado en la separación; por lo tanto, puede ser conveniente llevar a cabo medidas cinéticas de la enzima individuales, tales como los estudios del curso del tiempo, dependiente del sustrato y la inhibición. Esto demuestra que los substratos de la proteína de fusión recombinante ofrecen buenas alternativas para los sustratos de oligopéptido sintético utilizado con frecuencia, y debido a su alta similitud a los sustratos de la poliproteína, que representan la natural las interacciones enzima-sustrato con mayor precisión.
Protocolo
1. generación de la plásmidos de expresión codificación de sustrato
- Alinear el plásmido de expresión pDest su6- MBP-FP por PacI y NheI endonucleases de la restricción. Para la generación de su pDest6- MBP-FP, ver Bozóki et al.14.
- Añadir 1.500-2.000 μg de plásmido de expresión pDest su6- MBP-FP, 2 μl de PacI y NheI endonucleases de la restricción, 10 μl de tampón de x 10 (véase Tabla de materiales) y agua libre de nucleasas (NFW) a 100 μL en un tubo de microcentrífuga.
- Incubar la mezcla de reacción a 37 ° C durante 1 hora.
- Añadir 20 μl de 6 x púrpura de ADN carga colorante a la mezcla de reacción y separar los productos de la hendidura por electroforesis, utilizando gel de agarosa al 1%. Aplicar una escalera de DNA de 1 kB como estándar.
- Enjuagar el gel durante 15 min en 20 mL de TAE buffer (40 mM Tris, ácido acético de 20 mM, 1 mM EDTA, pH 8,5) que contiene 20 μl de solución de verde de SYBR y suprimir la banda del plásmido linearizado del gel de agarosa, con una herramienta afilada.
Nota: Al iluminar el gel por un transiluminador azul oscuro-lectura (DRBT), plásmido linearizado pDest su6- MBP-FP aparece como una banda discreta y brillante en alrededor de 7-8 kB. - Purificar el plásmido de expresión linealizada de la rebanada de gel utilizando un kit de extracción de gel según las instrucciones del fabricante.
- Introduzca la secuencia de sustrato en el plásmido de expresión linealizada pDest su6- MBP-FP.
- Recuece el forward (FWD) y las inversas cartillas de oligonucleótidos codón-optimizado (REV) e. coli que codifica para la secuencia de sustrato de interés.
Nota: Los iniciadores recocidos se va flanqueados por los extremos cohesivos correspondiente a PacI y NheI sitios escote del endonuclease de la restricción (figura 2).- Mezcla 150 ng de plásmido de expresión linealizada con 200 ng de FWD y 200 ng de REV oligonucleótidos cebadores en una reacción en cadena de polimerasa (PCR) 0,2 mL del tubo y ajustan el volumen a 17 μl añadiendo NFW.
- Incubar la mezcla a 65 ° C por 2 min y, después, a 4 ° C durante al menos 2 minutos.
- Realizar la inserción de los cebadores recocidos en el plásmido linearizado por la ligadura.
- Añadir 2 μl de tampón de la ligasa de T4 (10 x) y 1 μl de T4 ligasa a la mezcla que contiene el plásmido lineal y los cebadores recocidos.
- Incubar la mezcla de la ligadura a 16 ° C por 16 h.
- Recuece el forward (FWD) y las inversas cartillas de oligonucleótidos codón-optimizado (REV) e. coli que codifica para la secuencia de sustrato de interés.

Figura 2 : Cartillas del oligonucleótido de codificación para un clivaje proteolítico del sitio secuencia. Cartillas de avance y retroceso codifican el VSQNY * secuencia de sitio de escote PIVQ de VIH-1 PR. Después de recocer los cebadores oligonucleótidos complementarios, el ADN de doble hebra corta contiene extremos pegajosos, correspondiente a la de PacI y NheI endonucleases de la restricción. Haga clic aquí para ver una versión más grande de esta figura.
- Transformar 100 μl de células competentes BL21(DE3) por 5 μl de mezcla de ligadura y propagación de las células en placas de agar caldo (LB) Lisogenia que contiene ampicilina.
Nota: Las proteínas fluorescentes será en el mismo marco de lectura abierto con los tags de fusión N-terminal solamente después de una ligadura acertada. Unos días después de la transformación, las colonias (que contiene el plásmido de expresión para el sitio de la hendidura insertado de interés) muestran fluorescencia visible con o incluso sin utilizar un DRBT. - Preparar el caldo glicerol de las colonias representadas.
- Lave una colonia discreta en un tubo de centrífuga de 50 mL que contiene 5 μl de medio LB con ampicilina (a una concentración final de 100 μg/mL).
- Incubar a 37 ° C durante 8 h agitando continuamente a 220 rpm; Luego, cosechar las células por centrifugación a 1.000 x g durante 5 min a temperatura ambiente.
- Suspender las células en 1 mL de solución de glicerol 80% (diluida con agua destilada) y agregar 500 μl de 10 mM MgCl2 solución a la suspensión.
- Transfiera la suspensión a un tubo de congelación y almacén las existencias a-70 ° C.
- Verificar la secuencia del plásmido generado por la secuencia de la DNA.
- Añadir 10 μl del stock de glicerol (preparado en el paso 1.7) a 5 mL de medio LB con ampicilina 100 de μg/mL en un tubo de centrífuga de 50 mL.
- Incubar la suspensión a 37 ° C por 16 h agitando continuamente a 220 rpm; Luego, cosechar las células por centrifugación a 2.000 x g por 10 min a 4 ° C.
- Aislamiento del plásmido de expresión pellets celulares por una miniprep de plásmido kit (véase Tabla de materiales) de acuerdo a las instrucciones del fabricante y use el plásmido purificado para secuenciación de ADN.
Nota: para la secuencia, 5'-GATGAAGCCCTGAAAGACGCGCAG-3' (adelante) y 5'-GCAAGGCGATTAAGTTGGGTAACGC-3' pueden utilizarse las cartillas del oligonucleótido (inversa).
2. expresión de los sustratos fluorescentes
- Preparar la cultura de arrancador.
- Añadir 10 μl del stock de glicerol (preparado en el paso 1.7) a 5 mL de medio LB con ampicilina 100 de μg/mL en un tubo de centrífuga de 50 mL.
- Incubar la suspensión a 37 ° C durante 15 h agitando continuamente a 220 rpm.
- Transferir el cultivo bacteriano (5 mL) en 50 mL de medio fresco de LB con ampicilina 100 de μg/mL en un matraz de Erlenmeyer estériles de 500 mL.
- Crecen las células a 37 ° C a una absorbancia de 0.6-0.8 en 600 nm longitud de onda, agitando continuamente a 220 rpm.
Nota: Si un tratamiento de tetraciclina debe ser aplicada en el paso 2.5, se recomienda no cultivar las células a una absorbancia de 0.6 más de a 600 nm. - Añadir isopropílico β-D-1-tiogalactopiranósido (IPTG) a la concentración final de 1 mM para inducir la expresión de la proteína.
- Si no se aplica un tratamiento de tetraciclina, incubar la cultura por 3 h a 37 º C agitando continuamente a 220 rpm y continuar el protocolo con paso 2.6. Si se aplica un tratamiento de tetraciclina, seguir el protocolo con medidas 2.5.1-2.5.3.
Nota: Algunos FPs producida por las células de e. coli pueden tener un tiempo de maduración (ver anterior)16,17; en estos casos, la traducción de la proteína puede ser opcionalmente arrestada por el tratamiento de tetraciclina, para aumentar la producción fluorescente de la solución sustrato.- Incubar la suspensión celular por 2 h a 37 º C agitando continuamente a 220 rpm; a continuación, agregar una solución de tetraciclina (a una concentración final de 200 μg/mL).
- Incubar el cultivo celular según el tiempo de maduración de la proteína fluorescente de elección a 37 ° C, agitando continuamente a 220 rpm.
- 2 x 25 ml de la cultura para limpiar tubos de centrífuga de 50 mL y cosechar las células por centrifugación a 4.000 x g durante 15 min a 4 ° C.
- Deseche el sobrenadante y almacenar los pellets de células bacterianas a-70 ° C durante al menos 1 h.
Nota: Las células que contienen los substratos fluorescentes expresados muestran fluorescencia visible con o incluso sin utilizar un DRBT.
3. interrupción de la célula
- Coloque el precipitado de células congeladas en hielo y se deja descongelar durante 15 minutos.
- Añadir 2 mL de tampón de lisis (50 mM NaH2PO4, 300 mM NaCl, 10 mM imidazol, 0,05% Tween 20, pH 8) para el sedimento y suspender las células.
- Añadir 10 μl de solución de inhibidor de proteasa recién preparada phenylmethanesulfonyl fluoruro (PMSF) (8,7 mg/mL, disuelto en etanol) a la suspensión.
- Añadir 2 mg de lisozima y 20 unidades de la ADNsa a la suspensión y suspenderlo.
- Incubar la suspensión en hielo por 15 min y de vórtice que de vez en cuando.
- Transferencia de 2 x 1 mL de la suspensión a tubos de microcentrífuga de 1,5 mL y someter a ultrasonidos las suspensiones por 3 min, en rondas de 10 s de sonicación y 5 s de descanso.
- Centrifugar los tubos a 10.000 x g por 20 min a temperatura ambiente; a continuación, retire con cuidado el sobrenadante fluorescente (lisado despejado célula bacteriana) de cada tubo y transferencia a nuevos tubos de microcentrífuga.
Nota: Despejados lisados que contiene el sustrato fluorescente presentan fluorescencia visible con o incluso sin utilizar un DRBT y pueden almacenarse a 4 ° C hasta por 2 semanas. NO lo congele. Lisados despejado pueden ser utilizado directamente para preparación de muestras en el análisis de la proteasa (ver sección 4.1) o también puede ser utilizado para la purificación del substrato (ver paso 4.5.1).
4. ensayo de proteasa basado en grano magnético Ni-NTA
Nota: Debido a la flexibilidad de la plataforma de análisis, se puede ser optimizado para diferentes tipos de estudios. Por esta razón y debido a la diferencia en la tasa de actividad de las enzimas de la elección, algunos de los parámetros de ensayo (que se denota) no se puede describir explícitamente pero necesitan ser optimizados para los objetivos individuales y diseño experimental. Como una dirección, se indican los parámetros de algunos tipos de estudios en lo particular.
- Preparación de la muestra
- Generación de bolas magnéticas adheridas a sustrato
- Coloque un cerrado 2 mL baja proteínas de unión (véase Tabla de materiales) tubo de microcentrífuga con nuevo o reciclado (ver sección 4.7) perlas de agarosa magnético de Ni-NTA en un concentrador de partículas magnéticas (MPC).
Nota: La cantidad de la suspensión aplicada grano debe ajustarse basándose en el diseño experimental. Se utilizó 1 mL de solución de grano magnético (5%, v/v) en cada experimento. - Granos pueden pegarse a la pared o en la tapa del tubo de microcentrífuga. por lo tanto, invierta el MPC en todas direcciones para asegurarse de que todos los granos son recogidos.
- Quite el sobrenadante y deséchelo.
- Lavar los granos de tampón de lisis.
- Añadir 1.8 mL de tampón de lisis a los granos y quitar el tubo cerrado del MPC.
- Suspender los granos en el tubo por sacudir o girar los tubos boca abajo hasta que la muestra esté completamente homogénea.
- Coloque el tubo en el MPC y gírelo boca abajo para recoger los granos.
- Abra el tubo y descarte el sobrenadante.
- Añada 1.0-1.8 mL del despejado lisado (preparado en el paso 3.7) a los granos y quitar el tubo del MPC.
- Invierta el tubo cerrado hasta que los granos son completamente homogéneos y giren lentamente el tubo por un agitador a temperatura ambiente durante 30 minutos.
- Coloque en el MPC y retire la célula despejada lisada de los granos y de la tapa.
Nota: La célula despejada lisada puede ser descartada o guarda para su uso posterior (véase la nota después del paso 3.7). - Agregar 1% Tween 20 (pH 7) para las bolas magnéticas sustrato Unido (SAMBs).
Nota: SAMBs muestran fluorescencia visible con o incluso sin utilizar un DRBT.
- Coloque un cerrado 2 mL baja proteínas de unión (véase Tabla de materiales) tubo de microcentrífuga con nuevo o reciclado (ver sección 4.7) perlas de agarosa magnético de Ni-NTA en un concentrador de partículas magnéticas (MPC).
- Lavado de las SAMBs
- Coloque el tubo con la suspensión SAMB en el MPC y descarte el sobrenadante.
- Lavar el SAMBs 3 x con cada tampón: i) 1.8 mL de 1% Tween 20 (pH 7); II) 1.8 mL de tampón de lavado (50 mM NaH2PO4, 300 mM de NaCl, 5 mM imidazol, 0,05% Tween 20, pH 7); III) 1.8 mL de tampón de escote (50 mM NaH2PO4, 300 mM de NaCl, 0,05% Tween 20, pH 7).
Nota: Para el procedimiento de lavado, consulte el paso 4.1.1.4. El búfer de hendidura puede cambiarse según las necesidades experimentales, pero se recomienda verificar el manual de las bolas magnéticas de Ni-NTA para determinar la compatibilidad.
- Preparación de la solución stock de SAMB
- Añadir un buffer de escote a las SAMBs lavados para crear una solución stock de SAMB.
Nota: Después de la adición del buffer, no sacuda o gire el tubo boca abajo. El volumen del buffer de escote depende del diseño experimental individual y debe ser calculado basado en el número de bolas magnéticas (ver paso 4.1.1.1) y en los volúmenes que se utilizará en el paso 4.1.4.2. Para tubos de 2 mL, el volumen aplicado es hasta 1.900 μl (ver tabla 1). La densidad de grano magnético recomendado de la solución madre de SAMB es 2-10% (v/v).Tipo de estudio Volumen de tampón de escote (μL) Medidas S-dependientes (Fig 4) 1600 Curso del tiempo las mediciones (Fig. 5A) 1600 Estudio de inhibición (Fig. 5B) 1900 estudio de dependencia de pH (Fig. 6) 1400
Tabla 1: Volumen del buffer de escote para preparar la solución madre de SAMB en los diferentes tipos de mediciones. - Retire el tubo cerrado del MPC. Utilice la solución SAMB inmediatamente o guardar a 4 ° C por 24 h.
- Añadir un buffer de escote a las SAMBs lavados para crear una solución stock de SAMB.
- Generación de las muestras de ensayo con la solución stock de SAMB
Nota: Los detalles de esta parte del ensayo están fuertemente dependientes en el diseño experimental (muestra tipos se muestran en la tabla 2).Tipo de muestra Notas Muestra de reacción (R) -utilizado para la evaluación de propiedades de escote
-contiene la enzima y el substrato en solución tampón de escoteMuestra en blanco del substrato (B) -utilizado para evaluar la disociación espontánea del sustrato (ver paso 4.6.2)
-contiene sólo el substrato en solución tampón de escoteEjemplo de control de sustrato (C) -para detemining la concentración de substrato (ver paso 4.6.3)
-contiene solamente el substrato en solución tampón de elución
Tabla 2: Tipos de muestras de la prueba de la proteasa basado en grano magnético de Ni-NTA.- Preparar 2 mL de los tubos de microcentrífuga de baja proteína de Unión para las muestras de ensayo.
Nota: Otra baja proteína vinculante mercancías plásticas puede también utilizarse. Utilice tubos de fondo redondo o plano para garantizar la libre circulación de SAMBs. Ver la cantidad recomendada de tubos en la tabla 3.Tipo de estudio R B C Medidas S-dependientes (Fig 4) 5 5 2 Curso del tiempo las mediciones (Fig. 5A) 6 6 2 Estudio de inhibición (Fig. 5B) 7 7 1 estudio de dependencia de pH (Fig. 6) 5 5 1
Tabla 3: Número de tubos de microcentrífuga requiere 2 mL para cada tipo de muestra en los estudios demostrados. - Suspender la solución SAMB hasta homogeneidad y transferir la cantidad de sustrato a analizar en las reacciones inmediatamente en los frascos de muestra. El volumen recomendado es de 25-300 μL, pero debe ser fijado según el diseño experimental individual (tabla 4).
Nota: Verifique si todos SAMBs han sido medidos en la parte inferior de los tubos. SAMBs puede pegarse a la pared del tubo, que puede distorsionar los resultados del ensayo. Si diferentes volúmenes van a ser medidos secuencialmente, empezar a tomar con el volumen más alto y tratar de minimizar el cambio de las pipetas o pipetas.Tipo de estudio R B C Medidas S-dependientes (Fig 4) 25 – 50 – 100 – 150 – 250 25 – 50 – 100 – 150 – 250 25 Curso del tiempo las mediciones (Fig. 5A) 25 25 25 Estudio de inhibición (Fig. 5B) 120 120 120 estudio de dependencia de pH (Fig. 6) 100 100 100
Tabla 4: Volumen de la solución SAMB medido en los frascos de muestra de cada tipo de muestra en los estudios demostrados. - Colocar los tubos de muestra que contiene la suspensión alícuotas de SAMB en el MPC y el MPC se desplazará ligeramente hacia adelante y hacia atrás.
- Con cuidado retire el sobrenadante de las SAMBs y deséchela.
- Retirar los tubos del MPC y agregar el volumen calculado de buffer de reacción (buffer [100 mM EDTA, 0,05% Tween 20, pH 7] del escote o elución) cuidadosamente a las SAMBs.
Nota: Calcular el volumen de tampón según el diseño experimental (tabla 5). Para tubos de 2 mL, el volumen final recomendado de la mezcla de reacción (el volumen del buffer de reacción para ser añadido en este paso + el volumen de la solución que se agregará en el paso 4.2.3) es 50-150 μL. Asegúrese de que todos los SAMBs se lavan en el búfer adicional. Tampón de elución se usa en lugar del búfer del escote en el caso de muestras de control (C) sustrato. Para un estudio de inhibición, el inhibidor de elección se recomienda añadir en este paso.Tipo de estudio Volumen del buffer de reacción (μL) Medidas S-dependientes (Fig 4) 68 μl de tampón de escote Curso del tiempo las mediciones (Fig. 5A) 68 μl de tampón de escote Estudio de inhibición (Fig. 5B) Banco de 67,3 μl de tampón de escote + inhibidor de 0,7 μl solución * estudio de dependencia de pH (Fig. 6) Escote de 69,5 μl tampón **
Tabla 5: volumen de tampón de reacción en los estudios demostrados. * Amprenavir fue solucionado en dimetilsulfóxido; soluciones stock de amprenavir (desde 1 nM a concentraciones de 1 μm) se aplicaron para estudio inhibitorio (ver figura 5B). ** El pH del buffer escote aplicada osciló entre pH 6.0-8.5. - Cerrar las tapas de los tubos. Ahora están listas para el análisis de las muestras.
Nota: Las muestras pueden almacenarse a 4 ° C por 24 h, pero el almacenamiento de información sólo es aplicable si la solución SAMB fue utilizada inmediatamente después de la preparación (ver paso 4.1.3.2).
- Preparar 2 mL de los tubos de microcentrífuga de baja proteína de Unión para las muestras de ensayo.
- Generación de bolas magnéticas adheridas a sustrato
- Iniciación de las reacciones proteolíticas
- Preparar la solución de enzima proteolítica según las necesidades experimentales.
Nota: Se recomienda utilizar un búfer de escote para disolver o diluir la enzima. Protocolos para tratamiento de VIH-114 y TEV PRs18 han sido publicados con anterioridad. - Establecer el termoagitador agitación velocidad (600 rpm) y temperatura de incubación (tabla 6).
Tipo de estudio Temperatura de incubación (º C) Medidas S-dependientes (Fig 4) 37 Curso del tiempo las mediciones (Fig. 5A) 37 Estudio de inhibición (Fig. 5B) 37 estudio de dependencia de pH (Fig. 6) 30
Tabla 6: temperaturas de incubación aplicadas en tipos de estudios diferentes. Para VIH-1, 37 ° C se recomienda, aunque 30 ° C se recomienda para TEV PR. - Añadir la solución de enzima a las muestras de reacción para inicializar las reacciones proteolíticas.
Nota: En el caso de sustrato en blanco (B) y muestras, añadir escote buffer (tampón de enzima) y tampón de elución, respectivamente. El volumen debe calcularse según las necesidades experimentales (Tabla 7). Para tubos de 2 mL, el volumen final recomendado de la mezcla de reacción (el volumen del buffer de reacción, agregado en el paso 4.1.4.5 + el volumen de la solución que se añadan en este paso) es de 50-150 μL.Tipo de estudio Volumen del enzima enzimático solución tampón/elución tampón (μL) Medidas S-dependientes (Fig 4) 2 Curso del tiempo las mediciones (Fig. 5A) 2 Estudio de inhibición (Fig. 5B) 2 estudio de dependencia de pH (Fig. 6) 0.5
Cuadro 7: Volumen del enzima enzimático solución tampón/elución buffer añadido durante la inicialización de las muestras de ensayo en el caso de los estudios demostradas. - Remover los granos con cuidado moviendo suavemente los tubos y colocar los tubos inmediatamente en el termoagitador ya temblando.
Nota: Terminación Manual de las muestras (ver sección 4.3) lleva más tiempo que la iniciación; por lo tanto, se recomienda un retraso registrado de al menos 2 minutos entre las iniciaciones de las reacciones. - Incubar las muestras según el diseño experimental (Tabla 8).
Tipo de estudio Tiempos de incubación (min) Medidas S-dependientes (Fig 4A) 7 Medidas S-dependientes (Fig 4B) 120 Curso del tiempo las mediciones (Fig. 5A) 0 – 2.5 – 5 – 10 – 15 – 20 Estudio de inhibición (Fig. 5B) 10 estudio de dependencia de pH (Fig. 6) 60
Tabla 8: Tiempos de incubación aplicados a las muestras de ensayo en las diferentes mediciones.
- Preparar la solución de enzima proteolítica según las necesidades experimentales.
- Terminación de las reacciones proteolíticas
- Sacar la muestra de la coctelera, 30 s antes de final de la incubación y girar rápidamente.
- Coloque el tubo en el MPC, dejar reposar durante 15 s, y el MPC se desplazará ligeramente hacia adelante y hacia atrás.
- Abra la tapa y transferir el sobrenadante cuidadosamente a una placa o un tubo nuevo.
Nota: No toque los granos concentrados con la punta de la pipeta. El sobrenadante recogido de muestras de C y R con un alto grado de hendidura puede mostrar fluorescencia visible con o sin la utilización de un DRBT.
- Detección fluorescente
- Transferencia de 2 x 30 μl de los sobrenadantes de muestras separadas a una microplaca de área mitad negro.
- Medida de la fluorescencia con los filtros adecuados de excitación y emisión.
Nota: Medir la fluorescencia básica de la hendidura tampón y tampón de elución. Necesidad de combinaciones de filtro a elegir basado en la proteína fluorescente medida (Tabla 9).Proteína fluorescente Filtros de excitación (nm) Filtros de emisión (nm) mTurqiouse2 355/40 460/25 mEYFP 544/15 590/10 mApple 544/15 590/10
Tabla 9: Filtros de excitación y emisión para detectar diferentes proteínas fluorescentes.
- Calibración
Nota: Para generar las curvas de calibración en paso 4.6.1, valores de intensidad de fluorescencia de escote o elución-tampón-resuelto sustratos purificados en diferentes concentraciones que deba medirse.- Purificar los sustratos fluorescentes.
Nota: Para purificación, SAMBs del sustrato en blanco (B) las muestras después de que se puede recoger el ensayo de proteasa o un nuevo SAMB suspensión puede también ser preparada (ver las secciones 4.1.1 y 4.1.2).- Colocar un tubo con SAMBs suspendidas en 1 mL de tampón de escote (2% - 10%; v/v) del MPC y recoger las bolas magnéticas girando el MPC al revés en cada dirección.
- Abra el tubo y retire el búfer del escote, tanto del tubo y la tapa.
- Quite el tubo del MPC y añadir 400-600 μl de tampón de elución a las SAMBs.
- Gire lentamente el tubo cerrado con un agitador a temperatura ambiente durante 5 minutos.
- Coloque el tubo en el MPC y recoger los granos girando el MPC al revés.
- Quite el sobrenadante que contiene el sustrato fluorescente intacto purificado (efluente) y transferir a un tubo nuevo de microcentrífuga de baja proteína de Unión.
Nota: Efluente muestra fluorescencia visible con o incluso sin utilizar un DRBT.
- Realizar cambio de buffer paralelo mediante dos dispositivos de ultrafiltración de 10K de 0.5 mL.
- Mida la mitad de volumen de eluido preparado (200-300 μL) en cada dispositivo de ultrafiltración.
- Después en cada paso de centrifugación, diluir el efluente concentrado en el primero y el segundo dispositivos de ultrafiltración por tampón de elución y búfer de escote, respectivamente.
- Después de la recuperación, ajustar las muestras concentradas en los buffers diferentes para el mismo volumen, entre 120-200 μl.
Nota: Ahora el contenido de proteína del sustrato tampón resuelto escote es idéntico al sustrato de resuelto de tampón de elución; por lo tanto, no es necesario determinar el contenido de éste en el paso 4.5.3, en proteínas si el método utilizado para medir la concentración de la proteína interfiere con EDTA.
- Determinar el contenido de proteína de los substratos disuelto en tampón de elución o escote midiendo la absorbancia a 280 nm.
Nota: Otros métodos (por ejemplo, Bradford o bicinchoninic ácido (BCA) ensayos) pueden usarse para medir la concentración de la proteína, pero la posible interferencia con EDTA (presente en el tampón de elución) o con la absorbancia del sustrato fluorescente debe ser considerado. El contenido de proteína inicial de la solución del sustrato para ser aplicado en paso 4.5.4 se recomienda entre 0.4-2.0 mg/mL con el fin de generar una calibración de la curva en un rango apropiado. Véase la tabla 10 para los coeficientes de extinción.Sustrato Peso molecular
(Da)Coeficiente de extinción
(M-1 cm-1, a 280 nm medido en agua)Su6- MBP-VSQNY * PIVQ-mTurquoise2 72101.7 96845 Su6- MBP-KARVL * AEAM-mTurquoise2 72042.7 95355 Su6- MBP-VSQNY * PIVQ-mEYFP 72367.1 94325 Su6- MBP-VSQNY * PIVQ-mApple 72145.9 105200
Tabla 10: pesos moleculares y los coeficientes de extinción de los substratos de la proteína de fusión fluorescente recombinante diferente. - Preparar una dilución seriada de doble en al menos ocho pasos tanto desde la elución, las soluciones de sustrato escote-tampón-resuelto, con elución o escote búfer para la dilución, respectivamente.
- Transferencia 30 μl de cada dilución punto a una microplaca de área mitad negro.
- Medida de la fluorescencia con un Fluorímetro, usando el ajuste aplicado en el paso 4.4.2.
Nota: Medir la fluorescencia básica de la división y el tampón de elución.
- Purificar los sustratos fluorescentes.
- Evaluación del ensayo
- Trazar las curvas de calibración.
- Calcular la concentración (en mM) de las soluciones de substrato purificado (utilizado en el paso 4.5.4), basada en el contenido en proteínas determinado en el paso 4.5.3.
- Corregir los valores de intensidad de fluorescencia relativa (RFU) de los puntos de dilución seriada de los valores básicos de la RFU del tampón de dilución aplicada (el buffer del escote o el tampón de elución).
- Parcela los valores corregidos de la RFU contra la concentración molar de los substratos purificados resuelto escote o con elución-almacenador intermediario y realizar una regresión lineal (fuerza de la intercepción a cero).
Nota: Un valor alto de R2 (˃0.97) indica una buena correlación lineal entre la fluorescencia y la concentración de la proteína fluorescente. En este caso, la pendiente de la recta de regresión puede utilizarse para evaluar la concentración de los componentes del ensayo en la gama examinado en pasos 4.6.2 y 4.6.3. Distribución de punto de datos y errores experimental puede afectar a la fiabilidad de la calibración; por lo tanto, una evaluación gráfica puede realizarse con la ayuda del zoom en gráficos (como se muestra en la figura 3), con el fin de comprobar si los valores de pendiente y R2 son influenciados por los datos.
- Calcular la cantidad de producto de escote fluorescente C-terminal en las muestras de la reacción.
- Corregir los valores de la RFU de cada muestra de R con los valores de la RFU de la muestra B correspondiente.
- Calcular la concentración de producto de escote (en mM) en las muestras de reacción, dividiendo la corregida valores RFU por la pendiente de la calibración de escote-basadas de la curva (ver paso 4.6.1.3).
- Calcular la concentración de sustrato aplicada en las muestras de la reacción.
- Corregir los valores de la RFU de la muestra de C con el valor de la RFU del tampón de elución básica.
- Calcular la concentración del sustrato eluída (en mM) en el sobrenadante de la muestra C dividiendo su corrección valores RFU por la pendiente de la calibración base de tampón de elución de la curva (ver paso 4.6.1.3).
- Determinar la concentración de sustrato (en mM) de la solución madre de SAMB que se utiliza para crear las muestras de ensayo en paso 4.1.4.2, basado en la siguiente ecuación:
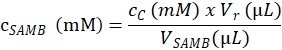
Aquí, cSAMB es la concentración molar de la solución madre de SAMB en sección 4.1.3; cC es la concentración molar del sustrato eluída de la muestra de C calculado en el paso 4.6.3.3; Vr es el volumen de la mezcla de reacción por la adición de la buffer de reacción en paso 4.1.4.5 y el buffer de la enzima en el paso 4.2.3.; y VSAMB es el volumen de la solución madre de SAMB en la muestra C (paso 4.1.4.2). - Calcular la concentración molar de los sustratos en cada muestra de R basada en la concentración molar de la SAMB solución (en mM) según el volumen (en μL) en cada tubo de muestras de reacción a paso 4.1.4.2.
- Realizar el procesamiento de datos.
Nota: El análisis de datos depende de la finalidad del experimento. El video muestra un ejemplo de procesamiento de datos de un estudio cinético dependiente del sustrato en PR de VIH-1 con su6- MBP-VSQNY * PIVQ-mTurquoise2 sustrato. Los valores de velocidad inicial se calculan el número de fragmentos de escote C-terminal y se trazan contra la concentración del substrato aplicado. Los parámetros cinéticos se determinan mediante un análisis de regresión no lineal de Michaelis-Menten.
- Trazar las curvas de calibración.
- Reciclaje de las bolas magnéticas
Nota: Después de realizar un ensayo, las perlas de agarosa magnético pueden ser recogidas y recicladas.- Recoger las bolas magnéticas usadas con el MPC y descarte el sobrenadante.
- Lavar los granos con 1,8 mL de los siguientes topes, en el orden dado: búfer de regeneración A (0.05% Tween 20, 0.5 M NaOH), búfer de regeneración B (0.05% Tween 20), búfer de regeneración C (0,05% Tween 20, 100 mM EDTA, pH 8), regeneración tampón B, (regeneración) buffer D 0,05% Tween 20, NiSO4de 100 mM, pH 8), regeneración tampón B y el búfer de regeneración E (0,5% de Tween 20, 30% etanol, pH 7).
Nota: Para el procedimiento de lavado, consulte el paso 4.1.1.4.
- Lavar los granos con 1,8 mL de los siguientes topes, en el orden dado: búfer de regeneración A (0.05% Tween 20, 0.5 M NaOH), búfer de regeneración B (0.05% Tween 20), búfer de regeneración C (0,05% Tween 20, 100 mM EDTA, pH 8), regeneración tampón B, (regeneración) buffer D 0,05% Tween 20, NiSO4de 100 mM, pH 8), regeneración tampón B y el búfer de regeneración E (0,5% de Tween 20, 30% etanol, pH 7).
- Almacenar los granos reciclados en búfer de regeneración E a 4 ° C.
- Recoger las bolas magnéticas usadas con el MPC y descarte el sobrenadante.
5. Análisis de la página
-
Preparación de la muestra
Nota: Después de realizar el ensayo basado en grano magnético de Ni-NTA, los sobrenadantes de ensayo pueden ser analizados por la página. En este caso, omita los pasos 5.1.1 y 5.1.2. Sin embargo, también es posible analizar la solución purificada sustratos fluorescentes o sus fragmentos escote después de la solución en la digestión con la proteasa de interés. En este caso, seguir el protocolo con el paso 5.1.1.- Preparar la solución de sustrato fluorescente purificado según paso 4.5.1.
- Llevar a cabo la digestión en solución.
- Cambio de tampón de elución con tampón de escote en el dispositivo de ultrafiltración de 10K de 0.5 mL y alícuota las muestras a ser digerido en tubos de microcentrífuga de 1,5 mL.
Nota: para el análisis de la página, tenemos alícuotas 68 μl de cada sustrato, pero el número de tubos de muestras y el volumen de solución de substrato que alícuotas pueden ser optimizados según el diseño experimental. - Añadir la solución de enzima a las muestras.
Nota: Para el análisis de la página, se aplicaron 2 μl de VIH-1, preparado según lo descrito por Bozóki et al14, pero el volumen se puede optimizar según el diseño experimental. Se recomienda utilizar tampón escote para disolver o diluir la enzima. - Incubar las muestras según el diseño experimental.
Nota: Para el análisis de la página, incubó la mezcla de reacción durante 45 min a 37 ° C, pero el tiempo de incubación y temperatura tienen que ajustarse según el diseño experimental. - Terminar la reacción realizando paso 5.1.3.
- Cambio de tampón de elución con tampón de escote en el dispositivo de ultrafiltración de 10K de 0.5 mL y alícuota las muestras a ser digerido en tubos de microcentrífuga de 1,5 mL.
- Preparar la muestra para la página.
Nota: Las muestras que contienen el sustrato fluorescente se pueden preparar para la página por un nondenaturing o un método de desnaturalización. Para el uso de condiciones nondenaturing o desnaturalización, siga el paso 5.1.3.1 o 5.1.3.2, respectivamente.- Preparar una muestra de nondenatured: mezclar 30 μl de la muestra con 6 μl de 6 x nondenaturing tampón de muestra de carga (300 mM de Tris, glicerol al 20%, 0.05% azul de bromofenol pH 6.8).
- Preparar una muestra desnaturalizada: mezclar 30 μl de la muestra con 6 μl de 6 x desnaturalización muestra carga buffer (300 mM Tris, glicerol al 20%, 0.05% bromofenol azul, 12% SDS, 100 mM β-mercaptoetanol, pH 6.8) y calentar las muestras a 95 ° C durante 10 minutos.
-
Análisis de SDS-PAGE
Nota: Opcionalmente, si sólo muestras nondenatured (preparado en paso 5.1.3.1) deben ser analizadas, una página nativa puede realizarse también. En este caso, sáltese la sección 5.3.- Preparar un gel de SDS-poliacrilamida (uso 14% separador y 4% gel de apilamiento) y llenar el tanque con el tampón de electroforesis (2,5 mM de Tris, glicina de 19,2 mM, 0.01% SDS).
- Añadir las muestras (preparadas en el paso 5.1.3.1 o 5.1.3.2) en los pocillos de un gel de poliacrilamida y realizar la electroforesis a 120 V de tensión.
- Retire el cartucho de gel desde el módulo de ejecución y coloque el gel en un tanque de lavado.
Nota: Las muestras Nondenatured ya son visibles en el gel, incluso por el ojo desnudo o con un DRBT.
-
En gel de renaturalización y la detección de proteínas fluorescentes
Nota: Para detectar las proteínas fluorescentes en muestras desnaturalizadas (preparadas en el paso 5.1.3.2) en el DRBT, SDS debe ser lavado fuera del gel, que parcialmente renature de las proteínas.- Añadir ~ 100 mL de agua destilada al gel y enjuague el gel por lo menos durante 30 minutos.
Nota: Para mejorar la eliminación de la SDS, reemplace el agua cada 10 minutos y enjuague hasta 60 min. - Visualizar las proteínas fluorescentes mediante una DRBT, o proyección de imagen de rayos UV.
- Añadir ~ 100 mL de agua destilada al gel y enjuague el gel por lo menos durante 30 minutos.
-
Tinción de Coomassie convencional del gel
- Tinción del gel con azul brillante de Coomassie tinte para visualizar proteínas nonfluorescent.
Resultados
Figura 1A se muestra la estructura esquemática de un sustrato de proteína recombinante fluorescente representativos que puede ser procesado por VIH-1 PR en su secuencia de sitio específico escote. Figura 1B representa la producción de sustrato y sus posibles aplicaciones en el análisis de la proteasa, incluyendo análisis basado en grano magnético de Ni-NTA o página.
Para obtener datos fiables por fluorimetría, un procedimiento de calibración se requiere, con el fin de determinar las cantidades de substratos fluorescentes y productos de escote. Para ello, los valores de intensidad de fluorescencia de los distintos sustratos en las condiciones de amortiguamiento diferentes necesitan ser medido y deban ser correlacionados a sus concentraciones en el intervalo de concentraciones ensayado (figura 3). Los valores de la pendiente de las curvas de calibración pueden aplicarse para determinar las cantidades de substratos y productos de escote en las muestras de ensayo. Las pendientes de las curvas de calibración son independientes de las secuencias del sitio de escote insertadas en los sustratos (tabla 11) y pueden potencialmente ser utilizadas para una serie de sustratos sobre el mismo tipo de proteína fluorescente. Zoom en los gráficos se muestran para que todos regresiones lineales, para ampliar las gamas más bajas de concentración así (figura 3). Es importante tener en cuenta que la calibración debe realizarse con cuidado ya que una adecuada distribución de los puntos de datos se requiere para una calibración confiable. Por esta razón, se aplica la doble dilución seriada para preparar las muestras para la calibración, porque el valor de R2 indica una buena correlación entre la concentración de proteína fluorescente y fluorescencia sólo si un número suficiente de puntos de datos se han utilizado para cubrir el rango de toda concentración. Además, los errores experimentales altamente pueden afectar la precisión de la calibración; por lo tanto, una evaluación gráfica de las líneas de regresión puede ser también necesaria.
Una variedad de mediciones enzimáticas puede realizarse por el análisis de la proteasa, incluyendo un examen del efecto de la concentración de sustrato sobre la velocidad de reacción (Figura 4A). Por regresión no lineal, los datos pueden ser utilizados para determinar parámetros cinéticos de la enzima (por ejemplo, vmax y Km). Una suspensión suficiente grano y dispersión y una terminación inadecuada reacción pueden provocar resultados subóptimos (Figura 4B), que no son adecuados para el cálculo de valores cinéticos de la enzima confiable.
Una dependencia de la formación del producto a tiempo puede determinarse por el análisis (figura 5A) (por ejemplo, durante la optimización de los parámetros de reacción de hendidura). La actividad enzimática en presencia de un inhibidor puede ser también investigados (figura 5B) para la determinación de la concentración de enzima activa y constante de inhibición. Utilizando la misma metodología, efectos de otros inhibidores de también pueden ser examinados por el análisis.
El ensayo de proteasa es útil al investigar los efectos del pH sobre la actividad enzimática, así. Figura 6A representa la dependencia de la actividad enzimática de pH por el ejemplo de la TEV, que tiene un pH óptimo amplio rango (pH 6-9). Si se estudia la dependencia del pH de la actividad de la enzima o enzimas con un grado óptimo pH ácido necesitan para medirse, es necesario considerar que la afinidad de unión de sustratos recombinantes a los granos puede estar restringida a un pH ligeramente ácido. Una elevada disociación de los substratos de los granos (Figura 6B) puede provocar una distorsión de los resultados del ensayo. Para considerar la disociación espontánea del substrato de los granos, los valores medidos para las muestras de reacción necesitan ser corregido por los de las muestras de B.
La figura 7 muestra que las proteínas fluorescentes nondenatured pueden ser distinguidas del gel basado en sus colores, con transiluminación luz azul (Figura 7A). Si es necesaria la determinación de los pesos moleculares de los fragmentos de sustratos/escote, desnaturalizar condiciones puede usarse para la preparación de la muestra, debido a proteínas fluorescentes pueden ser parcialmente renatured en el gel y pueden ser detectadas por iluminación UV (Figura 7B) o Coomassie tinción (figura 7). Si se analizan las muestras de R, solamente los productos de la hendidura del c-terminal son visibles (figura 7), mientras que los fragmentos de hendidura de la N-terminal y los sustratos uncleaved permanecen adheridos a los granos. En ocasiones, las proteínas pueden desnaturalizarse parcialmente a pesar de utilizar condiciones nondenaturing (figura 7), y mientras que las proteínas nondenatured son más abundantes, formas desnaturalizadas también detectables en la muestra. Este fenómeno no influye en la detección de clivaje proteolítico pero debe considerarse en el caso de densitometría cuantitativa de muestras nondenatured.
Aunque la descripción detallada se muestra solamente para un ensayo 2 mL tubo-basados, el ensayo puede ser adaptado para un 96 pocillos placa de sistema (figura 8), que ya ha sido probado con éxito en nuestro laboratorio (no mostrado). El formato adaptado de placa de 96 pocillos es totalmente compatible con el fluorimétrico y análisis electroforéticos, así, y también pueden evaluar los datos obtenidos basados en los métodos descritos en este documento.
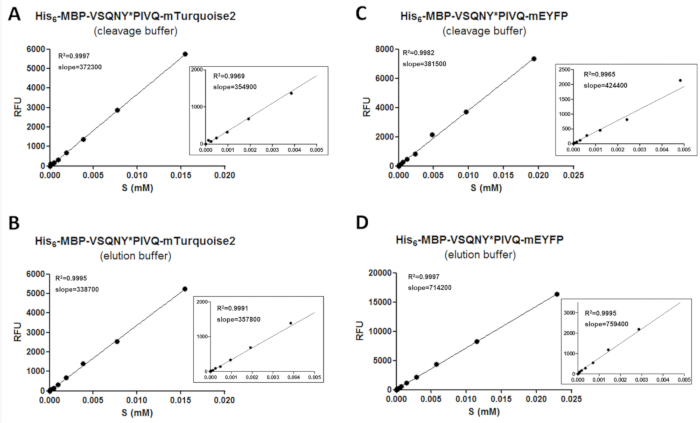
Figura 3 : Curvas de calibración. Curvas de calibración de sustrato representativo se demuestran con el ejemplo de dos sustratos recombinantes fusionado a diferentes etiquetas fluorescentes C-terminal: (A y B) su6- MBP-VSQNY * PIVQ-mTurquoise2 y (C y D de ) Su6- MBP-VSQNY * PIVQ-mEYFP. Zoom en figuras también aparecen para representar la regresión lineal de los puntos de datos en el 0.005 0 rango de concentración de sustrato de mM. Haga clic aquí para ver una versión más grande de esta figura.
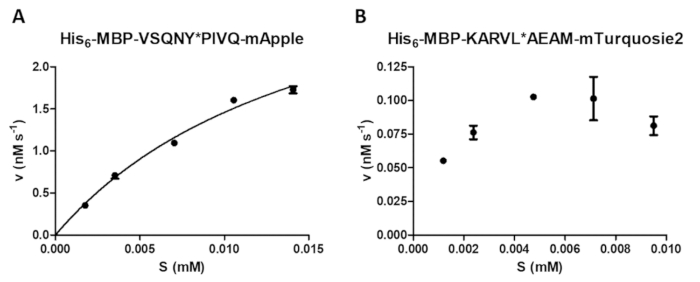
Figura 4 : Determinación de parámetros cinéticos de la enzima. Se realizaron medidas cinéticas dependiente del sustrato por VIH-1 PR (en una concentración final activa de 41,2 nM). Los valores de velocidad inicial se traza contra la concentración del substrato y se realizó un análisis de regresión no lineal de Michaelis-Menten. Las barras de error representan SD (n = 2). (A) A un resultado óptimo representante se muestra con el ejemplo de su6- MBP-VSQNY * PIVQ-mApple sustrato de proteína de fusión. (B) un representante resultado subóptimo se muestra también su6- MBP-KARVL * sustrato AEAM-mTurquoise2, donde el ajuste de concentraciones de sustrato adecuado era problemático debido a una insuficiente homogeneización de la solución madre de SAMB , mientras que los errores relativamente altos fueron causados por la terminación de la reacción incorrecta. Haga clic aquí para ver una versión más grande de esta figura.
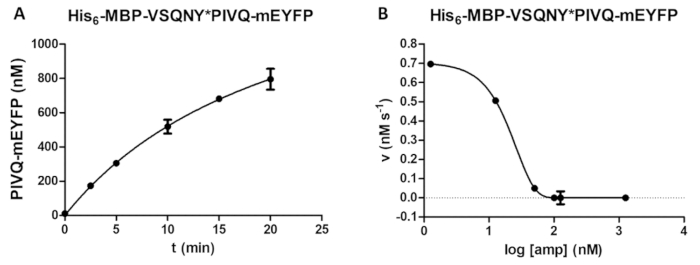
Figura 5 : Estudio curso del tiempo e inhibitorio. (A) Su 6- MBP-VSQNY * PIVQ-mEYFP sustrato de proteína de fusión recombinante (a una concentración final de 0,00326 mM) fue dividido por el VIH-1 PR (en una concentración final activa de 41,2 nM), y la liberación de fragmentos proteolíticos de fluorescente PIVQ-mEYFP se midió a realizar un análisis del curso del tiempo. Las mediciones se llevaron a cabo en cinco diferentes puntos temporales. Las barras de error representan SD (n = 2). (B) su6- MBP-VSQNY * PIVQ-mEYFP se utilizó como sustrato (a 0,0015 mM) para determinar el efecto inhibitorio de amprenavir en la actividad del VIH-1 PR (en una concentración total de 163.8 nM). Por trazado podrían evaluarse los datos, la media máxima concentración inhibitoria (IC50) y la concentración de enzima activa (una concentración activa final de 41,2 nM) de los VIH-1 aplicada podría también calcularse en base a la curva de inhibición. Las barras de error representan SD (n = 3). Haga clic aquí para ver una versión más grande de esta figura.
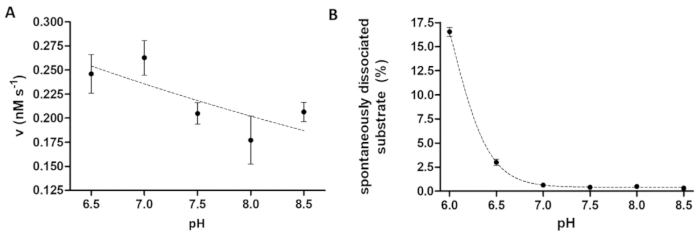
Figura 6 : Estudio de dependencia de la actividad enzimática y la disociación espontánea del sustrato en pH. (A) el su6- MBP-VSQNY * PIVQ mTurquoise2 sustrato (0,033 mM) se utilizó para medir la actividad enzimática de la TEV (en una concentración total final de 91.42 nM) en escote buffer a un pH diferente, entre el rango de 6.5-8.5. Las barras de error representan SD (n = 2). Los datos trazados ha sido publicado previamente14. (B) basada en los valores de intensidad fluorescente relativa de las muestras en blanco del substrato, la disociación espontánea de su6- MBP-VSQNY * PIVQ mTurquoise2 sustrato (0,033 mM) de las bolas magnéticas se estudió utilizando buffer de escote con un pH diferente, entre 6.0-8.5. Los datos trazados ha sido publicado previamente14. Haga clic aquí para ver una versión más grande de esta figura.
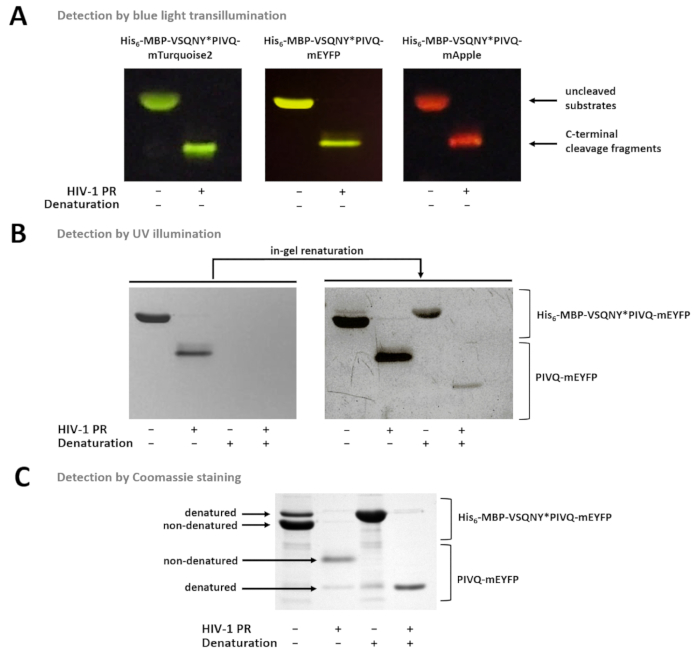
Figura 7 : Detección de proteínas en el gel por métodos diferentes. (A) Uncleaved y sustratos de proteína de fusión de VIH-1 PR-digerido después de la preparación de la muestra nondenaturing se visualizaron por transiluminación luz azul después de SDS-PAGE. La reacción de hendidura fue realizada por solución en la digestión. (B) inmediatamente después de la página, sólo nondenatured proteínas se podían detectar en el gel por iluminación UV, mientras que después del retiro de la SDS, las proteínas fluorescentes previamente desnaturalizadas se convirtieron parcialmente renatured y perceptibles. Las muestras se prepararon de los sobrenadantes del ensayo basado en grano magnético Ni-NTA. (C) tinción de Coomassie puede emplearse para la detección de la proteína, después de la renaturalización en gel. El SDS-presente en el gel-mayo causan la desnaturalización parcial de la proteína nativa, pero en muestras de nativas, las formas nondenatured son más abundantes. Las muestras se prepararon de los sobrenadantes del ensayo basado en grano magnético Ni-NTA. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8 : 96 pocillos placa-adaptación de la plataforma de análisis. (A) el ensayo puede realizarse no sólo en tubos de 2 mL pero en los pocillos de una placa de 96 pocillos, así. A continuación os mostramos la representación esquemática para la aplicación del análisis estudiar la especificidad de una proteasa ficticia utilizando una serie de sustratos fluorescentes, que pueden contener wild-type (wt) o transformada (mut-1 a mut-4) secuencias del sitio de clivaje. Para el manejo de las bolas magnéticas, un concentrador de partículas magnéticas compatible de 96 pocillos (MPC) debe ser utilizado en los experimentos. Todos los volúmenes indicados están relacionados con un solo pozo. Para comparar la eficacia de la hendidura de los distintos sustratos, conversión de sustrato puede evaluarse desde el porcentaje de valores RFU sustrato-corregida de las muestras de reacción, teniendo en cuenta los valores RFU sustrato-corregida de los correspondientes muestras de control de sustrato como 100. (B) después de fluorimetría, los sobrenadantes separados del ensayo las muestras pueden analizarse también por página y los componentes de proteína fluorescente pueden ser analizadas directamente o después de la renaturalización de la gel-en el caso de nondenaturing y desnaturalización de la muestra preparación, respectivamente. También se ilustran los tres tipos de muestra de ensayo diferentes en cada figura: C = sustrato control, B = sustrato en blanco y R = reacción. Sustrato control muestras en tampón de elución, mientras que el substrato blanco y las muestras de reacción son en tampón de escote. Haga clic aquí para ver una versión más grande de esta figura.
| Tampón de | Proteína fluorescente | CV % de pendientes (%) |
| Elución | mTurquoise2 | 6.04 |
| Escote | 9.11 | |
| Elución | mApple | 10,92 |
| Escote | 12,68 |
Cuadro 11: coeficiente de valores de variación (CV %) de las pendientes de las curvas de calibración de substrato. Para probar si la fluorescencia de los substratos de la proteína recombinante es dependiente en el sitio de clivaje insertado, calibraciones fueron realizadas por serie de mApple y mTurquoise2-fusionados con sustratos (seis variantes para cada uno, que contiene el sitio de la hendidura diferentes secuencias de proteasa VIH-1), ambos en tampones de elución y escote. Se encontró que valores de % CV de las laderas son menos 15% en todos los casos, lo que implica que una calibración del mismo sustrato puede utilizarse para la evaluación de las diferentes mediciones realizadas por variantes del sustrato que contiene la misma etiqueta fluorescente.
Discusión
Debido a las investigaciones industriales y académicas intensivas de enzimas proteolíticas y la constante demanda de plataformas de ensayo de proteasa de HTS-compatible de rápida y asequible en consecuencia, hemos desarrollado una proteasa fluorescente basado en grano magnético ensayo. El ensayo se basa en el uso de proteínas de fusión recombinantes que pueden ser nuevas alternativas a los sustratos ampliamente utilizado péptidos sintéticos.
En el formato de ensayo desarrollado, los substratos de la proteína de fusión se inmovilizan a las superficies de agarosa magnético recubierto de quelato Ni granos. La fijación del sustrato es proporcionada por la N-terminal su etiqueta de afinidad6 de la proteína de fusión, que está unida directamente a una etiqueta MBP para facilitar el plegado y mejorar la solubilidad en agua del sustrato13. La MBP es seguido por el escote de TEV PR y una proteasa de interés. El primero puede servir como un sitio de la hendidura de control en el ensayo, mientras que estos últimos pueden ser procesados por la proteasa para ser investigado. El sitio de la hendidura es intercambiable; una codificación de secuencia corta dsDNA en el sitio de clivaje de interés puede insertarse en el 'clonación casete flexible' del plásmido de expresión por la ligadura. Las proteínas de fusión recombinantes contienen una etiqueta altamente estable, monomérico proteína fluorescente en la terminal C, que permite la detección del punto final de las enzima liberada, fluorescentes C-terminal escote productos lanzados sobre clivaje proteolítico ( Figura 1A). Los sustratos intactos fluorescentes purificados en buffers diferentes también se utilizan para la calibración para evaluar las concentraciones molares de sustratos y productos de escote. Además, después de la fluorimetría, los componentes del ensayo pueden ser analizados por SDS-PAGE, también. Ambos nativos (nondenatured) y desnaturalizadas proteínas fluorescentes se pueden visualizar en el gel, inmediatamente después de la electroforesis o posterior renaturalización en gel, respectivamente. Este adicional procedimiento en combinación con un convencional azul brillante de Coomassie de tinción puede ser utilizado eficientemente para la verificación de los resultados del ensayo (figura 1B).
El procedimiento del ensayo consiste en pasos simples y fáciles de ejecutar en un formato de bajo volumen que puede ser totalmente adaptado a un entorno automático de alto rendimiento. Sin embargo, independientemente de la realización del análisis ya sea manualmente o con un sistema de automatización, las siguientes partes del ensayo se consideran crucial y necesitan una atención especial al realizar el procedimiento. i) homogeneidad de la solución grano magnético. Una solución homogénea de grano magnético debe utilizarse durante todo el ensayo, tanto en la purificación y pasos de lavado. Particularmente, la fiabilidad de los ensayos de proteasa depende en tomar correctamente las soluciones stock de grano magnético sustrato Unido (SAMB). Con el fin de aumentar la eficacia de la suspensión y dispersión, se recomienda establecer la concentración de grano entre 2% y 10% (v/v). Durante la preparación de la muestra, el uso de buffers complementados con detergente no iónico (como Tritón X-100 o Tween 20) hasta el 2% también puede disminuir la adherencia de las bolas magnéticas a las superficies de plástico. La adherencia de los granos a las paredes de las cubetas puede evitarse si las suspensiones de grano se aplican cuidadosamente a la parte inferior de los frascos en lugar de en las paredes de los tubos de muestra. La homogeneidad de las bolas magnéticas durante la reacción enzimática también es crítica y puede garantizarse agitando continuamente las muestras a 600 rpm durante la incubación. Granos correctamente se dispersan en mercancías plásticas redondeadas o fondo plano, aunque no se recomienda el uso de viales V-fondo. Un resultado subóptimo causado por la homogeneización inadecuada del grano está representado en la Figura 4B. II) terminación de las muestras de la reacción. Otra ventaja del método es que la reacción enzimática puede ser terminada sin el uso de tratamiento de la desnaturalización de calor o cualquier potencialmente interferentes químicos15. La terminación puede realizarse simplemente separando las bolas magnéticas de la mezcla de reacción, utilizando un concentrador de partículas magnéticas convencionales. Mientras que el buffer de reacción quitado contiene la enzima activa y los productos generados de escote fluorescente C-terminal, los sustratos uncleaved permanecen adheridos a los granos. Debido a la presencia de la enzima activa en el buffer de reacción, el procedimiento de separación debe realizarse cuidadosamente para la detección del punto final confiable. Antes de colocar los frascos de muestra en el concentrador, se recomienda aplicar un centrifugado Centrifugado corto. Después de colocar los tubos en el concentrador, proporcionar por lo menos 15 s para los granos a recogerse. Leve movimiento de atrás y el separador puede facilitar la recolección de los granos. Por favor tener en cuenta que, durante una separación realizada manualmente, la terminación generalmente toma más tiempo que la iniciación de las reacciones. Por lo tanto, un retraso de minutos registrados aproximadamente 2 se recomienda entre las iniciaciones si al mismo tiempo de incubación debe ser aplicado a todas las muestras.
El principio del ensayo descrito proteolítico es relativamente simple; sin embargo, la versatilidad del sistema está garantizada por la estructura del sustrato flexible y estable. La optimización individual del ensayo puede ser limitada sólo por la compatibilidad de los granos de afinidad con las condiciones aplicadas, reactivos y aditivos. De acuerdo con el protocolo del fabricante, también se encontró que la afinidad de unión de los sustratos a las superficies de grano Ni-NTA sustancialmente debilita a pH ≤ 6.515. Por lo tanto, se recomienda aplicar las muestras en blanco de sustrato paralelas a las muestras de reacción y la tasa de disociación espontánea sustrato debe considerarse durante la evaluación de resultados.
En esos casos, donde no se puede realizar ensayos magnéticos del grano debido a la utilización de componentes de grano-incompatible o un pH bajo, puede aplicarse también en la solución digestión de los sustratos recombinantes purificadas. En estos casos, las mezclas de reacción pueden ser analizadas por electroforesis y se pueden visualizar las proteínas en el gel basado en el protocolo descrito. Para investigar actividad proteolítica, digestión en solución y en gel-detección de las proteínas también pueden ser herramientas alternativas de fluorimetría. Como novedad, el sistema de sustrato diseñado es la aplicación de un paso de renaturalización en gel después de desnaturalizantes SDS-PAGE. Mientras que las proteínas nativas de fluorescentes (nondenatured) su fluorescencia durante la electroforesis, se suprime la propiedad fluorescente sobre desnaturalización (figura 7B). Sin embargo, la fluorescencia de proteínas desnaturalizadas puede recuperarse parcialmente por la eliminación de la SDS del gel. Así, una separación de componentes de la reacción usando condiciones de desnaturalización permite no sólo basada en la fluorescencia pero la identificación molecular basada en el peso. Otra ventaja de la detección en gel fluorescente en comparación con el análisis de un gel teñido de Coomassie es que las proteínas fluorescentes (nativo o renatured) pueden ser fácilmente identificadas en el gel basado en su fluorescencia (ver figura 7). Esto puede ser importante si se realizan reacciones de escote en las muestras que contienen contaminantes nonfluorescent o proteínas muy parecidas a los pesos moleculares de cada uno.
Proteasa ensayos utilizando semejantemente diseñados sustratos ya han sido publicados con anterioridad8,9,10, y aunque el sitio de la hendidura de interés en esos casos también se encuentra entre una etiqueta de afinidad y un proteína fluorescente, el sistema de análisis presentado aquí no sólo repite las ideas descritas pero combina las distintas ventajas de las plataformas anteriores y también se completa con otras mejoras: i) la utilización de un socio de fusión MBP, ii) el presencia de un sitio de la hendidura de TEV PR control, iii) el uso de la nueva ingeniería FPs monomérica y iv) la aplicación de un procedimiento de calibración de sustrato único. El ensayo sí mismo fue diseñado especialmente para ser útil para la especificidad de la enzima y estudios cinéticos en un lugar seguro, forma y costo-eficiente, sin necesidad de instrumental costoso. El método pretende ser una herramienta conveniente y asequible para ambos propósitos de investigación académica e industrial. Debido a la flexibilidad de la cassette de clonación del plásmido de expresión, el sistema puede ser adecuado para la generación rápida y barata de bibliotecas sustrato recombinante. El ensayo descrito en el presente documento es una herramienta factible para la aplicación de la especificidad de sustrato, mutagénesis de la enzima, y la inhibición de estudios y, también, proporcionar una herramienta alternativa para realizar la cinética de la enzima. La plataforma de ensayo (de la interrupción de la célula bacteriana a la determinación de los parámetros cinéticos) puede ser adaptada a un entorno basado en HTS y automatización y, potencialmente, puede aplicarse en la detección de inhibidor de la proteasa industrial o antivirales desarrollo. Además, la adaptación del ensayo de proteólisis competitivo es también en el futuro alcance de nuestro laboratorio. En un ensayo competitivo dos diferentes sustratos, cada uno que contiene un sitio de la hendidura diferentes fundido a un diferente terminal C fluorescente etiqueta-están destinado a ser utilizados simultáneamente en la misma reacción de hendidura para investigar la preferencia de los estudiados enzima para las secuencias de dada. Además, el uso de una forma de análisis adaptado de placa de 96 pocillos (figura 8) también está siendo optimizado para investigación de la mutación usando una serie de sustratos con secuencias del sitio de escote modificado en el caso de las proteasas de cisteína.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado en parte por el proyecto de "Equipo PHARMPROT" GINOP-2.3.2-15-2016-00044 y, también, financiado por el programa de excelencia institucional de educación superior del Ministerio de capacidades humanas en Hungría, en el marco de la Programa temático de biotecnología de la Universidad de Debrecen. Los autores agradecemos a los miembros del laboratorio de bioquímica Retroviral por su ayuda científica durante el desarrollo del ensayo y también por su paciencia durante el ensayo (especialmente a Norbert Kassay, Krisztina Joóné Matúz y Vanda Toldi, la película que aparecen en el fondo del vídeo). Los autores también desean decir especial gracias a Gedeon Richter Plc., especialmente al Dr. Zoltán Urbányi para permitir el trabajo de Beáta Bozóki en el Departamento de Bioquímica y Biología Molecular como investigador invitado. Los autores también desean extender su agradecimiento a György Zsadányi, Balázs Tőgyi, Balázs Pöstényi y Zoltán Király de la Multimedia y el centro técnico de E-learning de la Universidad de Debrecen la asistencia profesional en audio y video producción.
Materiales
| Name | Company | Catalog Number | Comments |
| 10K Amicon tubes | Merck-Millipore | UFC501096 | |
| 2-Mercaptoethanol (β-ME) | Sigma-Aldrich (St Louis, MO, USA) | M6250 | |
| 40% Acrylamide/Bis solution 37.5:1 | Bio-Rad | 1610148 | |
| Acetic acid | Merck | 100063 | |
| Agarose | SERVA | 11404.04 | |
| Alpha Imager HP gel documentation system | ProteinSimple | ||
| Ammonium persulfate (APS) | Sigma-Aldrich (St Louis, MO, USA) | A3678 | |
| Ampicillin sodium salt | Sigma-Aldrich (St Louis, MO, USA) | A9518 | |
| Beckman Coulter Allegra X-22 centrifuge | Beckman Coulter | 392185 | |
| Black half-area plates | Greiner bio-One | 675086 | |
| Bromophenol blue | Sigma-Aldrich (St Louis, MO, USA) | B0126 | |
| CutSmart buffer (10x) | New England Biolabs | B7204S | For plasmid linearization (step 1.1.1) |
| Dark Reader transilluminator | Clare Chemical Research | DR-45M | |
| DNase I | New England Biolabs | M0303L | |
| Dynamag-2 magnetic particle concentrator | Thermo Fischer Scientific | 12321D | |
| Escherichia coli BL21(DE3) competent cells | Thermo Fischer Scientific (Invitrogen) | C600003 | |
| Ethanol | Merc-Millipore | 100983 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich (St Louis, MO, USA) | 798681 | |
| Gel Loading Dye, Purple (6X) | New England Biolabs | B7024S | |
| Glycerol | Merck | 356350 | |
| Glycine | Sigma-Aldrich (St Louis, MO, USA) | G7126 | |
| High-Speed Plasmid Mini Kit | GeneAid | PD300 | |
| Imidazole | Sigma-Aldrich (St Louis, MO, USA) | 56750 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Thermo Fischer Scientific (Invitrogen) | AM9464 | |
| Jouan CR 412 centrifuge | Jouan | CR412 | |
| Labinco LD-76 Rotator | Labinco | 7600 | |
| Luria-Bertani (LB) broth | Sigma-Aldrich (St Louis, MO, USA) | L3022 | |
| Lysozyme | Sigma-Aldrich (St Louis, MO, USA) | L6876 | |
| Magnesium chloride | Scharlau | MA0036 | |
| MERCK eurolab ultrasonic bath | MERCK | USR54H | |
| Millifuge Eppendorf spin centrifuge | Millipore | CT10 | |
| Mini-PROTEAN 3 Electrophoresis Cell | Bio-Rad | ||
| N,N,N′,N′-Tetramethylethylenediamine (TEMED) | Sigma-Aldrich (St Louis, MO, USA) | T9281 | |
| NanoDrop 2000 | Thermo Fischer Scientific | ||
| NheI-HF restriction endonuclease | New England Biolabs | R3131L | |
| Nickel(II) sulfate (NiSO4) | Sigma-Aldrich (St Louis, MO, USA) | 656895 | |
| Ni-NTA magnetic agarose beads | Qiagen | 36113 | |
| Orbital shaker | Biosan | OS-20 | |
| PacI restriction endonuclease | New England Biolabs | R0547L | |
| PageBlue Protein Staining Solution | Thermo Fischer Scientific | 24620 | |
| Phenylmethanesulfonyl-fluoride (PMSF) | Sigma-Aldrich (St Louis, MO, USA) | P7626 | |
| Protein Lobind Micro-centrifuge tubes | Eppendorf | 22431102 | |
| QIAquick Gel Extraction Kit | QIAGEN | 28704 | |
| Snijders Press-to-Mix shaker | Gemini | 34524 | |
| Sodium-acetate trihydrate | Sigma-Aldrich (St Louis, MO, USA) | S7670 | |
| Sodium-chloride | Sigma-Aldrich (St Louis, MO, USA) | S9888 | |
| Sodium-hydroxide | Sigma-Aldrich (St Louis, MO, USA) | S5881 | |
| SYBR Green I Nucleic Acid Gel Stain | Thermo Fischer Scientific | S7563 | |
| T4 DNA ligase | Promega | M180A | |
| Thermo shaker | Biosan | TS-100 | with SC-24 accessory block |
| Tris | Sigma-Aldrich (St Louis, MO, USA) | T1503 | |
| Tween 20 | Sigma-Aldrich (St Louis, MO, USA) | P2287 | |
| WALLAC VICTOR2 1420 multilabel counter | Wallac Oy, Turku, Finland |
Referencias
- Meldal, M. Smart Combinatorial Assays for the Determination of Protease Activity and Inhibition. Molecular Informatics. 24 (10), 1141-1148 (2005).
- Rao, M. B., Tanksale, A. M., Ghatge, M. S., Deshpande, V. V. Molecular and biotechnological aspects of microbial proteases. Microbiology and Molecular Biology Reviews. 62 (3), 597-635 (1998).
- Zhang, G., Sittampalam, G. S., et al. Protease assays. The Assay Guidance Manual. , (2012).
- Woelcke, J., Hassiepen, U., Chen, T. Fluorescence-based biochemical assay formats. A Practical Guide to Assay Development and High-Throughput Screening in Drug Discovery. , (2010).
- Richardson, P. L. The determination and use of optimized protease substrates in drug discovery and development. Current Pharmaceutical Design. 8 (28), 2559-2581 (2002).
- Diamond, S. L. Methods for mapping protease specificity. Current Opinion in Chemical Biology. 11 (1), 46-51 (2007).
- Schilling, O., Overall, C. M. Proteome-derived, database-searchable peptide libraries for identifying protease cleavage sites. Nature Biotechnology. 26 (6), 685-694 (2008).
- Askin, S. P., Morin, I., Schaeffer, P. M. Development of a protease activity assay using heat-sensitive Tus-GFP fusion protein substrates. Analytical Biochemistry. 415 (2), 126-133 (2011).
- Chaparro-Riggers, J. F., Breves, R., Michels, A., Maurer, K. H., Bornscheuer, U. A GFP based assay for the determination of hydrolytic activity and substrate specificity of subtilisins under washing conditions. Journal of Molecular Catalysis B: Enzymatic. 35, 74-77 (2005).
- Patel, D., Frelinger, J., Goudsmit, J., Kim, B. In vitro assay for site-specific proteases using bead-attached GFP substrate. Biotechniques. 31 (5), 1194-1198 (2001).
- Branchini, B. R., et al. Sequential bioluminescence resonance energy transfer-fluorescence resonance energy transfer-based ratiometric protease assays with fusion proteins of firefly luciferase and red fluorescent protein. Analytical Biochemistry. 414 (2), 239-245 (2011).
- Zhou, C., Yan, Y., Fang, J., Cheng, B., Fan, J. A new fusion protein platform for quantitatively measuring activity of multiple proteases. Microbial Cell Factories. 13 (1), 44 (2014).
- Fox, J. D., Waugh, D. S. Maltose-binding protein as a solubility enhancer. Methods in Molecular Biology. 205, 99-117 (2003).
- Bozóki, B., et al. A recombinant fusion protein-based, fluorescent protease assay for high throughput-compatible substrate screening. Analytical Biochemistry. 540-541, 52-63 (2018).
- Mótyán, J. A., Miczi, M., Bozóki, B., Tözsér, J. Data supporting Ni-NTA magnetic bead-based fluorescent protease assay using recombinant fusion protein substrates. Data in Brief. 18, 203-208 (2018).
- Balleza, E., Kim, J. M., Cluzel, P. Systematic characterization of maturation time of fluorescent proteins in living cells. Nature Methods. 15, 47-51 (2018).
- Hebisch, E., Knebel, J., Landsberg, J., Frey, E., Leisner, M. High variation of fluorescence protein maturation times in closely related Escherichia coli strains. PLoS One. 8, e75991 (2013).
- Kapust, R. B., et al. Tobacco etch virus protease: mechanism of autolysis and rational design of stable mutants with wild-type catalytic proficiency. Protein Engineering, Design and Selection. 14, 993-1000 (2001).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados