Method Article
Producción, purificación y Control de calidad de vectores de base de Virus Adeno-asociado
En este artículo
Resumen
Aquí, describimos una estrategia eficiente y reproducible para producir, título y lotes de control de calidad de vectores de virus adeno-asociado. Permite al usuario obtener una preparación de vector con alto título (≥1 x 1013 vector genomas/mL) y una alta pureza, para uso en vitro o en vivo .
Resumen
Herramientas de entrega genética basadas en virus adeno-asociados (AAVs) son una opción popular para la entrega de los transgenes a sistema nervioso central (SNC), incluyendo aplicaciones de terapia génica. Vectores AAV son capaces de infectar células divisorias y no dividir y dar expresión de transgenes a largo plazo, no replicar. Importantemente, algunos serotipos, como el PHP nuevamente descrito. B, puede cruzar la sangre-barrera hematoencefálica (BBB) en modelos animales, después de la entrega sistémica. Vectores AAV se pueden producir eficientemente en el laboratorio. Sin embargo, protocolos robustos y reproducibles se requieren para obtener los vectores AAV con suficientes niveles de pureza y los valores de titulación lo suficientemente altos como para aplicaciones en vivo . Este protocolo describe una estrategia eficiente y reproducible para la producción de vectores AAV, basada en una estrategia de purificación gradiente iodixanol. El método de purificación de iodixanol es adecuado para la obtención de lotes de los vectores AAV alto-título de alta pureza, en comparación con otros métodos de purificación. Además, el protocolo es generalmente más rápido que otros métodos descritos en la actualidad. Además, una cuantitativa de polimerasa de la cadena de reacción (qPCR)-estrategia por turnos se describe para que una determinación rápida y precisa de la titulación de vectores, así como un método de tinción de plata determinar la pureza del lote de vector. Finalmente, resultados representativos de la entrega del gene para el CNS, después de la administración sistémica de AAV-PHP. B, se presentan. Estos resultados deberían ser posibles en todos los laboratorios utilizando los protocolos descritos en este artículo.
Introducción
En los últimos 30 años, tipo de aireación ha sido diseñados para crear vectores AAV recombinantes, que han demostrado para ser excepcionalmente útiles para la transferencia de genes en el CNS de1,2,3,4, 5,6 y gene terapia se acerca a la enfermedad (incluyendo terapias aprobadas por la FDA y EMA)4,7. Su idoneidad para el uso en el SNC deriva en gran parte de su capacidad de infectar las células no se dividen, poste-mitotic, suelen encontrarse en el CNS8. Sin embargo, los vectores de AAV tienen también la ventaja de permitir una expresión a largo plazo de cualquier transgen terapéutico dado4,9 , mientras que una respuesta inmune más suave en comparación con otros vectores virales7, 8,10,11,12.
Los elementos principales de cualquier vector AAV son el genoma y la cápside. Aireación de tipo salvaje es monocatenario (ss) virus de la DNA con un genoma de aproximadamente de 5 kilobases (kb)13. Para la producción de vectores AAV recombinantes, los genes rep y cap (necesarios para la replicación del genoma y el ensamblaje de la cápside viral) son eliminados del genoma de la AAV de tipo salvaje y proporcionados en el transporte, dejando espacio para un cassette de expresión que contiene el transgén14,15. Las secuencias repetición terminal invertidas (RTI) del genoma viral original son los únicos elementos retenidos en un vector AAV, ya que son esenciales para la replicación y embalaje3,10,14. Vectores AAV pueden diseñarse para mejorar la expresión del transgen; una mutación en uno de los ITRs conduce a la formación de un lazo de horquilla que efectivamente permite la generación de un complementario DNA filamento3,7,15. La principal ventaja de esta configuración, como un genoma de uno mismo-complementarios (sc), es que ignora la necesidad de síntesis del segundo filamento típico en el ciclo de vida convencional de aireación, aumenta considerablemente la velocidad y los niveles de expresión del transgen 1. sin embargo, el uso de un genoma de scAAV reduce la capacidad de carga del vector 2,4 kb aproximadamente. Esto incluye el transgen secuencias, así como cualquier secuencias reguladoras tales como promotores o sitios de unión de microARN, para limitar la expresión de tipos específicos de la célula16.
La cápside AAV determina la interacción de la célula de vector-host y confiere un grado de tropismo de tejido o tipo celular para un serotipo de la AAV, que también puede ser explotada para limitar la expresión del transgén a lugares específicos. Varios serotipos AAV se encuentran en la naturaleza, mientras que otros han sido producidos en laboratorios a través de enfoques recombinantes (es decir, PHP. B). Además, algunos cápsida también confiere otras características útiles, tales como la capacidad para cruzar el BBB, resultando en la entrega de los transgenes en el SNC después de la administración sistémica. Esto se ha demostrado para AAV9, así como el recientemente descrito PHP. B cápsida17. Como consecuencia, estos serotipos están demostrando para ser particularmente relevante para los nuevos enfoques de la terapia del gene para neurodegenerativas trastornos1,17,18.
El objetivo de este protocolo es describir un método rentable para la producción en pequeña escala de los vectores AAV con alto título y pureza. Aunque los resultados presentados aquí usan el PHP. Cápside de B y un cassette de expresión scAAV, el protocolo es conveniente para la producción de varios serotipos del vector AAV y configuraciones de genoma, lo que permite máxima flexibilidad experimental. Sin embargo, el rendimiento de vector y la pureza final pueden variar según el serotipo solicitado.
El protocolo sí mismo es una variante del método clásico tri-transfección para la producción de vectores virales e incorpora el uso de un gradiente de iodixanol para vector de limpiar, que, en comparación con el clásico uso de gradientes de cesio cloruro (CsCl), ha sido divulgado para producir vectores AAV de mayor pureza en una manera más eficiente19,20,21.
Los pasos de la transfección, la purificación y la concentración se pretenden realizarse según buenas prácticas de laboratorio (BPL) en un laboratorio de cultivo de tejidos para trabajo de vector viral. Cada tarea debe realizarse en cumplimiento de la legislación nacional y local relativas a la producción de vectores virales y utilizar. Trabajo debe realizarse bajo una campana de flujo laminar y en condiciones estériles. Dentro de las instalaciones de vector, se recomienda usar un delantal de laboratorio, además de la bata de laboratorio regular cultivo de tejidos. Por otra parte, un doble par de guantes y botas de plástico, se debe usar en todo momento.
Antes de comenzar la producción de vectores, asegurar todo el equipo necesario y los plásmidos son disponibles. 1) pCapsid plásmido contiene el gen rep que codifica cuatro proteínas no estructurales necesarias para la replicación, es decir, Rep78, Rep68, Rep52 y Rep40 y el gen de tapa que codifica tres proteínas estructurales de la cápside, a saber, VP1, VP2 y VP3. 2) pHelper plásmido contiene los genes E4, E2Ay VA de adenovirus, que facilitan la producción de AAV en células HEK293T. 3) pTransgene plásmido contiene el casete de expresión de transgenes, flanqueado por dos RTI. Estos plásmidos pueden ser sintetizados de novo en el laboratorio utilizando secuencias disponibles en línea22. Para plásmidos hacen de novo, especialmente aquellos que contienen transgenes novela, secuenciación es necesaria, para asegurarse de que el transgen y RTI es correctos. Alternativamente, premade plásmidos pueden adquirirse directamente a través de repositorios de plásmido en línea. Cuando sea necesario, plásmidos pueden ser amplificados y purificaron usando kits estándar, según las instrucciones23 el fabricante.
Título del vector y la pureza pueden afectar negativamente la capacidad de transducción de los vectores. Protocolos adicionales se suministran para evaluar la calidad del vector producido. Los vectores finales será útiles para estudios de la función de la célula del CNS en aplicaciones tanto in vitro e in vivo .
Protocolo
| Solución | Composición | |
| Cultivo celular y transfección | ||
| DMEM1 | DMEM 1 x | |
| 1% FBS (v/v) | ||
| 1% GlutaMAX (v/v) | ||
| DMEM10 | DMEM 1 x | |
| 10% FBS (v/v) | ||
| 1% GlutaMAX (v/v) | ||
| 150 mM NaCl | 4,380 g NaCl | |
| Hasta 500 mL de agua ultrapura | ||
| AAV purificación y desalación | ||
| NaCl de 5 M | 146,1 g NaCl | |
| Hasta 500 mL de agua ultrapura | ||
| 1 M Tris HCl (pH 8.5) | base de Tris g 12,11 | PRECAUCIÓN |
| Hasta 100 mL de agua ultrapura | ||
| Añadir 1 M de HCl con una pipeta Pasteur para reducir el pH a 8.5 | ||
| Tampón de lisis | 15 mL de NaCl de 5 M | |
| 25 mL de ácido 1 clorhídrico M Tris (pH 8.5) | PRECAUCIÓN | |
| Hasta 500 mL de agua ultrapura | ||
| 10 x tampón fosfato salino (PBS) | 80 g de NaCl | |
| 2 g de KCl | PRECAUCIÓN | |
| 14,4 g de Na2HPO4 | ||
| 2,4 g KH2PO4 | ||
| Hasta 1 L de agua dd | ||
| 1 M de MgCl2 | 20,33 g MgCl2-6 H2O | |
| Hasta 100 mL de agua ultrapura | ||
| KCl de 1 M | 7,45 g KCl | PRECAUCIÓN |
| Hasta 100 mL de agua ultrapura | ||
| 5 x solución stock de PBS magnesio-potasio (PBS-MK) | 250 mL de PBS x 10 | |
| 2,5 mL de 1 M de MgCl2 | ||
| 6,25 mL de KCl de 1 M | PRECAUCIÓN | |
| Hasta 500 mL ultra agua H2O | ||
| 15% Iodixanol | 12,5 mL de Optiprep densidad gradiente medio | PRECAUCIÓN |
| 10 mL de NaCl de 5 M | ||
| 10 mL de 5 x PBS-MK | ||
| 17,5 mL de agua ultrapura | ||
| 25% Iodixanol | 20,8 mL de Optiprep densidad gradiente medio | PRECAUCIÓN |
| 10 mL de 5 x PBS-MK | ||
| 19,2 mL de agua ultrapura | ||
| 100 μl de fenol rojo | ||
| 40% Iodixanol | 33,3 mL de Optiprep densidad gradiente medio | PRECAUCIÓN |
| 10 mL de 5 x PBS-MK | ||
| 6,7 mL de agua ultrapura | ||
| 60% Iodixanol | 50 mL de Optiprep densidad gradiente medio | PRECAUCIÓN |
| 100 μl de fenol rojo | PRECAUCIÓN | |
| Control de pureza AAV | ||
| 10 x tampón de Tris acetato EDTA (té) | base de Tris 44,8 g | PRECAUCIÓN |
| 11,4 mL ácido acético glacial (17.4M) | ||
| 3,7 g de EDTA | ||
| Agua ultrapura de L hasta 1 | ||
| Gel de agarosa | agarosa ultrapura 0.8 g | |
| Hasta 100 mL de tampón de té x 1 | ||
| Buffer del gel | base de Tris g 181,7 | PRECAUCIÓN |
| 1.5 g de SDS | PRECAUCIÓN | |
| Ajustar pH a 8.45 con 1 M de HCl | PRECAUCIÓN | |
| Hasta 500 mL de agua ultrapura | ||
| Cátodo de tampón 10 x | base de Tris 121,14 g | PRECAUCIÓN |
| g 179,2 tricino | PRECAUCIÓN | |
| 1% SDS (w/w) | PRECAUCIÓN | |
| Agua ultrapura de L hasta 1 | ||
| Ánodo de tampón 10 x | base de Tris de 242,3 g | PRECAUCIÓN |
| Agua ultrapura de L hasta 1 | ||
| Ajustar pH a 8.9 con 1 M de HCl | PRECAUCIÓN | |
| Tampón de muestra 5 x | De 20 mL: | |
| base de Tris 605 mg | PRECAUCIÓN | |
| 4 g de SDS | PRECAUCIÓN | |
| Serva de 10 mg azul G | ||
| 12 g de glicerol | ||
| Ajustar el pH a 6,8 con 1 M de HCl, alícuota y almacenar a-20 ° C | PRECAUCIÓN | |
| Gel de apilamiento | Para 2 geles: | |
| 400 μL acrilamida | PRECAUCIÓN | |
| 750 μl de tampón de gel | ||
| 1,85 mL agua ultrapura | ||
| 4 ΜL TEMED | PRECAUCIÓN | |
| 20 μl 10% APS (v/v) | PRECAUCIÓN | |
| Agregar el TEMED y el 10% APS inmediatamente antes de verter el gel. Utilizar ambos productos químicos bajo una campana química. | ||
| Gel de resolución | Para 2 geles: | |
| 3,32 mL acrilamida | PRECAUCIÓN | |
| 3,35 mL de tampón de gel | ||
| 1,14 mL agua ultrapura | ||
| 2,12 mL 50% de glicerol | ||
| 6 ΜL TEMED | PRECAUCIÓN | |
| 50% de 10 μl APS (w/v) | PRECAUCIÓN | |
| Agregar el TEMED y el 10% APS inmediatamente antes de verter el gel. Utilizar ambos productos químicos bajo una campana química. | ||
| Butanol saturado en agua | 10 mL n-butanol | PRECAUCIÓN |
| 1 mL de agua ultrapura | ||
| PRECAUCIÓN: Consulte la tabla de materiales para obtener directrices sobre el uso de productos químicos peligrosos. | ||
Tabla 1: Composición de las soluciones necesarias.
1. Tri-transfección de células HEK293T
Nota: Por favor consulte la tabla 1 para la composición de los tampones y soluciones utilizadas en el protocolo.
Nota: Funcionamiento de esta sección del protocolo tarda aproximadamente 4 días.
- Descongelar un vial de células 293T de riñón embrionario humano (HEK) en un baño de agua a 37 ° C.
Nota: Utilice sólo las células que han sido pasadas a menos de 20 x para garantizar la eficiencia de transfección óptima. - Platos de cultura de la célula las células HEK293T la semilla a una densidad de 2 x 103 a 6 x 103 células/cm2 en DMEM10 de 15 cm de diámetro.
- Crecen las células al 70 – 80% de confluencia en una incubadora estándar establecido a 37 ° C, con 95% humedad y 5% CO2.
Nota: La producción de un lote de vectores AAV usando este protocolo requiere 18 platos de cultivo celular (15 cm de diámetro). Una confluencia de células de 70-80% corresponde a 6 x 103 a 7 x 103 células/cm2, mantenido en 17 – 20 mL de medio de cultivo DMEM10. -
Preparar polietilenimina (PEI) / ADN de la mezcla en una proporción de concentración de 1/3,5 (w/w).
- Preparar la mezcla de ADN de 18 platos de cultivo celular en un tubo cónico de 50 mL mediante la mezcla de 360 μg de 180 μg de pTransgene en 18 mL de NaCl 150 mM, pΔF6 y 180 μg de pCapsid.
- Distribuir la mezcla de ADN en tres tubos cónicos de 50 mL (6 mL de ADN mezcla por el tubo cónico).
- Preparar la mezcla de PEI para seis platos de cultura en un nuevo tubo cónico de 50 mL de células mezclando 840 μg de PEI (1 μg/μl) en 6 mL de NaCl 150 mM.
- Preparar la mezcla de ADN PEI, añadir 6 mL de la mezcla de PEI (preparada en el paso 1.4.3), gota a gota, a uno de los tubos cónicos que contienen la mezcla de ADN (preparada en el paso 1.4.2) e incubar durante 20 min a temperatura ambiente.
Nota: Después de 20 min de incubación, la mezcla de ADN PEI será ligeramente turbia.
- Tomar seis platos de cultivo celular de la incubadora y aspirar completamente el medio de cada plato de la cultura en una campana de flujo laminar. Eliminar los rastros del medio de enjuague los platos con 5 mL de solución salina tamponada con fosfato de precalentado de Dulbecco (DPBS).
- Garantizar la distribución de DPBS sobre toda la superficie inclinando suavemente el plato.
- Suavemente Aspire la DPBS y añadir 12 mL de DMEM1 a cada plato.
Nota: Evitar separar las células añadiendo poco a poco, el medio de una pipeta en el borde del plato. - Mezclar el ADN PEI mediante pipeteo arriba y abajo 3 x - 5 x. Añadir 2 mL de la mezcla de ADN PEI a cada uno de los platos de la cultura de seis células en forma de gota a gota, cuidadosamente distribuyéndolo por toda la superficie. Una vez que la mezcla se agrega a cada plato, coloque las placas en la incubadora. Repita los pasos 1.4.3– 1.8 para los restantes platos de cultura.
- Incube las células transfected para 5 h a 37 ° C, con humedad de 95% y 5% CO2.
- Añadir un adicional 12 mL de DMEM10 a cada placa de cultivo sin quitar el medio preexistente (volumen medio total = 25 mL).
- Incube las células transfected arriba a transfección después de 72 h a 37 ° C, con 95% humedad y 5% CO2.
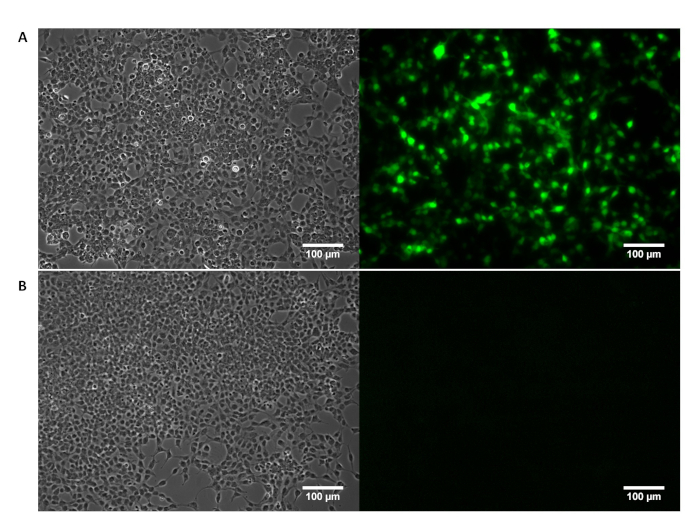
Suplementario Figura 1: morfología de la célula HEK 293T visualizada por microscopía de contraste de fase (izquierda) con la confirmación de la expresión de GFP visualizada por fluorescencia (derecha) la proyección de imagen. (A) exitosa transfección de células HEK293T con un pTransgene codificación de GFP es confirmada por la proyección de imagen de la fluorescencia. (B) HEK293T células tratadas exclusivamente con reactivos de transfección no mostrar ninguna expresión de GFP. Haga clic aquí para ver una versión más grande de esta figura.
- El medio y la células 72 h tras la transfección de la cosecha. Use un raspador celular para separar con cuidado las células de la placa de cultivo. Recoge el medio y las células en un tubo cónico de 50 mL en hielo.
Nota: El contenido de dos platos de cultivo celular puede recogerse en un tubo cónico de 50 mL solo. Al final de este paso, cada uno de los nueve tubos contiene aproximadamente 50 mL de medio. - Centrifugar los tubos cónicos en 420 x g durante 10 min a 4 ° C con la aceleración y desaceleración de la centrífuga al máximo.
- Descartar cuidadosamente el sobrenadante de cada tubo. No utilice Pipetas para evitar la pérdida de material. Por el contrario, suavemente Vierta el sobrenadante en un recipiente de eliminación de residuos y colocar los tubos que contienen los pellets de células en el hielo.
- Resuspender cada precipitado de células en 2 mL de tampón de lisis directamente en el tubo cónico de 50 mL mediante pipeteo arriba y abajo x 5 – 10. No no agitar con vortex. Piscina los lisados de tres tubos juntos.
Nota: En este punto, habrá tres tubos cónicos de 50 mL, cada una con 6 mL de las células resuspendidas en tampón de lisis.
2. purificación del Vector AAV
Nota: Funcionamiento de esta sección del protocolo tarda aproximadamente 1 día. Realice los pasos siguientes simultáneamente en cada uno de los tres tubos cónicos de 50 mL que contiene las células suspendidas en tampón de lisis (ver nota anterior).
- Congelar y descongelar las células resuspendidas 3 x les lyse y liberar las partículas AAV. Realizar el paso de congelación colocando los tubos en un cubo que contiene hielo seco mezclado con etanol. Realizar descongelamiento colocando inmediatamente las células en un baño de agua a 37 ° C.
- Después de la tercera fase de descongelación, centrifugar a 1.167 x g durante 15 min a 4 ° C.
Nota: Se formará una pelotilla sensible compuesta de restos celulares. Al manipular los tubos, evitar movimientos bruscos ya que puede causar el desprendimiento de la pastilla en el sobrenadante, que pondrá en peligro la pureza final del vector de la. - Transferir cuidadosamente los sobrenadantes para limpiar tubos cónicos de 50 mL y añadir nucleasa a cada tubo, a una concentración final de 50 U/mL de sobrenadante.
- Incubar durante 30 min a 37 ° C. Agitar los tubos cónicos de 50 mL a mano cada 10 minutos para asegurar que la nucleasa es totalmente mezclado con el sobrenadante.
- Aclarar el sobrenadante por centrifugación a 13.490 x g durante 20 min a 4 ° C.
- Acoplar un filtro de 0.45 μm a una jeringa de 10 mL y colóquelo en la parte superior un tubo cónico de 50 mL limpio. Con cuidado retire el émbolo y llenar la jeringa con el sobrenadante del paso 2.5.
- Utilice el émbolo para forzar el lisado a través del filtro. Utilice una jeringa y filtro nuevo para cada tubo del sobrenadante obtenido en el paso 2.5.
Nota: La fracción obtenida se conoce como 'lisado crudo'. - Cada una de las fracciones de iodixanol 15%, 25%, 40% y 60% en cuatro tubos cónicos de 50 mL separadas, preparar según las instrucciones en la tabla 1.
-
Preparar los gradientes de iodixanol en tres tubos de ultracentrifugación utilizando el siguiente orden de iodixanol fracciones: 8 mL de iodixanol 15%, 5,5 mL de iodixanol 25%, 5 mL de iodixanol 40% y 4,5 mL de iodixanol 60%.
PRECAUCIÓN: Iodixanol puede causar irritación en ojos, piel y los tractos gastrointestinales y respiratorios. Al manipular los gradientes iodixanol, utilice guantes y trabajar bajo campana de flujo laminar.- Pipeta 8 mL de iodixanol 15% en cada tubo de ultracentrifugación.
- Pipetee 5,5 mL de iodixanol solución al 25% en un tubo cónico de 50 mL limpio (figura 1A).
- Utilice una pipeta de Pasteur no graduado (como el cuello del ultracentrifugación tubo es demasiado estrecho para pipetas de precisión aforadas convencionales) para cuidadosamente una capa de 5,5 mL de la solución de iodixanol 25% por debajo del 15% iodixanol solución (figura 1B).
Nota: Esto puede lograrse con éxito añadiendo el iodixanol en tres pasos desde la pipeta Pasteur sólo puede soportar alrededor de 2 mL. - Añadir las soluciones de iodixanol 40% y 60% tal como se describe en el paso 2.9.3. No molestar el iodixanol diferentes interfaces durante la estratificación.
Nota: La preparación adecuada de las fracciones de diferentes iodixanol puede garantizarse mediante confirmación visual gracias al rojo de fenol añadido a las fracciones de iodixanol (vea las instrucciones en la tabla 1). Puesto que cada fracción tiene una densidad específica, no se mezcle durante la etapa de estratificación, si se realiza correctamente (ver figura 1).
- La capa del crudo lisado en la parte superior del gradiente de iodixanol 15% con una pipeta Pasteur. Proceder el gota a gota para evitar molestar a la interfaz entre el lisado crudo y la solución de iodixanol.
- Llenar el tubo de ultracentrifugación con tampón de lisis hasta que el menisco alcance la base del cuello de tubo para que el tubo no se derrumba bajo las muy altas fuerzas generadas durante la ultracentrifugación (figura 1).
- Cerrar los tubos de ultracentrifugación mediante tapas adecuadas. Utilizar una escala digital para asegurarse de que todos los tubos de ultracentrifugación tres tienen el mismo peso. Ajustar el peso, si es necesario, añadiendo más tampón de lisis sobre el lisado crudo.
Nota: La diferencia de peso entre los tubos de ultracentrifugación debe estar por debajo de 0,1 g asegurar la operación segura de la ultracentrífuga. Ultracentrífugas son potencialmente peligroso y deben ser utilizados por personas entrenadas. - Centrifugar los tubos a 301.580 x g, con un rotor de ángulo fijo titanio, durante 1 h y 40 min a 12 ° C, con máxima velocidad de aceleración y desaceleración.
-
Introduzca con cuidado una aguja Roma de acero inoxidable en el 40% y 60% iodixanol interfaz.
- Conecte la aguja a una jeringa de 5 mL (Figura 1E).
- Aspirar sólo la fracción claro, que contiene las partículas de vector.
Nota: El volumen total recogido es aproximadamente de 2,5 a 3 mL. Evitar la recolección de material en la interfaz de 25 – 40%, ya que esto aumentará el nivel de contaminación del lote de vector final, debido a la presencia de proteínas no deseados. - Procesar la fracción recogida (desalación y concentración) o almacenar durante la noche a 4 ° C.

Figura 1: configuración de purificación gradiente iodixanol y vector posterior colección. (A) antes de pipetear los gradientes de iodixanol diferentes en el tubo de ultracentrifugación, pipetear un volumen adecuado de cada solución de iodixanol en un separado tubo cónico. (B) luego use un Pasteur pipeta transferir secuencialmente cada iodixanol solución al tubo de ultracentrifugación: las capas de una concentración cada vez mayor iodixanol deben añadirse en la parte inferior del tubo por debajo de las capas anteriores. Capa (C) el vector crudo lisado en la parte superior una vez que el gradiente se ha preparado. Este sistema de la colección de vectores no utiliza agujas afiladas, que presentan un riesgo de lesiones 'por pinchazos'. (D) una aguja de jeringa 316 de acero inoxidable se inserta a través de la gradiente de iodixanol hasta la interfaz de iodixanol 40-60%. Vector (E) las partículas se encuentran en la fase de iodixanol 40% y se recogen. Haga clic aquí para ver una versión más grande de esta figura.
3. la desalación y concentración de los vectores AAV
Nota: Funcionamiento de esta sección del protocolo toma aproximadamente 2 h.
- Enjuague el filtro de membrana del filtro centrífugo añadiendo 5 mL de 1 x PBS-MK y centrifugar durante 5 min a 4.000 x g.
- Añadir 5 mL de 1 x PBS-MK y la fracción recogida de vector AAV, mezclar y luego añadir el volumen total del filtro. Sobre la adición de 1 x PBS-MK, se observa turbidez. Centrifugar a 4.000 x g hasta que el volumen actual del filtro en forma de cono se ha reducido a 1 mL. Deseche el paso acumulado en el tubo de la colección externa.
- Añadir 13 mL de 1 x PBS-MK y el filtro en forma de cono y repetir la centrifugación paso tantas veces como sea necesario (mínimo 3 x), hasta allí no más turbidez observa cuando fresca 1 x PBS-MK es añadido.
- En la final paso de lavar, añadir 13 mL de PBS + tensioactivo no iónico, 0.01% (v/v) y centrifugar a 4.000 x g hasta que el volumen se reduzca a 300 – 350 μl.
- Recoger la fracción restante presente en el filtro transfiriendo todo el volumen en un tubo de microcentrífuga con base estéril.
Nota: Esta fracción contiene los vectores AAV desalado y concentrado. En los siguientes pasos de este protocolo, esta fracción se denomina fracción 'primaria'. Asegúrese de que el tubo bajo el capó y almacenar a 4 ° C. - Enjuague el filtro con 200 μL de 1 x PBS-MK para recoger las partículas de vector residual retenidas en el filtro. Recoger en un tubo de microcentrífuga estéril.
Nota: Se trata de un stock vector diluido, que puede ser adecuado para algunas aplicaciones que requieren títulos de vector más bajos. En los pasos futuros, esta fracción se denomina fracción 'secundaria'. - Para el almacenamiento a corto plazo, almacenar el vector fraction(s) a 4 ° C (menos de 2 semanas). Alícuota y almacenar el vector de ‑20 ° C cuando se requiere el almacenamiento a largo plazo.
- Realizar control de calidad como se describe en la sección 4.
4. valoración del Vector por reacción en cadena de la polimerasa cuantitativa
Nota: Funcionamiento de esta sección del protocolo toma aproximadamente 3 h.
-
Curva estándar
- Alinear el plásmido de expresión de transgenes (pTransgene) utilizado para la transfección de células HEK-293T en la sección 1.
- Preparar la mezcla de digestión de restricción en un tubo de microcentrífuga de 0, 5 mL (ver Tabla 2 para la composición de la mezcla de digestión de restricción).
Nota: Ajustar la composición de la mezcla de digestión de restricción según la enzima utilizada y las directrices conexas del fabricante. - Incubar la mezcla de digestión de restricción por 1 h a 37 ° C.
- Comprobar la eficiencia de la digestión de restricción ejecutando el plásmido linearizado en gel de agarosa 0.8% (p/v) a 100 V para la digestión completa de la 1 h. del plásmido debe producir un solo fragmento de tamaño definido.
- Purificar el plásmido lineal ADN utilizando un kit de potabilización de la polimerización en cadena, siguiendo las instrucciones del fabricante de la24y medir la concentración de ADN con un espectrofotómetro midiendo la absorción a 260 nm. Después de la valoración, almacenar la alícuota restante del plásmido lineal a ‑20 ° C para su uso posterior.
- Calcular las siguientes moléculas (es decir, copias de ADN) de las acciones de plásmido por microlitro.
- En primer lugar, calcular el peso molecular del plásmido. Suponiendo que el peso promedio de un par de base de ADN (bp) es de 650 Daltons (Da) y un mol de un bp pesa 650 g, se puede estimar el peso molecular de cualquier plantilla de la DNA de doble hebra por tomar el producto de su longitud (en bp) y peso por par.
Peso molecular de plásmidos [g/mol] = tamaño del plásmido [bp] x 650 [Da/bp] - A continuación, calcular el número de moles de plásmido por microlitro.
Moles de plásmido por microlitro = concentración de plásmido [g/μl] / peso molecular de plásmidos [g/mol]
Nota: El inverso del peso molecular es el número de moles de plásmido presente en 1 g del material. - Luego, calcular el número de moléculas de plásmido por microlitro, utilizando el número de Avogadro (6,022 x 1023 moléculas/mol).
Moléculas de plásmido por microlitro = moles de plásmido por microlitro [moles/μl] x número de Avogadro [moléculas/mol] - Por último, diluir el caldo plásmidos (moléculas/μL) para obtener una solución μl 100 con la concentración de 1 x 109 moléculas (vector genomas (vg) por microlitro).
Stock de plásmido (100 μL) = (concentración deseada [moléculas/μl] x 100 μL) / moléculas de plásmido [moléculas/μl]
- En primer lugar, calcular el peso molecular del plásmido. Suponiendo que el peso promedio de un par de base de ADN (bp) es de 650 Daltons (Da) y un mol de un bp pesa 650 g, se puede estimar el peso molecular de cualquier plantilla de la DNA de doble hebra por tomar el producto de su longitud (en bp) y peso por par.
- Hacer diluciones seriadas de las existencias de plásmido (1 x 109 vg/μL) en triplicado:
10 μl de 1 x 109 plásmido vg/μl stock + 90 μl de H2O = 1 x 108 vg/μl solución
10 μl de la dilución de 1 x 108 vg/μl + 90 μl de H2O = 1 x 107 vg/μl solución
10 μl de la dilución de 1 x 107 vg/μl + 90 μl de H2O = 1 x 106 vg/μl solución
10 μl de la dilución de 1 x 106 vg/μl + 90 μl de H2O = 1 x 105 vg/μl solución
Seguir obtener una solución 1 x 101 vg/μl. - No las diluciones seriadas de las acciones de plásmido estándar en hielo hasta su carga en la placa de qPCR (sección 4.3).
| Componente | Cantidad |
| 10 x buffer de la enzima de la restricción | 5 ΜL |
| Enzima de restricción | 2,5 ΜL |
| Plásmido | 5 μg |
| H2O | hasta 50 μl |
Tabla 2: Composición de mezcla restricción digest.
Tabla 3: Calculadora de volumen de Stock plásmido. Haga clic aquí para descargar esta tabla.
-
Extracción de ADN de los vectores AAV
- Mezcle 2 μl de la AAV vector stock (la principal fracción de paso 3.5) con 198 μl de DNasa I (1 x) de búfer en tira tubos (PCR) y añadir 2 μl de DNasa I.
Nota: DNasa que se degrada cualquier material genético que no está contenido dentro de una cápside de vector (que distorsionaría los resultados de qPCR). Esta solución se denomina dilución 'dil1 x 10-2'. - Incubar durante 30 min a 37 ° C, seguida por 10 min a 95 ° C.
Nota: El protocolo se puede detener en este punto y el material puede ser almacenado indefinidamente a 4 ° C, para evitar el deterioro del producto. - Añadir 2 μl de proteinasa K a la solución de dil1 x 10-2 (paso 4.2.1) e incubar por 60 min a 50 ° C, seguido por 20 min a 95 ° C.
Nota: Este paso será desmontar la cápside del vector AAV y liberan el genoma del vector AAV en la solución. Añade proteinasa K en exceso como no se conoce el contenido de la muestra en proteínas (cápside). Tenga en cuenta que es esencial para asegurar que toda la actividad de proteinasa K se retira por desnaturalización, antes de la qPCR, para evitar problemas con la degradación de la polimerasa (parcial) que influyen en el resultado final. - Preparar 1:10 diluciones seriadas de la proteinasa K tratado dil1 x 10-2 solución (paso 4.2.3) en tubos de microcentrífuga de 1,5 mL como sigue:
10 μl de dil1 x 10-2 + 90 μl de H2O = dilución dil1 x 10-3
10 μl de dil1 x 10-3 + 90 μl de H2O = dilución dil1 x 10-4
10 μl odil1 f x 10-4 + 90 μl de H2O = dilución dil1 x 10-5 - Mantenga las diluciones seriadas del DNA extraído del vector en el hielo hasta la carga en la placa de qPCR (sección 4.3).
- Mezcle 2 μl de la AAV vector stock (la principal fracción de paso 3.5) con 198 μl de DNasa I (1 x) de búfer en tira tubos (PCR) y añadir 2 μl de DNasa I.
-
Titulación por qPCR basados en detección de SYBR Green
- Preparar la mezcla principal de qPCR en un tubo de microcentrífuga de 1,5 mL para la muestra y los estándares. Utilice 10 μl de mezcla de maestra SYBR Green, 1 μl del primer avance (stock 10 μm), 1 μl de cebador inverso (stock de 10 μm) y 3 μl de H2O por reacción. Ver el protocolo en la tabla 4 para las secuencias de la cartilla.
- Pipetear la qPCR master mix arriba y abajo, pero no no agitar con vortex.
- Añadir 15 μl de la mezcla principal de qPCR, seguida por cada 5 μl de la curva estándar preparada en la sección 4.1 o el ADN extraído de los vectores AAV en la sección 4.2, en cada pozo. Incluyen tres pozos que contienen sólo el qPCR master mix, como control negativo. Consulte la figura 2 para el diseño de la placa.
- Selle la placa con una película y centrifugar brevemente la placa qPCR en 1.500 x g durante 30 s a 4 ° C.
- Ejecutar la reacción de qPCR en una placa base en tiempo real PCR amplificación y detección de instrumento, usando las condiciones sugeridas en la tabla 5.
| Nombre de la cartilla | Secuencia de |
| Primer avance | 5'-CCCACTTGGCAGTACATCAA-3' |
| Primer revés | 5'-GCCAAGTAGGAAAGTCCCAT-3' |
Tabla 4: Secuencias de la cartilla diseñadas contra el promotor CBA.
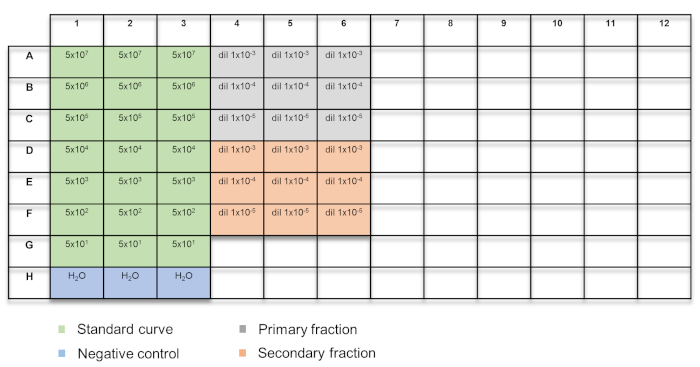
Figura 2: diseño de placa para titulación de vectores basados en qPCR. Las muestras están codificados con colores: verde = curva estándar; azul = H2O control; gris = fracción de primaria; naranja = fracción secundaria. Haga clic aquí para ver una versión más grande de esta figura.
| Paso | hora | Temperatura | Ciclos de | Objetivo |
| Pre incubación | 5 min | 95 ° C | x1 | Activación desnaturalización y polimerasa ADN (reacción en caliente-empiece). |
| Amplificación de | 10 min | 95 ° C | x1 | Amplificación de la DNA. Configuración puede optimizarse si se utilizan cartillas alternativas con diferente temperatura de recocido. |
| 10 s | 95 ° C | x40 | ||
| 40 s | 60 ° C | |||
| 1 s | 72 ° C | |||
| Refrigeración | 10 s | 40 ° C | x1 | Placa de enfriamiento. Final de la polimerización en cadena. |
Tabla 5: Protocolo de ciclismo térmico para valoración de qPCR basados en verde SYBR.
-
Análisis de los datos para determinar el título del vector AAV
- Se llenan las celdas de datos de hoja de cálculo (Tabla 6A) los valores de Ct obtenidos para las diferentes diluciones de la muestra patrón preparado en la sección 4.1 para generar una curva estándar.
Nota: Se mostrará la ecuación de la curva estándar (y = a ln (x) + b) junto con la eficacia de2 R(tabla 6B). Una qPCR debe tener una eficacia cercana al 100% y R2 cerca de 1.0 (≥ 0.96). - Utilice los valores calculados de a y b para rellenar las celdas de datos correspondientes en la hoja de cálculo (tabla 6).
- Completar la hoja de cálculo con los valores de Ct obtenidos para las diferentes diluciones de la muestra AAV en sección 4.2.
- Calcular el promedio título del vector AAV en genomas de vector por microlitro de la 'fracción primaria' utilizando la siguiente fórmula:
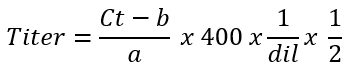
Nota: el factor 400 se utiliza para el solo genoma trenzado, mientras genomas sc utilizan un factor de multiplicación de 20025. De hecho, como cantidades de ADN dobles durante cada ciclo de qPCR, sc que ADN es detectado 2 x en comparación con un genoma de ss. El objetivo de la valoración es calcular la concentración en términos de genomas de vector por microlitro. Una corrección es necesaria para el funcionamiento de la qPCR al usar 2 μl de a partir de material (paso 4.2.1). DIL representa los factores de dilución de paso 4.2.4. Simultáneamente, se puede calcular la concentración de la fracción de vector AAV 'secundaria' (paso 3.6).
- Se llenan las celdas de datos de hoja de cálculo (Tabla 6A) los valores de Ct obtenidos para las diferentes diluciones de la muestra patrón preparado en la sección 4.1 para generar una curva estándar.
Tabla 6: plantilla para análisis de datos qPCR. Haga clic aquí para descargar este archivo.
5. pureza Control por SDS-PAGE y plata
Nota: Funcionamiento de esta sección del protocolo toma aproximadamente 5 h.
- Utilizar el etanol del 70% (v/v) para limpiar las placas de vidrio utilizadas para la fundición de los geles.
- Montar el sistema de fundición de gel. Asegurar que los fondos de las placas de vidrio no se saltan, para evitar las fugas de la mezcla de acrilamida al lanzar el gel.
- Preparar el apilamiento y el resolver soluciones de gel en dos separan tubos cónicos de 50 mL. Omitir el tetramethylethylenediamine (TEMED) y el persulfato de amonio 10% (p/v) (APS), ya que son responsables de la polimerización del gel. Agregar inmediatamente antes de emitir el gel.
Nota: El porcentaje final de acrilamida en el gel influye en el perfil de separación de las proteínas: por lo general, una concentración final de 10% (v/v) de acrilamida será suficiente para probar la pureza de una preparación del vector AAV. - Mezclar suavemente agitando el tubo que contiene los componentes del gel. No no agitar con vortex, ya que la oxigenación excesiva puede afectar la polimerización.
- Agregar el TEMED y el 10% (w/v) APS para la solución de gel de resolución. Mezclar y verter luego en el soporte del gel hasta que alcanza 1-2 cm por debajo de la parte superior de la placa de vidrio.
- Coloque una capa de butanol saturado en agua en la parte superior de la mezcla de acrilamida. Esto garantizará la formación de una superficie plana durante la polimerización. No deje el gel en alcohol por más de 30 min ya que deshidratan el gel y deteriorar su función.
PRECAUCIÓN: Butanol es peligroso en caso de contacto con la piel. También presenta un riesgo de incendio. Manéjela con cuidado. - Espere a que el gel polimerice y luego retirar el butanol. Consejo: Compruebe si se ha solidificado la mezcla exceso de gel en el tubo. La polimerización ocurre en menos de 20 minutos lavar la superficie del gel con H2O y séquelo con toallas de papel, teniendo cuidado de no para disturbar la superficie del gel.
- Agregar el TEMED y el 10% (p/v) APS el gel de apilamiento y vierta el gel en el soporte de gel en la parte superior del gel de separación.
- Coloque el peine provisto en el gel. Realizar esta acción con un movimiento constante para evitar la formación de burbujas de aire dentro de los pozos.
- Espere por lo menos 20 min para el gel polimerizar. Consejo: Compruebe que si el gel sobrante de la mezcla el tubo cónico se ha solidificado.
- Preparar las dos mezclas (tabla 7) para la primaria y la secundaria AAV vector fracciones (pasos 3.5 y 3.6, respectivamente).
| Alta cantidad | Baja cantidad | |
| Valores del vector AAV | 5 ΜL | 1 ΜL |
| 5 x buffer de la muestra | 3 ΜL | 3 ΜL |
| H2O | 7 ΜL | 11 ΜL |
Tabla 7: Composición de las mezclas de muestra requerido para la tinción de plata.
- Desnaturalizar totalmente las mezclas de muestra por calentamiento durante 5 min a 95 ° C. Montar el tanque de electroforesis, prestando atención a la orientación del electrodo.
- Llene el tanque con 1 x buffer de cátodo en el interior de la Asamblea de electrodo y 1 x buffer de ánodo en el exterior.
Nota: El buffer ánodo puede ser reciclado de corrida a corrida. Almacenador intermediario fresco cátodo debe utilizarse siempre. - Retire el peine del gel y limpiar los pozos del gel con tampón de cátodo de 1 x.
- 1 μl de escala de la proteína en un pozo de carga. Carga las mezclas de muestra en diferentes pozos en el mismo gel (Figura 3). Correr el gel a 50 V hasta las muestras de entrar en el gel de resolución. Entonces aumentar el voltaje a 100 V hasta que el frente de tinte alcanza el límite inferior del gel.
- Extraer con cuidado el gel de las placas de vidrio y utilizar la plata kit (según las instrucciones26) el fabricante de tinción para visualizar las proteínas virales (subunidades VP1, VP2 y VP3) que componen la cápsida AAV, así que Compruebe la posible contaminación de la proteína (Figura 3).

Figura 3: evaluación de la pureza del vector mediante SDS-PAGE y plata. Uso de un gel de Tricina-SDS, 5 μl de diversas preparaciones de vector se separaron. Las proteínas posteriormente fueron detectadas por tinción de plata. Vectores se consideran puro cuando VP1 (82 kDa), VP2 (67 kDa) y VP3 (60 kDa) son visibles en un 1:1:10 ratio (carril 1), sin excesivo fondo (carril 2) o bandas no específicos (carril 3). Haga clic aquí para ver una versión más grande de esta figura.
Resultados
AAV9 era considerado, hasta hace poco, que el serotipo más eficaz de vector AAV en cruzar el BBB y transducción de las células del SNC, después de la administración periférica. Se logró un avance significativo en el diseño de la cápside cuando Deverman reportaron el uso de un método de selección de cápside llamado Cre evolución basada en la recombinación de orientada a AAV (crear)17. Usando este método, se identificó una nueva cápside, llamada PHP. B, que informó como capaces de transducir la mayoría de los astrocitos y las neuronas en múltiples regiones de CNS, tras inyección sistémica17. En este punto, cabe señala que aunque PHP. B proporciona resultados positivos en ratones C57/Bl6 (que fue la cepa utilizada en los experimentos de aislamiento inicial), los informes preliminares sugieren que su eficacia puede variar de una manera dependiente de la cepa. Otros experimentos, sin duda, arrojará más luz sobre este tema31.
Sin embargo, a pesar de estos problemas, PHP. B ofrece interesantes posibilidades para la manipulación de la genética no invasiva en el SNC de ratones, incluyendo experimentos de terapia génica de prueba de concepto en modelos de la enfermedad. Como tal, decidimos evaluar la eficacia de la expresión del transgen mediante PHP. B versus AAV9, que ha sido el vector 'patrón oro' para la transducción de la CNS después de la administración periférica desde 20092. Para realizar una comparación directa de ambos serotipos, en condiciones óptimas para la expresión del transgen, usamos una sc genoma configuración32. Ambos vectores llevaron el transgen de la proteína verde fluorescente (GFP) bajo el control del promotor omnipresente pollo β-actina (CBA). Mujer ratones C57/Bl6 en día postnatal 42 (aproximadamente 20 g de peso) recibieron una dosis de 1 x 1012 vg por ratón de cualquier scAAV2/PHP. B-CBA-GFP o scAAV2/9-CBA-GFP. Administración de vector fue realizado mediante inyección en la vena la cola. Los experimentos fueron aprobados por el Comité de ética de la KU Leuven.
Postinjection de tres semanas, los ratones experimentaron transcardial perfusión con PBS helado, seguido por paraformaldehído al 4% (w/v) helado (PFA). Sus cerebros fueron cosechados y experimentaron más postfixation por una incubación durante la noche en el mismo fijador, antes de transferir al 0.01% (p/v) Na-azida/PBS para el almacenamiento hasta su análisis posterior. Después, los cerebros se seccionaron con un microtomo vibratorio y immunohistochemistry fue realizado en secciones gruesas de 50 μm.
Para evaluar los niveles de expresión del transgen, las secciones fueron teñidas con anticuerpos primarios contra GFP (conejo anti-GFP), con detección mediante anticuerpos secundarios conjugados a un colorante fluorescente (anti-conejo Alexa Fluor 488) (Figura 4A, B ). Las mediciones de intensidad de fluorescencia (en unidades arbitrarias [au]) confirmaron un aumento significativo en la expresión de GFP cuando un sc genoma y el PHP. Cápside de B fueron utilizados en relación con AAV9. Se observaron aumentos en la GFP en el cerebro (2105 ± 161 vs 1441 ± 99 au; p = 0.0032), cerebelo (± 196 2601 vs 1737 au ± 135; p = 0.0032) y el tronco encefálico (3082 ± 319 vs 2485 ± 88 au; p = 0.0038) (figura 4).
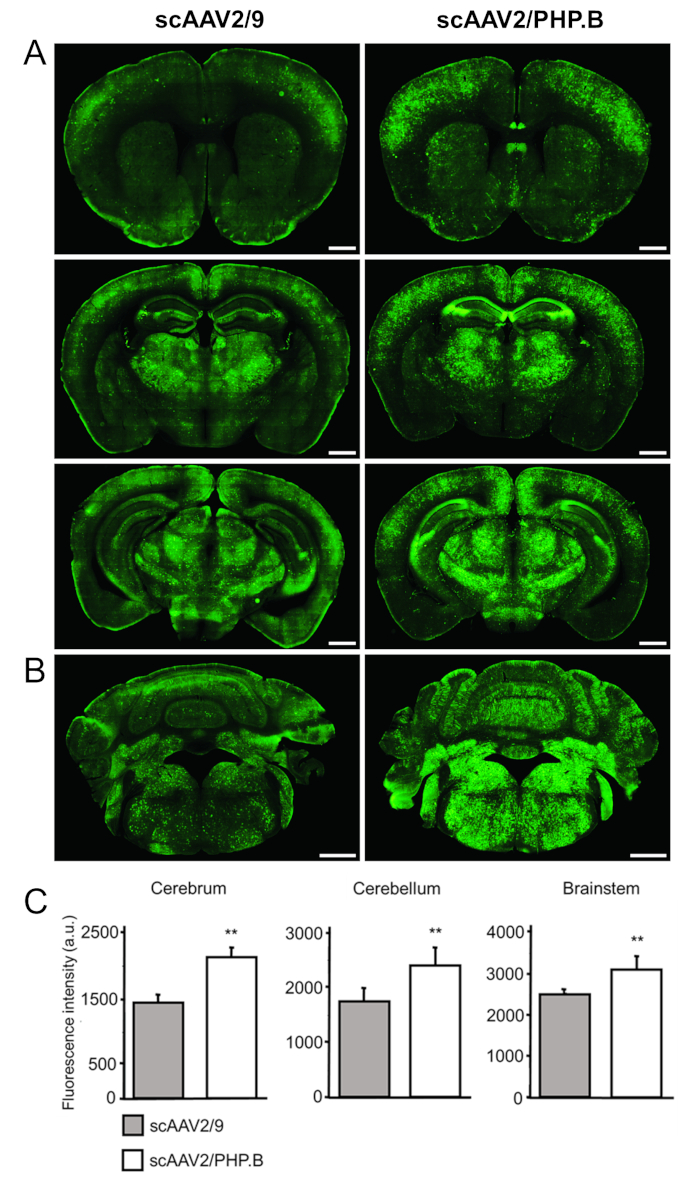
Figura 4: entrega sistémica de scAAV2/PHP. B-CBA-GFP conduce a una alta expresión de GFP en el SNC. scAAV2/PHP. B-CBA-GFP o scAAV2/9-CBA-GFP (1 x 1012 vg/ratón) fue administrado a ratones C57/Bl6 de 6 semanas de edad vía la inyección de la vena de la cola. GFP fue detectada usando immunohistochemistry en postinjection de 3 semanas de secciones coronales de cerebro. (A) el cerebro y (B) se muestran el cerebelo y el tronco encefálico. Barras de escala = 1 mm. (C) se realizó la cuantificación de la intensidad de fluorescencia relativa para determinar los niveles de señal GFP conseguido cada vector (10 secciones por ratón; tres ratones por grupo del vector). Se realizó una prueba ANOVA unidireccional, seguido de un Student dos colas t-prueba; los datos se expresan como media ± desviación estándar; p < 0.01; au. unidades arbitrarias. pCapsid, utilizado para la producción del vector AAV, contiene el gen rep de serotipo 2 y el gen cap de serotipo PHP. B o AAV9, por consiguiente. Esta figura ha sido modificada desde Rincon et al.32. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La producción de vectores AAV recombinantes descritos aquí utiliza materiales y equipos comunes a la mayoría de los laboratorios de biología molecular e instalaciones de cultivo de células. Permite al usuario obtener vectores AAV grado puro, preclínica que se pueden utilizar para varios tipos de células y tejidos de destino a través de una gama de aplicaciones in vitro e in vivo . Una de las mayores ventajas de este protocolo, comparado con otros (es decir, basado en el CsCl purificación), es el más corto tiempo de trabajo necesario. Vectores AAV listo para su uso son obtenibles en un plazo máximo de 6 días hábiles después de la inicial de la transfección de células HEK293T.
Varios factores pueden influir negativamente el rendimiento final o la calidad de los vectores AAV. Eficiencia de transfección deficiente es una de las principales razones de bajo rendimiento viral33. Una recomendación importante es la utilización de células HEK293T que no han sido pasados más de 20 veces y no tienen una confluencia celular superior al 90% en el momento de transfección21. Además, el método de transfección seleccionado tiene un impacto importante en los resultados. Este protocolo se basa en el uso del PEI. El PEI es un polímero catiónico con la capacidad de entregar ADN exógeno en el núcleo de la célula a través de la generación de complejos de ácido nucleico, conocido como polyplexes, que son tomados por la célula y son objeto de trata a través de endosomas34y polímero. Basado en el PEI la transfección es fácil y rápido de realizar, en contraste con otros métodos utilizados, como la coprecipitación de ADN con fosfato de calcio35. También, basado en el PEI la transfección es mucho más barata comparado con otros métodos recién introducidas, como el uso de lípidos catiónicos y transfección mediada por el imán de36.
La estrategia de purificación desempeña un papel clave en el protocolo. En comparación con otros métodos, basado en el iodixanol purificaciones tienden a contienen un mayor porcentaje de partículas virales vacías (20%)20. Esto se compensa, en un grado, por el hecho de que base de iodixanol purificación resulta habitualmente en preparaciones de vector AAV con una proporción de partículas a la infectividad de menos de 100. Esto representa una mejora significativa en comparación con los procedimientos convencionales basados en CsCl, que substancial pérdida de infectividad de la partícula es reportado37. Otro método alternativo común para purificar los vectores AAV es purificación basados en cromatografía. Sin embargo, este método tiene el gran inconveniente que una columna específica se requiere para cada cápside de vector utilizado: por ejemplo, mientras que AAV2 es clásico aislados utilizando columnas de heparina, esta metodología no funciona con AAV4 y AAV5, que no poseen heparina sitios en su cápsida38. Teniendo en cuenta que la purificación cromatografía también es costosa, purificación de iodixanol es generalmente más conveniente para los laboratorios que deseen producir lotes de alta calidad de vectores AAV en una pequeña escala33,39, 40. sin embargo, para maximizar el rendimiento final y la pureza del vector, es necesario mucho cuidado al hacer los gradientes de iodixanol. Las diferentes fracciones de iodixanol deben transferirse al ultracentrifugación tubo con una pipeta Pasteur estéril cuya punta toca la pared del tubo: iodixanol debe ser expulsado de la pipeta lentamente y continuamente. Como las partículas de vector se acumulan en la capa de iodixanol 40%, cuidado debe ser tomado para asegurar que las interfaces de gradiente no mezclen20. Finalmente, la fracción que contiene el vector debe ser recuperada por la inserción de una aguja Roma de acero inoxidable con un calibre no mayor que 20 G. Para maximizar la recuperación del vector, la fracción claro deberá ser recuperada en su totalidad. Durante este paso, el tiempo es crítico. Para evitar comprometer la pureza de la preparación, es fundamental para detener la colección antes de otras fases (contaminantes) del degradado que se recogen.
Las diferencias en el título del vector obtenido pueden atribuirse también a la capacidad intrínseca del vector para producir partículas de envasados. Una comparación entre diferentes serotipos AAV mostró que algunos vectores AAV son más difíciles de producir en un título más alto que otros (por ejemplo, AAV2)41. Precipitación del vector, durante la etapa de desalación, puede ser una posible razón de un título menor y fácilmente prevenir evitando concentración33. Por otra parte, también es posible que la eficiencia de purificación basados en gradiente de iodixanol difiere ligeramente entre serotipos y, por lo tanto, se pueden observar discrepancias en el título obtenido con diferentes serotipos41.
Finalmente, debe señalarse que a pesar de qPCR es un método muy preciso de cuantificación de ADN se observa cierta variabilidad inherente en la técnica. Exactitud en la valoración depende principalmente de la pipeteo preciso y Vortex adecuada de las soluciones. Para garantizar el título más preciso de la lectura, se puede repetir la qPCR independientemente, y un promedio de los valores obtenidos. La elección de primers presentadas en este protocolo se basa en la secuencia del promotor CBA en el plásmido pTransgene utilizado en nuestro laboratorio. El promotor de la CBA es un fuerte promotor sintético que es ampliamente utilizado en el campo del vector a la expresión de la unidad a través de múltiples tipos de células. Incorpora varios elementos, incluyendo el elemento potenciador temprano del citomegalovirus (CMV); el promotor, primer exón y el primer intrón del gene del CBA; y el aceptador del empalme del gene del β-globin de conejo. Sin embargo, se pueden diseñar cartillas para prácticamente cualquier elemento ubicado en el casete de expresión (incluyendo el promotor transgénico y elementos reguladores). La comparación del título a través de lotes de también es posible, proporcionar cartillas se utilizan contra las regiones comunes a los vectores en cuestión.
En conclusión, este protocolo puede utilizarse para producir vectores AAV con una variedad de cápsida, configuraciones de genoma, promotor tipos y cargas de transgenes. Esto permitirá a los usuarios para adaptarse fácilmente a las características finales de sus vectores para satisfacer mejor las necesidades experimentales. En el ejemplo presentado en los resultados representativos, el uso de PHP. Cápside de B, que cruza eficientemente el BBB, dio expresión génica altamente eficiente en el SNC, la siguiente cola vena inyección32. La administración sistémica de vectores penetrantes del CNS tiene ventajas considerables en términos de posibles efectos secundarios2,17,32. Una posible alternativa a la inyección periférica, evitando las salvedades de técnicas invasivas, es la entrega intratecal, que consiste en entrega del vector AAV en el líquido cefalorraquídeo. Esta ruta de entrega ha demostrado para ser eficaz, mostrando expresión generalizada del transgen en el SNC, menos efectos off-target en órganos periféricos y bajos niveles de respuesta inmune42. Sin embargo, las inyecciones intratecales son mucho más difícil, ya que requieren mayores conocimientos técnicos que la inyección de la vena de la cola.
Desarrollo posterior de la cápside a perfeccionar esta tecnología será conducido por las oportunidades para el uso del vector AAV en usos de la terapia génica. Estos enfoques ofrecen atractivas posibilidades para tratar trastornos de CNS actualmente incurables, como la esclerosis lateral amiotrófica, enfermedad de Charcot-Marie-Tooth, enfermedad de Parkinson y la enfermedad de Alzheimer18.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
M.R. es apoyado por un Fonds voor beca postdoctoral Wetenschappelijk Onderzoek Flandes (FWO) (133722/1204517N) y reconoce el apoyo continuo de la Fundación Cardiovascular de Colombia y el Departamento Administrativo de ciencia, Tecnología e innovación (Grant CT-FP44842-307-2016, código de proyecto 656671250485). M.M. es apoyado por una Beca doctoral FWO (1S48018N). M.G.H. fue apoyado por una beca institucional VIB y apoyo externo de la Fundación de Letrán de Thierry (SOD-VIP), la Fundación para la investigación de Alzheimer (SAO-FRA) (P #14006), FWO (Grant 1513616N) y el Consejo Europeo de investigación (CEI) (Starting Grant 281961 - AstroFunc; Prueba de concepto subvención 713755 - AD-VIP). Los autores reconocen Jeason Haughton por su ayuda con la cría de ratón, Stephanie Castaldo por su ayuda realizar las inyecciones de vena de la cola y Caroline Eykens para proporcionar las imágenes de células HEK293T transfected. M.G.H. reconoce Michael Dunlop, Peter Hickman y Dean Harrison.
Materiales
| Name | Company | Catalog Number | Comments |
| Plasmid production | |||
| pTransgene plasmid | De novo design or obtained from a plasmid repository | N/A | See step 1 of main protocol for further details |
| pCapsid | De novo design or obtained from a plasmid repository | N/A | See step 1 of main protocol for further details |
| pHelper | Agilent | 240071 | |
| Plasmid Plus maxi kit | Qiagen | 12963 | |
| QIAquick PCR purification Kit | Qiagen | 28104 | |
| AAV Helper-Free System | Agilent | 240071 | |
| Cell culture and transfection | |||
| Dulbecco’s Modified Eagle Medium (DMEM), high glucose, no glutamine | Life technologies | 11960-044 | Supplement DMEM with FBS (1% or 10% v/v) and GlutaMAX 200 mM (1% v/v) then filter sterilize the medium using a 0.22 µm filter |
| Fetal bovine serum (FBS) | GIBCO | 10500-064 | |
| GlutaMAX supplement | GIBCO | 35050038 | |
| (200 mM) | |||
| Corning bottle-top vacuum filter system | Sigma-Aldrich | CLS430769 | |
| Dulbecco’s Phosphate Buffered Saline (DPBS) with no calcium and no magnesium | GIBCO | 14190094 | |
| HEK293T cells | American Tissue Culture Collection | CRL3216 | Upon receipt, thaw the cells and culture as described in the protocol. After a minimal number of passages, freeze a subfraction for future in aliquots. Always use cells below passage number 20. Once cultured cells have been passaged more than 20 times, restart a culture from the stored aliquots |
| Cell culture dishes | Greiner Cellstar | 639160 | 15 cm diameter culture dishes |
| Cell scrapers | VWR | 10062-904 | |
| Polyethylenimine (PEI) | Polyscience | 23966-2 | PEI in powder form is dissolved at 1 µg/µL in deionized water (ddwater) at pH=2 (use HCl). Prepare in a beaker and stir for 2-3 h. When dissolved, bring the pH back to 7 with NaOH. Filter sterilize and store the resuspended stock solution in 1 ml aliquots at -20 °C. PEI aliquots can be freeze/thawed multiple times. |
| Virkon solution | Fisher Scientific | NC9821357 | Disinfect any material that has been in contact with assembled vector particles with Virkon solution |
| Mutexi long-sleeve aprons | Fisher Scientific | 11735423 | Wear an apron over the top of a regular lab coat |
| Fisherbrand maximum protection disposable overshoes | Fisher Scientific | 15401952 | |
| AAV Purification and desalting | |||
| Optiprep density gradient medium | Sigma-Aldrich | D1556 | Optiprep is a 60% (w/v) solution of iodixanol in water (sterile). CAUTION. Use under a laminar flow hood. Wear gloves |
| Phenol red | Sigma-Aldrich | P0290 | CAUTION. Use under a laminar flow hood |
| Pasteur pipette | Sigma-Aldrich | Z627992 | Sterilize before use |
| OptiSeal Polypropylene tubes | Beckman | 361625 | |
| Benzonase (250 U/µL) | Sigma-Aldrich | E1014 | Supplied as a ready-to-use solution |
| Acrodisc syringe filter | Pall corporation | 4614 | |
| Omnifix syringe (5 mL) | Braun | 4617053V | |
| Blunt syringe needle | Sigma Aldrich | Z261378 | Stainless steel 316 syringe needle, pipetting blunt 90° tip gauge 16, L 4 in. Referred to in the text as a blunt-end needle |
| Aqua Ecotainer | B. Braun | 0082479E | Sterile endotoxin-free water. Referred to as 'Ultrapure water' |
| Amicon ultra-15 centrifugal filter unit | Millipore | UFC910024 | These filters concentrate the final product by collecting the vector particles in consecutive centrifugation steps |
| Pluronic F68 (100x) | Thermo Fisher | 24040032 | Non-ionic surfactant. Dilute in sterile PBS to use at 0.01% (v/v) |
| Fisherbrand Sterile Microcentrifuge Tubes with Screw Caps (2 mL) | Fisher Scientific | 02-681-374 | Use skirted tubes for easy handling |
| AAV Titration | |||
| Restriction enzyme: StuI (10 U/µL) | Promega | R6421 | |
| DNAse I (1 U/µL) | Fisher Scientific | EN0521 | |
| Proteinase K | Sigma-Aldrich | 3115852001 | Reconstitute in ultrapure water and use at a final concentration of 10 mg/mL. Solution can be stored at -20 °C |
| EasyStrip Plus Tube Strips (with attached caps) | Fisher Scientific | AB2000 | |
| Eppendorf microtube 3810x | Sigma-Aldrich | Z606340-1000EA | |
| LightCycler 480 SYBR Green I Master Mix | Roche | 4707516001 | |
| LightCycler Multiwell Plates, 96 wells | Roche | 4729692001 | White polypropylene plate (with unique identifying barcode) |
| Microseal 'A' PCR plate and PCR Plate Sealing Film | Bio-Rad | msa5001 | |
| AAV Purity control | |||
| Ammonium persulfate (APS) | Sigma-Aldrich | A3678 | Reconstitute in ultrapure water to 10% (v/v). CAUTION. Use under a laminar flow hood. Wear gloves |
| Tetramethylethylenediamine (TEMED) | Sigma-Aldrich | T9281 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Tris Base ULTROL Grade | Merck | 648311 | CAUTION: Use under a laminar flow hood. Wear gloves |
| UltraPure Agarose | Thermo Fisher | 16500-500 | |
| Rotiphorese® Gel 30 (37,5:1) | Carl Roth | 3029.3 | Aqueous 30% acrylamide and bisacrylamide stock solution at a ratio of 37.5:1. CAUTION: Use under a laminar flow hood. Wear gloves |
| Serva Blue G | Sigma-Aldrich | 6104-58-1 | |
| Precision Plus prestained marker | Bio-Rad | 1610374edu | |
| 1-Butanol | Sigma-Aldrich | B7906 | CAUTION: Use under a laminar flow hood. Wear gloves |
| Immunohistochemistry | |||
| Rabbit anti-GFP | Synaptic Systems | 132002 | 1:300 dilution |
| Anti-rabbit Alexa Fluor 488 | Invitrogen | A21206 | 1:1,000 dilution |
| Equipment | Company | Catalog number | Comments |
| Vector production lab | |||
| Rotina 380 bench-top centrifuge * | Hettich | 1701 | |
| Optima XPN 80 ultracentrifuge * | Beckmann Coulter | A95765 | |
| Type 50.2 Ti fixed-angle titanium rotor * | Beckmann Coulter | 337901 | |
| Entris digital scale * | Sartorius | 2202-1S | |
| Warm water bath * | Set at 37 °C | ||
| Ice bucket * | VWR | 10146-290 | Keep material used in the vector production lab separate from that used in standard lab areas |
| Pipetboy pro * | Integra | 156,400 | |
| Graduated pipettes: Cell star * | Greiner bio-one | 606180 | Capacity of 5 mL |
| Graduated pipettes: Cell star * | Greiner bio-one | 607180 | Capacity of 10 mL |
| Graduated pipettes: Cell star * | Greiner bio-one | 760180 | Capacity of 25 mL |
| CO2 incubator CB150 * | Binder | 9040-0038 | Set at 37 °C, 5% CO2 and 95% humidity |
| Nuaire safety cabinet NU 437-400E * | Labexchange | 31324 | Clean all the surfaces with 70% ethanol and Virkon before and after use |
| Conventional lab | |||
| T100 thermal cycler * | Bio-Rad | 1861096 | |
| LightCycler 480 Instrument II * | Roche | 5015278001 | |
| ThermoMixer * | Eppendorf | C 5382000015 | |
| Nanodrop * | ThermoFisher Scientific | ND 2000 | |
| Mini-Protean Tetra Cell* | Bio-Rad | 1658001FC | For use with handmade or precast gels |
| ProteoSilver silver stain kit | Sigma-Aldrich | PROTSIL1 | High sensitivity protein detection with low background |
| Centrifuge 5804 R * | Eppendorf | B1_022628045 | High speed centrifuge for medium capacity needs (up to 250 mL) |
| Graduated pipettes Cell star * | Greiner bio-one | 606180 | 5 mL |
| Graduated pipettes Cell star * | Greiner bio-one | 607180 | 25 mL |
| Graduated pipettes Cell star * | Greiner bio-one | 760180 | 25 mL |
| Filter tips * | Greiner bio-one | 750257 | 1250 µL |
| Filter tips * | Greiner bio-one | 738257 | 300 µL |
| Filter tips * | Greiner bio-one | 771257 | 10 µL |
| Ice bucket with lid * | VWR | 10146-290 | |
| Mini diaphragm vacuum pump, VP 86 * | VWR | 181-0065 | |
| Pipetman P2 | Gilson | F144801 | |
| Pipetman P20 | Gilson | F123600 | |
| Pipetman P100 | Gilson | F123615 | |
| Pipetman P200 | Gilson | F123601 | |
| Pipetman P1000 | Gilson | F123602 | |
| * Materials marked with an asterisk are expensive pieces of equipment and are usually central infrastructure items shared between multiple labs. These items can also be replaced by equivalents if available. Note, when a different ultracentrifuge is used, care must be taken to select the correct rotor and centrifuge tubes. |
Referencias
- Daya, S., Berns, K. I. Gene Therapy Using Adeno-Associated Virus Vectors. Clinical Microbiology Reviews. 21 (4), 583-593 (2008).
- Duque, S., et al. Intravenous Administration of Self-complementary AAV9 Enables Transgene Delivery to Adult Motor Neurons. Molecular Therapy. 17 (7), 1187-1196 (2009).
- Bourdenx, M., Dutheil, N., Bezard, E., Dehay, B. Systemic gene delivery to the central nervous system using Adeno-associated virus. Frontiers in Molecular Neuroscience. 7, (2014).
- Kantor, B., McCown, T., Leone, P., Gray, S. J. Clinical Applications Involving CNS Gene Transfer. Advances in Genetics. 87, 71-124 (2014).
- Crystal, R. G. Adenovirus: The First Effective In Vivo Gene Delivery Vector. Human Gene Therapy. 25 (1), 3-11 (2014).
- Weinberg, M. S., Samulski, R. J., McCown, T. J. Adeno-associated virus (AAV) gene therapy for neurological disease. Neuropharmacology. 69, 82-88 (2013).
- Henckaerts, E., Linden, R. M. Adeno-associated virus: a key to the human genome?. Future Virology. 5 (5), 555-574 (2010).
- Howarth, J. L., Lee, Y. B., Uney, J. B. Using viral vectors as gene transfer tools (Cell Biology and Toxicology Special Issue: ETCS-UK 1 day meeting on genetic manipulation of cells). Cell Biology and Toxicology. 26 (1), 1-20 (2010).
- Nathwani, A. C., et al. Adenovirus-Associated Virus Vector-Mediated Gene Transfer in Hemophilia B. The New England Journal of Medicine. 365 (25), 2357-2365 (2011).
- Carter, B. J. Adeno-associated virus and the development of adeno-associated virus vectors: a historical perspective. Molecular Therapy. 10 (6), 981-989 (2004).
- Schambach, A., Zychlinski, D., Ehrnstroem, B., Baum, C. Biosafety Features of Lentiviral Vectors. Human Gene Therapy. 24 (2), 132-142 (2013).
- Van Vliet, K. M., Blouin, V., Brument, N., Agbandje-McKenna, M., Snyder, R. O. The Role of the Adeno-Associated Virus Capsid in Gene Transfer. Methods in Molecular Biology. 437, 51-91 (2008).
- Rincon, M. Y., VandenDriessche, T., Chuah, M. K. Gene therapy for cardiovascular disease: advances in vector development, targeting, and delivery for clinical translation. Cardiovascular Research. 108 (1), 4-20 (2015).
- Samulski, R. J., Muzyczka, N. AAV-Mediated Gene Therapy for Research and Therapeutic Purposes. Annual Review of Virology. 1 (1), 427-451 (2014).
- McCarty, D. M. Self-complementary AAV Vectors; Advances and Applications. Molecular Therapy. 16 (10), 1648-1656 (2008).
- Choi, J. H., et al. Optimization of AAV expression cassettes to improve packaging capacity and transgene expression in neurons. Molecular Brain. 7, 17 (2014).
- Deverman, B. E., et al. Cre-dependent selection yields AAV variants for widespread gene transfer to the adult brain. Nature Biotechnology. 34 (2), 204-209 (2016).
- Jackson, K. L., Dayton, R. D., Deverman, B. E., Klein, R. L. Better Targeting, Better Efficiency for Wide-Scale Neuronal Transduction with the Synapsin Promoter and AAV-PHP.B. Frontiers in Molecular Neuroscience. 9, (2016).
- Lock, M., et al. Versatile Manufacturing of Recombinant Adeno-Associated Viral Vectors at Scale. Human Gene Therapy. 21 (10), 1259-1271 (2010).
- Strobel, B., Miller, F. D., Rist, W., LamLa, T. Comparative Analysis of Cesium Chloride- and Iodixanol-Based Purification of Recombinant Adeno-Associated Viral Vectors for Preclinical Applications. Human Gene Therapy Methods. 26 (4), 147-157 (2015).
- Jungmann, A., Leuchs, B., Katus, H. A., Rommelaere, J., Müller, O. J. Protocol for efficient generation and characterization of adeno-associated viral (AAV) vectors. Human Gene Therapy Methods. , (2017).
- Tolmachov, O. Designing Plasmid Vectors. Methods in Molecular Biology. 542, 117-129 (2009).
- . QIAGEN Plasmid Purification Handbook Available from: https://www.qiagen.com/us/resources/download.aspx?id=46205595-0440-459e-9d93-50eb02e5707e&lang=en (2018)
- Lock, M., Alvira, M. R., Chen, S. J., Wilson, J. M. Absolute Determination of Single-Stranded and Self-Complementary Adeno-Associated Viral Vector Genome Titers by Droplet Digital PCR. Human Gene Therapy Methods. 25 (2), 115-125 (2014).
- . ProteoSilver Silver Stain Kit (PROTSIL1) - Bulletin, ProteoSilver Available from: https://www.sigmaaldrich.com/content/dam/sigma-aldrich/docs/Sigma/Bulletin/protsil1bul.pdf (2018)
- Machholz, E., et al. Manual Restraint and Common Compound Administration Routes in Mice and Rats. Journal of Visualized Experiments. (67), e2771 (2012).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Puntel, M., et al. Gene transfer into rat brain using adenoviral vectors. Current Protocols in Neuroscience. 50 (1), (2010).
- Bachman, J. Immunohistochemistry on Freely Floating Fixed Tissue Sections. Methods in Enzymology. 533, 207-215 (2013).
- Hordeaux, J., et al. The Neurotropic Properties of AAV-PHP.B Are Limited to C57BL/6J Mice. Molecular Therapy. 26 (3), 664-669 (2018).
- Rincon, M. Y., et al. Widespread transduction of astrocytes and neurons in the mouse central nervous system after systemic delivery of a self-complementary AAV-PHP.B vector. Gene Therapy. 25 (2), 83-92 (2018).
- Crosson, S. M., Dib, P., Smith, J. K., Zolotukhin, S. Helper-free Production of Laboratory Grade AAV and Purification by Iodixanol Density Gradient Centrifugation. Molecular Therapy. Methods & Clinical Development. 10, 1-7 (2018).
- Merdan, T., Kunath, K., Fischer, D., Kopecek, J., Kissel, T. Intracellular processing of poly(ethylene imine)/ribozyme complexes can be observed in living cells by using confocal laser scanning microscopy and inhibitor experiments. Pharmaceutical Research. 19 (2), 140-146 (2002).
- Meissner, P., et al. Transient gene expression: recombinant protein production with suspension-adapted HEK293-EBNA cells. Biotechnology and Bioengineering. 75 (2), 197-203 (2001).
- Reed, S. E., Staley, E. M., Mayginnes, J. P., Pintel, D. J., Tullis, G. E. Transfection of mammalian cells using linear polyethylenimine is a simple and effective means of producing recombinant adeno-associated virus vectors. Journal of Virological Methods. 138 (1-2), 85-98 (2006).
- Zolotukhin, S., et al. Recombinant adeno-associated virus purification using novel methods improves infectious titer and yield. Gene Therapy. 6 (6), 973-985 (1999).
- Kaludov, N., Handelman, B., Chiorini, J. A. Scalable Purification of Adeno-Associated Virus Type 2, 4, or 5 Using Ion-Exchange Chromatography. Human Gene Therapy. 13 (10), 1235-1243 (2002).
- Nass, S. A., et al. Universal Method for the Purification of Recombinant AAV Vectors of Differing Serotypes. Molecular Therapy. Methods & Clinical Development. 9, 33-46 (2017).
- Qu, G., et al. Separation of adeno-associated virus type 2 empty particles from genome containing vectors by anion-exchange column chromatography. Journal of Virological Methods. 140 (1-2), 183-192 (2007).
- Holehonnur, R., et al. Adeno-associated viral serotypes produce differing titers and differentially transduce neurons within the rat basal and lateral amygdala. BMC Neuroscience. 15, 28 (2014).
- Wang, H., et al. Widespread spinal cord transduction by intrathecal injection of rAAV delivers efficacious RNAi therapy for amyotrophic lateral sclerosis. Human Molecular Genetics. 23 (3), 668-681 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados