Method Article
Un análisis de alto rendimiento para evaluar y cuantificar la formación de neutrófilos trampa extracelular
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe un ensayo de neutrófilos trampa extracelular (red) altamente sensible y de alto rendimiento para la cuantificación semiautomática de ex vivo red formación por microscopia confocal tridimensional de la inmunofluorescencia. Este protocolo puede utilizarse para evaluar la red formación y degradación después de diferentes estímulos y se puede utilizar para estudiar terapias potenciales orientada en la red.
Resumen
Neutrófilos trampas extracelulares (redes) son estructuras de ADN extracelulares inmunogénicas que pueden ser liberadas por neutrófilos en una amplia variedad de factores desencadenantes. Las redes se han demostrado para servir como un mecanismo de defensa del huésped importante que atrapa y mata microorganismos. Por el contrario, han sido implicados en enfermedades autoinmunes sistémicas diversas. Las redes son estructuras inmunogénicas y tóxicos que contienen un grupo de autoantígenos relevantes, incluidos los anticuerpos citoplásmicos del anti-neutrófilo (ANCA)-asociado (AAV) la vasculitis y lupus eritematoso sistémico (les). Diferentes formas de redes pueden ser inducidas dependiendo del estímulo. La cantidad de redes puede ser cuantificada usando diferentes técnicas incluyendo medir la liberación de ADN en sobrenadantes, medición de ADN-complexed con las moléculas de la red como la mieloperoxidasa (MPO) o elastasa (NE), medir la presencia de citrulinado histonas por microscopía de fluorescencia o detección de citometría de flujo de red-componentes todos los cuales tienen diferentes características en cuanto a su especificidad, sensibilidad, objetividad y cantidad. Aquí es un protocolo para cuantificar ex vivo red formación de forma altamente sensible, de alto rendimiento mediante el uso de microscopia confocal de la inmunofluorescencia tridimensional. Este protocolo se puede aplicar para hacer frente a varias preguntas de investigación sobre formación de neto y degradación en la salud y la enfermedad.
Introducción
La formación de neutrófilos trampas extracelulares (redes) es el proceso en que neutrófilos liberan su ADN en una web de (3D) tridimensional extracelular como la estructura, formando complejos con una amplia gama de moléculas antimicrobianas y peligroso, granulares y las enzimas citoplasmáticas, péptidos y proteínas. Estas estructuras inmunogénicas y tóxicos tienen un papel fisiológico importante en la defensa inmune innata de los individuos sanos por atrapar y matar agentes patógenos infecciosos1. Sin embargo, también se han demostrado para ser implicados en la trombosis2 y varias enfermedades autoinmunes sistémicas, incluyendo los anticuerpos citoplásmicos del anti-neutrófilo (ANCA)-asociados (AAV) la vasculitis3, eritematoso de lupus sistémico (SLE )4,5, síndrome de antiphospholipid (APS)2,6, la artritis reumatoide (ar), psoriasis y gota7,8,9.
Formación red in vitro ha sido ampliamente estudiada con el forbol compuesto químico 12-miristato 13-acetato (PMA), que induce la formación de red masiva. Sin embargo más estímulos fisiológicos inducen niveles mucho más bajos de formación neta de10. Estudio red-disparadores en, por ejemplo, un escenario de enfermedad autoinmune, es necesario un ensayo estandarizado, sensible, de alto rendimiento para detectar y cuantificar la formación de la red. Cuantificación de las redes ha demostrado para ser un reto y actualmente se realiza por diferentes métodos, cada uno con sus propias ventajas y limitaciones11. Un método comúnmente usado es la detección de ADN en los sobrenadantes12, que es objetivo pero no discrimina entre el origen del ADN (apoptosis, necrosis, redes) y por lo tanto no es muy específico para redes. En segundo lugar, los análisis de enzima-ligado del inmunosorbente (ELISA) de ADN complejado con proteínas específicas de la red, por ejemplo, mieloperoxidasa (MPO) o elastasa (NE), son un enfoque más específico para detectar redes y fueron demostrados que correlaciona bien con citrulinado histona-3 (CitH3) positivo redes13. Sin embargo, no se sabe si este método es lo suficientemente sensible como para recoger todas las redes (por ejemplo, MPO, NE y CitH3 redes negativas). Un tercer enfoque es la microscopia de la inmunofluorescencia que se utiliza para detectar la colocalización de moléculas asociada a la red (NE, MPO, CitH3) con el ADN extracelular para cuantificar las redes. Este método es generalmente específico para redes, pero no puede aplicarse como un método de alto rendimiento y no es objetivo debido a diagonal del observador. Además, este método no tiene en cuenta MPO-, NE-, redes de CitH3-negativo que se presenta con frecuencia dependiendo de la red-gatillo usado14,15. Métodos de citometría de flujo detectan las redes a través de una dispersión hacia delante/hacia un lado cambiante (FSC/SSC) que indica inflamación del núcleo en red-ting neutrófilos16. Este método no tiene en cuenta las diferentes formas de formación red que han sido identificados, que no podría presentar inflamación del núcleo, como formación red vital17. Por último, microscopia confocal de la inmunofluorescencia se ha aplicado para visualizar y cuantificar neta formación manchando directamente ADN extracelular con un celular impermeable colorante que tiñe de12,de ADN extracelular18. Por lo general, 5 a 10 campos de alta potencia manualmente y los evaluados, que cubre 1-5% de cada pocillo de una placa de 96 pocillos11,17. Selección manual de imágenes no es siempre objetiva, propenso al sesgo y no atractivo para el análisis de alto rendimiento. Recientemente se desarrolló un ensayo de cuantificación de red automatizada, alto rendimiento, que imagen 11% del pozo de forma 3D que cubre 13 μm a través de microscopía confocal inmunofluorescencia Z apilados, lo lleva a una técnica altamente sensible para evaluar redes en comparación con los métodos convencionales10. El actual informe describe el protocolo más reciente para cuantificar la formación de red a través de un análisis automatizado, altamente sensible usando microscopia confocal 3D, que alcanza un área total de la imagen del 45% de cada bien y cubre 27 μm a través de pilas de Z. Este protocolo es conveniente cuantificar, con una alta sensibilidad, bajos niveles de formación de red de una manera imparcial y objetivo.
Protocolo
Todos los pacientes y controles sanos consintieron en participar en el Biobanco LUMC. Ambos estudios de biobancos fueron aprobados por el Comité de ética LUMC.
1. aislamiento de neutrófilos sanos
- Obtener 20 mL de sangre periférica de un donante sano en dos tubos recubiertos de EDTA de 10 mL.
- Poner 10 mL de sangre en un tubo estéril de 50 mL y añadir tamponada fosfato salino (PBS) hasta 32,5 mL.
-
Añadir el gradiente de densidad (por ejemplo,., amidotrizoaat de Ficoll) en las células.
- Tomar 14 mL de la densidad del gradiente con una pipeta de 10 mL y pipeta controlador.
- Coloque la pipeta en el fondo del tubo de 50 mL.
- Quite la pipeta de la pipeta, permitiendo que el gradiente de densidad salga de la pipeta por gravedad hasta el máximo por efecto capilar (1-2 mL va a dejar), sin usar el motor.
- Retire la pipeta un dedo pulgar encima de la pipeta, evitando gradiente de densidad de escaparse hacia fuera durante el retiro de la pipeta.
- Girar los tubos por 20 min a 912 x g y temperatura ambiente (RT) sin aceleración o freno.
Nota: Neutrófilos y células de sangre rojas (RBC) tienen una densidad alta y en la parte inferior del tubo de 50 mL. Las células mononucleares de sangre periférica (PBMCs) son separados y en la parte superior del gradiente de densidad como un anillo blanco. Plasma diluido en PBS estará por encima de las PBMCs. Si es necesario, pueden aislarse PBMCs transfiriendo el anillo blanco a un nuevo tubo de 50 mL con pasos adicionales lavado con PBS. - Retire con cuidado el anillo blanco que contiene PBMCs en primer lugar, seguido por el retiro del plasma diluido en PBS y por último la capa de gradiente de densidad tanto como sea posible.
-
Para aislar los neutrófilos de la mezcla de neutrófilos/eritrocitos, lisar eritrocitos por agua destilada estéril fría.
- Tomar la botella de agua destilada estéril fría y una 10 x concentrado frasco de PBS de la nevera.
- Trabajar con rapidez para este paso. Añadir 36 mL de agua destilada estéril fría directamente sobre el precipitado y mezclar una vez cuidadosamente. Añadir 4 mL de PBS x 10 después de 20 s para preparar una solución isotónica. Mezclar una vez cuidadosamente.
- Girar el tubo durante 5 min a 739 x g y 4 ° C (para la eliminación de glóbulos rojos). Neutrófilos se pondrá en la pelotilla blanca.
- Descartar cuidadosamente el sobrenadante. Realizar paso 1.6.2 otra vez y asegúrese de que el sedimento se suspende correctamente.
- Girar el tubo por 5 min a 328 x g a 4 ° C.
- Cuidadosamente Quite el sobrenadante y resuspender el precipitado en 5 mL de PBS. Contar los neutrófilos y mantener en hielo.
Nota: Rendimiento esperado de 1 tubo de sangre (10 mL) es aproximadamente de 15 millones neutrófilos.
2. roja célula fluorescente etiquetado de neutrófilos
- Hacer una suspensión neutrófila neutrófilos 10 millones en 2 mL de PBS en un tubo de 15 mL.
- Hacer una solución de 2 mL de PBS con 4 μL de vinculador de célula fluorescente rojo de 2 μm (véase Tabla de materiales) en un tubo de 15 mL diferentes. Añadir suavemente la suspensión neutrófilo y mezclar cuidadosamente.
- Incubar en la oscuridad durante exactamente 25 minutos a 37 ° C para etiquetar los neutrófilos con el vinculador de célula fluorescente rojo.
- Desactivar el etiquetado mediante la adición de Medio RPMI 1640 con 10% de calor inactiva el suero bovino fetal (FCS) a temperatura ambiente hasta 15 mL y mezclar una vez cuidadosamente. Asegúrese de que el pellet se resuspendió cuidadosamente si una pelotilla ha formado.
- Girar el tubo durante 5 minutos a 328 x g y RT.
- Quite el sobrenadante y resuspender el precipitado en 5 mL de rojo de fenol libre RPMI 1640 medio que contiene FCS 2% y 10% P/S en RT. contar los neutrófilos.
Nota: Una pérdida de la célula del 50% puede ocurrir después de célula fluorescente rojo etiquetado.
3. inducción de la formación de neutrófilos trampa extracelular
- Haga una suspensión de 0.42 x 106 células/mL de rojo de fenol libre de FCS de 2% con Medio RPMI 1640 y 10% P/S.
- Añadir 37.500 neutrófilos 90 μl por pozo en una placa de fondo negro de 96 pocillos, plana.
- Añadir 10 μl del estímulo elegido (por ejemplo, los sueros de paciente) por triplicado para llegar a una concentración de 10% en el pozo. Incluir siempre un control negativo (mediana) por triplicado.
- Incubar en la oscuridad a 37 ° C durante el tiempo deseado, que van desde 30 min a 2, 4 ó 6 h. de incubación de 4 h se sugiere.
- Calcular el volumen necesario para añadir 25 μl de ADN impermeable de 5 μm tinte (véase Tabla de materiales), para llegar a una concentración final de 1 μm en el pozo. Hacer una predilución si es necesario en RPMI 1640 medio conteniendo 2% FCS y 10% P/S para obtener una concentración de 5 μm.
- Añada 25 μl de 5 μm impermeable ADN tinte 15 min antes de finalizar el tiempo de incubación. Continuar la incubación durante otros 15 minutos a 37 ° C en la oscuridad.
- Quite el sobrenadante (~ 125 μL) con mucho cuidado y guardar si es necesario. Añada 100 μl del 4% paraformaldehido (PFA). Mantener en la oscuridad y continuar inmediatamente con el paso 4.
4. red visualización con Microscopía Confocal inmunofluorescencia 3D de alta resolución, alto contenido
-
Configurar las opciones en el microscopio confocal de inmunofluorescencia haciendo clic en la configuración de la adquisición.
- Haga clic en la ficha configurar .
- Seleccione el objetivo y la cámara. Elegir el objetivo X Apo Lambda 10 con un modo de adquisición de un confocal agujero de alfiler μm 60.
- Haga clic en placa y seleccione la placa de 96 pocillos de plástico. Seleccionar los sitios para visitar y elegir un número fijo de sitios. Llenar en 3 columnas y 3 filas sin traslapo (0 μm), que cubren un total del 45% del pozo.
- Haga clic en adquisición. Seleccione Activar láser centrado. Seleccione Adquirir las Series Z serie y hora si es necesario.
- Haga clic en sitio Autofocus.
- Haga clic en énfasis en la parte inferior de la placa | Off-Set por el grueso de la parte inferior. Para que el pozo inicial encontrar la muestra, elegir el primer pozo adquirido. Para el enfoque automático de sitio, seleccione todos los sitios.
- Haga clic en longitudes de onda.
- El número de longitudes de onda, elija 2. Para el nivel de refinamiento de corrección del sombreado de TL, elija 2.
- 1 longitud de onda, seleccione rojo de Texas.
- Para las opciones de enfoque automático, seleccione láser con la compensación de Z, post laser offset 1.1 μm. uso Z-stack con una gama personalizada de 200-10.
- 2 longitud de onda, seleccione FITC.
- Para las opciones de enfoque automático, seleccione láser con desplazamiento Z desde w1 0 μm. uso Z-stack con una gama personalizada de 200-10.
- Para las opciones de adquisición, seleccione las series Z y máximo de la imagen de proyección 2D. Para las opciones de adquisición, seleccione corrección de sombreado | De.
- Seleccione serie Z. Seleccione el número de pasos: 10. Seleccione el tamaño de paso: 3 mm (rango total será de 27 μm).
-
Poner la placa en la microscopia confocal de la inmunofluorescencia.
- Haga clic en la pestaña de Ejecutar .
- Completar Descripción y nombre de la placa y elegir la ubicación de almacenamiento.
- Seleccionar los pozos que deben adquirirse.
- Haga clic en la pestaña de Ejecutar .
- Elegir el tiempo de exposición para Texas Red y FITC.
- Haga clic en Adquirir placa para iniciar la adquisición, que se llevará aproximadamente 1 h por placa.
5. Análisis de la formación neta de
- Utilice un programa diseñado para análisis de imágenes científicas multidimensionales (véase Tabla de materiales) para analizar la formación de la red de procesamiento de imágenes.
- Transferencia de los datos adquiridos de la imagen a un disco duro separado.
-
Seleccione el herramienta de color.
- Seleccionar w1 y elegir la carpeta en el disco duro donde se almacenan los datos.
- Seleccione w2 y elegir la carpeta en el disco duro donde se almacenan los datos.
Nota: Utilice una macro estándar que w1 se utiliza en el nombre del archivo para agregar color rojo a las imágenes de Texas Red y w2 se utiliza para agregar el color verde a las imágenes FITC.
-
Seleccione la Macro de análisis.
- Seleccione w1, elija el valor de umbral (umbral de intensidad), que suele ser 10. Seleccione el valor del píxel deseada (umbral de tamaño, por ejemplo, 100).
- Seleccione w2, elija el valor de umbral (umbral de intensidad), que suele ser 10. Seleccione el valor del píxel deseada (umbral de tamaño, por ejemplo, 500).
- Elija el destino para el archivo de hoja de cálculo, realizar análisis y guardar archivos de registro luego.
- Analizar los datos en una hoja de cálculo.
Resultados
Formación de neutrófilos trampa extracelular (NET) se cuantifica de una manera 3D mediante la cuantificación de ADN extracelular manchada sobre 10 Z-pilas con 3 Distancias μm de partida en el plano focal en cada pozo. Midiendo el área acumulativo, la sensibilidad de los aumentos del ensayo (figura 1A). Los neutrófilos aislados tienen una pureza media del 98.7% con desviación estándar (SD) de 1.10% medido en 14 diferentes muestras de diferentes aislamientos. El porcentaje medio de células de sangre rojas es 1,04% ± 1.1% SD y el porcentaje medio de monocitos es de 0.085% ± 0,17% SD (datos no mostrados). El área total de neutrófilos manchadas imagen están cuantificados sólo en el plano focal de cada bien, que se correlacionó significativamente con el recuento total de neutrófilos en cada pozo con un coeficiente de correlación de Pearson de 0.99 (intervalo de confianza 95% [IC] 0.985-0.997, p < 0.0001) (figura 1B). El resultado representativo de cuantificación de neta formación en neutrófilos estimulados con 10% de sueros de pacientes AAV o intermedio (' Med ') como control negativo, expresado como acumulativa área manchada de ADN extracelular Z-pilas de más de 10 por imagen del neutrófilo (figura 1 C). se muestran instantáneas de imágenes representativas de neutrófilos sin estimular (figura 2A) y de redes en los neutrófilos estimulados por el AAV (figura 2B).
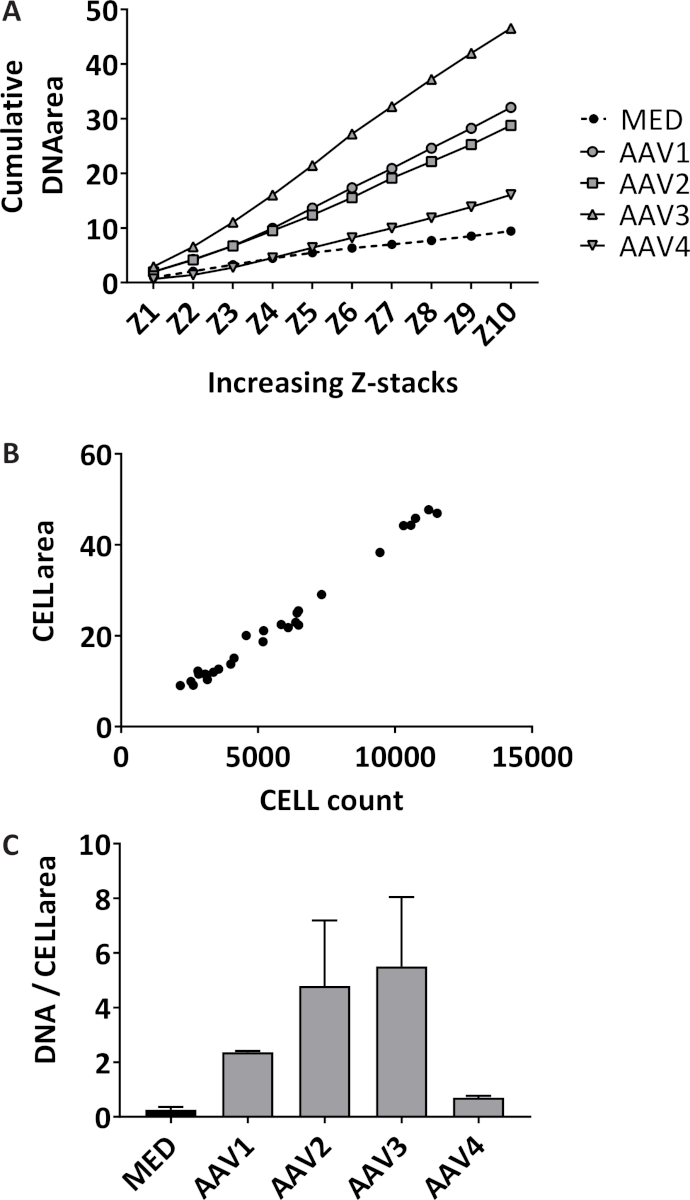
Figura 1: cuantificación de neta formación midiendo el DNA extracelular y recuento de neutrófilos de. (A) área acumulativamente se cuantifica sobre los 10 montones de Z para cada bien de neutrófilos sin estimular (MED) y de neutrófilos estimulados con 10% de suero de la vasculitis P-ANCA-asociada pacientes (AAV) (n = 4) cuantificado con un programa de procesamiento de imágenes. Cada estímulo se analizó por triplicado, cada punto representa el valor medio. (B) rojo fluorescente con área y célula de conteo se cuantificaron en el plano focal de cada bien por el programa de procesamiento de imágenes (R2 = 0.99, p < 0.0001). (C) formación neta se expresa como área acumulado por imagen del neutrófilo (área de la célula). El error de estándar de la media ± de la media (SEM) de cada triplicado se traza por el estímulo. Haga clic aquí para ver una versión más grande de esta figura.
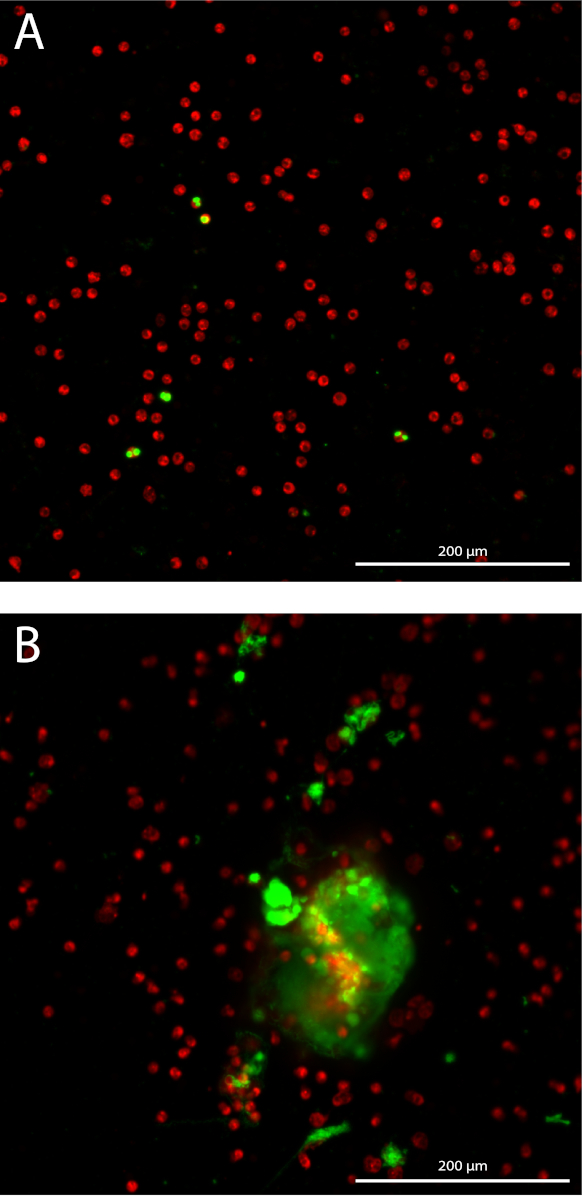
Figura 2: fotos del ensayo de cuantificación red. Neutrófilos con fluorescentes aparecen en rojo y manchado ADN extracelular se muestra en verde. 10 x objetivo Plan Apo Lambda. (A) neutrófilos sin estimular. (B) neutrófilos estimulados con suero AAV. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La parte más crítica de este ensayo es la necesidad de utilizar neutrófilos recién aisladas para cada experimento porque los neutrófilos son de breve duración y morir congelada. Esto requiere de un donante sano cada vez, que podría implicar algunas variaciones debido a las características de la donante. Una de estas variaciones es el estado de activación de los neutrófilos. Neutrófilos pueden activarse ya en vivo antes del aislamiento. Además, los neutrófilos pueden activarse a través de las medidas de aislamiento en particular durante la lisis de los eritrocitos, por lo tanto, un manejador experimentado de neutrófilos es necesaria para reducir al mínimo la activación de los neutrófilos. En general, aislamiento de los neutrófilos se debe realizar tan pronto como sea posible después de dibujo de la sangre y el experimento no debe ser pausado para evitar la excesiva activación espontánea. En segundo lugar, debe evitarse el manejo brusco de los neutrófilos. Como tal, la notable ventaja del protocolo descrito es las intervenciones mínimas de pipeteado una vez que los neutrófilos se siembran en una placa de 96 pocillos. Lo importante es el estado de activación de los neutrófilos se evalúa mejor en la condición sin estimular, en el cual este ensayo sensible puede detectar niveles bajos de formación red. Otro factor que podría influir en el ensayo es el uso de FCS en el medio. El porcentaje de FCS se ha reducido de 10% a 2% para evitar la posible supresión de la formación neta de antioxidante actividad19,20 o la posible activación de los neutrófilos a pesar de inactivación de calor. Cultura sin FCS o con los diferentes tipos de uso de los medios de comunicación no ha sido probada. Un control sin estimular o medio es siempre llevado al realizar el análisis para tener una indicación de la señal de fondo (por ejemplo estado de, la activación de los neutrófilos). Se muestra el aumento del doble para cada estímulo en comparación con la muestra sin estimular para lograr resultados consistentes sobre diferentes experimentos utilizando el mismo estímulo.
Un factor importante para un posible fondo alta es tinción de ADN extracelular que está relacionado con el proceso de formación de la red. El presente ensayo intenta reducir esto quitando la tinción de ADN extracelular inmediatamente después del período de incubación corto de 15 minutos y mediante el análisis de la placa directamente después de la fijación. Por lo tanto, es esencial usar un microscopio confocal avanzado que tiene suficiente velocidad y poder analítico para capturar la placa de 96 pocillos dentro de 1 a 2 h. automáticos se recomienda el ajuste del tiempo de exposición y enfoque. Como tal, el ajuste del microscopio puede variar entre cada muestra y experimentar en relación con el umbral de intensidad de color que es necesario para una calidad de imagen óptima en general. Las influencias de este último la capacidad eventual para cuantificar correctamente neutrófilos y redes y el ajuste óptimo por lo tanto, debe confirmarse mediante el uso de múltiples muestras de control (por ejemplo, suero de controles sanos). Durante el análisis de las imágenes captadas, el uso de un umbral de píxeles y tamaño umbral en el programa de análisis permite una mejor selección de formación de la red.
DNA extracelular derivado de la formación de la red puede ser el resultado de vías distintas de la muerte, incluyendo NETosis, necroptosis, pyroptosis, ferroptosis o incluso no lítico proceso de formación de red vital1. Así, una limitación del presente ensayo es que mediante tinción para ADN extracelular no hay ninguna diferenciación posible entre la formación neta y otras vías de muerte celular correspondiente. Es posible lograrlo usando ambos inhibidores selectivos de la vías distintas de la muerte para discriminar entre las diferentes formas en que se basa la formación neta o immunostainings independiente para confirmar la presencia de marcadores específicos de la red, como citH3 y NE, Co localizado con el ADN. La co-localización de DNA extracelular con citH3 y NE ha sido confirmado recientemente para este ensayo10. La ventaja de evitar netos marcadores específicos en este análisis, permite evaluar todas las formas de neta formación lleva a la extrusión de ADN por neutrófilos como completa y tan objetiva como sea posible con el potencial de proyección de alto rendimiento. La aplicabilidad de este protocolo se ha demostrado en el estudio de bajo nivel inducción red mediada por complejos inmunes en enfermedad autoinmune en la que la capacidad de detectar diferencias cualitativas y cuantitativas puede ser más importante que el tipo de proceso involucrados10,21,22. Ilustrar que este ensayo novela cuantificación neto puede ser de valor añadido para diversos investigadores investigar diversos aspectos de la formación neta de. Fácilmente se aplican pequeños ajustes en el análisis: ajustar el período de estimulación, el uso de un marcador neto favorito para centrarse en el camino de una muerte específica hacia la formación de la red, la utilización de diferentes aumentos o el uso de diferentes criterios netos en la cuantificación y el análisis.
En conclusión, el protocolo siempre es un ensayo ampliamente aplicable altamente sensible para la cuantificación semiautomática de neta formación para la evaluación de ex vivo la inducción de redes a diferentes estímulos.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
El trabajo de Eline J. Arends y Y.K. Onno Teng es apoyado por la fundación holandesa de riñón (17OKG04), beca clínica de la organización de países bajos para la investigación científica (90713460). Trabajo de Laura S. van Dam es apoyado por la Fundación para la investigación en Reumatología (FOREUM).
Materiales
| Name | Company | Catalog Number | Comments |
| Aqua Sterile H2O | B. Braun, Melsungen, Germany | 12604052 | |
| Fetal bovine serum (FCS) | Bodinco, Alkmaar, The Netherlands | Used in high concentrations it could influcence NET formation | |
| Ficoll 5.7% - amidotrizoaat 9% density 1.077 g/mL | LUMC, Leiden, The Netherlands | 97902861 | |
| Immunofluorescence confocal microscope | Image Xpress Micro Confocal (Molecular Devices, Sunnyvale, CA, USA) | ||
| Neutralization PBS (10x) | Gibco, Paisley, UK | 70011-036 | |
| Penicillin/streptomycin (p/s) | Gibco, Paisley, UK | 15070063 | |
| Phenol red free RPMI 1640 (1x) | Gibco, Paisley, UK | 11835-063 | Phenol red can interfere with the immunofluorescence signal |
| Phosphate-buffered saline (PBS) | B. Braun, Melsungen, Germany | 174628062 | |
| PKH26 2 μM Red fluorescent cell linker | Sigma Aldrich Saint-Louis, MO, USA | PKH26GL-1KT | PKH are patented fluorescent dyes and a cell labeling technology named after their discoverer Paul Karl Horan |
| Program for scientific multidimensional images analysis | ImageJ, Research Services Branch, National Institute of Mental Health, Bethesda, Maryland, USA | ||
| RPMI medium 1640 (1x) | Gibco, Paisley, UK | 52400-025 | |
| Sytox green 5 mM Impermeable DNA dye | Gibco, Paisley, UK | 57020 | |
| Trypan blue stain 0.4% | Sigma Aldrich, Germany | 17942E | |
| 96 well, black, flat bottom, tissue culture treated plate | Falcon, NY, USA | 353219 |
Referencias
- Jorgensen, I., Rayamajhi, M., Miao, E. A. Programmed cell death as a defence against infection. Nature Reviews Immunology. 17 (3), 151-164 (2017).
- Rao, A. N., Kazzaz, N. M., Knight, J. S. Do neutrophil extracellular traps contribute to the heightened risk of thrombosis in inflammatory diseases?. World Journal of Cardiology. 7 (12), 829-842 (2015).
- Kessenbrock, K., et al. Netting neutrophils in autoimmune small-vessel vasculitis. Nature Medicine. 15 (6), 623-625 (2009).
- Garcia-Romo, G. S., et al. Netting neutrophils are major inducers of type I IFN production in pediatric systemic lupus erythematosus. Science Translational Medicine. 3 (73), 73ra20 (2011).
- Lande, R., et al. Neutrophils activate plasmacytoid dendritic cells by releasing self-DNA-peptide complexes in systemic lupus erythematosus. Science Translational Medicine. 3 (73), 73ra19 (2011).
- Meng, H., Yalavarthi, S., et al. In Vivo Role of Neutrophil Extracellular Traps in Antiphospholipid Antibody-Mediated Venous Thrombosis. Arthritis & Rheumatology. 69 (3), 655-667 (2017).
- Desai, J., et al. Particles of different sizes and shapes induce neutrophil necroptosis followed by the release of neutrophil extracellular trap-like chromatin. Scientific Reports - Nature. 7 (1), 15003 (2017).
- Desai, J., et al. PMA and crystal-induced neutrophil extracellular trap formation involves RIPK1-RIPK3-MLKL signaling. European Journal of Immunology. 46 (1), 223-229 (2016).
- Apel, F., Zychlinsky, A., Kenny, E. F. The role of neutrophil extracellular traps in rheumatic diseases. Nature Reviews Rheumatology. , (2018).
- Kraaij, T., et al. A novel method for high-throughput detection and quantification of neutrophil extracellular traps reveals ROS-independent NET release with immune complexes. Autoimmunity Reviews. 15 (6), 577-584 (2016).
- Masuda, S., et al. NETosis markers: Quest for specific, objective, and quantitative markers. Clinica Chimica Acta. 459, 89-93 (2016).
- Brinkmann, V., Goosmann, C., Kuhn, L. I., Zychlinsky, A. Automatic quantification of in vitro NET formation. Frontiers in Immunology. 3, 413 (2012).
- Nakazawa, D., et al. Enhanced formation and disordered regulation of NETs in myeloperoxidase-ANCA-associated microscopic polyangiitis. Journals of the American Society of Nephrology. 25 (5), 990-997 (2014).
- Konig, M. F., Andrade, F. A Critical Reappraisal of Neutrophil Extracellular Traps and NETosis Mimics Based on Differential Requirements for Protein Citrullination. Frontiers in Immunology. 7, 461 (2016).
- Kenny, E. F., et al. Diverse stimuli engage different neutrophil extracellular trap pathways. Elife. 6, (2017).
- Zhao, W., Fogg, D. K., Kaplan, M. J. A novel image-based quantitative method for the characterization of NETosis. Journal of Immunological Methods. 423, 104-110 (2015).
- Pilsczek, F. H., et al. A novel mechanism of rapid nuclear neutrophil extracellular trap formation in response to Staphylococcus aureus. The Journal of Immunology. 185 (12), 7413-7425 (2010).
- Tanaka, K., et al. In vivo characterization of neutrophil extracellular traps in various organs of a murine sepsis model. PLoS One. 9 (11), e111888 (2014).
- Fuchs, T. A., et al. Novel cell death program leads to neutrophil extracellular traps. Journal of Cell Biology. 176 (2), 231-241 (2007).
- von Köckritz-Blickwede, M., Chow, O., Nizet, V. Fetal calf serum contains heat-stable nucleases that degrade neutrophil extracellular traps. Blood. 114 (25), 5245-5246 (2009).
- Kraaij, T., et al. Excessive neutrophil extracellular trap formation in ANCA-associated vasculitis is independent of ANCA. Kidney International. , (2018).
- Kraaij, T., et al. The NET-effect of combining rituximab with belimumab in severe systemic lupus erythematosus. Journal of Autoimmunity. , (2018).
- Hahn, J., Schauer, C., et al. Aggregated neutrophil extracellular traps resolve inflammation by proteolysis of cytokines and chemokines and protection from antiproteases. The FASEB Journal. (Aug 21), (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados