Method Article
Disección de Local Ca2 + señales en las células cultivadas por membrana dirigidos Ca2 + indicadores
En este artículo
Resumen
Aquí presentamos un protocolo de Ca2 + proyección de imagen en neuronas y células gliales, que permite la disección de Ca2 + señales con resolución subcelular. Este proceso es aplicable a todo tipo de celular que permiten la expresión de indicadores de Ca2 + genéticamente codificados.
Resumen
Ion calcio (Ca2 +) es una molécula de mensajero intracelular universal que impulsa múltiples vías de señalización, a diversos productos biológicos. La coordinación de dos fuentes de Ca2 + señal — «Ca2 + afluencia"de fuera de la célula y"Ca2 + lanzamiento"de la Ca2 + intracelular retículo endoplasmático (ER), se considera que subyacen a los diversos patrones espacio-temporales de Ca 2 + señales que provocan múltiples funciones biológicas en las células. El propósito de este protocolo es describir un nuevo Ca2 + método de imagen que permite la monitorización del momento de "Ca2 + afluencia" y "Ca2 + en libertad". REA-GCaMP6f es un genéticamente codificados Ca2 + indicador (GECI) compuesto por GCaMP6f, que está dirigido a la membrana externa de ER. REA-GCaMP6f puede controlar Ca2 + lanzamiento en una mayor resolución temporal que GCaMP6f convencionales. Combinado con GECIs orientada en la membrana plasmática, el espacio-temporal Ca2 + patrón de señal puede ser descrito en una resolución subcelular. El objetivo subcelular Ca2 + indicadores descritos aquí son, en principio, disponible para todos los tipos de células, incluso para el vivo en proyección de imagen de las neuronas de los elegans de Caenorhabditis . En este protocolo, introducimos el Ca2 + proyección de imagen en células de líneas de células, neuronas y glía en cultivos primarios disociados y describir la preparación de caldo congelado de neuronas corticales de rata.
Introducción
CA2 + señales representan la elevación de la concentración de Ca2 + intracelular. CA2 + es el segundo mensajero universal de las células eucariotas. Con Ca2 +, las células funcionan a través de diversas vías de señalización intracelular e inducen varias salidas biológicos. Por ejemplo, en las neuronas, liberación de la vesícula sináptica a la terminal presináptica, la expresión génica en el núcleo y la inducción de la plasticidad sináptica en la dendrita son regulados por distintas Ca2 + señales que se activan precisamente la adecuada enzimas aguas abajo en los sitios de derecha y con sincronización precisa1.
Patrones espacio-temporales específicos de señales de Ca2 + activan las enzimas específicas de aguas abajo. CA2 + se generan mediante la coordinación entre dos distintas Ca2 + fuentes de señales: Ca2 + afluencia desde el espacio extracelular y Ca2 + liberación desde el retículo endoplásmico (ER), que sirve como un Ca intracelular2 + guardar. El significativa spatiotemporal Ca2 + señalización patrón para inducir una función específica de la célula también es apoyado por nanodomains de 10-100 μm Ca2 + generado en las proximidades de canales de Ca2 + en la membrana plasmática o membrana de ER2. Lo importante es la fuente de señales de Ca2 + es uno de los factores más críticos para determinar la salida biológica aguas abajo. En las neuronas, Ca2 + afluencia y comunicado de Ca2 + tienen efectos opuestos en el agrupamiento de los receptores ácido gamma - aminobutírico (GABA)A (GABAAR) en las sinapsis GABAérgicas, que es responsable de la inhibición de la excitabilidad neuronal3. CA2 + flujo acompañado de excitación neuronal masiva provoca la dispersión de grupos sinápticos de GABAAR, mientras que persistente Ca2 + lanzamiento de ER promueve la agrupación de synaptic GABAARs. Otros grupos también han informado de que la dirección de ajuste de conos de crecimiento es críticamente dependiente de la fuente de la señal de Ca2 + :2 + afluencia Ca induce la repulsión, mientras que el comunicado de Ca2 + guía la atracción del crecimiento neuronal cono4. Por lo tanto, para entender completamente el Ca2 + subyacente específicas celulares salidas de vías de señalización, es importante identificar la fuente de Ca2 + señales describiendo Ca2 + señales en la resolución subcelular.
En este protocolo, describimos un Ca2 + método de imagen para reportar señales de Ca2 + en la resolución subcelular, que permite la estimación de las Ca2 + fuentes de señal (figura 1). CA2 + microdominios justo debajo de la membrana plasmática son monitoreados con éxito por genéticamente codificados Ca2 + indicadores (GECIs) dirigidos a la membrana plasmática mediante el anclaje de la señal de localización de la membrana plasmática Lck dentro de Src quinasa en el termini N GECIs5. Para detectar el patrón de Ca2 + señal en las proximidades de ER en una mejor resolución espacial y temporal, recientemente desarrollamos OER-GCaMP6f, en que GCaMP6f6 metas ER externas de la membrana, utilizando la proteína transmembrana de ER. REA-GCaMP6f sensible puede reportar Ca2 + lanzamiento de ER en una mejor resolución espaciotemporal que GCaMP6f desea convencionales de células COS-77 y de las células HEK2938, evitando la difusión de Ca2 + y GECIs . También confirmamos que la espontánea Ca2 + elevación en los astrocitos de hipocampales cultivadas reportado por OER-GCaMP6f mostró un patrón espacio-temporal diferente comparado con el que por GCaMP6f dirigidos a membrana del plasma (Lck-GCaMP6f)7 ,9, indicando que el Ca2 + proyección de imagen con la rea-GCaMP6f en combinación con Lck-GCaMP6f contribuye a la disección de Ca2 + señales en la resolución subcelular para identificar sus fuentes.
En la actualidad, detallamos el protocolo para el análisis de Ca2 + señales en células HeLa y neurona-astrositos mezclado culturas sobre cubreobjetos de vidrio. La Ca2 + técnica de imagen con GECIs indicadas aquí, Lck-GCaMP6f, RCaMP2 plasma membrana dirigidos10 (Lck-RCaMP2), y rea-GCaMP6f (figura 1) son aplicables a todas las células en las que se pueden expresar estos GECIs.
Protocolo
Todos los experimentos descritos aquí fueron aprobados por el Comité de seguridad RIKEN y experimento animal, según la directriz emitida por el Ministerio Japonés de educación, cultura, deportes, ciencia y tecnología.
1. preparación de las células
- Preparación de poli (general)-cubierto de cubreobjetos
Nota: Capa de Poly(ethyleneimine) (PEI) se recomienda para el aparato de vidrio, ya que permite a las neuronas y los astrocitos para sujetar firmemente a los cubreobjetos sin prevenir su desarrollo. Sin embargo, otros métodos de recubrimiento (por ejemplo, poli-ornitina, poli L-lisina, laminina capa) también están disponibles, si es necesario, para platos de fondo de cristal.- Coloque un cubreobjetos de cristal de 18 mm de diámetro en cada pocillo de una placa de 12 pozos. Preparar solución de PEI de 0,04% (12,5 mL/12-bien placa) usando agua esterilizada.
- Añadir 1 mL de solución de PEI de 0,04% a cada pocillo. Asegúrese de que no hay ningunas burbujas debajo del cubreobjetos.
- Incubar las placas en un incubador de CO2 durante la noche a 37 ° C.
- Al día siguiente, lavar los cubreobjetos recubierto 3 x con 1 mL de agua esterilizada. Retirar la solución de PEI con un aspirador, añadir 1 mL de agua estéril a cada bien y agitar la placa de 12 pozos para que la solución del PEI entre el cubreobjetos y la placa se puede lavar fondo. Como el resto PEI es tóxico para las células, asegúrese de que el agua después del último lavado se aspira completamente.
- Secar y esterilizar el cubreobjetos dentro de la campana con ultravioleta (UV) luz durante al menos 15 minutos. El plato cubierto de PEI puede almacenarse a 4 ° C hasta por 2 meses. Iluminar los platos con Ultravioleta luz durante 15 minutos antes de usar.
- Añadir 5 mL de agua destilada estéril en el espacio entre los pozos para evitar la evaporación del medio de cultivo.
- Líneas celulares de la galjanoplastia
Nota: Este protocolo proporciona un ejemplo para la transfección en las células de las líneas de células de mamífero, como las células HeLa y células COS-7. Los usuarios pueden aplicar otros protocolos de la transfección optimizadas para sus experimentos. En esta sección, describiremos el protocolo cultura de células HeLa, que también es aplicable a las células COS-7.- El día antes de la transfección, la cultura las células en una placa de cultivo de 10 cm hasta que alcanzan el 70% – 90% de confluencia.
- Precaliente el medio de cultivo (véase Tabla de materiales) a 37 ° C.
- Lavar las células 2 x con solución salina con tampón fosfato sin Ca2 + y Mg2 + (PBS [-]).
- Aspirar la PBS(-), añadir 1 mL de solución de ácido (EDTA) 0,5% tripsina-etilendiaminotetracético e incubar las células a 37 ° C por 90 s, hasta que logran una forma redonda.
- Añadir 9 mL de medio de cultivo precalentada para parar la tripsinización. Diluir las células con medio de cultivo en una proporción de 1:6.
- 1 mL de las células diluidas en cubreobjetos recubierto de PEI en las placas 12-pozo de la semilla.
- Preparación de la cultura de hippocampal neuron-astrositos mezclado de ratas o ratones
Nota: Secciones 1.3 y 1.4 primero deben ser revisados y aprobaron por un Comité de uso y cuidado Animal institucional y deben seguir procedimientos oficialmente aprobados para el uso y cuidado de animales de laboratorio. El diagrama de flujo del protocolo cultura neuronal se muestra en la figura 2.- Preparar todos los reactivos bajo la campana de flujo laminar. Medio modificado Eagle de lugar Dulbecco (DMEM) en dos 100 mm cultura platos (aproximadamente 20 mL/plato) que se encuentran en una nevera.
- Preparar 50 mL de medio de disección compuesto de DMEM y ácido-(2-hydroxyethyl)-1--1-ácido de 20 mM 4 (HEPES) (véase Tabla de materiales) y dispensar el medio en tres platos de cultura 60 mm (aproximadamente 7 mL/plato) y ocho 35 mm platos de cultura (aproximadamente 2 mL/plato). Coloque los platos en otra nevera.
- Preparar 50 mL de la solución salina de incubación, compuesto por una solución salina equilibrada de Hanks suplementada con HEPES (véase Tabla de materiales), de 20 mM y 8 mL de la solución salina en un tubo cónico de 15 mL en hielo.
- Prepare el soporte de placas con medio esencial mínimo (MEM) suplementado con B-27, glutamina y penicilina-estreptomicina (véase Tabla de materiales). Mantener este medio a temperatura ambiente (20 – 28 ° C).
- Esterilizar los instrumentos quirúrgicos con etanol al 70%.
- Coloque una toalla de papel en un frasco de vidrio con tapa y 1 mL de isoflurano. Deje que el isoflurano se evapore durante 1 minuto.
- Coloque un ratón o una rata embarazada en el frasco preparado según paso 1.3.6 y mantener el animal en el tarro hasta que es anestesiado profundamente (aproximadamente 30 s a 1 min).
- Saquen el animal anestesiado de la jarra y desinfectar el animal y el equipo de disección por aspersión con etanol al 70%. Corta la línea media ventral con tijeras de disección estándar y pinzas y extraer el útero de la embarazada rata o ratón.
- Extraer E18 – 19 embriones en el útero de una rata hembra anestesiado o el ratón, usando las tijeras de disección delicadas y colocar los embriones extraídos con una pinza de anillo en DMEM helado en un plato de 10 cm para la anestesia fría.
- Decapitar el embrión con tijeras de disección fina y coloque la cabeza en DMEM helado en un plato de 10 cm.
- Extraer el cerebro de cada embrión con una pinza de Semken 13 cm curvada y pinzas con puntas finas. Mantener el cerebro en el medio de disección fría en un plato de 60 mm.
- Quitar los hipocampos, utilizando dos pinzas con puntas finas, en el medio de disección fría en platos de 35 mm y mantener el tejido aislado en las Salinas de incubación a un tubo cónico de 15 mL en hielo.
- Lavar los hipocampos con solución salina de incubación e incubar con tripsina (1,25 mg/mL) y DNasa I (0.25 mg/mL) en la solución salina de la incubación durante 5 minutos a 37 ° C. El volumen de incubación recomendado es 2,7 mL de solución salina de la incubación, 150 μL de 20 x stock tripsina y 150 μL de caldo x 20 DNasa (véase Tabla de materiales).
- Lavar los hipocampos 3 x con solución salina helada de incubación.
- Aspirar la solución salina de incubación y añadir 1 mL del medio forro con DNasa I (10 μl de la solución madre, véase Tabla de materiales). Suspender el tejido por pipeteo no más de 20 x y medir la densidad de células viables, utilizando un contador de células y ensayo de azul de tripano.
- Diluir las células hippocampal a una densidad de 1.4 x 105 viable de células/mL para las ratas y 2.5 x 105 viable de células/mL para los ratones. 1 mL de las suspensiones de células diluidas sobre el cubreobjetos recubierto de PEI en placas 12-pozo de la semilla.
- Mantener las células a 37 ° C en un incubador de CO2 de 2-3 días.
- Retire el medio de la galjanoplastia. No permita que las células secar. Suavemente y rápidamente agregar el medio de mantenimiento precalentado (véase Tabla de materiales).
- Preparación de rata neurona cortical-astrositos mezcla cultura y las células y la reactivación de cultivos congelados
Nota: Un método de criopreservación de células corticales fue descrito previously11. Aquí, se proporciona un protocolo modificado en el cual células corticales pueden almacenarse a-80 ° C durante al menos 3 meses. El diagrama de flujo para este protocolo se muestra en la figura 2.- Preparar el DMEM, disección media, salina de incubación y medio de revestimiento como se indica en pasos 1.3.1–1.3.4 y la Tabla de materiales.
- Preparar el medio de lavado de DMEM, suero bovino fetal inactivado por calor y penicilina-estreptomicina (véase Tabla de materiales), si es necesario.
- Extraer E18 – 19 embriones en el útero de una rata hembra anestesiado o el ratón, usando las tijeras de disección delicada y utilice pinzas de anillo para colocar cada embrión extraído en DMEM helada de frío anestesia.
- Quitar el cerebro de los embriones y mantenerlos en medio de la disección fría. Retire el cortexes y mantener en la solución salina de incubación a un tubo cónico de 15 mL en hielo.
- Lavar el cortexes con solución salina de incubación e incubar cortexes con tripsina (1,25 mg/mL) y DNasa I (0.25 mg/mL) en solución salina de la incubación durante 5 minutos a 37 ° C. El volumen de incubación recomendado para 12 cortexes es 5,4 mL de solución salina de la incubación, 300 μL 20 x bolsa tripsina y 300 μL de caldo x 20 DNasa I.
- Lavar el cortexes 3 x con solución salina helada de incubación.
- Quite el sobrenadante y añadir 2 mL de medio de galjanoplastia complementado con 150 μL de DNasa stock. Disociar las células transfiriendo menos de 20 movimientos y las células utilizando un colador de células con un tamaño de 70 μm de poro del filtro.
- Lave el filtro celular con 20 mL del medio de galjanoplastia para la galjanoplastia. Para la preparación de la acción de la célula congelada, lavar las células con 20 mL de medio de lavado (véase Tabla de materiales)
- Medir la densidad de las células viables, utilizando un contador de células y el método de azul tripán.
- Diluir las células corticales a una densidad de 1.4 x 105 viable de células/mL con el medio forro y añadir 1 mL de la suspensión de células diluidas a cubreobjetos recubierto de PEI en el pozo de 12 placas.
- Mantener las células a 37 ° C en un incubador de CO2 para 2-3 días y cambiar el medio de cultivo el medio de mantenimiento.
- Después de paso 1.4.9, preparar el caldo congelado células corticales por centrifugación las células a 187 x g durante 3 min, con un rotor de columpio.
- Aspirar el sobrenadante y añadir el medio de la crioconservación (véase Tabla de materiales) mantenerse a 4 ° C, para obtener una densidad celular de 1 x 107 células/mL. Alícuota 1 mL de la suspensión de células en los tubos criogénicos.
- Colocar los tubos en una célula de congelación contenedor con un índice de congelación de-1 ° C/min, hasta que se alcance una temperatura de-80 ° C y transferir el contenedor de congelamiento a un congelador de-80 ° C. Las células pueden almacenarse durante al menos 3 meses a-80 ° C.
- Para revitalizar las células, precaliente el medio de lavado (aproximadamente 13 mL en cada tubo criogénico) y medio de mantenimiento de las células corticales (véase Tabla de materiales).
- Descongelar las células congeladas rápidamente a 37 ° C en un baño de agua.
- Diluir las células descongeladas con lavado precalentado medio. Centrifugar las células a 187 x g durante 3 min, con un rotor de columpio.
- Suspender el sedimento en 1 mL de medio de lavado y medir la densidad de células viables.
- Diluir las células con el medio de mantenimiento de las células corticales producir una densidad celular de 3.0 x 105 células viables/mL y las semillas 1 mL de la suspensión de células en las placas 12-bien cubierto por el PEI.
2. expresión de GECIs orientada a membrana
-
Transfección de células
- Agregar 250 ng de plásmido GECI (es decir, Lck-GCaMP6f, RCaMP2 Lck o OER-GCaMP6f con el promotor del CMV)7,8,9 a 100 μl de medio de suero reducido (véase Tabla de materiales) por pozo. Para cotransfection de Lck-RCaMP2 y rea-GCaMP6f, uso 250 ng de cada plásmido en 100 μl de medio de suero reducido en cada pozo.
- Añadir 0,5 μl de reactivo de transfección (véase Tabla de materiales) por bien a la mezcla medio de suero reducido de plásmido. Para cotransfection de Lck-RCaMP2 y rea-GCaMP6f, Añadir 0,5 μl de reactivo de transfección por pozo.
- Incubar la mezcla durante 30 min a temperatura ambiente (20 – 28 ° C).
- Añadir 100 μl de la mezcla a cada cubreobjetos de manera drop-wise.
- Incube las células durante 48-72 h en un incubador de CO2 a 37 ° C para permitir la expresión de las GECIs.
-
Transfección y la infección del virus adeno-asociado de neuronas de hipocampales o corticales
Nota: Transfección de 3 – 5 días in vitro (DIV) se traduce en una mayor tasa de transfección para las neuronas. Transfección en 6 – 8 DIV es preferida para la expresión óptima de GECIs en astrocitos. Para la expresión de GECIs en neuronas disociadas de la cultura después de 9 DIV, la infección de los vectores de virus adeno-asociado (AAV) proporciona una mejor eficacia de la expresión. Vectores AAV para la expresión de Lck-GCaMP6f, RCaMP2 de Lck y rea-GCaMP6f en el EF1a promotores fueron preparados como se describió anteriormente, utilizando HEK293 células12 (véase Tabla de materiales).- De 3 a 8 días después de la galjanoplastia de la transfección, etiqueta dos tubos, uno para el DNA plasmídico y el otro para el reactivo de transfección.
- Añadir 50 μl de medio de suero reducida (véase Tabla de materiales) por pozo en cada tubo.
- Añadir 0,5 μg de plásmido ADN por cubreobjetos y 1 μl de suplemento acompañado de reactivo de transfección para las neuronas (véase Tabla de materiales) por pozo en el tubo de DNA de plásmido. Para cotransfection de Lck-RCaMP2 y rea-GCaMP6f, 0.5 μg de cada plásmido y 1 μl de suplemento se mezclan en 50 μl de medio de suero reducido por pozo.
- Añadir 1 μl de reactivo de transfección (véase Tabla de materiales) por pozo en el tubo de reactivo de transfección. Se utiliza la misma cantidad de reactivo de transfección para cotransfection.
- Vórtice ambos tubos para 1 – 2 s.
- Agregar la mezcla de reactivo de transfección (del paso 2.2.4) a la mezcla de ADN (de paso 2.2.3). Mezclar mediante pipeteo suavemente e incubar la mezcla (100 μl por cubreobjetos) durante 5 minutos a temperatura ambiente.
- Coloque esta mezcla sobre las células de manera drop-wise.
- Incubar las células en una incubadora de CO2 durante 2 – 3 días hasta que se expresan las proteínas marcadoras.
- Para la infección de AAV, agregar 3 μl de AAV por bien a la cultura de astrositos de neuronas mezcladas. Mezclar suavemente, meciendo el plato. Para la infección doble de Lck-RCaMP2 y rea-GCaMP6f, 3 μl de cada AAV es introducido por pozo. En caso de que el número de células que expresan GECIs es insuficiente, debe determinarse la cantidad óptima de AAV para la infección.
- Mantener la cultura de 1 – 2 semanas hasta las GECIs se expresan.
3. Ca2 + imagen
-
La proyección de imagen simultánea de las células que expresan RCaMP2 Lck y rea-GCaMP6f
Nota: Para grabar simultáneamente las señales RCaMP2 Lck y OER-GCaMP6f, División de imagen óptica se requiere. La óptica permiten la separación de RCaMP2 y GCaMP6f y su proyección en el mismo marco fotográfico de la cámara (Figura 3A). Proyección de imagen simultánea también requiere fuentes de (1) luz que al mismo tiempo pueden emitir luz en el azul (450-490 nm) la excitación espectros verde (500-560 nm), (2) banda de doble filtro y espejo dicroico establece en el microscopio y emisión (3) filtros para RCaMP2 y GCaMP6f. Para obtener más información, consulte la Tabla de materiales.- Encienda los dispositivos y ordenadores por lo menos 30 min antes de la grabación. Precaliente el microscopio calefacción cámara a 37 ° C. Configurar el dispositivo de separación de imagen, filtros y fuente de luz. Alinee la óptica separación de imagen para que aparezca el mismo campo de visión de la cámara. Elegir el objetivo adecuado (véase Tabla de materiales).
- Monte el cubreobjetos que contiene las células transfected con Lck-RCaMP2 y rea-GCaMP6f en la sala de grabación, añadir el medio apropiado de imágenes o búfer (400 μL de cubreobjetos de 18 mm) en la cámara y colóquela sobre la platina del microscopio. Coloque una tapa sobre la cámara de grabación para evitar la evaporación del medio.
- Localizar las células expresando Lck-RCaMP2 y rea-GCaMP6f por la proyección de imagen fluorescente. Minimizar la intensidad de luz de excitación para evitar fotoblanqueo y fototoxicidad.
- Retire la tapa y empezar a grabar en time-lapse de 10 Hz. Durante esta grabación, añadir al agonista a la cámara para evocar el Ca2 + respuestas (p. ej., histamina por las células HeLa, ATP para las células COS-7).
- Guardar los datos Time-lapse en la unidad de disco duro (HDD).
- Analizar los datos usando software de análisis de imagen.
-
Actividades espontáneas de astrocitos expresión de Lck-RCaMP2 y rea-GCaMP6f de grabación
Nota: Sin separación de imagen óptica, las señales de Ca2 + en la membrana plasmática y ésos alrededor de la sala de emergencia pueden ser monitoreadas en la misma célula. Aquí, se describe la grabación secuencial de Lck-RCaMP2 y rea-GCaMP6f en los astrocitos de la misma. Un objetivo de inmersión en aceite con una apertura numérica mayor que 1.3 es muy recomendable para la actividad espontánea de Ca2 + .- Encender el microscopio, cámara, fuente de luz y la calefacción de microscopio cámara de al menos 30 minutos antes de grabar.
- Monte el cubreobjetos que contiene las células transfectadas con Lck-RCaMP2 y rea-GCaMP6f en la cámara de grabación y añadir 400 μL de medio de imágenes. Coloque una tapa encima de la cámara.
- Seleccione el filtro de GCaMP6f y la fuente de luz (la luz de excitación, por ejemplo, 470– 490 azul nm; véase Tabla de materiales). Localizar los astrocitos expresan rea-GCaMP6f.
- Elegir un sistema de filtro y la fuente de luz para RCaMP2 (verde luz de excitación, por ejemplo, 510-560 nm; véase Tabla de materiales) y confirmar si Lck-RCaMP2 se expresa en los astrocitos de la misma. Evitar la exposición prolongada a la fuente de luz para evitar el fotoblanqueo.
- Grabar imágenes de Time-lapse de Lck-RCaMP2 en 2 Hz durante 2 minutos guardar los datos de imagen en el disco duro.
- Cambiar el filtro establezca para GCaMP6f. Grabar imágenes de lapso de tiempo de rea-GCaMP6f en el mismo campo de vista, a 2 Hz durante 2 minutos guardar los datos en el disco duro.
- Analizar los datos utilizando el software de análisis de imagen.
-
Grabación de la actividad neuronal espontánea y Ca2 + elevación inducida en las neuronas
Nota: La configuración del microscopio para la proyección de imagen neuronal es el mismo que se describe en la sección 3.2. Aquí, se describe la proyección de imagen de Ca2 + elevación espontánea debido a Lck-GCaMP6f y Ca2 + elevación inducida por la activación del mGluR debido a OER-GCaMP6f.- Para registrar la actividad neuronal espontánea, Monte el cubreobjetos que contiene las células expresando Lck-GCaMP6f en la cámara de grabación y añadir 400 μL de medio de la proyección de imagen. Coloque una tapa encima de la cámara.
- Configurar el filtro y la fuente de luz (excitación azul, por ejemplo, 470 – 790 nm; véase Tabla de materiales) a los de GCaMP6f. Encontrar las neuronas expresan Lck-GCaMP6f y mostrando la actividad espontánea.
- Adquisición de imágenes a 2 Hz o más rápido. Guardar los datos en el disco duro.
- Analizar los datos utilizando el software de análisis de imagen.
- Para grabar el Ca2 + elevación inducida, montar el cubre-objetos que contiene las células expresar OER-GCaMP6f con 400 μL de medio. Coloque una tapa encima de la cámara.
- El filtro de GCaMP6f, encontrar las neuronas expresan rea-GCaMP6f.
- Retire la tapa. Iniciar la grabación Time-lapse a 2 Hz o más rápido. Durante la grabación, añadir los agonistas para un receptor acoplado a Gq-proteína (por ejemplo, mGluR5 agonista [RS] - 3,5 - dihydroxyphenylglycine [DHPG]) para evocar un Ca2 + comunicado de la sala de emergencia.
- Guardar las imágenes de lapso de tiempo en el disco duro y analizar los datos.
Resultados
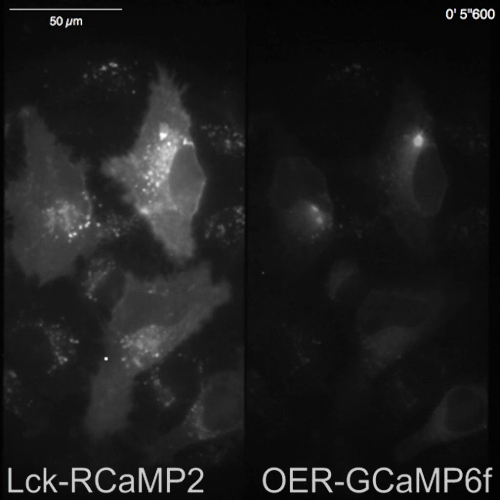
RCaMP2 Lck y rea-GCaMP6f se expresaron en células HeLa, y ambas señales se registraron simultáneamente con separación de imagen óptica, 24 h después de transfección (Figura 3A y 1 vídeo). Las imágenes fueron adquiridas en 10 Hz. histamina (su, 1 μm), que induce Ca2 + liberación de ER, se añadió durante la grabación. La petición de su aumenta la intensidad de la señal de Lck-RCaMP2 y rea-GCaMP6f, como se muestra en la pantalla de pseudocolor de ΔF/F0, que representa el cambio de la intensidad de fluorescencia inicial (figura 3B). Se compararon los cursos tiempo de Ca2 + elevación (ΔF/F0) reportados por RCaMP2 Lck y rea-GCaMP6f en la misma región de interés (ROI) (figura 3). Los valores ΔF/F0 se normalizaron los valores de pico para permitir la comparación del curso de tiempo entre los dos GECIs diferentes, que tienen niveles de expresión diferente y distribuciones. Ambos sensores informaron una oscilación como Ca2 + elevación. RCaMP2 Lck y rea-GCaMP6f demostrada el mismo curso del tiempo de elevación de Ca2 + en dos células entre los tipos cinco celulares examinados (figura 3, ROI 1 y 3). Sin embargo, Ca2 + elevaciones de Lck-RCaMP2 mantuvieron en un nivel más alto en comparación con la de rea-GCaMP6f (figura 3 C, ROI 2, 4 y 5). Los resultados indican que la elevación del Ca2 + se prolonga en las proximidades de la membrana plasmática, mientras que se terminó antes alrededor de la sala de emergencia, que es la fuente de Ca2 + señal inducida por su estimulación.
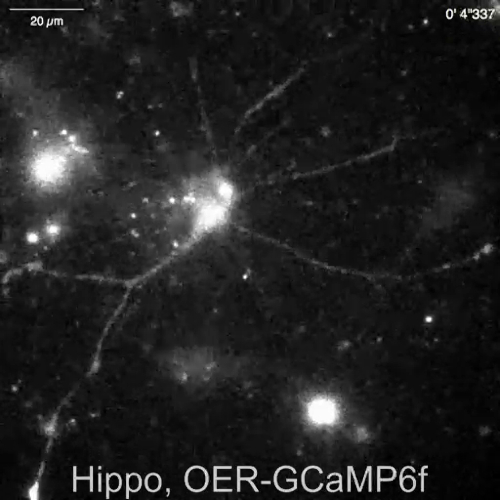
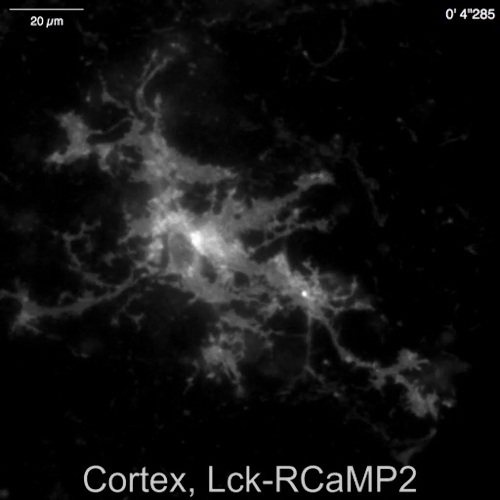
Espontánea Ca2 + señales de astrocitos en la neurona-astrositos mezclado cultura de hipocampo de rata (Figura 4A) y cortexes (Figura 4B) fueron demostrados por Lck-RCaMP2 y rea-GCaMP6f (figura 4, Video 2, Video 3 de , 4y 5 de vídeo). Las culturas corticales fueron revividas del material congelado que se preparó como se describe en este protocolo. Secuencialmente se registraron señales de Lck-RCaMP2 y rea-GCaMP6f a 2 Hz de las células del mismo. Tres ROIs fueron seleccionados en el área que mostró elevación del Ca2 + por cada GECI, y cambió el curso del tiempo de ΔF/Fbase (es decir, la intensidad de fluorescencia) de la intensidad de fluorescencia media durante el período de toda grabación (Fbase ). Cuando la fluorescencia basal es estable y Ca2 + elevaciones son menos frecuentes, Fbase se convierte en una referencia útil para detectar eventos de elevación de Ca2 + . Espontánea Ca2 + elevaciones eran visibles sólo en los procesos astrocytic, no en el cuerpo de la célula. Este resultado es consistente con los anteriores informes sobre astrocytic espontánea Ca2 + señales de otros GECIs visualizado in vitro13 y vivo en14. En los astrocitos de hipocampales y corticales, Ca2 + elevaciones de Lck-RCaMP2 (arriba) fueron más frecuentes que las que se muestran por OER-GCaMP6f. Este resultado es consistente con nuestra demostración anterior que elevaciones de Ca2 + en los astrocitos debido a Lck-GCaMP6f con más frecuencia se ha detectado que debido a la rea-GCaMP6f7 y sugiere que este concepto también es aplicable en el nivel unicelular.
Espontánea Ca2 + elevaciones de Lck-GCaMP6f en neuronas hipocampales de rata inmadura (DIV 10) fueron vistas en 2 Hz (figura 5A y 6 de vídeo). Los cursos de tiempo de ΔF/F0 en cinco diferentes ROIs sugieren que estas elevaciones de Ca2 + local se limitan a los dominios subcelulares. Figura 5B (Video 7) muestra las Ca2 + respuestas en neuronas hippocampal ratón maduro (30 DIV) infectadas con vectores AAV rea-GCaMP6f-expresión. Las neuronas fueron estimuladas con DHPG, que es el agonista de los receptores de glutamato metabotrópicos, induciendo comunicado de Ca2 + de 100 μm. Se detectó DHPG inducida por Ca2 + versión debido a OER-GCaMP6f.
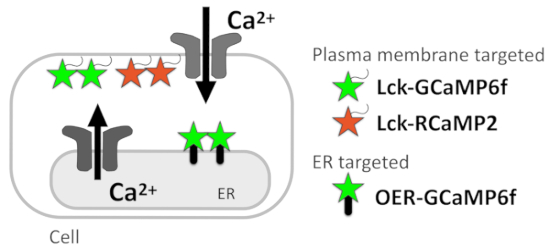
Figura 1: diagrama que muestra orientada a membrana GECIs. Diagrama esquemático de GECIs orientada en la membrana plasmática (Lck-GCaMP6f y RCaMP2 Lck) y ER externo membrana orientada GCaMP6f (OER-GCaMP6f).
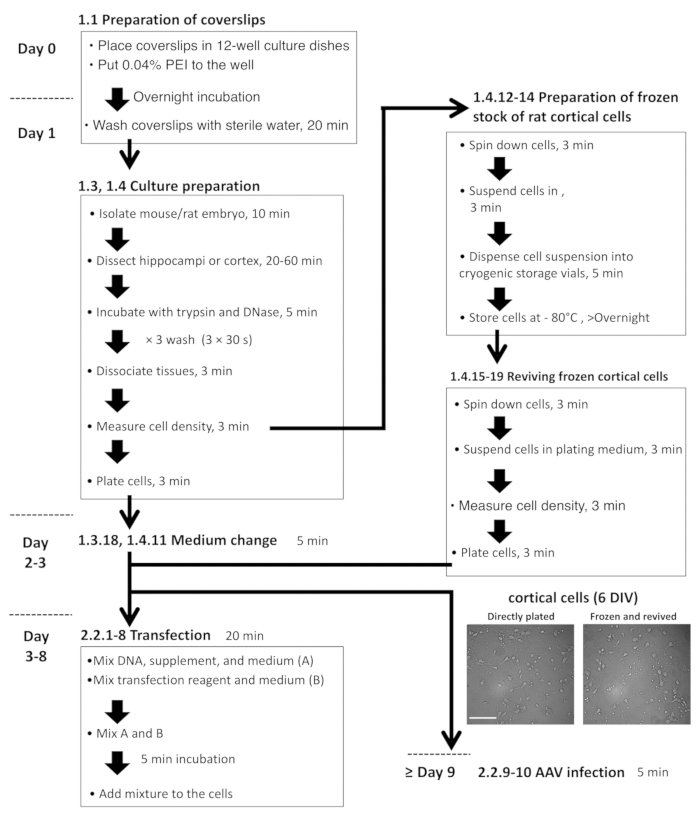
Figura 2: Diagrama de flujo para la preparación de células hipocampales y cortical, transfección del plásmido y la infección de AAV. Las imágenes microscópicas son representativos, recién plateado DIV-6 corticales células (izquierda) y revivieron las células del material congeladora (derecha). Barra de escala = 100 μm. haga clic aquí para ver una versión más grande de esta figura.
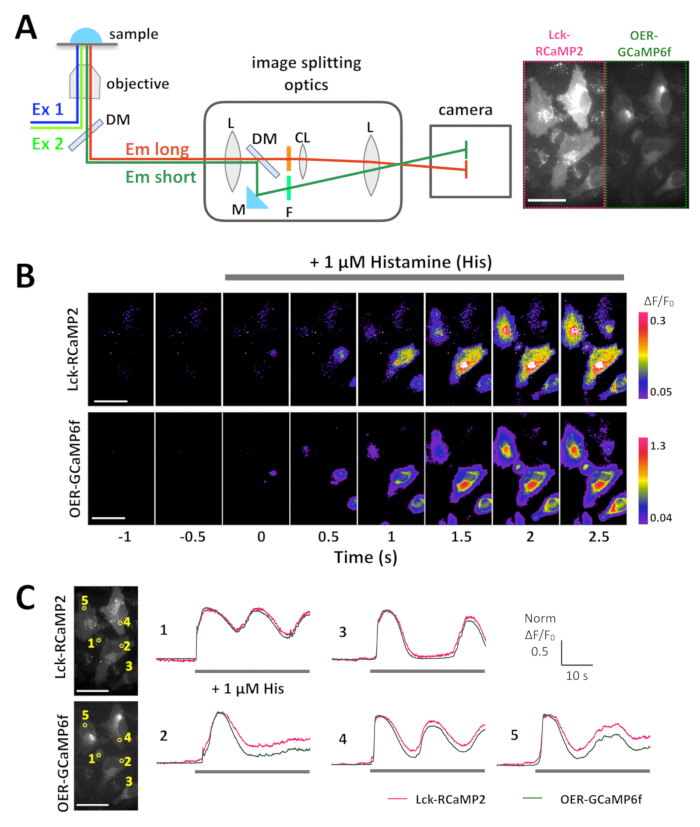
Figura 3: ejemplo de la proyección de imagen simultánea de Lck-RCaMP2 y rea-GCaMP6f en células HeLa. (A) representación esquemática de la separación de la señal con la división de imagen óptica. El mismo campo de visión de Lck-RCaMP2 y rea-GCaMP6f se proyecta simultáneamente en la cámara. Una grabación representación adquirida de 10 Hz por un CMOS de la cámara se proporciona en el Video 1, y un fotograma de esta grabación se muestra en el panel A (derecha). (B) imágenes pseudo-color de ΔF/F0 Lck-GCaMP2 (arriba) y rea-GCaMP6f (parte inferior). Histamina (su, 1 μm) fue agregada en 0 s. representante de (C) curso normalizado tiempo ΔF/F0 de Lck-GCaMP2 (magenta) y rea-GCaMP6f (verde). Los datos fueron normalizados al valor máximo de ΔF/F0 para cada parcela. Las barras grises indican el momento de su aplicación. Datos se analizaron con un software por encargo de banco de trabajo de TI15. Barra de escala = 50 μm (imagen microscópica). Haga clic aquí para ver una versión más grande de esta figura.
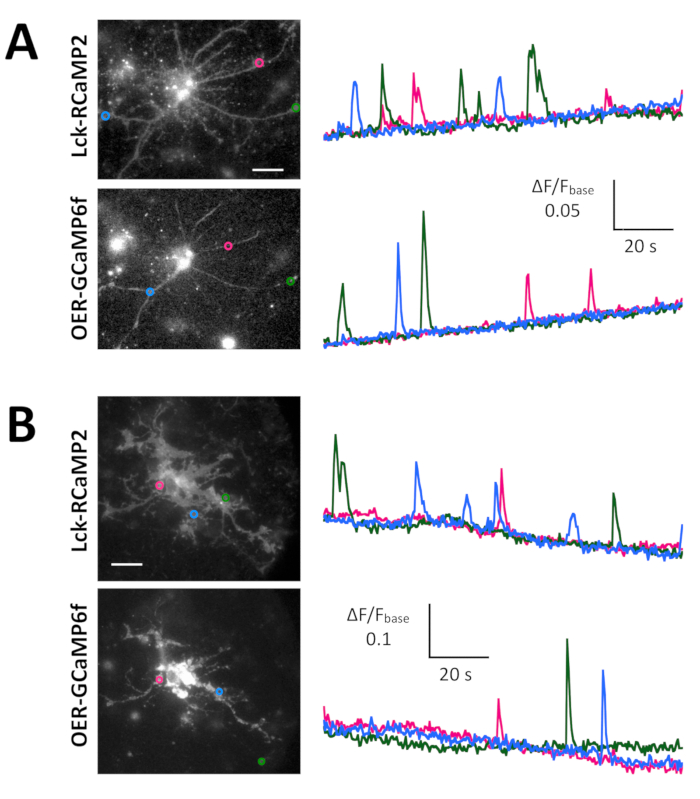
Figura 4: Espontánea Ca2 + elevación en los astrocitos de seguimiento para la expresión de Lck-RCaMP2 y rea-GCaMP6f. (A) representante de hippocampal y (B) astrocitos corticales transfectados con Lck-RCaMP2 (arriba) y rea-GCaMP6f (parte inferior). Células corticales fueron revividas de culturas stock congeladas. RCaMP2 Lck y rea-GCaMP6f imágenes fueron adquiridos secuencialmente en la misma celda, a 2 Hz, con un EM-CCD de la cámara. Las parcelas en la demostración izquierda los cursos tiempo de ΔF/Fbase medidos en el ROIs se indican en la imagen microscópica. Datos se analizaron con Banco de trabajo de TI. Películas reales se encuentran en el Video 2, Video 3, Video 4y 5 de Video. La barra de escala = 20 μm (imagen microscópica). La deriva de referencia indica los cambios en el Ca2 + nivel global en la celda. Haga clic aquí para ver una versión más grande de esta figura.
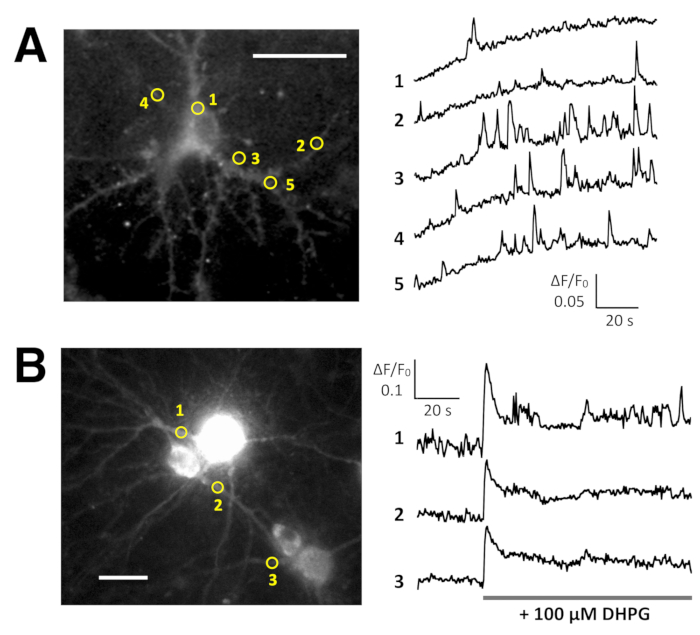
Figura 5: Ejemplos de Ca2 + proyección de imagen en las neuronas con Lck-GCaMP6f y rea-GCaMP6f. (A) representante de la rata hipocampo las neuronas expresando Lck-GCaMP6f en DIV 10 (izquierda) y de la parcelas que muestra el tiempo cursos de ΔF/F0 mide en ROIs (círculos amarillos) se han indicado en la imagen (derecha). Los números en el curso del tiempo corresponden a los números ROI en la imagen. Tenga en cuenta que el patrón temporal de elevación del Ca2 + es diferente entre las distintas regiones de interés. La deriva de referencia sugiere el aumento de Ca2 + globalmente en esta neurona. (B) un ejemplo de neuronas hippocampal del ratón maduro (DIV 30) infectados con OER-GCaMP6f expresión vectores AAV (izquierdas). El tiempo de curso de ΔF/F0 mide muestra la Ca2 + respuesta a 100 μm (RS) - 3,5 - dihydroxyphenylglycine (DHPG) aplicado en el momento de la barra gris. Círculos amarillos muestran la posición de ROIs donde se obtuvo el curso del tiempo. Las imágenes adquiridas en 2 Hz con una cámara CCD refrescado (panel A) o una cámara EM-CCD (panel B) y analizaron con Banco de trabajo de TI. Barra de escala = 20 μm (imagen microscópica). Haga clic aquí para ver una versión más grande de esta figura.
Video 1: ejemplo de la proyección de imagen simultánea de Lck-RCaMP2 y rea-GCaMP6f en células HeLa. Grabación representativa adquirió en 10 Hz y presentado en la figura 3. Barra de escala = 50 μm. Haga clic aquí para descargar este video.

Video 2: Transitorio2 + Ca espontánea observada en RCaMP2 Lck en astrositos hippocampal. Representante de grabación en 2 Hz (Figura 4A), registrado en el mismo campo de visión como Video 3. Barra de escala = 20 μm. haga clic aquí para descargar este video.
Video 3: Transitorio2 + Ca espontánea observada en rea-GCaMP6f en un hipocampo astrositos. Representante de grabación adquirida en 2 Hz (Figura 4A), en el mismo campo de visión como Video 2. Barra de escala = 20 μm. haga clic aquí para descargar este video.
Video 4:2 + transitoria espontánea Ca observada en Lck-RCaMP2 en una cortical astrositos representante grabación en 2 Hz (Figura 4B), registrado en el mismo campo de visión como de vídeo 5. Barra de escala = 20 μm. haga clic aquí para descargar este video.
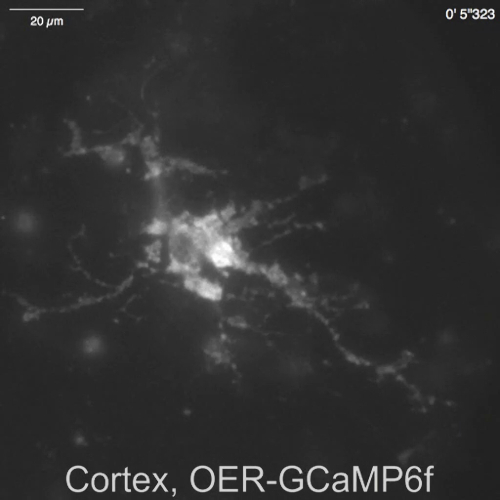
Video 5: Transitorio2 + Ca espontánea observada en rea-GCaMP6f en una cortical astrositos. Representante de grabación adquirida en 2 Hz (Figura 4B), en el mismo campo de visión como Video 4. La barra de escala = 20 μm. haga clic aquí para descargar este video.
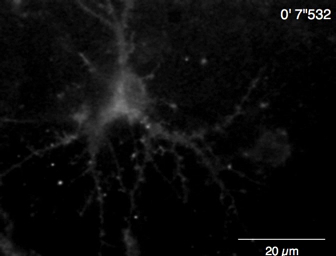
Video 6: Ejemplo de Ca2 + proyección de imagen en una neurona hippocampal de la rata (DIV 10) por Lck-GCaMP6f. Ejemplo de neuronal Ca2 + señales grabadas en 2 Hz (figura 5A). Barra de escala = 20 μm. haga clic aquí para descargar este video.
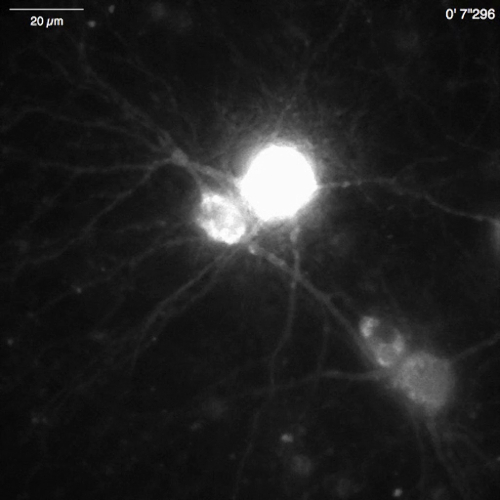
Video 7: Ca2 + lanzamiento en una neurona de hipocampo de ratón (DIV 30) expresar OER-GCaMP6f. Ejemplo de Ca2 + señales neuronales registrados en una neurona de hipocampo de ratón infectada con vectores de AAV de la expresión de OER-GCaMP6f (figura 5B). La neurona fue estimulada con 100 μm dihydroxyphenylglycine (DHPG) aplicado a 30 s para evocar el Ca2 + comunicado de la sala de emergencia. Barra de escala = 20 μm. haga clic aquí para descargar este video.
Discusión
Diversas salidas biológicos son iniciadas por las señales de Ca2 + . CA2 + es un versátil Mensajero de señalización intracelular. Decodificación de Ca2 + señales para evocar salidas específicas ha sido una pregunta biológica fundamental y Ca2 + técnicas de imagen para describir la diversidad de señales de Ca2 + se requiere. El protocolo actualmente detallado permite la detección de distintas señales de Ca2 + en la membrana plasmática y ER (figura 3 y figura 4) y Ca2 + microdominios local dentro de una célula (figura 4 y figura 5). Esto contribuye a describir la diversidad de señales de Ca2 + intracelulares. La resolución temporal de Ca2 + señales también fue mejorada por targeting GECIs en la membrana plasmática y ER porque puede evitar el efecto de una difusión tridimensional de la Ca2 + y GECIs ellos mismos, y tiene el potencial para detectar el momento de afluencia2 + Ca o Ca2 + lanzamiento, que se produce en la membrana.
El protocolo tiene algunas limitaciones. Los usuarios deben tener presente que las señales detectadas son la suma de "el momento de afluencia2 + Ca o liberación" y "Ca2 + difundido hacia fuera de la original fuente de Ca2 +" , especialmente para grandes señales de Ca2 + . Por ejemplo, aunque su estímulo en las células HeLa evoca Ca2 + la versión de la ER, su resultante Ca2 + señales son detectadas por orientada a ER rea-GCaMP6f, sino también por plasma membrana dirigidos Lck-RCaMP2 (figura 3). Otra limitación es que el patrón espacio-temporal de Ca2 + señales puede no ser el único determinante de la producción de señales de Ca2 + . La distribución de proteínas efectoras aguas abajo (tales como Ca2 +-dependiente de quinasas y fosfatasas) también se puede determinar un factor de2. Para descodificar completamente las señales de Ca2 + intracelulares, análisis del comportamiento de la enzima aguas abajo, que no está cubierto en este protocolo, es absolutamente necesario.
Uno de los aspectos más críticos para éxito Ca2 + proyección de imagen es la proyección de imagen adquisición imagen y configuración de las condiciones, así como por otros estudios de imágenes en vivo. Previamente demostramos que la Ca2 + respuestas en la célula son altamente dependientes de la duración e intensidad de la excitación y sobre las condiciones de adquisición de imagen, incluyendo la exposición tiempo y adquisición de frecuencia16. Potencia de iluminación de excitación es el factor más crítico, ya que puede causar toxicidad ligera y fotoblanqueo de GECIs. Las condiciones de grabación de tiempo de exposición, frecuencia, intensidad de luz de excitación y duración de grabación de grabación deben ser optimizadas según el propósito del experimento. Recomendamos reducir el tiempo de exposición y la intensidad de luz de excitación tanto como sea posible para evitar el fotoblanqueo y fototoxicidad a la celda. La frecuencia de la grabación y la duración de la grabación deben ser suficientes para cubrir los eventos de Ca2 + elevación de interés pero deben mantenerse tan bajas como sea posible para evitar también el fotoblanqueo y fototoxicidad. Se recomiendan determinar la frecuencia de la grabación y la duración primero y optimizar el tiempo de exposición y la intensidad de luz para que se minimice el fotoblanqueo de las GECIs. Otro factor importante es el nivel de expresión de las GECIs. GECIs tienen un Ca2 +-buffering efecto como Ca2 +-las proteínas. Por lo tanto, la sobreexpresión de GECIs resulta en el almacenamiento en búfer de Ca2 +, que es fisiológicamente necesario para las células. La cantidad de expresión GECI debe reducirse para evitar la proyección de imagen de las células que expresan altas cantidades de GECIs.
En conclusión, la disección de Ca2 + señales con una resolución subcelular es uno de los pasos más importantes para descifrar la Ca2 + señales intracelulares que determinan el fenómeno biológico de la salida. Este protocolo proporciona un nuevo método para la disección de Ca2 + señales para describir la diversidad entre estas señales. En la actualidad, esta técnica es limitada para los experimentos in vitro. Sin embargo, Lck-GCaMP6f ya está siendo utilizado en vivo Ca2 + imagen en ratones17y rea-GCaMP6f fue confirmado monitorear Ca2 + señales en vivo en las neuronas de motor VD en C. elegans7. Por lo tanto, dirigida a GECIs en el compartimento subcelular tiene el potencial de ampliarse en vivo la proyección de imagen en el futuro, así que Ca2 + disección en vivo.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo es apoyado por las subvenciones siguientes: la ciencia de Japón y la Agencia de tecnología (JST) Precursory de investigaciones para la embrionaria ciencia y tecnología (PRESTO) (JPMJPR15F8, Japón); la sociedad japonesa para la promoción de la ciencia (JSPS) / becas de ayuda para la investigación científica (KAKENHI) (JP18H05414, JP17H05710, JP16K07316), Fundación Takeda. Los autores agradecen a Haruhiko Bito (Universidad de Tokio) para proporcionar RCaMP2 y Arthur J.Y. Huang y Thomas McHugh (RIKEN CBS) por sus vectores AAV y por instrucciones sobre preparación de AAV. Los autores quisieran agradecer a los editores en los diario de experimentos visualizados por su ayuda con video filmación y edición.
Materiales
| Name | Company | Catalog Number | Comments |
| (RS)-3,5-Dihydroxyphenylglycine (DHPG) | Tocris | #0342 | |
| 0.5% DNase I stock solution | Sigma-Aldrich | #11284932001 | Prepare 0.5% DNase I (w/v) in Hanks' Balanced Salt Solution supplemented with 120 mM MgSO4. Prepare 160 µL aliquots and store at -30 °C. |
| 0.5% Trypsin-EDTA solution | Thermo Fisher Scientific | #25300054 | |
| 100 mM L-glutamine (×100 stock) | Thermo Fisher Scientific | #25030081 | Preparing small aliquots of 250-750 µL and store at -30 °C. |
| 100 mM Sodium pyruvate (×100 stock) | Thermo Fisher Scientific | #11360070 | Aliquots (10 mL) can be stored at -20 °C. After thawing, the solution can be maintained at 4 °C for 2 months. |
| 12-Well multiwell culture plates with low-evaporation lid | Falcon | #353043 | Low-evaporation lid is critical for culturing neuron-glia mixed culture. For cell line cells, alternative culture dishes can be used. |
| 18 mm diameter circular coverslips | Karl Hecht "Assistent" | #41001118 | Thickness 1, 18 mm diameter circular coverslips; alternative coverslips can be used. |
| 1 M HEPES | Thermo Fisher Scientific | #15630080 | pH 7.2-7.6 |
| 2.5% Trypsin stock solution (×20 stock) | Sigma-Aldrich | #T4674 | Prepare 150 µL aliquot and store at -30 °C. |
| 50% Poly(ethyleneimine) (PEI) solution | Sigma-Aldrich | #P3143 | Prepare 2% (V/V) PEI stock solution (×50) with distilled water sterilized by filtration. Store stock solution at -30 °C after preparing small aliquots of 250-750 µL. Prepare 0.04% PEI solution with distilled water on the day of coverslip coating. |
| 70% Ethanol | Kept in a spray bottle to be used for surface disinfection. | ||
| Adeno-associated virus (AAV) for Lck-GCaMP6f, Lck-RCaMP2, and OER-RCaMP2 expression under the direction of the EF1a promoter | AAV can be prepared using AAV Helper Free System (Agilent Technologies) and HEK293 cells, or alternative methods. pAAV.EF1a.Lck-GCaMP6f, pAAV.EF1a.Lck-RCaMP2, and pAAV.EF1a.OER-GCaMP6f are available upon request. | ||
| B-27 supplement (×50 stock) | Thermo Fisher Scientific | #17504044 | This can be replaced by B-27 plus supplement (Thermo Fisher Scientific; #A3582801) or MACS NeuroBrew-21 (Miltenyi Biotec, Bergisch Gladbach, Germany; #130-093-566). |
| B57BL/6 | Japan SLC, Inc. | ||
| Camera for microscopic image recording | The following cameras were available for use: cooled-CCD camera (e.g., Hamamatsu Photonics, OECA-ER), EM-CCD camera (e.g., Hamamatsu Photonics, ImagEM; Andor, iXon) or CMOS camera (e.g., Hamamatsu Photonics ORCA-Flash4.0) | ||
| Cell freezing container | Sarstedt K.K. | #95.64.253 | Alternative cell freezing container can be used. |
| Cell strainer | Falcon | #352350 | |
| CO2 incubator | Maintain at 37 °C, 5% CO2. | ||
| Cryogenic tube | Corning | #430661 | Alternative cryogenic tubes can be used. |
| Cryopreservation medium | Zenoaq | "CELLBANKER1" | |
| Culture medium (for HeLa cells) | Dulbecco's modified Eagle's medium (DMEM) supplemented with 10% heat-inactivated fetal bovine serum, and penicillin-streptomycin solution (final concentration: Penicillin 100 U/mL and Streptomycin 100 µg/mL) | ||
| Dissection medium | One milliliter of 1 M HEPES (final concentration 20 mM) to 49 mL DMEM | ||
| DMEM | Nacalai | #08456-65 | Alternative DMEM can be used. |
| DMEM | Nacalai | #08456-65 | Low glucose |
| DNA transfection reagent | Sigma-Aldrich | #6366244001 | "X-tremegene HP DNA transfection reagent" Alternative transfection reagents can be used. |
| Glass jar with a lid | 500 mL jar (for mouse) or 1,500 mL jar (for rat) to anesthetize the animal | ||
| HBSS | Thermo Fisher Scientific | #14170161 | HBSS free of calcium and magnesium |
| Heat inactivated bovine serum | Thermo Fisher Scientific | #10100147 | |
| HeLa cells | RIKEN BioResource Center | #RCB0007 | |
| Histamine | Sigma-Aldrich | #H7125 | |
| Image analysis software | Such as Metamorph (Molecular Devices), ImageJ (NIH), and TI Workbench14 (custom made) | ||
| Image splitting optics | Hamamatsu Photonics | #A12801-01 | W-view GEMINI |
| Image splitting optics dichroic mirror | Semrock | #FF560-FDi01-25×36 | For separation of green fluorescent protein/red fluorescent protein (GFP/RFP) signal |
| Image splitting optics emission filters | Semrock | #FF01-512/25-25, #FF01-630/92-25 | For emission of GFP/RFP signal, respectively |
| Imaging medium and buffer | Use optimal medium or buffer for the experiment. When medium is used, medium without phenol red is desirable to reduce background fluorescence. Add 20 mM HEPES to maintain pH outside of CO2 incubator. | ||
| Incubation saline | Add 1 mL of 1 M HEPES (20 mM) to 49 mL HBSS | ||
| Inverted fluorescence microscope | Such as IX73 (Olympus) or Eclipse TI (Nikon Instech) | ||
| Isoflurane | Pfizer | Used for anesthesia | |
| Maintenance medium (for 4 × 12 well dishes) | 48.5 mL Neurobasal-A medium supplemented with 1 mL B-27, 500 µL of L-glutamine stock and 25 µL Penicillin-Streptomycin solution. | ||
| Maintenance medium for frozen cortical cells (for 1 × 12 well dishes) | 12.2 mL Neurobasal plus medium supplemented with 250 µL B-27, 125 µL of L-glutamine stock and 6.2 µL Penicillin-Streptomycin solution. | ||
| MEM (Minimum Essential Medium) | Thermo Fisher Scientific | #11090-081 | |
| Microscope filter set for GCaMP6f imaging | Appropriate filter for GFP (excitation, 480 ± 10 nm; emission, 530 ± 20 nm) | ||
| Microscope filter set for RCaMP2 imaging | Appropriate filter for RFP (excitation, 535 ± 50 nm; emission, 590 nm long pass) | ||
| Microscope filter sets for double imaging of RCaMP2 and GCaMP6f | Semrock | #FF01-468/553-25, #FF493/574-FDi01-25×36, #FF01-512/630-25 | Dual excitation filter, Dual dichroic mirror, and emission filter for GFP/RFP imaging. |
| Microscope heating system | A heating system to maintain cells at 37 °C during the imaging. To avoid drift caused by thermal expansion, heating systems covering the entire microscope itself (e.g., Tokai Hit, Thermobox) are recommended. | ||
| Microscope light source for excitation | Mercury lamp (100 W), xenon lamp (75 W), Light-emitting diode (LED) illumination system (e.g., CoolLED Ltd., precisExcite; Thorlabs Inc., 4-Wavelength LED Source; Lumencor, SPECTRA X light engine). In case of mercury lump and xenon lamp, use ND filter to reduce the excitation intensity. | ||
| Microscope objective lens | Plan-Apochromat oil immersion objective with numerical aperture higher than 1.3 is highly recommended for the recording of spontaneous Ca2+ activity in neurons and astrocytes. | ||
| Neurobasal plus medium | Thermo Fisher Scientific | #A3582901 | |
| Neurobasal-A Medium | Thermo Fisher Scientific | #10888022 | Neurobasal plus medium (Thermo Fisher, A3582901) can be used instead of Neurobasal-A medium. |
| PBS(-): Phosphate-buffered saline free of Ca2+ and Mg2+ | Fujifilm Wako Pure Chemical Cooperation | #164-23551 | The absence of Ca2+ and Mg2+ is critical not to inhibit the trypsin activity. An alternative to PBS(-) can be used. |
| PC and image acquisition software | Such as Metamorph (Molecular Devices); Micromanager; TI Workbench14. | ||
| Penicillin-Streptomycin solution | Thermo Fisher Scientific | #15140122 | Penicillin 10,000 U/mL and Streptomycin 10,000 µg/mL |
| Plasmid for Lck-GCaMP6f, Lck-RCaMP2, and OER-RCaMP2 expression under cytomegalovirus promoter 7-9 | Available upon request | ||
| Plating medium (for 4 × 12 well dishes) | 48 mL MEM supplemented with 1 mL B-27 supplement, 500 µL L-glutamine stock (final concentration: 2 mM), 500 µL of sodium pyruvate stock (1 mM) and 25 µL Penicillin-Streptomycin solution (penicillin 5 U/mL, streptomycin 5 µg/mL). This concentration of Penicillin-Streptomycin, which is 1/20 of the concentration recommended by the manufacturer, is critical for neuronal survival. | ||
| Recording chamber | Elveflow | Ludin Chamber | This recording chamber is for 18 mm diameter round coverslips. |
| Reduced serum media | Thermo Fisher | #11058021 | Opti-MEM |
| Stereomicroscope | Used to dissect hippocampi. Olympus SZ60 or equivalent stereomicroscopes are available. | ||
| Surgical instruments | Standard dissecting scissors to cut the abdomen of a mouse or a rat, tweezers to pinch the uterus, delicate dissecting scissors to cut the uterus and the head of embryo, ring forceps to pinch the embryos, 13 cm curved Semken forceps (Fine Science Tools #11009-13) to extract brains, 3 forceps with fine tips (Dumont Inox #5) | ||
| Transfection reagent for neuron | Thermo Fisher Scientific | #L3000008 | "Lipofectamine 3000" reagent. It is composed of the the "supplement (P3000)" that should be mixed with plasmid DNA in the step 2.2.3, and the "transfection reagent (lipofectamine 3000)" used in the step 2.2.4. |
| Trypan blue (0.4%) | Thermo Fisher Scientific | #15250061 | |
| Wash medium for frozen cortical cells | 25 mL DMEM, supplemented with 250 µL heat-inactivated fetal bovine serum + 12.5 µL Penicillin Streptomycin. | ||
| Wistar rats | Japan SLC, Inc | Pregnant rats (E18) |
Referencias
- Clapham, D. E. Calcium signaling. Cell. 131 (6), 1047-1058 (2007).
- Bagur, R., Hajnoczky, G. Intracellular Ca(2+) Sensing: Its Role in Calcium Homeostasis and Signaling. Molecular Cell. 66 (6), 780-788 (2017).
- Bannai, H., et al. Bidirectional Control of Synaptic GABAAR Clustering by Glutamate and Calcium. Cell Reports. 13 (12), 2768-2780 (2015).
- Tojima, T., Hines, J. H., Henley, J. R., Kamiguchi, H. Second messengers and membrane trafficking direct and organize growth cone steering. Nature Reviews Neuroscience. 12 (4), 191-203 (2011).
- Shigetomi, E., Kracun, S., Sofroniew, M. V., Khakh, B. S. A genetically targeted optical sensor to monitor calcium signals in astrocyte processes. Nature Neuroscience. 13 (6), 759-766 (2010).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Niwa, F., et al. Dissection of local Ca(2+) signals inside cytosol by ER-targeted Ca(2+) indicator. Biochemical and Biophysical Research Communications. 479 (1), 67-73 (2016).
- Vervliet, T., et al. Basal ryanodine receptor activity suppresses autophagic flux. Biochemical Pharmacology. 132, 133-142 (2017).
- Sakuragi, S., Niwa, F., Oda, Y., Mikoshiba, K., Bannai, H. Astroglial Ca2+ signaling is generated by the coordination of IP3R and store-operated Ca2+ channels. Biochemical and Biophysical Research Communications. 486 (4), 879-885 (2017).
- Inoue, M., et al. Rational design of a high-affinity, fast, red calcium indicator R-CaMP2. Nature Methods. 12 (1), 64-70 (2015).
- Quasthoff, K., et al. Freshly frozen E18 rat cortical cells can generate functional neural networks after standard cryopreservation and thawing procedures. Cytotechnology. 67 (3), 419-426 (2015).
- Boehringer, R., et al. Chronic Loss of CA2 Transmission Leads to Hippocampal Hyperexcitability. Neuron. 94 (3), 642-655 (2017).
- Arizono, M., et al. Receptor-selective diffusion barrier enhances sensitivity of astrocytic processes to metabotropic glutamate receptor stimulation. Science Signaling. 5 (218), ra27 (2012).
- Kanemaru, K., et al. In vivo visualization of subtle, transient, and local activity of astrocytes using an ultrasensitive Ca(2+) indicator. Cell Reports. 8 (1), 311-318 (2014).
- Inoue, T. TI Workbench, an integrated software package for electrophysiology and imaging. Microscopy (Oxford, UK). 67 (3), 129-143 (2018).
- Miyamoto, A., Bannai, H., Michikawa, T., Mikoshiba, K. Optimal microscopic systems for long-term imaging of intracellular calcium using a ratiometric genetically-encoded calcium indicator. Biochemical and Biophysical Research Communications. 434 (2), 252-257 (2013).
- Srinivasan, R., et al. New Transgenic Mouse Lines for Selectively Targeting Astrocytes and Studying Calcium Signals in Astrocyte Processes In Situ and In Vivo. Neuron. 92 (6), 1181-1195 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados