Method Article
Una guía para crear un altamente inclinado barrido microscopio de azulejo para la proyección de imagen de una sola molécula campo de visión extendida
En este artículo
Resumen
Una instrucción detallada se describe en cómo construir una muy inclinada de barrido microscopio de azulejo (HIST) y su uso para la proyección de imagen de una sola molécula.
Resumen
Proyección de imagen de una sola molécula ha avanzado grandemente nuestra comprensión de los mecanismos moleculares en estudios de biología. Sin embargo, ha sido difícil obtener imágenes de gran tamaño campo de visión y de alto contraste en los tejidos y células de espesor. Aquí, presentamos muy inclinada teja barrida (HIST) microscopía que supera este problema. Un par de lentes cilíndricas se implementó para generar un haz de excitación alargado que fue analizado en una gran superficie de proyección de imagen vía un espejo galvo rápido. Una configuración de 4f fue utilizada para colocar componentes ópticos. Una cámara científica semiconductor complementario de óxido metálico había detectado la señal de fluorescencia y bloquea el fondo fuera de foco con la ranura confocal dinámica sincronizada con el barrido del haz. Presentamos una instrucción paso a paso en la construcción del microscopio HIST con todos los componentes básicos.
Introducción
Proyección de imagen de fluorescencia de una sola molécula desempeña un papel importante en muchos estudios biológicos que revelan ultraestructuras, dinámica y la cantidad de biomoléculas1,2,3. Sin embargo, ha sido difícil estudiar solo las moléculas dentro de células o tejidos. Mientras que la microscopía confocal proporciona alta capacidad de seccionamiento4, no es conveniente para la proyección de imagen de una sola molécula por photobleaching severa por la intensidad de excitación alta o baja velocidad de proyección de imagen. Microscopia de campo amplio utiliza iluminación más débil pero sufre de una pobre señal a fondo ratio (SBR)5. Microscopía de luz de hoja, por el contrario, podría demostrar buenas secciones y photobleaching baja6; sin embargo, la disposición apertura numérica (NA) grandemente está limitada por el requisito de objetivos colocados ortogonalmente7. Por otra parte, requiere iluminadores especiales y muestra cámaras8,9.
Por estas razones, la microscopia hoja óptica altamente inclinada y laminado (HILO) ha sido ampliamente utilizada para 3D sola molécula imagen10. Cuando una viga inclinada encuentra con una interfaz de dos medios (vidrio y agua, por ejemplo), el rayo se refracta conforme a la ley de Snell. Lo importante, la viga refractada es más delgada, y su grosor se describe como dz = R/tan(θ) donde R es el diámetro de la viga inclinada y θ es el ángulo de refracción del haz transmitido. Esta sencilla aplicación da como resultado una buena capacidad de seccionamiento. Sin embargo, esta relación indica que requiere de una iluminación fina (es decir, alta capacidad de seccionamiento) una R pequeña o una grande θ. Por ejemplo, cuando R = 20 μm y θ = 72 grados, uno puede obtener dz = 6,5 μm. Puesto que hay un límite práctico para aumentar el ángulo de refracción para la imagen profunda dentro de las células y evitar la reflexión interna total, hay un acoplamiento fuerte de la iluminación de diámetro y el espesor de la viga. Por esta razón, la proyección de imagen de HILO muestra una relativamente pequeño campo de visión (FOV) que limita mucho sus aplicaciones en imagen multicelular.
Recientemente, hemos superado este problema por microscopia altamente inclinada teja barrida (HIST) donde el FOV es disociado del espesor de la viga en una forma muy simple11. En primer lugar, se genera un haz de luz alargado en una dirección mediante un par de lentes cilíndricas. Este rayo, como un azulejo, produce una iluminación fina con dz ~ 4 μm mientras que su campo de visión es de 130 x 12 μm2. Entonces, el azulejo se barre a través de la muestra utilizando un espejo giratorio del galvo. Mientras tanto, la imagen de fluorescencia se graba en una cámara científica semiconductor complementario de óxido metálico (sCMOS) que filtra eficientemente fuera de enfoque fondo funcionando en un modo de obturador rodante que sirve de detección ajustable abertura confocal. De esta manera, HIST microscopía permite proyección de imagen de una sola molécula con un mayor campo de visión (~ 130 x 130 μm2) y una sensibilidad más fina que la proyección de imagen de HILO. Aplicamos esta imagen nueva técnica para detectar las transcripciones del RNA con una sola sonda en las células o con unas puntas de prueba en los tejidos de cerebro de ratón, que tiene gran potencial para estudiar enfermedades y expresión génica. A diferencia de otros enfoques, HIST emplea sólo un objetivo de apertura numérica alta sola sin un iluminador adicional u objetivos de detección remota y es totalmente compatible con los microscopios invertidos. Estas ventajas junto con un FOV grande y alto contraste hará HIST microscopia una herramienta importante en biología y medicina. Presentamos instrucciones detalladas con respecto a la instrumentación del microscopio HIST y cómo probar y calibrar su funcionamiento como abajo.
Protocolo
1. configuración de las herramientas de microscopio, láser y alineación
- Antes de construir el microscopio, preparar todos los componentes necesarios incluyendo optomecánico, óptica y electrónica indicada en la Tabla de materiales.
- Preparar un cuerpo de microscopio compuesto principalmente de dos partes: un soporte objetivo con un puerto roscado RMS y un piezo-escenario montado sobre un bloque de aluminio (figura 1A).
Nota: El cuerpo del microscopio a medida se utiliza para la conveniencia y flexibilidad de la instrumentación12. Cualquier cuerpo de microscopio disponible comercialmente se puede utilizar para microscopía HIST. - La combinación de múltiples líneas de láser y acoplándolos a una fibra del solo modo
- Instalar 405, 561, láseres de 638 nm en la óptica de la tabla y combina las vigas a través de un divisor de viga polarizantes y un espejo dicroico de paso largo, como se muestra en la figura 1B. Asegúrese de que todos los rayos de láser pasan a través de agujeros de alfiler en la herramienta de alineación. Inserte placas de onda media para la regulación de la potencia.
Nota: Use anteojos de seguridad para la protección de los ojos y usar bloques de viga para absorber los rayos láser no deseados. - Instalar una lente de acoplamiento de la fibra (f = 4,5 mm) y un adaptador de la fibra en traductor de eje z con un sistema de jaula.
- Conecte una fibra multimodo (MMF, Ø 62.5 μm) para el adaptador de la fibra. Ajuste cada par del espejo dirección y z-traductor hasta que la eficiencia de acoplamiento de cada láser es superior al 95%. El haz de salida tiene un perfil en forma de gaussiana cercano con patrones de punto.
- Quitarle la fibra multimoda y conecte una fibra monomodo (SMF). Similar a MMF, ajustar y maximizar la eficiencia de acoplamiento de tres láseres.
- Instalar 405, 561, láseres de 638 nm en la óptica de la tabla y combina las vigas a través de un divisor de viga polarizantes y un espejo dicroico de paso largo, como se muestra en la figura 1B. Asegúrese de que todos los rayos de láser pasan a través de agujeros de alfiler en la herramienta de alineación. Inserte placas de onda media para la regulación de la potencia.
- Montar una fuente de luz colimada que se utilizará para la alineación de la viga en los caminos de la excitación y detección. Este dispositivo se compone de una fuente de luz temporal coherente (561 nm) conectado a SMF, adaptador de la fibra, lente acromática (f = 60 mm), diafragma y Ø1 "tubo separador en un sistema de jaula (figura 1C). Ajustar la distancia entre el adaptador de la fibra y la lente usando un interferómetro que esquila para la colimación.
- Preparar una herramienta de alineación de la viga (figura 1D). Se trata de un par de postes de aluminio con agujeros de alfiler en 2" altura de la superficie de la tabla óptica, que permite la alineación rápida y precisa de la viga.
- Montar un sistema de doble agujero de alfiler que consiste en dos Ø1 "discos de alineación del cristal de tierra en cada extremo y dos Ø1" tubos (el inferior es ranurado) de la lente como se muestra en la figura 1E.
2. establecer la trayectoria de detección
- Sacar el objetivo e instale la fuente de luz blanca y colimada. Ajuste los botones del espejo (M1) bajo el soporte del objetivo para que el haz de salida del microscopio es más o menos paralelos a la mesa óptica en altura y alineados con los agujeros roscados en la mesa. Consulte la figura 2 para posiciones detalladas de cada componente óptico.
- Inserte un multibanda espejo dicroico (DM) y reflejar el rayo de 90 grados. Usar el tamaño máximo del diafragma y asegúrese de que el rayo pasa a través del centro del espejo dicroico sin saturación.
- Use el rayo fugas pasando a través del espejo dicroico para guiar la alineación de la trayectoria de detección. Coloque una cámara sCMOS al rayo y asegúrese de que el rayo golpea el centro de la viruta de la cámara mediante el uso de dos espejos (M2 y M3).
- Insertar una lente de tubo (TL; f = 300 mm) aproximadamente 300 mm de la cámara.
- Retire la fuente de luz blanca y colimada y ajustar la distancia relativa entre la cámara y la lente del tubo hasta que un patrón en el techo es claramente resuelto por la cámara.
- Inserte un filtro de paso de varias bandas (BF) antes de la lente de tubo para la proyección de imagen de la fluorescencia multicolora.
3. establecer la ruta de la excitación
- Vuelva a instalar la fuente de luz colimada en el soporte del objetivo. Coloque un espejo doble (M4) para dirigir la salida de la viga desde el microscopio por 90 grados. Ajuste los botones del espejo dicroico y el espejo de doble forma iterativa hasta que la viga pasa a través de agujeros de alfiler en la herramienta de alineación de la viga.
- Desconecte la fuente de luz blanca y colimada y lo instalamos en la mesa, en la que el haz apunta hacia el cuerpo del microscopio. Alinee el rayo utilizando una herramienta de alineación de haz y un sistema de doble agujero de alfiler.
- Insertar una lente de L4 (f = 400 mm; Ø = 2") a la trayectoria óptica aproximadamente 400 mm de soporte objetivo. Instale la lente del objetivo y ajuste la posición de L4 a lo largo del eje óptico hasta un patrón perfecto disco luminoso en el techo.
Nota: Al insertar la lente, la posición de la viga pasa a través de la lente debe mantenerse sin cambios. La lente L4 tiene una rosca de SM2 que le permite ser fácilmente atado/separada de la placa roscada SM2 jaula de 60 mm. - Desenrosque el objetivo y vuelva a instalar la fuente de luz colimada con un diafragma abierto. Trazar hacia abajo de la salida del haz desde el microscopio con una tarjeta de visita. Montar un espejo M5 en el lugar donde el tamaño de la viga es la más pequeña y aproximadamente 400 mm distancia L4, que es un plano de imagen conjugado (cIP).
- Instale un espejo M6 y reflejar el rayo de 90 grados. Ajuste iterativamente M5 y M6 con la herramienta de alineación de la viga.
- Insertar una lente L3 (f = 150 mm) aproximadamente 150 mm del M5. Uso de un interferómetro que esquila para la colimación del haz de salida.
- Temporalmente llevar L4 y rastro abajo de la viga para encontrar la posición focal de L3. Poner un espejo del galvo de eje en este punto, que es un plano focal nuevo conjugado (cBFP). Fuente de 0 voltios para el espejo del galvo y gire el soporte del espejo del galvo para que refleje el haz de 90 grados.
- Coloque un espejo doble M7. Coloque correctamente el L2 (f = 100 mm) al igual que paso 3.6.
- Retire la fuente de luz blanca y colimada del objeto soporte. Instalar una lente de colimación L1 (f = 100 mm), adaptador de la fibra y el iris. Conecte una fibra monomodo en el adaptador y enviar la viga a través del sistema de proyección de imagen.
- Vuelva a L4 y afinar el sistema hasta que aparezca un patrón perfecto disco luminoso en el techo.
4. configuración de las lentes cilíndricas
- Insertar una lente cilíndrica (CL1, f = 400 mm) después de L1 y asegúrese de que la lente cilíndrica centra el rayo a lo largo del eje x.
- Inserte otra lente cilíndrica (CL2, f = 50 mm) a la trayectoria de viga. Uso de un interferómetro que esquila para que el haz de salida es colimado.
Nota: La distancia entre las dos lentes cilíndricas es de 450 mm. El haz de salida tiene una relación de compresión de 8 y un patrón de disco ventilado en forma oval alargada se forma en el techo.
5. prueba de proyección de imagen de azulejo
- Preparación de muestra de hidrogel 3D. Mezcla 20 nm Crimson cuentas con una solución de hidrogel, que consiste en acrylamide:bisacrylamide de 12% (29: 1), 0,2% (v/v) TEMED y persulfato de amonio 0.2% (p/v) en tampón x TAE 0.75. Inyectar 50 μl de la solución mezclada en una cámara de flujo como se describe en otra parte11. Después de 10 min, la muestra de hidrogel 3D está lista para la proyección de imagen.
- Colocar la muestra en el portamuestras. Encienda 638 nm láser y ajustar la potencia a < 1 mW para la excitación de la muestra.
- Ejecute el software de control de cámara. En el panel de adquisición-ajuste de cámara, seleccione interna en el modo de disparador y haga clic en vídeo gratis funcionando modo.
- Ajustar ligeramente la posición de la cámara para que la imagen se encuentra en el centro de la cámara cuando 0 voltios es aplicada al espejo galvo.
- Gire la rueda horizontal del espejo M5 para lograr una iluminación altamente inclinada.
Nota: Con el aumento del ángulo de iluminación, la imagen de hidrogel se vuelve más clara que el de la imagen de Epi como la viga es más delgada. Sin embargo, la imagen mantiene casi la misma posición. - Grabar la imagen de azulejo. Calcular la anchura de iluminación eficaz11. Por ejemplo, la figura 3 muestra el ancho de iluminación eficaz de 12 μm.
6. HIST imagen
- Prepare una tarjeta de adquisición de datos conectada con un bloque de terminales. Conectar usuario 1 conector BNC con P0.0 a través de un cable eléctrico. Utilizar usuario 1 como una salida digital la activación externa de sCMOS cámara. Conectar una salida AO0 a un controlador de espejo galvo.
- Generar trenes de pulsos TTL de P0.0 utilizando un programa a medida (figura 4A) y fijar el periodo de tiempo = 400 ms y t_ON = 2 Sra. comprobar los pulsos generados del usuario 1 terminal BNC por un osciloscopio digital y luego conecte el cable BNC a la cámara Puerto de disparo externo.
Nota: El software de control utilizado en este documento está disponible a petición. Cuando la proyección de imagen en las velocidades de fotogramas diferentes con la cámara, el periodo de tiempo debe ajustarse en consecuencia. - Iniciar un espejo galvo mediante el programa a medida. Ajustar Vmin a-500 mV y Vmáximo a 500 mV para obtener imágenes de campo visual completo. Tenga en cuenta que en esta operación, hidrogel 3D todavía demuestran alta fondo similares a la Epi iluminación.
- Cambiando el valor de adquisición de la cámara.
- Seleccione externo en modo de gatillo y abajo (secuencial) en Plus de luz lista desplegable como se muestra en la figura 4B.
Nota: En este escenario, la cámara toma imágenes a menos que una señal de disparo se activa. - Haga clic en Scan Control de velocidad para control de tiempo de la exposición altura y línea de ventana y establezca los valores a ser 180 filas y 28 ms, respectivamente.
Nota: Cuando un azulejo de la anchura (Weff) es 180 filas (12 μm) y un tiempo de integración por línea (Tint) es 28 ms, un tiempo de retardo entre líneas (TD) se determina como TD = Tint/weff = 0.156 Sra. para proyección de imagen x 2.048 2.048 píxeles, el tiempo de adquisición total es 2.048 x TD + Tint = 346 ms, correspondiente a ~2.9 fps.
- Seleccione externo en modo de gatillo y abajo (secuencial) en Plus de luz lista desplegable como se muestra en la figura 4B.
- Ajustar ligeramente Vmax y Vmin para obtener imágenes más claras.
- Obtener imágenes 3D de la pila utilizando el programa a la medida cambio pila 3D on y especificando el número de pilas y el tamaño de paso.
Resultados
Por ejemplo, ADN marcado con Atto647N era reflejada con una longitud de onda de excitación de 638 nm en un hidrogel 3D. ADN fue anclado a la red de hidrogel mediante una molécula de acrydite durante la polimerización del gel. Las imágenes fueron tomadas en 5 μm sobre la superficie como se muestra en la figura 5un. La imagen HIST demostró mucho menos fondo en comparación con la imagen de Epi, de la cual la relación señal a fondo se calculó en 1,9 ± 0,7 para la HIST la imagen mientras la mayoría de los sitios de sola molécula apenas pudo detectarse por Epi.
Una sola molécula RNA hibridación fluorescente in situ (smFISH) fue realizado con 4 sondas de FISH. Figura 5 b muestra las imágenes de la smFISH de EEF2 (factor 2 de elongación de la traducción eukaryotic) etiquetados con 647 AlexaFluor en células A549 en un búfer de imagen (consulte nuestro trabajo anterior sobre la preparación de muestra11). Una proyección de intensidad máxima fue realizada en 20 pilas de z correspondiente a 5 μm de grosor. La imagen HIST demostrada no sólo mucho mejor SBR pero también más iluminación uniforme en comparación con la imagen de Epi. Para la proyección de imagen de Epi, el tiempo de exposición era 400 ms. mientras que para la integración de la proyección de imagen de HIST tiempo por línea era 32 ms, que tenían el mismo poder de iluminación de 7.5 mW medido antes el objetivo. Las velocidades de proyección de imagen de Epi y HIST fueron 2,5 fps.

Figura 1 . Herramientas de cuerpo, láseres y alineación de microscopio. (A) objetivo y sostenedor de la muestra. (B) foto de sistemas láser. LP, espejo dicroico de paso largo; Placas de λ/2, media onda; PBS, beamsplitter polarizante. (C) Collimated fuente de luz. (D) herramienta de alineación de la viga con dos agujeros de alfiler insertables. Sistema de doble orificio (E). Haga clic aquí para ver una versión más grande de esta figura.
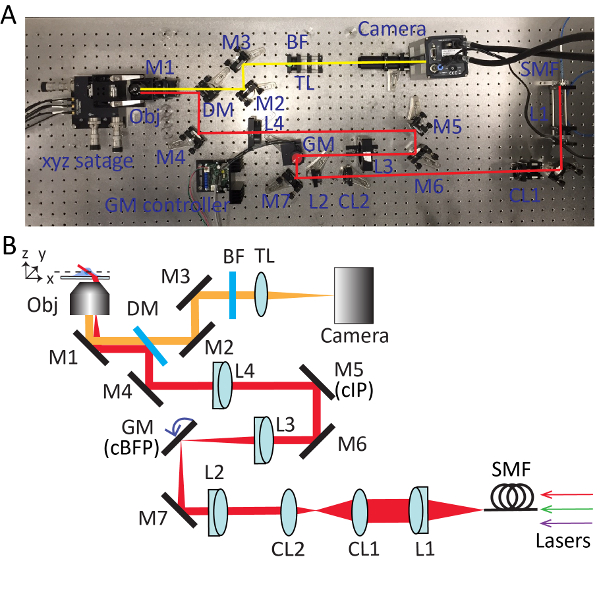
Figura 2 . Configuración detallada para microscopía altamente inclinada teja barrida (HIST). Foto (A) y (B) esquema de sistema de microscopio HIST. BF, filtro de paso de banda múltiple; Lentes 2 CL1, cilíndricas; DM, espejo dicroico; GM, galvo espejo; BF, filtro band-pass; M1-7, espejos; L1-4, lentes; SMF, fibra del solo modo; TL, lente de tubo; cIP, plano de imagen conjugado; cBFP, conjugado plano focal hacia atrás. Haga clic aquí para ver una versión más grande de esta figura.
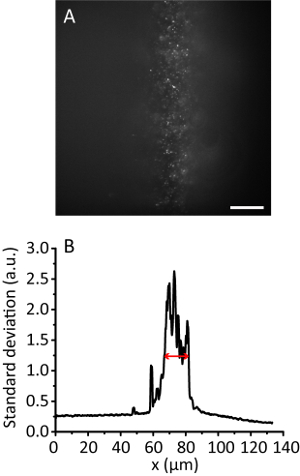
Figura 3 . Azulejo de la iluminación con una relación de compresión de 8. (A) imagen de fluorescencia de 20 granos de nm en un hidrogel 3D. Barra de escala, 20 μm. (B) desviación estándar de proyección a lo largo de la dirección y de la A, por 10 puntos. La flecha roja indica un ancho de iluminación eficaz de 12 μm. haga clic aquí para ver una versión más grande de esta figura.
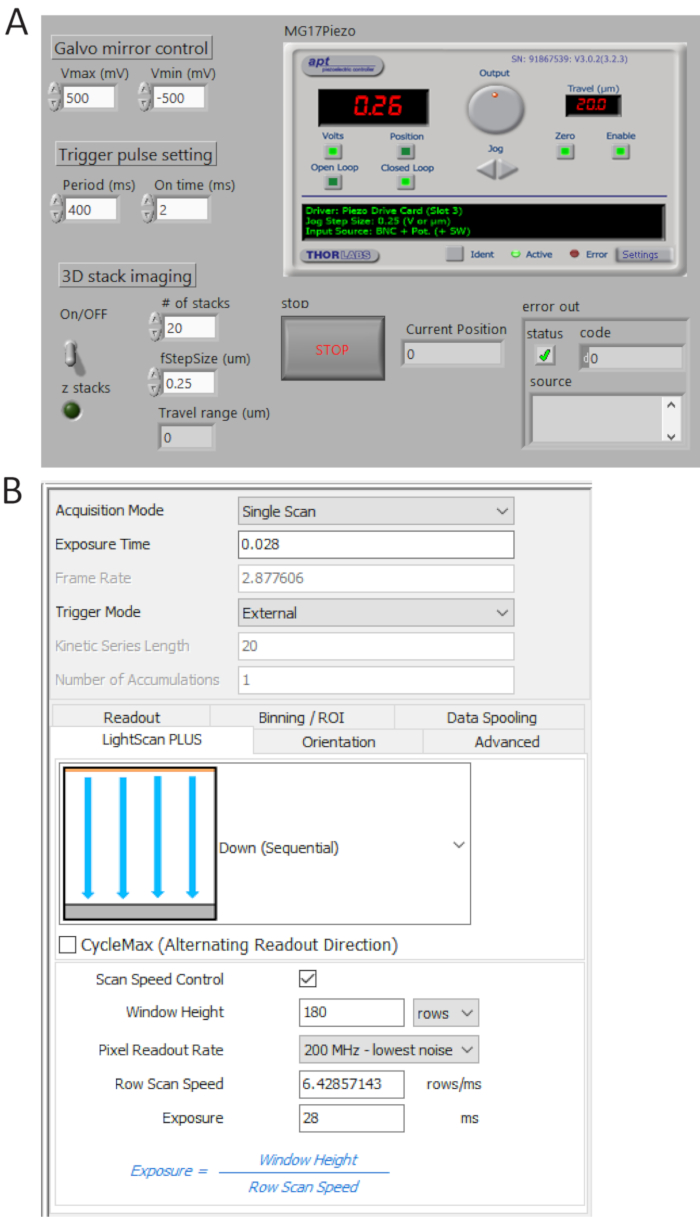
Figura 4 . Control y software de imágenes frente a paneles. Programa de LabView a la medida (A) A síncrono controla el barrido del espejo galvo, la adquisición inicial de sCMOS cámara y el movimiento de la etapa de piezo. Panel de control (B) valor de adquisición de cámara. Haga clic aquí para ver una versión más grande de esta figura.
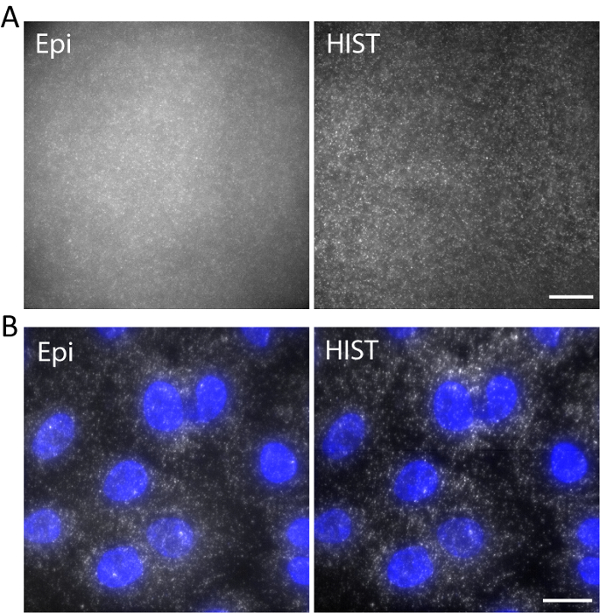
Figura 5. (A) ADN marcado con imágenes de Atto647N en un hidrogel 3D con iluminación Epi y HIST. (B) smFISH imágenes de EEF2 con 4 peces sondas en células A549 por microscopia Epi y HIST. En azul se muestra tinción DAPI. Escala de barras, 20 μm. haga clic aquí para ver una versión más grande de esta figura.
Discusión
Hay dos pasos críticos en este protocolo. La primera es la colocación adecuada de L4 en el paso 3.3, asegurando que el rayo incidente pasa por el centro de la lente y se forma un patrón perfecto disco luminoso en el techo. La posición de L4 determina la ubicación de todos los otros componentes ópticos, incluyendo GM, M5, L3 y L2. El segundo paso crítico es el proceso de sincronización. Para rechazar la salida del fondo focus, píxeles activos cuya anchura eficaz de detección es igual a la anchura de la baldosa deben ser sincronizados con el barrido del haz. Por lo tanto, es necesario medir la anchura de iluminación eficaz de un azulejo de la viga (paso 5.6) y parámetros de la cámara ajustado en consecuencia paso 6.4.
Cuando proyección de imagen con gran campo de visión, el método presentado muestra un fondo mayor en un lado respecto al otro lado. Esto se atribuye a ángulos ligeramente alterados de iluminación en diferentes posiciones de proyección de imagen. Implementación de un segundo espejo galvo en vez de M5 alivia este problema como lo demuestra antes de forma sincrónica ajustando la posición y el ángulo barrido11. En lugar de Dobletes acromáticos estándar, una lente de telecentric la exploración será también útil. Sin embargo, para un área de la proyección de imagen < 8.080 μm2, galvo solo barrido del espejo era suficiente. HIST microscopia tiene un límite de la profundidad de la proyección de imagen, sin embargo, es capaz de obtener una buena SBR cuando proyección de imagen a ~ 15 μm con un haz de azulejo 12 μm y un NA 1.45 aceite inmersión objetivo11.
En este protocolo, se utilizó una relación de compresión de la viga de 8 para hacer una viga de azulejo. Una iluminación más delgada puede utilizarse en HIST microscopia para lograr mayor SBR, que pueden ser de gran alcance para el tejido de una sola molécula de11. Sin embargo, en este caso, efecto de fotoblanqueo se debe considerar por una intensidad de excitación creciente mientras que la actual relación de compresión de la viga reducida fotoblanqueo en imágenes en 3D en comparación con el Epi11. Comparado con microscopios de luz-hoja con dos objetivos colocados ortogonalmente, HIST microscopia es simple de implementar y compatible con las preparaciones de muestras convencionales. El SBR mayor FOV grande de microscopía HIST es adecuado para el estudio de las interacciones y las dinámicas de las biomoléculas individuales en varias celdas y puede utilizarse más en proyección de imagen de súper resolución y seguimiento de una sola molécula.
Divulgaciones
Universidad de la Florida Central ha presentado una solicitud de patente que cubre el trabajo descrito en este documento.
Agradecimientos
Este trabajo fue apoyado por defensa avanzada investigación proyectos agencia (DARPA) (HR00111720066) y National Science Foundation (NSF) (1805200). Agradecemos a Michael Serge en Andor Technology para prestar generosamente la cámara sCMOS.
Materiales
| Name | Company | Catalog Number | Comments |
| 1" Achromatic doublet | Thorlabs | AC254-060-A-ML | Collimator |
| 1" Achromatic doublet | Thorlabs | AC254-100-A-ML | L1,L2 |
| 1" Achromatic doublet | Thorlabs | AC254-300-A-ML | TL |
| 1" Broadband Dielectric Mirrors | Thorlabs | BB1-E02-10 | M1~M7 |
| 1" Cylindrical Lenses | Thorlabs | LJ1363RM-A | CL1 |
| 1" Cylindrical Lenses | Thorlabs | LJ1695RM-A | CL2 |
| 1" square kinematic mount | Edmund Optics | 58-857 | For dichroic mirror mounting |
| 1" Threaded Cage Plate | Thorlabs | CP02 | For holding other lenses |
| 2" Achromatic doublet | Thorlabs | AC508-150-A-ML | L3 |
| 2" Achromatic doublet | Thorlabs | AC508-400-A-ML | L4 |
| 2" Threaded Cage Plate | Thorlabs | LCP01 | For holding L4 |
| 2" Threaded Cage Plate | Thorlabs | LCP01T | For holding L3 |
| 2% Bis Solution | Bio Rad | 64085292 | hydrogel component |
| 20 nm fluorescent beads | Thermo Fisher | F8782 | For testing imaging |
| 30 mm Cage Right-Angle Kinematic Mirror Mount | Thorlabs | KCB1 | For objective & camera mounting |
| 30mm Cage System Iris | Thorlabs | CP20S | |
| 3-Axis NanoMax Stage | Thorlabs | MAX311D | |
| 40% Acrylamide Solution | Bio Rad | 64148001 | hydrogel component |
| 405 nm laser | Cobolt | Cobolt 06-MLD | |
| 50x TAE buffer | Bio-Rad | 161-0743 | hydrogel component |
| 561 nm laser | Cobolt | Cobolt 06-DPL | |
| 638 nm laser | Cobolt | Cobolt 06-MLD | |
| Ammonium persulfate | Sigma | A3678-25G | hydrogel component |
| Beam alignment tool | custom made | ||
| BNC terminal blocks | Natural Instruments | BNC-2110 | |
| Cage plate with M9 x 0.5 internal threads | Thorlabs | CP1TM09 | For holding aspheric lens |
| Cage System Rods | Thorlabs | SR series | |
| Cell culture & smFISH | See a reference [11] | ||
| Double side tape | Scotch | 515182 | Flow chamber |
| Epoxy | Devcon | 14250 | Flow chamber |
| Galvo mirror | Thorlabs | GVS211 | GM |
| Galvo System Linear Power Supply | Thorlabs | GPS011 | |
| Half wave plate | Thorlabs | WPH10M-405/561/633 | Power adjustment |
| long-pass dichroic mirror | Chroma | T550lpxr | For combining lasers |
| Microscope slides | Fisherbrand | 12549-3 | Flow chamber |
| Mikroskopische Deckglaser | Hecht Assistent | 990/5024 | Flow chamber |
| Mounted Frosted Glass Alignment Disk | Thorlabs | DG10-1500-H1-MD | For double pinhole system |
| Mounted rochester aspheric lens | Thorlabs | A230TM-A | |
| Multi-band dichroic mirror | Semrock | Di03-R405/488/561/635-t3 | DM; 3 mm thickness |
| Multi-band filter | Semrock | FF01-446/523/600/677-25 | BF |
| Multimode fiber | Thorlabs | M31L02 | MMF |
| N,N,N',N'-tetramethyl ethylenediamine | Sigma | T7024-25ML | hydrogel component |
| NI-DAQ board | Natural Instruments | PCI-6733 | |
| Ø1" Kinematic Mirror Mount | Thorlabs | KM100 | For holding mirrors |
| Objective lens | Olympus | PLANAPO N 60X | 60X 1.45NA oil |
| Pedestal Base Clamping Forks | Newport | 9916 | |
| Pedestal Pillar Posts | Thorlabs | RS1P8E | |
| Piezo controller | Thorlabs | BPC303 | |
| Polarized beam splitter | Thorlabs | PBS251 | For combining lasers |
| RMS-SM1 adapter | Thorlabs | SM1A3TS | For objective lens |
| Rod holder | custom made | ||
| Rotation cage mount | Thorlabs | RSP1/CRM1/CRM1P | For HWP & cylindrical lens mounting |
| sCMOS camera | Andor | Zyla-4.2P-CL10 | |
| Shearing interferometer | Thorlabs | SI100 | Beam collimation test |
| Single mode fiber | Thorlabs | P5-405BPM-FC-2 | SMF |
| SM1 Lens Tubes | Thorlabs | SM1S25 | For double pinhole system |
| SM1 Slotted Lens Tube | Thorlabs | SM1L30C | For double pinhole system |
| Stage mount | custom made | ||
| threaded fiber adapter | Thorlabs | SM1FC | |
| Z-Axis Translation Mount | Thorlabs | SM1Z | Fiber coupling |
Referencias
- Sigal, Y. M., Zhou, R., Zhuang, X. Visualizing and discovering cellular structures with super-resolution microscopy. Science. 361, 880-887 (2018).
- Lerner, E., et al. Toward dynamic structural biology: Two decades of single-molecule Forster resonance energy transfer. Science. 359, (2018).
- Raj, A., van Oudenaarden, A. Single-Molecule Approaches to Stochastic Gene Expression. Annual Review of Biophysics. 38, 255-270 (2009).
- Wilson, T. Resolution and optical sectioning in the confocal microscope. Journal of microscopy. 244, 113-121 (2011).
- Sase, I., Miyata, H., Corrie, J. E., Craik, J. S., Kinosita, K. Real time imaging of single fluorophores on moving actin with an epifluorescence microscope. Biophysical Journal. 69, 323-328 (1995).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical Sectioning Deep Inside Live Embryos by Selective Plane Illumination Microscopy. Science. 305, 1007-1009 (2004).
- Cella Zanacchi, F., et al. Live-cell 3D super-resolution imaging in thick biological samples. Nature Methods. 8, 1047 (2011).
- Galland, R., et al. 3D high- and super-resolution imaging using single-objective SPIM. Nature Methods. 12, 641 (2015).
- Gustavsson, A. K., Petrov, P. N., Lee, M. Y., Shechtman, Y., Moerner, W. E. 3D single-molecule super-resolution microscopy with a tilted light sheet. Nature Communications. 9, 123 (2018).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells. Nature Methods. 5, 159-161 (2008).
- Tang, J., Han, K. Y. Extended field-of-view single-molecule imaging by highly inclined swept illumination. Optica. 5, 1063-1069 (2018).
- Han, K. Y., Kim, S. K., Eggeling, C., Hell, S. W. Metastable Dark States Enable Ground State Depletion Microscopy of Nitrogen Vacancy Centers in Diamond with Diffraction-Unlimited Resolution. Nano Letters. 10, 3199-3203 (2010).
- Sinkó, J., Szabó, G., Erdélyi, M. Ray tracing analysis of inclined illumination techniques. Optics Express. 22, 18940-18948 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados