Method Article
Interrogando a centros germinales autorreactivos individuales por fotoactivación en un modelo mixto de quimérico de la autoinmunidad
En este artículo
Resumen
Este protocolo describe la generación de quimeras mixta médula ósea murina con centros germinales autoinmunitarios espontáneos, en autorreactivos que linfocitos llevan un reportero de la proteína verde fluorescente (GFP-PA) de photoactivatable. Esto proporciona la capacidad para vincular la localización celular en posteriores análisis moleculares y funcionales de los tejidos.
Resumen
Enfermedades autoinmunes presentan una carga significativa para la salud. Siguen sin respuesta preguntas fundamentales sobre el desarrollo y progresión de la enfermedad autoinmune. Un requisito para los avances en nuestra comprensión de los mecanismos subyacentes de la enfermedad y la dinámica celular es el acoplamiento exacto de la localización microanatomical de subconjuntos de la célula con posteriores análisis moleculares o funcionales; un objetivo que ha sido tradicionalmente difícil de lograr. Recientemente ha permitido el desarrollo de fluoróforos biológica estable photoactivatable y su integración en las cepas de reportero precisa microanatomical etiquetado y rastreo de celulares subconjuntos en modelos murinos. Aquí, describimos cómo la capacidad de analizar los linfocitos autorreactivos de centros germinales solo puede ayudar a proporcionar nuevas penetraciones en autoinmunidad, utilizando la combinación de un novedoso modelo quimérico de autoinmunidad con un reportero de photoactivatable como ejemplo . Demostrar que un procedimiento para generar mezcla quimeras con espontánea autorreactivos centros germinales poblados por linfocitos con un reportero de la proteína fluorescente verde photoactivatable. Usando estrategias de etiquetado en vivo, solo centros germinales pueden visualizarse en tejidos linfoides explantados y su componentes celulares fotoactivado por microscopia de dos fotones. Linfocitos fotoactivado de centros germinales solo pueden analizarse entonces clasifican flujo cytometrically, como células individuales o a granel y podrán ser sometidos a análisis moleculares y funcionales descendentes adicionales. Este enfoque puede aplicarse directamente para proporcionar nuevas perspectivas en el campo de la autoinmunidad, pero el procedimiento para la generación de quimeras de la médula ósea y el procedimiento de fotoactivación además puede encontrar amplio uso en estudios de enfermedades infecciosas y metástasis del tumor.
Introducción
La incidencia de la enfermedad autoinmune ha aumentado rápidamente en las últimas décadas, particularmente en las sociedades occidentales. Hoy en día, enfermedad autoinmune alinea tercero en la lista de causas más frecuentes de morbilidad y mortalidad en el mundo occidental1. Siguen sin respuesta preguntas fundamentales sobre el desarrollo y progresión de la enfermedad autoinmune. Un requisito para los avances en nuestra comprensión de los mecanismos subyacentes de la enfermedad y la dinámica celular es el acoplamiento exacto de la localización microanatomical de subconjuntos de la célula con análisis moleculares o funcionales posteriores. En la última década, ha permitido el desarrollo de un número de fluoróforos biológica photoconvertible, photoactivatable o fotoconmutables estable y su integración en las cepas reportero preciso microanatomical etiquetado y rastreo de celulares subconjuntos en modelos murinos.
Kaede, una proteína fluorescente de photoconvertible origina una corales pétreos, somete photoconversion irreversible de fluorescencia verde a fluorescencia roja a la exposición a la luz violeta o ULTRAVIOLETA2. Inicialmente empleado para seguir el comportamiento dinámico de las células individuales en el desarrollo de organotypic de rebanadas de cerebro3, generación de un ratón knock-in permite posteriormente monitoreo celular movimiento en vivo de Kaede y el sistema fue aplicado al análisis de migración de células inmunes a y de los ganglios linfáticos4. Este enfoque fue posteriormente refinado con un reportero de segunda generación5. Un reportero similar es Dendra6, que recientemente fue utilizado para rastrear las metástasis de nodo de linfa en vivo7.
La primera proteína de photoactivatable desarrollada era una proteína verde fluorescente (GFP) diseñada con una sola mutación del punto (T203H), conduce a una absorción muy baja en la región de longitud de onda de 450 a 550 nm8. Después de la fotoactivación por luz ultravioleta, esta proteína fluorescente verde photoactivatable (PA-GFP) cambia su máximo de absorción de ~ 400 a ~ 500 nm, dando una intensidad aproximada de la 100-fold aumenta cuando excitó con una longitud de onda de 488 nm. La generación de ratones transgénicos en los que todas las células hematopoyéticas expresan PA-GFP permite, por primera vez, un análisis profundo de la selección de la célula de B en anatómicamente definidas zonas claras y oscuras del centro germinal9.
Considerando que la fotoactivación es una conversión irreversible de un estado no fluorescente a un estado fluorescente, y photoconversion es una transición unidireccional de una longitud de onda a otra, fotoconmutables proteínas son capaces de traslados entre ambas condiciones10 . Esta última capacidad recientemente fue aprovechada para ingeniero control óptico de proteína actividad11.
Utiliza el periodista PA-GFP, recientemente hemos caracterizado los repertorios de células B de centros germinales solo en un modelo novedoso de autoinmunidad como lupus espontáneo12. Este modelo se basa en quimeras mezclados con 1 parte de la médula que un autorreactivos de células B receptor knock-en con especificidad para los complejos de proteína ribonuclear (564Igi13,14) combinado con 2 partes de la médula de cualquier deseada donante. En aproximadamente 6 semanas post reconstitución se consiguen condiciones homeostáticas en que autorreactivos espontáneos centros germinales están presentes en el bazo y los ganglios linfáticos cutáneos. En particular, el centro germinal células B población es casi exclusivamente (~ 95%) compuesto de células derivadas del compartimiento no 564Igi, y estas células B derivados de tipo salvaje son autorreactivos. Por lo tanto, el modelo permite un enfoque de 'plug-and-play' para análisis de células de B autoreactive centro germinal usando varios transgenes, knock-outs y reporteros. Aquí, describimos el procedimiento para generar quimeras mixtas con centros germinales autorreactivos espontánea poblados por linfocitos con el reportero PA-GFP. Usando estrategias de etiquetado en vivo, solo centros germinales pueden visualizarse en tejidos linfoides explantados y su fotoactivado de componentes celulares utilizando un microscopio de dos fotones. Linfocitos fotoactivado de centros germinales solo pueden posteriormente analizados por citometría de flujo o clasificados por celular activado por el fluorocromo clasificación (FACS) y sometidos a análisis moleculares y funcionales descendentes adicionales. La capacidad de analizar los linfocitos autorreactivos de centros germinales solo puede ser aplicada directamente para proporcionar nuevas perspectivas en el campo de la autoinmunidad, pero las técnicas y enfoques descritos pueden además encontrar las aplicaciones relevantes en estudios de enfermedades infecciosas y las metástasis del tumor.
Protocolo
Todo el uso animal se ajustó a las directrices de la Comunidad Europea y fue aprobado por la inspección de investigación Animal danés (2017-15-0201-01348).
1. cría de ratón general y preparación de buffers y herramientas
- Líneas de ratón de la casa bajo condiciones libres patógenos específicos (SPF), con supervisión periódica del estado de salud según las pautas estándar.
- Opcional: verificar la ausencia de centros germinales espontáneas en ratones ingenuo debido a infecciones adventicias no supervisado. Esto puede hacerse por microscopia de la inmunofluorescencia (presencia de estructuras de centro germinal) o flujo cytometry (frecuencia de las células del centro germinal B) como se describió anteriormente12.
Nota: Ya sea hembras o machos. En general, es ideal para sexo partido de donantes y receptores, como un desajuste de sexo teóricamente puede llevar a Alorreactividad hacia el antígeno Y masculino por los receptores o donantes mujer15. - Uso de los receptores CD45.1 (B6. SJL -Ptprcuna Pepcb/BoyJ) en alrededor de 6-10 semanas de edad. Usar 564Igi (B6. Cg-Ightm1 (Igh564) TikIgktm1 Tik (Igk564)/j) y PA-GFP (B6.Cg-Tg(UBC-PA-GFP)1Mnz/J) donantes en 6-12 semanas de edad.
- Esterilice en autoclave los las herramientas quirúrgicas (recto finos tijeras y pinzas Dumont #5 y #7) ellos según directrices de esterilización rutinaria.
- Preparar 500 mL de tampón de la médula (BM) que contiene solución salina tamponada con fosfato (PBS), 2% suero bovino Fetal (FBS), 1 mM dihidratada del ácido (EDTA) a pH 7.4. Para preparar el tampón de BM, añadir 10 mL de inactivado con calor (1 hora en un baño de agua de 56 ° C para inactivar el complemento) FBS y 1,25 mL de una solución de EDTA de 400 mM (ajustada a pH 7,4) a 500 mL de PBS, pH 7,4 y mezcla bien. Filtrar el búfer utilizando un matraz de filtración de 0.2 μm.
- Diluir 1 mL de un stock de 10 x para 10 mL de volumen total con agua de grado reactivo para preparar 10 mL de tampón de lisis de glóbulos rojos (gr) (155 m m de NH4Cl, 12 mM NaHCO3, 0.1 mM EDTA). Preparar 50 mL de PBS con 5 mM EDTA, pH 7,4.
2. creación de quimeras de mixtos de la médula
- Irradiación de los destinatarios (día 0)
- Los receptores de médula ósea CD45.1 en un recipiente apropiado de la irradiación e irradiar con 1.100 Rad en un irradiador gamma.
Nota: Pueden utilizar fuentes alternativas de la irradiación. Independientemente de la fuente, el dosis/tiempo debe ser optimizada para obtener efecto máximo myeloablative con daño tisular colateral mínimo a los animales. - Lugar en antibiótico de agua ad libitum (1 mg de sulfadiazin y 0,2 mg de trimetoprima/mL agua).
- Los receptores de médula ósea CD45.1 en un recipiente apropiado de la irradiación e irradiar con 1.100 Rad en un irradiador gamma.
- Extracción de los huesos (día 1)
- Anestesiar a los donantes de médula ósea 564Igi por flujo continuo de 4% de isoflurano en aire y eutanasia por dislocación cervical. Aerosol hacia abajo de los donantes con etanol y en cojines quirúrgicos estériles en la campana de flujo. Proceder para trabajar mantenimiento de condiciones estériles, uso de equipo y tampones estériles.
- Para extraer el fémur y la tibia, en primer lugar hacer una incisión alrededor del tobillo y extender hacia arriba hasta la cadera con unas tijeras recta finas. Usando un fórceps pesado o dedo pulgar y los dedos del índice, tirar la piel hacia arriba y la pierna hacia el cuerpo. Del mismo modo tirar la piel hacia abajo y el pie.
- Saltar las articulaciones de la rodilla y el tobillo la pierna en la cadera y tirar el pie con fuerza. Proceder a romper el tobillo empalme y tirar los pies hacia el cuerpo mientras sostenemos la tibia, así pelando los tendones y los músculos de la tibia.
- Romper la rodilla para liberar la tibia y semejantemente esto tire hacia el cuerpo mientras sostenemos el fémur, así pelando los tendones y los músculos de fémur. Hacer una incisión en la articulación de la cadera y corte los tendones, luego sacar el fémur de la cadera toma. Repita los pasos 2.2.2 – 2.2.4 para el lado contralateral.
- Limpiar cuidadosamente los huesos por frotarlos con una toalla de papel grueso para quitar todo resto tejido muscular y conjuntivo. Luego enjuáguelos en buffer BM helada antes de transferir finalmente al búfer de BM frío fresco en hielo con un par de pinzas Dumont #7. Repita el paso 2.2 para los donantes de PA-GFP.
Nota: El número de células de médula ósea de un donante único varía según sexo y edad. Escala el número de donantes según proporciones de entrada deseada de la médula y los números y el número de destinatarios. Si los donantes son escasos, las extremidades delanteras se pueden incluidas para la extracción de médula ósea. Esto normalmente produce un adicional 1/3 a 1/2 de las células obtenidas de los miembros posteriores. Por lo general, en cualquier lugar de 50 millones de células se pueden recuperar por donantes, dependiendo de la edad, sexo, antecedentes y si se incluyen sólo hind o posteriores y extremidades delanteras.
- Extracción de células de médula ósea
- Preparar el mortero aclarando en buffer BM helada. Vaciar el búfer de enjuague y utilizar un aspirador eléctrico con una pipeta serológica de 10 mL, agregar 10 mL de tampón de BM helada fresca.
- Transferir los huesos de los donantes de 564Igi en el mortero con un par de pinzas Dumont #7 y utilizar el mortero para triturar y moler los huesos para liberar la médula ósea. Aspire el extracto de médula ósea con una pipeta serológica de 10 mL y pasarlo por un colador de celular de 70 μm en un tubo de 50 mL en hielo.
- Agregar un adicional 10 mL de tampón de BM helada fresca al mortero y repita el procedimiento para asegurar la completa recuperación de las células. Retire el mortero con una toalla de papel de material óseo, Deseche apropiadamente y enjuagar el mortero con etanol al 70%, seguido de búfer de BM. Repita el paso 2.3 para el grupo de donantes de médula ósea PA-GFP.
- Conteo de células de médula ósea
- Usando una micropipeta, coloque una gota que contiene 40 μl de tampón de lisis RBC en un pedazo de película plástica de la parafina. Invertir el tubo de la médula ósea de 564Igi un par de veces y saque un 10 μl utilizando una micropipeta alícuotas. Mezclar con 40 μl de gota de tampón de lisis RBC.
- Posteriormente añadir 50 μl de azul tripán (0,4% en solución acuosa) a la caída. Inmediatamente cargar 10 μl de la mezcla resultante en un hemocitómetro de Bürker Türk y conteo al microscopio. Calcular el número de células por mL, utilizando el 10 x factor de dilución total. Confirmar viabilidad celular adecuada > 90%. Repita el paso 2.4 para el grupo de donantes de médula ósea PA-GFP.
- Preparación de suspensiones de donantes
- Basado en las cuentas obtenidas en el paso 2.4 y el número de receptores deseado, calcular el volumen de donantes de médula de cada uno de los grupos de dos donantes que se mezcla en el tubo de mezcla del donante.
Nota: por ejemplo, para configurar un grupo de 564Igi:PA mezcla 1:2-quimeras GFP con 6 recipientes de CD45.1: cada uno de ellos requiere 20 x 106 donantes las células total, 564Igi parte 1 y 2 partes PA-GFP. Por lo tanto, esto requiere de 6 x 1/3 x 20 x 106 = 40 x 106 células de donantes de 564Igi y 6 x 2/3 x 20 x 106 = 80 x 106 PA-GFP células del donante. - Mezclar las cantidades apropiadas de médula de donante PA-GFP y 564lgi en un tubo cónico de 50 mL. Centrifugar la mezcla de la médula ósea a 200 x g y 4 ° C durante 10 minutos usando un rotor oscilante de cubo.
- Decantar el sobrenadante y resuspender las células en buffer de BM helada a una densidad de 1 x 108 células por mL. Transferir a un tubo de microcentrífuga de 1,5 mL preenfriada en hielo.
- Basado en las cuentas obtenidas en el paso 2.4 y el número de receptores deseado, calcular el volumen de donantes de médula de cada uno de los grupos de dos donantes que se mezcla en el tubo de mezcla del donante.
- Reconstitución de los receptores de médula ósea con médula ósea de donante
- Anestesiar a los destinatarios mediante inducción con flujo continuo de 4% de isoflurano en aire, seguido de mantenimiento en el 3,75%. Verificar el adecuado plano de anestesia por ausencia del reflejo del pellizco del dedo del pie.
- Cuidadosamente mueva el tubo que contiene mezcla de médula ósea para asegurar adecuada resuspensión de células de médula ósea y luego aspirar 200 μL de mezcla de médula ósea (~ 20 x 106 células), de 0,3 mL, jeringa de insulina de calibre 30.
- Coloque el receptor en su lado, estire suavemente la piel por encima y debajo del ojo para un poco ' el ojo ' y suavemente inserte la punta de la jeringa aproximadamente en un ángulo de 30° en la parte delantera de la cavidad del ojo, teniendo cuidado con el ojo y el tejido circundante. Cuando la punta de la aguja se siente tocar el hueso subrayando el zócalo del ojo, retraer ligeramente (~0.5 mm) e inyectar lentamente la médula del donante utilizando presión constante.
Nota: No debe ser sangrado, no hay fugas de líquido y no poca protrusión del ojo sobre la inyección. - Volver el ratón a la jaula con agua ad libitum de antibiótico y verificar la recuperación inmediata del procedimiento. Repita el paso 2.6 para cada destinatario.
Nota: Inyección en la vena de la cola se puede utilizar en lugar de la inyección retroorbital con resultados similares, sin embargo, en nuestras manos es considerablemente más lento, que puede ser una preocupación cuando se trabaja con grandes grupos de destinatarios. Recuperación de los animales anestesiados directamente en lecho de diámetro pequeño debe evitarse ya que presenta un riesgo de aspiración y asfixia
- Eliminar el agua antibiótico (día 14)
- Quite el antibiótico del agua de la cage(s) y reemplace por agua potable regular.
3. comprobar reconstitución acertada y verificar el adecuado grado de quimerismo (semana 6)
-
Sangrado retroorbital de quimeras y controles
- Preparar tubos sangre etiquetado 1,5 mL en tubos de microcentrífuga según números de la etiqueta de oído receptor y añadiendo 50 μl de PBS con 5 mM EDTA.
Nota: Incluye los controles adecuados para PA-GFP, CD45.1, CD45.2 y 9 11 (idiotipo). Esto puede hacerse mediante la inclusión de 1 PA-GFP + mouse, mouse CD45.1 1, 1 ratón de B6 y 1 ratón 564Igi. - Anestesiar a ratones y verifique el adecuado plano de anestesia como en el paso 2.6.1. Lugar la quimera de su lado, estire suavemente la piel por encima y debajo del ojo para un poco ' el ojo '.
- Inserte suavemente un envuelto de BoPET heparinizado tubo capilar (volumen interno de 60 μL) aproximadamente en un ángulo de 40° en la parte delantera de la cavidad del ojo, teniendo cuidado de no dañar el ojo y el tejido circundante. Torcedura/gire suavemente el tubo hasta que comienza a llenarse de sangre.
- Permitir que la sangre pasivamente llena el tubo por capilaridad, hasta casi completamente lleno, luego retraiga el tubo y colóquelo en el tubo de colección etiquetadas correspondiente, mientras que al mismo tiempo relajarse inmediatamente el agarre alrededor del ojo para permitir que el ojo colocar en posición. La sangría debe parar inmediatamente.
- Asegúrese de que ha vaciado el tubo capilar en el tubo de colección y descartarlo en un contenedor de objetos punzantes. Cierre el tubo e invertir tres veces para asegurar una mezcla completa con PBS/EDTA.
- Volver el ratón a la jaula y comprobar la recuperación inmediata del procedimiento. Repita el paso 3.1 para cada ratón experimental y los controles apropiados.
Nota: Tenga cuidado al usar la punción de la vena submaxilar ya que este método puede representar un mayor riesgo de infección adventicia en los receptores irradiados antes de que éstos son completamente reconstituidos. Además, en nuestra experiencia, encontramos que el volumen de sangre y la cantidad de sangre perdida debido a un sangrado excesivo es más variable. Dos de estas consideraciones son importantes, ya que las quimeras de la médula ósea son sensibles en la fase de reconstitución, antes de que la nueva médula es totalmente engrafted y hematopoyesis ha retomado los niveles normales.
- Preparar tubos sangre etiquetado 1,5 mL en tubos de microcentrífuga según números de la etiqueta de oído receptor y añadiendo 50 μl de PBS con 5 mM EDTA.
-
Purificación de células mononucleares (PBMC) de sangre periférica
- Después de la terminación de la recolección de sangre, brevemente (10 s) centrifugar los tubos a baja velocidad (< x 200 g) recoger el diluido estabilizado sangre en la parte inferior de los tubos.
- Llene una jeringa de 10 mL con medio de separación de linfocitos y conecte una aguja de 18 G. Inserte la aguja en la parte inferior del primer tubo y underlayer de la muestra de sangre con 1 mL de medio de separación de linfocitos. Cuidadosamente retire la aguja y limpie con una toalla de papel para evitar la contaminación de la muestra siguiente.
- Continuar a través de todas las muestras, luego centrifugar durante 25 minutos a 800 x g, a temperatura ambiente, en una centrifugadora de balde de balanceo, con los frenos a baja/apagado.
- Preparar un conjunto de correspondientemente etiquetado 1,5 mL tubos de microcentrífuga con 1 mL de helado tampón BM.
- Tras centrifugación, para cada muestra, entrar en la capa superior (plasma) con una micropipeta de 200 μl y aspirar la capa de células mononucleares (MNC) justo por encima de la interfaz. Transferencia de las células al tubo correspondiente etiquetado que contiene 1 mL de tampón de BM. Cierre la tapa e invierta para mezclar. Deseche el tubo de medio que contiene la separación de linfocitos.
- Proceder a través de todas las muestras y luego centrifugar a 200 x g durante 5 min, 4 ° C en un rotor que hace pivotar del cubo. Aspirar y descartar el sobrenadante y resuspender el pellet en 200 μL de tampón de BM helada. Las muestras están ahora listas para tinción de anticuerpos y el análisis cytometric del flujo.
-
Coloración para evaluación de citometría de flujo
Nota: Sugeridos panel: CD45.1-FITC, B220-PerCP-Cy5.5, 9D 11-A568, CD45.2-APC. No activado PA-GFP se detecta en el Pacífico canal naranja (o equivalente). Ningún tinte de viabilidad es necesaria ya que la separación de linfocitos se deshace de las células muertas.- Usando una micropipeta, agregar 100 μl de la suspensión celular por pozo para cada muestra de quimera y control, a una placa de 96 pocillos.
- Para las 3 muestras de control de la PA-GFP, los restantes 100 μl de cada muestra (total 300 μL) de la piscina. Añadir 50 μl de este material para el control sin manchas y pocillos de control manchada solo. Para el control de PA-GFP solo teñido además agregar 50 μl de muestra PA-GFP sin manchas.
- A cada pocillo, añadir 100 μl de buffer (sin mancha), un solo anticuerpo (controles de compensación solo manchado, excepto para control de compensación de PA-GFP) o mezcla de anticuerpos (muestras). Incubar en hielo por 20 minutos.
- Centrifugue a 200 x g durante 5 minutos a 4 ° C. Película de la memoria intermedia. Agregar 200 μL de tampón de BM para cada bien y centrifugue nuevamente para lavar. Película de la memoria intermedia y resuspender las células en cada pozo en 200 μL de tampón de BM. Las muestras están ahora listas para análisis en un citómetro de flujo (figura 1).
Nota: Las respuestas del centro Germinal en las quimeras pueden analizarse en cualquier punto desde 6 semanas a partir.
4. etiquetado In vivo del zona marginal, subcapsular sino para facilitar la identificación de centros germinales solo
Nota: El presente Protocolo se demuestra bandolero/hock (ganglio poplíteo) y las inyecciones intravenosas (i.v., bazo), pero puede variar según el sitio de destino.
-
Inyección de bandolero bilateral para el etiquetado de ganglio poplíteo
- Anestesiar los ratones como en el paso 2.6.1.
- En un tubo de microcentrífuga de 1,5 mL, diluir 2 μl del anticuerpo de CD169 de anti-ratón marcado con PE rata en 18 μL de PBS, pH 7,4. Coloque dos gotas de 10 μl de la mezcla sobre un pedazo de película plástica de la parafina. Aspirar cada gota utilizando una jeringa de insulina de 0,3 mL con una aguja de 30 calibre.
- Inyectar los 10 μl de la mezcla ya sea de etiquetado el bandolero (introducir la aguja en un ángulo de 5-10° en la parte central de la almohadilla, proximal desde el comienzo de los dedos del pie e introducir la aguja aproximadamente a mitad de camino hacia el talón) o el corvejón (introducir la aguja en un 5 - 10 ° ángulo justo encima del talón e insertar sobre mitad de su longitud en el eje del tendón de Aquiles en la dirección hacia la rodilla). Retomar los ratones de sus jaulas y espere aproximadamente 15 minutos antes de proceder con el paso 5.
-
Inyección intravenosa para el etiquetado de bazo
- Anestesiar los ratones como en el punto 2.6.1.
- En un tubo de microcentrífuga de 1,5 mL, diluya 10 μl del anticuerpo de CD169 de anti-ratón marcado con PE rata en 90 μl de PBS. Aspirar la mezcla con una jeringa de insulina de 0,3 mL.
- Realizar la inyección de i.v. retroorbital según paso 2.6. Retomar los ratones de sus jaulas y espere aproximadamente 15 minutos antes de proceder con el paso 5.
Nota: como alternativa al isoflurano, inyección anestésica como mezcla de ketamina/xilacina puede ser utilizado; sin embargo, esto normalmente lleva a los tiempos de recuperación más lento. Puesto que el drenaje linfático es generalmente influenciado por movimiento de los músculos esqueléticos, se espera que llevar a tiempo de drenaje más lento.
5. explantar el bazo y los ganglios linfáticos y la preparación para la fotoactivación
-
Preparar una cámara de proyección de imagen y fotoactivación doble cara
- Quitar el émbolo de una jeringa de 20 mL y espalda carga lo con grasa de vacío mediante la inserción de la boquilla de un tubo de grasa para vacío en él. Luego retire el émbolo de una jeringa de 5 mL y utilice la jeringa de 20 mL para espalda carga lo con grasa para vacío.
- Utilizar la jeringa de 5 mL de grasa de vacío cargado para preparar una proyección de imagen y cámara de fotoactivación por colocar un cubreobjetos cuadrado sobre una superficie plana y rastreo a lo largo de los bordes del cubreobjetos con grasa para vacío (aproximadamente 1-2 mm en los bordes).
Nota: tenga cuidado para evitar la contaminación de la grasa para vacío de cualquier y todas las superficies que posteriormente entran en contacto con la lente del microscopio, como microgotas de grasa para vacío emulsionado en el agua de inmersión pueden contaminar la lente. - Llenar la cámara de vacío grasa cubreobjetos con tampón BM helada y coloque sobre una superficie plana fría.
-
Recolección de los ganglios linfáticos y el bazo
- Eutanasia en vivo etiquetados quimérico ratón para ser analizados según paso 2.2.1. Aerosol hacia abajo de la canal con etanol al 70%.
- Para acceder a los ganglios linfáticos poplíteos, utilice tijeras recta finas para hacer una incisión en la piel justo debajo del hoyo de la rodilla y extiende el corte hacia arriba a lo largo de la línea de tendón de la corva casi hasta la articulación de la cadera. Con Dumont #5 o #7 pinzas, tire de cada una de las solapas expuestas del hacia fuera de la piel, para exponer el tejido en el hueco poplíteo (figura 2A).
- Cuidadosamente usando un par de pinzas Dumont #5, entrar en la fosa poplítea justo medial a la vena poplítea y diseccionar abrir la grasa insertando y abriendo y cerrando las pinzas en el eje de la pierna, con el fin de exponer el ganglio poplíteo subyacente.
- Pop ganglionar de la fosa pellizcando el músculo cuadríceps de la parte frontal y proximal a la rodilla con los dedos pulgar e índice (figura 2B). Coge el nodo de linfa desde abajo con el fórceps para liberarlo del tejido circundante (figura 2) y colocarla en el compartimiento de grasa para vacío preparado en el paso 5.1.
- Repita los pasos 5.2.2, 5.2.4 para el lado contralateral. Nodos de linfa múltiples pueden montarse en una cámara única si se desea.
- Finalmente cerrará la cámara colocando un segundo cubreobjetos encima del borde de grasa para vacío y presionando suavemente hacia abajo, cuidando de sacar todas las burbujas de aire.
Nota: Algunos del búfer pueden ser empujados hacia fuera así, pero la grasa para vacío forman un sello hermético, impidiendo la salida del líquido (Figura 2D). Los ganglios linfáticos están ahora en una cámara de proyección de imagen de doble cara. - Para el bazo, con un par de tijeras recta fina hace una incisión a través de la pared abdominal en el lado izquierdo del ratón, proximal a la línea media anterior, justo debajo de la caja torácica y extender alrededor del cuerpo a la línea axilar posterior. La punta del bazo debe ser visible (Figura 3A).
- Extraer el bazo con un par de pinzas Dumont #7 y cortar las adherencias en la parte inferior para liberarlo. Utilice el par de tijeras recta finas para cortar mm ~ 2 rodajas gruesas, corte transversales.
- Coloque la rebanada en el compartimiento de grasa para vacío preparado en el paso 5.1. Varias rebanadas de bazo pueden montarse en una cámara única si se desea.
- Finalmente cerrará la cámara colocando un segundo cubreobjetos encima del borde de grasa para vacío y presionando suavemente hacia abajo, cuidando de sacar todas las burbujas de aire. Mantenga todas las cámaras de proyección de imagen en el hielo en todo momento, excepto durante la proyección de imagen y la fotoactivación.
Nota: Algunos del búfer pueden ser empujados hacia fuera así, pero la grasa para vacío forman un sello hermético, evitando fugas de líquido. Los cortes de bazo están ahora en una cámara de doble cara (figura 3B).
6. fotoactivación
-
Identificación de centros germinales solo
Nota: Este protocolo se describe para el bazo, pero es enteramente análogo para los nodos de linfa.- Coloque la imagen de la cámara en la platina del microscopio. Utilizando una pipeta de plástico de 3.5 mL, coloque una gota de agua destilada sobre el cubreobjetos superior y bajar el objetivo hasta el punto de contacto. Se centran en la parte superior del tejido con luz transmitida.
- Cambiar a modo oscuro y excitación de dos fotones y ajustar el láser de 940 nm.
Nota: Con los sistemas de filtro apropiado, esta longitud de onda permite la excitación y la detección de la segunda generación de armónicos en las estructuras que contienen colágeno asociadas a grandes vasos sanguíneos y elementos estructurales, así como el CD169-PE inyectado en el paso 4.2, que identifica la zona marginal. Sin embargo, 940 excitación nm no no Fotoactivar PA-GFP. - Localizar áreas blanco pasta individuales (delimitadas por la coloración CD169-PE) cerca de la superficie del tejido e identificar la vaina linfoide periarteriolar (PALS, zona de la célula de T) por la segunda generación de armónicos asociada a la arteriola central. En la zona entre los amigos y la zona marginal, busque la presencia de la altamente autofluorescent, activó macrófagos de cuerpos tingibles (señal fuerte autofluorescent en todos los canales, blob-como aspecto con vacuolas oscuras) (Figura 4A).
Nota: Si es necesario, debido a la orientación indeseable del tejido, la cámara de proyección de imagen puede dar la vuelta y la proyección de imagen se puede realizar desde la otra dirección. - Basado en características distintivas identificadas en el paso 6.1.3., dibujar una región de interés identificación de un área de solo centro germinal. Establecer una pila de Z de alrededor de 100-150 μm profundidad, a partir de la superficie del tejido y utilizar un tamaño de paso de 3 μm.
- Interruptor de onda de excitación de 830 nm. Cierre o atenuar todos los canales para evitar el fotodaño en detectores (como potencia del láser y fluorescencia de salida suele ser considerablemente más alta en esta longitud de onda) y luego 'imagen' de la pila.
Nota: Ajustes específicos, tales como láser potencia y pixel tiempo de permanencia, dependen de la profundidad en el tejido, el tejido específico utilizado y el sistema de proyección de imagen. Cada aplicación tiene que ser optimizado para el sistema específico de proyección de imagen utilizado. Mientras que es esencial para conseguir fotoactivación eficiente a lo largo de la pila, debe tener cuidado no a fotoenvejecimiento las células. - Volver a la onda de excitación de 940 nm y abrir canales. Escanear a través de la pila para confirmar la fotoactivación eficiente a lo largo (Figura 4B) y ausencia de fotodaño (difusa, no delimitada por células PA-GFP señal, manchas oscuras o autofluorescence de alto grado en el área de fotoactivado).
- Proceder a Fotoactivar todos los tejidos pertinentes en la sala de proyección de imagen, entonces inmediatamente volver al hielo hasta que la transformación posterior. Continuar con la fotoactivación de cámaras de proyección de imagen adicionales.
Nota: Tejido explantar, montaje y particularmente fotoactivación son procesos lentos, pero el tiempo de vuelta total debe restringirse a 4-6 horas, para evitar una disminución dramática en la viabilidad celular.
7. recuperación y análisis de las células de fotoactivado
-
Extracción de los linfocitos de los ganglios linfáticos y el bazo
- Para cada muestra de Fotoactivado, preparar un tubo de microcentrífuga de 1,5 mL por consiguiente etiquetado conteniendo 500 μl de tampón de BM en el hielo. Son muestras de un control de la PA-GFP y un ratón de PA-GFP no activado. Esto puede lograrse mediante la inclusión de un control de B6 y un ratón de control de la PA-GFP.
- Retire con cuidado la hoja de cubierta superior de la cámara de proyección de imagen, teniendo cuidado de mantener la posición de las muestras (si las muestras múltiples están presentes en una sola cámara) y coloque cada muestra en el tubo de muestra respectivo.
- Usando un homogeneizador de mortero, apretar el tejido y torcer la mano del mortero en el tubo para soltar los linfocitos. Usando una micropipeta, Aspire el lisado y filtrar con un colador de celular de 70 μm en un tubo de microcentrífuga de 1,5 mL fresco, previamente enfriado. Para las muestras de ganglios linfáticos, vaya al paso 7.1.5.
- Para las muestras de bazo, centrifugar a 200 x g durante 5 min a 4 ° C en un rotor que hace pivotar del cubo. Deseche el sobrenadante y resuspender el pellet en 200 μL de tampón de lisis RBC. Incubar por 5 min a temperatura ambiente, luego añadir 800 μl de tampón de BM helada y proceda al paso 7.1.5.
- Centrifugue a 200 x g durante 5 min a 4 ° C en un rotor que hace pivotar del cubo. Deseche el sobrenadante y resuspender en 200 μL de tampón de BM helada. Las muestras ya están listas para coloración para evaluación de citometría de flujo y clasificación, si se desea.
-
Coloración para evaluación de citometría de flujo
Nota: Sugeridos panel: CD169-PE, B220-PerCP-Cy5.5, 9D 11-A647, CD38-PE-Cy7, fijable viabilidad tinte Efluor-780, GL7 Pacífico azul. No activado PA-GFP se detecta en el Pacífico canal naranja (o equivalente). Photoactivated PA-GFP se detecta en el canal GFP. Cualquier macrófagos Co purificados (que pueden o pueden no haber sido en vivo con CD169-PE) pueden ser excluidos por tinción con CD169-PE y usando esto como una puerta de descarga.- Usando una micropipeta, agregar 100 μl de la suspensión celular por pozo para cada muestra control y quimera, en una placa de 96 pocillos.
- Para las muestras de control de B6, añada 50 μl de este material para el control sin manchas y pocillos de control manchada solo. Para el control no activa PA-GFP solo teñido además agregar 50 μl de la muestra de PA-GFP no activado sin manchas. Para el control de solo manchado de PA-GFP activo, piscina de material restante para todas las muestras de fotoactivado.
- A cada uno, añadir 100 μl de buffer (mancha y controla la compensación de PA-GFP), un solo anticuerpo (controles de compensación solo manchado) o mezcla de anticuerpos (fotoactivado muestras). Incubar en hielo por 20 minutos.
- Centrifugue a 200 x g 5 minutos a 4 ° C. Película de la memoria intermedia. Agregar 200 μL de tampón de BM para cada bien y centrifugue nuevamente para lavar. Película de la memoria intermedia y resuspender las células en cada pozo en 200 μL de tampón de BM. Las muestras están ahora listas para análisis en un citómetro de flujo o clasificador (resultados representativos en la figura 5).
Resultados
Generación de quimeras de mixtos de la médula
El presente Protocolo robusta alcanza quimeras de médula ósea mezclada con un chimerism casi total en el compartimiento de la célula de B como se muestra en el resultado representativo en la figura 1 (para significación estadística consulte por favor a 12). Los números de células B normalizado revela serotipificación en 6 semanas post reconstitución (figura 1A), con una baja frecuencia de 9 11 (idiotipo) positivo células B circulantes derivan del compartimiento 564Igi (figura 1B). Dentro de la puerta de linfocitos totales, hay una baja frecuencia de células residuales derivados del destinatario, ~ 6% CD45.1 (Q1), que indican un total grado de quimerismo de ~ 94% (figura 1). En el donante del compartimento (CD45.1-, Q3 + Q4) el cociente de 564Igi (Q4) a PA-GFP (Q3) está alrededor de 23% a 77%. Esta ligeramente inferior de entrada de 33% a 66% de proporción se explica por la fuerte selección negativa de células B derivados del compartimiento de 564Igi 12. Como se ve en la figura 1, existe quimerismo virtualmente completa en el compartimiento de la célula de B (99.9% CD45.1-) y el dominio de PA-GFP médula ósea las células de B (Q3), que es una consecuencia de la pesada selección negativa de células B derivados de 564Igi.
Cosecha de tejidos, transformación y evaluación de citometría de flujo
Figura 2 y figura 3 demuestran procedimientos y resultados de explantar recién aislaron de los ganglios linfáticos y bazo rebanadas. Figura 4 se presenta un resultado representativo para el etiquetado en vivo y la fotoactivación de un área de solo centro germinal en la rebanada de un bazo explanted. Como puede verse (Figura 4A), el etiquetado en vivo con CD169-PE ha etiquetado enérgicamente la zona marginal (rojo, indicado por "MZ"). La segunda señal de armónicos es evidente en los elementos estructurales que contengan colágeno y vasos principales (azules), incluyendo la arteriola central de la vaina linfoide periarteriolar (PALS). Muy autofluorescent, macrófagos de cuerpos tingibles activados se asocian a actividad de centro germinal (flecha). Tomados en conjunto, la identificación de la zona marginal, PALS y macrófagos de cuerpos tingibles, permite la identificación de una región de interés que probablemente contiene un único centro germinal. La región de interés es Fotoactivado, tal como se ilustra en la Figura 4B. Como lo demuestra, fotoactivación es microanatomically precisa9, produciendo un área definida de la activación. Los resultados presentados además servir como confirmación de una densidad alta de PA-GFP + linfocitos en el reconstituido quimeras y la presencia de centros germinales espontáneos. Evaluación de citometría de flujo aguas abajo más confirma número de compartimiento de normalizada la célula de B (figura 5), una población espontánea centro germinal (figura 5E) y la presencia de un subconjunto de las células del centro germinal B que han sido fotoactivado (figura 5F).
Así, el presente Protocolo presenta un método robusto para generación de quimeras mixta médula ósea espontánea autorreactivos centros germinales, que se componen predominante tipo derivadas de células de B con un reportero de photoactivatable. A su vez esto permite análisis aguas abajo de los centros germinales (descripción gráfica en la figura 6).
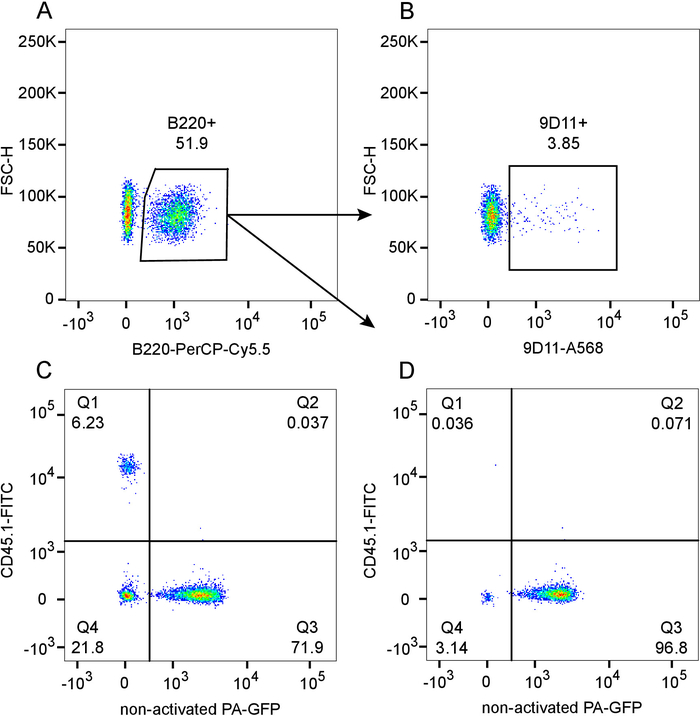
Figura 1: Flow cytometric evaluación del grado de quimerismo en sangre de 564Igi (CD45.1-, PA - GFP-): PA-GFP (CD45.1, PA-GFP +) mezclado quimeras en los receptores de CD45.1 letalmente irradiados (CD45.1 +, PA - GFP-), 6 semanas post reconstitución. Parcela A) mostrando el control de las células B B220 +, previamente cerradas en los linfocitos de la camiseta. Subgate de parcela A, mostrando 9 11 + (idiotipo) frecuencia en la población de la célula de B en B). C) parcela de PA-GFP versus CD45.1, pre-gated en los linfocitos de la camiseta. D) parcela de PA-GFP versus CD45.1 en la subgate de la célula de B de parcela A. haga clic aquí para ver una versión más grande de esta figura.
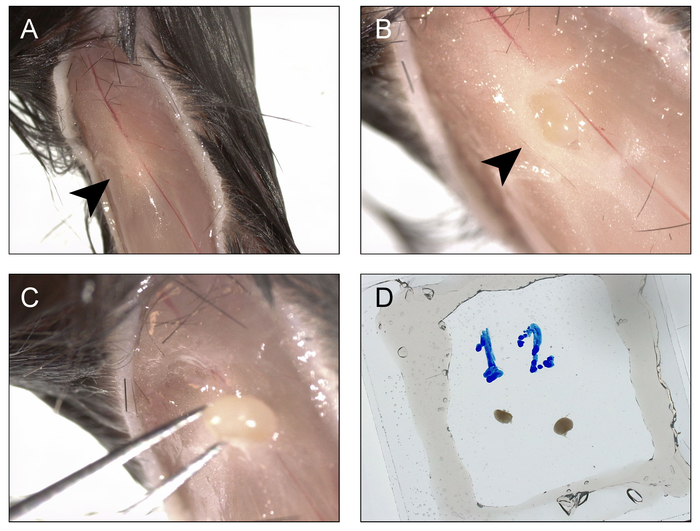
Figura 2: Procedimiento para la recolección y montaje poplíteo los nodos de linfa para la proyección de imagen y fotoactivación. A) una incisión se hace debajo de la rodilla y extender hasta la articulación de la cadera, y los bordes se repliegan hacia los lados, con el fin de exponer el hueco poplíteo (flecha). B) el supraclavicle que se abre y el ganglio linfático poplíteo es expuesta (flecha). C) ganglio linfático poplíteo es obtenido de la fosa. D) el procedimiento se repite para el lado contralateral y ambos nodos se montan en una cámara de vacío/cubreobjetos-grasa doble cara llenada con tampón de BM. Haga clic aquí para ver una versión más grande de esta figura.
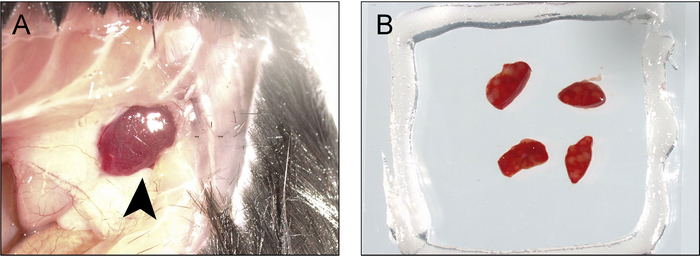
Figura 3: procedimiento para la cosecha y el bazo para la proyección de imagen y la fotoactivación de montaje. Un) una incisión se hace en la línea medial anterior justo debajo de la caja torácica y extendida alrededor del cuerpo a la línea axilar posterior y los bordes se repliegan para exponer la punta del bazo (flecha). B) del bazo es retraída y suprimida y cortar en rodajas finas (1-2 mm), que se montan en una cámara de vacío/cubreobjetos-grasa doble cara llenada con tampón de BM. Haga clic aquí para ver una versión más grande de esta figura.
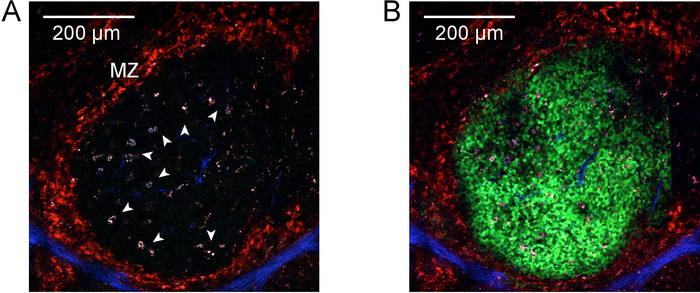
Figura 4: Fotoactivación. Dos fotones A) micrografía de un centro germinal en el bazo antes de fotoactivación. Etiquetado in vivo con anti-CD169-PE fue realizado antes de la cosecha del bazo para etiquetar la zona marginal (rojo, indicado por "MZ"). El segundo armónicos de la señal es evidente en estructuras que contengan colágeno asociadas al tegumento y vasos principales (azul). Puntas de flecha identifican altamente autofluorescent, macrófagos tingibles cuerpo activados asociados con la actividad del centro germinal. Se realizó la proyección de imagen 940 excitación nm. La barra de escala en la esquina superior izquierda indica 200 μm. B) en cuanto a, pero después de la fotoactivación a 830 nm. Fotoactivado células son ahora visible (verde) en una región definida de interés delimitada por la zona marginal y que abarca los macrófagos de cuerpos tingibles previamente identificados. Haga clic aquí para ver una versión más grande de esta figura.
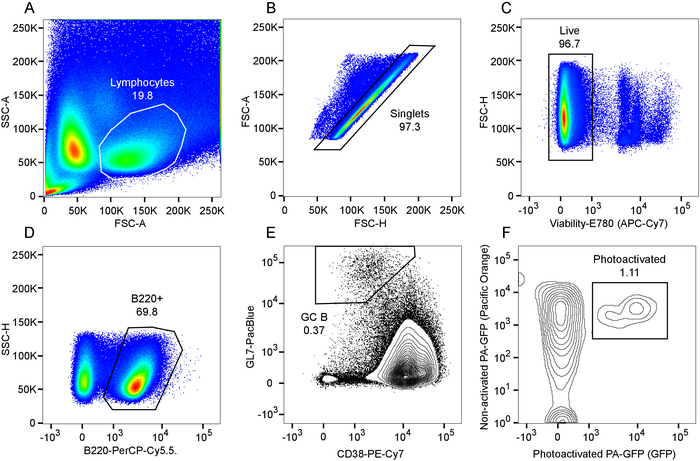
Figura 5: Flow cytometric análisis de las células del centro germinal B fotoactivado. A) parcela de avance versus dispersión y linfocitos la puerta del lado. Parcela B) área de dispersión hacia adelante en función de la altura de la dispersión hacia delante dentro de la puerta del linfocito y puerta de camiseta resultante. C) viabilidad del tinte parcela de exclusión dentro de la puerta de la camiseta y puerta de célula viva resultante. Gating D) de las células B B220 +. Gating E) de las células del centro germinal B, identificado como CD38lo GL7hi células dentro el B220 + puerta. F) Gating de fotoactivado células dentro de la población de células B GC, identificado como el subconjunto de las células que expresan Co desactivado y fotoactivado PA-GFP. Haga clic aquí para ver una versión más grande de esta figura.
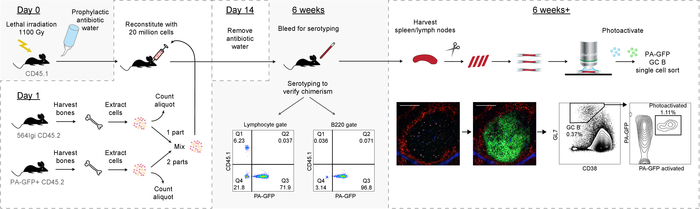
Figura 6: gráfica Resumen del Protocolo de. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Un gran número de modelos murinos de autoinmunidad está disponible, muchos de los cuales presentan centros germinales espontánea16. Sin embargo, muchos de los modelos disponibles albergan complejos orígenes genéticos o mutaciones en los centro reguladores de proliferación de linfocitos o activación, hacerlas mal adaptado a entrecruzamiento con líneas de reportero y estudios del comportamiento normal del linfocito en autoinmunidad, respectivamente. El modelo actual, por el contrario, permite un enfoque de 'plug-and-play' al análisis profundo de las células de centro germinales derivados de tipo salvaje B autorreactivos utilizando cualquier combinación deseada de los transgenes, knock-outs y reporteros, en este caso representado por photoactivatable GFP. Usando estrategias de etiquetado en vivo, solo centros germinales pueden visualizarse en tejidos linfoides explantados y su fotoactivado de componentes celulares utilizando un microscopio de dos fotones. Los linfocitos fotoactivado de centros germinales solo pueden ser analizados u ordenado flujo cytometrically, como células individuales o a granel. Estas células pueden someterse posteriormente a análisis moleculares y funcionales adicionales aguas abajo para proporcionar nuevas perspectivas en el campo de la autoinmunidad.
Hay algunos pasos críticos para el desempeño exitoso de este procedimiento. Como lo demuestran los resultados representativos, la irradiación (1.100 Rad) y la reconstitución de la médula ósea de donante con éxito Coloque nuevamente el compartimiento de receptores de la médula que rinde casi completo quimerismo en el compartimiento de la célula de B. Esto es un punto importante, como las células B residuales derivados del destinatario haría un subconjunto de la población de centro germinal 'oscuro'. Independientemente de la fuente usada para la irradiación, el dosis/tiempo de irradiación debe ser optimizada para obtener efecto máximo myeloablative con daño tisular colateral mínimo a los animales. Para la reconstitución, el protocolo de hueso-crush y reconstitución con células del donante total 20 millones se ha encontrado para producir robusta grados altos de reconstitución. Trabajo estéril y frío de hielo para la extracción de médula ósea asegura alta viabilidad del donante de médula. Para llegar al donante deseado proporción de médula ósea, es fundamental tener gran cuidado cuando contando partes alícuotas de las células, tanto para el conteo en sí mismo y al sacar la submuestra de la médula ósea para contar. Mezcla y granulación Co los tuétanos de donantes, en lugar de centrifugar y resuspender por separado y luego mezclar, sirven para evitar cualquier sesgo en los coeficientes de donantes tras el recuento de células.
La generación de quimera mixta médula del Protocolo puede estar sola, y que permite generación de quimeras con centros germinales autorreactivas con reportero deseada, transgén o knock-out. Sin embargo, una limitación a esto es la necesidad de donantes histocompatibles. La cepa de 564Igi está en un fondo de congenic C57Bl/6J y como consecuencia, el otro donante o donantes y los receptores deben tener un fondo de congenic H-2b (o alternativamente, la cepa de 564Igi debe ser retrocruzas a la tensión deseada y el fenotipo autoinmune verificado en el fondo). El procedimiento de irradiación tiende a favorecer un ambiente de tolerogénicas17y desajustes en algunos antígenos menores de histocompatibilidad pueden ser tolerados. Sin embargo, este aspecto debe cuidadosamente considerar, particularmente si mezclar machos y hembras donantes o beneficiarios, debido al potencial de reactividad mujer con hombre restringido Y-antígenos.
Del mismo modo, el aspecto de fotoactivación del Protocolo puede estar solo y puede usarse en muchos contextos diferentes. Sin embargo, el reportero GFP PA actualmente sólo está disponible con el promotor de la UBC, que está activo en todas las células de estirpe hematopoyética, pero no en células stromal. Como se mencionó en la introducción, otros photoactivatable, fotoconmutables, cepas de reportero de photoconvertible están disponibles y se pueden sustituir por PA-GFP, con adecuado ajuste de las condiciones experimentales.
Es importante evitar la fotoactivación inadvertida de zonas indeseables, manteniendo el láser muy por encima de 900 nm cuando la proyección de imagen, como esta longitud de onda no Fotoactivar PA-GFP. Para la fotoactivación de sí mismo, ajustes específicos, tales como láser potencia y pixel tiempo de detención, dependerá de la profundidad en el tejido, el tejido específico utilizado y el sistema de proyección de imagen, y cada aplicación tiene que ser optimizado para el sistema específico de proyección de imagen utilizado. Debe tener cuidado no a fotoenvejecimiento las células, pero es al mismo tiempo esencial para fotoactivación eficiente a lo largo de la pila, con el fin de obtener una representación suficiente de las células activadas para análisis posteriores. Generalmente constituyen las células del centro germinal B en cualquier lugar de 0.5% ~ 2% de las células esplénicas o cutáneo ganglionar B y como puede verse en los resultados representativos (figura 5), pueden hacer las células del centro germinal única B fotoactivado la ~ 1% del total población presente en una porción de bazo único. Por lo tanto, acertado análisis o clasificación de un número significativo de células requiere procesar un gran número de eventos.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
SE Degn es un compañero de Lundbeckfonden y Carlsberg Foundation Distinguished Fellow. Este trabajo fue apoyado en parte además por una subvención de biomédica NNF (SE Degn).
Materiales
| Name | Company | Catalog Number | Comments |
| Antibody, 9D11-A568 | In-house generated | 9D11 hybridoma, kindly provided by MC Carroll, labeled with kit: Biotium 92255 | |
| Antibody, 9D11-A647 | In-house generated | 9D11 hybridoma, kindly provided by MC Carroll, labeled with kit: Nordic Biosite ABD-1031 | |
| Antibody, FITC anti-mouse CD45.1 | Biolegend | 110705 | |
| Antibody, Pacific Blue anti-mouse/human GL7 Antigen (T and B cell Activation Marker) | Biolegend | 144613 | |
| Antibody, PE anti-mouse CD169 (Siglec-1) | Biolegend | 142403 | |
| Antibody, PE/Cy7 anti-mouse CD38 | Biolegend | 102717 | |
| Antibody, PerCP/Cy5.5 anti-mouse/human CD45R/B220 | Biolegend | 103235 | |
| Capillary tube, Mylar-wrapped, heparinized | Fisher Scientific | 211766 | |
| Cell strainer, 70 µm | Falcon | 352350 | |
| Conical tubes, 50 mL | Falcon | 352235 | |
| Cover slip, square, 22x22 mm, 0.13-0.17 mm | Thermo Fisher Scientific | 22X22-1 | |
| EDTA | Merck | 1,084,180,250 | |
| Ethanol, 70% | VWR | 8301.360 | |
| Fetal bovine serum | Life Technologies | 10270106 | |
| Flow cytometer, FACS Canto II | BD Biosciences | 338962 | |
| Flow cytometer, LSRFortessa SORP | BD Biosciences | - | Special order product with 4 lasers (405 nm, 488 nm, 561 nm and 640 nm) |
| Grease, high vacuum, Dow Corning | VWR | DOWC1597418 | |
| Hemocytometer, Burker-Türk | VWR | 630-1544 | |
| Isoflurane, IsoFlo vet. | Orion Pharma | 9658 | |
| Lymphocyte separation medium (Lympholyte-M Cell Separation Media) | Cedarlane | CL5035 | |
| Microcentrifuge tube, 1.5 mL (Eppendorf) | Sarstedt | 72.690.550 | |
| Microscope, Two-photon | Prairie Technologies (now Bruker) | - | Special order Ultima In Vivo Two Photon Microscope |
| Mortar w. lip, unglazed, 75 ml | VWR | 410-0110 | |
| NaHCO3 | Merck | 1063290500 | |
| Needle, 18 gauge | BD Medical | 304622 | |
| NH4Cl | VWR | 87,769,290 | |
| PBS | Sigma | d8537 | |
| Pestle homogenizer | VWR | 47747-358 | |
| Pestle, unglazed, 175 mm | VWR | 410-0122 | |
| Pipette, Serological, 10 ml | VWR | 612-3700 | |
| Pipette, transfer, plastic | Sarstedt | 861,172,001 | |
| Plastic paraffin film (Parafilm M) | Bemis | PM996 | |
| Plate, 96-well | Falcon | 353910 | |
| Surgical forceps, Student Dumont #5 Forceps | FST - Fine Science Tools | 91150-20 | |
| Surgical forceps, Student Dumont #7 Forceps | FST - Fine Science Tools | 91197-00 | |
| Surgical scissors, Student Fine Scissors, Straight | FST - Fine Science Tools | 91460-11 | |
| Syringe, 10 mL | Terumo | SS-10ES1 | |
| Syringe, 20 mL | Terumo | SS-20ES1 | |
| Syringe, 5 mL | Terumo | SS-05S1 | |
| Syringe, Insulin, 0.3 cc | BD Medical | 324827 | |
| Tribrissen vet. 24% inj., containing 200 mg sulfadiazin and 40 mg trimethoprim/ml | MSD Animal health | 431577 | |
| Trypan blue solution, 0.4% | VWR | K940-100ML | |
| Viability dye, eBioscience Fixable Viability Dye eFluor 780 | Thermo Fisher Scientific | 65-0865-14 |
Referencias
- Lerner, A., Jeremias, P., Matthias, T. The World Incidence and Prevalence of Autoimmune Diseases is Increasing. International Journal of Celiac Disease. 3 (4), 151-155 (2015).
- Ando, R., Hama, H., Yamamoto-Hino, M., Mizuno, H., Miyawaki, A. An optical marker based on the UV-induced green-to-red photoconversion of a fluorescent protein. Proceedings of the National Academy of Sciences of the United States of America. 99 (20), 12651-12656 (2002).
- Mutoh, T., Miyata, T., Kashiwagi, S., Miyawaki, A., Ogawa, M. Dynamic behavior of individual cells in developing organotypic brain slices revealed by the photoconvertable protein Kaede. Experimental neurology. 200 (2), 430-437 (2006).
- Tomura, M., et al. Monitoring cellular movement in vivo with photoconvertible fluorescence protein “Kaede” transgenic mice. Proceedings of the National Academy of Sciences. 105 (31), 10871-10876 (2008).
- Tomura, M., et al. Tracking and quantification of dendritic cell migration and antigen trafficking between the skin and lymph nodes. Scientific Reports. 4, 6030 (2014).
- Gurskaya, N. G., et al. Engineering of a monomeric green-to-red photoactivatable fluorescent protein induced by blue light. Nature biotechnology. 24 (4), 461-465 (2006).
- Pereira, E. R., et al. Lymph node metastases can invade local blood vessels, exit the node, and colonize distant organs in mice. Science (New York, NY). 359 (6382), 1403-1407 (2018).
- Patterson, G. H., Lippincott-Schwartz, J. A photoactivatable GFP for selective photolabeling of proteins and cells. Science (New York, NY). 297 (5588), 1873-1877 (2002).
- Victora, G. D., et al. Germinal center dynamics revealed by multiphoton microscopy with a photoactivatable fluorescent reporter. Cell. 143 (4), 592-605 (2010).
- Habuchi, S., et al. Reversible single-molecule photoswitching in the GFP-like fluorescent protein Dronpa. Proceedings of the National Academy of Sciences of the United States of America. 102 (27), 9511-9516 (2005).
- Zhou, X. X., Chung, H. K., Lam, A. J., Lin, M. Z. Optical control of protein activity by fluorescent protein domains. Science (New York, NY). 338 (6108), 810-814 (2012).
- Degn, S. E., et al. Clonal Evolution of Autoreactive Germinal Centers. Cell. 170 (5), 913-926 (2017).
- Berland, R., et al. Toll-like receptor 7-dependent loss of B cell tolerance in pathogenic autoantibody knockin mice. Immunity. 25 (3), 429-440 (2006).
- Chatterjee, P., et al. Complement C4 maintains peripheral B-cell tolerance in a myeloid cell dependent manner. European journal of immunology. 43 (9), 2441-2450 (2013).
- Toubai, T., et al. Induction of acute GVHD by sex-mismatched H-Y antigens in the absence of functional radiosensitive host hematopoietic-derived antigen-presenting cells. Blood. 119 (16), 3844-3853 (2012).
- Luzina, I. G., et al. Spontaneous formation of germinal centers in autoimmune mice. Journal of leukocyte biology. 70 (4), 578-584 (2001).
- Sachs, D. H., Kawai, T., Sykes, M. Induction of tolerance through mixed chimerism. Cold Spring Harbor perspectives in medicine. 4 (1), a015529 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados