Method Article
Descongelación, cultivo y criopreservación de líneas de células de Drosophila
En este artículo
Resumen
Líneas de células de Drosophila son reactivos importantes para la investigación fundamental y biomedicina. Este artículo proporciona protocolos para descongelar, subcultivos y la criopreservación de líneas de células de Drosophila usadas para ayudar a los investigadores a incorporar el uso de estos reactivos en sus investigaciones.
Resumen
Actualmente hay más de 160 diferentes Drosophila líneas celulares distribuidas por centro de recursos de la genómica de Drosophila (DGRC). Con la ingeniería del genoma, se espera que el número de líneas celulares novela aumentar. La DGRC pretende familiarizar a los investigadores con el uso de líneas de células de Drosophila como instrumento experimental para complementar e impulsar su agenda de investigación. Se proporcionan procedimientos para trabajar con una variedad de líneas de células de Drosophila con características distintivas, incluyendo protocolos para descongelar, cultivo y criopreservación de células. Lo importante, esta publicación muestra las mejores prácticas para trabajar con líneas de células de Drosophila para minimizar el riesgo de contaminaciones de microorganismos adventicios o de otras líneas celulares. Los investigadores que familiarizarse con estos procedimientos podrán profundizar en las muchas aplicaciones que utilizan las células de Drosophila cultivadas incluyendo bioquímica, biología celular y genómica funcional.
Introducción
El uso de Drosophila cultivado células complementos en vivo volar el análisis genético y sirve como una herramienta de consulta primaria para abordar muchas cuestiones biológicas básicas1,2,3. Líneas de células de Drosophila oferta única población homogénea de células derivadas de tejido diferentes fuentes con diferentes fondos genéticos. Las líneas celulares son convenientes para muchos usos incluyendo la expresión de genes transgénicos, genómica, transcriptómica, proteómica, metabolómica, pantallas de alto rendimiento RNA de interferencia (RNAi), biología celular y microscopía. Lo importante es el uso de cultivo de células de Drosophila facilita la caracterización de las respuestas temporales inmediato a los estímulos conocidos. Además, el cultivo de células de Drosophila es favorable a CRISPR Cas9 genoma edición, lo que es relativamente fácil de crear nuevas líneas de células con genoma específicas modificaciones4,5,6, 7.
El centro de recursos de genómica de Drosophila (DGRC) sirve como un centro de depósito y distribución de líneas de células de Drosophila . Uno de los objetivos de la DGRC es ayudar a los miembros de la comunidad de investigación en el uso de recursos de cultivo de células de Drosophila . Este artículo presenta los protocolos básicos para el manejo de líneas de células de Drosophila . Complementa los recursos existentes para ayudar a los investigadores a sentirse cómodo con el manejo de cultivos de células de Drosophila y alcanzar un nivel de independencia en sus experimentos1,2,8,9 ,10.
Las líneas de células de Drosophila más comúnmente utilizadas son: sistema nervioso central (SNC) líneas13,14, líneas de Milner laboratorio disco imaginal y Schneider las líneas11, Kc16712, disco imaginal Mitsubishi/Miyake 15, la célula del ovario adulto líneas16,17y el Ras líneas18 (tabla 1). Las líneas de Schneider y Kc167 son líneas de celulares para todo uso general para su uso en Bioquímica recombinante genes transgénicos y pantallas de genéticas inversas. Las líneas de laboratorio (ML) de Mitsubishi/Miyake se derivaron de los discos imaginales larvales o sistema nervioso central (SNC) y han sido útiles para estudios relacionados con la neurosecretion, la regulación de la transcripción y procesamiento del RNA. Las líneas del disco de Milner (CME) han sido importantes para el estudio de la transducción de la señal. Las líneas celulares de fGS/OSS derivadas de ovarios adultos mutantes siguen siendo importantes reactivos para estudiar el impacto de la biología de RNA pequeños no codificantes en la célula de germen mantenimiento y diferenciación de17,19. Por último, las líneas Ras son únicas porque son líneas celulares derivadas de embriones ectopically expresan el oncogén Ras. Tienen la firma transcripcional de células precursoras de músculo y expresa piRNA activo maquinaria20. Últimos artículos de revisión y capítulos de libros cubren las aplicaciones de estas líneas celulares populares con más detalles2,3,9.
Todas estas líneas celulares pueden ser subcultivadas y congeladas. Hay requisitos diferentes leves pero importantes cómo cada línea celular se mantiene y preparado para la criopreservación. Por ejemplo, líneas celulares distintas requieren diferentes medios y suplementos (tabla 1). Las líneas varían también en las propiedades de adhesión superficial, morfología (figura 1 y figura 2), genotipo y tiempo de duplicación (tabla 2). Presentar protocolos básicos y resaltar las diferencias únicas para el manejo de las diferentes líneas de células de Drosophila ampliamente utilizadas.
Protocolo
1. descongelar y reactivación de líneas de células congeladas de Drosophila
- Esterilizar la campana de limpieza de la superficie de trabajo con etanol al 70%. Pipetear 5 mL del medio apropiado (tabla 1) en una de 25 cm2 frasco de T (T-25).
- Quite la ampolla de cryovial de líquido N2 o hielo seco. Limpie el cryovial con etanol al 70%, cuidadosamente Afloje y unseal la ampolla.
- Con una pipeta Pasteur, retirar 1 mL de medio de temperatura (RT) del frasco T-25. Añadir poco a poco los medios de comunicación en lo cryovial y mezclar suavemente para descongelar las células congeladas, asegurando que la suspensión de células que no se desborda.
- Transferir todo el volumen de la suspensión de células descongeladas de la ampolleta en el frasco T-25. Repita el procedimiento para garantizar que la suspensión de células se ha transferido completamente.
- Colocar el matraz en una incubadora de 25 ° C, permitiendo que las células se asiente y se adhieren para por lo menos 2 h. examina las células bajo un microscopio para asegurarse de que la mayoría de las células se asentaron en la superficie cada vez mayor. Suavemente Quite medios viejo y reemplácelo con 5 mL de medio fresco. Devolver el frasco en la incubadora.
- Al día siguiente, suavemente Quite los medios viejos y reemplácelo con 5 mL de medio fresco. Volver la cultura a la incubadora.
2. descongelación y reactivación de líneas de células congeladas de Drosophila (alternativa)
- En una campana estéril, descongelar las células por Resuspender el sedimento congelado con 1 mL de medio de RT. Transferir toda la suspensión de células descongeladas en un tubo cónico de 15 mL.
- Sedimenten las células por centrifugación a 1.000 x g durante 5 min descartar el sobrenadante y resuspender el precipitado de células en 5 mL de medio fresco.
- Transferir todo el volumen de la suspensión de células en un frasco de T-25 e incubar el cultivo a 25 ° C.
- 1 a 2 h después, examina las células bajo el microscopio para asegurarse de que la mayoría de las células se asentaron en la superficie cada vez mayor. Al día siguiente, reemplazar los viejos medios con 5 mL de medio fresco y volver la cultura a la incubadora.
3. subcultivo de las células semi adherentes cultivadas en placas de cultivo de 100 mm
- Esterilizar la campana por limpiar con etanol al 70%. Traer el material estéril para subcultivo en la campana, incluyendo botellas de los medios de comunicación, pipetas, ayuda de la pipeta y placas de cultura.
- Examinar la morfología y la confluencia de la cultura bajo un microscopio. Busque signos claros de contaminación microorganismal en la cultura. Determinar si las células están listas para ser pasados, basándose en las características de la cultura: densidad y tiempo, incluyendo la última vez que fueron subcultivados de duplicación de la célula.
- Si la cultura aparece muy confluentes (figura 1), determinar la densidad celular. En la campana estéril, desalojar las células de la superficie creciente por pipeteo hasta 10 mL del medio de la placa y la dispensación en las células. Repita unas cuantas veces, asegurándose de no para formar espuma, hasta que la superficie creciente se vuelve claro. Determinar la densidad celular usando un hemocitómetro o un contador de partículas automático (sección 5, figura 3). Subcultura las células si la densidad celular es entre 5 x 106 y 1 x 107 células/mL.
Nota: No no subcultura Drosophila líneas celulares a una densidad celular por debajo de 1 x 106 células/mL. -
Diluir la suspensión celular por consiguiente usando un medio apropiado para una concentración final de siembra de al menos 1 x 106 células/mL.
- De pases y de rutina mantenimiento, añadir un volumen adecuado de la suspensión celular a un determinado volumen de medio en una nueva placa de cultivo para lograr la densidad deseada de célula siembra.
- Para ampliar una cultura, transferir toda la suspensión de células en un frasco grande. Diluir la suspensión de células a la densidad de célula deseada con un volumen adecuado del medio. Distribuir volúmenes iguales de la suspensión de células diluidas a placas nuevas. Este método reduce al mínimo las variaciones en la densidad celular entre las placas.
- Tapar y etiquetar las placas con las iniciales del operador, fecha, relación de split, siembra la densidad celular, identificador de línea celular, medios de comunicación, número de paso y cualquier adiciones de los medios de comunicación tales como antibióticos.
- Coloque las placas en un recipiente de plástico y vuelva la caja a la incubadora.
Nota: la tabla 3 lista de los recipientes de cultivo comúnmente utilizados para el cultivo de líneas celulares de Drosophila y los volúmenes de trabajo asociado.
4. desacoplar las células adherentes cultivadas en placas de cultivo de 100 mm
- Transferir el medio de la placa a un matraz estéril nuevo. Guarde el medio.
- Enjuague las células añadiendo lentamente 1 mL de tripsina 0,05%-EDTA a la placa. Agitar suavemente para asegurar que la solución de tripsina cubre la superficie de todo crecimiento. Deseche la solución de tripsina.
- Suavemente añadir 1 mL de tripsina 0,05%-EDTA a la placa. Incubar la placa a 25 ° C entre 3−10 min mientras que el monitoreo de signos visibles de la separación de capa celular y deslizamiento de la superficie cada vez mayor.
- Añadir 9 mL de medio guardado a la placa para detener la actividad de la tripsina. Mezclar la suspensión de células para disociar grupos celulares. Una vez que todas las células han sido desalojadas, la superficie creciente será claro.
Nota: El uso de enzimas digestivas como la tripsina ayuda en pases líneas celulares fuertemente adherente. Tripsina es una mezcla de proteasas derivadas a menudo de páncreas porcino y está comercialmente disponible en diferentes grados de pureza.
5. manual de la célula contando con la célula de Neubauer recuento de diapositiva
- Preparar el hemocitómetro portaobjetos y cubreobjetos frotando la superficie con alcohol al 70%.
- Mezclar la suspensión de células y dispensar 15 μl de la suspensión de células en el borde estriado del hemocitómetro (Figura 3A) para llenar la sala primera de la hemocitómetro. Llenar la cámara segunda del hemocitómetro. La suspensión de células se sorteará en la cámara de conteo por acción capilar.
- Usando un 10 x objetivo de microscopio, contar las células dentro de la zona2 de 1 mm en el centro de la red por las líneas paralelas (figura 3,D). Para evitar el conteo duplicado, contar las células que superposición la parte superior e izquierdas límites, pero no células que cruzan los límites derecho e inferior de las 200 plazas de2 μm. Contar entre las células 100−200. Repetir la cuenta con la segunda cámara.
- Calcular el promedio de las dos cuentas y determinar la densidad celular según la siguiente fórmula: densidad (células/mL) de la célula = promedio recuento (n1 + n22) x 104.
Nota: Viabilidad celular se expresa como el porcentaje de células viables en células totales. Para determinar viabilidad celular, la mezcla la suspensión de células con un volumen igual de azul tripán (0.4%) solución antes de conteo manual o automática de la célula. Células vivas no tomará el tinte, mientras que las células muertas se teñido azul.
6. criopreservación de líneas de células de Drosophila
- Compruebe la cultura saludable morfología, crecimiento y la falta de contaminación. Cosechan los cultivos desde el mediados de a la fase de crecimiento del último registro (paso 3.3 o sección 4). Para muchas líneas de células de Drosophila , es aproximadamente entre 4 x 106 células/mL a 8 x 106 células/mL.
- Transferir la suspensión de toda la célula en un tubo cónico de 15 mL o 50 mL. Recoger las células por centrifugación a 1.000 x g durante 5 min y descarte el sobrenadante.
- Resuspender el precipitado de células en un volumen de medio de congelación (tabla 4) que dan lugar a una densidad celular final de al menos 4 x 107 células/mL.
- Añadir gota a gota la cantidad apropiada del crioprotector dimetil sulfóxido (DMSO) en la suspensión de células tal que la concentración final de DMSO es 10%. Mezclar suavemente la suspensión de células.
- Cuidadosamente añada 0,5 mL de la suspensión de células en alícuotas de los crioviales previamente marcados (~ 2 x 107 células/vial). Colocar las ampollas en un envase de congelación con isopropanol (Figura 4A). Transferir el contenedor de congelación en un congelador de-80 ° C durante la noche para permitir que la temperatura de los crioviales caer lentamente (-1 ° C/min) a la temperatura del congelador.
- Sacar los crioviales congelados y rápidamente sujete a bastones (Figura 4B). Introduzca las columnas que contienen los crioviales en un bote (figura 4). Como alternativa, coloque crioviales congelado dentro de una caja de congelación previamente enfriada (figura 4). Tienda congelados crioviales en la fase líquida de congeladores de2 N (figura 4E,F).
Nota: Cuando se utiliza la congelación los medios de comunicación que contiene DMSO, un retraso de hasta 30 min a temperatura ambiente no es perjudicial para las células.
Resultados
Es importante descongelar las células Drosophila rápidamente y cultura a una densidad celular que trae la cultura en la fase de crecimiento. Si se siguen los procedimientos de criopreservación y descongelación, la densidad celular en el matraz T-25 mínimo será igual a 4 x 106 células/mL. Una o dos horas después de descongelar, más líneas de células de Drosophila comenzará a fijar a la superficie cada vez mayor. Bajo la circunstancia en la que la mayoría de las células no ha unido en la superficie cada vez mayor dentro de dos horas después de la descongelación, se recomienda incubar las células durante la noche antes de cambiar los medios de comunicación.
El objetivo del subcultivo es mantener las células en la saludable fase logarítmica exponencial de la curva de crecimiento. Los criterios para subcultivos dependen la falta visible de contaminación microorganismal, densidad celular y la necesidad de establecer un programa de mantenimiento regular. Es importante primero evaluar la salud de las células y determinar la ausencia de contaminantes adventicias antes de la congelación. La mayoría de bacterias y hongos contaminantes son fáciles de detectar simplemente por inspección visual. Cultivos contaminados pueden identificarse por un aumento en la turbidez de los medios de comunicación. Bajo el microscopio, pueden aparecer contaminantes como barras de bacterias, cocos, células de levadura o secuencia-como hifas de los hongos de florecimiento. Otras fuentes de contaminación como el micoplasma no citopático pueden detectarse visualmente y pueden comprobarse regularmente por ensayos de PCR21.
La confluencia de una línea celular puede ser determinada visualmente (figura 1). Líneas de células de crecimiento rápido llegar a confluencia temprano y necesitan ser pasados regularmente. Tales líneas son subcultivados hasta dos veces a la semana. En contraste, las células de crecimiento lento son los menos una vez cada dos semanas o más. Sin embargo, las células necesitan ser alimentados a medio fresco cada semana. Esto es para prevenir el agotamiento de los medios de comunicación y para diluir productos de desechos metabólicos de las células. Líneas celulares derivan de diversas fuentes difieren en su morfología (figura 2), propiedades de adhesión, requisitos de los medios de comunicación (tabla 1) del tejido y duplicar el tiempo (tabla 2). Tabla 5, tabla 6, Tabla 7y Tabla 8 lista las recetas de los diferentes medios de cultivo celular Drosophila .
Cuenta de célula asegura una densidad de siembra precisa y una rutina predecible para subcultivo. Para los experimentos cuantitativos, conteo celular es esencial. Las células se cuentan ya sea utilizando un hemocitómetro (Figura 3A) o un contador de partículas automático (figura 3B). Si utiliza un contador automatizado, siga las instrucciones del fabricante. Conteo células manualmente usando un hemocitómetro es económico y fácil. El número de células dentro de las rejillas de Neubauer medianas se cuenta y se calcula la densidad celular; Por ejemplo, n = 214 células, dando por resultado una densidad celular de 2.14 x 106 células/mL (figura 3D).
Suspensión de células de dos placas de 100 mm, cada uno conteniendo 10 mL de la suspensión celular en 4 x 106 células/mL se recogen y se resuspendió en 2 mL de la congelación de los medios de comunicación para lograr una densidad de 4 x 107 células/mL. Cada cryovial congelado con 0,5 mL de suspensión contiene 2 x 107 células. Esto resultará en una cultura con 4 x 106 células/mL cuando se haya descongelado según el protocolo de la sección 1.
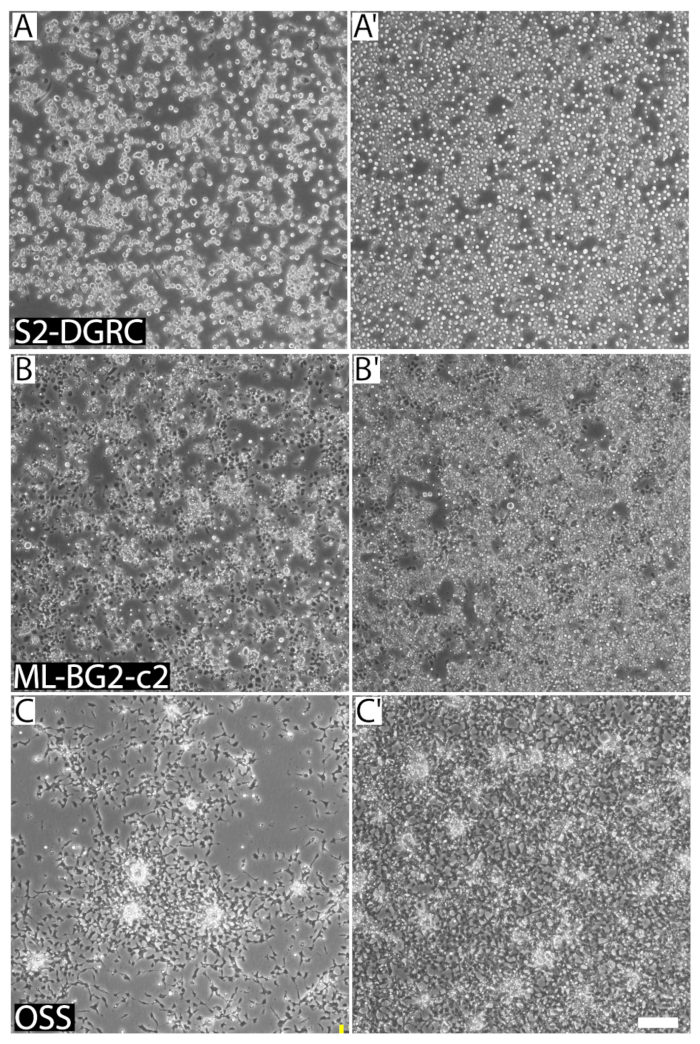
Figura 1 : Imágenes representativas de tres distintas Drosophila de células en diferentes densidades de confluencia y celular. (A) S2-DGRC cultura 1 x 106 células/ml. (A') Cultura de S2-DGRC de 4.5 x 106 células/mL. (B) ML-BG2-c2 de la cultura en 2 x 106 células/mL. (B') ML-BG2-c2 cultura en 8 x 106 células/mL en el cual las células son viruta y agregando como focos. (C) OSS cultura 1 x 106 células/ml. (C') Cultura de la OSS en 4 x 106 células/mL. Células en suspensión no son capturadas en el mismo plano focal. Barra de escala = 100 μm. haga clic aquí para ver una versión más grande de esta figura.
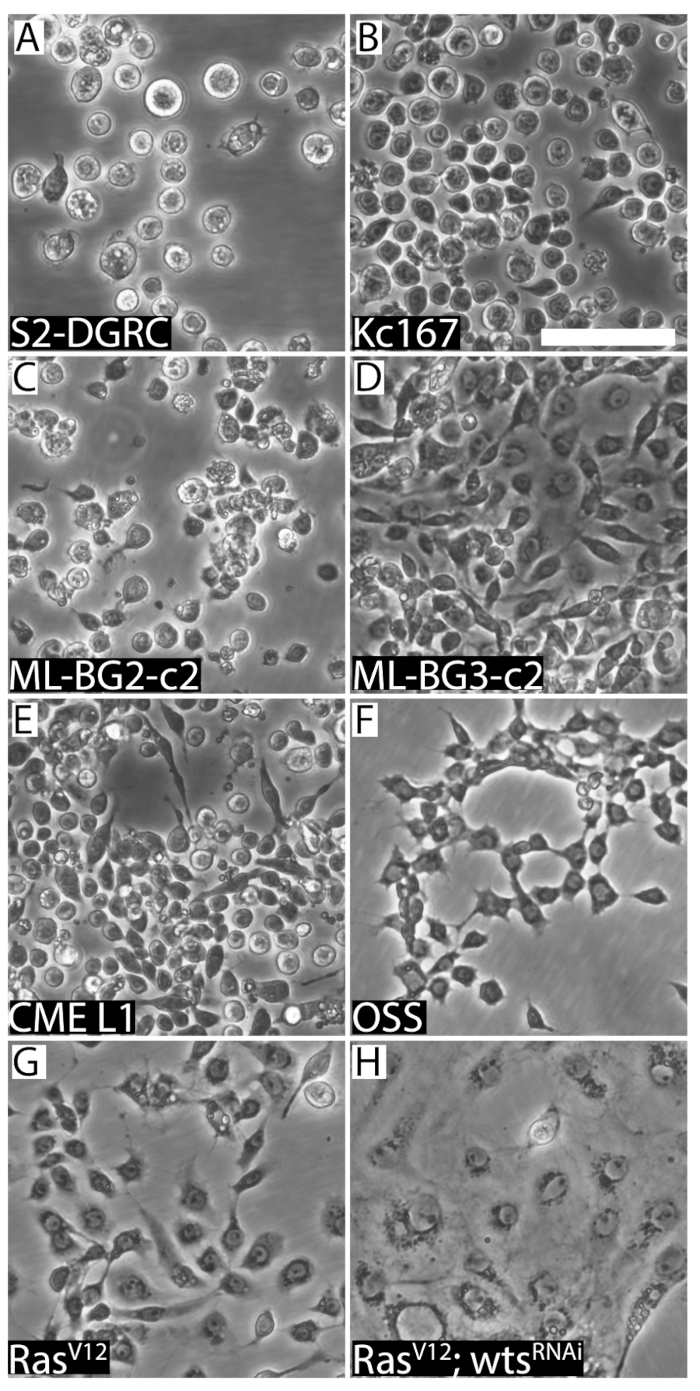
Figura 2 : Imágenes representativas de las ocho distintas líneas de células de Drosophila . (A) ronda S2-DGRC derivados del embrión. (B) ronda derivados de embriones Kc167. (C) redonda larvas derivadas de CNS ML-BG2-c2. (D) ronda larvales fusiformes ML-BG3-c2. (E) CME L1, una línea celular derivada de los discos imaginal de larvas de la pierna, es más pequeño y tiene morfología redonda/fusiforme. (F) OSS, una línea celular derivada de ovarios adultos, muestra morfología en forma de huso. (G) línea de células Spindle-shaped RasV12 manifestando activó Ras. (H) RasV12; wtsRNAi (WRR1), una línea de células expresando Ras activado y ARN bicatenario contra el tumor supresor verrugas (wts), muestra características epiteliales. Barra de escala = 50 μm. haga clic aquí para ver una versión más grande de esta figura.
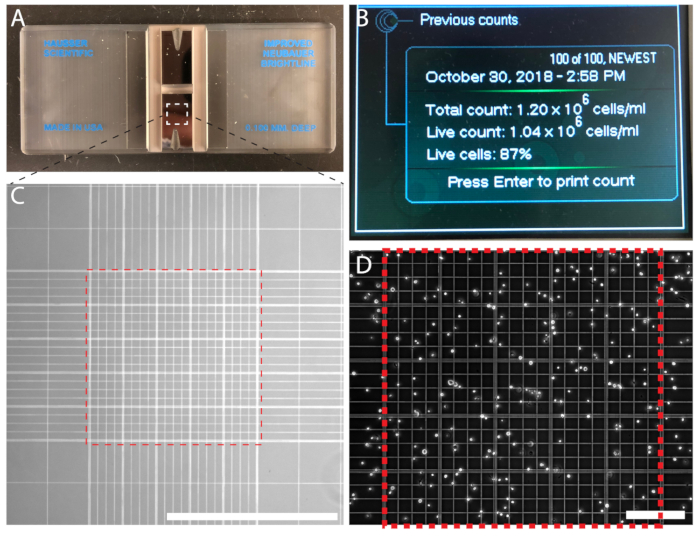
Figura 3 : Densidad celular puede ser contada manualmente utilizando un hemocitómetro o automáticamente mediante un contador de partículas automático. (A) A hemocitómetro con dos cámaras. (B) un contador celular automatizado mostrando el resultado de un conteo. (C) la cuenta de celular de Neubauer mejorada red vista bajo un objetivo de 10 x. Contar celdas por la rejilla central de 0.1 mm3 (Plaza de la línea discontinua roja). (D) la rejilla central en el hemocitómetro lleno de células para contar. Barra de escala = 1 mm (C); 0,2 mm (D). Haga clic aquí para ver una versión más grande de esta figura.

Figura 4 : Equipo para criopreservación. (A) A congelación envase tiendas ampollas en posición vertical para la congelación lenta. (B) un metal caña para sostener ampollas congeladas. (C) A frasco para sujetar bastones. (D) una congelación caja de plástico (cryobox). (E) A frasco con múltiples bastones insertados en un tanque de almacenaje líquido N2 . (F) un líquido N2 tanque de almacenamiento. Haga clic aquí para ver una versión más grande de esta figura.
| Tensión de celda | Medio | Adherencia | Tripsina |
| Líneas de Schneider | M3 + BPYE + 10% de suero fetal de ternero (FCS), pH 6.6 | Semi-adherente | No |
| (S2R +, S2-DRSC, S2-DGRC, Sg4) 11 | |||
| Media+ + 10% FCS de Schneider | |||
| KC las líneas (Kc167, Kc7E10)21,22 | M3 + BPYE + 5% FCS, pH 6.6 | Semi-adherente | No |
| Hyclone-CCM3, pH 6.2 | |||
| Disco imaginal y CNS (ML-líneas)13,14 | M3 + BPYE + 10% FCS, pH 6.6 | Semi-adherente | No |
| insulina de 10 μg/mL | |||
| Disco imaginal Milner líneas (líneas de CME)15 | M3 + 2% FCS | Semi-adherente | No |
| insulina de 5 μg/mL | |||
| 2.5% extracto de mosca | |||
| fGS/OSS16 | M3 + 10% FCS, pH 6.8 | Adherente | * |
| insulina de 10 μg/mL | |||
| 1 mg/mL C5H8KNO4 | |||
| 0.5 mg/mL KHCO3 | |||
| glutatión de 0.6 mg/mL | |||
| 10% Extracto de mosca | |||
| RasV12 líneas18 | M3 + BPYE + 10% FCS, pH 6.6 | Adherente | Sí |
Tabla 1: Los requisitos de propiedades y medios de comunicación de varios Drosophila líneas celulares. Diferentes aislados de las líneas de Schneider semi adherentes incluyendo S2R +, S2-Drosophila RNAi Screening Center (DRSC), centro de recursos de genómica de Drosophila S2 (DGRC) y Sg4 son líneas celulares utilizadas que proliferan robusta cuando cultivadas en medios M3 + Bactopetone Extracto de levadura (BPYE) suplementado con 10% de suero fetal de ternero (FCS). Por otra parte, los medios de comunicación de Schneider (pH 6.7-6.8) es de uso frecuente en lugar de M3 + BPYE. Las líneas de Kc proliferan en tanto M3 + BPYE (5% FCS) o libre de suero CCM3. Las líneas de sistema nervioso central (SNC) y el disco imaginal ML requieren suplementos de insulina para la proliferación. Las líneas del disco imaginal de Milner requieren insulina y mosca extracción de suplementación. Líneas de células adherentes fGS/OSS requieren insulina, una mayor concentración de extracto de moscas así como glutatión para crecimiento. Líneas de RasV12 adherentes crecen bien en M3 + BPYE (10% FCS). Tripsina se utiliza para desplazar las líneas de células adherentes de la superficie de crecimiento.
| De células (Stock #) | Genotipo | Duplicar tiempo (h) * | Fuente de tejido |
| S2R + (150) | OreR | 39 | Embriones de finales |
| S2-DGRC (6) | OreR | 23 | Embriones de finales |
| S2-DRSC (181) | OreR | 46 | Embriones de finales |
| Kc167 (1) | e/se | 22 | 6−12 embriones HS |
| ML-BG2-c2 (53) | y v f mal | 48 | 3rd instar larval CNS |
| ML-BG3-c2 (68) | y v f mal | 104 | 3rd instar larval CNS |
| ML-DmD8 (92) | y v f mal | 66 | 3 disco de ala larvas de estadio derd |
| CME W1 Cl.8+ (151) | OreR | 46 | 3 disco de ala larvas de estadio derd |
| L1 CME (156) | OreR | 47 | 3 disco de pierna larvas de estadio derd |
| OSS (190) | bamD86 | 45 | Adultos bam ovarios mutante |
| Ras líneas deV12 | UAS-GFP; P(UAS-Ras85D.V12) / P (Act5C-GAL4) 17bFO1 | 41−65 | Embrión |
Tabla 2: Genotipo, duplicando el tiempo y fuentes de tejido de ampliamente utilizado Drosophila líneas celulares. Se presentan el genotipo de tejido, fuente y tiempo de líneas celulares utilizadas de duplicación de la población. Tiempo de duplicación se basa en el crecimiento en los medios recomendados a 25 ° C.
| Vasija de la cultura | Volumen de medios de comunicación (mL) |
| frasco de 12,5 cm2 T | 2.5 |
| frasco de 25 cm2 T | 5 |
| frasco de 75 cm2 T | 15 |
| placa de 35 mm | 1 |
| placa de 60 mm | 4 |
| placa de 100 mm | 10 |
| placa de 384 pozos * | 0,04/pozo |
| placa de 96 pozos * | 0.1/pozo |
| placa de 48 pozos * | 0.3/pozo |
| placa de 24 pocillos * | 0.5/pozo |
| placa de 12 pozos | 1.0/pozo |
| placa de 6 pozos | 2.0/pozo |
Tabla 3: la cultura de los vasos y los volúmenes recomendados los medios de comunicación. Recipientes de cultivo de varios tamaños están disponibles para el cultivo de células de Drosophila . Los volúmenes de medios apropiados (mL) se recomiendan para cada recipiente. Placas de varios pocillos que contienen menos de 0,5 mL de la suspensión celular con la película de parafina para reducir la pérdida de los medios de comunicación debido a la evaporación del sello.
| Volumen | |
| M3 + BPYE, pH 6.6 | 70 mL |
| Calor FCS inactivado | 20 mL |
| Filtrado estéril DMSO * | 10 mL |
Tabla 4: receta para preparar 100 mL de medio de congelación (M3 + BPYE, FCS de 20%, 10% DMSO). Preparar medios de congelación según sea necesario y Evite guardar media congelación contiene DMSO durante tiempo prolongado.
| M3 + medio BPYE | Cantidad |
| Escudos y cantó de M323 | 1 botella de |
| KHCO3 | 0.5 g |
| Extracto de levadura selecta | 1.0 g |
| Bactopeptone | 2,5 g |
| Agua purificada estéril | 1000 mL |
Tabla 5: Receta para preparar 1 L de M3 + BPYE medio de cultivo de tejido. Ajustar el pH a 6,6. Esterilizar al pasar el medio a través de un filtro de 0,22 μm.
| Base medio de M3 para la línea celular de fGS/OSS | Cantidad |
| Escudos y cantó M3 | 1 botella de |
| KHCO3 | 0.5 g |
| C5H8KNO4 | 1.0 g |
| Agua purificada estéril | 1.000 mL |
Tabla 6: Receta para 1 L de medio base de fGS/OSS M3. Ajustar el pH a 6.8. Esterilizar al pasar el medio a través de un filtro de 0,22 μm.
| Hyclone CCM3 | Cantidad |
| CCM3 polvo | 28,6 g |
| NaHCO3 | 0,35 g |
| 10 N NaOH | 2,5 mL |
| CaCl2 | 0.5 g |
| Agua purificada estéril | 1.000 mL |
Tabla 7: Receta para 1 L de medio de cultivo de tejido Hyclone CCM3. Ajustar el pH a 6.2. Esterilizar al pasar el medio a través de un filtro de 0,22 μm.
| M3 + BPYE + 10% FCS | Disco de Miyake y CNS líneas medianas | Medio de líneas de disco Milner | medio completo fGS/OSS | |
| M3 + BPYE, pH 6.6 | 90 mL | 90 mL | - | - |
| Calor FCS inactivado * | 10 mL | 10 mL | 2 mL | 10 mL |
| Insulina (10 mg/mL) | - | 100 ΜL | 50 ΜL | 100 ΜL |
| Extracto de la mosca | - | - | 2,5 mL | 10 mL |
| Glutatión (60 mg/mL) | - | - | 1 mL | |
| M3, pH 6.6 | - | - | 97,5 mL | - |
| fGS/OSS M3, pH 6.8 | - | - | 79 mL |
Tabla 8: Receta para preparar 100 mL de común varios Drosophila medios de cultivo celular. Incubar FCS a 56 ° C durante 1 h y agitar cada cinco minutos para Inactive por calor las proteínas del complemento.
Discusión
Cultivos de células de Drosophila son reactivos primarios para pantallas de celulares de alto rendimiento. Su uso también complementa la investigación genética en vivo proporcionando una población homogénea de células adecuadas para bioquímica, rápida de construcciones transgénicas antes de inyectar en moscas, biología de la célula, microscopía y más recientemente genético de células somáticas manipulaciones por genoma edición1,2,3,8,9,10.
La viabilidad y la recuperación de las células Drosophila es sensible a las fluctuaciones drásticas incluso a bajas temperaturas. La DGRC almacena congelado células en la fase líquida de N2 (-196 ° C) y medios de transporte en hielo seco (-78,50 ° C). Ampollas congeladas que han sido transportados en hielo seco no deben ser transferidas en líquido N2 o un congelador de-80 ° C para el almacenamiento. En cambio, las células congeladas descongeladas, resembradas en una alta densidad celular tan pronto como sea posible a la llegada (protocolo sección 1) y cultivadas para sus fines (artículo 3 del Protocolo). Si las líneas celulares no son utilizadas inmediatamente para los experimentos, la célula líneas debe ser cryopreserved (artículo 6 del Protocolo) hasta que estén listas para su uso.
Algunas líneas celulares, como las líneas ML-BG2-c2 y Ras necesitan varios días para recuperarse de los efectos de ser restablecido el estado criopreservado. Una gran cantidad de detritos celulares acompaña a estas líneas celulares los primeros días después de descongelarla. A la izquierda imperturbado, las células recuperan y proliferan. Muchas líneas de células de Drosophila en la DGRC se han adaptado a crecer en M3 en los medios de comunicación22. Para líneas celulares que son lentas para recuperarse de los efectos de la descongelación, el uso de medios condicionados puede ser útil. Probabilidad condicionados medios contienen factores de crecimiento secretados por las células en los medios de comunicación pueden fomentar la recuperación y proliferación de las células después de descongelar.
Líneas celulares generalmente siguen una curva de crecimiento stereotypical que consta de una fase lag, fase exponencial, fase de meseta y una fase de deterioro. Muchas líneas de células de Drosophila proliferan en la fase logarítmica de crecimiento cuando son cultivadas con una densidad entre 1 x 106 y 1 x 107 células/mL a 25 ° C. Es esencial que las líneas celulares son pasadas que están siempre en la fase de crecimiento exponencial.
La confluencia de la cultura, expresada en porcentaje, describe la superficie de crecimiento que está cubierta por células. Confluencia de células de una línea celular depende de su tamaño y forma celular. Líneas celulares distintas tienen propiedades de adherencia y diferentes morfologías. Como resultado, diferentes líneas celulares en aproximadamente similar confluencia pueden tener densidad de células muy distintas (figura 1). Confluencia de la cultura no puede ser un indicador ideal para pases de cultivos de células de Drosophila porque líneas de células de Drosophila siguen proliferando por apilado uno encima del otro como focos o en suspensión, incluso después de que la superficie de crecimiento ha sido cubierta (figura 1). Sin embargo, los usuarios experimentados con líneas celulares específicas pueden utilizar a menudo confluencia como una guía visual rápida para cuando para subcultivo.
Mientras que es posible cultivar líneas de Drosophila a TA ambiente entre 19−25 ° C, no se recomienda porque las fluctuaciones de temperatura pueden afectar la tasa de proliferación. Se recomienda el uso de un dedicado 25 ° C la incubadora. La incubadora de cultivos de células de Drosophila no es necesario facilitar el intercambio de CO2 del gas porque los medios de cultivo de células de Drosophila no utilizan CO2 para almacenamiento en búfer. La humedad dentro de la incubadora para el cultivo de líneas celulares es un factor importante no para ser pasado por alto cuando las células en placas de cultivo. Dependiendo del tipo de incubadora y el ambiente de trabajo, puede ser necesario colocar un vaso de agua estéril dentro de la incubadora. Para minimizar la evaporación de los medios de comunicación, utilizar T-matraz cerrado o almacenar placas en un recipiente de plástico bien sellado dentro de la incubadora.
Es importante desarrollar un programa para subcultivo líneas de células de Drosophila . Para estimar la consistencia de la velocidad y monitor de crecimiento, es conveniente subcultivo en una relación incluso geométrica (split ratio 1:2, 1:4, 1:8). Por ejemplo, una placa confluente de 10 mL de células Kc167 en 8 x 106 células/mL se puede dividir en proporción de 1:8 para lograr una densidad de siembra de 1 x 106 células/mL (1.25 mL de la suspensión celular diluida en 8,75 mL de medio fresco). Se espera que en 72 h, Kc167 culturas proliferan a una densidad de 8 x 106 células/mL, dado su tiempo de duplicación de 24 h. Por lo tanto la relación de split está decidida a facilitar una subcultura conveniente rutina hasta dos veces a la semana, asegurando que las células se cultivan siempre en su fase logarítmica exponencial de crecimiento. Esto permite un horario regular para el subcultivo de las células para que el momento de confluencia es ni demasiado corto ni demasiado largo. Si es demasiado corto el tiempo de confluencia, las células son subcultivadas en una menor densidad celular (cociente más alto de la fractura). Del mismo modo, si es demasiado largo el tiempo para llegar a la confluencia, las células son subcultivadas en una mayor densidad celular (relación de división inferior). Es importante tener en cuenta que mayoría de las líneas de células de Drosophila es muy sensible a las densidades bajas de la célula (< 1 x 105 células/mL), en que las células no proliferan y eventualmente pueden morir.
Líneas de células de Drosophila varían en morfología y características de crecimiento. Como resultado, pueden tener líneas celulares con propiedades distintas que se tratan de manera distinta. Mayoría de las líneas de células de Drosophila es semi-adherente. En baja densidad celular, se adhieren más a la superficie de crecimiento y como la cultura llega a ser confluente, las células se convierten en menos adherentes y separar fácilmente. Este cambio gradual en la adhesión celular facilita la fácil subcultivos de líneas de células de Drosophila más ampliamente utilizadas (Schneider, Kc líneas, disco imaginal y CNS) ya que permite al operador simplemente distribuir los medios de comunicación sobre la monocapa celular para desalojarlos de la superficie de crecimiento cuando la cultura es densa. Para líneas de superficie adherente como la mujer germinal vaina somática vástago/ovárico (fGS/OSS) y Ras líneas, es esencial al incubar las células en tripsina por un corto período facilitar la extracción de las células de la superficie de crecimiento.
Adiciones de los medios de comunicación para la mayoría de las líneas de células de Drosophila incluyen suero fetal de ternero (FCS). Insulina y extracto de moscas adulta (FEX) son necesarios para algunas líneas específicas. FEX contiene componentes esenciales para el crecimiento de líneas específico disco imaginal larval y la célula del ovario adulto. Prepara la DGRC, y hace disponible FEX adultos derivados de moscas de Oregon-R-modENCODE 1 semana de edad (RRID: BDSC_25211) en alícuotas de 2,5 mL y 10 mL. La DGRC también proporciona instrucciones para la preparación de FEX de pequeña escala en su página web < https://dgrc.bio.indiana.edu/include/file/additions_to_medium.pdf>. Preparación de FEX, sin embargo, lleva tiempo y requiere una gran cantidad de moscas adultas.
La criopreservación de líneas de células de Drosophila ahorra tiempo y reactivos para el mantenimiento de líneas celulares no en uso inmediato. Criopreservación se logra congelando poco a poco las células (-1 ° C/min) a-80 ° C en un medio que contiene DMSO, un agente crioprotectores. El lento paso de enfriamiento es crítico para la criopreservación exitosa. En un congelador de-80 ° C, se enfría la ampolla de las células a una tasa de-1 ° C/min cuando se coloca en un recipiente congelación llenado con isopropanol. A partir de 25 ° C de temperatura ambiente, tardará hasta 2 h para la temperatura en las ampollas para llegar a 80 ° C. Se recomienda dejar las ampollas para congelar durante la noche.
Ampollas congeladas deben ser transferidos rápidamente a la fase líquida de nitrógeno para un almacenamiento prolongado. A temperatura ambiente, la cryovial se recalentar rápidamente en aproximadamente 10 ° C/min y la viabilidad se verá afectada en el encima de-50 ° C23. Para mantener a la transferencia rápida, manejar ampollas en pequeñas cantidades para reducir al mínimo la exposición a temperatura ambiente. Como alternativa, colocar los crioviales congelado en hielo seco mientras se prepara para su traslado en líquido N2. Si no hay nitrógeno líquido, las células pueden almacenarse en un congelador de-80 ° C, aunque con un riesgo de deterioro significativo en el tiempo.
Densidad celular es crítica para la criopreservación exitosa y el posterior renacimiento de líneas celulares. En general, células nuevas líneas deben congelarse para crear el primer freeze (1−3 ampollas) tan pronto como disponga de un exceso de células. Una vez que la línea celular ha sido más cultivada estable, se debe crear un stock congelado de 10−20 ampollas. Esta acción es descongelado luego busque su recuperación posterior congelación celular y viabilidad, después de lo cual se propaga para experimentación o para reemplazar la población cuando el número de ampollas stock congelados cae por debajo de cinco. Finalmente, es importante validar que las células descongeladas conservan las características de su stock parental como líneas celulares conocen evolucionar3,24.
En conclusión, este artículo presenta una cartilla para trabajar con cultivos de células de Drosophila proporcionando la información fundamental sobre las diversas líneas, mejores prácticas y protocolos de audiovisuales para el manejo básico de líneas de células de Drosophila . Este recurso accesible pretende aliviar suavemente la introducción al trabajo con células cultivadas de Drosophila y como complemento de guías de capacitación existente en cualquier laboratorio de investigación.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a los institutos nacionales de salud (Premio NIH P40OD010949) y la comunidad de investigación para la utilización de los diferentes recursos de celular de vector de ADN de D. melanogaster curados en la DGRC.
Materiales
| Name | Company | Catalog Number | Comments |
| 100 mm tissue culture plates | Corning | 430167 | Subculturing |
| 25 cm2 T-flask | Corning | 430168 | Subculturing |
| 35HC Liquid Nitrogen Storage Tank | Taylor-Wharton | 35HCB-11M | Cryopreservation |
| Automated Cell counter | BIO-RAD | TC20 | Counting |
| Bactopeptone | BD BioSciences | 211677 | Medium additions |
| Counting Slides | BIO-RAD | 145-0011 | Counting |
| Cryovial 1 mL | Greiner | 123263 | Cryopreservation |
| DMSO | Sigma Aldrich | D5879 | Cryopreservation |
| Freezing Box | Nalgene | 5029-0909 | Cryopreservation |
| Freezing Container | Fisher Scientific | 15-350-50 | Cryopreservation |
| Hematocytometer | Fisher Scientific | #0267110 | Counting |
| Human Insulin | Millipore Sigma | I9278 | Medium additions |
| Hyclone CCM3 media | GE Healthcare Life Sciences | SH30061.03 | Medium |
| Hyclone Fetal Bovine Serum | GE Healthcare Life Sciences | SH30070.03 | Medium additions |
| L-Glutamic acid potassium salt monohydrate | Millipore Sigma | G1149 | Medium additions |
| L-Glutathione reduced | Millipore Sigma | G6013 | Medium additions |
| Potassium Bicarbonate | Millipore Sigma | 237205 | Medium additions |
| Select Yeast Extract | Millipore Sigma | Y1000 | Medium additions |
| Shields and Sang's M3 Insect medium | Millipore Sigma | S8398 | Medium |
| Trpsin-EDTA (0.05 %), phenol red | ThermoFisher Scientific | 25300054 | Subculturing |
| Trypan Blue (0.4%) | BIO-RAD | 145-0013 | Counting |
Referencias
- Baum, B., Cherbas, L., Dahmann, C. Drosophila: Methods and Protocols. Methods in Molecular Biology. 420, 391-424 (2008).
- Cherbas, L., Gong, L. Cell lines. Methods. 68 (1), 74-81 (2014).
- Luhur, A., Klueg, K. M., Zelhof, A. C. Generating and working with Drosophila cell cultures: Current challenges and opportunities. Wiley Interdisciplinary Reviews: Developmental Biology. , e339 (2018).
- Franz, A., Brunner, E., Basler, K. Generation of genome-modified Drosophila cell lines using SwAP. Fly (Austin). 11 (4), 303-311 (2017).
- Housden, B. E., et al. Identification of potential drug targets for tuberous sclerosis complex by synthetic screens combining CRISPR-based knockouts with RNAi. Science Signaling. 8 (393), r9 (2015).
- Kunzelmann, S., Bottcher, R., Schmidts, I., Forstemann, K. A Comprehensive Toolbox for Genome Editing in Cultured Drosophila melanogaster Cells. G3 (Bethesda). 6 (6), 1777-1785 (2016).
- Ishizu, H., Sumiyoshi, T., Siomi, M. C. Use of the CRISPR-Cas9 system for genome editing in cultured Drosophila ovarian somatic cells. Methods. 126, 186-192 (2017).
- Echalier, G. . Drosophila Cells in Culture. , (1997).
- Echalier, G., Perrimon, N., Mohr, S. . Drosophila cells in culture. 2nd edition. , (2017).
- Cherbas, L., Cherbas, P., Roberts, D. B. . Drosophila: A practical approach. 10, 319-346 (1998).
- Schneider, I. Cell lines derived from late embryonic stages of Drosophila melanogaster. Journal of Embryollgy and Experimental Morphology. 27 (2), 353-365 (1972).
- Echalier, G., Ohanessian, A. Isolement, en cultures in vitro, de lignees cellulaires diploides de Drosophila melanogaster. Comptes rendus de l'Académie des Sciences. 268, 1771-1773 (1969).
- Ui, K., et al. Newly established cell lines from Drosophila larval CNS express neural specific characteristics. In Vitro Cellular & Developmental Biology − Animal. 30A (4), 209-216 (1994).
- Ui, K., Ueda, R., Miyake, T. Cell lines from imaginal discs of Drosophila melanogaster. In Vitro Cellular & Developmental Biology. 23 (10), 707-711 (1987).
- Currie, D. A., Milner, M. J., Evans, C. W. The growth and differentiation in vitro of leg and wing imaginal disc cells from Drosophila melanogaster. Development. 102, 805-814 (1988).
- Niki, Y., Yamaguchi, T., Mahowald, A. P. Establishment of stable cell lines of Drosophila germ-line stem cells. Proceedings of the National Academy of Sciences of the United States of America. 103 (44), 16325-16330 (2006).
- Saito, K., et al. A regulatory circuit for piwi by the large Maf gene traffic jam in Drosophila. Nature. 461 (7268), 1296-1299 (2009).
- Simcox, A., et al. Efficient genetic method for establishing Drosophila cell lines unlocks the potential to create lines of specific genotypes. PLoS Genetics. 4 (8), e1000142 (2008).
- Sumiyoshi, T., et al. Loss of l(3)mbt leads to acquisition of the ping-pong cycle in Drosophila ovarian somatic cells. Genes & Development. 30 (14), 1617-1622 (2016).
- Dequeant, M. L., et al. Discovery of progenitor cell signatures by time-series synexpression analysis during Drosophila embryonic cell immortalization. Proceedings of the National Academy of Sciences of the United States of America. 112 (42), 12974-12979 (2015).
- Young, L., Sung, J., Stacey, G., Masters, J. R. Detection of Mycoplasma in cell cultures. Nature Protocols. 5 (5), 929-934 (2010).
- Shields, G., Sang, J. H. Improved medium for culture of Drosophila embryonic cells. Drosophila Information Service. 52, 161 (1977).
- Freshney, R. I., Capes-Davis, A., Gregory, C., Przyborski, S. . Culture of animal cells : a manual of basic technique and specialized applications. Seventh edition. edn. , (2016).
- Lee, H., et al. DNA copy number evolution in Drosophila cell lines. Genome Biology. 15 (8), R70 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados