Method Article
Estudios dirigidos mediante la cara de bloque serie y la microscopía electrónica de escaneo de haz de iones enfocado
En este artículo
Resumen
Aquí, presentamos un protocolo para combinar eficientemente la cara del bloque serie y la microscopía electrónica de barrido de haz de iones enfocado para apuntar a un área de interés. Esto permite una búsqueda eficiente, en tres dimensiones, y la localización de eventos raros en un campo de visión grande.
Resumen
Este protocolo permite la toma de imágenes eficientes y eficaces de muestras de células o tejidos en tres dimensiones a nivel de resolución de microscopía electrónica. Durante muchos años, la microscopía electrónica (EM) ha seguido siendo una técnica inherentemente bidimensional. Con la llegada de las técnicas de imagen del microscopio electrónico de barrido en serie (volumen EM), utilizando un microtomo integrado o un haz de iones enfocado para cortar y luego ver los tejidos incrustados, la tercera dimensión se vuelve fácilmente accesible. La microscopía electrónica de barrido facial de bloques serie (SBF-SEM) utiliza un ultramicrotome incluido en la cámara SEM. Tiene la capacidad de manejar muestras grandes (1.000 m x 1.000 m) e imágenes de grandes campos de visión en tamaño de píxel X,Y pequeño, pero está limitada en la dimensión Z por el cuchillo de diamante. El haz de iones focalizado SEM (FIB-SEM) no está limitado en resolución 3D, (los vóxeles isotrópicos de 5 nm son alcanzables), pero el campo de visión es mucho más limitado. Este protocolo muestra un flujo de trabajo para combinar las dos técnicas para permitir la búsqueda de regiones individuales de interés (ROI) en un campo grande y, a continuación, la toma de imágenes del volumen objetivo posterior a una alta resolución de vóxeles isotrópicos. La preparación de células o tejidos fijos es más exigente para las técnicas de volumen EM debido al contraste adicional necesario para la generación eficiente de señales en imágenes SEM. Estos protocolos consumen mucho tiempo y requieren mucha mano de obra. Este protocolo también incorpora el procesamiento de tejido asistido por microondas facilitando la penetración de reactivos, lo que reduce el tiempo necesario para el protocolo de procesamiento de días a horas.
Introducción
Este protocolo describe un flujo de trabajo para la segmentación eficiente de microscopía electrónica tridimensional (EM) de alta resolución a una región específica de interés (ROI). Desde sus inicios en la década de 1930, EM ha sido una técnica esencialmente bidimensional. Las primeras imágenes publicadas fueron de tejidos enteros o células, pero que pronto dieron paso a secciones que fueron cortadas a mano usando un ultramicrotome e imágenes utilizando un microscopio electrónico de transmisión (TEM). TEM produce micrografías de muy alta resolución donde incluso las estructuras celulares más pequeñas son claramente discernibles. Sin embargo, la delgadez de la sección necesaria para que el tejido sea imagendo por el haz de electrones hizo que la información en la dimensión Z fuera mínima. Dado que las celdas son estructuras tridimensionales, las interacciones entre las estructuras de celda y las superficies de celda tuvieron que deducirse de datos limitados. Esto planteó el potencial de mala interpretación, especialmente en estructuras complejas. Algunos microscopistas lograron obtener estructuras 3D más precisas mediante la sección en serie de células y tejidos y luego reconstruirlos minuciosamente a partir de imágenes TEM individuales1. Este fue un proceso muy laborioso y antes de la llegada de la imagen digital y la representación por computadora los resultados también eran difíciles de visualizar. En los últimos años se han introducido dos técnicas que se han conocido colectivamente como microscopía electrónica de volumen (volumen EM)2 que han hecho que EM en tres dimensiones sea accesible para más laboratorios.
La idea de obtener una pila de imágenes de un bloque incrustado dentro de un microscopio electrónico se remonta a 1981 cuando Steve Leighton y Alan Kuzirian construyeron un microtome en miniatura y lo colocaron en la cámara de un microscopio electrónico de barrido3 (SBF-SEM) . Este prototipo fue finalmente copiado y mejorado 23 años más tarde por Denk y Horstmann4 y posteriormente comercializado. Al mismo tiempo, los científicos biológicos se dieron cuenta de otra tecnología utilizada principalmente en la ciencia de los materiales, el haz de iones enfocado. Esta técnica utiliza un haz iónico de algún tipo (Galio, plasma) para eliminar una cantidad muy pequeña de material superficial de una muestra (FIB-SEM)5. Ambas técnicas emplean seccionamientoseguido seguido de imágenes proporcionando una serie de imágenes que se pueden combinar en una pila X, Y, Z. Ambas técnicas proporcionan información 3D pero a diferentes escalas de resolución. SBF-SEM está limitado por las propiedades físicas del cuchillo de diamante a rodajas no más delgadas que 50 nm para largos rayos en serie; sin embargo, el tamaño del bloque de muestra que se puede seccionar es grande, hasta 1 mm x 1 mm x 1 mm. Debido al gran formato de adquisición digital del detector de electrones dispersos posteriormente (32k x 32k píxeles) que recibe una señal de la cara del bloque , los tamaños de píxeles de imagen pueden ser tan pequeños como 1 nm. Esto da como resultado vóxeles no isotrópicos donde la dimensión X,Y es con frecuencia más pequeña que la Z. Debido a la precisión del haz iónico, FIB-SEM tiene la capacidad de recoger imágenes con vóxeles isotrópicos de 5 nm. Sin embargo, el área total que se puede imaginar es bastante pequeña. Una tabla resumida de varias muestras y volúmenes de la imagen con las dos técnicas se ha publicado previamente3.
La preparación de tejidos para el volumen EM es más difícil que para el TEM estándar o SEM porque las muestras deben ser manchadas para proporcionar una generación de señal adecuada en el SEM. Con frecuencia, las manchas deben optimizarse no sólo para el tipo de tejido en particular, sino también para agregar estructuras celulares para facilitar la identificación y la reconstrucción. El protocolo utilizado aquí se basaen la norma NCMIR 6. La tinción adicional generalmente significa pasos de protocolo adicionales. Por lo tanto, para el volumen EM, los protocolos estándar deben ampliarse para garantizar el tiempo suficiente para que los reactivos penetren en la muestra. El procesamiento asistido por microondas puede reducir el tiempo necesario para latinción de horas a minutos y hace que la preparación de la muestra EM de volumen sea más eficiente 7. Este método es aplicable a todos los tipos de células y tejidos8 y a las preguntas de investigación donde la inhomogeneidad del tejido hace que el muestreo de un área específica sea esencial9.
Una vez que se obtiene una pila de datos se puede alinear y las estructuras de interés segmentadas del resto de los datos y modelado en 3D. Aunque la automatización de la creación de imágenes de muchas rebanadas de tejido ha hecho que la adquisición de imágenes sea relativamente sencilla, el proceso de reconstrucción digital y visualización de los datos es una tarea que requiere mucho tiempo. El software para este fin aún no está integrado ni totalmente automatizado. Dado que gran parte de los primeros trabajos utilizando el volumen EM se dirigieron hacia la neurociencia, las técnicas para tinjar y segmentar digitalmente estructuras como los axones es bastante avanzada en comparación con otras células y orgánulos. Mientras que la literatura sobre otros tejidos no neuronales está creciendo rápidamente, las estructuras no lineales o irregulares requieren más entrada manual.
El uso de SBF-SEM y FIB-SEM es un enfoque útil para la orientación y la creación de imágenes específicas, estructuras de tejido no homogéneas a alta resolución en 3D. Combinando eso con el procesamiento de tejido asistido por microondas que reduce enormemente el tiempo necesario para la preparación de la muestra. Juntos, este flujo de trabajo hará que la generación de datasets de imágenes de vóxeles isotrópicos de alta resolución de estructuras finas sea un proceso eficiente y más rápido.
Protocolo
1. Fijación y procesamiento de muestras para microscopía electrónica
- Arreglar las plántulas de Arabidopsis thaliana cultivadas en placas de agar en 0.5% paraformaldehído, 2.5% glutaraldehído en tampón de fosfato de 0.1 M (PB) pH 6.8 para 2 h a temperatura ambiente (RT).
ADVERTENCIA: Los aldehídos son irritantes y corrosivos y tienen potencial cancerígeno, mutagénico y teratogénico. Todas las soluciones deben manejarse con el equipo de protección adecuado y con una campana de humo. - Corte las puntas de la raíz de la planta cultivada en el paso 1.1 y ponga 2-3 puntas en tubos de 0,5 ml que contengan el mismo fijador durante la noche a 4oC.
NOTA: El volumen de esta y cualquier solución en los pasos restantes viene determinado por el volumen de la muestra; una proporción mínima de muestra a solución es 10:1. Las muestras de más de 1 mm en cualquier dimensión serán difíciles de manchar, por lo que trabajar con bloques de tejido más grandes es más difícil. No todos los tejidos tienen las mismas características; por ejemplo, las hojas y tallos de las plantas pueden ser difíciles de manchar. Si se desean muestras más grandes o tipos de tejidos difíciles, se debe optimizar el procesamiento de muestras antes de pasar a la recopilación de datos. - Preparar la solución de tiocarbohidrazida (TCH), necesaria fresca y disponible antes del paso 1.7. Añadir 0,1 g de tiocarbohidrazida a 10 ml de agua destilada doble (ddH2O) y disolver calentando a 60oC en el horno durante 1 h. Antes de su uso, filtre la solución de TCH utilizando un filtro de jeringa de 0,22 m.
- Retire el fijador de los tubos y sustitúyalo por 0,1 M PB pH 6,8. Coloque los tubos en una mesa de agitación orbital a 100 rpm y lave durante 10 minutos. Repita el lavado con PBS fresco 5 veces.
- Post fijar las puntas de la raíz mediante la sustitución de PB con 2% de tetróxido de osmio (OsO4) y 0.2% rojo rutenio en 0.1 M PB pH 6.8. Coloque los tubos en el microondas con las tapas abiertas y comience el programa 9 (Tabla 1).
ADVERTENCIA: El osmio es extremadamente peligroso en caso de ingestión, muy peligroso en caso de inhalación, y peligroso en caso de contacto con la piel. Siempre manipule con el equipo de protección adecuado y en una campana de humo.
NOTA: A lo largo del protocolo, las tapas de los tubos siempre están abiertas durante los escalones del microondas. - Lave las puntas de las raíces dos veces con ddH2O durante 5 minutos cada una en la mesa. Para el tercer y cuarto ddH2O programa de lavado 15 en el microondas (Tabla 1). Después del primer lavado de 40 segundos ddH2O, saque las muestras del microondas y reemplace el tampón con ddH2O. Vuelva a colocar las muestras en el microondas y continúe con el programa.
NOTA: El microondas sonará una alarma cuando sea necesario actualizar el búfer. Asegúrese de que la tapa de la cámara de vacío se reemplaza correctamente cada vez. - Incubar muestras en solución TCH previamente preparada en RT durante 2 minutos en el banco y para su posterior incubación utilice el programa de microondas 8 (Tabla 1). No cambie la solución entre el banco y el microondas.
- Lave las muestras como se describe en el paso 1.6.
- Coloque las muestras en 1% OsO4 en ddH2O para el programa de microondas 9 (Tabla 1).
- Lave las muestras como se describe en el paso 1.6.
- Incubar muestras en 1% de acetato de ursionlo en ddH2O utilizando el programa de microondas 16 (Tabla 1).
ADVERTENCIA: El acetato de ursionl es tóxico, irritante y tiene potencial cancerígeno, mutagénico y teratogénico. Siempre manipule con el equipo de protección adecuado. - Lave las muestras como se describe en el paso 1.6.
- Prepare la solución de plomo de Walton para su uso en el paso 1.14. En primer lugar, haga una solución en stock de ácido L-aspártico añadiendo 0,998 g de ácido L-aspártico a 250 ml de ddH2O y ajustando el pH a 3,8 con 1 M KOH. A continuación, disolver 0,066 g de nitrato de plomo en 10 ml de solución de material de ácido L-aspártico y ajustar el pH a 5,5. Dejar la solución en el horno a 60oC durante 30 min.
NOTA: No se deben formar precipitados. - Incubar muestras en la solución de plomo de Walton durante 30 minutos en el horno a 60 oC.
- Lave las muestras como se describe en el paso 1.6.
- Deshidratar muestras en EtOH en pasos calificados de 50%, 70%, 90% en ddH2O, y luego 2x en 100% EtOH. Utilice el programa de microondas 10 (Tabla 1) y el microondas pedirá a los usuarios cada 40 s que reemplacen la solución con el siguiente paso EtOH. Este es el último paso que se realiza en el microondas.
- Deshidratar aún más en óxido de propileno 100% 2x durante 10 minutos cada uno en RT en el banco, reemplazando la solución entre pasos.
NOTA: El óxido de propileno puede disolver algunos plásticos como los poliestirenos; utilizar viales de vidrio para este paso o plásticos pre-prueba para la resistencia.
ADVERTENCIA: El óxido de propileno es altamente inflamable. Siempre manipule con el equipo de protección adecuado y en una campana de humo. - Comience la infiltración de puntas de raíz incubando en resina de 50% Spurr en óxido de propileno (min 2 h).
ADVERTENCIA: Los componentes de resina de Spurr son irritantes. Siempre manipule con el equipo de protección adecuado y en una campana de humo. - Reemplace la solución por 100% Spurr's y deje pasar la noche en RT.
- Cambio a resina fresca 100% Spurr 2 veces (incubaciones mínimas de 2 h).
- Colocar las muestras en un molde de incrustación, conteniendo de nuevo resina fresca 100% Spurr y polimerizar en un horno a 65oC durante 36 x 48 h.
NOTA: El molde de incrustación utilizado depende del tipo de tejido y del enfoque utilizado para la toma de imágenes. Aquí, se utilizó un molde de incrustación de silicona plana (Figura1A).
2. Preparar muestras incrustadas para la toma de imágenes
- Retire las muestras del horno, retire la resina del molde de incrustación (Figura1B).
- Usando una cuchilla de afeitar, recorta aproximadamente la muestra a un bloque de un máximo de 0,5 mm x 0,5 mm x 0,5 mm (Figura1C).
NOTA: Para evitar la carga en SBF-SEM, es importante recortar la mayor cantidad de resina desnuda posible y hacer que la muestra sea lo más plana/delgada posible. Idealmente todos los lados del bloque contienen tejido ya, pero lo más importante es que el lado que se unirá al pasador de metal (ver paso 2.3) tiene que contener tejido expuesto para que el tejido esté en contacto directo con el metal conductor. - Retire la muestra de la resina extraña y adjúntela a un pasador metálico (Figura1D)con resina epoxi conductora, asegurándose de que parte del tejido esté tocando el pasador de metal. Dejar que el epoxi se cure durante la noche en el horno a 65oC.
NOTA: Asegúrese de que la muestra esté colocada en el centro del pasador, ya que el movimiento del escenario en el SB-SEM es limitado. La eliminación de la muestra muy pequeña reequipada a resina de resina extra puede ser difícil, ya que la pequeña muestra tendrá una tendencia a volar lejos cuando se desprende. Una solución simple y eficaz a esto es cubrir la muestra con una hoja de película de parafina como se muestra en la película complementaria de referencia1. - Fije el soporte en el soporte para el ultramicrotome. Usa una cuchilla de afeitar para eliminar cualquier exceso de epoxi y usa el ultramicrotome y un cuchillo de diamante para alisar la cara y los lados del bloque, formando una pirámide. Asegúrese de que al menos parte del tejido ya esté expuesto en la cara de bloque.
NOTA: El paso adicional de usar un cuchillo de diamante es opcional, pero hace que el bloque resultante sea más fácil de acercar en el SBF-SEM porque la sombra del cuchillo en la cara del bloque es más clara, lo que hace que la estimación de la distancia entre el cuchillo y la cara del bloque sea más fácil de determinar. - Coloque el bloque de muestra recortado en el recubrimiento de esputo y cubra la muestra con una capa delgada (2 x 5 nm) de platino (Pt).
NOTA: El platino en la cara de bloque se cortará durante el enfoque en el SBF-SEM (ver más abajo), pero el platino en los lados de la pirámide proporcionará conductividad adicional. En este ejemplo, la muestra fue recubierta de platino, pero el oro, o oro / paladio también es eficaz; sin embargo, el recubrimiento con oro dio lugar a un aumento de los desechos en la cara de bloque durante una ejecución de imágenes.
3. Imágenes en el SBF-SEM
- Inserte el soporte en el microscopio SBF-SEM y acerque el cuchillo a la superficie de la muestra. Usando el cuchillo de diamante recortar la parte superior de la muestra para que la capa Pt ya ha sido removida y al menos parte del tejido está expuesta.
NOTA: Dado que este proceso es diferente para cada microscopio SBF-SEM, no se especifica cada paso aquí. Siempre y cuando la superficie de la muestra esté libre de Pt y esté lista para la toma de imágenes, los siguientes pasos serán posibles. - Comience la creación de imágenes a baja resolución y tiempos de permanencia cortos para obtener una visión general de la muestra y localizar una región de interés (Figura1E).
NOTA: Aquí, se utilizaron 512 x 512 píxeles y 1 tiempo de permanencia para el escaneo y posicionamiento rápidos del escenario y se utilizaron 2.000 x 2.000 píxeles con un tiempo de permanencia de 1 s para optimizar la ventana de imágenes y ajustar el enfoque. - Usando una tensión de aceleración de 1.5-2.0 kV a una corriente de 80-100 pA, capture una imagen del tejido.
NOTA: El ejemplo que se muestra aquí se realizó una imagen en un sistema de alto vacío donde la corriente del haz debe ajustarse para minimizar la carga, que es muy dependiente de la muestra. Típicamente, el haz de electrones se establece en 1.5-2.0 kV, pero esto será dependiente de la muestra. En aumentos más altos (generalmente > 10.000x) la resina se ve demasiado afectada por el haz para garantizar un ensección suave, por lo que normalmente el tamaño de píxel se establece en 8 x 20 nm en un tamaño de imagen de 8.000 a 10.000 x 8.000 a 10.000 píxeles con un aumento correspondiente de 430 – 1.400x y tamaños de campo de 64 X 64 mm y 200 x 200 mm respectivamente. - Determine una región de interés y decida cuántas secciones se necesitan para cubrir el volumen de interés e iniciar la ejecución de imágenes, utilizando el detector de electrones dispersos posteriores.
NOTA: En el ejemplo presentado aquí, 500 secciones de 80 nm se crearon imágenes a 10 nm píxeles y 10.000 x 10.000 píxeles de imágenes (tiempo de permanencia 1 s). El microscopio se estableció en 1,6 kV y 100 pA. En general, el número de secciones depende de la muestra y el tamaño del ROI y puede variar de 100 s a 1.000 s de secciones consecutivas. El conjunto de datos resultante consta de imágenes únicas de cada sección. Estas imágenes deben convertirse en una pila 3D.
4. Procesamiento de datos SBF-SEM
- Con Fiji, seleccione la secuencia de imágenes de importación de archivos y localice la pila de imágenes para cargar las imágenes. En función del tamaño del conjunto de datos, active la casilla "Usar pila virtual".
NOTA: Si el conjunto de datos es realmente grande, primero conviértalo en 8 bits (si se recopila a 16 bits) y, si es necesario, bin los datos hasta que tenga un tamaño viable. - Con el botón de reproducción situado en la parte inferior de la imagen, desplácese por el conjunto de datos para ver si la ejecución de imágenes se realizó correctamente. Compruebe si hay artefactos de imagen típicos para SBF-SEM, como secciones que caen del cuchillo en la cara de bloque, carga en áreas de resina desnuda, corte de artefactos de la cuchilla (líneas horizontales en la imagen).
- Con el comando image-properties ajusta el tamaño de píxel y la profundidad de voxel (es decir, el grosor de sección) utilizado durante la ejecución. Si los datos ya están enanos, tenga esto en cuenta.
- Usando el comando plugins-registration-linear stack alignment con SIFT para registrar los datos.
NOTA: Se necesita el registro de los datos SBF-SEM porque puede haber un ligero movimiento de la muestra durante la toma de imágenes debido a la carga o la deriva de la muestra. Como esto es sólo un movimiento mínimo en XY, sólo se necesita traducción. - Compruebe la alineación desplazándose por el dataset y, si Aceptar, utilice el comando guardar en el menú de archivos para guardar el dataset alineado como un archivo 3D-tif.
- Analice el conjunto de datos cuidadosamente para ver si se incluye el ROI y contiene la información necesaria para la pregunta biológica. En la última imagen de la pila (en la cara de bloque actual), seleccione un nuevo ROI para la creación de imágenes FIB-SEM.
NOTA: Si no hay una buena región para la creación de imágenes FIB-SEM presentes en la cara de bloque actual, se pueden cortar más secciones desde el bloque (que todavía está en el SBF-SEM) hasta que aparezca un ROI. Hay un límite en el volumen que se puede crear una imagen con la FIB. El ROI en la imagen SBF-SEM puede ser máximo en X,Y de 30-40 ám x 15-20 m.
5. Imágenes en la FIB-SEM
- Tome imágenes generales de la muestra en el SBF-SEM, idealmente incluyendo uno o más bordes de la muestra que luego son reconocibles en la FIB-SEM (Figura2A,C).
NOTA: En este ejemplo, las imágenes de resumen SBF-SEM se tomaron con un tamaño de píxel de 10 nm, 8.000 x 8.000 píxeles a 1 hora de permanencia. El microscopio todavía estaba fijado en 1,6 kV y 100 pA. - Retire la muestra del SBF-SEM y colóquela en el revestimiento de esputo. Cubra la muestra con platino de 20 nm para imágenes FIB-SEM.
- Cargue la muestra en FIB-SEM y utilice un detector de electrones secundario a 15 kV, 1nA localice el ROI identificado en el SBF-SEM en la cara de bloque (Figura 2B,D).
NOTA: Es necesario realizar imágenes a 15 kV para ver a través del recubrimiento de platino. - Lleve el ROI de la muestra al punto de coincidencia de las vigas FIB y SEM, moviendo e inclinando la etapa (Figura3A).
NOTA: La columna FIB se suele montar bajo un ángulo (Figura3A). Esto significa que cualquier muestra debe inclinarse de tal manera que la superficie que se va a crear una imagen y seccionarse se coloque paralela a la viga FIB. La superficie a crear una imagen ahora está inclinada con respecto al haz SEM y es necesario eliminar una zanja de tejido antes de que el SEM pueda crear imágenes del ROI (Figura3E) - Utilizando el sistema de inyección de gas y haz FIB, deposite una capa protectora de platino de 1 mm en la superficie por encima del ROI (Figura3C). A continuación, utilizando una corriente de fresado baja (50-100 pA), fresar líneas finas en la deposición de platino para el enfoque automático y el seguimiento 3D durante la ejecución de imágenes (Figura3D). Usando la columna FIB y el inyector de gas de carbono, cubra estas líneas con deposición de carbono.
NOTA: El tamaño del ROI aquí corresponde al tamaño del ROI en la imagen SBF-SEM y el tamaño máximo puede ser de 30-40 ám x 15-20 m. En este ejemplo se ha generado un ROI de 17 m x 8 m. La deposición de carbono es necesaria para la protección de las líneas y para crear un contraste blanco-negro entre el carbono y el platino que es ideal para el enfoque automático. Las corrientes de fresado utilizadas para cada paso se pueden encontrar en la Tabla2. - Usando una corriente de fresado alta, fresar una zanja de 30 m delante del ROI, creando la superficie de imagen para el haz SEM (Figura3E).
NOTA: El haz FIB es inherentemente destructivo, aún más a altas corrientes. Asegúrese de mantener las imágenes a altas corrientes al mínimo y la imagen a baja ampliación y velocidades de escaneo rápidas para evitar que se derrita la resina en el ROI. - Suave la superficie de la imagen con una corriente de fresado más cercana a la corriente utilizada durante el funcionamiento de la toma de imágenes. Detenga el pulido cuando todas las marcas de seguimiento 3D y de enfoque automático estén claramente visibles en la superficie de imagen (Figura3F). El progreso de la FIB puede ser seguido por la toma de imágenes de la superficie con el EM (usando un detector de electrones dispersos hacia atrás) durante el pulido.
- Determine el área que se va a crear en la superficie recién creada y establezca los parámetros de imagen. Asegúrese de que el haz de electrones esté enfocado en la superficie, ajuste el brillo y el contraste y establezca el tamaño del píxel y el grosor de la sección. Mantenga el tiempo de imagen por debajo de 1 minuto ajustando el tiempo de permanencia y el promedio de la línea.
NOTA: Es importante utilizar un bajo voltaje para la toma de imágenes con el haz de electrones para asegurarse de que sólo se toma una imagen de la superficie del bloque (es decir, que no se muestrea electrones de más profundo en la muestra). Esto se hace manteniendo el voltaje por debajo de 2 kV y usando un detector de electrones dispersos posteriormente con una tensión de red, permitiendo que solo se fotografíen electrones de alta energía. En este ejemplo, el haz de electrones se estableció en 1,5 kV y 1 nA con una tensión de red de 1,2 kV en el detector de electrones dispersos posterior. También aquí, un tamaño de píxel de 5 nm se utilizó con secciones de 5 nm para dar lugar a un conjunto de datos con vóxeles isotrópicos. Se indujo un área de 17 m x 10 m a 6,5 os de tiempo de permanencia y un promedio de línea de 1,0. - Establezca las ventanas para el ajuste automático y el seguimiento 3D, utilizando el mismo tamaño de píxel, tiempo de permanencia y promedio de línea que se utiliza para la imagen.
NOTA: Este proceso será diferente para diferentes sistemas, por lo tanto, sólo se menciona el paso sin especificar las diferentes acciones. - Inicie la ejecución de imágenes y supervise la estabilidad del proceso durante las primeras 50 a 100 secciones. Una vez que el sistema funciona sin problemas, salga de la habitación y asegúrese de que hay la menor perturbación posible en la habitación.
NOTA: La duración de la ejecución y el número de secciones dependerán del tamaño del ROI y del grosor de la sección. En FIB-SEM el eje Z es en realidad la altura de la caja de ROI en la imagen SBF-SEM (máx. 15-20 m; Figura 3E). - Registre los datos FIB-SEM de la misma manera que se describió anteriormente para los datos SBF-SEM.
Resultados
Las imágenes del SBF-SEM proporcionan una visión general del tejido, dando una visión de la orientación espacial de las células y las conexiones intercelulares (Figura4A). La imagen posterior de la FIB-SEM en una nueva región, que suele ser una región de interés determinada después de la inspección de la ejecución SBF-SEM, agrega detalles de alta resolución de células y/o estructuras específicas (Figura4B).
Figura 4C ,D muestra la diferencia en la representación de los vóxeles no isotrópicos de los datos SBF-SEM (Figura4C)y los datos FIB-SEM de voxel isotrópico (Figura4D). El espesor z utilizado en SBF-SEM significa que el renderizado muestra claramente las secciones, lo que resulta en un efecto de "escalera" en la superficie. En los datos FIB-SEM, las secciones de 5 nm aseguran que el renderizado parezca mucho más suave y las secciones individuales se mezclan completamente en la superficie.
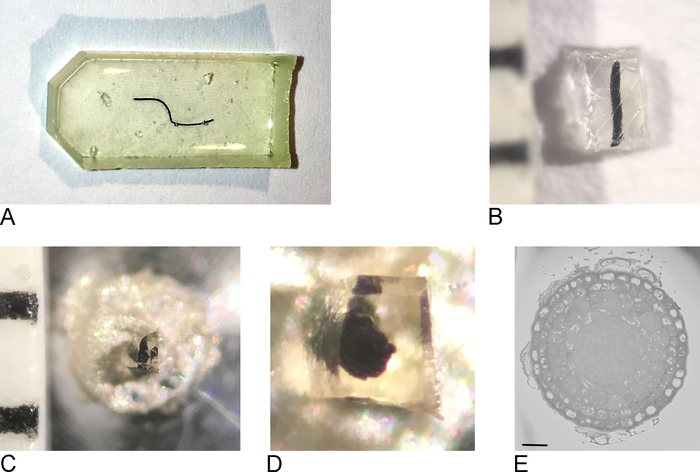
Figura 1: Creación de la cara del bloque a partir de una muestra incrustada de resina. (A) Una punta de raíz incrustada en resina. (B) Con una cuchilla de afeitar el exceso de resina se recorta hasta que quede un bloque de 0,5 mm2. (C,D) El bloque recortado se pega en un pasador de metal y después de una noche en el horno, los lados del bloque se recortan y la superficie se alisa con un cuchillo de diamante utilizando un ultramicrotoma. (E) Dentro del SBF-SEM, la muestra está orientada de modo que la cara de bloque y el ROI se puedan reconocer, la barra de escala de 20 m. Por favor, haga clic aquí para ver una versión más grande de esta figura.
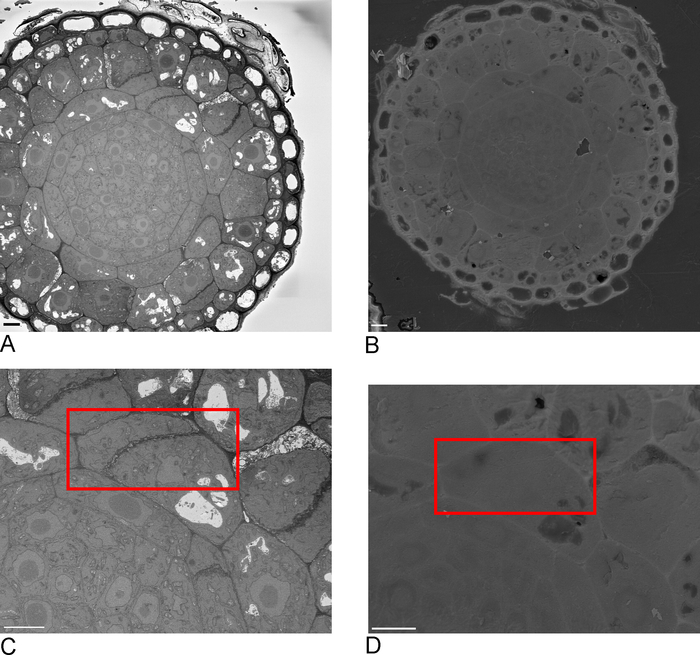
Figura 2: Correlación entre SBF-SEM y FIB-SEM. Visión general de las imágenes de la cara de bloque utilizando el SBF-SEM (A) y el FIB-SEM (B), la barra de escala a 5 m. (C,D) Zoom en el ROI. El cuadro rojo delinea la región que se va a crear una imagen con FIB-SEM, barra de escala a 5 m. Por favor, haga clic aquí para ver una versión más grande de esta figura.
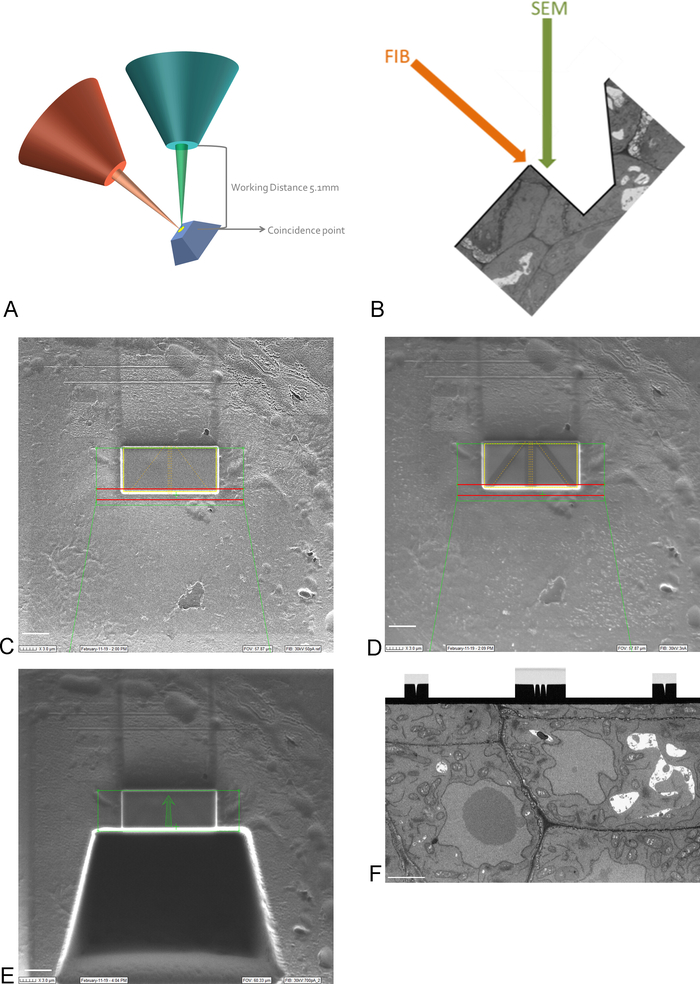
Figura 3: Esquema FIB-SEM y pasos de preparación. (A) Esquema que muestra la orientación de la viga FIB, la viga SEM y la muestra. La muestra debe colocarse en el punto de coincidencia de las vigas FIB y SEM para poder fresar e imaginar en la misma región. (B) Dibujo esquemático de la zanja necesaria para la toma de imágenes SEM de las secciones eliminadas por la FIB. (C) Imagen tomada con el haz FIB que muestra la deposición de platino en el ROI, barra de escala 5 m. (D) Imagen tomada con el haz FIB que muestra las líneas utilizadas para el enfoque automático y el seguimiento 3D. Las líneas en el medio se utilizan para el enfoque automático y las líneas exteriores proporcionan seguimiento 3D. La deposición de carbono en la parte superior de las líneas proporciona el contraste necesario (platino vs carbono) para realizar estas tareas, barra de escala 5 m. (E) Imagen tomada con el haz FIB después del fresado de la zanja, barra de escamas 5 m. (F) Imagen tomada con el haz SEM que muestra el haz SEM que muestra el haz SEM que muestra el haz SEM que muestra el haz SEM que muestra el haz SEM que muestra el haz SEM que muestra el haz SEM que muestra el haz SEM que muestra el haz SEM que muestra el haz SEM que muestra el haz SEM que muestra el haz SEM que muestra el haz SEM que muestra el haz SEM que muestra el haz SEM que muestra el haz SEM que muestra el haz SEM que muestra el haz SEM que muestra el haz SEM que muestra el haz SEM que región de interés de la imagen durante la ejecución de FIB-SEM, barra de escala 2 m. Haga clic aquí para ver una versión más grande de esta figura.
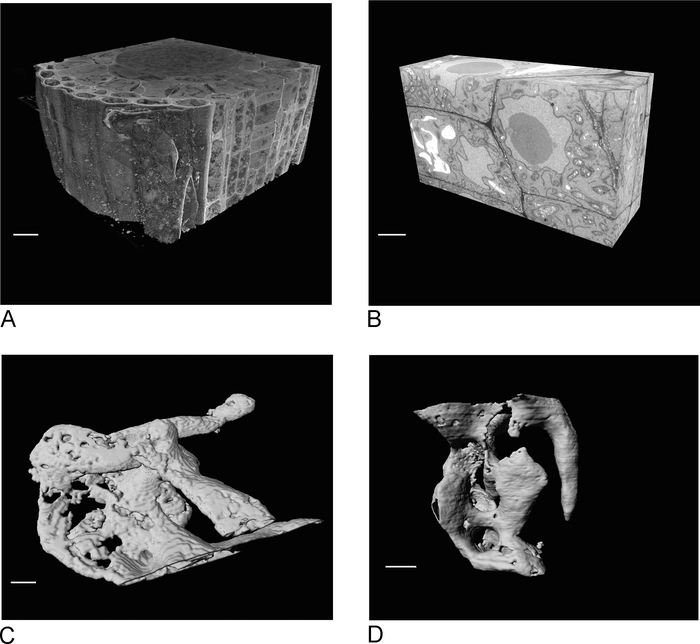
Figura 4: Resultados SBF-SEM y FIB-SEM antes y después de la segmentación. (A) Vista 3D del dataset SBF-SEM (100 x 100 x 40 ám, barra de escala a 10 m), (B ) vista 3D del dataset FIB-SEM (17 x 10 x 5,4 ám, barra de escala a 2 ám), (C) Vacuolas renderizadas segmentadas a partir de datos SBF-SEM por umbral, barra de escala a 2 m D. de los datos de FIB-SEM mediante el umbral, la barra de escala s 2 m. Haga clic aquí para ver una versión más grande de esta figura.
| Protocolo para el procesamiento de microondas | |||||||||
| Programa # | Descripción | Solicitud de usuario (encendido/apagado) | Hora (hr:min:seg) | Potencia (vatios) | Temperatura (C) | Enfriador de carga (apagado/automático/encendido) | Bomba de vacío/burbuja (off/bubb/vac cycle/vac on/vap) | Temp estable | |
| Bomba (encendido/apagado) | Temperatura (C) | ||||||||
| 8 | Tch | OFF | 0:01:00 | 150 | 50 | OFF | CICLO DE VACÍO | En | 30 |
| OFF | 0:01:00 | 0 | 50 | OFF | CICLO DE VACÍO | En | 30 | ||
| OFF | 0:01:00 | 150 | 50 | OFF | CICLO DE VACÍO | En | 30 | ||
| 9 | Osmio | OFF | 0:02:00 | 100 | 50 | OFF | CICLO DE VACÍO | En | 30 |
| OFF | 0:02:00 | 0 | 50 | OFF | CICLO DE VACÍO | En | 30 | ||
| OFF | 0:02:00 | 100 | 50 | OFF | CICLO DE VACÍO | En | 30 | ||
| OFF | 0:02:00 | 0 | 50 | OFF | CICLO DE VACÍO | En | 30 | ||
| OFF | 0:02:00 | 100 | 50 | OFF | CICLO DE VACÍO | En | 30 | ||
| 10 | 50% EtOH | En | 0:00:40 | 150 | 50 | OFF | OFF | En | 30 |
| 70% EtOH | En | 0:00:40 | 150 | 50 | OFF | OFF | En | 30 | |
| 90% EtOH | En | 0:00:40 | 150 | 50 | OFF | OFF | En | 30 | |
| 100% EtOH | En | 0:00:40 | 150 | 50 | OFF | OFF | En | 30 | |
| 100% EtOH | En | 0:00:40 | 150 | 50 | OFF | OFF | En | 30 | |
| 15 | 0.1M CACODYLATE | En | 0:00:40 | 250 | 50 | OFF | CICLO DE VACÍO | En | 30 |
| 0.1M CACODYLATE | En | 0:00:40 | 250 | 50 | OFF | CICLO DE VACÍO | En | 30 | |
| 15 | ddH2O | En | 0:00:40 | 250 | 50 | OFF | CICLO DE VACÍO | En | 30 |
| ddH2O | En | 0:00:40 | 250 | 50 | OFF | CICLO DE VACÍO | En | 30 | |
| 16 | Acetato de uranyl | OFF | 0:01:00 | 150 | 50 | OFF | CICLO DE VACÍO | En | 30 |
| OFF | 0:01:00 | 0 | 50 | OFF | CICLO DE VACÍO | En | 30 | ||
| OFF | 0:01:00 | 150 | 50 | OFF | CICLO DE VACÍO | En | 30 | ||
| OFF | 0:01:00 | 0 | 50 | OFF | CICLO DE VACÍO | En | 30 | ||
| OFF | 0:01:00 | 150 | 50 | OFF | CICLO DE VACÍO | En | 30 | ||
| OFF | 0:01:00 | 0 | 50 | OFF | CICLO DE VACÍO | En | 30 | ||
| OFF | 0:01:00 | 150 | 50 | OFF | CICLO DE VACÍO | En | 30 | ||
Tabla 1. Protocolo detallado para el procesamiento de microondas.
| Paso | Actual | Tiempo estimado |
| Deposición Platino | 3n A | 10-15 minutos |
| Milling Autotune y Marcas de seguimiento | 50-100 pA | 4-6 minutos |
| Carbono de deposición | 3 nA | 5-10 minutos |
| Fresado de zanja gruesa | 15-30 nA | 30-50 minutos |
| Superficie de pulido | 1.5-3 nA | 15-20 minutos |
| Imaging Run | 700 pA-1.5 nA | Horas-días |
Cuadro 2. Corrientes de fresado FIB utilizadas para la preparación de muestras y la ejecución de imágenes
Discusión
La microscopía electrónica de volumen es más difícil y requiere mucho tiempo que la SEM o TEM convencional. Debido a la necesidad de manchar tejidos o células en bloque, los pasos de procesamiento deben ser lo suficientemente largos como para asegurar la penetración de los reactivos en toda la muestra. El uso de energía de microondas para facilitar la penetración hace que el procesamiento sea más corto y eficiente y mejora la tinción. Debido a que la preparación para EM es mucho más estricta que para la microscopía ligera, todas las soluciones y reactivos deben controlarse estrictamente con la calidad. Los cambios en el pH, la tonicidad, el uso de reactivos impuros y la introducción de contaminantes debido a una técnica deficiente pueden tener efectos nocivos en la imagen final.
El volumen EM también requiere protocolos personalizados para cada tipo de muestra diferente. Tejidos mamíferos de diferentes tipos: plantas, células individuales como levadura, tripanosomas, C. elegans,etc., todos necesitan sus propias variaciones para lograr resultados óptimos. La fijación y la tinción deben diseñarse de manera que se preserve la integridad estructural y se mantenga la muestra lo más cerca posible de su morfología in vivo. La fijación de los tejidos a temperatura fisiológica, pH y tonicidad es fundamental para hacer que la muestra sea tan realista como puede ser. La congelación a alta presión (HPF) de las muestras puede ayudar a preservar una situación más realista, (o tal vez simplemente producir artefactos diferentes), pero para otras células y tejidos muy delgados HPF fallará ya que el hielo vítreo sólo se puede generar en volúmenes pequeños. Por lo tanto, para muchas preguntas la fijación química es la única opción. No importa si la fijación es HPF o química, en cualquier experimento EM los resultados estructurales deben compararse cuidadosamente con resultados similares de imágenes de células vivas o tejidos para ver si son consistentes. La tinción también debe optimizarse teniendo en cuenta la pregunta específica que debe responderse y el protocolo que se utilizará para la visualización de las imágenes digitales.
Tener un sistema SBF-SEM y FIB muy cerca es una gran ventaja en muchos experimentos. El gran campo de visión y la alta resolución X,Y de SBF-SEM hacen que encontrar estructuras individuales/células/eventos sea sencillo y proporciona una orientación espacial general de las células en los tejidos. Además, su capacidad para permitir la creación de imágenes a través de una muestra en Z es muy potente; sin embargo, las reconstrucciones que requieren detalles geométricos finos pueden fallar o producir artefactos utilizando esta técnica debido a los vóxeles no isotrópicos que genera. La FIB está limitada por la física del proceso a un campo de imagen más pequeño, pero su resolución 3D es suficiente para reconstrucciones muy precisas. La combinación de las dos técnicas es sencilla, ya que las muestras pueden pasar de SBF-SEM a FIB sin más procesamiento o preparación. Reconocemos que el uso del SBF-SEM para buscar a través de una muestra para encontrar un área en particular es un uso muy costoso de una herramienta mucho más capaz. Sin embargo, la capacidad de ver inmediatamente la nueva cara de bloque y determinar si se ha alcanzado el ROI es una gran ventaja. Además, las alternativas de utilizar secciones de LM semidelgadas en serie (0,5 m) pueden eliminar estructuras pequeñas antes de que se detecten, e inspeccionar un bloque utilizando secciones TEM únicas que tienen que ser cortadas, puestas en una rejilla y luego vistas en un TEM igualmente caro no es tan eficiente como se presenta el método.
Debido a que existen muchos programas para segmentar y representar los datos, y es posible que una sola aplicación no pueda satisfacer mejor las necesidades de una estructura determinada, no se puede proponer ningún flujo de trabajo estándar. Algunas estructuras simples pueden segmentarse con un algoritmo de umbral si se encuentran dentro de valores de escala de grises muy estrechos. Las estructuras neuronales se pueden segmentar semiautomáticamente utilizando un programa como Ilastik11, pero será menos útil en orgánulos de forma más aleatoria o compleja como Urgencias. Microscopy Image Browser es un programa muy flexible que puede alinear, segmentar y renderizar datos EM de volumen, pero requiere una interacción significativa del usuario12. Como regla general, la cantidad de tiempo necesario para visualizar digitalmente los resultados excederá en gran medida el tiempo para preparar la muestra y la toma de imágenes.
Las técnicas de volumen EM han abierto la tercera dimensión al análisis ultraestructural. Otros métodos para obtener EM 3D tienen limitaciones en su volumen (tomografía TEM), o su eficiencia (sección serial TEM). Aunque en su mayor parte las técnicas de EM de volumen son demasiado complejas y costosas para ser implementadas en laboratorios individuales, el número de instalaciones básicas compartidas que las ofrecen ha ido creciendo y el número de tipos de muestras que se han utilizado con éxito ha aumentado rápidamente. Para aquellos con una pregunta específica y un tejido en particular es probable que alguien sea capaz de ofrecer consejos e instrucciones sobre su preparación e imágenes. Se puede mejorar el equipo EM de volumen para incluir la capacidad de manejar muestras más grandes en el SBF-SEM y la capacidad de fresar ROI más grandes con la FIB. El software que sea capaz de segmentar estructuras de interés de una manera más automatizada simplificará enormemente el proceso de análisis de los datos y las mejoras en la velocidad de computación reducirán el tiempo necesario para hacerlo. A pesar de sus limitaciones actuales, el volumen EM sigue siendo una herramienta útil y la combinación de SBF-SEM y FIB-SEM proporciona un flujo de trabajo eficiente para identificar eventos raros y crear imágenes a alta resolución.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
El equipo para el volumen EM fue proporcionado por una generosa subvención del Gobierno de Flandes.
Materiales
| Name | Company | Catalog Number | Comments |
| 3View 2XP | Gatan | NA | In chamber ultramicrotome for SBFI |
| Cacodylate buffer 0.2M solution | EM Sciences | 11652 | |
| Conductive epoxy resin (circuit works) | RS components | 496-265 | |
| Diatome Histo 4.0mm diamond knife | EM Sciences | 40-HIS | |
| Digitizing tablet | Wacom | DTV-1200W | No longer available |
| Eppendorf tubes | Eppendorf | 0030 120.094 | |
| Flat Embedding Mold | EM Sciences | 70900 | |
| Gluteraldehyde 25% solution | EM Sciences | 16220 | |
| High MW Weight Tannic Acid | EM Sciences | 21700 | |
| Lead Citrate | Sigma-Aldrich | 22861 | |
| NaCl | Sigma-Aldrich | 746398 | |
| Osmium Tetroxide 4% solution | EM Sciences | 19170 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Pelco Biowave Pro + | Ted Pella | 36700 | |
| Potassium Ferrocyanide | Sigma-Aldrich | P3289 | |
| Quorum Q150T ES sputter coater | Quorum Technologies | 27645 | |
| Reichert-Jung Ultracut ultramicrotome | NA | NA | No longer available |
| Sodium Cacodylate 0.2M | EM Sciences | 11653 | |
| Spurrs Resin kit | EM Sciences | 14300 | |
| Uranyl Acetate | EM Sciences | 22400 |
Referencias
- Linberg, K. A., Fisher, S. K. An ultrastructural study of interplexiform cell synapses in the human retina. Journal of Comparative Neurology. 243, 561-576 (1986).
- Peddie, C. J., Collinson, L. M. Exploring the third dimension: volume electron microscopy comes of age. Micron. 61, 9-19 (2014).
- Leighton, S. SEM images of block faces, cut by a miniature microtome within the SEM – A technical note. Scanning Electron Microscopy. (pt 2), 71-76 (1981).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three dimensional tissue nanostructure. PLoS Biology. 11, 329 (2004).
- Heymann, J. A., Hayles, M., Gestmann, I., Giannuzzi, L. A., Lich, B., Subramaniam, S. Site specific 3D imaging of cells and tissues with a dual beam microscope. Journal of Structural Biology. 155 (1), 63-73 (2006).
- . NCMIR Methods for 3D EM: A new protocol for preparation of biological specimens for serial block face scanning electron microscopy. V7_01_10 Available from: https://ncmir.ucsd.edu/sbem-protocol (2019)
- Giberson, R. T., Austin, R. L., Charlesworth, J., Adamson, G., Herrera, G. A. Microwave and digital imaging technology reduce turnaround times for diagnostic electron microscopy. Ultrastructural Pathology. 27 (3), 187-196 (2003).
- Kremer, A., et al. Developing 3D EM in a broad biological context. Journal of Microscopy. 259 (2), 80-96 (2015).
- Vanslembrouck, B., Kremer, A., Pavie, B., van Roy, F., Lippens, S., van Hengel, J. Three-dimensional reconstruction of the intercalated disc including the intercellular junctions by applying volume scanning electron microscopy. Journal of Histochemistry and Cell Biology. 149, 479-490 (2018).
- Russel, M. R., et al. 3D correlative light and electron microscopy of cultured cells using serial blockface scanning electron microscopy. Journal of Cell Science. 130 (1), 278-291 (2017).
- Sommer, C., Strähle, C., Köthe, U., Hamprecht, F. A. ilastik: Interactive Learning and Segmentation Toolkit. Eighth IEEE International Symposium on Biomedical Imaging (ISBI). Proceedings. , 230-233 (2011).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy Image Browser: A Platform for Segmentation and Analysis of Multidimensional Datasets. PLoS Biology. 14 (1), e1002340 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados