Method Article
CRISPR/Cas9 Edición génica precisa mediada por Ribonucleoproteína por electroporación de tubo
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí se presenta un protocolo para la edición eficiente de genes mediados por ribonucleoproteína CRISPR/Cas9 en células de mamíferos mediante electroporación de tubos.
Resumen
Las nucleasas de edición de genes, representadas por la proteína 9 asociada a CRISPR (Cas9), se están convirtiendo en herramientas principales en la investigación biomédica. La entrega exitosa de elementos CRISPR/Cas9 en las células objetivo por transfección es un requisito previo para una edición eficiente de genes. Este protocolo demuestra que la administración mediada por máquina de electroporación de tubos (TE) de ribonucleoproteína CRISPR/Cas9 (RNP), junto con plantillas de donantes de oligodesoxinucleótido de una sola cadena (ssODN) a diferentes tipos de células de mamíferos, conduce a plantillas robustas de donantes de oligodesoxinucleótidos (ssODN) a diferentes tipos de células de mamíferos, conduce a plantillas robustas de donantes de oligodesoxinucleótidos (ssODN) a diferentes tipos de células de mamíferos, conduce a plantillas robustas de donantes de oligodesoxinucleótidos (ssODN) a diferentes tipos de células de mamíferos, eventos precisos de edición genética. En primer lugar, se aplicó TE para suministrar CRISPR/Cas9 RNP y ssODN para inducir mutaciones causantes de enfermedades en el gen gamma de subunidad receptora interleucina 2 (IL2RG) y en el gen de la sepiapterina reductasa (SPR) en células fibroblastas de conejo. Se lograron tasas de mutación precisas de 3,57%-20% según lo determinado por la secuenciación bacteriana de la clonación TA. La misma estrategia se utilizó entonces en iPSCs humanos en varios genes clínicamente relevantes, incluyendo receptor del factor de crecimiento epidérmico (EGFR), proteína de unión a la miosina C, cardiaco (Mybpc3), y subunidad beta de hemoglobina (HBB). Consistentemente, se lograron tasas de mutación de alta precisión (11,65%-37,92%) según lo determinado por la secuenciación profunda (DeepSeq). El presente trabajo demuestra que la electroporación de tubos de CRISPR/Cas9 RNP representa un protocolo de transfección eficiente para la edición de genes en células de mamíferos.
Introducción
CRISPR/Cas9 es la nucleasa programable más utilizada para la edición de genes. Funciona a través del reconocimiento mediado por ARN de guía única (sgRNA) de ambas secuencias diana y una secuencia de motivo adyacente protoespacial (PAM) adyacente en el genoma. La nucleasa Cas9 genera una rotura de ADN de doble cadena (DSB) ubicada tres nucleótidos aguas arriba de la secuencia PAM1. Los DSB se reparan a través de vías de unión final no homólogas (NHEJ) propensas a errores o de reparación dirigida por homología (HDR). Para lograr una edición génica precisa a través de la vía HDR, las plantillas de donantes a menudo se proporcionan en el formato de ADN plásmido (PDNA) o oligodesoxinucleótido de una sola cadena (ssODN).
CRISPR/Cas9 y el sgRNA se pueden suministrar a las células en tres formatos: el complejo de ribonucleoproteína (RNP) de la proteína Cas9 y el gRNA2,3; Cas9 mRNA y sgRNA4,5; o ADN plásmido (pDNA) que contiene los promotores necesarios, sgRNA accionado, y la región de codificación Cas96,7,8. Muchos grupos han demostrado que cuando CRISPR/Cas9 se administra como RNP, la eficiencia de edición de genes a menudo supera a los logrados enformatos pDNA o ARNm, atribuibles al tamaño mucho menor de RNP en comparación con los ácidos nucleicos 9. Además, se ha demostrado anteriormente que una nueva máquina de electroporación detubos (TE) es particularmente eficaz en aplicaciones de edición de genes en varios tipos de células 9.
En el presente trabajo se presenta un protocolo paso a paso en la utilización de TE para la entrega de CRISPR/Cas9 RNP a células de mamíferos de diferentes especies en varios loci clínicamente relevantes. Esta novedosa técnica de transfección TE y el fenómeno de alta tasa HDR pueden encontrar amplias aplicaciones en la investigación biomédica.
Protocolo
Todos los procedimientos de mantenimiento, cuidado y uso de animales fueron revisados y aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad de Michigan.
1. Preparación de células
-
Adquirir iPSC seres humanos (ACS-1030) de la American Type Culture Collection (ATCC). Cultivo iPScs en matriz extracelular artificial con medio de cultivo celular libre de alimentador (ver Tabla de Materiales) en una incubadora de cultivo celular (5% CO2 a 37 oC) siguiendo las instrucciones del proveedor.
- 2 h antes de la transfección, tratar los iPSCcon 10 M Asociado Rho, bobina enrollada que contiene proteína quinasa (ROCK) inhibidor Y27632 (el uso de los cuales reduce la apoptosis de hiPSC humanos disociados y aumenta la supervivencia y la eficiencia de clonación de hiPSCs sin hiPSCs sin afectando su pluripotencia).
- Al transfectar, disociar iPSCs con solución de desprendimiento de celda (ver Tabla de materiales)a celdas individuales a 37 oC durante 5 min. Cuente el número de celda.
-
Establecer un cultivo de células fibroblastos de conejo utilizando un cultivo primario de biopsias de tejido de la piel del oído de conejo, como se describió anteriormente10.
- Se obtiene una biopsia de piel de oído de 0,5 cm x 0,5 cm de la punta de la oreja de conejo. Abunde el cabello del tejido auditivo.
- Enjuague 2 veces con la solución salina tamponada de fosfato (DPBS) de Dulbecco con un 5% de penicilina-estreptomicina. Transfiera el tejido auditivo a un nuevo plato de cultivo de tejido de 6 cm y, a continuación, corte el tejido en trozos pequeños (1,0 mm x 1,0 mm). Agregue unas gotas de suero bovino fetal para evitar que el tejido se seque.
- Esparce el tejido rallado a un plato de cultivo de tejido de 10 cm, luego agrega 10 ml de medio de cultivo. Las células fibroblásticas de conejo se cultivan en el medio de águila modificada (DMEM) de Dulbecco con un 10% de suero bovino fetal. Poner el plato de cultivo tisular en la incubadora de cultivo celular (5% CO2 a 37 oC).
- Tres a cinco días después del enchapado, utilice trypsin-EDTA para digerir las células a 37 oC durante 2 minutos.
2. Diseño y Síntesis de gRNA y Oligos de Donantes
- Para cada gen, diseñe el ARN guía basado en la secuencia del locus objetivo utilizando una herramienta en línea (por ejemplo, ).
- Pegar en la secuencia de ADN de interés.
- Seleccione un genoma y un motivo adyacente protoespacial (PAM). Las posibles secuencias de guía en las secuencias de ADN de entrada se mostrarán en la página de salida. Se recomienda seleccionar gRNA con mayor eficiencia pronosticada y menores potenciales fuera de objetivo.
- Sintetizar ADN por un proveedor comercial para transcribir gRNAs. Realizar la transcripción in vitro de gRNA utilizando un kit de síntesis de ARNm de acuerdo con las instrucciones del fabricante.
- Purificar el GRNA utilizando una micro columna de purificación de ARN incluida en el kit de síntesis de ARNm. Mida la concentración y, a continuación, almacene los gRNAs a -80 oC.
- Diseñe una plantilla de donante ssODN para cada sitio de mutación. Los ssODN pueden ser sintetizados por proveedores comerciales como IDT. En general, cada ssODN es de 120-160 nucleótidos (nt) de longitud, que consiste en 60-80 nt en el brazo de homología izquierda y 60-80 nt en el brazo de homología derecha. Para evitar el recorte del ADN editado, se debe introducir una mutación silenciosa en el PAM en el ssODN siempre que sea posible. El sitio de corte CRISPR debe estar situado lo más cerca posible del cambio genómico previsto.
3. Electroporación de tubos de Cas9 RNP y ssODNs
- Prepare las celdas como se describe en la sección 1.
- Resuspenda 2-3 x 105 células en 20 s de tampón de electroporación. Pipetear hacia arriba y hacia abajo cuidadosamente para producir una suspensión de una sola célula.
- Para la transfección Cas9 RNP, premezcle 2 g de proteína Cas9-NLS con 0,67 g de gRNA a temperatura ambiente (RT) durante 10-15 min. A continuación, mezcle suavemente el complejo RNP formado junto con 2 g de ssODN con las células.
- Transfiera la mezcla celular a un tubo de electroporación de 20 l utilizando puntas de pipeta de ajuste universal proporcionadas por el kit de electroporación del tubo. Para lograr una mejor electroporación, trate de evitar la formación de burbujas de aire durante la transferencia.
- Coloque el tubo de electroporación en la ranura del electroporator y pulse "Go" para terminar. Siga los parámetros sugeridos por el fabricante para cada tipo de celda. Por ejemplo, para los isPC humanos y las células de fibroblastos de conejo, el conjunto de voltaje es de 420 V y el tiempo de pulso es de 30 ms. Un ciclo de electroporación exitoso se indica mediante el informe de pulsos en la pantalla del electroporator.
- Después de la electroporación, transfiera las células iPS humanas a 1 ml del medio de cultivo precalentado que contiene Y-27632 descrito en la parte de cultivo celular. Para las células fibroblásticas de conejo, transfieralas a DMEM con un 10% de suero bovino fetal.
- Placar las células resuspendidas a un pozo de una placa de cultivo celular de 12 pozos.
- Cambia el medio cultural todos los días. Y-27632 se elimina del medio de cultivo humano iPSC 24 h después de la electroporación.
4. Análisis de eventos de edición de genes
- Células de cosecha 72 h después de la electroporación. Digerir las células de la placa de cultivo utilizando trypsin-EDTA para células fibroblasos de conejo o solución de desprendimiento celular para iPSCs humanos. Después de la centrífuga, resuspende las células con 350 ml de tampón de lisis (1 M Tris HCl, 5 M NaCl, 0,5 M EDTA; pH 8,0, 10% SDS, agregue 20 ml de 20 mg/ml de proteinasa K por 1 ml de tampón de lisis), luego incubar a 55 oC durante la noche.
- Extraiga el ADN genómico con fenol-cloroformo utilizando procedimientos estándar.
- Amplifica rúbricas de 100-200 bp que contienen una región objetivo utilizando una polimerasa de ADN de alta fidelidad y, a continuación, purifica los fragmentos de ADN de los geles utilizando un kit de extracción de gel o directamente de productos PCR utilizando un minikit PCR SV.
- Para determinar la eficiencia de edición de genes mediante la secuenciación bacteriana de colonias, coloca los productos de PCR purificados en un vector pCR4-TOPO utilizando un kit de clonación TOPO TA. Recoger aleatoriamente clones bacterianos, luego secuenciar las plaquitas utilizando una imprimación de secuenciación universal proporcionada por el kit de clonación TOPO TA.
- Para determinar la eficiencia de la edición de genes mediante la secuenciación profunda, envíe los productos de PCR purificados (100-200 bp) desde el paso 4.3 para la secuenciación de amplificación CRISPR en un núcleo de secuenciación de ADN.
Resultados
TE de Cas9 RNP y ssODNs a células de fibroblastos de conejo
El proceso general de entrega mediada por TE de Cas9 RNP a células de mamíferos se ilustra en la Figura1. En primer lugar, se produjeron mutaciones C231Y y Q235X en el gen IL2RG, y la mutación R150G se produjo en el gen SPR en células fibroblastas de conejo. Se sabe que las mutaciones de pérdida de función en los genes IL2RG y SPR causan inmunodeficiencia primaria11 y déficits motores y cognitivos12,respectivamente.
Los diseños específicos de sgRNA se ilustran en la Figura 2A. Las imprimaciones utilizadas para amplificar las regiones objetivo se enumeran en el Cuadro3. Las secuencias de ssODN se muestran en la Tabla 1. Las tasas de edición de genes se determinaron mediante clonación bacteriana de TA (Figura2B). En el locus IL2RG C231, de los 28 clones que fueron secuenciados, uno (3,57%) conllevó la mutación c231Y precisa, cuatro (14,28%) mutaciones de inserción o deleción (indel) y las 23 restantes (82%) eran de tipo salvaje. En el locus IL2RG Q235, de los 27 clones que fueron secuenciados, dos (7,41%) conlató la mutación Q235X precisa, tres mutaciones indel (11,11%) y el resto eran de tipo salvaje. En el locus SPG R150, de los 20 clones secuenciados, cinco (25%) llevó la mutación r150G precisa, 10 (50%) mutaciones indel, y los restantes eran de tipo salvaje.
TE de Cas9 RNP y ssODNs a iPSCs humanos
TE se utilizó entonces para entregar Cas9 RNP y ssODN a iPSCs humanos y apuntar loci clínicamente relevante en genes EGFR, Mybpc3 y HBB. Las mutaciones puntuales en la región proximal EGFR T790 confieren resistencia a los inhibidores de la tirosina quinasa EGFR en pacientes con cáncer de pulmón de células no pequeñas (NSCLC) que albergan mutaciones activadoras de EGFR13. Una mutación de cambio de marco en el exón 16 en Mybpc3 está implicada en la cardiomiopatía hipertrófica14. La mutación del punto E6V en el gen HBB conduce a la enfermedad de las células falciformes15.
Los diseños específicos de sgRNA se ilustran en la Figura 3A. Las imprimaciones utilizadas para amplificar las regiones objetivo se enumeran en el Cuadro3. Las secuencias de ssODN se muestran en la Tabla 1. Las tasas de edición de genes fueron determinadas por DeepSeq (Figura3B). En el locus del EGFR, el 15,68% de los alelos llevaban las mutaciones puntuales precisas (6.315 lecturas), el 22,75% llevaban mutaciones indel (9.162 lecturas) y el 61,57% restante eran de tipo salvaje (24.797 lecturas). En el locus de Mybpc3, el 37,92% llevó la eliminación precisa de TGAA de 4 bp (11.654 lecturas), el 2,24% llevaba mutaciones indel (410 lecturas) y el 59,84% restante eran de tipo salvaje (18.692 lecturas). En el locus HBB, el 11,65% llevaba la mutación e6V precisa (6.565 lecturas), el 23,35% llevaba mutaciones indel (13.163 lecturas) y el 65% restante eran de tipo salvaje (36.644 lecturas).

Figura 1: Gráfico de flujo de electroporación de tubos de Cas9 RNP.

Figura 2 : Edición génica de células fibroblastas de conejo. (A) Ilustración de secuencias de destino. Las casillas indican loci objetivo. Las letras subrayadas corresponden a secuencias de ARNNes gRNA. Las letras de color rojo indican secuencias PAM. (B) Resultados de clonación TA de eventos de edición de genes. Las cajas indican loci mutados con precisión. La secuencia indel mostrada es sólo representativa de un tipo de alelo. No se muestran otras secuencias indel. Haga clic aquí para ver una versión más grande de esta figura.
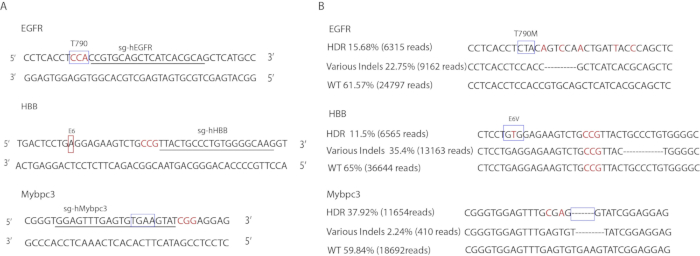
Figura 3 : Edición génica de iPSCs humanos. (A) Ilustración de secuencias de destino. Las casillas indican loci objetivo. Las letras subrayadas corresponden a la secuencia de ARNNes gRNA. Las letras de color rojo indican secuencias PAM. (B) Resultados profundos de eventos de edición de genes. Las cajas indican loci mutados con precisión. Las letras de color rojo indican mutaciones silenciosas que se introdujeron en las plantillas de donantes. La secuencia indel mostrada es sólo representativa de un tipo de alelo. No se muestran otras secuencias indel. Haga clic aquí para ver una versión más grande de esta figura.
| Lugar geométrico |
Secuencia de oligo | |||||||
| (mutación dirigida) | ||||||||
| Conejo IL2RG (C231Y) | AGCGTAGGGGCAGAAGAAACTCACGTTCCCCCCCCCCCCCCGTTTTAACCCTTTTGTATGGGAGTGCACatTGGAGT GAATGGAGCCACCCGATCCACTGGGGGAGCAAAAACTTCAAAGGGTAAAATGGGCCT | |||||||
| Conejo IL2RG (Q235X) | AGCGTGGATGGGCAGAAGAAACTCACGTTCCAGCCCCGCCCCCCCCGTTTTAACCCTTTTGTGTGGGAGTGTTAGCATTGGAGT GAATGGAGCCACCCGATCCACTGGGGGAGCAAAAACTTCAAAGGGTAAAATGGGCCT | |||||||
| Rabbit SPR | gacctccatgctctctctctctctcctgcatcctcctgaaggcgtttcctgccacccccccccccccccccccccccccccccccccccccccccccccccccccccccccccacccctagcctagcctagcctagcctagcctagcctaggcgaggtgaggtggtgtgtgtggccctggcagccctcaaggcgggg cgctgtac | |||||||
| (R150G) | ||||||||
| EGFR humano | ACGTGATGGCCAGCGTGGACAACCCCCCGTGCCGCCCCTGCTGGCATCTGCCTCTCACCCCCCAACTGATTACCC AGCTCATGCCCTTCGGCTCTCCCCTGGACTATCCGGGAAAAAAAAAAATTGGCTCCCATAC | |||||||
| (Mutaciones puntuales próximas a T790) | ||||||||
| Mybpc3 humano | GCCCCCTGTGCTCATCACGCGCCCCTGGAGGACCAGCTGGGATGGTAGGGGGCAGGGGGTGAG GGAGGGGGGGCGCAAGTCAAATGGTGAGTTCCAGAAGGGGGGGGGGTGTGGGGGGCATCAT | |||||||
| (eliminación de 4 bp) | ||||||||
| Human HBB | TCTGACACACAACTGTTCACCAACCTCAAACACACACACCATGGGGCATCATCTGACTCCTGTGGAGAAGTCTGCAGTTACTGCC CTGTGGGGCAAGGTGAACAGGGATGAAGTTGGTGGTGAGGCCCTGGGCAG | |||||||
| (E6V) | ||||||||
Tabla 1: Secuencias de ssODN.
| Paso | Problema | Posibles razones | Soluciones |
| 2.1 | Baja tasa de indel | Diseño de ARN guía deficiente, reservas de ARN guía >6 meses, baja concentración de ARN guía | Rediseñar ARN guía, producir/pedir nuevo ARN guía. |
| 2.3 | Baja eficiencia de PGE | diseño de ADN de donante deficiente, ARN guía de baja eficiencia, cantidad incorrecta de ADN de donante o ADN de mala calidad | Aumentar la longitud del brazo de homología, introducir la mutación PAM, introducir mutaciones silenciosas en el ADN del donante, utilizar un ARN guía más eficiente, Optimizar la proporción de proteína Cas9 sobre ARN guía. |
| 3.4 | Transfección fallida | Burbujas de aire formadas durante la transferencia de células-mezcla de búfer a tubo de electroporación, ajuste incorrecto de voltaje / duración | Trate de evitar la formación de burbujas de aire, ajuste el ajuste de voltaje / duración. |
| 3.6 | baja viabilidad celular después de la electroporación | Baja supervivencia de ipsc humano único | Añadir inhibidor DE ROCK después de la electroporación, aumentar el número de células. |
| 4.1 | PCR fallido | Alto contenido de GC, o secuencia repetitiva | Optimice la condición PCR, agregue DMSO al sistema PCR. |
Tabla 2: Guías de solución de problemas para problemas frecuentes.
| Primer nombre | Secuencia | Nota |
| Rb-IL2RG-F | CATGACAGTGACAGGCCC | Para amplificar el fragmento de ADN IL2RG de conejo |
| Rb-IL2RG-R | TGCCAGAGACACAAGCGAAC | |
| Rb-SPR-F | GTACTTTGGAGGGACAGAGG | Para amplificar el fragmento de ADN SPR del conejo |
| RB-SPR-R | CTCAGCACCCTGACACTGGG | |
| H-EGFR-F | TGATGGCCAGCGTGGACAAC | Para amplificar fragmentos de ADN EGFR humanos |
| H-EGFR-R | ACCAGTTGAGCAGGTACTGGG | |
| H-Mybpc3-F | ATGCCCCGTGCTTCTGGAAC | Para amplificar el fragmento de ADN Mybpc3 humano |
| H-Mybpc3-R | TCAGGGGAGCCAACCCTCAT | |
| H-HBB-F | TAACCTTGATACCAACCTGC | Para amplificar el fragmento de ADN HBB humano |
| H-HBB-R | CATTTGCTTCTGACACAACT |
Tabla 3: Primers utilizados en el paso 4.3.
Discusión
El método de electroporación de tubos fue eficaz en la entrega de CRISPR/Cas9 RNP y ssODN a células de conejo y humanos, lo que llevó a una sólida edición de genes preciso (PGE). La principal diferencia entre TE y otros dispositivos de electroporación convencionales es el uso de un tubo, en el que dos electrodos están en la parte superior e inferior del tubo y la muestra se carga en su totalidad y luego se sella sobre la electroporación (Figura1). Por el contrario, en una cubeta convencional, los electrodos están en los lados y la muestra no está completamente sellada durante la electroporación. Este nuevo diseño reduce la generación de burbujas de aire y comprime el tamaño de la burbuja de aire,lo que por lo tanto mejora la distribución uniforme de la tensión eléctrica, y como resultado conduce a una reducción de la mortalidad celular y una alta eficiencia de transfección 9. En el presente trabajo, altas tasas de PGE (15%-37%) se lograron apuntando a los genes EGFR, Mybpc3 y HBB en iPSCs humanos. Estos resultados son consistentes con un informe previo en elque se lograron altas tasas de PGE en células madre humanas 9.
Las mutaciones causantes de enfermedades se dirigieron a los genes IL2RG y SPR en células de conejo. Recientemente, los conejos IL2RG-knockout se han producido como modelos para la inmunodeficiencia combinada grave ligada al X humano (SCID-X1)16,17. El presente trabajo muestra que las mutaciones del paciente IL2RG (por ejemplo, C231Y y Q235X) se pueden generar eficientemente en células de conejo, demostrando la viabilidad de crear modelos de conejoS-X1 portadores de mutaciones de pacientes. También se demostró que las mutaciones SPR R150G se pueden crear eficientemente en células de conejo. Esta mutación causa déficits motores y cognitivos en niños12. Estos modelos de conejodes de mutación IL2RG y SPR, una vez generados, pueden servir como valiosos modelos preclínicos para estudios traslacionales. También se pueden utilizar para establecer terapias basadas en la edición de genes para estas enfermedades monogénicas.
Una preocupación para las aplicaciones de edición de genes mediadas por CRISPR/Cas9 son los eventos de edición fuera de destino. Las tasas de indel se analizaron en los sitios de destino superior previstos para los sgRNA utilizados en este estudio (TablaS1), utilizando métodos descritos anteriormente9. En total, se analizaron siete loci potenciales de la parte superior fuera de la diana para sg-rb-IL2RG-01, cinco para sg-rb-SPR, siete para sg-hEGFR, cinco para sg-hMybpc3 y siete para sg-hHBB), utilizando los imprimadores enumerados en la Tabla S2. Los ensayos T7E1 (FiguraS1)no revelaron indels fuera del objetivo, lo que indica los riesgos mínimos fuera del objetivo para la edición genética mediada por CRISPR/Cas9 utilizando estos sgRNAs. También indica que el método de electroporación de tubo en sí no causa o aumenta las ediciones fuera del objetivo. Sin embargo, los esfuerzos deben dedicarse a reducir o eliminar las ediciones indeseables fuera del objetivo. La secuenciación del genoma completo puede ser necesaria para excluir tales eventos para las células que están destinadas a ser utilizadas en aplicaciones clínicas.
A nivel técnico, los siguientes son factores clave para lograr una edición eficiente y precisa del genoma mediante la electroporación del tubo CRISPR/Cas9 RNP. En primer lugar, se recomienda seleccionar un sgRNA eficiente con un potencial predicho bajo fuera de objetivo. Es importante validar la eficiencia indel del sgRNA seleccionado antes de usarlo para aplicaciones PEG. No es raro que un software predijo un buen sgRNA falla en el paso de validación.
En segundo lugar, para lograr un ALTO PGE, se recomienda inducir una mutación PAM al donante ssODN siempre que sea posible. La razón es que al hacerlo, se evita el recorte CRISPR/Cas9 después de que se prevenga la integración de la plantilla de donante. En algunos casos, el propio PGE introduce mutaciones PAM. En otros casos, es posible introducir mutaciones silenciosas en la secuencia de PAM. En caso de que una mutación PAM no sea posible, se aconseja tratar de incluir varias mutaciones silenciosas en el donante que corresponde a la secuencia de sgRNA.
En tercer lugar, particularmente relevante para TE, es importante evitar la formación de burbujas de aire al transferir células y mezcla RNP al tubo de electroporación. Mientras que el diseño de un tubo TE ya minimiza la formación de burbujas de aire, un manejo cuidadoso reducirá aún más e incluso puede completar evitar la formación de burbujas de aire. En la Tabla 2se proporciona una guía de resolución de problemas para problemas frecuentes que se pueden encontrar en la aplicación de electroporación de tubos para la edición precisa de genes mediada por ribonucleoproteína CRISPR/Cas9.
En conclusión, aquí se demuestra que la electroporación de tubos es un medio eficaz para la administración de CRISPR/Cas9 RNP y ssODN a células de mamíferos para lograr altas tasas de PGE. Esta nueva técnica de transfección TE y su robusta y precisa tasa de edición genética pueden facilitar el desarrollo de aplicaciones de edición de genes.
Divulgaciones
J. C. trabaja en Celetrix LLC, fabricante del electroporator de tubo. L. M., L. J., J. S., D. Y., J. Z., Y.E.C., y J. X. no declaran intereses competidores.
Agradecimientos
Este trabajo fue apoyado por los Institutos Nacionales de Salud (R21OD023194 a JX). Este trabajo utilizó Core Services apoyado por Center for Advanced Models for Translational Sciences and Therapeutics (CAMTraST) en el Centro Médico de la Universidad de Michigan.
Materiales
| Name | Company | Catalog Number | Comments |
| Accutase | STEMCELL Technologies | 792 | Cell detachment solution for human iPSCs, first used in Step 1.1.2. |
| Cas9 Nuclease 3NLS | IDT | 1074182 | Cas9 protein, first used in Step 3.3. |
| DMEM | Thermo Fisher | 11965092 | For cell culture, first used in Step 1.2.3. |
| DPBS | Thermo Fisher | 1708075 | For preparing cell culture, first used in Step 1.2.2. |
| EDTA | Lonza | 51201 | For making lysis buffer, first used in Step 4.1. |
| Electroporation buffer | Celetrix | 13–0104 | The electroporation buffer, first used in Step 3.2. |
| Electroporation tubes | Celetrix | 20 μL: 12–0107; 120 μL: 12–0104 | The electroporation tube, first used in Step 3.4. |
| Electroporator | Celetrix | CTX-1500A LE | The tube electroporation machine, first used in Step 3.5 |
| Fetal bovine serum | Sigma Aldrich | 12003C | For cell culture, first used in Step 1.2.2. |
| Forma CO2 Incubators | Thermo Fisher | Model 370 | For cell culture, first used in Step 1.1. |
| Gel Extraction Kit | Qiagen | 28115 | For gel purification, first used in Step 4.3. |
| Human induced pluripotent stem cells | American Type Culture Collection | ACS-1030 | Human iPSCs, first used in Step 1.1. |
| Matrigel | Corning | 354277 | Artificial extracellular matrix; for precoating cell culture plate, first used in Step 1.1. |
| mTeSR 1 medium | STEMCELL Technologies | 85850 | Feeder-free cell culture medium for human iPSCs, first used in Step 1.1. |
| PCR SV mini | GeneAll | 103-102 | For PCR product purification, first used in Step 4.3. |
| Penicillin-Streptomycin | Thermo Fisher | 15140163 | For preparing cell culture, first used in Step 1.2.2. |
| Phenol-chloroform | Thermo Fisher | 15593031 | For DNA extraction, first used in Step 4.2. |
| Precision gRNA Synthesis Kit | Invitrogen | A29377 | For the generation of full length gRNA (guide RNA), first used in Step 2.4. |
| Proteinase K Solution | Thermo Fisher | AM2548 | For DNA extraction, first used in Step 4.1. |
| Q5 high-fidelity DNA polymerase | NEB | M0491 | For PCR amplification, first used in Step 4.3. |
| Sodium dodecyl sulfate | Sigma Aldrich | L3771 | For making lysis buffer, first used in Step 4.1. |
| TA Cloning Kit | Thermo Fisher | K457502 | For TA clone sequencing, first used in Step 4.4. |
| Tissue Culture Dish (10 cm) | FALCON | 353003 | For cell culture, first used in Step 1.2.3. |
| Tissue Culture Dish (12 well) | FALCON | 353043 | For cell culture, first used in Step 3.7. |
| Tissue Culture Dish (6 cm) | FALCON | 353004 | For cell culture, first used in Step 1.2.2. |
| Tris HCl | Thermo Fisher | BP1757-500 | For making lysis buffer, first used in Step 4.1. |
| Trypsin-EDTA | Thermo Fisher | 25200056 | For cell digestion, first used in Step 1.2. 4. |
| Universal Fit Pipette Tips | Celetrix | 14-0101 | For electroporation, first used in Step 3.4. |
| Y27632 | LC Labs | Y-5301 | The apoptosis inhibotor, first used in Step 1.1.1. |
Referencias
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Mout, R., et al. Direct Cytosolic Delivery of CRISPR/Cas9-Ribonucleoprotein for Efficient Gene Editing. ACS Nano. 11 (3), 2452-2458 (2017).
- Zuris, J. A., et al. Cationic lipid-mediated delivery of proteins enables efficient protein-based genome editing in vitro and in vivo. Nature Biotechnology. 33 (1), 73-80 (2015).
- Miller, J. B., et al. Non-Viral CRISPR/Cas Gene Editing In Vitro and In Vivo Enabled by Synthetic Nanoparticle Co-Delivery of Cas9 mRNA and sgRNA. Angew Chem Int Ed Engl. 56 (4), 1059-1063 (2017).
- Finn, J. D., et al. A Single Administration of CRISPR/Cas9 Lipid Nanoparticles Achieves Robust and Persistent In Vivo Genome Editing. Cell Reports. 22 (9), 2227-2235 (2018).
- Liang, C., et al. Tumor cell-targeted delivery of CRISPR/Cas9 by aptamer-functionalized lipopolymer for therapeutic genome editing of VEGFA in osteosarcoma. Biomaterials. 147, 68-85 (2017).
- Luo, Y. L., et al. Macrophage-Specific in Vivo Gene Editing Using Cationic Lipid-Assisted Polymeric Nanoparticles. ACS Nano. 12 (2), 994-1005 (2018).
- Wang, H. X., et al. Nonviral gene editing via CRISPR/Cas9 delivery by membrane-disruptive and endosomolytic helical polypeptide. Proceedings of the National Academy of Sciences of the United States of America. 115 (19), 4903-4908 (2018).
- Xu, X., et al. Efficient homology-directed gene editing by CRISPR/Cas9 in human stem and primary cells using tube electroporation. Scientific Reports. 8 (1), 11649 (2018).
- Du, F., et al. Beneficial effect of young oocytes for rabbit somatic cell nuclear transfer. Cloning Stem Cells. 11 (1), 131-140 (2009).
- Allenspach, E., Rawlings, D. J., Scharenberg, A. M., Adam, M. P., et al. . GeneReviews(R). , (1993).
- Friedman, J., et al., Adam, M. P., et al. . GeneReviews(R). , (1993).
- Hidaka, N., et al. Most T790M mutations are present on the same EGFR allele as activating mutations in patients with non-small cell lung cancer. Lung Cancer. 108, 75-82 (2017).
- Ma, H., et al. Correction of a pathogenic gene mutation in human embryos. Nature. 548 (7668), 413-419 (2017).
- Vakulskas, C. A., et al. A high-fidelity Cas9 mutant delivered as a ribonucleoprotein complex enables efficient gene editing in human hematopoietic stem and progenitor cells. Nature Medicine. 24 (8), 1216-1224 (2018).
- Song, J., et al. Bacterial and Pneumocystis Infections in the Lungs of Gene-Knockout Rabbits with Severe Combined Immunodeficiency. Frontiers in Immunology. 9, 429 (2018).
- Song, J., et al. Production of immunodeficient rabbits by multiplex embryo transfer and multiplex gene targeting. Scientific Reports. 7 (1), 12202 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados