Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Funcionalización de voladizos de microscopio de fuerza atómica con células de una t o de una sola partícula para espectroscopia de fuerza de una sola célula inmunológica
En este artículo
Resumen
Presentamos un protocolo para funcionalizar los voladizos del microscopio de fuerza atómica (AFM) con una sola célula T y partícula de cuentas para estudios inmunológicos. Se muestran los procedimientos para sondear la unión de células T de un solo par por AFM y para monitorear la respuesta celular en tiempo real de los macrófagos a una sola partícula sólida por AFM con imágenes de fluorescencia.
Resumen
La espectroscopia de fuerza de célulaúnica basada en microscopía de fuerza atómica (AFM-SCFS) es una poderosa herramienta para estudiar las propiedades biofísicas de las células vivas. Esta técnica permite sondear las fuerzas de interacción y la dinámica en una membrana celular viva, incluyendo aquellos entre las células, receptor y ligandos, y junto con muchas otras variaciones. También funciona como un mecanismo para entregar un estímulo físico o bioquímico en células individuales de una manera controlada espaciotemporalmente, permitiendo así la activación celular específica y los eventos celulares subsiguientes para ser monitoreadoen en tiempo real cuando se combina con células vivas fluorescencia. El paso clave en esas mediciones AFM-SCFS es la funcionalización AFM-cantilever, o en otras palabras, adjuntar un sujeto de interés al voladizo. Aquí, presentamos métodos para modificar los voladizos AFM con una sola célula T y un solo cordón de poliestireno respectivamente para estudios inmunológicos. El primero implica un pegamento biocompatible que acopla células T individuales a la punta de un voladizo plano en una solución, mientras que el segundo se basa en un pegamento epoxi para la adhesión de un solo cordón en el ambiente del aire. También se proporcionan dos aplicaciones inmunológicas asociadas con cada modificación en voladizo. Los métodos descritos aquí se pueden adaptar fácilmente a diferentes tipos de células y partículas sólidas.
Introducción
La microscopía de fuerza atómica (AFM), una herramienta versátil, ha encontrado muchas aplicaciones en la investigación de biología celular1,2,3,4,5. Aparte de su capacidad de imagen de alta resolución, la función nativa de sondeo de fuerza permite investigar directamente las propiedades biofísicas de las células vivas in situ en el nivel6deuna sola célula,7. Estas incluyen las rigideces de las estructuras subcelulares o incluso células enteras8,9,10,11,12, ligando /receptor específico nivel de molécula única en la superficie celular13, y fuerzas de adhesión entre pares únicos de partículas sólidas y células o entre dos células1,2,14,15. Estos dos últimos se clasifican a menudo como espectroscopía de fuerza de una sola célula (SCFS)16. Debido a los voladizos fácilmente disponibles con varias constantes de resorte, el rango de fuerza accesible para AFM es bastante amplio desde unos piconewtons (pN) hasta micronewtons (N), que cubre adecuadamente toda la gama de eventos celulares que involucran fuerzas de unas pocas decenas de pN, como la unión de una sola molécula basada en receptores, a nN, como los eventos celulares fagocíticos15. Este gran rango de fuerza dinámica hace que el AFM sea ventajoso sobre otras técnicas de sondeo de fuerza, como pinzas ópticas/magnéticas y una sonda de fuerza de biomembrana, ya que son más adecuados para mediciones de fuerza débil, con una fuerza típicamente inferior a 200 pN17 , 18. Además, AFM puede funcionar como un manipulador de alta precisión para entregar varios estímulos en células individuales de una manera espaciotemporalmente definida4,19. Esto es deseable para los estudios de activación de una sola célula en tiempo real. En combinación con las imágenes de fluorescencia de células vivas, la respuesta celular posterior al estímulo específico se puede monitorear simultáneamente, haciendo que el SCFS basado en AFM sea extremadamente robusto como imágenes ópticas que proporcionan una herramienta práctica para sondear la señalización celular. Por ejemplo, AFM se utilizó para determinar las cepas necesarias para obtener transitorios de calcio en osteoblastos20. En este trabajo, los transitorios de calcio fueron rastreados fluorescentemente a través de imágenes métricas de relación de calcio después de la aplicación de fuerzas localizadas en osteoblastos cultivados con una punta de AFM. Recientemente, se empleó AFM para estirar fibrillas de colágeno en las que se cultivaban células estelares hepáticas (HSC) y esta activación de HSC transducida por mecano fue monitoreada en tiempo real por un biosensor fluorescente Src, cuya fosforilación representada por el la intensidad de la fluorescencia del biosensor está correlacionada con la activación de HSC3.
En los experimentos SCFS basados en AFM, la funcionalización adecuada de los voladizos AFM es un paso clave hacia mediciones exitosas. Dado que nuestro interés en la investigación se centra en la activación de las células inmunitarias, funcionalizamos rutinariamente losvoladizos con partículas, como partículas sólidas individuales que pueden desencadenar fagocitosis y/o respuestas inmunitarias fuertes 4,14 , 15 y células T únicas que pueden formar una sinapsis inmune con células que presentan antígeno, como células dendríticas activadas (DC)2. Las partículas sólidas individuales normalmente se acoplan a un voladizo a través de un pegamento epoxi en el entorno del aire, mientras que las células T individuales, debido a su naturaleza no adhesiva, se funcionalizan a un voladizo a través de un pegamento biocompatible en solución. Aquí, describimos los métodos para realizar estos dos tipos de modificación en voladizo y dar dos aplicaciones asociadas también. La primera aplicación es sondear las interacciones de células T/DC con AFM-SCFS para comprender el mecanismo supresor de las células T reguladoras desde el punto de vista de la mecánica celular. El segundo consiste en combinar AFM con imágenes de fluorescencia de células vivas para monitorear la respuesta celular de macrófagos a una partícula sólida en tiempo real para revelar el mecanismo molecular de fosfatidilinositol independiente del receptor 4,5-bisfosfato (PIP2)- La moesina mediaba en la fagocitosis. El objetivo de este protocolo es proporcionar un marco de referencia para que los investigadores interesados diseñen e implementen sus propios entornos experimentales con análisis de una sola célula basados en AFM para la investigación inmunológica.
Protocolo
El protocolo de experimento de ratón sigue las pautas de cuidado animal de la Universidad de Tsinghua
1. Funcionalización en voladizo con células T únicas
- Preparación de células de bazo de ratón
- Sacrificar el ratón (8-16 semanas de edad (ya sea sexo); por ejemplo, cepa C57BL/6) usando dióxido de carbono, seguido de luxación cervical.
- Limpie el ratón con 75% de etanol y haga una incisión cutánea de línea media seguida de una esplenectomía.
- Homogeneizar el bazo en 4 ml de PBS que contiene 2% de suero bovino fetal (FBS) utilizando diapositivas de vidrio y eliminar agregados y desechos pasando la suspensión celular a través de un colador de nylon de malla de 70 m.
- Centrifugar la suspensión celular a 500 x g durante 5 min, desechar el sobrenadante y resuspender las células en 2 ml de tampón de lisis de glóbulos rojos (equilibrado a temperatura ambiente) durante 5 min. Terminar la reacción de lisis añadiendo 8 ml de solución de PBS.
- Centrifugar la suspensión celular a 500 x g durante 5 min y resuspender células a una densidad de 1 x 108 células/ml en PBS que contienen 2% FBS y 1 mM EDTA (etiquetado como Solución A), normalmente 0,25-2 ml dependiendo de la densidad celular. Transfiera las celdas resuspendidas a un tubo inferior redondo de poliestireno de 5 ml (12 x 75 mm).
- Preparación de células T cd4+ de ratón
- Añadir 50 l/ml de suero de rata (ver Tabla de materiales)y 50 l/ml de cóctel de aislamiento de células T CD4+ (ver Tabla de materiales)a la muestra de células obtenida del paso 1.1.5. Mezclar e incubar durante 10 min a temperatura ambiente.
- Vortex la solución de partículas magnéticas recubierta saltevevidina (ver Tabla de Materiales)durante 30 s o hasta que las partículas aparezcan uniformemente dispersas.
- Añadir partículas magnéticas recubiertas de estreptavidina de 75 ml/ml a la muestra de células. Mezclar e incubar durante 2,5 min a temperatura ambiente.
- Agregue la solución A para recargar la muestra de celda a 2,5 ml y mezcle pipeteando suavemente hacia arriba y hacia abajo durante 2-3 veces.
- Coloque el tubo de muestra (sin tapa) en el imán (ver Tabla de materiales)e incubar durante 5 minutos a temperatura ambiente. Vierta cuidadosamente la suspensión de celda enriquecida en un nuevo tubo de fondo redondo de poliestireno de 5 ml.
- Centrifugar la suspensión celular a 500 x g durante 5 min. Deseche el sobrenadante y vuelva a suspender las células T enriquecidas en 500 s de la solución A.
NOTA: Las células T CD4+ enriquecidas contienen células T convencionales y reglamentarias.
- Separación de células T reguladoras de las células T convencionales
- Añadir 25 l de bloqueador FcR (ver Tabla de materiales)a la muestra de células T enriquecida obtenida del paso 1.2.6. Mezclar e incubar durante 5 min a temperatura ambiente.
- Añadir 25 l de cóctel regulador de selección positiva de células T (ver Tabla de Materiales)a la muestra de células T. Mezclar e incubar durante 10 min a temperatura ambiente.
- Añadir 10 l de cóctel de selección de PE (ver Tabla de Materiales)a la muestra de células T. Mezclar e incubar durante 5 min a temperatura ambiente.
- Vortex la solución de partículas magnéticas recubierta de dextran (ver Tabla de Materiales)durante 30 s o hasta que las partículas aparezcan uniformemente dispersas.
- Añadir 10 l de partículas magnéticas recubiertas de desnción a la muestra de células T. Mezclar e incubar durante 5 min a temperatura ambiente.
- Agregue la solución A para recargar la muestra de células T a 2,5 ml y mezcle pipeteando suavemente hacia arriba y hacia abajo durante 2-3 veces.
- Coloque el tubo de muestra de células T (sin tapa) en el imán e incubar durante 5 minutos a temperatura ambiente. Vierta cuidadosamente el sobrenadante en un tubo nuevo.
NOTA: El sobrenadante contiene las células CD4+T convencionales enriquecidas. - Centrifugar las células CD4+T convencionales enriquecidas a 500 x g durante 5 min. Deseche el sobrenadante y vuelva a suspender las células en 4 ml de RPMI1640 que contienen 10% FBS, 0,05 mM de mercaptoetanol, 0,01 M HEPES y 1% penicilina/estreptomicina (etiquetado como medio B).
- Retire el tubo en el que se enriquecen las células T reguladoras del imán. Agregue 2,5 ml de solución A al tubo y mezcle pipeteando suavemente hacia arriba y hacia abajo durante 2-3 veces. Vuelva a colocar el tubo en el imán, incubar durante 5 minutos y luego verter cuidadosamente y desechar el sobrenadante. Repita este paso tres veces más.
- Resuspenda las células T reguladoras enriquecidas en 2 ml del Medio B.
- Incubar tanto células T convencionales purificadas como células T reguladoras con 100 U/ml de hIL-2 durante la noche o durante al menos 4 h a 37 oC en una incubadora humidificada con 5% de CO2 antes de ser utilizada para la funcionalización en voladizo.
- Preparación de células dendríticas
- Preparar la solución de piraña, una mezcla de 30% H2O2 (30%) y 70% H2SO4 (conc) (v/v). Vierta lentamente 3 ml de H2O2 en 7 ml de H2SO4 bajo agitación y enfriamiento constantes.
ADVERTENCIA: La solución de Piranha es altamente corrosiva, y puede quemar y destruir los tejidos del cuerpo. Por lo tanto, es más seguro utilizar la solución de piraña bajo una capucha y usar el equipo de seguridad adecuado, ya que la mezcla salpicará alrededor del vaso de precipitados. Neutralizar la solución con NaOH a pH 7 después de su uso. - Sumerja el cubreobjetos de vidrio de 24 mm de diámetro en la solución de piraña durante 30 minutos y enjuague bien después con el agua ultrapura estéril.
- Sumerja un par de pinzas puntiagudas en 75% de etanol durante 30 min para la desinfección en frío.
- Introducir los cubreobjetos de vidrio limpio en una placa de cultivo de 6 pocillos junto a las pinzas.
- Incline un plato de cultivo plástico de 6 cm en el que las células DC2.4 fueron precultivadas con 4 ml de Medio B y aspirar todo el medio. Agregue 2 ml de PBS en la placa de cultivo para enjuagar las células DC2.4 y deseche PBS. Repita este paso de enrreo dos veces más.
- Añadir 1 mL de 0,25% de EDTA de trippsina al plato de cultivo durante 2 min. Añadir 1 mL de Medio B a este plato para poner fin a la reacción de digestión enzimática. Transfiera la suspensión de la célula digerida a un tubo de 15 ml.
- Centrifugar la suspensión celular a 500 x g durante 5 min y resuspender las células DC2.4 a una densidad de 2 x 105 células/ml en medio B.
- Células de semilla DC2.4 en los cubreobjetos de vidrio preparadas en el paso 1.4.4 eincubar las células durante la noche en una cámara humidificada a 37oC con 5% de CO2.
NOTA: Para medir las fuerzas de interacción entre dos células individuales, es necesaria una concentración relativamente baja de células DC2.4 (es decir, una confluencia de <10%) para tener un espaciado adecuado entre las células.
- Preparar la solución de piraña, una mezcla de 30% H2O2 (30%) y 70% H2SO4 (conc) (v/v). Vierta lentamente 3 ml de H2O2 en 7 ml de H2SO4 bajo agitación y enfriamiento constantes.
- Preparación en voladizo AFM
NOTA: Los voladizos que son adecuados para experimentos de espectroscopia de fuerza de celda única son aquellos con constantes de resorte bajo, típicamente en el rango de 0.01-0.06 N/m. Aquí, los voladizos suaves sin puntas son preferidos para la funcionalización de células individuales y partículas sólidas únicas.- Limpie los voladizos mediante el tratamiento con Piranha o la limpieza de plasma o ozono UV.
- Monte el voladizo limpio en el cabezal de escaneo AFM.
- Preparar una cámara de muestra limpia llena de agua pura y calibrar el voladizo en la solución de agua ejecutando primero una curva de fuerza en el sustrato de vidrio para obtener la sensibilidad (la pendiente del ajuste lineal sobre la parte repulsiva de la curva de aproximación) y luego registrando un espectro de ruido térmico para extraer la constante de resorte de acuerdo con el manual de instrucciones del AFM.
- Retire el cabezal de escaneo AFM de la solución, lave el voladizo montado con unas gotas de etanol puro y mantenga el voladizo seco en el cabezal de escaneo.
- Fijación de celdas T individuales al voladizo
- Precalentar el recinto de ambiente de células vivas con 5% de CO2a 37 oC.
- Monte la cubierta de vidrio con células DC2.4 cultivadas en él desde el paso 1.4.8 hasta un conjunto de cámara de muestra, agregue 600 ml de medio B a la cámara inmediatamente y, a continuación, coloque el conjunto en la etapa de muestra del AFM.
- Agregue las células CD4+T incubadas hIL-2 (células T convencionales o reglamentarias) a la cámara de muestra.
NOTA: El volumen total de la muestra no debe superar 1 ml. - Espere hasta que las celdas CD4+T agregadas estén completamente asentadas en la parte inferior de la cubierta.
NOTA: Las burbujas de aire causarán una gran perturbación al experimento, por lo tanto, es aconsejable evitar cualquier burbuja de aire en los pasos 1.6.2 y 1.6.3. - Añadir una gota de 2 l de pegamento biocompatible en el extremo del voladizo montado con una pipeta como se muestra en la Figura 1 y luego colocar el cabezal de escaneo en la etapa de la muestra rápidamente, dejando así que el voladizo recubierto con el pegamento biocompatible se sumerja en el Solución.
ADVERTENCIA: No toque el bloque de vidrio ni el voladizo con la punta de la pipeta. Dado que el pegamento biocompatible utilizado aquí es propenso a la oxidación en el aire, este paso debe hacerse lo más rápido posible. - Localice una célula T sana debajo de la punta del voladizo engrosada gruesamente debajo del microscopio moviendo la etapa de la muestra y luego ajuste finamente el posicionamiento moviendo el cabezal de escaneo.
NOTA: Una célula CD4+T sana normalmente tiene un tamaño relativamente grande, bordes lisos y transmisiva ópticamente en las imágenes de campo brillante. - Baje el voladizo manualmente con tamaños de paso a partir de 50 m y luego a 10, 5, 2 y 0,5 m gradualmente mediante el control gradual de los motores paso a paso. Mantenga la posición de los motores paso a paso y ajuste el posicionamiento del cabezal de escaneado para una mejor alineación entre la punta del voladizo y la celda, una vez que el voladizo hace un contacto firme con la célula T objetivo como se indica por un pequeño desplazamiento del rayo láser posición en el fotodetector correspondiente a un rango de fuerza típico de 0.5-1.5 nN.
NOTA: Este paso también se puede realizar ejecutando una medición de fuerza única en la que el punto de ajuste (la fuerza aplicada a la celda) y el tiempo de contacto se pueden definir bien en el software. Sin embargo, debido a la naturaleza no adhesiva de las células T, el enfoque manual proporciona más flexibilidad en el control de apuntar, posicionamiento y tiempo de contacto que el acercamiento automático y funciona de forma fiable para la adhesión de células T. Los futuros experimentalistas deben probar tanto el acercamiento manual como el automático para averiguar cuál funciona mejor para sus sistemas de interés. - Retirar el voladizo después de 30 s de contacto.
NOTA: Si la celda se mueve con el voladizo, el accesorio se realiza correctamente. Si no es así, repita el paso 1.6.6 pero en una celda T diferente. El pegamento biocompatible se oxida fácilmente. El paso 1.6.5-1.6.7 debe completarse en un plazo de 5 min. Además, si el mismo voladizo falla tres veces para el enlace de la celda T, se debe utilizar un nuevo voladizo y el procedimiento de conexión debe comenzar desde el paso 1.5.2 de nuevo.
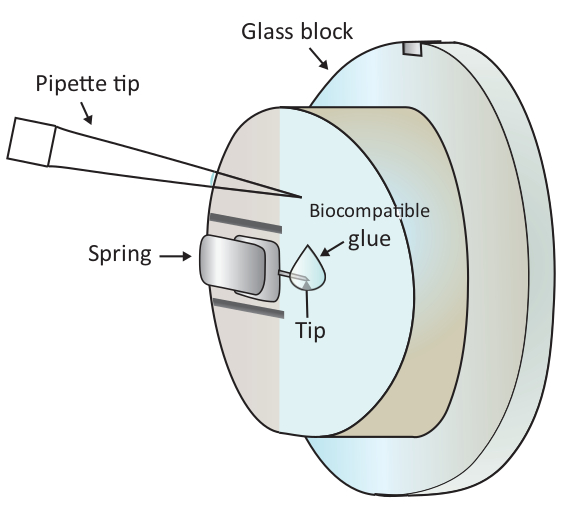
Figura 1: Representación esquemática de la adición de una pequeña gota de pegamento biocompatible en el voladizo montado. El voladizo se monta a través de un muelle de sujeción en el soporte de bloque de vidrio que se instala en el cabezal de escaneo AFM (no dibujado aquí). Cuando el cabezal de escaneado se encuentra sobre una superficie nivelada, el voladizo se orienta verticalmente como se muestra en el dibujo. Se puede añadir un pegamento biocompatible de aproximadamente 2 l a la punta del voladizo con una micropipeta. Haga clic aquí para ver una versión más grande de esta figura.
- Espectroscopia de fuerza de la interacción de células T de un solo par/célula dendrítica
NOTA: Para sondear las interacciones de celda/célula, se requiere un AFM con un rango Z mayor que los 10-15 m convencionales para separar completamente las dos celdas. El AFM utilizado aquí tiene un rango Z de 100 m, que es adecuado para separar la célula T de la célula dendrítica después del contacto celular/célula.- Coloque la celda T conectada por encima de una celda DC2.4 separada moviendo la etapa de muestra y/o el cabezal de escaneo (consulte la Figura2).
- Establezca los parámetros adecuados y ejecute la espectroscopia de fuerza.
NOTA: Normalmente se utilizan los siguientes ajustes de teclas: Punto de consigna 0,5 nN, Longitud de tracción 50 m, Velocidad constante de movimiento Z, Velocidad de extensión de 5 m/s, Tiempo de contacto 10 s, Fuerza constante del modo de retardo. Para cada par T-DC, se recopilan 20 repeticiones de curvas de fuerza y se utilizan un mínimo de 14 curvas de fuerza para su posterior análisis. - Monte un nuevo voladizo limpio, fírlelo en agua pura como en el paso 1.5.3 y vuelva a la misma muestra de células T-DC para repetir los pasos 1.6 y 1.7 para un par T-DC diferente. Sondee al menos 5 pares para cada condición.
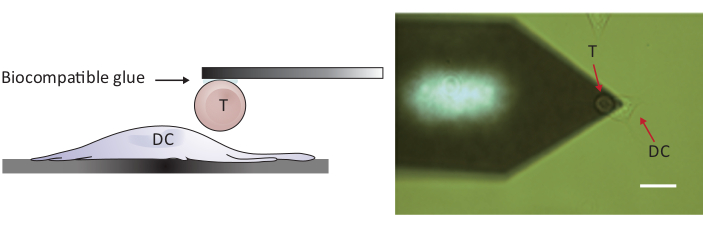
Figura 2: Configuración experimental del sondeo de fuerza entre una sola célula T y CC. (A) Dibujo esquemático de la configuración experimental en la que una célula T unida al voladizo se lleva a un CC cultivado en el sustrato para el sondeo de fuerza. (B) Imagen de campo brillante de un voladizo funcionalizado por células T y un DC. Barra de escala, 20 m. Por favor, haga clic aquí para ver una versión más grande de esta figura.
2. Funcionalización en voladizo con perlas de poliestireno único
- Preparación de cuentas individuales
- Diluir la suspensión en stock de perlas de poliestireno de 6 m en etanol al 100%.
NOTA: La concentración de la solución de perlas diluidas debe ser lo suficientemente baja como para que cuando se añadan a una superficie de recubrimiento de vidrio, las perlas individuales estén bien separadas sin agrupación significativa después de la evaporación del disolvente. - Limpie la cubierta de vidrio de 24 mm de diámetro con etanol y retire el polvo por flujo de aire N 2.
- Monte el cubreobjetos de vidrio limpio en un conjunto de cámara de muestra y coloque el conjunto en el microscopio.
- Coloque una gota de solución de perlas diluidas en el lado izquierdo pero cerca del centro de la cubierta (ver Figura 3) y compruebe el espaciado entre las perlas después de la evaporación del disolvente en campo brillante bajo el microscopio con un objetivo de 20x. Continúe con el siguiente paso si las cuentas individuales están bien separadas.
- Sumerja una punta de micropipeta o un palillo de dientes en un pegamento epoxi bien mezclado y luego transfiera una pequeña cantidad de dicho pegamento a tres puntos separados con toques suaves sucesivos en el lado derecho pero cerca del centro de la cubierta.
NOTA: Los tres puntos de pegamento deben estar alineados verticalmente (ver Figura 3). El último punto con la menor cantidad de pegamento se utilizará más adelante.
- Diluir la suspensión en stock de perlas de poliestireno de 6 m en etanol al 100%.
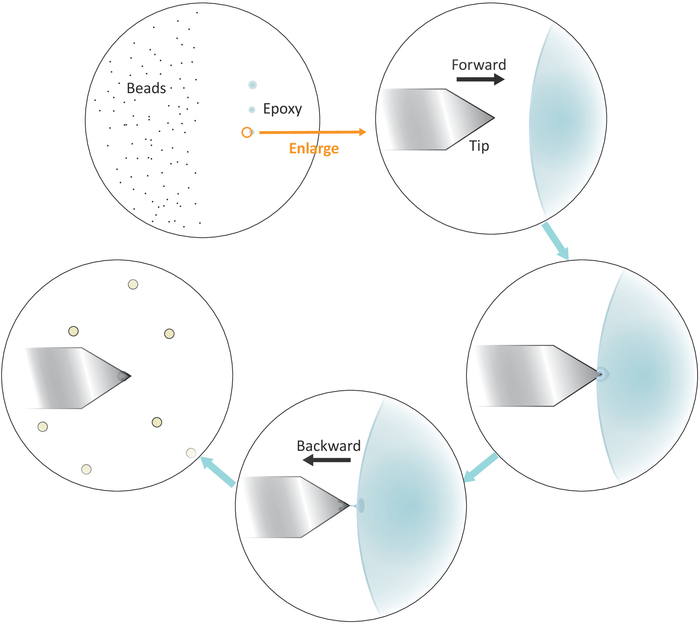
Figura 3: Representación esquemática del flujo de trabajo para la funcionalización de perlas únicas en el voladizo. Las cuentas del tamaño de una microna bien separadas se preparan en el lado izquierdo del sustrato y una pequeña cantidad de pegamento epoxi se transfiere al lado derecho del sustrato a través de 3 toques suaves sucesivos, lo que resulta en 3 puntos de pegamento. Sólo el último punto con la menor cantidad de pegamento (indicado por un círculo) se utiliza para recubrir el extremo mismo del voladizo. Acercarse al voladizo en el pegamento desde la izquierda y luego mover el voladizo hacia atrás una vez que se sumerge en el pegamento para confinar el pegamento en el extremo del voladizo. Coloque el cordón objetivo debajo del voladizo y alinee correctamente antes de hacer un contacto firme (normalmente 2-5 nN) para la adhesión del cordón. Cuando el cordón se funcionaliza correctamente en el voladizo, se puede montar un nuevo voladizo para iniciar un nuevo ciclo de funcionalización. Haga clic aquí para ver una versión más grande de esta figura.
- Preparación en voladizo AFM
- Monte un voladizo sin punta limpia en el cabezal de escaneo AFM.
- Calibrar este voladizo en el aire con una superficie limpia para obtener la constante de resorte.
- Fijación de perlas individuales al voladizo
- Coloque la punta en voladizo sobre el límite izquierdo del último punto de pegamento epoxi como se muestra en la Figura 3.
- Acerque el voladizo al pegamento lentamente bajando los motores paso a paso con pequeños tamaños de escalón.
- Tire del voladizo rápidamente del pegamento lateralmente moviendo el cabezal de escaneo AFM hacia atrás (a la izquierda) manualmente una vez que la punta está sumergida en el pegamento.
NOTA: Asegúrese de que sólo una pequeña cantidad del pegamento se adhiere al extremo de la punta. Si hay pegamento excesivo en la punta, es posible reducir la cantidad de pegamento tocando seguido de deslizar la punta sobre una superficie vacía. - Mueva la punta en voladizo sobre una perla única bien aislada.
- Acercarel lentamente al voladizo y hacer un contacto firme con el cordón (como lo indica el desplazamiento de la posición del rayo láser en el fotodetector correspondiente a un rango de fuerza típico de 2-5 nN) durante unos 10 s durante el cual un ajuste fino de la t IP posicionamiento lateralmente ayudará a localizar mejor el cordón en el extremo de la punta. Retirar la punta al final del contacto.
NOTA: La desaparición del cordón del plano focal original indica un evento adherente exitoso. - Desmonte el voladizo modificado con perlas cuidadosamente y guárdelo en una caja en voladizo durante la noche para la solidificación completa del pegamento.
- Imágenes por fluorescencia de la respuesta celular de macrófagos a un solo cordón suministrado por AFM.
NOTA: Las imágenes por fluorescencia se realizaron en un microscopio de fluorescencia de reflexión interna total de tipo objetivo casero basado en un soporte de microscopio comercial. Este sistema de imágenes está equipado con 4 fuentes láser (405 nm, 488 nm, 561 nm, 647 nm), un visor divisor para la detección de dos colores y un dispositivo acoplado de carga de multiplicación de electrones (EMCCD) para imágenes de campo ancho.- Cultivar células RAW264.7 sobre un cubreobjetos de vidrio a 37 oC en una cámara humidificada 5% CO 2.
- Transfect Moesin-EGFP y PLC-PH-mCherry a células RAW264.7 utilizando un kit de transfección (ver Tabla de Materiales)según el protocolo del fabricante para visualizar fluorescentemente Moesin y fosfatidilinositol 4,5-bisfosfato (PIP2) moléculas Respectivamente.
NOTA: Moesin tiene un motivo ITAM que puede activar Syk, un jugador clave en fagocitosis. PIP2 es conocido por reclutar Moesin a la membrana celular. - Coloque la cubierta de vidrio con celdas en un conjunto de cámara de muestra y monte el ensamblaje en la etapa de muestra de AFM.
- Monte el voladizo modificado con perlas en el cabezal de escaneo AFM.
- Ejecute una curva de fuerza en un área vacía y calibre la fuerza con la sensibilidad de esta curva y la constante de resorte medida en el paso 2.2.2.
- Encuentre una célula bien aislada con intensidades de fluorescencia adecuadas en los canales verde (Moesin-EGFP) y rojo (PLC-PH-mCherry) con excitaciones de 488/561 nm.
- Entregue el cordón de poliestireno desnudo de 6 m con AFM a la superficie celular con 1 nN de fuerza constante y 500 s de tiempo de contacto.
- Registre la serie de imágenes de fluorescencia de la célula en contacto con el cordón para su análisis (normalmente 10 fotogramas/s).
NOTA: Para reducir el fotoblanqueo de los fluoróforos, se debe utilizar un poder de excitación relativamente bajo para buscar las células de interés. Además, se puede emplear un esquema de excitación intermitente para prolongar los rastros de tiempo de fluorescencia si la dinámica de las respuestas celulares está en una escala de tiempo lenta.
Resultados
La Figura 4A muestra las curvas típicas de fuerza-distancia de la interacción de enlace entre la célula de una T y la sola CC en un ciclo de aproximación-retracción. La curva roja clara es la curva de extensión y la roja oscura es la curva de retracción. Dado que la curva de extensión se utiliza normalmente para la sangría o el análisis de rigidez, aquí sólo la curva de retracción se refiere a la adhesión de celdas. El valor mínimo (el círculo...
Discusión
La espectroscopia de fuerza de una sola célula basada en AFM ha evolucionado hasta convertirse en una poderosa herramienta para abordar las propiedades biofísicas de las células vivas. Para esas aplicaciones, el voladizo debe ser funcionalizado correctamente con el fin de sondear interacciones específicas o propiedades en las celdas de interés. Aquí, se describen los métodos para acoplar una sola célula T y un solo micronés a la voladizo sin punta, respectivamente. Para fijar una sola célula T al voladizo, se e...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo cuenta con el apoyo del Programa General de la Fundación Nacional de Ciencias Naturales de China (31370878), el Programa Clave del Estado (31630023) y el Programa de Grupos de Investigación Innovadora (81621002).
Materiales
| Name | Company | Catalog Number | Comments |
| Material | |||
| 10 μl pipette tip | Thermo Fisher | 104-Q | |
| 15 ml tube | Corning | 430791 | |
| 6 cm diameter culture dish | NALGENE nunc | 150462 | |
| 6-well culture plate | JET | TCP011006 | |
| AFM Cantilever | NanoWorld | Arrow-TL1-50 | tipless cantilever |
| β-Mercaptoethanol | Sigma | 7604 | |
| Biocompatible glue | BD Cell-Tak | 354240 | |
| CD4+ T cell isolation Cocktail | STEMCELL | 19852C.1 | |
| DC2.4 cell line | A gift from K. Rock (University of Massachusetts Medical School, Worcester, MA) | ||
| Dextran-coated magnetic particles | STEMCELL | SV30010 | |
| EDTA | GENEray | Generay-E1101-500 ml | |
| Epoxy | ERGO | 7100 | |
| Ethanol | twbio | 00019 | |
| FBS | Ex Cell Bio | FSP500 | |
| FcR blocker | STEMCELL | 18731 | |
| Glass coverslip | local vender (Hai Men Lian Sheng) | HX-E37 | 24mm diameter, 0.17mm thinckness |
| Glass slides | JinTong department of laboratory and equipment management, Haimen | N/A | customized |
| H2O2 (30%) | Sino pharm | 10011218 | |
| H2SO4 | Sino pharm | 80120892 | |
| HEPES | Sigma | 51558 | |
| Magnet | STEMCELL | 18000 | |
| Mesh nylon strainer | BD Falcon | REF 352350 | |
| Moesin-EGFP | N/A | cloned in laboratory | |
| Mouse CD25 Treg cell positive isolation kit | STEMCELL | 18782 | Component: FcR Blocker,Regulatory T cell Positive Selection Cocktail, PE Selection Cocktail, Dextran RapidSpheres, |
| Mouse CD4+ Tcell isolation kit | STEMCELL | 19852 | Component:CD4+T cell isolation Cocktail, Streptavidin RapidSpheres, Rat Serum |
| NaOH | Lanyi chemical products co., LTD? Beijing | 1310-73-2 | |
| PBS | Solarbio | P1022-500 | |
| PE selection cocktail | STEMCELL | 18151 | |
| Penicillin-Streptomycin | Hyclone | SV30010 | |
| PLCδ-PH-mCherry | Addgene | 36075 | |
| Polystyrene microspheres 6.0μm | Polysciences | 07312-5 | |
| polystyrene round bottom tube | BD Falcon | 352054 | |
| Rat serum | STEMCELL | 13551 | |
| RAW264.7 | ATCC | ||
| Recombinant Human Interleukin-2 | Peprotech | Peprotech, 200-02-1000 | |
| Red blood cell lysis buffer | Beyotime | C3702 | |
| Regulatory T cell positive selection cocktail | STEMCELL | 18782C | |
| RPMI 1640 | Life | C11875500BT | |
| Sample chamber | Home made | ||
| Streptavidin-coated magnetic particles | STEMCELL | 50001 | |
| Transfection kit | Clontech | 631318 | |
| Trypsin 0.25% EDTA | Life | 25200114 | |
| Tweezers | JD | N/A | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 20x objective NA 0.8 | Zeiss | 420650-9901 | Plan-Apochromat |
| Atomic force microscope | JPK | cellHesion200 | |
| Centrifuge | Beckman coulter | Allegra X-12R | |
| Fluorescence imaging | home-made objective-type total internal reflection fluorescence microscop based on a Zeiss microscope stand | ||
| Humidified CO2 incubator | Thermo Fisher | HERACELL 150i | |
| Inverted light microscope | Zeiss | Observer A1 manual |
Referencias
- Benoit, M., Gabriel, D., Gerisch, G., Gaub, H. E. Discrete interactions in cell adhesion measured by single-molecule force spectroscopy. Nature Cell Biology. 2 (6), 313-317 (2000).
- Chen, J., et al. Strong adhesion by regulatory T cells induces dendritic cell cytoskeletal polarization and contact-dependent lethargy. Journal of Experimental Medicine. 214 (2), 327-338 (2017).
- Liu, L., et al. Mechanotransduction-modulated fibrotic microniches reveal the contribution of angiogenesis in liver fibrosis. Nature Materials. 16 (12), 1252-1261 (2017).
- Mu, L. B., et al. A phosphatidylinositol 4,5-bisphosphate redistribution-based sensing mechanism initiates a phagocytosis programing. Nature Communications. 9, (2018).
- Qi, C., et al. Pathology-targeted cell delivery via injectable micro-scaffold capsule mediated by endogenous TGase. Biomaterials. 126, 1-9 (2017).
- Muller, D. J., Helenius, J., Alsteens, D., Dufrene, Y. F. Force probing surfaces of living cells to molecular resolution. Nature Chemical Biology. 5 (6), 383-390 (2009).
- Muller, D. J., Dufrene, Y. F. Atomic force microscopy: a nanoscopic window on the cell surface. Trends in Cell Biology. 21 (8), 461-469 (2011).
- Radotic, K., et al. Atomic force microscopy stiffness tomography on living Arabidopsis thaliana cells reveals the mechanical properties of surface and deep cell-wall layers during growth. Biophysics Journal. 103 (3), 386-394 (2012).
- Kuznetsova, T. G., Starodubtseva, M. N., Yegorenkov, N. I., Chizhik, S. A., Zhdanov, R. I. Atomic force microscopy probing of cell elasticity. Micron. 38 (8), 824-833 (2007).
- Scheuring, S., Dufrene, Y. F. Atomic force microscopy: probing the spatial organization, interactions and elasticity of microbial cell envelopes at molecular resolution. Molecular Microbiology. 75 (6), 1327-1336 (2010).
- Berdyyeva, T. K., Woodworth, C. D., Sokolov, I. Human epithelial cells increase their rigidity with ageing in vitro: direct measurements. Physics in Medicine and Biology. 50 (1), 81-92 (2005).
- Sokolov, I., Dokukin, M. E., Guz, N. V. Method for quantitative measurements of the elastic modulus of biological cells in AFM indentation experiments. Methods. 60 (2), 202-213 (2013).
- Bozna, B. L., et al. Binding strength and dynamics of invariant natural killer cell T cell receptor/CD1d-glycosphingolipid interaction on living cells by single molecule force spectroscopy. Journal of Biological Chemistry. 286 (18), 15973-15979 (2011).
- Flach, T. L., et al. Alum interaction with dendritic cell membrane lipids is essential for its adjuvanticity. Nature Medicine. 17 (4), 479-487 (2011).
- Ng, G., et al. Receptor-independent, direct membrane binding leads to cell-surface lipid sorting and Syk kinase activation in dendritic cells. Immunity. 29 (5), 807-818 (2008).
- Helenius, J., Heisenberg, C. P., Gaub, H. E., Muller, D. J. Single-cell force spectroscopy. Journal of Cell Science. 121 (11), 1785-1791 (2008).
- Litvinov, R. I., Shuman, H., Bennett, J. S., Weisel, J. W. Binding strength and activation state of single fibrinogen-integrin pairs on living cells. Proceedings of the National Academy of Sciences of the United States of America. 99 (11), 7426-7431 (2002).
- Evans, E., Ritchie, K., Merkel, R. Sensitive Force Technique to Probe Molecular Adhesion and Structural Linkages at Biological Interfaces. Biophysics Journal. 68 (6), 2580-2587 (1995).
- Lamprecht, C., Hinterdorfer, P., Ebner, A. Applications of biosensing atomic force microscopy in monitoring drug and nanoparticle delivery. Expert Opinion on Drug Delivery. 11 (8), 1237-1253 (2014).
- Charras, G. T., Horton, M. A. Single cell mechanotransduction and its modulation analyzed by atomic force microscope indentation. Biophysics Journal. 82 (6), 2970-2981 (2002).
- Sun, M. Z., et al. Multiple membrane tethers probed by atomic force microscopy. Biophysics Journal. 89 (6), 4320-4329 (2005).
- Yan, J. C., Liu, B., Shi, Y., Qi, H. Class II MHC-independent suppressive adhesion of dendritic cells by regulatory T cells in vivo. Journal of Experimental Medicine. 214 (2), 319-326 (2017).
- Hao, J. J., et al. Phospholipase C-mediated hydrolysis of PIP2 releases ERM proteins from lymphocyte membrane. Journal of Cell Biology. 184 (3), 451-462 (2009).
- Rodriguez, R. M., et al. Lymphocyte-T Adhesion to Fibronectin (Fn) - a Possible Mechanism for T-Cell Accumulation in the Rheumatoid Joint. Clinical and Experimental Immunology. 89 (3), 439-445 (1992).
- Kimura, A., Ersson, B. Activation of Lymphocytes-T by Lectins and Carbohydrate-Oxidizing Reagents Viewed as an Immunological Recognition of Cell-Surface Modifications Seen in the Context of Self Major Histocompatibility Complex Antigens. European Journal of Immunology. 11 (6), 475-483 (1981).
- Miller, K. The Stimulation of Human Lymphocyte-B and Lymphocyte-T by Various Lectins. Immunobiology. 165 (2), 132-146 (1983).
- Vitte, J., Pierres, A., Benoliel, A. M., Bongrand, P. Direct quantification of the modulation of interaction between cell- or surface-bound LFA-1 and ICAM-1. Journal of Leukocyte Biology. 76 (3), 594-602 (2004).
- Beaussart, A., et al. Quantifying the forces guiding microbial cell adhesion using single-cell force spectroscopy. Nature Protocols. 9 (5), 1049-1055 (2014).
- Shu, F., et al. Cholesterol Crystal-Mediated Inflammation Is Driven by Plasma Membrane Destabilization. Frontiers in Immunology. 9, (2018).
- Hosseini, B. H., et al. Immune synapse formation determines interaction forces between T cells and antigen-presenting cells measured by atomic force microscopy. Proceedings of the National Academy of Sciences of the United States of America. 106 (42), 17852-17857 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados