Method Article
Uso de un sistema inalámbrico de video-eEG para monitorear descargas epiptiformes después de una lesión cerebral traumática inducida por percusión de fluido lateral
En este artículo
Resumen
Aquí presentamos un protocolo para inducir TBI severo con el modelo de lesión de percusión de fluido lateral (FPI) en ratas Macho macho. También demostramos el uso de un sistema de telemetría inalámbrica para recopilar grabaciones continuas de video-EEG y monitorear las descargas epileptiformes consistentes con la epileptogénesis postraumática.
Resumen
El modelo de lesión de percusión de fluido lateral (FPI) está bien establecido y se ha utilizado para estudiar TBI y epilepsia postraumática (PTE). Sin embargo, se ha notificado una considerable variabilidad para los parámetros específicos utilizados en diferentes estudios que han empleado este modelo, lo que dificulta la armonización e interpretación de los resultados entre los laboratorios. Por ejemplo, se ha notificado variabilidad con respecto al tamaño y la ubicación de la craneectomía, cómo se coloca el cubo de bloqueo Luer en relación con la craneectomía, la presión atmosférica aplicada a la dura y la duración del pulso de presión. Cada uno de estos parámetros puede afectar la gravedad de la lesión, que se correlaciona directamente con la incidencia de PTE. Esto se ha manifestado como una amplia gama de tasas de mortalidad, enderezando los tiempos reflejos y la incidencia de convulsiones convulsivas notificadas. Aquí proporcionamos un protocolo detallado para el método que hemos utilizado para ayudar a facilitar la armonización entre los estudios. Utilizamos FPI en combinación con un sistema de telemetría EEG inalámbrico para monitorear continuamente los cambios electrográficos y detectar la actividad de las convulsiones. FpI se induce mediante la creación de una craniectomía de 5 mm sobre el hemisferio izquierdo, entre el Bregma y Lambda y adyacente a la cresta lateral. Un cubo de bloqueo Luer está fijado en el cráneo sobre la craneectomía. Este concentrador está conectado al dispositivo FPI, y un pulso de presión de 20 milisegundos se entrega directamente a la dura intacta a través de tubos de presión conectados al concentrador a través de un conector de bloqueo de torsión. Después de la recuperación, las ratas se vuelven a anestesiar para eliminar el cubo. Cinco tornillos de electrodo EEG de acero inoxidable de 0,5 mm se ponen en contacto con la dura a través del cráneo y sirven como cuatro electrodos de grabación y un electrodo de referencia. Los cables del electrodo se recogen en un conector de pedestal que se fija en su lugar con cemento óseo. Las grabaciones continuas de vídeo/EEG se recopilan durante un máximo de 4 semanas después de TBI.
Introducción
En un informe de 2015 al Congreso, los Centros para el Control de Enfermedades informaron que aproximadamente 2.5 millones de personas por año sufren lesiones cerebrales traumáticas (TBI) en los Estados Unidos1. Se estima que el TBI causa el 20% de las epilepsias sintomáticas y el 5% de todas las epilepsias2,3,4. Además, alrededor del 20% de los pacientes con TBI desarrollan epilepsia postraumática5. Es importante destacar que las convulsiones crónicas y recurrentes que se producen comoconsecuencia de la TBI son a menudo farmacorresistentes, aumentando la carga de la enfermedad 6. Los mecanismos exactos que conducen a la epilepsia postraumática (TEP) siguen sin estar claros. Sin embargo, varios estudios epidemiológicos clave han examinado la incidencia y el riesgo potencial de desarrollar epilepsia postraumática (PTE)2,4,7,8,9 ,10,11. Estos estudios epidemiológicos reforzaron cada uno la correlación de la gravedad de la lesión con el riesgo de epileptogénesis.
Los métodos actuales que se han utilizado ampliamente para identificar nuevas terapias contra la epilepsia han dependido en gran medida de modelos que utilizan quimioconvulsantes o afines eléctricos para inducir la epilepsia12. Dada la alta incidencia de farmacorresistencia a los medicamentos desarrollados en estos modelos por pacientes con TBI, hipotetizar que las convulsiones inducidas por TBI pueden ser diferentes de las convulsiones inducidas por la quimioconvulsiones o la leña y pueden implicar diferentes vías o procesos de epileptogénesis. Por lo tanto, un modelo tBI puede ser más adecuado para el desarrollo de tratamientos que son más eficaces para prevenir la epileptogénesis postraumática.
El modelo de lesión de percusión fluida (FPI) de TBI se ha utilizado durante décadas y es un método bien establecido para investigar tanto TBI como PTE13,14,15,16,17, 18. Sin embargo, como hemos examinado recientemente, hay un alto grado de variabilidad en los métodos FPI reportados en todos los laboratorios19,20. Esta falta de coherencia entre los laboratorios evita la reproducibilidad de los hallazgos preclínicos y hace que la interpretación de los resultados sea un desafío. Como consecuencia, se han aplicado mayores intereses y esfuerzos para establecer una mayor armonización para este tipo de estudios21,22,23,24.
En un esfuerzo por aumentar aún más la coherencia y la armonización entre los laboratorios centrados en el estudio de la epileptogénesis postraumática, proporcionamos aquí una metodología detallada de nuestro enfoque. Hemos informado previamente de una incidencia del 60% de convulsiones convulsivas dentro de las seis semanas después de TBI20graves. Ahora usamos este enfoque para monitorear ratas a partir del día de la lesión y las seguimos continuamente las 24 horas del día durante un máximo de 4 semanas. Hemos optado por utilizar un sistema de telemetría inalámbrica que ofrece varias ventajas. En primer lugar, las ratas son capaces de moverse libremente alrededor de su jaula, y por lo tanto reduce el estrés. En segundo lugar, una reducción en el ruido de la señal como la rata sirve como el suelo. Además, nuestro sistema actual emplea un acelerómetro que detecta el movimiento rápido en los tres planos (X, Y y Z) y puede ser útil para identificar eventos convulsivos de convulsiones. Por último, el sistema de telemetría inalámbrica permite una gestión más sencilla de las ratas, como las inyecciones suplementarias de salina, el pesaje y la realización de puntuaciones de gravedad neurológica, lo que es complicado cuando las ratas están unidas a una amarre. Sin embargo, este enfoque también tiene varias limitaciones. En primer lugar, el costo inicial de un sistema para registrar de hasta ocho ratas simultáneamente puede estar en el rango de $60,000. En segundo lugar, la alimentación está limitada por una fuente de batería. Esto requiere monitoreo diario y reemplazo de baterías. El tiempo necesario entre los cambios de la batería puede verse influenciado por la frecuencia de muestreo. Sin embargo, para una frecuencia de muestreo de 1000 Hz, las baterías suelen cambiarse una vez a la semana. La fuente de alimentación limitada también restringe el sistema a la grabación desde sólo cuatro señales EEG. Por último, la caída de la señal es limitada, pero ocasionalmente ocurre. Sin embargo, este enfoque proporciona un método consistente y confiable para monitorear la epileptogénesis postraumática y puede ayudar en la identificación de nuevos tratamientos terapéuticos.
Protocolo
Todos los procedimientos fueron aprobados por y seguidos por las directrices de la Universidad en Buffalo Institutional Animal Care and Use comité.
1. Lesión de percusión fluida
- Use una bata de laboratorio o una bata quirúrgica, una máscara quirúrgica, guantes quirúrgicos y cubrecabezas y esterilice todas las herramientas y materiales que contacten con el sitio quirúrgico.
- Anestetizar a una rata Wistar de 10-12 semanas de edad, macho (350-400 g) con 3% de isoflurano y 1 L/min de oxígeno en una cámara de inducción de tamaño adecuado para ratas. Retire la rata de la cámara de inducción y muévala al área de preparación una vez que esté inconsciente. Ponga la pomada oftálmica estéril en ambos ojos.
- Afeitar el cabello en la cabeza de la rata con cortadoras eléctricas con una hoja #40 desde justo por encima de los ojos hasta la base caudal de las orejas para producir suficiente campo quirúrgico. Retire cualquier cabello suelto y recortado del sitio.
- Limpie el sitio quirúrgico aplicando un exfoliante de clorohexidina al cuero cabelludo afeitado seguido de un 70% de etanol. Comience en el centro y muévase hacia afuera en círculos concéntricos lejos del sitio de la incisión. Repita este proceso 3 veces. Aplicar la solución Betadine en el sitio de la misma manera y dejar que se seque.
- Coloque la rata anestesia en el marco estereotaxico y mantenga la anestesia en 2-3% de oxígeno isoflurano-1 L/min a través de nosecone. Compruebe si hay pérdida de reflejo de abstinencia de la extremidad posterior y pérdida del reflejo palpebral para asegurarse de que la rata está en un plano quirúrgico de anestesia.
- Controle la frecuencia respiratoria, la frecuencia cardíaca, la temperatura corporal y la saturación de oxígeno durante toda la cirugía. Mantener la frecuencia cardíaca entre 300-400 bpm, y SpO2 por encima del 90%.
NOTA: Un oxímetro de pulso conectado a un pie trasero se puede utilizar para proporcionar la lectura constante de la frecuencia cardíaca y SpO2. Una frecuencia cardíaca superior a 400 lpm indica que la rata no está suficientemente anestesiada. Una almohadilla de calentamiento autorregulable, acoplada a un termómetro rectal, establecida a 37 oC, se puede colocar debajo de la rata durante toda la cirugía para mantener la temperatura corporal. Un estereomicroscopio con una fuente de luz en combinación con una lámpara de fibra óptica son útiles para visualizar el procedimiento. - Utilice una aguja de 23 g para inyectar un 0,5% de clorhidrato de bupivacaína intrador en el cuero cabelludo en el lugar de la incisión para la analgesia local 10 - 15 minutos antes de hacer una incisión.
- Hacer una incisión de línea media de 1,5-2,5 cm a través de la piel y el músculo del cuero cabelludo utilizando una cuchilla de bisturí #10. Retirar la piel y el músculo para exponer el cráneo y proporcionar un campo quirúrgico claro. Refleja la fascia subyacente y el tejido graso lejos del hueso con hisopos de algodón estériles.
NOTA: Una unidad de cauterización eléctrica es útil para lograr una hemostasis rápida. - Afeitar por la cresta lateral del hueso parietal izquierdo usando una cureta quirúrgica para producir una superficie plana lisa de modo que la base del cubo de bloqueo Luer hembra-mujer pueda descansar al ras con el cráneo.
- Irrigar la superficie del cráneo y los tejidos circundantes con 2,0 mg/ml de solución de gentamicina en solución salina estéril. Blot exceso de solución con un hisopos estériles.
- Aplique un 3% de peróxido de hidrógeno en el cráneo para secar el hueso.
NOTA: Si el hueso no está suficientemente seco, el cemento dental no se adhiere correctamente y formará un sello sólido. - Crear un sitio de craneectomía de 5 mm de diámetro a través del hueso parietal izquierdo.
NOTA: Una broca trephine colocada en un taladro eléctrico conectado al marco estereotáctico puede ser útil para iniciar la craneectomía. Utilice un taladro manual con un trephine de 5 mm de diámetro para terminar lentamente la craneectomía a través del hueso restante. Cuando esté cerca de completar la craneectomía, gire la trephine a la inversa para evitar la ruptura de la dura madre subyacente. Habrá un adelgazamiento del cráneo alrededor del perímetro del disco y la solapa del cráneo se sentirá suelta cuando se presione ligeramente. - Retire el colgajo óseo con la cureta quirúrgica y los fórceps de tejido liso.
NOTA: Se puede producir algo de sangrado, pero la hemostásis se puede lograr rápidamente aplicando una presión suave con hisopos de algodón estériles. - Utilice un estereomicroscopio e iluminación para inspeccionar visualmente la dura en busca de cualquier signo de ruptura. Un borde delgado del hueso permanecerá alrededor de la circunferencia del sitio de la craneectomía. Retire suavemente esta llanta con fórceps de tejido liso teniendo cuidado de no romper la dura.
- Swab el cráneo con 70% de etanol para eliminar cualquier polvo óseo y para secar el cráneo.
- Aplica una fina capa de pegamento de gel de cianoacrilato alrededor del borde inferior del cubo de bloqueo Luer y asegúrate de que el cráneo sobre la craniectomía sin obstruir la abertura. Tenga cuidado de no poner el pegamento en contacto con la dura. Además, selle el bloqueo Luer en su lugar con una capa delgada adicional de pegamento alrededor de la base exterior del cubo.
- Prepare una mezcla de cemento dental. Aplique el cemento a la superficie del cráneo alrededor y sobre la base del cubo de bloqueo Luer para asegurarlo en su lugar.
- Llene el cubo de bloqueo Luer con una solución de líquido cefalorraquídeo artificial (CSF) libre de conservantes estériles (pH 7.4) utilizando una jeringa y una aguja para que se pueda ver un bolo convexo de solución salina por encima de la parte superior del borde.
NOTA: La solución mantendrá la dura húmeda a medida que el cemento dental se seca, así como sirve como una indicación de la integridad del sello. Si el nivel de solución cae en absoluto, eso es una indicación de una fuga en el sistema y el bloqueo Luer debe ser eliminado y reemplazado. - Una vez que el cemento dental esté completamente curado, interrumpa la anestesia de gas y retire la rata del marco estereotaxico.
- Coloque la rata en una plataforma junto al dispositivo FPI.
- El dispositivo FPI tiene una punta metálica curva que se extiende desde el transductor de presión al final del depósito de fluidos. Asegure una longitud de 12 cm de tubo de presión hasta el final de la punta curvada con el extremo opuesto terminando en un conector de giro de bloqueo Luer macho de 2 cm. Fije la rata al dispositivo FPI conectando el extremo hembra del cubo del cráneo de la rata al conector macho.
NOTA: Asegúrese de que la conexión esté bien asegurada y de que todas las burbujas de aire se hayan eliminado del sistema. - Coloque al animal en recabencia esternal y compruebe repetidamente la devolución del reflejo de retirada. Tan pronto como la rata recupere el reflejo de abstinencia pero todavía esté sedada, suelte el péndulo del dispositivo FPI para causar un solo pulso de presión de 20 ms e inducir lesiones.
NOTA: Es importante no inducir la lesión mientras el animal está profundamente anestesiado, ya que esto tiende a causar un aumento de la mortalidad debido al edema pulmonar inducido por neurogénicos. Todos los dispositivos muestran variabilidad. Sin embargo, en el dispositivo utilizado para este experimento, una colocación de ángulo de 17o del martillo produce un pulso de presión atmosférica de 2,2 a 2,3. Los animales falsos y no lesionados se someten a todos los mismos procedimientos, con la excepción del pulso de líquido real a la lesión de inducción. - Desconecte inmediatamente la rata del dispositivo FPI después de una lesión, colóquela en recumbencia esternal y proporcione oxígeno suplementario (1 L/min) a través de un cono nasal hasta que vuelva la respiración espontánea. La apnea es una consecuencia anticipada de la lesión. Si es necesario, proporcione respiraciones manuales periódicas a través de una máscara de válvula de bolsa hasta que la rata comience a respirar espontáneamente por sí sola.
NOTA: Por lo general, la apnea dura menos de 2 min. Inmediatamente después de la administración del pulso de presión debido a una ráfaga de catecolaminas se observa un aumento rápido transitorio de la frecuencia cardíaca (>500 ppm). Esto se puede controlar con un oxímetro de pulso unido al pie de la rata y puede servir como un posible indicador de que se ha producido una lesión grave. - Monitorear la rata continuamente y registrar el tiempo de retorno del reflejo de enderece (ambulación estable en las cuatro extremidades).
- La magnitud del pulso de presión atmosférica para cada rata debe estar dentro de las atmósferas de 0,05. Confirme que cada uno de los impulsos de presión produce una señal suave en el osciloscopio con amplitud y duración constantes.
NOTA: Una señal de noterminal puede indicar burbujas de aire en el sistema que deben retirarse antes de emitir el pulso de lesión. Los pulsos de presión atmosférica que producen una lesión grave, en este experimento, son aquellos que normalmente resultan en tiempos de endereso animal de 30-60 min. Este rango de tiempos de endereado se asocia n.o de mortalidad de aproximadamente el 40-50%). - Administrar 10 ml de salina precalentada por vía subcutánea como un cuidado de apoyo.
- Devolver la rata a su jaula de origen y dejar que se recupere durante al menos 4 h.
NOTA: Se ha observado un aumento de la mortalidad cuando las ratas se colocan inmediatamente de nuevo bajo anestesia.
2. Implantación de electrodos corticales EEG y grabación de video-EEG
- A las 4 h después de la lesión, anestesiar a la rata como se describió anteriormente y colocarla de nuevo en el marco estereotáctico para quitar el cubo de bloqueo Luer y el cemento dental.
NOTA: El cubo y el cemento se desprenden fácilmente con una presión moderada. Al retirar el cubo, compruebe cuidadosamente si hay alguna ruptura o daño a la dura. Eutanita irresponsable mente a cualquier animal con daño a la dura. - Aplique una pequeña gota de clorhidrato de bupivacaína al cráneo al 0,5% en cada uno de los lugares donde se perforarán 5 orificios piloto (ver Figura 1).
- Taladre agujeros piloto a través del cráneo con una broca de mano de 0,1 mm.
- Fije un tornillo de electrodo de acero inoxidable en cada orificio piloto en los siguientes lugares: se coloca un tornillo de referencia caudal a la lambda sobre el cerebelo. Los electrodos de registro se colocan: 1) sobre el hemisferio ipsilateral y rostral a la craniectomía; 2) sobre el hemisferio ipsilateral y caudal a la craniectomía; 3) sobre el hemisferio contralateral y rostral a la craneectomía; 4) sobre el hemisferio contralateral y caudal a la craniectomía.
- Swab el cráneo con 70% de etanol para eliminar cualquier polvo óseo.
- Cubra el sitio de la craneectomía con una fina capa de cera ósea estéril para cubrir la dura expuesta.
- Conecte una matriz de electrodos a los 5 electrodos EEG envolviendo el extremo expuesto de un cable de electrodo codificado por colores firmemente alrededor de su tornillo de electrodo de acero inoxidable designado.
NOTA: Los extremos opuestos de cada cable de electrodo se colocan en una ubicación específica y designada dentro del conector del pedestal. - Prepare una mezcla de cemento óseo.
- Recoger los cables del electrodo en una bobina debajo del pedestal y asegurar los cables y el pedestal en su lugar con cemento óseo. Mantenga el pedestal en posición hasta que el cemento óseo se haya curado.
NOTA: El hueso debe ser particularmente seco y vacío de cualquier sangre residual con el fin de lograr una adhesión adecuada y evitar la extracción prematura del transmisor. - Conecte el transmisor inalámbrico con baterías nuevas al pedestal antes de retirar lo animal del marco estereotáctico.
- Coloque el animal en su jaula de origen y coloque la jaula cerca del receptor y en vista de una cámara de video designada. Inicie la grabación de vídeo/EEG.
3. Colección de grabaciones de video-EEG
- Antes de recoger las señales EEG, haga un barrido de frecuencia de la habitación donde las ratas se alojarán para la recolección de EEG para identificar cualquier posible interferencia de frecuencias para evitar la recolección de grabación EEG con cualquier frecuencia que tenga ruido de fondo.
- Establezca todos los transmisores en frecuencias específicas que estén libres de interferencias.
- Ajuste la frecuencia de muestreo y el rango de entrada de cada transmisor programable.
NOTA: Esto se puede hacer utilizando una herramienta inteligente proporcionada por el fabricante del sistema. Los transmisores pueden muestrear a una velocidad máxima de 1000 Hz y un rango de entrada máximo de 10 mV. En este experimento, se analizaron grabaciones de EEG entre 0,5 Hz y 30 Hz. Por lo tanto, la frecuencia de muestreo se fijó en 250 Hz. Normalmente observamos Amplitudes de menos de 1 mV. Por lo tanto, el rango de entrada establecido estaba en 2 mV. - Utilice el software de recopilación EEG proporcionado por el fabricante para grabar continuamente video-EEG a partir del día de la lesión que vincula cada transmisor inalámbrico a través de una frecuencia única a un receptor específico.
NOTA: Cada par de receptores de transmisor es capaz de monitorear 4 canales EEG monopolares, y la aceleración en los planos X, Y y Z. Los datos de EEG se pueden escribir en un servidor de almacenamiento. Los datos de vídeo deben guardarse en un dispositivo NAS vinculado al servidor de almacenamiento. El software de análisis EEG sincroniza la grabación de vídeo y EEG en función del tiempo mantenido por el servidor de almacenamiento. - Utilice el software de recopilación de vídeo para grabar vídeo de cada rata con su propia cámara de resolución de 2 MP (1920 x 1080) configurada para grabar a 30 fotogramas/s.
NOTA: Cada cámara tiene su propia iluminación infrarroja para la colección de vídeo por la noche. - Configure el sistema para guardar automáticamente todas las grabaciones de vídeo y EEG en un servidor de almacenamiento cada 24 horas. Los vídeos producen archivos bastante grandes.
4. Análisis de vídeo/EEG
- Sincronice el vídeo con cada grabación EEG con una resolución de 1/10 s. Para ello, utilice el software de análisis de vídeo/EEG de los fabricantes del sistema que crea un metarchivo con el sello del tiempo preciso tanto del EEG como del vídeo.
- Captura de pantalla manual a través de grabaciones EEG para identificar eventos de índice que definen la actividad de decomiso.
- Usando el software de análisis de vídeo/EEG y los eventos EEG de índice, cree un archivo de configuración que utilice parámetros clave (es decir, potencia en bandas de frecuencia específicas, la relación de las bandas de frecuencia con la potencia total, umbral de aceleración, etc.) para definir las características de los posibles eventos de convulsiones.
- Ejecute el software de análisis EEG para identificar las regiones potenciales de grabación EEG que califican en función de los parámetros seleccionados en el archivo de configuración.
NOTA: El software de análisis EEG permite la detección automática de convulsiones y resalta las regiones de interés en las señales EEG y proporciona análisis del espectro de potencia FFT a través de la señal. - Confirme posibles convulsiones convulsivas mediante el uso de grabaciones de vídeo recogidas durante la adquisición, que se sincronizan con las grabaciones EEG respectivas de cada rata.
Resultados
Con este modelo, inducimos TBI severo en ratas adultas, machos, Wistar. En las condiciones que describimos aquí, normalmente observamos las tasas de mortalidad de 40-50%, y los tiempos reflejos de enderedo de 30 - 60 min como se describió anteriormente20. Pudimos recoger grabaciones de video/EEG 24 h/día a partir del día de la lesión. En la Figura 1A se muestra un diagrama que muestra la ubicación de cuatro electrodos EEG monopolares y un único electrodo dereferencia. Las imágenes que demuestran la ubicación y la apariencia de las lesiones TBI esperadas con las condiciones descritas aquí se muestran en la Figura 1B-D. En las condiciones descritas aquí, observamos constantemente la desaceleración delta dentro de los primeros tres días después de TBI. Las ratas menos gravemente heridas presentan una desaceleración delta unilateral e intermitente (Figuras2C-D). Por el contrario, se observa una desaceleración delta bilateral continua después de lesiones más graves (Figura3C-D). Se observó consistentemente cierto grado de desaceleración delta en todas las ratas TBI, pero no se detectó en ratas de control operadas por farsa (solo craneectomía) (Figuras2A-B; 3A-B). Durante los tres primeros días después de la lesión en la mayoría de las ratas TBI se observó consistentemente una desaceleración delta extensa. Curiosamente, las ratas suelen mostrar una pérdida de peso pronunciada durante los primeros tres días después de la lesión. Ocasionalmente se observan convulsiones no convulsivas en la primera semana después de TBI (Figura4 C-D). Las convulsiones clínicas, que se presentan como racimos de picos asociados con la crianza y caída, así como el clono del antebrazo se pueden observar después de 1 semana después de TBI (Figura5C-D). Por último, la Figura 6 presenta imágenes representativas de la caída de la señal intermitente ocasional y la pérdida de señal debido a un fallo de la batería.
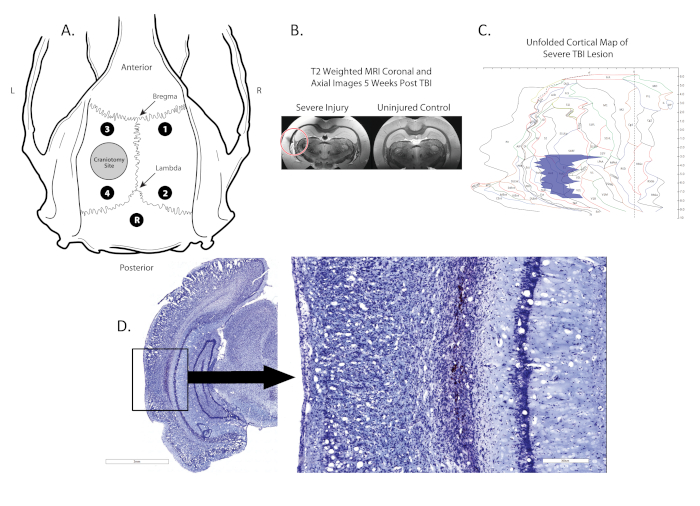
Figura 1 . Localización de la craneectomía, la colocación de electrodos y la lesión. (A) muestra un diagrama esquemático del cráneo de rata con las ubicaciones de la craneectomía (círculo gris en el hemisferio izquierdo), cuatro electrodos monopolares (puntos negros; 1,2,3,4) situados entre el Bregma y Lambda y un electrodo de referencia (punto negro, R) colocado en la línea media, posterior a la lambda; (B) muestra las resonancias magnéticas T2 coronales post mortem con la ubicación de la lesión identificada por un círculo rojo; (C) muestra un mapa 2D de la corteza donde se identifica la ubicación y el tamaño de la lesión (región azul). (D) muestra una sección coronal teñida de Nissl con la lesión en caja, la lesión es 100x magnificada en la imagen de la derecha. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2 . Desaceleración delta unilateral e intermitente recogida el día de un TBI moderado. (A) muestra un rastro de EEG de 90 s de una rata de control inoperal operada por una farsa el día de la cirugía. Se presentan los cuatro canales. Un rastro largo de 10 s (tomado de la región en caja) se extrajo del 3er canal para visualizar mejor el patrón EEG de línea base. A continuación, se seleccionó una sección EPOC de 2048 ms para ser analizada en el FFT correspondiente. (B) Análisis FFT de 2048 ms seleccionado EPOC de la farsa no lesionada operado animal en el día de la cirugía. (C) muestra un rastro de EEG de 90 s, que demuestra el patrón de ralentización delta unilateral intermitente de un animal moderadamente herido el día de la lesión. Un rastro largo de 10 s (tomado de la región en caja) fue extraído del 3er canal para visualizar mejor el patrón EEG de ralentización delta. A continuación, se seleccionó una sección EPOC de 2048 ms para ser analizada en el FFT correspondiente. (D) Análisis FFT de 2048 ms seleccionado EPOC del animal TBI moderado el día de la lesión. 90 s eEG trazas, de arriba a abajo son biopotenciales 1, 2, 3, 4, correspondientes a sus ubicaciones alrededor del sitio de la craneectomía como se ve en la Figura 1. Las marcas verticales grises definen intervalos de 1 s en las trazas EEG. Todas las trazas de EEG se muestran en una escala de (500 V). Dentro de los gráficos de análisis FFT, el rango de frecuencia analizado general fue de 0,5-30 Hz. Esto se dividió en 4 bandas de frecuencia separadas de Delta (amarillo, 0.5-4 Hz), Theta (púrpura, 4-8 Hz), alfa (rojo, 8-12 Hz) y beta (verde, 12-30 Hz). El gráfico % (Potencia) que se muestra en el análisis FFT indica qué porcentaje de la potencia total en el EPOC analizado proviene de cada banda de frecuencia especificada anteriormente, lo que permite una mayor caracterización matemática de los patrones de forma de onda EEG. Haga clic aquí para ver una versión más grande de esta figura.
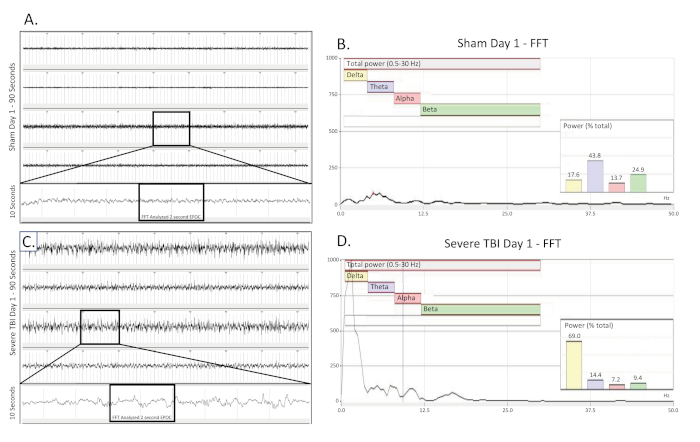
Figura 3 . Desaceleración delta bilateral y continua recogida el día de un TBI severo. (A) muestra un rastro de EEG de 90 s de una rata de control inoperal operada por una farsa el día de la cirugía. Se presentan los cuatro canales. Un rastro largo de 10 s (tomado de la región en caja) se extrajo del 3er canal para visualizar mejor el patrón EEG de línea base. A continuación, se seleccionó una sección EPOC de 2048 ms para ser analizada en el FFT correspondiente. (B) Análisis FFT de 2048 ms seleccionado EPOC de la farsa no lesionada operado animal en el día de la cirugía. (C) muestra un rastro de EEG de 90 s, que demuestra el patrón de desaceleración delta bilateral continua de un animal gravemente herido el día de la lesión. Un rastro largo de 10 s (tomado de la región en caja) fue extraído del 3er canal para visualizar mejor el patrón EEG de ralentización delta. A continuación, se seleccionó una sección EPOC de 2048 ms para ser analizada en el FFT correspondiente. (D) análisis FFT de 2048 ms seleccionado EPOC del animal TBI grave el día de la lesión. 90 s eEG trazas, de arriba a abajo son biopotenciales 1, 2, 3, 4, correspondientes a sus ubicaciones alrededor del sitio de la craneectomía como se ve en la Figura 1. Las marcas verticales grises definen intervalos de 1 s en las trazas EEG. Todas las trazas de EEG se muestran en una escala de 500 V. Dentro de los gráficos de análisis FFT, el rango de frecuencia analizado general fue de 0,5-30 Hz. Esto se dividió en 4 bandas de frecuencia separadas de Delta (amarillo, 0.5-4 Hz), Theta (púrpura, 4-8 Hz), alfa (rojo, 8-12 Hz) y beta (verde, 12-30 Hz). El gráfico % (Potencia) que se muestra en el análisis FFT indica qué porcentaje de la potencia total en el EPOC analizado proviene de cada banda de frecuencia especificada anteriormente, lo que permite una mayor caracterización matemática de los patrones de forma de onda EEG. Haga clic aquí para ver una versión más grande de esta figura.
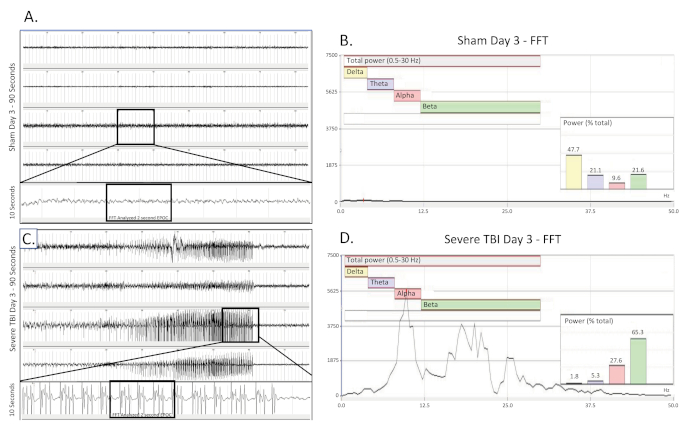
Figura 4 . Convulsiones electrográficas no convulsivas recogidas 3 días después de TBI grave. (A) muestra un rastro de EEG de 90 s de una rata de control falsa, operada por una farsa, sin lesiones 3 días25 después de la cirugía. Se presentan los cuatro canales. Un rastro largo de 10 s (tomado de la región en caja) se extrajo del 3er canal para visualizar mejor el patrón EEG de línea base. A continuación, se seleccionó una sección EPOC de 2048 ms para ser analizada en el FFT correspondiente. (B) Análisis FFT de 2048 ms seleccionado EPOC de la farsa no lesionada operado animal en el día tres25 después de la cirugía. (C) muestra un rastro de EEG de 90 s tres 25 días después de una lesión grave. Este espectáculo de construcción, patrón de pico rápido presente bilateralmente y a través de los 4 canales de recolección. Un rastro largo de 10 s (tomado de la región en caja) fue extraído del 3er canal para visualizar mejor el patrón EEG de pico. A continuación, se seleccionó una sección EPOC de 2048 ms para ser analizada en el FFT correspondiente. (D) análisis FFT de 2048 ms seleccionado EPOC del animal TBI grave el día de la lesión. 90 s eEG trazas, de arriba a abajo son biopotenciales 1, 2, 3, 4, correspondientes a sus ubicaciones alrededor del sitio de la craneectomía como se ve en la Figura 1. Las marcas verticales grises definen intervalos de 1 s en las trazas EEG. Todas las trazas de EEG se muestran en una escala de 500 V. Dentro de los gráficos de análisis FFT, el rango de frecuencia analizado general fue de 0,5-30 Hz. Esto se dividió en 4 bandas de frecuencia separadas de Delta (amarillo, 0.5-4 Hz), Theta (púrpura, 4-8 Hz), alfa (rojo, 8-12 Hz) y beta (verde, 12-30 Hz). El gráfico % (Potencia) que se muestra en el análisis FFT indica qué porcentaje de la potencia total en el EPOC analizado proviene de cada banda de frecuencia especificada anteriormente, lo que permite una mayor caracterización matemática de los patrones de forma de onda EEG. Haga clic aquí para ver una versión más grande de esta figura.
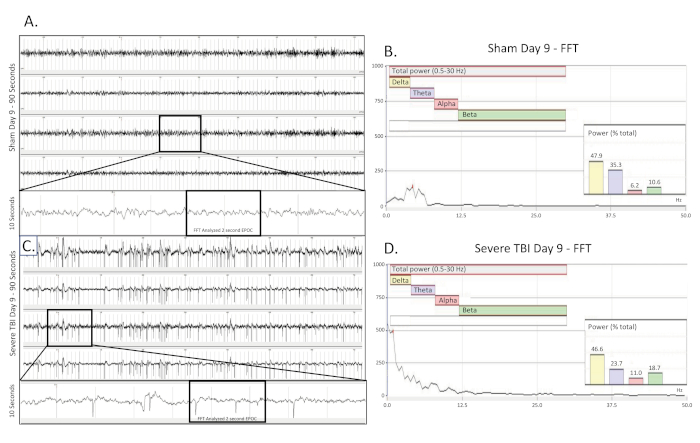
Figura 5 . Convulsiones electrográficas convulsivas recogidas 9 días después de TBI. (A) muestra un rastro de EEG de 90 s de una rata de control incondoyutoria operada por falso nueve (9) días después de la cirugía. Se presentan los cuatro canales. Un rastro largo de 10 s (tomado de la región en caja) se extrajo del 3er canal para visualizar mejor el patrón EEG de línea base. A continuación, se seleccionó una sección EPOC de 2048 ms para ser analizada en el FFT correspondiente. (B) Análisis FFT de 2048 ms seleccionado EPOC de la farsa no lesionada operado animal en el día nueve (9) después de la cirugía. (C) muestra un rastro de EEG de 90 s nueve (9) días después de una lesión grave. Este espectáculo de construcción, patrón de pico rápido presente bilateralmente y a través de los 4 canales de recolección. Un rastro largo de 10 s (tomado de la región en caja) fue extraído del 3er canal para visualizar mejor el patrón EEG de pico. A continuación, se seleccionó una sección EPOC de 2048 ms para ser analizada en el FFT correspondiente. (D) Análisis FFT de 2048 ms seleccionado EPOC del animal TBI grave nueve (9) días después de la lesión. 90 s eEG trazas, de arriba a abajo son biopotenciales 1, 2, 3, 4, correspondientes a sus ubicaciones alrededor del sitio de la craneectomía como se ve en la Figura 1. Las marcas verticales grises definen intervalos de 1 s en las trazas EEG. Todas las trazas de EEG se muestran en una escala de 500 V. Dentro de los gráficos de análisis FFT, el rango de frecuencia analizado general fue de 0,5-30 Hz. Esto se dividió en 4 bandas de frecuencia separadas de Delta (amarillo, 0.5-4 Hz), Theta (púrpura, 4-8 Hz), alfa (rojo, 8-12 Hz) y beta (verde, 12-30 Hz). El gráfico %(Power) que se muestra en el análisis FFT indica qué porcentaje de la potencia total en el EPOC analizado proviene de cada banda de frecuencia especificada previamente, lo que permite una mayor caracterización matemática de los patrones de forma de onda EEG. Haga clic aquí para ver una versión más grande de esta figura.
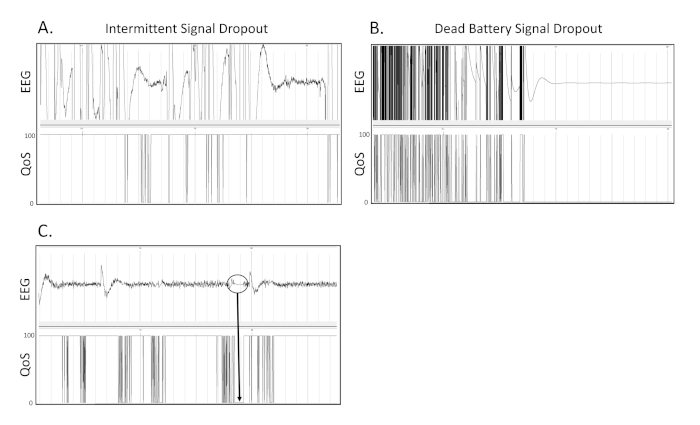
Figura 6 . Caída de la señal. Estos son 3 ejemplos separados de qué caída de señal debido a los problemas del transmisor o del receptor aparece como en la grabación EEG. (A) Este es un ejemplo de abandono intermitente de la señal EEG en una grabación. (B) Este es un ejemplo de abandono debido a un fallo de la batería durante la telemetría inalámbrica continua aparece como en un seguimiento EEG. (C) Dentro de la región en círculo, se puede ver que cuando la calidad de la señal (QoS) cae de 100 a 0, el trazado EEG se aplana y se estanca a 0 V. Las marcas verticales grises definen intervalos de 1 s en las trazas EEG. Todas las trazas de EEG se muestran en una escala de 500 V. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Se ha notificado una variabilidad considerable entre los laboratorios con respecto a los parámetros y métodos específicos utilizados para el FPI TBI modelo 14,26,27,28. Estas incoherencias han dado lugar a resultados contradictorios y dificultan la armonización de los esfuerzos y resultados entre los laboratorios. Aquí, hemos presentado una metodología detallada que describe nuestro enfoque de la grabación continua a largo plazo de video/EEG para monitorear la actividad epileptiforme postraumática. Una serie de pasos son críticos para generar resultados reproducibles con el método descrito.
En primer lugar, dado que la incidencia de epilepsia postraumática se correlaciona con la gravedad de la lesión, aplique condiciones que resulten en el TBI más grave. Específicamente, utilice una craniectomía de 5 mm para asegurarse de que una zona suficientemente grande de dura está expuesta. Además, asegure un dispositivo de bloqueo Luer hembra-mujer en la superficie del cráneo, con la abertura colocada directamente sobre la craneectomía. Esto difiere de otros laboratorios que han utilizado una craniectomía más pequeña (3 mm) y/o colocado un cubo de aguja modificado dentro de la craniectomía, lo que reduce efectivamente el tamaño de apertura. Al colocar el candado Luer fuera de la craniectomía, se mantiene la abertura de 5 mm. Estos parámetros específicos afectan a la fuerza global aplicada a la dura. La presión atmosférica aplicada a la dura también tiene un impacto importante en la gravedad de la lesión observada. Desafortunadamente, la presión atmosférica es muy variable y parece depender del dispositivo. Algunos laboratorios han reportado la aplicación de un pulso de presión de 8 - 10 ms18. Por el contrario, el método descrito aquí da como resultado un pulso de presión de 20 ms. Esto es consistente con otros laboratorios que parecen generar lesiones más graves 14,28. Está claro que el pulso de presión que induce lesiones es un parámetro que muestra una variabilidad considerable entre los laboratorios y debe definirse empíricamente. Sin embargo, la gravedad de la lesión puede determinarse en función de una combinación de las tasas de mortalidad (40-50%), los tiempos reflejos de enderedo (>30 min)26. También es fundamental que sólo los animales con una dura intacta sean incluidos en el estudio. Además, si la craneectomía está ocluida por cualquier pegamento o cemento de tal manera que parte de la dura debajo de la craniectomía no esté expuesta a toda la fuerza del pulso de presión del fluido, entonces el animal debe ser eliminado del estudio. Además, el exceso de pegamento debajo de la cerradura Luer puede adherirse a la dura y quitarlo con la tapa de cemento incluso después de una lesión exitosa. Finalmente, la forma suave de la curva de pulso de presión en el trazado del osciloscopio da la indicación de que no hay burbujas de aire en la cámara de fluidos e indica que el émbolo se mueve sin impedancia.
La anestesia es otro factor crítico que debe ser controlado. La exposición al isoflurano debe mantenerse en los niveles más bajos posibles para mantener un plano quirúrgico de la anestesia. Las ratas expuestas a niveles más altos de isoflurano o durante largas duraciones son más propensas a desarrollar edema pulmonar inducido por neurogénicos. La preparación del cráneo representa otro aspecto crítico del método. Particularmente, secar el cráneo y eliminar cualquier polvo óseo ayuda a evitar que las ratas retiren el transmisor prematuramente.
La colocación de tornillos y la conexión de los cables EEG son obviamente críticos para producir grabaciones reproducibles consistentemente. Es importante que los tornillos no se colocan demasiado profundamente como para inducir una lesión en el cerebro. El colgajo óseo recuperado de la craniectomía de ratas Macho macho súbditos adultos (12 semanas de edad) es consistentemente de 2 mm de espesor. Utilice tornillos de electrodo EEG con un eje de 2,5 mm. Es útil utilizar las puntas de fórceps hemostáticos de mosquito curvo como un espaciador para asegurarse de que los tornillos sólo se extienden a la base del hueso y no sobresalen en el cerebro.
El enfoque que se presenta aquí tiene algunas limitaciones. Las baterías deben cambiarse regularmente. La frecuencia de los cambios de la batería depende de la frecuencia de muestreo. Las baterías se cambian normalmente una vez a la semana para una frecuencia de muestreo de 1000 Hz. Este período de tiempo se puede ampliar reduciendo la frecuencia de muestreo. El sistema también se limita a la grabación de cuatro electrodos EEG monopolares. Sin embargo, esto proporciona dos canales por hemisferio y puede diferenciar entre eventos focales y generalizados y puede diferenciar entre cambios anteriores y posteriores. A pesar de estas limitaciones, este enfoque proporciona un método razonable para llevar a cabo la supervisión continua de video/EEG y la detección de cambios epileptiformes después de tBI severo.
El método descrito aquí da lugar a convulsiones electrográficas y convulsivas dentro de un mes después de TBI. Por lo tanto, este enfoque proporciona un plazo razonable para estudiar las terapias potenciales para prevenir la epileptogénesis después de la TBI grave. Este enfoque también proporciona un método para investigar los mecanismos moleculares asociados con la ETE y puede conducir a la identificación de posibles biomarcadores que se pueden utilizar para identificar a los pacientes que están en mayor riesgo de desarrollar TeP.
Divulgaciones
Chelasea R Richardson es un empleado de emka Scientific, el proveedor de este sistema de telemetría inalámbrica descrito.
Agradecimientos
Queremos agradecer a Paul Dressel su inestimable apoyo en el diseño gráfico y la preparación de figuras.
Materiales
| Name | Company | Catalog Number | Comments |
| 1.00 mm Drill Bits | Drill Bit City: New Carbide Tools | 05M200 | |
| 3M ESPE Durelon Carboxylate Cement | 3M , Neuss Germany | 38019 | Dental Cement |
| 4-0 Suture | Ethicon, Sommerville, NJ | K831H | 4-0 Ethicon Perma-hand Silk, 26mm 1/2c Taperpoint, 30" (75cm), Black Braided non-absorbable suture |
| 5 mm outer diameter trephine | Fine Science Tools | 18004-50 | |
| Bonewax | Medline Industries, Mendelcin, IL | REF DYNJBW25 | |
| Buprenorphine HCL, Injection (0.3 mg/mL) 1 mL vial | Par Pharmalogical, Chestnut Ridge NY | 3003706 | NDC 42023-179-01 |
| Dumont #6 Forceps | Fine Science Tools | 11260-20 | |
| Dumont #7b Forceps | Fine Science Tools | 11270-20 | |
| ecgAUTO | EMKA Technologies, Falls Church, VA | ||
| Female Luer Thread Style Coupler Clear Polycarbonare | Cole-Palmer instrument | SKO#45501-22 | Order lot #214271 |
| Foot Power Drill | Grobet USA, Carlstadt, NJ | Model C-300 | |
| GentaMax 100 (Gentamicin, Sulfate Solution) | Phoenix, Manufactured by Clipper Distributing Company LLC, St. Joseph, MO | NDC 57319-520-05 | |
| Hill's Prescription Diet a/d Canine/Feline | Hill's Pet Nutrition, Inc. , Topeka, KS | ||
| IOX2 Software | EMKA Technologies, Falls Church, VA | ||
| Isoflorane, USP | Piramal Enterprise Limited, Andhra, India | NDC 66794-013-25 | |
| IsoTech Anesthesia machine | SurgiVet | WWV9000 | |
| Lateral FPI device | AmScien | 302 | curved tip, with pressure tubing extension. connected via screw lock connector (Cole-Palmer; #4550-22) |
| Leica A60 Stereomicroscope | Leica Biosystems, Richmond, VA | PN: 10 450 488 | |
| Marcaine (0.5%) Bupivacaine hcl injection usp 5 mg/mL | Hospira, Lake Forest, IL | CA-3627 | 50mL multiple dose vial; NDC 0409-1610-50 |
| Micro-Adson Forceps | Fine Science Tools | 11018-12 | |
| Olsen-Hegar Needle Holders with Suture Cutters | Fine Science Tools | 12002-14 | |
| PALACOS R+G bone cement with gentamicin | Heraeus, | REF: 5036964 | Radiopaque bone cement containing 1 x 0.5g Gentamicin |
| Physio Suite | Kent Scientific, Terrington, CT | ||
| Povidone-iodine solution | Betadine | ||
| Puralube Vet Ointment | Dechra Veterinary Products, Overland Park KS | NDC 17033-211-38 | |
| Scalpel blade (#10) and holder | Integra Miltex, York, PA | REF: 4-110 | |
| Scalpel Handle - #4 | Fine Science Tools | 10004-13 | |
| Sickle Knife | Bausch + Lomb Storz Instruments | N1705 HM | 5mm curved blade. Round handle. Overall length 168mm, 6.6 inches. |
| Silverstein Micro Mirror | Bausch + Lomb Storz Instruments | N1706 S8 | 3mm diameter. Angled 45 degrees. Overall length 180mm, 7.2 inches |
| Storage NAS | Synology Inc. | DS3615xs | |
| Synology Assistant | Synology Inc. | ||
| Thermal Cautery Unit | Geiger Medical Technology, Delasco Council Bluffs, IA | Model NO: 150 | |
| Vetivex | Dechra Veterinary Products, Overland Park KS | Veterinary pHyLyteTM Injection pH 7.4 (Multiple Electrolytes Injection, Type 1, USP) | |
| Video Cameras | TRENDnet, Torrance, CA | TV-IP314PI | Indoor/Outdoor 4MP H.265 WDR PoE IR Bullet Network Cameral |
| Video NAS | Synology Inc. | DS916 | |
| Wistar IGS rats | Charles River | strain code 003 | 12 wk old at the time of injury |
| Wullstein Retractor | Fine Science Tools | 17018-11 |
Referencias
- Flanagan, S. R. Invited Commentary on Centers for Disease Control and Prevention Report to Congress: Traumatic Brain Injury in the United States: Epidemiology and Rehabilitation. Archives of Physical Medicine and Rehabilitation. 96, 1753-1755 (2015).
- Annegers, J. F., Coan, S. P., Hauser, W. A., Leestma, J., Duffell, W., Tarver, B. Epilepsy, vagal nerve stimulation by the NCP system, mortality, and sudden, unexpected, unexplained death. Epilepsia. 39, 206-212 (1998).
- Lowenstein, D. H. Epilepsy after head injury: an overview. Epilepsia. 50, 4-9 (2009).
- Englander, J., et al. Analyzing risk factors for late posttraumatic seizures: a prospective, multicenter investigation. Archives of Physical Medicine and Rehabilitation. 84, 365-373 (2003).
- Faul, M. X. L., Wald, M. M., Coronado, V. G. Traumatic Brain Injury in the United States: Emergency Department Visits, Hospitalizations and Deaths 2002-2006. Centers for Disease Control and Prevention, National Center for Injury Prevention and Control. , (2010).
- Herman, S. T. Epilepsy after brain insult: targeting epileptogenesis. Neurology. 59, 21-26 (2002).
- Annegers, J. F., Coan, S. P. The risks of epilepsy after traumatic brain injury. Seizure. 9, 453-457 (2000).
- Christensen, J., Pedersen, M. G., Pedersen, C. B., Sidenius, P., Olsen, J., Vestergaard, M. Long-term risk of epilepsy after traumatic brain injury in children and young adults: a population-based cohort study. Lancet. 373, 1105-1110 (2009).
- Webb, T. S., Whitehead, C. R., Wells, T. S., Gore, R. K., Otte, C. N. Neurologically-related sequelae associated with mild traumatic brain injury. Brain Injury. 29, 430-437 (2015).
- Mahler, B., Carlsson, S., Andersson, T., Adelow, C., Ahlbom, A., Tomson, T. Unprovoked seizures after traumatic brain injury: A population-based case-control study. Epilepsia. 56, 1438-1444 (2015).
- Wang, H., et al. Post-traumatic seizures--a prospective, multicenter, large case study after head injury in China. Epilepsy Research. 107, 272-278 (2013).
- Simonato, M., French, J. A., Galanopoulou, A. S., O'Brien, T. J. Issues for new antiepilepsy drug development. Current Opinion in Neurology. 26, 195-200 (2013).
- Xiong, Y., Mahmood, A., Chopp, M. Animal models of traumatic brain injury. Nature Review Neuroscience. 14, 128-142 (2013).
- Kharatishvili, I., Nissinen, J. P., McIntosh, T. K., Pitkanen, A. A model of posttraumatic epilepsy induced by lateral fluid-percussion brain injury in rats. Neuroscienc. 140, 685-697 (2006).
- McIntosh, T. K., et al. Traumatic brain injury in the rat: characterization of a lateral fluid-percussion model. Neuroscience. 28, 233-244 (1989).
- Thompson, H. J., et al. Lateral fluid percussion brain injury: a 15-year review and evaluation. Journal of Neurotrauma. 22, 42-75 (2005).
- Curia, G., Eastman, C. L., Miller, J. W., D'Ambrosio, R., Laskowitz, D., Grant, G. Modeling Post-Traumatic Epilepsy for Therapy Development. Translational Research in Traumatic Brain Injury. , (2016).
- D'Ambrosio, R., Fairbanks, J. P., Fender, J. S., Born, D. E., Doyle, D. L., Miller, J. W. Post-traumatic epilepsy following fluid percussion injury in the rat. Brain. 127, 304-314 (2004).
- Saatman, K. E., et al. Classification of traumatic brain injury for targeted therapies. Journal of Neurotrauma. 25, 719-738 (2008).
- Smith, D., Brooke, D., Wohlgehagen, E., Rau, T., Poulsen, D. Temporal and Spatial Changes in the Pattern of Iba1 and CD68 Staining in the Rat Brain Following Severe Traumatic Brain Injury. Modern Research in Inflammation. 4, 9-23 (2015).
- Ndode-Ekane, X. E., et al. Harmonization of lateral fluid-percussion injury model production and post-injury monitoring in a preclinical multicenter biomarker discovery study on post-traumatic epileptogenesis. Epilepsy Research. 151, 7-16 (2019).
- Ciszek, R., et al. Informatics tools to assess the success of procedural harmonization in preclinical multicenter biomarker discovery study on post-traumatic epileptogenesis. Epilepsy Research. 150, 17-26 (2019).
- Immonen, R., et al. Harmonization of pipeline for preclinical multicenter MRI biomarker discovery in a rat model of post-traumatic epileptogenesis. Epilepsy Research. 150, 46-57 (2019).
- Kamnaksh, A., et al. Harmonization of pipeline for preclinical multicenter plasma protein and miRNA biomarker discovery in a rat model of post-traumatic epileptogenesis. Epilepsy Research. 149, 92-101 (2019).
- Redell, J. B., Moore, A. N., Ward, N. H., Hergenroeder, G. W., Dash, P. K. Human traumatic brain injury alters plasma microRNA levels. Journal of Neurotrauma. 27, 2147-2156 (2010).
- Smith, D., et al. Convulsive seizures and EEG spikes after lateral fluid-percussion injury in the rat. Epilepsy Research. 147, 87-94 (2018).
- Eastman, C. L., Fender, J. S., Temkin, N. R., D'Ambrosio, R. Optimized methods for epilepsy therapy development using an etiologically realistic model of focal epilepsy in the rat. Experimental Neurology. 264, 150-162 (2015).
- Shultz, S. R., et al. Can structural or functional changes following traumatic brain injury in the rat predict epileptic outcome. Epilepsia. 54, 1240-1250 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados