Method Article
Una tarea de asociación de recompensa de olor de bajo costo para pruebas de aprendizaje y memoria
En este artículo
Resumen
Se utilizó una tarea de aprendizaje asociativo de recompensa olfativa para investigar los efectos diferenciales de la manipulación fisiológica en la memoria a largo y corto plazo.
Resumen
Los paradigmas conductuales robustos y simples de la memoria apetitiva y asociativa son cruciales para los investigadores interesados en los mecanismos celulares y moleculares de la memoria. En este artículo, se describe un protocolo de comportamiento de ratón eficaz y de bajo costo para examinar los efectos de la manipulación fisiológica (como la infusión de agentes farmacológicos) sobre la tasa de aprendizaje y la duración de la memoria de recompensa por olor. Se proporcionan resultados representativos de un estudio que examina el papel diferencial de la actividad del receptor de tirosina quinasa en la memoria a corto plazo (STM) y a largo plazo (LTM). Los ratones machos fueron condicionados para asociar una recompensa (gránulo de azúcar) con uno de los dos olores, y su memoria para la asociación se probó 2 o 48 h más tarde. Inmediatamente antes del entrenamiento, se administró un inhibidor del receptor de tirosina cinasa (Trk) o infusiones de vehículos en el bulbo olfatorio (OB). Aunque no hubo ningún efecto de la infusión sobre la tasa de aprendizaje, el bloqueo de los receptores Trk en el OB alteró selectivamente la LTM (48 h), y no la memoria a corto plazo (STM; 2 h). El deterioro de LTM se atribuyó a la disminución de la selectividad del olor medida por la duración del tiempo de excavación. La culminación de los resultados de este experimento demostró que la activación del receptor Trk en el OB es la clave en la consolidación de la memoria olfativa.
Introducción
Los mecanismos de formación de la memoria asociativa se han investigado previamente principalmente sobre la base de estudios de condicionamiento del miedo de un ensayo. Sin embargo, muchas tareas mundanas suelen tener patrones de adquisición más complejos y se basan en encuentros repetidos. El objetivo de este protocolo es proporcionar un paradigma de comportamiento de roedores rentable que se utilice para comprender los mecanismos celulares y moleculares del aprendizaje apetitivo y la memoria de múltiples ensayos.
El aprendizaje de olores que depende del bulbo olfativo principal (OB) proporciona varias ventajas para el estudio de la memoria apetitiva de múltiples ensayos. En primer lugar, las memorias dependientes de OB tienen duraciones variables (STM, LTM y memoria a medio plazo1) y dependen del mismo mecanismo molecular 2,3 y estructural que en otras partes del cerebro, incluida la neuromodulación4, la potenciación a largo plazo5 y la neurogénesis adulta 6,7,8. En segundo lugar, en contraste con las regiones de orden superior, como el hipocampo, las memorias dependientes de OB permiten observar una correspondencia más directa entre las manipulaciones del experimentador del entorno perceptivo y los cambios en los circuitos neuronales responsables del aprendizaje 8,9,10,11 . En este artículo, se detalla un paradigma de aprendizaje asociativo y memoria dependiente de OB, que se puede utilizar para estudiar los mecanismos moleculares y estructurales generales. Fue desarrollado para permitir a los investigadores acceder a las ventajas del aprendizaje olfativo para el estudio de los mecanismos celulares y moleculares de la memoria.
En nuestra reciente publicación3, se utilizó el protocolo descrito aquí para demostrar que la consolidación del aprendizaje del olor apetitivo depende de la activación del receptor Trk dentro del OB. En el siguiente protocolo, también se discuten las áreas en las que el paradigma conductual se puede ajustar para diferentes necesidades experimentales.
En este estudio se utilizaron 27 ratones machos CD-1 adultos, de 8 semanas de edad en el momento de la canulación. Para conocer las distribuciones precisas de los grupos y el uso del conjunto de olores, consulte la sección de métodos de nuestra publicación anterior3. Se utilizaron ratones macho para evitar grandes fluctuaciones en los niveles de estrógeno debido a investigaciones previas12 que mostraron que la memoria olfativa mejora con el aumento de los niveles de estrógeno. Estos ratones siempre se mantuvieron en un ciclo inverso de luz/oscuridad de 12:12 h y tuvieron acceso al agua. Durante los experimentos conductuales, las dietas de los ratones se restringieron para mantenerlos en ~ 90% de su peso libre de alimentación. La restricción de la dieta comenzó 3 días antes del comienzo del experimento conductual. Como se describirá a continuación, al mismo conjunto de ratones se les presentan diferentes conjuntos de olores con el fin de alcanzar los niveles adecuados de potencia estadística y minimizar el uso animal. La sección de análisis estadístico muestra cómo tener en cuenta la varianza aleatoria que puede ser introducida por esto.
Protocolo
El protocolo a continuación se adhiere a las pautas de cuidado animal de la IACUC en Earlham College.
1. Canulación de bulbo olfativo
NOTA: Estas cirugías no requieren técnica estéril ya que no requieren que se realicen grandes incisiones. Sin embargo, cada institución puede diferir en sus requisitos. Si los experimentadores están realizando esta cirugía en cepas de ratones inmunocomprometidos, pueden ser necesarias consideraciones adicionales. En general, se recomienda a los experimentadores que discutan este protocolo con su veterinario y equipo de cuidado animal antes de usarlo y que limpien y desinfecten todas las herramientas entre cada cirugía.
- Durante la instalación, remoje las cánulas y los tornillos en un vaso de precipitados pequeño o en una placa de Petri que contenga un 32% de clorhexidina para mantenerlos desinfectados.
- Anestesiar ratones con isoflurano gaseoso al 4% en oxígeno puro y asegurarlos en un aparato estereotáxico. Durante la cirugía, asegúrese de que los ratones se mantengan bajo anestesia de isoflurano al 1,5-2% suministrada a través de un cono nasal. Monitoree la respiración durante toda la cirugía. Use ungüento para los ojos para prevenir la sequedad de los ojos mientras está bajo anestesia.
- Después de que el ratón esté asegurado y ya no responda a un pellizco firme de la pata trasera, use clorhexidina al 32% para frotar la parte superior de la cabeza con el fin de limpiar la superficie de la incisión.
- A continuación, frote la parte superior de la cabeza en dirección rostral a caudal con lidocaína (analgesia tópica).
- Presione firmemente para hacer una sola incisión en la línea media con una hoja de bisturí limpia.
- Con un taladro acoplado a la estereotáxica, perfore dos orificios sobre los bulbos olfativos para la cánula guía (26 G) utilizando las coordenadas AP +5,0 mm, ML +/-0,75 mm con respecto al bregma.
- Perfora dos agujeros sobre la formación cerebelosa.
NOTA: La ubicación de estos tornillos no necesita ser precisa, asegúrese de que sean simétricos a lo largo de la línea media. - Coloque tornillos en los dos orificios sobre la formación cerebelosa y use un adhesivo de papel tisú para asegurar estos tornillos al cráneo.
- Utilice el estereotáxico para insertar la cánula guía (26 G) en los orificios perforados sobre los bulbos olfativos (paso 1.6). Baje la cánula DV 1,0 mm.
- Mezcla el cemento dental en una placa de Petri. Use una pequeña cuchara de metal para apilar lentamente el cemento dental alrededor de la cánula. Déjalo secar durante 5 s. Luego, retire los brazos del dispositivo estereotáxico, teniendo cuidado de no sacar la cánula guía en el proceso. Continúe apilando el cemento dental sobre toda la incisión hasta que se forme una pequeña tapa (vea la figura 1A).
- Coloque los tapones falsos en la cánula guía en este punto para evitar la obstrucción.
- Inmediatamente después de la cirugía, inyecte ketoprofeno (0,2 mg/kg) y solución salina (200 μL) para reducir el dolor y rehidratarse. Proporcione alimento ablandado o hidrogel a los ratones después de la cirugía. No deje a los ratones desatendidos hasta que hayan recuperado la conciencia para mantener la decúbito esternal.
NOTA: A partir de este momento, los ratones también se alojan solos. - Inyecte solución salina (200 μL) y ketoprofeno (0,2 mg/kg) una vez al día durante dos días después de la cirugía.
- Durante 2 días y hasta 5 días (según sea necesario) después de la cirugía, pese a los ratones y controle su peso. Si el peso no vuelve a los niveles previos a la cirugía dentro de dos o tres días, consulte con el veterinario sobre el método adecuado de alimentación.
- Permita que los ratones se recuperen durante al menos 7 días antes de comenzar el entrenamiento conductual.
2. Tarea de discriminación asociativa
- Infusiones
- Administre infusiones específicas de OB del inhibidor del receptor de tirosina cinasa, K252a (50 μM; 5% de DMSO en solución salina) o vehículo (5% de DMSO en solución salina) a los ratones de la siguiente manera.
- Administrar la perfusión en el OB de los ratones bilateralmente. Inyecte un volumen final de 2,0 μL por bulbo con una tasa de infusión de 0,2 μL/min y 10 min de tiempo total de infusión utilizando una bomba de doble inyector.
NOTA: El momento de la manipulación se puede ajustar según el tipo de estudio de comportamiento que se realice. Los pasos exactos de la infusión son específicos de cada bomba inyectora y se proporcionan en el manual del fabricante. - Asegúrese de dejar los inyectores dentro de las cánulas durante unos 5 minutos después del parto para inhibir el reflujo y promover la difusión. (es decir, planifique un total de 15 minutos para cada infusión).
- Administrar la perfusión en el OB de los ratones bilateralmente. Inyecte un volumen final de 2,0 μL por bulbo con una tasa de infusión de 0,2 μL/min y 10 min de tiempo total de infusión utilizando una bomba de doble inyector.
- Administre infusiones específicas de OB del inhibidor del receptor de tirosina cinasa, K252a (50 μM; 5% de DMSO en solución salina) o vehículo (5% de DMSO en solución salina) a los ratones de la siguiente manera.
- Conjuntos de olores.
- Diluya todos los odorantes en aceite mineral ligero a una presión parcial de 1.0 Pa utilizando una proporción precalculada basada en la presión de vapor (Tabla 1).
- Utilice los 5 pares de olores separados de la Tabla 1 (los números de la tabla indican el volumen en μL para mezclar 50 mL de aceite mineral durante 1.0 Pa).
- Para preparar la arena perfumada que se utilizará durante las etapas de comportamiento (Sección 2.3 y 3), mezcle 400 μL del odorante 1.0 Pa de la Etapa 2.2.2 por cada 100 g de arena de juego.
- Formar
NOTA: Los ratones deben someterse a un moldeado durante un período de 10 días como se describe a continuación.- Lleve ratones a la sala de procedimientos y manipule durante 10 minutos al día durante los primeros dos días después de la recuperación de la cirugía.
- El día 3, coloque una placa de Petri llena de arena perfumada con (+)-limoneno en las jaulas domésticas de los ratones y rellénela con aproximadamente 10 gránulos de sacarosa, cada uno de 5 mg en masa.
NOTA: Use 1.0 Pa (+)-limoneno (mezcle 102 μL en 50 mL de aceite mineral) como olor recompensado y aceite mineral simple (el agente diluyente para los olores de prueba) como olor no recompensado. También se recomienda elegir odorantes monomoleculares, ya que es más probable que sean nuevos para los ratones. - Reponga tanto la arena como los gránulos el día 4.
- En los días 5 y 6, aclimate a los ratones al aparato conductual hecho a medida, colocándolos en el aparato y dejándolos explorar el espacio (Figura 1B,C). Fabrica el aparato con una jaula casera estándar y poli (metacrilato de metilo) para construir dos tapas y un divisor central negro. Asegúrese de que tanto las tapas como el divisor central sean 1-2 cm más grandes que la jaula de casa.
- Prepare una placa de Petri de arena perfumada con limoneno y otra con arena que contenga aceite mineral. Después de la aclimatación en los días 5 y 6, coloque ambos platos de arena en la cámara de prueba y mezcle 10 gránulos de sacarosa en el plato con aroma a limoneno para que sirva como recompensa. Coloque cada ratón en la cámara de prueba durante 10 minutos y permita explorar y consumir libremente las bolitas de recompensa.
- El día 7, introduzca a los ratones en una versión abreviada del procedimiento de prueba final, colocando los platos que contienen arena perfumada con limoneno y aceite mineral en el aparato de comportamiento. Esta vez incluye el divisor central.
- Coloque una sola recompensa encima de la arena con aroma a limoneno y coloque el ratón en la cámara de descanso.
- Una vez que el ratón se haya colocado en la cámara de descanso, levante el divisor central para permitir que el ratón entre en la cámara de prueba para investigar y cavar en los platos llenos de arena. Regrese el ratón a la cámara de reposo después de que haya recuperado la bolita de recompensa o después de que hayan transcurrido 5 minutos.
- Repita este proceso para un total de 10 pruebas para cada ratón individual. Contrarresta la colocación del plato recompensado en el lado izquierdo o derecho empleando un generador de números aleatorios. No hay períodos de descanso entre juicios.
- El día 8, repita las pruebas del día 7, pero también entierre progresivamente el pellet cada vez más profundamente en la arena.
NOTA: La mayoría de los ratones deberían estar cavando en busca de la bolita de recompensa invisible para la10ª prueba en el día 8. - El día 9, aumente el número de ensayos a 20 ensayos para cada ratón con el entierro completo y profundo de la pelliza de sacarosa e introducción de los ratones en la cámara de prueba durante 1 minuto por ensayo. Deja que los ratones caven en ambos platos para obtener la recompensa.
- El día 10, repita las 20 pruebas para cada ratón, pero si cavan en el plato no recompensado antes de cavar en el plato recompensado, y luego comience la siguiente prueba. Permita que los ratones que primero cavaron en el plato recompensado (con aroma a limoneno) recuperen la bolita de recompensa antes de enviarlos de regreso a la cámara de descanso.
3. Entrenamiento y pruebas
NOTA: Una vez que los ratones hayan comenzado a cavar de manera confiable en busca de las bolitas de recompensa invisibles y con olor señalado, puede comenzar el experimento.
- Adiestramiento
NOTA: La fase de entrenamiento comienza dos días después de completar el modelado y consta de 20 pruebas para cada ratón. Antes del entrenamiento, administre inmediatamente las infusiones intrabulbares del fármaco/vehículo (consulte la sección 2.1 para obtener más información sobre la perfusión) y comience el entrenamiento inmediatamente después de las perfusiones.- Coloque un ratón en la cámara de descanso.
- Coloque dos platos de arena perfumados con un nuevo par de olores en la cámara de prueba, donde se entierra una bolita de recompensa en uno de los platos.
- Una vez que la cámara de prueba esté lista, levante la barrera opaca e introduzca el mouse en la cámara de prueba. Regrese inmediatamente el ratón a la cámara de descanso, si el ratón cava primero en el plato no recompensado (registre estos intentos como un "0"). Si el ratón inhala primero el olor gratificante, permítale recuperar la bolita y devolverla a la cámara de descanso. Registre estos ensayos como un "1". Si la prueba dura 1 minuto sin que el ratón recupere la recompensa, envía al ratón de vuelta a la cámara de descanso.
- Limpie y vuelva a llenar los platos y comience la siguiente prueba. Repita lo mismo durante 20 intentos.
- Ensayo
NOTA: Las pruebas de memoria se pueden realizar en cualquier momento de interés para el investigador. En este experimento, dos grupos separados de ratones fueron probados 2 h (STM) o 48 h (LTM) después del entrenamiento dado el interés en la influencia diferencial de K252a en STM y LTM.- Lleve a cabo las pruebas utilizando los mismos olores y procedimientos que se describen para la capacitación (Sección 3.1).
NOTA: Dependiendo de la pregunta de investigación, es posible que el investigador deba incluir grupos de control. Por ejemplo, en el experimento publicado anteriormente, se estudiaron los efectos del bloqueo del receptor Trk en la consolidación de la memoria3. Por lo tanto, se infundió a un grupo de control K252a antes de la prueba de 48 h para demostrar que los efectos no se debían a la interferencia con la recuperación.
- Lleve a cabo las pruebas utilizando los mismos olores y procedimientos que se describen para la capacitación (Sección 3.1).
- Análisis estadístico
NOTA: La sintaxis de SPSS 22.0 para cada paso se proporciona como un archivo complementario a modo de ejemplo.- Realizar análisis estadísticos utilizando el análisis lineal de efectos mixtos. A diferencia de los ANOVA, los modelos lineales de efectos mixtos pueden tener en cuenta mejor los efectos aleatorios y las medidas repetidas.
- Calcule la medida dependiente: "proporción correcta". Recuerde que de 3.1.3 se asignó un "1" a las pruebas en las que el ratón cavó primero en el olor gratificante, y un "0" si el ratón cavó primero en el olor no gratificante. Promedio cada cinco ensayos para crear cuatro bloques de ensayos (TB; por ejemplo, el bloque de ensayo 1 o TB1 fue el promedio de los ensayos 1-5, el bloque de ensayo 2 o TB 2 fue el promedio de los ensayos 6-10 y así sucesivamente).
- Establezca las variables independientes o los efectos fijos como grupos de fármacos (K252a o Vehículo; Sección 2.1.1) y bloques de prueba (de 3.3.1). En los resultados representativos a continuación, se especifican las variables utilizadas para cada análisis.
- Incluya el ratón individual y el conjunto de olores anidados dentro del ratón como "efectos aleatorios" para compensar las diferencias de comportamiento intrínsecas en los ratones y cualquier efecto del uso de múltiples conjuntos de olores.
- Realice una transformación logit en la proporción correcta.
NOTA: La proporción correcta no es una variable dependiente continua y no vinculada. Por lo tanto, viola dos supuestos para los modelos lineales. Por lo tanto, se realiza la transformación logit. - Utilizar medias marginales estimadas para realizar pruebas post hoc sobre interacciones significativas identificadas por el modelo completo; Las comparaciones de pares múltiples deben corregirse en las pruebas post hoc. Por lo general, se utilizan Bonferroni o Šidák.
Resultados
Como se describe, este protocolo permite a los investigadores evaluar la influencia de alguna manipulación en el aprendizaje, STM y LTM. Aquí se presentan los resultados de la muestra de Tong et al, 20183 . Los resultados apoyan la hipótesis de que el bloqueo del receptor Trk inhibe selectivamente la LTM, pero no el aprendizaje o la STM.
La figura 2A muestra los esquemas del entrenamiento, la prueba STM y la prueba LTM. En primer lugar, se demostró que las infusiones de K252a no afectaban a la tasa de aprendizaje de una asociación olor-recompensa. La Figura 2B (Sección 3.1) muestra la tasa de aprendizaje de los grupos K252a y de vehículos de Entrenamiento. Se realizó un análisis estadístico mediante un modelo lineal mixto con dos efectos fijos, grupo de fármaco y bloque de ensayo (TB); El ratón y el conjunto de olores anidados dentro del ratón fueron efectos aleatorios. Los datos de las pruebas (sección 3.2) no se incluyeron en el análisis. Se observó un efecto principal significativo en el bloque de ensayo (F(3, 183,692) = 43,735, p < 0,001), pero ningún efecto en el grupo de fármacos (F(1, 85,685) = 0,132, p = 0,717) y ninguna interacción significativa (F(3, 183,692) = 0,111, p = 0,954). Las pruebas post hoc, utilizando el ajuste Šidák, confirmaron que el K252a y los grupos de vehículos no difirieron en ninguno de los bloques de prueba durante el entrenamiento (p > 0,05 para todas las comparaciones). TB2, TB3 y TB4 fueron significativamente más altos que TB1 para todas las comparaciones (p ≤ 0,001 en todos los casos), lo que demuestra que ambos grupos aprendieron con éxito la asociación olor-recompensa al final de 20 ensayos de entrenamiento.
A continuación, para examinar los efectos de la infusión sobre STM y LTM, se realizó el mismo análisis e incluyó datos de pruebas (Sección 3.2). Mostró una interacción significativa entre el grupo de fármaco y el bloque de ensayo (F(2, 77,558) = 4,043, p = 0,021), sin efectos principales significativos del grupo de fármaco (F(1, 55,629) = 1,438, p = 0,236) o bloque de ensayo (F(2, 69,979) = 1,360, p = 0,263). Con el fin de examinar específicamente la memoria, las comparaciones post hoc por pares con la corrección de Šidák, compararon las diferencias entre el último bloque de prueba de Entrenamiento (Sección 3.1) y el primer bloque de prueba de Prueba (Sección 3.2) 2 (STM) o 48 horas (LTM) después. Para los ratones con infusión de vehículos, las comparaciones mostraron retención de la memoria asociativa tanto a las 2 como a las 48 h después del entrenamiento (p > 0,05 para todas las comparaciones con el rendimiento del entrenamiento). Para los ratones con infusión de K252a, el primer bloque de prueba de la prueba de 2 horas (STM) no difirió del último bloque de prueba de Training (p > 0,05); sin embargo, su rendimiento de memoria fue significativamente menor después de 48 h (p = 0,018). Además, la memoria en la prueba de 48 horas se redujo significativamente en comparación con la memoria en la prueba de 2 horas (p = 0,009) y con el rendimiento del grupo de vehículos en la prueba de 48 horas (p = 0,006). No hubo diferencias en STM entre los ratones con infusión de vehículo y K252a (p = 0,356). En conjunto, los resultados muestran que la inhibición de K252a de los receptores Trk en el bulbo olfativo interrumpe selectivamente la memoria de olores a largo plazo, pero no a corto plazo (Figura 3).
| Conjunto de olores | Olor 1 | Olor 2 |
| 1 | ácido pentanoico | Ácido butanoico |
| 225.1 | 63.6 | |
| 2 | Hexanal | heptanal |
| 11.1 | 35.3 | |
| 3 | Acetato de propilo | acetato de butilo |
| 3.1 | 10.9 | |
| 4 | 2-octanona | 2-heptanona |
| 87.4 | 28.7 | |
| 5 | pentanol | hexanol |
| 37.2 | 127.3 |
Tabla 1: Volúmenes de mezcla para conjuntos de olores. Cada fila muestra dos olores que se pueden usar como un par para los pasos de comportamiento. Por ejemplo, para usar el primer "conjunto de olores", haga las mezclas de ácido pentanoico y butanoico. Los números de la tabla indican el volumen en μL para mezclar en 50 mL de aceite mineral para una concentración de 1,0 Pa de cada olor. Durante el entrenamiento y las pruebas, una placa de Petri se perfumaría con ácido pentanoico y la otra con ácido butanoico.

Figura 1: Colocación de la canulación y aparato conductual. (A) Muestra la posición relativa de la cánula, la tapa de cemento dental y los tornillos a la cabeza del ratón. Tenga en cuenta que las agujas de la cánula llegan a los dos bulbos olfativos, el pedestal en sí está incrustado en la tapa de cemento dental. Los tornillos se colocan en dos orificios perforados en el cráneo sobre la formación cerebelosa. Los tornillos no tocan el cerebro en sí, pero actúan como un anclaje caudal para la tapa de cemento dental. La figura muestra el tamaño relativo para hacer la tapa de cemento. (B) Muestra el aparato conductual ensamblado. El cuerpo es una jaula casera típica de ratón. Las tapas con orificios para el aire estaban hechas de plexiglás. El divisor central también está hecho de plexiglás negro. Las tapas deben estar hechas de plexiglás lo suficientemente pesado como para que puedan actuar como un tracto para que el divisor central se levante y se coloque durante las pruebas. (C) Muestra un lado del aparato conductual. Tenga en cuenta que el divisor central es ligeramente más alto que la jaula para facilitar la elevación. Se pueden colocar placas de Petri de arena a lo largo del borde. Haga clic aquí para ver una versión más grande de esta figura.
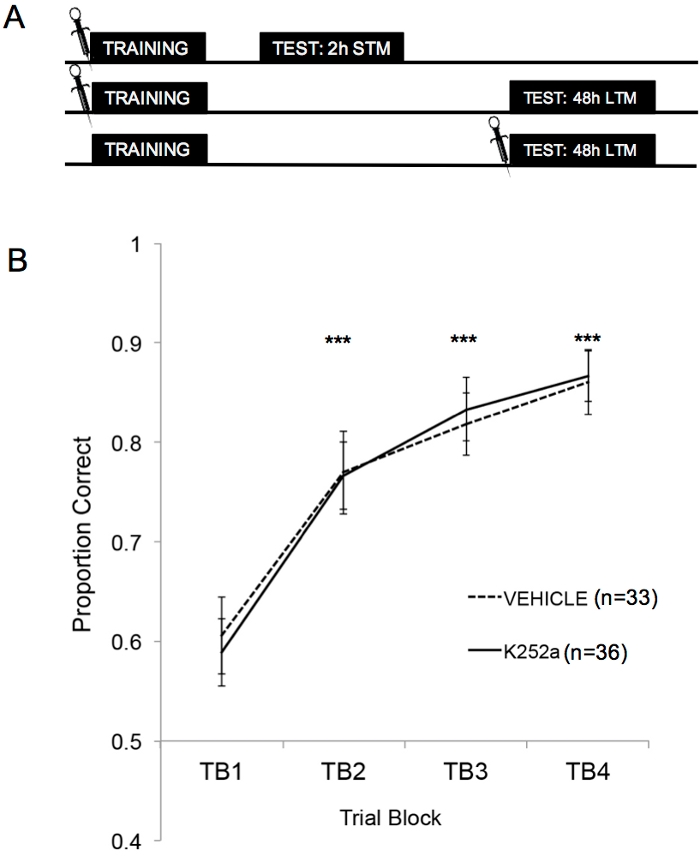
Figura 2: Diseño del estudio y resultados de aprendizaje. (A) Muestra el esquema del diseño del estudio. Nótese que los grupos STM y LTM eran independientes (es decir, diferentes grupos de ratones). Los símbolos al principio de los bloques indican la hora en que se administraron las infusiones. (B) Muestra la proporción correcta para las pruebas 1-20 durante el entrenamiento. Los resultados indican que los grupos K252a y vehículos no difirieron en su tasa de aprendizaje (pendiente de las líneas). Las barras de error representan el error estándar de la media (SEM). Los asteriscos muestran aumentos significativos en la proporción correcta en comparación con TB1 tanto para el vehículo como para las cohortes K252a (p ≤ 0,001 para todas las comparaciones). Esta figura es una adaptación de Tong et al. 2018 con permiso3. Haga clic aquí para ver una versión más grande de esta figura.
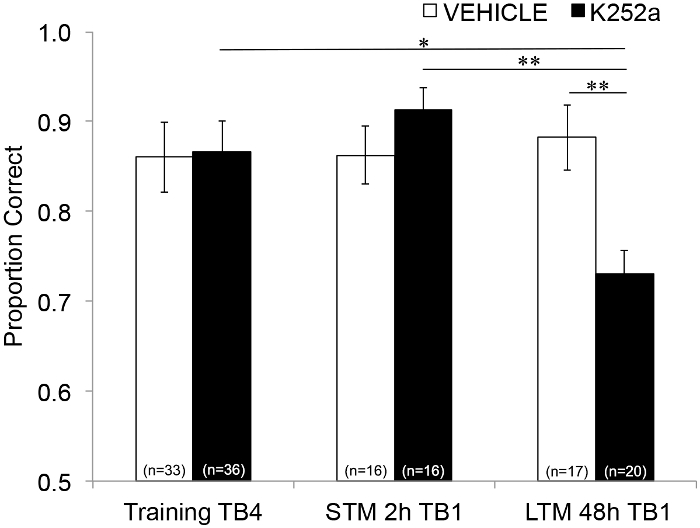
Figura 3: Efectos diferenciales del bloqueo del receptor Trk en STM y LTM. Muestra la proporción correcta para el Bloque de Prueba 4 de Entrenamiento y el Bloque de Prueba 1 de las Pruebas STM y LTM. Es decir, se utiliza un modelo lineal mixto para comparar la proporción correcta durante el último bloque de prueba de la fase de entrenamiento (Figura 2; Training-TB4) a los que se encuentran durante los primeros bloques de prueba (Testing-TB1) de prueba de memoria a corto plazo (prueba de 2 horas) y a largo plazo (prueba de 48 horas). El modelo lineal mixto tuvo dos efectos fijos: grupo de fármaco y bloque de ensayo (Training-TB4, STM-TB1, LTM-TB1). Los efectos aleatorios fueron el ratón y el conjunto de olores anidados dentro del ratón. Las comparaciones post hoc encontraron que los ratones K252a tenían un LTM significativamente deteriorado (comparación con el entrenamiento TB4; p = 0,018) pero no STM (p > 0,05). El rendimiento de LTM de los ratones con infusión de K252a también fue significativamente menor que el STM de los ratones con infusión de K252a (p = 0,009) y menor que el LTM de los ratones de vehículos (p = 0,006). Las barras de error representaban el SEM. Esta figura es una adaptación de Tong et al. 2018 con permiso3. Haga clic aquí para ver una versión más grande de esta figura.

Archivo complementario: Sintaxis utilizada para el análisis estadístico. Haga clic aquí para descargar este archivo.
Discusión
El condicionamiento del miedo de una sola prueba es un poderoso protocolo conductual para estudiar la dinámica molecular y celular de la memoria, pero gran parte del aprendizaje natural es incremental y se modela mejor a través de un paradigma como el descrito anteriormente. La inhibición de los receptores Trk en el OB impidió la consolidación de la memoria olfativa en un paradigma de aprendizaje apetitivo multiensayo, tal y como demostró previamente nuestro grupo3. El hallazgo abre nuevas vías para la investigación sobre la sincronización diferencial de los mecanismos moleculares, como las neurotrofinas, en el aprendizaje apetitivo y aversivo.
Este experimento constó de dos partes críticas: (1) la canulación y (2) la tarea de discriminación asociativa (subdividida en conformado, entrenamiento y prueba). Los experimentadores pueden adaptar este protocolo a su pregunta de investigación específica. Por ejemplo, nos interesaba principalmente la obstetricia y este protocolo establecido se puede aplicar fácilmente a otros estudios de obstetricia. Para los experimentadores con otras regiones de interés, será importante validar los sitios de infusión en un estudio piloto. Es posible que los experimentadores también deban considerar la tasa de difusión, la penetración espacial y la duración de la bioactividad de lo que están infusionando.
Los pasos de configuración descritos en el protocolo han sido ampliamente utilizados por los autores de este protocolo. Cumplirlos como se describe parece ser importante para que los ratones aprendan la tarea de manera oportuna. Usando otras líneas de tiempo, los autores observaron más variación entre los ratones en su familiaridad con la tarea y esto significó un entrenamiento adicional para llevar a todos los ratones a un criterio para las pruebas con olores experimentales. Para la formación y las pruebas, el investigador tiene flexibilidad, en función de sus intereses de investigación, con el número de ensayos, la concentración de los olores experimentales y la similitud de los olores entre sí. Recomendamos el uso de múltiples conjuntos de olores cuando sea posible, como hemos descrito, para reducir el número de animales utilizados para el experimento. Consulte la sección Análisis estadístico para obtener instrucciones sobre cómo tener en cuenta el uso de varios conjuntos de órdenes en el análisis final. En principio, la similitud del par de olores se puede variar para ajustar la dificultad de la discriminación. En el estudio previamente publicado de nuestro grupo3, los pares de olores consisten en dos odorantes del mismo grupo funcional pero difieren entre sí en una longitud de carbono. Estas discriminaciones son más difíciles que los pares que difieren en dos o más longitudes de carbono, pero más fáciles que los enantiómeros (por ejemplo, (+)-limoneno y (-)-limoneno). Los odorantes de diferentes grupos funcionales son muy diferentes perceptualmente. Cleland et al13 discuten las variaciones de estímulos y su efecto sobre parámetros específicos de aprendizaje.
Una de las principales limitaciones de este protocolo es que se tarda mucho más tiempo en llevarlo a cabo en comparación con las tareas de aprendizaje asociativo automatizado en las que se podrían probar varios animales en paralelo. Para una prueba determinada, un investigador tardaría al menos 20 minutos en completar 20 ensayos para un ratón. Sin embargo, es esta falta de automatización lo que significa que el protocolo es más accesible desde el punto de vista financiero, una prioridad para muchas instituciones. Es importante destacar que, en el caso de este experimento, se ha encontrado que este protocolo es altamente manejable y efectivo para la formación de investigadores de pregrado con intereses en la neurociencia del comportamiento. En particular, estos estudiantes desarrollan fuertes habilidades de manejo de animales, además de los beneficios habituales de la participación en la investigación.
Los investigadores que están interesados en adoptar este paradigma pueden variar varios parámetros. Aparentemente, las manipulaciones farmacológicas de los mecanismos son diversas, y este protocolo de comportamiento se puede utilizar con técnicas quimiogenéticas u otras formas de manipular las vías moleculares y celulares (por ejemplo, la optogenética). El paradigma en sí mismo se puede ajustar para variar el tipo de aprendizaje y la memoria evaluada. Por ejemplo, los investigadores pueden ajustar la similitud de los dos olores presentados para controlar la tasa de aprendizaje. En nuestro estudio3, los pares de olores consisten en dos odorantes del mismo grupo funcional pero difieren entre sí en una longitud de carbono. Estas discriminaciones son más difíciles que las de los pares que difieren en dos o más longitudes de carbono, pero más fáciles que los enantiómeros (por ejemplo, (+)-limoneno y (-)-limoneno). Los odorantes de diferentes grupos funcionales son muy diferentes perceptualmente. Cleland et al13 discuten más variaciones de estímulos y su efecto sobre parámetros específicos de aprendizaje, concluyendo que los olores más similares son más difíciles de discriminar y, por lo tanto, tardan más enaprenderse 14. Estas manipulaciones también afectarían la fuerza de los recuerdos. En este sentido, los investigadores pueden estar interesados en probar la memoria en diferentes puntos temporales después del aprendizaje. Por ejemplo, dos estudios 15,16 examinaron el papel del BDNF en la persistencia de LTM para una tarea de aprendizaje aversivo de un ensayo. El BDNF es un ligando de TrkB. Los estudios mostraron que la infusión de oligonucleótidos anti-BDNF y antisentido en el hipocampo 12 horas después del aprendizaje bloqueó la LTM 7 días después, pero no 2 días después. Este estudio muestra que la escala de tiempo de los mecanismos moleculares después del aprendizaje inicial juega un papel interesante, y aún por entender, en la LTM. En este trabajo se describe un protocolo de comportamiento que permitiría investigar estas escalas temporales. Otros parámetros de interés para futuras aplicaciones incluyen el modelo de ratón utilizado. Por ejemplo, sería interesante reemplazar ratones machos (que tienen una neurobiología significativamente mejor estudiada)17 por ratones hembra en futuros estudios para examinar las variaciones en la tasa de aprendizaje, STM y LTM, ya que los mamíferos hembra tienen una mayor sensibilidad y selectividad a los olores que los mamíferosmachos 18. Por supuesto, los modelos de enfermedades en roedores también se pueden utilizar eficazmente con este protocolo.
Divulgaciones
Los autores de este artículo no tenían intereses financieros contrapuestos.
Agradecimientos
El proyecto contó con el apoyo de la Beca de Investigación Colaborativa de Verano de Scantland y el Fondo de Investigación Stephen y Sylvia Tregidga Burges. Los autores desean agradecer a sus colegas del Departamento de Psicología y del Programa de Neurociencia del Earlham College por su apoyo y orientación.
Materiales
| Name | Company | Catalog Number | Comments |
| Double guide cannula | PlasticsOne | C235GS-5-1.5/SPC | Custom order |
| (-)-limonene | Sigma-Aldrich | 218367-50G | |
| (+)-limonene | Sigma-Aldrich | 183164-100ML | |
| 2-hetanone | Sigma-Aldrich | 537683 | |
| 2-octanone | Sigma-Aldrich | O4709 | |
| 5mg sucrose pellets | Test Diet | 1811560 | Custom size. Used for rewards |
| Butanoic acid | Sigma-Aldrich | B103500 | |
| butyl acetate | Sigma-Aldrich | 402842 | |
| Dental Cement Powder (Coral) | A-M Systems | 525000 | |
| Dental Cement Solvent | A-M Systems | 526000 | |
| Double connector assembly | PlasticsOne | C232C | |
| Double dummy cannula | PlasticsOne | C235DCS-5/SPC dummy dbl | Custom order |
| Double injector | PlasticsOne | C235IS-5/SPC | Custom order |
| Drill | Kopf Instruments | Model 1474 High Speed Stereotaxic Drill | This drill requires an additional "adaptor" piece in order to fit certain drill bits. We get by this problem by wrapping the drill bit with lab tape to increase the circumference of the drill it to fit. This may not be an option for surgeries requiring sterile technique. |
| Eye Ointment | Purchase from local pharmacy | ||
| Figure 1 illustration software | BioRender | ||
| heptanal | Sigma-Aldrich | W254002 | |
| hexanal | Sigma-Aldrich | 115606 | |
| hexanol | Sigma-Aldrich | H13303 | |
| Infusion pump model 11 | Harvard Apparatus | 4169D | Used pumps available via American Instrument Exchange |
| Isoflurane | Santa Cruz Animal Health | sc-363629Rx | Vet prescription needed for order |
| K252a | Sigma-Aldrich | K2015 | Mixed to 50uM in DMSO (5%) |
| Ketoprofen | Allivet | 25920 | Vet prescription needed for order |
| Lidocaine | Aspercreme | Purchased from Amazon | |
| Mounting Screws | PlasticsOne | 00-96 X 3/32 | |
| Mouse Anesthesia Mask | Kopf Instruments | Model 907 Mouse Anesthesia Mask | Used with the stereotaxic to allow oxygen and anesthesia while mouse in stereotax |
| Mouse Nose Adaptor | Kopf Instruments | Model 926 Mouse Adaptor | Used with the stereotaxic to allow for head of mouse to be secured. |
| Novalsan | Jeffers | 41375 | |
| Pentanoic acid | Sigma-Aldrich | 240370 | |
| pentanol | Sigma-Aldrich | 138975 | |
| Petri dish glass bottoms | VWR | 10754-804 | |
| Polycarbonate Café bottoms | Ancare | N10PCSEC | Use normal housing cages and custom fit a track in the middle to act as the track for an opaque plexiglass divider |
| propyl acetate | Sigma-Aldrich | 537438 | |
| Quikrete Premium Play Sand | Purchase from local hardware store | ||
| Saline | Insight Needles | N/A | Sterile saline for drug mixing |
| Stereotaxic apparatus | Kopf Instruments | Model 902 Small Animal Stereotaxic Instrument | |
| Testing chamber | Ancare | N10PCSEC | Our testing chambers are modified using the regular mouse housing cage. The manuscript details what was done. |
| Vetbond Tissue Adhesive | 3M | Purchased from Amazon |
Referencias
- Grimes, M. T., Smith, M., Li, X., Darby-King, A., Harley, C. W., Mclean, J. H. Mammalian Intermediate-Term Memory: New Findings in Neonate Rat. Neurobiology of Learning and Memory. 95 (3), 385-391 (2011).
- Grimes, M. T., Harley, C. W., Darby-King, A., Mclean, J. H. PKA Increases in the Olfactory Bulb Act as Unconditioned Stimuli and Provide Evidence for Parallel Memory Systems: Pairing Odor with Increased PKA Creates Intermediate- and Long-Term, but not Short-Term, Memories. Learning and Memory. 19 (3), 107-115 (2012).
- Tong, M. T., Kim, T. Y. P., Cleland, T. A. Kinase Activity in the Olfactory Bulb is Required for Odor Memory Consolidation. Learning & Memory. 25 (5), 198-205 (2018).
- Devore, S., Lee, J., Linster, C. Odor Preferences Shape Discrimination Learning in Rats. Behavioral Neuroscience. 127 (4), 498-504 (2013).
- Gao, Y., Strowbridge, B. W. Long-Term Plasticity of Excitatory Inputs to Granule Cells in the Rat Olfactory Bulb. Nature Neuroscience. 12 (6), 731-733 (2009).
- Bath, K. G., Mandairon, N., et al. Variant Brain-Derived Neurotrophic Factor (Val66Met) Alters Adult Olfactory Bulb Neurogenesis and Spontaneous Olfactory Discrimination. Journal of Neuroscience. 28 (10), 2383-2393 (2008).
- Lazarini, F., Lledo, P. M. Is Adult Neurogenesis Essential for Olfaction. Trends in Neurosciences. 34 (1), 20-30 (2011).
- Mandairon, N., Peace, S., Karnow, A., Kim, J., Ennis, M., Linster, C. Noradrenergic Modulation in the Olfactory Bulb Influences Spontaneous and Reward-Motivated Discrimination, but not the Formation of Habituation Memory. European Journal of Neuroscience. 27 (5), 1210-1219 (2008).
- Guérin, D., Peace, S. T., Didier, A., Linster, C., Cleland, T. A. Noradrenergic Neuromodulation in the Olfactory Bulb Modulates Odor Habituation and Spontaneous Discrimination. Behavioral Neuroscience. 122 (4), 816-826 (2008).
- Moreno, M. M., Bath, K., Kuczewski, N., Sacquet, J., Didier, A., Mandairon, N. Action of the Noradrenergic System on Adult-Born Cells Is Required for Olfactory Learning in Mice. Journal of Neuroscience. 32 (11), 3748-3758 (2012).
- Vinera, J., Kermen, F., Sacquet, J., Didier, A., Mandairon, N., Richard, M. Olfactory Perceptual Learning Requires Action of Noradrenaline in the Olfactory Bulb: Comparison with Olfactory Associative Learning. Learning and Memory. 22 (3), 192-196 (2015).
- Dillon, T. S., Fox, L. C., Han, C., Linster, C. 17β-estradiol Enhances Memory Duration in the Main Olfactory Bulb in CD-1 Mice. Behavioral Neuroscience. 127 (6), 923 (2013).
- Cleland, T. A., Narla, V. A., Boudadi, K. Multiple Learning Parameters Differentially Regulate Olfactory Generalization. Behavioral Neuroscience. 123 (1), 26 (2009).
- Cleland, T. A., Morse, A., Yue, E. L., Linster, C. Behavioral Models of Odor Similarity. Behavioral Neuroscience. 116 (2), 222-231 (2002).
- Bekinschtein, P., Cammarota, M., Igaz, L., Bevilaqua, L., Izquierdo, I., Medina, J. Persistence of Long-Term Memory Storage Requires a Late Protein Synthesis- and BDNF- Dependent Phase in the Hippocampus. Neuron. 53 (2), 261-277 (2007).
- Bekinschtein, P., et al. BDNF is Essential to Promote Persistence of Long-Term Memory Storage. Proceedings of the National Academy of Sciences. 105 (7), 2711-2716 (2008).
- Andreano, J., Cahill, L. Sex influences on the neurobiology of learning and memory. Learning and Memory. 16 (2009), 248-266 (2009).
- Kass, M. D., Czarnecki, L. A., Moberly, A. H., Mcgann, J. P. Differences in Peripheral Sensory Input to the Olfactory Bulb Between Male and Female Mice. Scientific Reports. 7 (1), (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados