Method Article
Métodos funcionales y fisiológicos de evaluación de la regeneración media nerviosa en la rata
* Estos autores han contribuido por igual
En este artículo
Resumen
Presentado es un protocolo para producir diferentes tipos de lesiones del nervio mediano (MN) y reparación en la rata. Además, el protocolo muestra cómo evaluar la recuperación funcional del nervio utilizando varias pruebas conductuales no invasivas y mediciones fisiológicas.
Resumen
El objetivo principal de esta investigación es mostrar cómo crear y reparar diferentes tipos de lesiones medias del nervio (MN) en la rata. Además, se presentan diferentes métodos de simulación de fisioterapia postoperatoria. Múltiples estrategias estandarizadas se utilizan para evaluar la recuperación motora y sensorial utilizando un modelo MN de lesión y reparación del nervio periférico, lo que permite una fácil comparación de los resultados. Se incluyen varias opciones para proporcionar un entorno postoperatorio similar a la fisioterapia a las ratas que han sufrido lesiones por MN. Por último, el documento proporciona un método para evaluar la recuperación de la MN mediante varias pruebas no invasivas (es decir, prueba de agarre, prueba de pin prick, prueba de caminar por peldaño de escalera, prueba de escalada de cuerda y análisis de pista de marcha), y mediciones fisiológicas (termografía infrarroja, electroneuromía, evaluación de la fuerza de flexión y determinación del peso muscular flexor carpi radialis). Por lo tanto, este modelo parece particularmente apropiado para replicar un escenario clínico, facilitando la extrapolación de resultados a la especie humana.
Aunque el nervio ciático es el nervio más estudiado en la investigación del nervio periférico, el análisis de la rata MN presenta varias ventajas. Por ejemplo, hay una menor incidencia de contracturas articulares y automutilación de la extremidad afectada en estudios de lesiones MN. Además, el MN no está cubierto por masas musculares, por lo que su disección es más fácil que la del nervio ciático. Además, la recuperación de MN se observa antes, porque el MN es más corto que el nervio ciático. Además, el MN tiene un camino paralelo al nervio cubital en el brazo. Por lo tanto, el nervio cubital se puede utilizar fácilmente como el injerto nervioso para reparar lesiones de MN. Finalmente, el MN en ratas se encuentra en la extremidad anterior, similar a la extremidad superior humana; en los seres humanos, la extremidad superior es el sitio de la mayoría de las lesiones nerviosas periféricas.
Introducción
Las lesiones del nervio periférico ocurren regularmente como resultado de traumatismos, infecciones, vasculitis, autoinmunidad, neoplasia maligna y/o radioterapia1,2. Desafortunadamente, la reparación del nervio periférico continúa presentando resultados clínicamente impredecibles y con frecuencia decepcionantes3,4. Existe un consenso generalizado de que todavía se necesita una considerable investigación básica y traslacional para mejorar la perspectiva de los afectados4,5,6,7.
La rata MN muestra grandes similitudes con la de los humanos8,9 (Figura 1). Originario del plexo braquial en la región axilar, este nervio desciende al aspecto medial del brazo, alcanzando el codo y ramificándose hasta la mayoría de los músculos del compartimiento ventral del antebrazo. El MN llega a la mano, donde inerva los músculos tenar y los dos primeros músculos lumbricales, así como a parte de la piel de la mano de la rata9 (Figura 1).
Utilizando la rata MN, es posible replicar adecuadamente las lesiones del nervio periférico en humanos10,,11,12. Este nervio tiene varias ventajas potenciales de investigación en relación con el nervio ciático utilizado habitualmente. Debido a que el MN se encuentra en la extremidad anterior de las ratas (similar a las extremidades superiores humanas), puede dañarse experimentalmente con un impacto mucho menor en el bienestar de la rata, en comparación con el nervio ciático, que inerva una porción sustancial de la extremidad pélvica13. Además, en humanos la mayoría de las lesiones clínicas se producen en la extremidad superior, que corresponde a la extremidad delantera de la rata10,11,12,14,15,16.
Este artículo muestra cómo producir diferentes tipos de lesiones MN en la rata. Además, se presentan diferentes formas de simular la fisioterapia postoperatoria. Por último, se describen las pruebas para evaluar la recuperación funcional del MN. Existen múltiples estrategias estandarizadas disponibles para evaluar la recuperación motora y sensorial utilizando un modelo MN de lesión y reparación del nervio periférico, lo que permite una fácil comparación de los resultados. El modelo MN es particularmente adecuado para replicar el escenario clínico, facilitando la extrapolación de resultados a la especie humana.
Protocolo
Todos los procedimientos relacionados con sujetos animales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales y el Comité Etico de la Escuela de Medicina de la Universidad de Nova, Lisboa, Portugal (08/2012/CEFCM).
1. Mediana de la cirugía nerviosa
NOTA: Siga la técnica aséptica durante la cirugía. Utilice instrumentos de protección personal (EPP) y use una bata quirúrgica estéril17. Autoclave todos los instrumentos quirúrgicos necesarios antes de la cirugía (ver la Tabla de Materiales).
- Usa ratas Wistar de 12 semanas. Proporcione alimentos y agua ad libitum con ciclos de luz-oscuro de 12 h 7 días antes de la cirugía. Antes de la anestesia, sopesar la rata para determinar la cantidad de anestésico requerido.
- Anestesiar a la rata con una inyección intraperitoneal de una mezcla de ketamina (40-80 mg/kg de peso corporal) y xilazina (5-10 mg/kg de peso corporal). Compruebe la profundidad de la anestesia por la falta de respuesta a un pellizco del dedo del dedo del dedo del dedo del tiempo y por la observación de la tasa de respiración durante todo el procedimiento18,19. Proporcionar analgesia adicional si se observa una frecuencia respiratoria de más de 110 ciclos/min o una respuesta motora al pellizco del dedo del dedo del dedo del dedo del día18,20.
- Inyectar 1 mg/kg de meloxicam por vía subcutánea para proporcionar analgesia preventiva20,21.
- Para evitar la abrasión corneal durante la cirugía, aplique gel oftálmico en ambos ojos.
- Usa una crema depilatoria para eliminar el cabello sobre el aspecto medial de la derecha. Una vez hecho esto, lavar con salina tibia para eliminar la crema17.
- Coloque la rata en posición supina en una almohadilla de calentamiento. Aplicar un exfoliante quirúrgico a base de yodo o clorhexidina sobre el sitio operativo. Déjalo durante al menos 15 s y luego limpie con etanol. Repita la aplicación 3x. Asegúrese de que el exfoliante esté en contacto con la piel durante al menos 2 minutos antes de continuar con la cirugía.
NOTA: Póngase en contacto con la autoridad de control de infecciones de su unidad de investigación para obtener protocolos alternativos para prevenir la infección en el sitio quirúrgico19. - Cubrir el área quirúrgica17.
NOTA: Realice todos los procedimientos bajo estrictas condiciones asépticas19. - Incise la piel en el aspecto medial del brazo derecho y la región pectoral al plano fascial profundo, utilizando una hoja de bisturí número 15. Cauterizar cuidadosamente cualquier vaso sangrante usando un cauterio eléctrico.
- Divida cuidadosamente la fascia braquial, que se presenta como una vaina blanquecina que cubre los músculos, utilizando una termocauterización o un par de tijeras contundentes, teniendo cuidado de no dañar las estructuras vasculares y nerviosas en el aspecto medial del brazo.
- Abra un par de tijeras sin rodeos debajo de la inserción terminal del músculo pectoral mayor, con el fin de burlarse de este músculo lejos de la arteria axilar subyacente y la vena, así como de las ramas terminales del plexo braquial.
- Dividir la inserción del músculo pectoral mayor con una cautela eléctrica. Exponer y seccionar el músculo pectoral menor.
- Disecciona con sordelismo el MN de los vasos braquiales y del nervio cubital desde la región axilar hasta el codo. Esto permite la exposición de las diferentes ramas terminales del plexo braquial, a saber, la mediana, el cúbito, el radial, el axilar y los nervios musculocutáneos(Figura 2).
- Separe diferentes grupos experimentales como se describe a continuación.
- Cree el grupo Sham disertando solamente el MN.
- Cree el grupo Crush comprimiendo el MN en la parte media del brazo durante 15 s usando un fórceps de microcirugía número 5, o un instrumento similar22,23.
- Cree el grupo Decision usando un par de tijeras de microcirugía para extirpar un segmento de 10 mm de largo de la parte central del MN en el brazo. Ligar el muñón proximal del nervio con una sutura de nylon 8/0 para prevenir el crecimiento axonal.
- Cree el grupo Injerto utilizando el segmento de 10 mm de largo del MN descrito en este último paso y girándolo 180o. Sutura los tocones proximales y distales de la MN seccionada al injerto nervioso usando puntadas de nylon 10/0 interrumpidas.
- Cierre la herida de la piel con puntos de nylon 5/0 interrumpidos10,24.
- Proporcionar analgesia postoperatoria con 7 ml de paracetamol con sabor a cereza mezclado con 43 ml de agua del grifo25 para obtener una concentración de 4,48 mg/ml en botellas de agua plástica de 50 ml puestos a disposición de las ratas ad libitum durante 3 días25.
2. Vivienda y fisioterapia
- Permita que las ratas tengan contacto con los aparatos de fisioterapia 2-4 semanas antes de la cirugía, con el fin de asegurar una adaptación más fácil y rápida a los ajustes del ejercicio. Realice los ejercicios siguiendo los procedimientos detallados a continuación.
- Una vez al día, coloque cada rata dentro de una esfera de fisioterapia individual, y posteriormente coloque la esfera en una habitación con pocos obstáculos. Deje que la rata se ambule y explore la habitación libremente durante media hora.
- Casa a las ratas individualmente en jaulas solitarias con ruedas de correr incorporadas para ayudarles a hacer ejercicio.
- Formar grupos de 4-5 animales y albergar a estos grupos en jaulas personalizadas. Personalice las jaulas incluyendo escaleras, cuerdas, ruedas de running y otros elementos enriquecedores ambientales.
- Regrese ratas individuales a jaulas personalizadas el día después de la cirugía.
- Reanudar los ejercicios de fisioterapia 3 días después de la cirugía.
3. Pruebas funcionales
- Una semana antes de comenzar a realizar las pruebas funcionales, familiarizar a las ratas con las golosinas alimentarias para ser utilizadas como refuerzo positivo. Proporcione este refuerzo después de la finalización exitosa de cada prueba, antes y después de la cirugía. Después del período de entrenamiento inicial de 3 semanas, reanudar todas las pruebas 1 semana después de la cirugía.
- Realizar las pruebas por la noche, cuando las ratas son naturalmente más activas. Reanudar las pruebas 1 semana después de la cirugía.
- Realiza la Prueba de Agarre colocando la rata sobre una rejilla y levántala por su cola, dejándola agarrar la rejilla con sus patas delanteras11,,26. Asigne una puntuación "Positiva" si la rata puede agarrar la cuadrícula con ambas patas delanteras. Asigne una puntuación "Negativa" si la rata no puede agarrar la rejilla con la pata lesionada.
NOTA: Una prueba de agarre positiva indica que el componente motor del MN está funcionando16,27. - Realice una prueba de pin prick28,29.
- Haga una plataforma de plástico con un patrón de rejilla cuadrada de 4 mm x 4 mm. Proporcionar soporte a esta rejilla con un marco metálico de 21 cm de largo.
- Coloque la rata sobre la plataforma y cubra la rejilla con una caja de plástico transparente de 15,5 cm x 15,5 cm x 11 cm. Espere unos minutos hasta que las actividades normales (por ejemplo, exploratorias y de aseo mayor) desaparezcan.
- Comience la prueba cuando la rata esté estacionaria y de pie sobre sus cuatro patas.
- Con la ayuda de un espejo, inserte un estesiómetro (por ejemplo, el pelo Von Frey número 4 con una fuerza de flexión de 25 g) a través de la malla y empuje el aspecto palmar de la pata delantera en el territorio de la piel de la MN(Figura 1). Repita la evaluación 5 veces en cada pata delantera alternativamente, esperando unos segundos después de cada evaluación.
- Compruebe la flexión del filamento Von Frey30 para la evaluación correcta. Puntuar las respuestas de retiro de la siguiente manera: "0" para ninguna respuesta de retiro, "1" si la rata quita lentamente la pata del filamento, "2" si la rata responde rápidamente al estímulo y quita la pata o lame la pata.
NOTA: Si se observa la ambulación y la mordida del filamento, repita el estímulo, ya que se consideran respuestas ambiguas.
- Sesiones de formación
NOTA: Entrene a las ratas diariamente durante 3 semanas antes de realizar la cirugía por la noche en un ambiente con poca luz. Las sesiones de entrenamiento se recomiendan especialmente para las pruebas de escalada de cuerdas, peldaño de escalera y pistas de senderismo. Estos se pueden hacer en el orden presentado antes, comenzando con la prueba de escalada de cuerda, peldaño de escalera, y finalmente prueba de pistas de marcha. Deje que el mismo animal unos minutos de descanso antes de una nueva prueba.- Durante la primera semana, coloque la rata en el último tercio de la escalera/cuerda/pasillo, cerca de la entrada de la caja. Acondicionar al animal para que se mueva hacia la abertura de la caja tocando suavemente y/o tirando de la punta de su cola. Proporcione a la rata un alimento una vez que entre en la caja, permitiéndole algunos segundos de descanso antes de repetir la prueba. Repetirlo 5 veces al día durante 5 días.
- Durante la segunda semana, coloque el animal en el segundo tercio de la escalera/cuerda/corridor Repita los pasos en 3.5.1.
- Durante la tercera semana, coloque la rata en la parte inferior de la escalera/cuerda/pasillo, en el lado opuesto de la entrada de la caja. Repite los pasos en 3.5.1, pero solo recompensa al animal cuando complete la prueba correctamente.
- Realice la prueba de peldaño de escalera.
NOTA: Esta prueba se utiliza para evaluar la fuerza, el paso, la colocación y la coordinación de las extremidades anteriores31.- Coloque la rata en la parte inferior de la escalera (120 cm x 9 cm x 2 cm con 18 escalones de 1,5 cm de espesor, espaciados 4 cm de distancia) y toque suavemente la cola de la rata. Asegúrese de que la escalera se coloca a una inclinación de 10o y conduce a una abertura de 13,20 cm x 11 cm en una caja de madera oscura de 31,5 cm x 35 cm x 35 cm.
- Inicie el temporizador una vez que la rata comience a subir la escalera y detenga el temporizador una vez que el hocico de la rata cruce la entrada de la caja.
- Registre el tiempo y repita la prueba 3x, cada uno separado al menos por un intervalo de 1 min.
- Escalada de cuerdas
NOTA: Esta prueba se utiliza para evaluar la fuerza de agarre, que depende de la recuperación de MN32.- Coloque la rata en la parte inferior de la cuerda y persuadirla a subir tocando suavemente su cola. Arranca el temporizador una vez que el animal comience a escalar y deténgalo en el momento en que el hocico de las ratas cruce la entrada de la plataforma.
- Para cada prueba, registre el tiempo necesario para subir a la plataforma y el número de resbalones de la pata lesionada mientras la rata sube por la cuerda. Considere la prueba válida si el animal no duda durante la tarea o no deja de escalar. Proporcione a la rata un refrigerio después de realizar la tarea correctamente.
- Registre el tiempo y repita la prueba 3x, cada uno separado al menos por un intervalo de 1 minuto.
- Walking Tracks
NOTA: Esta prueba se utiliza para la evaluación de la recuperación del motor de las extremidades delanteras33,34.- Instalar un aparato que consista en una pasarela confinada de 16,5 cm de altura x 8,7 cm de ancho x 43 cm de longitud. Asegúrese de que esto conduce a una abertura rectangular de 8,8 cm x 8,2 cm en una de las paredes de una caja de madera negra de 23 cm x 36 cm x 28 cm. Incluya una puerta corredera vertical para cerrar la entrada de la caja rápidamente. Incluya una tapa extraíble que se utilizará para recuperar la rata33,34.
- Coloque un trozo de papel gráfico en el suelo del pasillo. Coge la rata por su cola y deja que sostenga un pincel de pintura empapado en azul de metileno. Coloque la rata en la entrada del pasillo para que camine dentro de la caja. Retire el papel gráfico del suelo del pasillo y repita la prueba hasta obtener una buena impresión representativa de ambas patas delanteras.
- A partir de las impresiones obtenidas, seleccione una con impresiones claras y sucesivas, fotografíelas en formato tiff o jpeg y mida los siguientes parámetros utilizando el software de acceso abierto FIJI35.
NOTA: En primer lugar, calibrar cada imagen con las marcas en el papel gráfico (Analizar ? Establecer escala) En segundo lugar, convertir cada imagen a un formato de 8 bits (Imagen ? Tipo de la clase de texto (Type 8 bits). Posteriormente, usa la Herramienta Selección Rectangular para seleccionar la impresión de la pata. Recortar esta porción de la imagen (Imagen ? Recortar). En cada imagen, resalte las huellas de las patas y elimine el fondo mediante el umbral de la imagen (Imagen ? Ajustar ? Umbral).- Mida el factor de postura midiendo el área de impresión de la pata. Utilice la herramienta Selección rectangular para seleccionar la impresión de la pata y pulse Control + M.
- Mida el factor de longitud de impresión midiendo la longitud más larga de la impresión de la pata (para los pasos 3.8.3.2–3.8.3.6, utilice la herramienta Selección de línea recta para seleccionar los dos puntos más distantes y presione Control + M).
- Mida el factor de propagación del dedo midiendo el ancho más ancho de la impresión de la pata.
- Mida el factor de propagación del dedo intermedio midiendo el ancho más ancho entre el segundo y el tercer dedo.
- Mida la longitud de la zancada midiendo la distancia entre los puntos homólogos de las impresiones sucesivas de la pata en un lado dado.
- Mida la base del soporte midiendo la distancia perpendicular entre la parte central de la impresión de la pata y la dirección del movimiento29,,33,36.
NOTA: Realice las dos últimas mediciones en dos pares de impresiones de pata bilateral consecutivas representativas33.
4. Mediciones fisiológicas
- Termografía infrarroja (IRT)37,38,39.
- Asegúrese de que la temperatura de la habitación en la que se realizarán las mediciones se encuentra entre 18oC y 25oC utilizando un hidrotermómetro digital normal con una resolución térmica de 0,1oC. Asegúrese de que no haya fuentes de calor significativas (por ejemplo, computadoras o refrigeradores).
- Aclimatar a las ratas llevándolas a la sala de evaluación 2 h antes de la evaluación. Antes de iniciar el experimento, anestetiza a la rata como se describió anteriormente (pasos 1.3–1.6) o siguiendo el protocolo de la institución. Compruebe la falta de respuesta a un pellizco de dedo del dedo del dedo del tiempo antes de comenzar el experimento.
- Encienda la cámara termográfica infrarroja 15 minutos antes de la adquisición y no la apague durante las evaluaciones. Establezca el parámetro de emisividad de la cámara para que coincida con el de la piel de la rata (a 0,98)37,40,41.
- Coloque la rata sobre su dorso sobre una superficie limpia y estable con una esponja de polietileno. Asegúrese de que no haya materiales reflectantes y otras posibles fuentes de artefactos. Fije sus patas delanteras cuidadosamente en la supinación con cinta adhesiva de doble cara. Inserte un termómetro digital de 2 cm dentro del recto para monitorear la temperatura central de la rata durante todas las evaluaciones.
- Sostenga la cámara termográfica en un ángulo de 90o y 30 cm de distancia de la rata. Enfoca la cámara en todo el cuerpo del animal. Obtener tres imágenes de termografía infrarroja separadas 30 s.
- Transfiera los termogramas adquiridos a un ordenador y analícelos utilizando un software de análisis. Definir la temperatura de la superficie plantar de ambas patas delanteras utilizando una región rectangular fija de interés (por ejemplo, 9 x 11 píxeles) en el territorio plantar del MN, por ejemplo en el centro de la primera almohadilla de pie metacarpal(Figura 1). Usando el software gratuito FLIR Tools, seleccione la termografía haciendo doble clic en él. En la barra de herramientas izquierda, seleccione el botón"Agregar herramientade medición de cuadro" y dibuje un rectángulo de 9 * 11 píxeles sobre el área plantar de ambas patas delanteras. Al ajustar el rectángulo, se puede confirmar su dimensión en píxeles. Realizarlo en ambas patas delanteras. En el lado derecho de la imagen encontrará las temperaturas máximas, mínimas y medias.
- Sobre el ROI previamente dibujado, haga clic con el botón derecho y seleccione exportar. Las temperaturas medias, máximas y mínimas, así como una matriz de temperaturas del ROI se exportan a un documento .csv. Estos datos se pueden explorar más adelante utilizando el software de análisis de datos.
- Evaluación electroneuromiográfica (ENMG)
- Configure un estimulador eléctrico. Tape un par de agujas de acupuntura desechables (0,25 mm x 25 mm) con una impedancia insignificante [<1o]) y 25 mm entre ellas para crear electrodos para la estimulación. Ahora conecte el estimulador y el electrodo a una unidad de adquisición de datos para tomar las señales entrantes y convertirlas en señales digitales que se pueden procesar con el software informático.
- Realizar las evaluaciones en la misma sala, y siempre bajo las mismas condiciones ambientales controladas42,,43,44. Apriete el antepieco para asegurarse de que las ratas están profundamente anestesiadas antes de iniciar la adquisición de datos.
NOTA: La anestesia profunda es de suma importancia para minimizar la variabilidad asociada con los movimientos espontáneos voluntarios y/o involuntarios por parte de las ratas43. - Exponga el MN en ambos lados bajo el microscopio quirúrgico como se describe en los pasos 1.8–1.13. Utilice una cuchilla de bisturí número 15 para prolongar las incisiones braquiales en los antebrazos con una incisión de línea media ventral.
- Exponer el aspecto superficial de los músculos flexor digitorum sublimis separando sin rodeos la fascia antebraquial sobrecuesta usando tijeras de iris. Inserte la aguja de tierra en el músculo femoris del cuádriceps de la extremidad posterior izquierda para conectar el enchufe de tierra de la señal.
- Comience con la pata delantera derecha y coloque los electrodos de registro en el vientre muscular flexor digitorum sublimis de la pata delantera y el electrodo de estimulación proximal al sitio de la lesión en el MN. Humedezca estos electrodos con salina.
- Asegúrese de que el software está configurado de la siguiente manera: puerto de entrada de canal 1 (CH1) – estimulador a 0-10 V; y el puerto de entrada de canal 2 (CH2) - EMG a 30–1,000 Hz. Comience eligiendo una amplitud de estimulación de 10 mV y registre los potenciales de acción muscular compuesta CMAPs frecuencia de muestreo de 50 kHz para una duración de 40.000 ms. Aumentar gradualmente la amplitud de estimulación en pasos de 10 mV hasta llegar a 2.000 mV. Repita lo mismo para la pata izquierda42,43,44.
NOTA: La señal se amplifica a 1.000x y se filtra utilizando una banda de 30 a 1.000 Hz. La salida de estimulación se establece para un solo pulso con una duración de 1 ms42,,43,44. - Abra el archivo grabado en el software del aparato de grabación.
NOTA: Por defecto, la pantalla mostrará las ventanas de remolque en la parte superior en rojo, los pulsos del estimulador, y por debajo en azul la grabadora ENMGs. Al deslizar la barra de desplazamiento horizontal debajo de la escala de tiempo, se permite la visualización del registro completo. Las dos herramientas principales, la herramienta Zoom y la herramienta I-Beam, se encuentran en la parte inferior derecha del panel. Con la herramienta Zoom, es posible optimizar la visualización de los CMAP y explorar los gráficos. Para garantizar un buen ajuste en la pantalla de visualización, puede ser necesario ajustar la visualización después del zoom. Para ello, seleccione Visualizar ( Display) Escalar automáticamente las formasde onda . La herramienta viga I permite la selección de áreas específicas de los gráficos y el rendimiento de las mediciones deseadas. En la parte superior de los gráficos, hay tres ventanas pequeñas donde se muestran las medidas. P-P muestra el valor de amplitud promedio del área seleccionada en voltios (tanto en el registro del estimulador como en en ENMGs), mientras que Delta-T muestra el intervalo de tiempo de esa selección. - Mida los parámetros del potencial de acción muscular compuesta (CMA, descrito en la Tabla 1) utilizando las herramientas de medición homónima del plug de software "Toolbox para la clasificación no supervisadade MUAPs y potencialesde acción en EMG "45.
- Para cada rata, determine un valor mínimo de voltaje de estimulación después del cual la amplitud de los CMAP no aumenta aún más. Comience a partir de un estímulo de 0,05 mV y dé estímulos crecientes sucesivos en voltajes incrementales de 0,05 mV.
- Aplicar un estímulo 20% por encima de este voltaje con el fin de obtener un valor de estimulación supramaximal.
- Después de determinar este último valor y aplicar el estímulo correspondiente, registre los siguientes parámetros de los CMAP.
- Evaluación de la fuerza de flexión
- Utilice los mismos electrodos de estimulador y estimulación para estimular eléctricamente el MN que en el paso 4.2. Ajuste el canal de entrada CH1 como estimulador (0-10 V) y los ajustes de salida para la duración de los estímulos de 30 s con pulsos de 1 ms de duración y frecuencia de 1 Hz. Vincule un dinamómetro, con una resolución de d a 0,001 N a un ordenador.
NOTA: La visualización en tiempo real de los datos se puede obtener mediante la construcción de una gráfica de fuerza por tiempo (N/s) utilizando el software previamente instalado en el ordenador y vinculado a un dinamómetro46. - Coloque la rata como se describe en el paso 4.1.4. Coloque un bucle de sutura de seda 5/0 a través del segundo espacio interosseo de ambas patas delanteras. Fije el bucle de sutura al gancho del dinamómetro y la pata delantera alineada con el dinamómetro sin poner una tensión excesiva en la línea de sutura.
- Fije la pata contralateral con cinta adhesiva para evitar interferencias de movimiento espurias en las lecturas del dinamómetro.
- Establezca el dinamómetro en cero haciendo clic en el botón CERO.
- Ajuste el estimulador a una estimulación de amplitud supramáxima de 1,5 V ajustando el nudo de tensión.
- En el PC, abra el software AFH-01. Abra el separador "Dispositivo"y seleccione el dispositivo FH5. Cree un nuevo archivo("Medidas1" es el nombre dado de forma predeterminada) y cambie el nombre del archivo.
- Coloque el electrodo en la parte proximal del MN, haga clic en el juego en la parte inferior del programa, registre el tirón en el dinamómetro durante 30 s.
- Importe los valores obtenidos a un software de análisis de datos. Calcule los valores de fuerza máxima y media y el área debajo de la curva (AUC) para el gráfico de fuerza x tiempo para cada evaluación.
- Repita para la pata delantera izquierda.
- Utilice los mismos electrodos de estimulador y estimulación para estimular eléctricamente el MN que en el paso 4.2. Ajuste el canal de entrada CH1 como estimulador (0-10 V) y los ajustes de salida para la duración de los estímulos de 30 s con pulsos de 1 ms de duración y frecuencia de 1 Hz. Vincule un dinamómetro, con una resolución de d a 0,001 N a un ordenador.
- Peso muscular
- Eutanasia a las ratas bajo anestesia general por exsanguinación47,48.
- Cosecha el músculo flexor carpi radialis de ambos antebrazos, disección el músculo de su origen hasta su inserción del tendón distal, utilizando una hoja de bisturí número 15.
- Pesar los músculos con una escala de precisión9,49.
Resultados
Un total de 34 ratas se dividieron aleatoriamente en los siguientes grupos: Sham (n.o 17), Escisión (n x 17) e Injerto nervioso (n x 10) para la operación. Todas las ratas sobrevivieron a la cirugía y al postoperatorio sin incidentes. Una semana después de la cirugía y durante los siguientes 100 días, todos los animales se sometieron a las pruebas funcionales descritas anteriormente una vez a la semana. Los resultados representativos de cada una de estas pruebas se describen a continuación.
Prueba de agarre
El porcentaje de ratas con una respuesta positiva en la prueba de agarre fue más alto para el grupo Sham. Este valor aumentó gradualmente con el tiempo en ratas de los grupos de Crush y Nerve Graft (Figura 3).
Prueba de Pin Prick
Las ratas del grupo Sham tuvieron las mejores puntuaciones en la prueba acumulativa de pin prick en relación con las ratas del grupo Nerve Graft. Ambos tenían mejores puntuaciones que las ratas en el grupo de escisión (Figura 4).
Prueba de funcionamiento de escalera
La velocidad de las ratas en la prueba de funcionamiento de la escalera fue más alta en el grupo Sham que en las ratas sometidas a la lesión MN. Entre estos últimos, el tiempo para ejecutar la escalera tendió a disminuir con el tiempo, paralelización de la recuperación de MN (Figura 5).
Prueba de cuerda
Al igual que en la prueba de carrera de escalera, el tiempo que las ratas tardaron en subir la cuerda fue más corto en el grupo Sham en comparación con los grupos en los que el MN resultó herido. La velocidad de las ratas en esta prueba aumentó cuando se permitió que el MN se recuperara(Figura 6).
Análisis de pista a pie
El análisis de las pistas para caminar tendió a mostrar cambios en la morfología de las huellas de las patas(Figura 7). Estos cambios fueron a menudo más pronunciados en lesiones por aplastamiento que en lesiones nerviosas segmentales50.
Termografía infrarroja
La termografía fue útil al examinar las diferencias de temperatura entre las patas delanteras en los primeros 30 días después de la cirugía. Las diferencias de temperatura eran más notables en ratas con un MN más gravemente herido, como en las del grupo de escisión (Figura 8 y Figura 9).
Electroneuromiografía
La Tabla 1 resume la importancia biológica de las mediciones de electroneuromiografía, proporcionando resultados representativos para los diferentes grupos experimentales. Se observaron varios patrones con electroneuromiografía. Un CMAP normal era típico de una rata del grupo Sham, mientras que un CMAP polifásico se asoció con un grado variable de lesión del MN, como en los grupos Destelento y injerto nervioso (Figura 10). En el grupo de la Escisión, no se observaron CMAP.
Fuerza de flexión de la muñeca
Dado que la flexión de la muñeca depende principalmente de la MN, esta prueba se utilizó para evaluar la recuperación motora en el territorio de este nervio. La fuerza de flexión dela muñeca era más cercana a lo normal cuando la recuperación era máxima(Figura 11).
Peso muscular y morfología
El peso y la morfología del músculo flexor carpis radialis dependían de la recuperación de MN, ya que este músculo está inervado exclusivamente por el MN9,,10. Así, el peso normal y la morfología se observaron en el grupo Sham. Se observó una pérdida de peso y trofismo muscular en los grupos Crush, Nerve Grafty Escision (Figura 12).
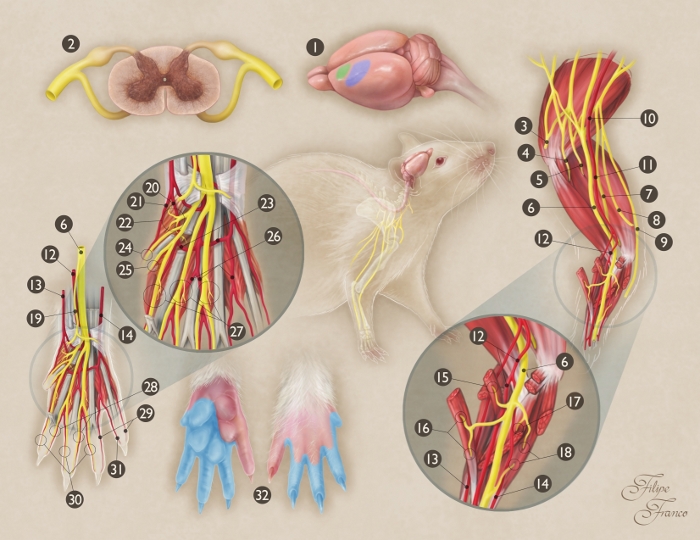
Figura 1: Representación esquemática de la anatomía del nervio mediano de la rata.
(1) Origen y terminación del nervio mediano en el cerebro de la rata (área verde - área motora primaria; área azul - área sensorial primaria). (2) Sección transversal de la médula espinal a nivel de segmento C7; (3) Nervio axilar; (4) Nervio musculocutáneo; (5) Nervio radial; (6) nervio mediano; (7) Nervio ulnque; (8) Rama medial cutáneo del brazo; (9) Rama medial cutánea del antebrazo; (10) Arteria axilar; (11) Arteria braquial; (12) Arteria mediana; (13) Arteria radial superficial; (14) Arteria Ulnar; (15) Rama motora del nervio mediano hasta el músculo pronator teres; (16) Rama motora del nervio mediano hasta el músculo flexor carpis radialis; (17) Rama motora del nervio mediano hasta el músculo flexor digitorum superficialis; (18) Rama motora del nervio mediano hasta el músculo flexor digitorum profundus; (19) Rama sensorial del nervio mediano a la región de la nar; (20) Arteria palmar común del primer espacio interosseo; (21) Arteria digital radial palmar del primer dígito; (22) Rama motora del nervio mediano a los músculos tenar; (23) Arco arterial palmar; (24) nervio digital radial palmar del primer dígito; (25) nervio digital palmar Ulnar del primer dígito; (26) Arteria palmar común del tercer espacio interosseo; (27) Ramas motoras de las divisiones terminales del nervio mediano a los tres primeros músculos lumbricales; (28) los nervios digitales palmar de Ulnar de los dígitos segundo, tercero y cuarto; (29) Arterias digitales palmar ulnar a los dígitos cuarto y quinto; (30) nervios digitales radiales palmar de los dígitos segundo, tercero y cuarto; (31) Arteria digital radial palmar del quinto dígito; (32) Territorio de la piel del nervio mediano en la pata delantera (región de sombra azul). Haga clic aquí para ver una versión más grande de esta figura.
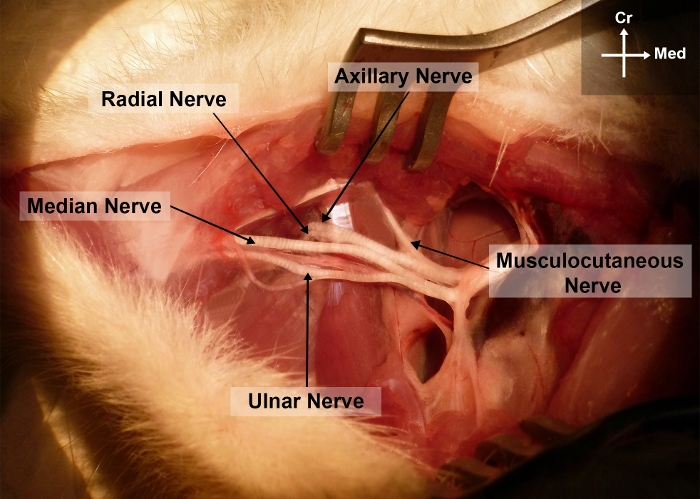
Figura 2: Fotografía de la extremidad delantera derecha de la rata que muestra la anatomía quirúrgica del nervio mediano en el brazo y las regiones axilares.
Cr, craneal; Yo, medial Por favor, haga clic aquí para ver una versión más grande de esta figura.
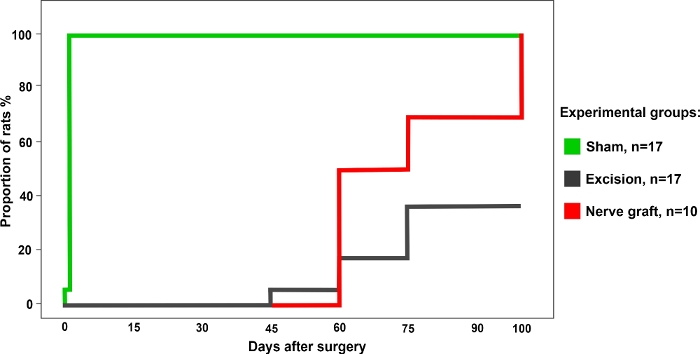
Figura 3: Porcentaje de ratas con una prueba de agarre positiva en el grupo experimental diferente durante un período de 100 días después de la cirugía. Haga clic aquí para ver una versión más grande de esta figura.
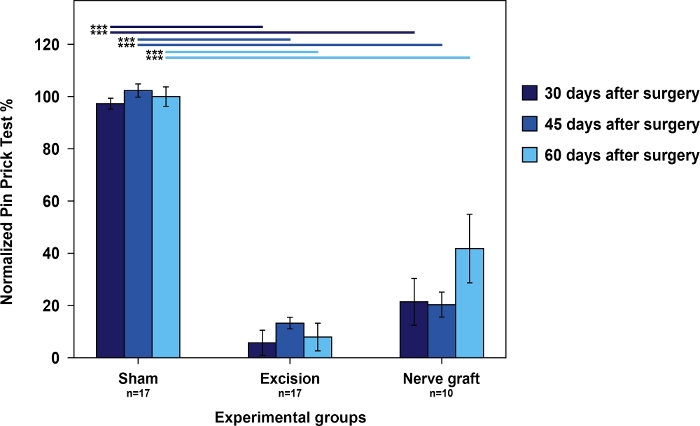
Figura 4: Evaluación de la nocinación utilizando resultados acumulativos de la prueba de pinchazo en la pata delantera operada normalizada a la pata contralateral en los diferentes grupos experimentales.
Las barras verticales representan intervalos de confianza del 95%. Las líneas horizontales en la parte superior de la figura indican diferencias estadísticamente significativas entre los grupos experimentales, ***p<0.001. Haga clic aquí para ver una versión más grande de esta figura.
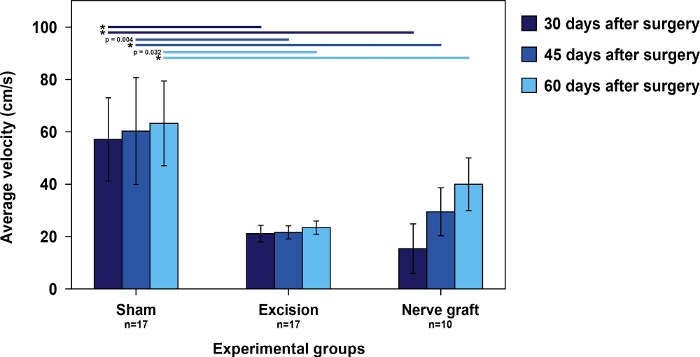
Figura 5: Velocidad media en la prueba de funcionamiento de la escalera en los diferentes grupos experimentales.
Las barras verticales representan intervalos de confianza del 95%. Los asteriscos en la parte superior de la figura indican diferencias estadísticamente significativas entre grupos, *p<0.001. Haga clic aquí para ver una versión más grande de esta figura.
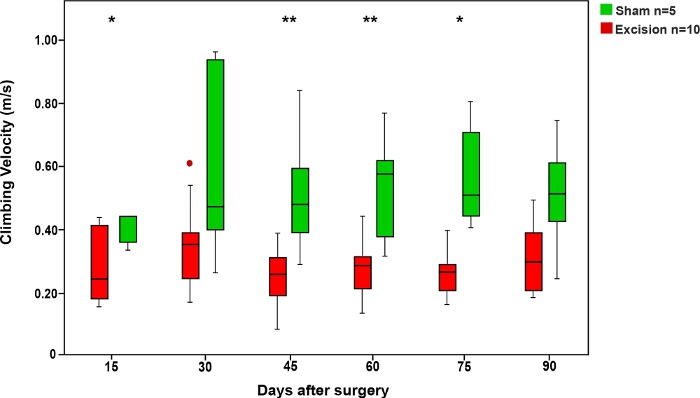
Figura 6: Velocidad media de escalada en la prueba de cuerda en los grupos Sham y Escisión.
Las barras verticales representan intervalos de confianza del 95%. Los asteriscos en la parte superior de la figura muestran diferencias estadísticamente significativas entre los grupos, *p<0.05; **p<0.01. Haga clic aquí para ver una versión más grande de esta figura.
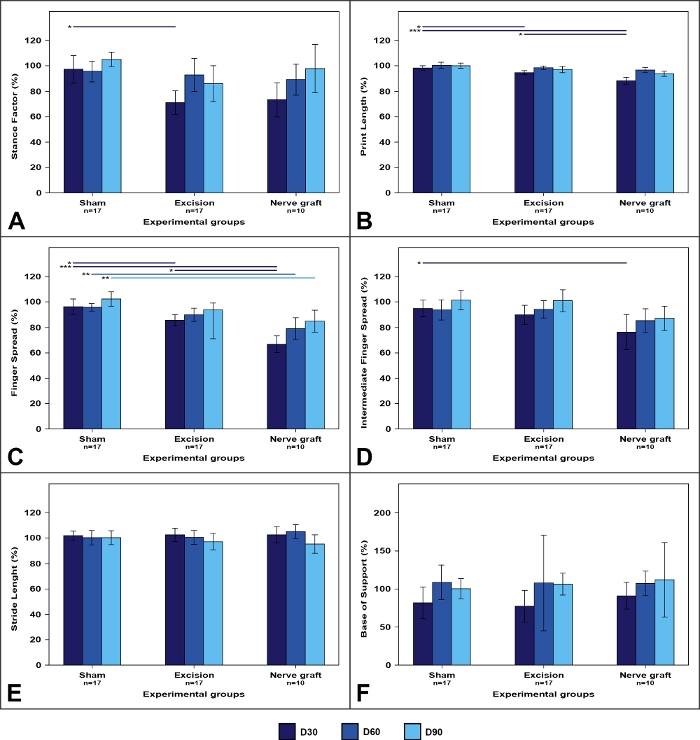
Figura 7: Parámetros de pista a pie en los diferentes grupos experimentales.
Los valores en la extremidad operada se expresan como porcentajes de medios normalizados a la extremidad contralateral. (A) Factor de postura; (B) Longitud de impresión; (C) Factor de propagación del dedo; (D) Factor de propagación del dedo intermedio; (E) Longitud de zancada; (F) Base de soporte. Las barras verticales representan intervalos de confianza del 95%. Las líneas horizontales en la parte superior de la figura indican diferencias estadísticamente significativas entre los grupos experimentales. D30, D60, D90 a 30, 60 y 90 días después de la cirugía, *p<0.05; **p<0.01; p<0.001. Haga clic aquí para ver una versión más grande de esta figura.
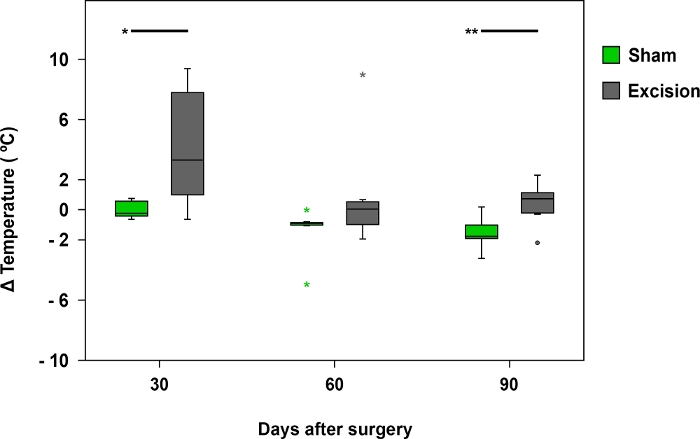
Figura 8: Diferencia media de temperatura registrada por termografía infrarroja.
Las gráficas de caja representan la diferencia de temperatura entre la región palmar del nervio mediano en el lado operado (lado derecho) y el lado contralateral (izquierda) en los grupos Sham (n a 17) y Escisión (n a 17), *p<0.05; **p<0.01. Haga clic aquí para ver una versión más grande de esta figura.
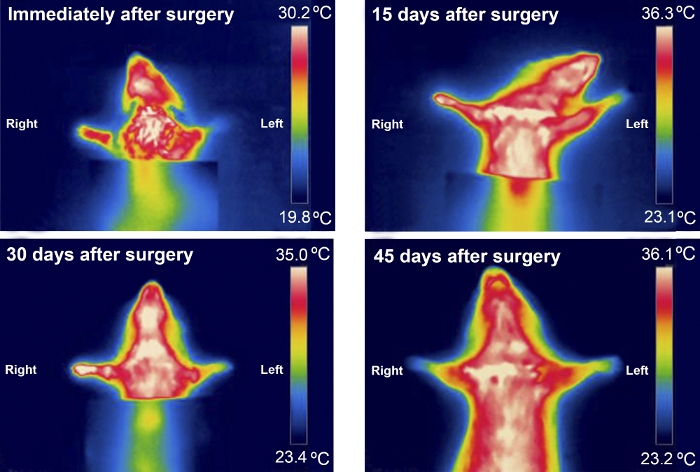
Figura 9: Patrón típico de termografía infrarroja de un animal del grupo de escisión durante los primeros 45 días después de la cirugía. Haga clic aquí para ver una versión más grande de esta figura.
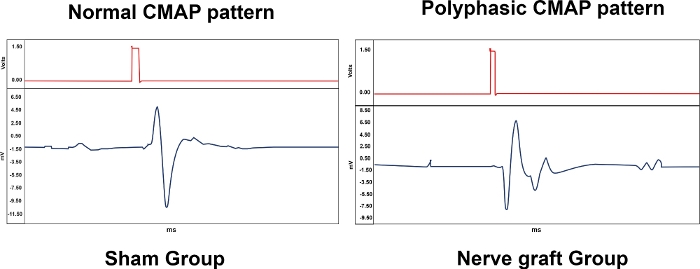
Figura 10: Patrones típicos de potenciales de acción muscular compuesta(CMAP) de un animal de los grupos Sham e Nerve Graft 90 días después de la cirugía. Por favor, haga clic aquí para ver una versión más grande de esta figura.
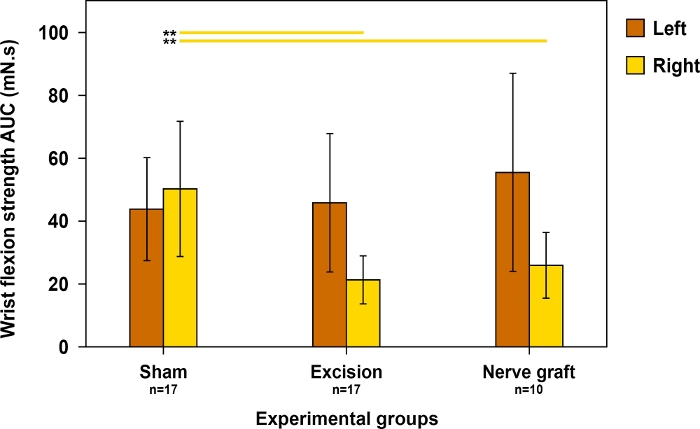
Figura 11: Evaluación de la fuerza de flexión de la muñeca en ambas patas de 60 días postoperatorias en diferentes grupos experimentales.
La fuerza de flexión de la muñeca se evaluó utilizando el área bajo la curva (AUC) durante un período de tiempo de 30 s y utilizando estimulación supratetánica. Las líneas verticales denotan intervalos de confianza del 95%. Las líneas horizontales en la parte superior de la figura resaltan las diferencias estadísticamente significativas entre los grupos, **p<0.01. Haga clic aquí para ver una versión más grande de esta figura.
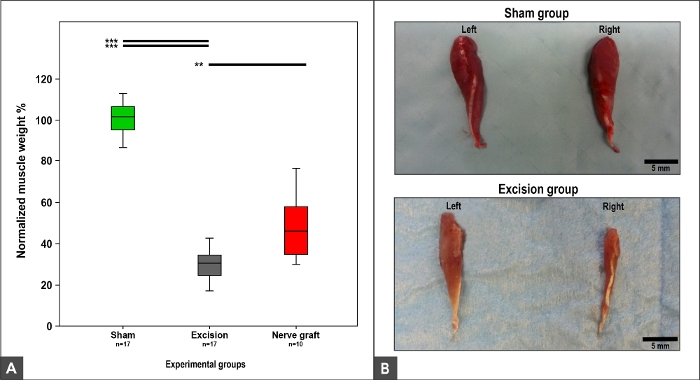
Figura 12: Flexor carpi radialis peso muscular y apariencia macroscópica 100 días después de la cirugía.
(A) Cajas que representan el peso muscular normalizado flexor carpi radialis en diferentes grupos experimentales, **p<0.01; p<0.001. (B) Fotografías de los músculos de los lados derecho e izquierdo en los grupos experimentales Sham y Escision. Haga clic aquí para ver una versión más grande de esta figura.
| Parámetro | Importancia del parámetro | Grupo Sham | Grupo de escisión | Grupo NG |
| Umbral de estimulación neurológica (%) | Evaluación de la regeneración nerviosa, ya que se requiere un número mínimo de fibras nerviosas para producir un CMAP o una contracción muscular visible12 | 281,63 a 271,65 | 5359,98 a 3466,52 | 2108,12 a 2115,13 |
| Umbral de estimulación motora (%) | Evaluación de la regeneración nerviosa, ya que se requiere un número mínimo de fibras nerviosas para producir un CMAP o una contracción muscular visible12 | 462,52 a 118,91 | 1694,10 a 503,24 | 1249,50 a 503,24 |
| Latencia (%) | Evaluación de la velocidad de conducción nerviosa en las fibras nerviosas más rápidas, es decir, las fibras mielinizadas más grandes44 | 113,55 a 25,04 | N/A | 132,80 a 69,95 |
| Velocidad de transducción neuromuscular (%) | Evaluación de la velocidad de conducción nerviosa en las fibras nerviosas más rápidas, es decir, las fibras mielinizadas más grandes44 | 92,01 a 20,88 | N/A | 91,30 a 26,51 |
| Amplitud de CMAPs (%) | Evaluación del número de unidades motoras reinnervated34 | 110,63 x 45,66 | N/A | 41,60 a 24,84 |
| Duración de los CMAP (%) | Evaluación de la sincronía de la inervación muscular, que depende del grado de reinnervación muscular y mielinización de las fibras motoras de inervación44,45 | 101,12 a 23,92 | N/A | 151,06 a 54,52 |
|
NG, injerto nervioso CMAPs, potencial de acción muscular compuesta. N/A, no aplicable Todos los parámetros se expresan como porcentajes de los valores contralaterales promedio. Las variables numéricas se expresan como promedio de desviación estándar. | ||||
Tabla 1: Evaluación electroneuromiográfica al final del experimento.
Discusión
Este documento presenta un protocolo para crear diferentes tipos de lesiones MN y reparar en la rata. Además, ilustra cómo evaluar la recuperación funcional de este nervio utilizando varias pruebas conductuales no invasivas y mediciones fisiológicas.
En particular, varias de las pruebas funcionales descritas en este artículo, a saber, la prueba de funcionamiento de escalera y la prueba de cuerda, dependen significativamente de la voluntad de la rata para realizar la tarea con la expectativa de obtener la recompensa alimentaria51,52,53. Cabe señalar que ciertas cepas de ratas son más susceptibles de entrenar y realizar de forma reproducible en este tipo de pruebas51,,52,,53. Por ejemplo, las ratas Lewis tienen un bajo rendimiento en estas pruebas tanto en la fase de entrenamiento como posteriormente51,,52,53.
La vivienda de ratas debe permitir una amplia libertad de movimiento de acuerdo con su comportamiento exploratorio natural, además de permitir que los animales experimentales se familiaricen con algunos de los elementos presentes en las pruebas funcionales19. Por lo tanto, se muestran diferentes formas de vivienda que permiten una mayor libertad de movimiento. Las jaulas grandes están personalizadas con elementos de enriquecimiento que luego se utilizan en las pruebas funcionales (por ejemplo, cuerdas y escaleras).
Podría decirse que estos elementos enriquecedores, así como las jaulas con ruedas de running incorporadas y las esferas de entrenamiento individuales proporcionan una forma de fisioterapia postoperatoria similar a la ofrecida a los pacientes humanos operados en el sistema nervioso periférico10.
Significativamente, aunque algunos autores abogan por diseccionar los tejidos subcutáneos y las fascias musculares sin rodeos o mediante el corte limpio con un bisturí número 15, se recomienda el uso de termocauterización al diseccionar estas estructuras para minimizar el riesgo de hematoma postoperatorio.
Cabe señalar que se han ideado numerosas pruebas para probar diferentes aspectos de la reparación del nervio periférico en la rata, a saber, la regeneración axonal, la reinnervación objetivo y la recuperación funcional, algunas de las cuales están fuera del alcance de este estudio29,,54,,55,,56. Por ejemplo, el análisis cinemático29,36,55 y la evaluación histomorfométrica29,36,57 son ampliamente empleados por múltiples autores. Además, varias de estas pruebas implican variaciones para maximizar la eficiencia y/o reproducibilidad54. Por ejemplo, la algisemetría mecánica (es decir, la evaluación de las respuestas a los estímulos mecánicos dolorosos) puede evaluarse cualitativamente utilizando un filamento von Frey determinado, como se describe en el presente documento, o utilizando semicuantitativamente filamentos von Frey sucesivamente más fuertes, o incluso cuantitativamente utilizando dispositivos electrónicos que aplican presiones crecientes hasta que se observe una respuesta de retirada30,54.
Del mismo modo, aunque varios autores utilizan el análisis de la vía para caminar para evaluar la reparación del nervio de las extremidades anteriores en la rata, otros autores argumentan que las lesiones de MN individuales con frecuencia no producen cambios reproducibles en las huellas de patas10,58,59. Además, algunos han declarado que estos cambios pueden no ser proporcionales a la recuperación muscular10,60. Teniendo esto en cuenta, algunos investigadores han abogado por el uso de análisis de vías de marcha en la pata delantera principalmente al evaluar la recuperación después de aplastar lesiones neve en lugar de después de la reconstrucción del nervio segmental10,50,61.
La prueba de agarre se utiliza ampliamente para evaluar la recuperación motora de los músculos controlados por el MN16,,27. Para garantizar la uniformidad y reproducibilidad de los datos obtenidos con esta prueba, se recomienda aplicar la Prueba de Agarre utilizando la metodología bien establecida propuesta por Bertelli et al.16. Sin embargo, el protocolo actual difiere en que no inmoviliza rutinariamente la pata contralateral para evitar tensiones indebidas11,27. También hay que señalar que otros autores, después de inmovilizar la pata no lesionada, evalúan cuantitativamente la prueba de agarre utilizando un dinamómetro o una escala27,56. Sin embargo, esta evaluación cuantitativa puede verse afectada por la fuerza que el investigador aplica a la cola de la rata26. Además, es difícil distinguir entre la fuerza generada por los músculos flexores digitales (únicamente internado por el MN en la rata y el objeto de la Prueba de Agarre9)de la fuerza producida por los flexores de muñeca, que incluyen el flexor carpi ulnaris que recibe su inervación del nervio cubital9,10,27. Con el fin de tratar de eludir estos posibles sesgos, este protocolo utiliza una escala ordinal similar a la escala del Consejo de Investigación Médica comúnmente utilizada para calificar la fuerza muscular en los seres humanos10,,11,62. Alternativamente, otros autores han descrito la evaluación detallada de la comprensión mediante el análisis de vídeo y un sistema de puntuación basado en vídeo11,63.
Una desventaja potencial de usar el MN en comparación con el nervio ciático es que una mayor cantidad de información está disponible con respecto a este último nervio. Esto, a su vez, puede hacer más difícil comparar los datos obtenidos con el MN con los de trabajos experimentales anteriores46,48,64. Además, el tamaño más pequeño del MN en comparación con el nervio ciático hace que la manipulación quirúrgica sea más difícil8,12,27,56,65.
Contrariamente a la metodología descrita en este documento, la evaluación de la electroneuromiografía se puede realizar utilizando electrodos monopolosos transcutáneos colocados en el brazo y en las regiones nar51. A pesar de ser menos invasivo, este método conlleva el riesgo de confusión potencial debido a la posibilidad de coestimulación del nervio cubital en la región del brazo9,,51.
La mayoría de los autores coinciden en que no todas las pruebas utilizadas en la rata proporcionan resultados concordantes, ya que la reparación del nervio periférico depende de una compleja gama de factores, que comprenden la supervivencia de las neuronas, el alargamiento y la poda axonales, la sinaptogénesis, la recuperación exitosa de los órganos sensoriales denervados y las unidades motoras, y la plasticidad cerebral7,,10,50,,66,,67.
Por último, cabe señalar que una advertencia significativa de modelos de roedores es que los nervios periféricos de rata están mucho más cerca de sus órganos finales y tienen áreas transversales mucho más pequeñas que las estructuras humanas homólogas. Sin embargo, esta diferencia de tamaño garantiza datos experimentales más rápidos en roedores, y mejores resultados generales en ratas en comparación con los seres humanos se esperan68. De hecho, varios autores advierten que se debe tener cuidado al tratar de extrapolar los datos experimentales obtenidos en la reparación de los nervios periféricos utilizando roedores a los seres humanos7,69. Los modelos de primates se consideran más comparables70. Sin embargo, su uso está asociado con las molestas restricciones éticas, logísticas y presupuestarias71.
A pesar de que el nervio ciático es el nervio más comúnmente utilizado en la investigación del nervio periférico, la rata MN presenta múltiples ventajas. Por ejemplo, las lesiones MN se asocian con una menor incidencia de contracturas articulares y automutilación de la pata afectada11,12,16,56. Significativamente, la autotomía posterior a la transección del nervio ciático afecta al 11-70% de las ratas. Esto puede hacer que las evaluaciones actuales como el índice ciático imposible14. Esto, a su vez, hace que la estimación del número de animales necesarios para obtener un poder estadístico determinado engorroso15.
Además, como el MN es más corto que el nervio ciático, la recuperación del nervio se observa antes58,,72,73,74,75,76. Además, el MN no está cubierto por masas musculares, por lo que su disección técnicamente más fácil que la del nervio ciático16. Además, el MN tiene un camino paralelo al nervio cubital en el brazo. Por lo tanto, el nervio cubital se puede utilizar fácilmente como injerto nervioso para reparar lesiones de MN. Finalmente, en los seres humanos, la mayoría de las lesiones del nervio periférico se producen en la extremidad superior, lo que apoya aún más el uso de este nervio en la rata77,78.
Podría decirse que los roedores son los animales experimentales más utilizados en el ámbito de la reparación del nervio periférico48,,79. Como se muestra, la rata MN es un modelo conveniente de lesión y reparación del nervio periférico. De hecho, existen múltiples estrategias estandarizadas disponibles para evaluar la recuperación motora y sensorial, permitiendo una comparación más fácil de los resultados36,,46,,60,,80,,81,,82. Muchos de estos métodos no son invasivos, lo que permite la evaluación diaria.
Además, la fisioterapia es parte del estándar de atención de los pacientes que se recuperan de lesiones en los nervios periféricos. Como se demuestra en este artículo, hay múltiples estrategias para proporcionar un entorno de fisioterapia postoperatoria-como a las ratas sometidas a lesiones MN4,5. Por lo tanto, este modelo es particularmente adecuado para replicar el escenario clínico, facilitando la extrapolación de resultados a la especie humana12,,27,48,56,58,83.
Como se muestra en este artículo, hay múltiples estrategias estandarizadas disponibles para evaluar la recuperación motora y sensorial en el modelo MN de la rata. La mayoría de estos son procedimientos no invasivos, lo que permite la evaluación frecuente. Además, como la mayoría de las lesiones del nervio periférico en la especie humana se producen en la extremidad superior, los ajustes de fisioterapia experimental mencionados pueden imitar más acertadamente la recuperación en el contexto clínico. Podría decirse que esto puede facilitar la extrapolación de los resultados a la especie humana, validando aún más el uso de este nervio en la rata.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Diogo Casal recibió una beca del Programa de Educación Médica Avanzada, que es patrocinado por la Fundación Calouste Gulbenkian, Fundación Champalimaud, Ministério da Saúde e Fundación para la Ciencia y Tecnologia, Portugal. Los autores están muy agradecidos al Sr. Filipe Franco por el dibujo ilustrativo de la Figura 1. Los autores quieren agradecer la ayuda técnica del Sr. Alberto Severino en el rodaje y edición del vídeo. Por último, los autores desean agradecer a la Sra. Sara Marques su ayuda en todos los aspectos logísticos relacionados con la adquisición y el mantenimiento de animales.
Materiales
| Name | Company | Catalog Number | Comments |
| Acetaminophen | Amazon | https://www.amazon.com/Childrens-Tylenol-grape-flavor-ages/dp/B0051VVVZG | |
| Acland clamps | Fine Science Tools | 00398 V | http://www.merciansurgical.com/aclandclamps.pdf |
| Acland Single Clamps B-1V (Pair) | Fine Science Tools | 396 | http://www.merciansurgical.com |
| Biogel Surgical Gloves | Medex Supply | 30465 | https://www.medexsupply.com |
| BSL Analysis | BIOPAC Systems | https://www.biopac.com/ | |
| Castroviejo needle holders | Fine Science Tools | 12565-14 | http://s-and-t.ne |
| Clamp applicator | Fine Science Tools | CAF-4 | http://www.merciansurgical.com/acland-clamps.pdf |
| Constante voltage stimulator | BIOPAC Systems | STM200 | https://www.biopac.com/product/constant-voltage-stimulator-unipolar-pulse/ |
| Cutasept skin disinfectant | Bode Chemie | http://www.productcatalogue.bode-chemie.com/products/skin/cutasept_f.php | |
| Dafilon 10-0 | G1118099 | http://www.bbraun.com/cps/rde/xchg/bbraun-com/hs.xsl/products.html?prid=PRID00000816 | |
| Derf Needle Holders 12 cm TC | Fine Science Tools | 703DE12 | http://www.merciansurgical.com |
| Dry heat sterilizer | Quirumed | 2432 | http://www.quirumed.com/pt/material-de-esterilizac-o/esterilizadores |
| Dynamometer | SAUTER | FH5 | https://www.sauter.eu/shop/en/measuring-instruments/force-measurement/FH-S/ |
| Electroneuromiography setup | BIOPAC Systems | MP36 | https://www.biopac.com/product/biopac-student-lab-basic-systems/ |
| Ethilon 5-0 | W1618 | http://www.farlamedical.co.uk/ | |
| FLIR Software | FLIR | ||
| Graeffe forceps 0.8 mm tips curved | Fine Science Tools | 11052-10 | http://www.finescience.de |
| Graph paper | Ambar | ||
| Heat Lamp HL-1 | Harvard Apparatus | 727562 | https://www.harvardapparatus.com/webapp/wcs/stores/servlet/haisku3_10001_11051_39108_-1_HAI_ProductDetail_N_37610_37611_37613 |
| Heparin Sodium Solution (Heparin LEO 10000IU/ml) | Universal Drugstore | http://www.universaldrugstore.com/medications/Heparin+LEO/10000IU%2Fml | |
| High-Temperature Cautery | Fine Science Tools | AA03 | http://www.boviemedical.com/products_aaroncauteries_high.asp |
| Homeothermic Blanket System with Flexible Probe | Harvard Apparatus | 507220F | https://www.harvardapparatus.com/webapp/wcs/stores/servlet/haisku3_10001_11051_39108_-1_HAI_ProductDetail_N_37610_37611_37613 |
| Infrared camera | FLIR | E6 | http://www.flir.eu/instruments/e6-wifi/ |
| Instrapac - Adson Toothed Forceps (Extra Fine) | Fine Science Tools | 7973 | http://www.millermedicalsupplies.com |
| Iris Scissors 11.5 cm Curves EASY-CUT | Fine Science Tools | EA7613-11 | http://www.merciansurgical.com |
| Ketamine hydrochloride/xylazine hydrochloride solution | Sigma- Aldrich | K113 | https://www.sigmaaldrich.com/catalog/product/sigma/k113?lang=pt®ion=PT |
| Lacri-lube Eye Ointment 5g | Express Chemist | LAC101F | http://www.expresschemist.co.uk/lacri-lube-eye-ointment-5g.html |
| Mayo Scissors 14 cm Straight Chamfered Blades EASY-CUT | Fine Science Tools | EA7652-14 | http://www.merciansurgical.com |
| Meloxicam | Recropharma | Mobic | https://www.recropharma.com/product-pipeline/meloxicam |
| Methylene Blue solution | Sigma- Aldrich | https://www.sigmaaldrich.com/catalog/product | |
| Micro Jewellers Forceps 11 cm straight 00108 | Fine Science Tools | JF-5 | http://www.merciansurgical.com |
| Micro Jewellers Forceps 11cm angulated 00109 | Fine Science Tools | JFA-5b | http://www.merciansurgical.com |
| Micro retractor | Fine Science Tools | RS-6540 | http://www.finescience.de |
| Micro Scissors Round Handles 15 cm Straight | Fine Science Tools | 67 | http://www.merciansurgical.com |
| Micro-vessel dilators 11 cm 0.3 mm tips 00124 | Fine Science Tools | D-5a.2 | http://www.merciansurgical.com |
| Monosyn 5-0 | 15423BR | http://www.mcfarlanemedical.com.au/15423BR/SUTURE-MONOSYN-5_or_0-16MM-70CM-(C0023423)-BOX_or_36/pd.php | |
| Normal saline for irrigation | Hospira, Inc. | 0409-6138-22 | http://www.hospira.com/en/search?q=sodium+chloride+irrigation%2C+usp&fq=contentType%3AProducts |
| Operating microscope | Leica Surgical Microsystems | http://www.leica-microsystems.com/products/surgical-microscopes/ | |
| Skin Skribe Surgical Skin Marker | Moore Medical | 31456 | https://www.mooremedical.com/index.cfm?/Skin-Skribe-Surgical-Skin-Marker/&PG=CTL&CS=HOM&FN=ProductDetail&PID=1740&spx=1 |
| Snacks | Versele-Laga | Complete Crock-Berry | http://www.versele-laga.com/en/complete/products/complete-crock-berry |
| Straight mosquito forcep | Fine Science Tools | 91308-12 | http://www.finescience.de |
| Surgical drapes | Barrier | 800430 | http://www.molnlycke.com/surgical-drapes/ |
| Veet Sensitive Skin Hair Removal Cream Aloe Vera and Vitamin E 100 ml | Veet | http://www.veet.co.uk/products/creams/creams/veet-hair-removal-cream-sensitive-skin/ |
Referencias
- Lad, S. P., Nathan, J. K., Schubert, R. D., Boakye, M. Trends in median, ulnar, radial, and brachioplexus nerve injuries in the United States. Neurosurgery. 66 (5), 953-960 (2010).
- Murovic, J. A. Upper-extremity peripheral nerve injuries: a Louisiana State University Health Sciences Center literature review with comparison of the operative outcomes of 1837 Louisiana State University Health Sciences Center median, radial, and ulnar nerve lesions. Neurosurgery. 65 (4), 11-17 (2009).
- Dy, C. J., Isaacs, J., Dy, C. J., Isaacs, J. . American Society for Surgery of the Hand surgical anatomy: nerve reconstruction Vol. 1. , (2017).
- Trehan, S. K., Model, Z., Lee, S. K. Nerve Repair and Nerve Grafting. Hand Clinics. 32 (2), 119-125 (2016).
- Boyd, K. U., Fox, I. K., Mackinnon, S. E. . Nerve surgery Vol. 1. , 75-100 (2015).
- Geuna, S., et al. Update on nerve repair by biological tubulization. Journal of Brachial Plexius Peripheral Nerve Injury. 9 (1), 3 (2014).
- Sulaiman, W., Gordon, T. Neurobiology of peripheral nerve injury, regeneration, and functional recovery: from bench top research to bedside application. Ochsner Journal. 13 (1), 100-108 (2013).
- Angelica-Almeida, M., et al. Brachial plexus morphology and vascular supply in the wistar rat. Acta Medica Portuguesa. 26 (3), 243-250 (2013).
- Bertelli, J. A., Taleb, M., Saadi, A., Mira, J. C., Pecot-Dechavassine, M. The rat brachial plexus and its terminal branches: an experimental model for the study of peripheral nerve regeneration. Microsurgery. 16 (2), 77-85 (1995).
- Casal, D., et al. Reconstruction of a 10-mm-long median nerve gap in an ischemic environment using autologous conduits with different patterns of blood supply: A comparative study in the rat. PLoS One. 13 (4), 0195692 (2018).
- Stößel, M., Rehra, L., Haastert-Talini, K. Reflex-based grasping, skilled forelimb reaching, and electrodiagnostic evaluation for comprehensive analysis of functional recovery-The 7-mm rat median nerve gap repair model revisited. Brain and Behavior. 7 (10), 00813 (2017).
- Manoli, T., et al. Correlation analysis of histomorphometry and motor neurography in the median nerve rat model. Eplasty. 14, 17 (2014).
- Ronchi, G., et al. The Median Nerve Injury Model in Pre-clinical Research - A Critical Review on Benefits and Limitations. Frontiers in Cellular Neuroscience. 13, 288 (2019).
- Weber, R. A., Proctor, W. H., Warner, M. R., Verheyden, C. N. Autotomy and the sciatic functional index. Microsurgery. 14 (5), 323-327 (1993).
- Charan, J., Kantharia, N. D. How to calculate sample size in animal studies. Journal of Pharmacology & Pharmacotherapeutics. 4 (4), 303-306 (2013).
- Bertelli, J. A., Mira, J. C. The grasping test: a simple behavioral method for objective quantitative assessment of peripheral nerve regeneration in the rat. Journal of Neuroscience Methods. 58 (1-2), 151-155 (1995).
- Casal, D., et al. A Model of Free Tissue Transfer: The Rat Epigastric Free Flap. Journal of Visualized Experiments. (119), e55281 (2017).
- Bertens, A. P. M. G., Van Zuthphen, L. F., Baumas, V., Beymen, A. C. Anaesthesia, analgesia and euthanasia. Principles of Laboratory Animal Science. , 277-311 (2001).
- Pritchett-Corning, K. R., Luo, Y., Mulder, G. B., White, W. J. Principles of rodent surgery for the new surgeon. Journal of Visualized Experiments. (47), e2586 (2011).
- Lee-Parritz, D. Analgesia for rodent experimental surgery. Israel Journal of Veterinary Medicine. 62 (3), 74 (2007).
- Roughan, J. V., Flecknell, P. A. Evaluation of a short duration behaviour-based post-operative pain scoring system in rats. European Journal of Pain. 7 (5), 397-406 (2003).
- Bauder, A. R., Ferguson, T. A. Reproducible mouse sciatic nerve crush and subsequent assessment of regeneration by whole mount muscle analysis. Journal of Visualized Experiments. (60), e3606 (2012).
- Ronchi, G., et al. Functional and morphological assessment of a standardized crush injury of the rat median nerve. Journal of Neuroscience Methods. 179 (1), 51-57 (2009).
- Matsumine, H., et al. Vascularized versus nonvascularized island median nerve grafts in the facial nerve regeneration and functional recovery of rats for facial nerve reconstruction study. Journal of Reconstructive Microsurgery. 30 (2), 127-136 (2014).
- Mickley, A. G., Hoxha, Z., Biada, J. M., Kenmuir, C. L., Bacik, S. E. Acetaminophen Self-administered in the Drinking Water Increases the Pain Threshold of Rats (Rattus norvegicus). Journal of the American Association for Laboratory Animal Science. 45 (5), 48-54 (2006).
- Mandillo, S., et al. Reliability, robustness, and reproducibility in mouse behavioral phenotyping: a cross-laboratory study. Physiological Genomics. 34 (3), 243-255 (2008).
- Papalia, I., Tos, P., Stagno d'Alcontres, F., Battiston, B., Geuna, S. On the use of the grasping test in the rat median nerve model: a re-appraisal of its efficacy for quantitative assessment of motor function recovery. Journal of Neuroscience Methods. 127 (1), 43-47 (2003).
- Costa, L. M., Simoes, M. J., Mauricio, A. C., Varejao, A. S. Chapter 7: Methods and protocols in peripheral nerve regeneration experimental research: part IV-kinematic gait analysis to quantify peripheral nerve regeneration in the rat. International Reviews in Neurobiology. 87, 127-139 (2009).
- Geuna, S., Varejao, A. S. Evaluation methods in the assessment of peripheral nerve regeneration. Journal of Neurosurgery. 109 (2), 360-362 (2008).
- Howard, R. F., Hatch, D. J., Cole, T. J., Fitzgerald, M. Inflammatory pain and hypersensitivity are selectively reversed by epidural bupivacaine and are developmentally regulated. Anesthesiology. 95 (2), 421-427 (2001).
- Metz, G. A., Whishaw, I. Q. Cortical and subcortical lesions impair skilled walking in the ladder rung walking test: a new task to evaluate fore- and hindlimb stepping, placing, and co-ordination. Journal of Neuroscience Methods. 115 (2), 169-179 (2002).
- Thallmair, M., et al. Neurite growth inhibitors restrict plasticity and functional recovery following corticospinal tract lesions. Nature Neuroscience. 1 (2), 124-131 (1998).
- Brown, C. J., et al. Self-evaluation of walking-track measurement using a Sciatic Function Index. Microsurgery. 10 (3), 226-235 (1989).
- Hruska, R. E., Kennedy, S., Silbergeld, E. K. Quantitative aspects of normal locomotion in rats. Life Science. 25 (2), 171-179 (1979).
- Ferreira, T., Rasband, W. ImageJ user guide. ImageJ/Fiji. 1, 155-161 (2012).
- Dijkstra, J. R., Meek, M. F., Robinson, P. H., Gramsbergen, A. Methods to evaluate functional nerve recovery in adult rats: walking track analysis, video analysis and the withdrawal reflex. Journal of Neuroscience Methods. 96 (2), 89-96 (2000).
- Ludwig, N., Formenti, D., Gargano, M., Alberti, G. Skin temperature evaluation by infrared thermography: Comparison of image analysis methods. Infrared Physics & Technology. 62, 1-6 (2014).
- Bennett, G. J., Ochoa, J. L. Thermographic observations on rats with experimental neuropathic pain. Pain. 45 (1), 61-67 (1991).
- Wakisaka, S., Kajander, K. C., Bennett, G. J. Abnormal skin temperature and abnormal sympathetic vasomotor innervation in an experimental painful peripheral neuropathy. Pain. 46 (3), 299-313 (1991).
- Muntean, M. V., et al. Using dynamic infrared thermography to optimize color Doppler ultrasound mapping of cutaneous perforators. Medical Ultrasonography. 17 (4), 503-508 (2015).
- Shterenshis, M. Challenges to Global Implementation of Infrared Thermography Technology: Current Perspective. Central Asian Journal of Global Health. 6 (1), 289 (2017).
- Wilbourn, A. J., Mackinnon, S. E. . Nerve surgery Vol. 1. , 59-74 (2015).
- Wu, Y., Martínez, M. &. #. 1. 9. 3. ;. M., Balaguer, P. O., Turker, H. . Electrodiagnosis in New Frontiers of Clinical Research. , (2013).
- Werdin, F., et al. An improved electrophysiological method to study peripheral nerve regeneration in rats. Journal of Neuroscience Methods. 182 (1), 71-77 (2009).
- Sedghamiz, H., Santonocito, D. Unsupervised Detection and Classification of Motor Unit Action Potentials in Intramuscular Electromyography Signals. 2015 E-health and Bioengineering Conference IEEE. , 1-6 (2015).
- Hadlock, T. A., Koka, R., Vacanti, J. P., Cheney, M. L. A comparison of assessments of functional recovery in the rat. Journal of the Peripheral Nervous System. 4 (3-4), 258-264 (1999).
- Carstens, E., Moberg, G. P. Recognizing pain and distress in laboratory animals. Ilar Journal. 41 (2), 62-71 (2000).
- Tos, P., et al. Chapter 4: Methods and protocols in peripheral nerve regeneration experimental research: part I-experimental models. International Reviews in Neurobiology. 87, 47-79 (2009).
- Galtrey, C. M., Fawcett, J. W. Characterization of tests of functional recovery after median and ulnar nerve injury and repair in the rat forelimb. Journal of the Peripheral Nervous System. 12 (1), 11-27 (2007).
- Giusti, G., et al. Return of motor function after segmental nerve loss in a rat model: comparison of autogenous nerve graft, collagen conduit, and processed allograft (AxoGen). Journal of Bone and Joint Surgery American. 94 (5), 410-417 (2012).
- Stossel, M., Rehra, L., Haastert-Talini, K. Reflex-based grasping, skilled forelimb reaching, and electrodiagnostic evaluation for comprehensive analysis of functional recovery-The 7-mm rat median nerve gap repair model revisited. Brain and Behavior. 7 (10), 00813 (2017).
- Nikkhah, G., Rosenthal, C., Hedrich, H. J., Samii, M. Differences in acquisition and full performance in skilled forelimb use as measured by the 'staircase test' in five rat strains. Behavioral Brain Research. 92 (1), 85-95 (1998).
- Whishaw, I. Q., Gorny, B., Foroud, A., Kleim, J. A. Long-Evans and Sprague-Dawley rats have similar skilled reaching success and limb representations in motor cortex but different movements: some cautionary insights into the selection of rat strains for neurobiological motor research. Behavioral Brain Research. 145 (1-2), 221-232 (2003).
- Navarro, X. Functional evaluation of peripheral nerve regeneration and target reinnervation in animal models: a critical overview. European Journal of Neuroscience. 43 (3), 271-286 (2016).
- Costa, L. M., Simões, M. J., Maurício, A. C., Varejão, A. S. P. . International Review of Neurobiology. 87, 127-139 (2009).
- Ronchi, G., et al. Functional and morphological assessment of a standardized crush injury of the rat median nerve. Journal of Neuroscience Methods. 179 (1), 51-57 (2009).
- Raimondo, S., et al. Chapter 5: Methods and protocols in peripheral nerve regeneration experimental research: part II-morphological techniques. International Reviews in Neurobiology. 87, 81-103 (2009).
- Bontioti, E. K. M., Dahlin, L. B. Regeneration and functional recovery in the upper extermity of rats after various types of nerve injuries. Journal of the Peripheral Nervous System. 8, 159-168 (2003).
- Schönfeld, L. M., Dooley, D., Jahanshahi, A., Temel, Y., Hendrix, S. Evaluating rodent motor functions: Which tests to choose. Neuroscience & Biobehavioral Reviews. 83, 298-312 (2017).
- Urbancheck, M. S. Rat walking tracks do not reflect maximal muscle force capacity. Journal of Reconstructive Microsurgery. 15 (2), 143-149 (1999).
- Cudlip, S. A., Howe, F. A., Griffiths, J. R., Bell, B. A. Magnetic resonance neurography of peripheral nerve following experimental crush injury, and correlation with functional deficit. Journal of Neurosurgery. 96 (4), 755-759 (2002).
- Wang, Y., Sunitha, M., Chung, K. C. How to measure outcomes of peripheral nerve surgery. Hand Clinics. 29 (3), 349-361 (2013).
- Wang, H., Spinner, R. J., Sorenson, E. J., Windebank, A. J. Measurement of forelimb function by digital video motion analysis in rat nerve transection models. Journal of the Peripheral Nervous System. 13 (1), 92-102 (2008).
- Yanase, Y., Tamai, S., Usui, M., Yoshizu, T. . Experimental and Clinical Reconstructive Microsurgery. , 44-51 (2004).
- Barton, M. J., et al. Morphological and morphometric analysis of the distal branches of the rat brachial plexus. Italian Journal of Anatomy and Embryology. 121 (3), 240-252 (2016).
- Vincent, R., Slutsky, D. J., Hentz, V. R. Adult and obstetrical brachial plexus injuries. Peripheral Nerve Surgery: Practical applications in the upper extremity. , 299-317 (2006).
- Dahlin, L. B., Slutsky, D. J., Hentz, V. R. . Peripheral Nerve Surgery: Practical Applications in the Upper Extremity. , 1-22 (2006).
- Vargel, I., et al. A comparison of various vascularization-perfusion venous nerve grafts with conventional nerve grafts in rats. Journal of Reconstructive Microsurgery. 25 (7), 425-437 (2009).
- Grinsell, D., Keating, C. Peripheral nerve reconstruction after injury: a review of clinical and experimental therapies. BioMed Research International. 2014, 698256 (2014).
- Wang, D., et al. A simple model of radial nerve injury in the rhesus monkey to evaluate peripheral nerve repair. Neural Regeneration Research. 9 (10), 1041-1046 (2014).
- Casal, D., et al. Unconventional Perfusion Flaps in the Experimental Setting: A Systematic Review and Meta-Analysis. Plastic Reconstructive Surgery. 143 (5), 1003-1016 (2019).
- Bontioti, E. . End-to-side nerve repair. A study in the forelimb of the rat. , (2005).
- Bodine-Fowler, S. C., Meyer, R. S., Moskovitz, A., Abrams, R., Botte, M. J. Inaccurate projection of rat soleus motoneurons: a comparison of nerve repair techniques. Muscle Nerve. 20 (1), 29-37 (1997).
- Valero-Cabre, A., Navarro, X. H reflex restitution and facilitation after different types of peripheral nerve injury and repair. Brain Research. 919 (2), 302-312 (2001).
- Wall, P. D., et al. Autotomy following peripheral nerve lesions: experimental anaesthesia dolorosa. Pain. 7 (2), 103-111 (1979).
- Bertelli, J. A., Taleb, M., Saadi, A., Mira, J. C., Pecot-Dechavassine, M. The rat brachial plexus and its terminal branches: an experimental model for the study of peripheral nerve regeneration. Microsurgery. 16, 77-85 (1995).
- Wood, M. J., Johnson, P. J., Myckatyn, T. M., Mackinnon, S. E., Yee, A. . Nerve Surgery Vol. 1. , 1-40 (2015).
- Rosberg, H. E. Epidemiology of hand injuries in a middle-sized city in southern Sweden - a retrospective study with an 8-year interval. Scandinavian Journal of Plastic and Reconstructive Surgery and Hand Surgery. 38, 347-355 (2004).
- Gordon, T., Borschel, G. H. The use of the rat as a model for studying peripheral nerve regeneration and sprouting after complete and partial nerve injuries. Experimental Neurology. 287, 331-347 (2017).
- Bertelli, J. A., Ghizoni, M. F. Concepts of nerve regeneration and repair applied to brachial plexus reconstruction. Microsurgery. 26 (4), 230-244 (2006).
- Bertelli, J. A., Mira, J. C. Behavioural evaluating methods in the objective clinical assessment of motor function after experimental brachial plexus reconstruction in the rat. Journal of Neuroscience Methods. 46, 203-208 (1993).
- Bertelli, J. A., Mira, J. C. The grasping test: a simple behavioral method for objective quantitative assessment of peripherla nerve regeneration in the rat. Journal of Neuroscience Methods. 58 (1-2), 151-155 (1995).
- Ronchi, G., et al. Standardized crush injury of the mouse median nerve. Journal of Neuroscience Methods. 188 (1), 71-75 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados