Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Afinación de la acidez de los catalizadores Pt/ CNTs para la hidrodesoxigenación del éter de difenilo
En este artículo
Resumen
Se presenta un protocolo para la síntesis de HNbWO6, HNbMoO6, HTaWO6 nanohoja de ácido sólido modificado Pt/CNTs.
Resumen
Aquí presentamos un método para la síntesis de HNbWO6, HNbMoO6, HTaWO6 nanohoja de ácido sólido modificado Pt/CNTs. Al variar el peso de varias nanohojas de ácido sólido, una serie de Pt/xHMNO6/CNTs con diferentes composiciones de ácido sólido (x 5, 20 wt%; M - Nb, Ta; N - Mo, W) han sido preparados por pretratamiento de nanotubos de carbono, intercambio protónico, exfoliación de ácidos sólidos, agregación y finalmente impregnación de partículas Pt. Los Pt/xHMNO6/CNT se caracterizan por difracción de rayos X, microscopía electrónica de barrido, microscopía electrónica de transmisión y desorción programada de temperatura NH3. El estudio reveló que las nanohojas HNbWO6 estaban unidas en los CNT, con algunos bordes de las nanohojas dobladas en forma. La resistencia ácida de los catalizadores Pt soportados aumenta en el siguiente orden: Pt/CNTs < Pt/5HNbWO6/CNTs < Pt/20HNbMoO6/CNTs < Pt/20HNbWO6/CNTs < Pt/20HTaWO6/CNTs. Además, se ha investigado la hidroconversión catalítica del compuesto modelo derivado de la lignina: éter de difenilo utilizando el catalizador sintetizado Pt/20HNbWO6.
Introducción
Muchos procesos industriales para la fabricación de productos químicos implican el uso de ácido inorgánico acuoso. Un ejemplo típico es el proceso convencional H2SO4 para la hidratación del ciclohexano para producir ciclohexanol. El proceso implica un sistema bifásico, con el ciclohexano en fase orgánica y el producto ciclohexanol en fase acuosa ácida, lo que dificulta el proceso de separación por simple destilación. Aparte de la dificultad en la separación y recuperación, el ácido inorgánico también es altamente tóxico y corrosivo para el equipo. A veces, el uso de ácido inorgánico genera subproductos que reducirán el rendimiento del producto y deben evitarse. Por ejemplo, la deshidratación de 2-ciclohexeno-1-ol para producir 1,3-ciclohexadieno usando H2SO4 dará lugar a subproductos de polimerización1. Por lo tanto, muchos procesos industriales se desplazan hacia el uso de catalizadores de ácido sólido. Varios ácidos sólidos tolerantes al agua se utilizan para resolver el problema anterior y para maximizar los rendimientos del producto, como el uso de HZSM-5 y Amberlyst-15. Se ha demostrado que el uso de zeolita HZSM-5 de alta sílice sustituye a H2SO4 en la producción de ciclohexanol a partir del benceno2. Dado que la zeolita está presente en la fase acuosa neutra, el producto pasará exclusivamente a la fase orgánica, simplificando así el proceso de separación. Sin embargo, debido a la formación de aductos de base de ácido Lewis de moléculas de aguaa los sitios de ácido Lewis, los materiales zeoliticos todavía demostraron menor selectividad debido a la presencia de sitios inactivos 3. Entre todos estos ácidos sólidos, Nb2O5 es uno de los mejores candidatos que contienen tanto los sitios de ácido Lewis como el de Brensted. La acidez de Nb2O5nH2O es equivalente a una solución de 70% H2SO4, debido a la presencia de los protones lábiles. La acidez de Br-nsted, que es comparable a los materiales de zeolita protónica, es muy alta. Esta acidez se convertirá en acidez Lewis después de la eliminación del agua. En presencia de agua, Nb2O5 forma los aductos tetraédricos NbO4-H2O, que pueden disminuir en la acidez de Lewis. Sin embargo, los sitios de ácido Lewis siguen siendo eficaces ya que el tetraédrico NbO4 todavía tienen cargas positivas efectivas4. Tal fenómeno se ha demostrado con éxito en la conversión de glucosa en 5-(hidroximetil)furfural (HMF) y la alilación de benzaldehído con estano de tetraalilo en agua5. Por lo tanto, los catalizadores tolerantes al agua son cruciales en la conversión de biomasa en aplicaciones de energía renovable, especialmente cuando las conversiones se realizan en disolventes benignos ambientales como el agua.
Entre los muchos catalizadores ambientales benignos de ácido sólido, nanomateriales de carbono funcionalizados utilizando grafeno, nanotubos de carbono, nanofibras de carbono, materiales de carbono mesoporosos han estado desempeñando un papel importante en la valorización de la biomasa debido a la porosidad ajustable, superficie específica extremadamente alta, y excelente hidrofobicidad6,7. Los derivados sulfonados son materiales catalíticos protónicos particularmente estables y altamente activos. Pueden ser preparados por carbonización incompleta de compuestos aromáticos sulfonados8 o por sulfonación de azúcares incompletamente carbonizados9. Han demostrado ser catalizadores muy eficientes (por ejemplo, para la esterificación de ácidos grasos más altos) con una actividad comparable al uso del líquido H2SO4. Los grafenos y CNT son materiales de carbono con una gran superficie, excelentes propiedades mecánicas, buena resistencia al ácido, distribuciones uniformes de tamaño de poro, así como resistencia a la deposición de coque. Se ha encontrado que el grafeno sulfonado cataliza eficientemente la hidrólisis del acetato de etilo10 y se han encontrado catalizadores bifuncionales de grafeno para facilitar la conversión de un depósito de ácido levullinico a -valerolactona11. Los metales bifuncionales soportados en CNT también son catalizadores muy eficientes para su aplicación en la conversión de biomasa12,13 como la oxidación aeróbica altamente selectiva de HMF a 2,5-diformylfuran sobre el VO2-PANI/CNT catalizador14.
Aprovechando las propiedades únicas de Nb2O5 ácido sólido, CNT funcionalizados y metal bifuncional soportado en CNTs, informamos del protocolo para la síntesis de una serie de Nb(Ta) basado en nanohoja de ácido sólido modificado Pt /CNTs con un alto superficie mediante un método de agregación de nanohojas. Además, demostramos que Pt/20HNbWO6/CNTs, como resultado del efecto sinérgico de partículas Pt bien dispersas y sitios de ácido fuerte derivados de nanohojas HNbWO6, exhiben la mejor actividad y selectividad en la conversión compuestos modelo derivados de lignina en combustibles por hidrodesoxigenación.
Protocolo
ADVERTENCIA: Para conocer los métodos de manipulación, propiedades y toxicidades adecuados de los productos químicos descritos en este documento, consulte las fichas de datos de seguridad de materiales (MSDS) pertinentes. Algunos de los productos químicos utilizados son tóxicos y cancerígenos y se debe tener especial cuidado. Los nanomateriales pueden potencialmente representar riesgos para la seguridad y efectos para la salud. Se debe evitar la inhalación y el contacto con la piel. Se deben tomar precauciones de seguridad, como realizar la síntesis del catalizador en la campana de humos y evaluar el rendimiento del catalizador con reactores de autoclave. Se debe usar equipo de protección personal.
1. Pretratamiento de las CNT13
- Sumerja 1,0 g de CNT en 50 ml de ácido nítrico en un vaso de precipitados de 100 ml.
- Sonicar la solución a 25 oC durante 1,5 h para eliminar las impurezas de la superficie y mejorar el efecto de anclaje del catalizador.
- Transfiera la solución a un matraz inferior redondo de 100 ml.
- Reflujo de la solución en una mezcla de ácido nítrico (65%) y ácido sulfúrico (98%) a 60oC para pasar la noche. Ajuste la relación de volumen en 3:1. Esto creará defectos superficiales en los CNT.
- Filtrar la solución para obtener el nanotubo de carbono multipared sólido. Lave el sólido con agua desionizada.
- Secar el sólido a 80oC durante 14 h.
2. Preparación de HNbWO6 nanohojas de ácido sólido15 por intercambio protónico seguido de exfoliación
- Mezclar cantidades estequiométricas de Li2CO3 (0,9236 g) y óxidos metálicos Nb2O5 (3.3223 g) y WO3 (5.7963 g) en una relación molar de 1:1:2.
- Calcine la mezcla sólida a 800oC durante 24 h con una molienda intermedia.
- Colocar 10,0 g de LiNbWO6 polvo en 200 ml de 2 M HNO3 solución acuosa a 50 oC y agitar la mezcla de solución durante 5 días (120 h) con un reemplazo del ácido a 60 h.
- Cambie el líquido ácido todos los días y repita el paso 2.3.
- Filtrar el sólido y lavar el sólido con agua desionizada 3x.
- Secar el sólido a 80oC durante la noche.
- Añadir una cantidad de 25 wt.% TBAOH (tetra (n-butilammonium) hidróxido) a 150 ml de solución de agua desionizada con 2,0 g de compuesto protónico obtenido en el paso 2.6 hasta que el pH alcance 9.5 – 10.0.
- Revuelva la solución anterior durante 7 días.
- Centrifugar la solución anterior y recoger la solución sobrenadante que contiene las nanohojas dispersas.
3. Preparación de nanohojas de ácido sólido HNbMO6
NOTA: El procedimiento es similar al del paso 2, excepto el primer y el tercer paso.
- Mezclar cantidades estequiométricas de Li2CO3 y óxidos metálicos Nb2O5 y MoO3 en una relación molar de 1:1:2.
- Calcine las mezclas sólidas anteriores a 800oC en aire durante 24 h con una molienda intermedia.
- Colocar 10,0 g de LiNbMoO6 polvo en 200 ml de 2 M HNO3 solución acuosa a 50oC y remover la mezcla de solución durante 5 días (120 h) con un reemplazo del ácido a 60 h.
4. Preparación de htaWO6 nanohojas de ácido sólido
NOTA: El procedimiento es similar al del paso 2, excepto el primer y el tercer paso.
- Mezclar cantidades estequiométricas de Li2CO3 y óxidos metálicos Ta2O5 y WO3 en una relación molar de 1:1:2.
- Calcine las mezclas sólidas anteriores a 900oC en aire durante 24 h con una molienda intermedia.
- Colocar 10,0 g de LiTaWO6 polvo en 200 ml de 2 M HNO3 solución acuosa a 50 oC y agitar la mezcla de solución durante 5 días (120 h) con un reemplazo del ácido a 60 h.
5. Preparación de HNbWO6/MWCNTs por el método de agregación de nanohojas
- Añadir 2,0 g de CNT multipared obtenidos en el paso 1 a una solución de 100 ml de Nanohojas HNbWO6 en un matraz inferior redondo de 250 ml.
- Añadir 100 ml de solución acuosa de 1,0 M HNO3 en el matraz de fondo redondo en sentido de gota. Esto agregará las muestras de nanohojas.
- Continúe agitando la solución a 50oC durante 6 h.
- Filtrar el sólido y lavar el sólido con agua desionizada 3x.
- Secar el sólido a 80oC durante la noche.
- Pesar el sólido seco y registrar el % de carga del ácido sólido en el MWCNT.
6. Preparación de Pt/20HNbWO6/CNTs por el método de impregnación
- Disolver el H2PtCl6o H2O en agua (1,0 g/100 ml).
- Impregnar los materiales CNT modificados de nanohojas de nanohojas como preparados con 1,34 ml de la solución acuosa Pt anterior.
- Secar los materiales cnTs de nanohojas a 80 oC y calcicar los materiales a 400 oC durante 3 h.
- Obtenga los catalizadores Pt/CNT modificados en nanohojas de ácido sólido basados en Nb(Ta).
7. Hidrodeoxigenación del éter aromático derivado de la lignina
NOTA: El éter aromático derivado de la lignina elegido es el éter difenil en este experimento. El éter aromático derivado de la lignina elegido es el éter difenil en este experimento. La actividad de Pt/20HTaWO6/CNTs (conversión del 88,8%, no mostrada en este documento) es inferior a Pt/20HNbWO6/CNTs (99,6%), por lo que el rendimiento del ciclohexano disminuye. Por lo tanto, aunque, mayor selectividad del ciclohexano se obtuvo sobre Pt/20HTaWO6/ CNTs, menor conversión de éter de difenilo limita su utilización. Utilizar el equipo de protección adecuado y la campana de humo según el uso de reactivos cancerígenos.
- Diluir 0,05 gramos de catalizador en 5 mililitros de arena de cuarzo. Cargue la solución en medio de un reactor de cama fija entre dos almohadas de lana de cuarzo.
- Reducir el catalizador en H2 (40 ml/min) a 300 oC durante 2 h.
- Bombear las materias primas de éter de difenilo (incluyendo 5,0 wt.% reactivo en n-decano y 2.0 wt.% n-dodecane como estándar interno para el análisis de cromatografía de gases) en el reactor de lecho fijo a diferentes caudales (0,05-0,06 ml/min)
- Recoger los productos en diferentes tiempos de espacio definidos como la relación entre la masa del catalizador W (g) y el caudal del sustrato F (g/min).
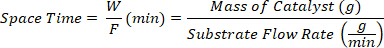
- Identifique los productos líquidos por un GC (HP-5, 30 m x 0,32 mm x 0,25 ám) con 5977A MSD y analice fuera de línea por cromatografía de gases (GC 450, FID, columna capilar FFAP 30 m x 0,32 mm x 0,25 ám).
- Determinar la conversión de reactivos (conv.%), selectividad hacia el producto I (Si %), y el rendimiento del producto i (Yi %) utilizando las siguientes ecuaciones:
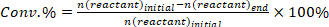 (1)
(1)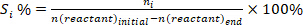 (2)
(2)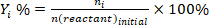 (3)
(3)
Resultados
Se han estudiado patrones de difracción de rayos X (RDX) para el precursor LiNbWO6 y la correspondiente muestra de catalizador intercambiado por protones HNbWO6 para determinar la fase (Figura1 y Figura 2). NH3-temperatura programada desorción (NH3-TPD) se utilizó para sondear la acidez superficial de las muestras de catalizador (Figura3). Se registraron microscopía...
Discusión
El pretratamiento de las CNT con ácido nítrico aumenta significativamente la superficie específica (SBET). Los CNT crudos tienen una superficieespecífica de 103 m2/g, mientras que después del tratamiento, la superficie se incrementó a 134 m2 /g. Por lo tanto, este pretratamiento para crear defectos en la superficie CNT tendrá un efecto positivo en la superficie específica en los catalizadores después de la modificación del ácido sólido y la impregnación de partículas de plat...
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
El trabajo descrito en este documento fue plenamente apoyado por una subvención del Consejo de Subvenciones de Investigación de la Región Administrativa Especial de Hong Kong, China (UGC/FDS25/E09/17). También reconocemos a la National Natural Science Foundation of China (21373038 y 21403026) por proporcionar instrumentos analíticos para la caracterización del catalizador y el reactor de lecho fijo para la evaluación del rendimiento del catalizador. El Dr. Hongxu Qi desea dar las gracias por el Auxiliar de Investigación otorgado por el Consejo de Subvenciones de Investigación de Hong Kong (UGC/FDS25/E09/17).
Materiales
| Name | Company | Catalog Number | Comments |
| Carbon nanotubes (multi-walled) | Sigma Aldrich | 724769 | |
| Nitric acid (65%) | Sigma Aldrich | V000191 | |
| sulphuric acid (98%) | MERCK | 100748 | |
| Lithium carbonate (>99%) | Aladdin | L196236 | |
| Niobium pentaoxide (99.95%) | Aladdin | N108413 | |
| Tungsten trioxide (99.8%) | Aladdin | T103857 | |
| Molybdenum trioxide (99.5%) | Aladdin | M104355 | |
| Tantalum oxide (99.5%) | Aladdin | T104746 | |
| Chloroplatinic acid hexahydrate, ≥37.50% Pt basis | Sigma Aldrich | 206083 | |
| tetra (n-butylammonium) hydroxide 30-hydrate | Aladdin | D117227 | |
| Diphenyl ether, 98% | Aladdin | D110644 | |
| 2-Bromoacetophenone,98% | Aladdin | B103328 | |
| Diethyl ether,99.5% | Sinopharm | 10009318 | |
| n-Decane,98% | Aladdin | D105231 | |
| n-Dodecane,99% | Aladdin | D119697 | |
| Autoclave Reactor | CJF-0.05—0.1L (Dalian Tongda Equipment Technology Development Co., Ltd) | ||
| Tube furnace | SK2-1-10/12 (Luoyang Huaxulier Electric Stove Co., Ltd) |
Referencias
- Jensen, J. L., Uaprasert, V., Fujii, C. R. Acid-Catalyzed Hydration of Dienes. 2. Changes in Activity Coefficient Ratios, Enthalpy, and Entropy as a Function of Sulfuric Acid Concentration. Journal of Organic Chemistry. 41 (10), 1675-1680 (1976).
- Ishida, H., Ono, M., Kaji, S., Watanabe, A. Synthesis of 1,3-Cyclohexadiene through Liquid Phase Dehydration of 2-Cyclohexen-1-ol in Aqueous Solution using Zeolite Catalyst. Nippon Kagaku Kaishi. 4, 267-275 (1997).
- Ishida, H. Liquid-phase hydration process of cyclohexene with zeolites. Catalysis Surveys from Japan. , 241-246 (1997).
- Ushikubo, T., Iizuka, T., Hattori, H., Tanabe, K. Preparation of highly acidic hydrated niobium oxide. Catalysis Today. 16, 291-295 (1993).
- Nakajima, K., et al. Nb2O5.nH2O as a heterogeneous catalyst with water-tolerant Lewis acid sites. Journal of the American Chemical Society. 133 (12), 4224-4227 (2011).
- Lam, E., Luong, J. H. T. Carbon Materials as Catalyst Supports and Catalysts in the Transformation of Biomass to Fuels and Chemicals. ACS Catalysis. 4 (10), 3393-3410 (2014).
- Sudarsanam, P., et al. Functionalised heterogeneous catalysts for sustainable biomass valorisation. Chemical Soceity Review. 47 (22), 8349-8402 (2018).
- Hara, M., et al. A carbon material as a strong protonic acid. Angewandte Chemie International Edition English. 43 (22), 2955-2958 (2004).
- Toda, M., et al. Biodiesel made with sugar catalyst. Nature. 438 (7065), (2005).
- Ji, J., et al. Sulfonated graphene as water-tolerant solid acid catalyst. Chemical Science. 2 (3), 484-487 (2011).
- Wang, Y., et al. Graphene-Based Metal/Acid Bifunctional Catalyst for the Conversion of Levulinic Acid to γ-Valerolactone. ACS Sustainable Chemistry & Engineering. 5 (2), 1538-1548 (2016).
- Ma, Q., et al. Catalytic depolymerization of lignin for liquefied fuel at mild condition by rare earth metals loading on CNT. Fuel Processing Technology. , 220-225 (2017).
- Rahzani, B., Saidi, M., Rahimpour, H. R., Gates, B. C., Rahimpour, M. R. Experimental investigation of upgrading of lignin-derived bio-oil component anisole catalyzed by carbon nanotube-supported molybdenum. RSC Advances. 7 (17), 10545-10556 (2017).
- Guo, Y., Chen, J. Bicomponent Assembly of VO2and Polyaniline-Functionalized Carbon Nanotubes for the Selective Oxidation of Biomass-Based 5-Hydroxymethylfurfural to 2,5-Diformylfuran. ChemPlusChem. 80 (12), 1760-1768 (2015).
- He, J., et al. Characterization of HNbMoO6, HNbWO6 and HTiNbO5 as solid acids and their catalytic properties for esterification reaction. Applied Catalysis A: General. , 145-152 (2012).
- Tagusagawa, C., Takagaki, A., Hayashi, S., Domen, K. Characterization of HNbWO6 and HTaWO6 Metal Oxide Nanosheet Aggregates As Solid Acid Catalysts. Journal of Physical Chemistry C. 113, 7831-7837 (2009).
- Niwa, M., Katada, N., Sawa, M., Murakami, Y. Temperature-Programmed Desorption of Ammonia with Readsorption Based on the Derived Theoretical Equation. Journal of Physical Chemistry. 99, 8812-8816 (1995).
- Leiva, K., et al. Conversion of guaiacol over supported ReOx catalysts: Support and metal loading effect. Catalysis Today. , 228-238 (2017).
- Deng, W., Liu, M., Tan, X., Zhang, Q., Wang, Y. Conversion of cellobiose into sorbitol in neutral water medium over carbon nanotube-supported ruthenium catalysts. Journal of Catalysis. 271 (1), 22-32 (2010).
- Huang, B., Huang, R., Jin, D., Ye, D. Low temperature SCR of NO with NH3 over carbon nanotubes supported vanadium oxides. Catalysis Today. 126 (3-4), 279-283 (2007).
- Takagaki, A., Tagusagawa, C., Hayashi, S., Hara, M., Domen, K. Nanosheets as highly active solid acid catalysts for green chemical syntheses. Energy & Environmental Science. 3 (1), 82-93 (2010).
- Hu, L. -. F., et al. Structure and photocatalytic performance of layered HNbWO6nanosheet aggregation. Journal of Nanophotonics. 9 (1), (2015).
- Geim, A. K. Graphene: Status and Prospects. Science. 324, 1530-1534 (2009).
- Golberg, D., et al. Boron Nitride Nanotubes and Nanosheets. ACS Nano. 4 (6), 2979-2993 (2010).
- Wilson, J. A., Yoffe, A. D. The transition metal dichalcogenides discussion and interpretation of the observed optical, electrical and structural properties. Advances in Physics. 18 (73), 193-335 (1969).
- Ma, R., Sasaki, T. Nanosheets of oxides and hydroxides: Ultimate 2D charge-bearing functional crystallites. Advanced Materials. 22 (45), 5082-5104 (2010).
- Pope, T. R., Lassig, M. N., Neher, G., Weimar Iii, R. D., Salguero, T. T. Chromism of Bi2WO6 in single crystal and nanosheet forms. Journal of Materials Chemistry C. 2 (17), 3223-3230 (2014).
- Yu, Y., et al. Controlled scalable synthesis of uniform, high-quality monolayer and few-layer MoS2 films. Scientific Reports. 3, 1866 (2013).
- Prasomsri, T., Shetty, M., Murugappan, K., Román-Leshkov, Y. Insights into the catalytic activity and surface modification of MoO3 during the hydrodeoxygenation of lignin-derived model compounds into aromatic hydrocarbons under low hydrogen pressures. Energy & Environmental Science. 7 (8), 2660-2669 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados