Method Article
Redes de cardiomiocitos derivados de iPSC humanos en matrices de microelectrodos multipolos para grabaciones potenciales de acción recurrente
* Estos autores han contribuido por igual
En este artículo
Resumen
Este artículo contiene un conjunto de protocolos para el desarrollo de redes de cardiomiocitos derivados de células madre pluripotentes inducidas por el hombre (hiPSC-CM) cultivadas en placas MEA multipocillos para electroportar la membrana celular de forma reversible para mediciones potenciales de acción. Las grabaciones de alto rendimiento se obtienen de los mismos sitios de celda repetidamente durante días.
Resumen
El cribado de seguridad cardíaca es de suma importancia para el descubrimiento de fármacos y la terapia. Por lo tanto, el desarrollo de nuevos enfoques electrofisiológicos de alto rendimiento para preparaciones de cardiomiocitos derivados de hiPSC (hiPSC-CM) es muy necesario para pruebas de drogas eficientes. Aunque los arreglos multielectrodos (MEA) se emplean con frecuencia para mediciones potenciales de campo de células excitables, una publicación reciente de Joshi-Mukherjee y colegas describió y validó su aplicación para grabaciones de potencial de acción recurrente (AP) de la misma preparación hiPSC-CM durante días. El objetivo aquí es proporcionar métodos detallados paso a paso para la sembración de mde y para medir formas de onda AP a través de electroporación con alta precisión y una resolución temporal de 1 s. Este enfoque aborda la falta de metodología fácil de usar para obtener acceso intracelular para mediciones AP de alto rendimiento para investigaciones electrofisiológicas confiables. Se discute un flujo de trabajo detallado y métodos para el enchapado de hiPSC-CM en placas MEA multipozos, haciendo hincapié en los pasos críticos donde sea pertinente. Además, se informa de un script MATLAB personalizado para el manejo, extracción y análisis rápidos de datos para una investigación exhaustiva del análisis de la forma de onda para cuantificar las diferencias sutiles en morfología para diversos parámetros de duración de AP implicados en arritmia y cardiotoxicidad.
Introducción
Los cardiomiocitos derivados de células madre pluripotentes inducidos por el hombre (hiPSC-CP) son el estándar de oro para un número creciente de laboratorios1,2,3,4,5,6 ,7,8,9,10. Golpeando cuerpos embrionarios11,12,13 y monocapa3,7,10,11,12, 13,14,15,16,17 diferenciación son los métodos preferidos para la producción de cardiomiocitos y la matriz multielectrodo (MEA) se ha convertido en una modalidad común para el seguimiento de la electrodinámica de estas redes18,19,20. Si bien los parámetros que se pueden extraer de potenciales de campo (FP) como la velocidad de latido, la amplitud, la duración y los intervalos RR son respuestas electrofisiológicas basales de las monocapas18,21, 22,23, los componentes potenciales de acción (AP) subyacentes a estas señales de FP extracelulares son difíciles de extrapolar24. Nuestra reciente publicación sobre el descubrimiento de una aplicación de MEA para mediciones directas recurrentes de AP proporciona una prueba de metodología para lecturas de AP intracelulares ejemplares con un extenso análisis de forma de onda en varias fases de repolarización a través de múltiples lotes de redes de cardiomiocitos derivados de hiPSC3. En el estudio demostramos que la entrega de pulsos electroporantes a redes de cardiomiocitos derivados de hiPSC permite el acceso intracelular para las grabaciones AP. Estas grabaciones ap transitorias dependen de posibles recuperaciones transmembranas observadas a través del sitio de lesión3,25,26. Las formas de onda registradas a través de MEA y parche- clamp en nuestro estudio mostraron morfologías AP similares validando así la fiabilidad del enfoque3.
Algunos laboratorios han reportado la medición de AP de varias células electrogénicas utilizando MEAs a medida18,21,26,27,28,29, 30, pero no se evaluó la fiabilidad del uso de MEA para mediciones DE AP consistentes y recurrentes. Actualmente, la técnica de abrazadera de parche estándar de oro se limita a las grabaciones de terminales7,31 mientras que, las mediciones AP basadas en MEA son transitorias y por lo tanto se pueden llevar a cabo varias veces en la misma célula. También mostramos que se pueden grabar fácilmente señales AP de alta calidad en el rango de milivoltios que requieren un filtrado mínimo. Por lo tanto, los investigadores pueden llevar a cabo no sólo estudios agudos, sino también crónicos de drogas en las mismas preparaciones utilizando AME. Además, esta tecnología permite la medición simultánea de FP/AP que genera bibliotecas de electrobioma en un corto período de tiempo. Dado el creciente énfasis en la predicción de arritmias y la cardiotoxicidad asociada a fármacos24,32,33,34,35, integración de la medición AP mejorarán las evaluaciones de la seguridad y eficacia de los medicamentos.
Aquí, presentamos protocolos para 1) pre-plating de hiPSC-CM crioconservados para la maduración, 2) disociación y chapado de hiPSC-CM en MEA multipozo, 3) grabación de FP y AP de redes hiPSC-CM, 4) segmentando y extrayendo los datos para el análisis, y 5) restaurar las matrices para su reutilización múltiple. Cada paso se ha optimizado haciendo hincapié en los pasos críticos siempre que sea pertinente. Se discuten los requisitos para la fijación celular para garantizar una monocapa sincitial batida y se explican los procedimientos para la restauración de MEA multipozo para estudios electrofisiológicos repetitivos. Finalmente, se presenta una GUI personalizada desarrollada en el laboratorio para la extracción de señal AP, el aseguramiento de la calidad, y el flujo de trabajo de segmentación para cuantificar y analizar los parámetros AP.
Protocolo
1. Preparación de soluciones y materiales (ver Tabla de Materiales)
-
Recubrimiento de sustrato de placa de tejido-cultivo de 6 polos
- Descongelar el sustrato de recubrimiento sobre hielo o a 4oC.
- Preparar una dilución de sustrato de recubrimiento 1:100 en medio DMEM/F12 frío. Mezcle la solución mediante un pipeteo lento.
- Transfiera 2 ml de la solución de sustrato de recubrimiento (paso 1.1.2) por pozo de una placa de cultivo de tejido de 6 pocillos.
- Colocar inmediatamente la placa de cultivo de tejido recubierto en la incubadora de cultivo celular a 37 oC y 5% de CO2 durante al menos 7 h y utilizar en un plazo de 7 días.
-
medio de cultivo hiPSC-CM
- Añadir 10 ml de suplemento de medios CM desawed a 4 oC a 500 mL de medio base CM. Conservar a 4oC durante un máximo de 2 semanas.
- Aliquot requiere cantidad de medios para el día y llevar a temperatura ambiente antes de su uso.
- medio de descongelación hiPSC-CM: Prepárese fresh mezclando el medio de cultivo hiPSC-CM (paso 1.2) con un 10% de suero bovino fetal (FBS). Lleve el medio a temperatura ambiente antes de descongelar los MN para la suspensión.
- Solución en stock de fibronectina 1 mg/ml: Aliquot 200 l en tubos de microfúgelos estériles de 1,5 ml y se almacena a 4 oC para su uso posterior. Preparar la solución de trabajo de 50 g/ml de concentración recién sobre hielo.
- Solución de limpieza multipozo: Combine 0,5 g de detergente enzimático con 50 ml de agua estéril de doble destilación (ddH2O). Vórtice para mezclar el contenido. Filtrar y almacenar a 4oC hasta por semana.
2. Pre-plating de hiPSC-CM crioconservado para maduración (Figura 1)
NOTA: Esta sección está destinada a descongelar y cultivar hiPSC-CM que se diferenciaron utilizando el método monocapa libre de alimentador3,16 y crioconservado en nitrógeno líquido 10 días después de la diferenciación a 1-2 millones de células/vial. Las células de un vial se chapan en dos pocillos recubiertos de sustrato de una placa de cultivo de tejido de 6 pocillos. Los cardiomiocitos tienden a asentarse en la parte inferior del tubo, por lo que la mezcla suave en el momento del pre-plating es importante para lograr una densidad celular uniforme a través de los pozos.
- Aliquot 2 mL de FBS por vial de hiPSC-CP que se descongela en un tubo cónico de 15 ml y se lleva a temperatura ambiente.
- Descongelar los viales de hiPSC-CMs crioconservados colocándolos en un baño de agua de 37oC y remolino suavemente para descongelar seponce durante no más de 3 minutos.
- Transfiera inmediatamente el contenido del vial al tubo que contiene FBS (ver paso 2.1), mezcle girando y centrifugando a 200 x g durante 5 min.
- Aspirar el sobrenadante y resuspender el pellet celular en 1 ml de medio de descongelación hiPSC-CM (ver paso 1.3) por vial desmadente. Utilice una pipeta de transferencia para resuspender el pellet mediante una trituración suave. Evalúe la viabilidad celular.
- Añadir 3 ml adicionales de medio de descongelación por vial de hiPSC-CM desmadente en el paso 2.4 y suspender suavemente con una pipeta de transferencia para disociar más los grumos celulares.
- Dispensar 2 ml de suspensión celular suavemente en cada pocal de placas de 6 pocillos recubiertas de sustrato (ver paso 1.1). Colocar en la incubadora de cultivo celular a37oC y 5% co2.
- Reemplazar con medio de cultivo hiPSC-CM fresco después de 24 h y 3 veces por semana a partir de entonces durante 20 días.
NOTA: Las células deben adherirse al recubrimiento del sustrato 24 h y batir espontáneamente a 48 h de post-plating (Ver Video 1 y Video 2).
3. Esterilización y recubrimiento de placas Multiwell MEA (Figura 2 y Figura 3)
NOTA: El protocolo descrito aquí es para la preparación de placas MEA de 24 pocillos con 12 electrodos recubiertos de PEDOT de micro oro en vidrio para chapado hiPSC-CM. Evite tocar la parte inferior de la placa, ya que esto puede dañar los electrodos.
- Dos días antes del revestimiento de celdas, agregue 0,5 ml de medio de cultivo hiPSC-CM (consulte el paso 1.2) a cada pocto y realice una grabación de línea base para verificar la relación señal-ruido para la comprobación de calidad de los MeA.
- Aspirar el medio, enjuagar con ddHestéril 2O y esterilizar bajo luz UV dentro de una campana de flujo laminar durante la noche.
- El día anterior al revestimiento celular, agregue 0,1 ml de FBS a cada pocato para el tratamiento hidrófilo de las superficies de MEA. Incubar durante 30 min a temperatura ambiente. Este paso es necesario para la conexión de celda.
- Aspirar el FBS y enjuagar con 0,5 ml de ddH estéril2O por pozo. Repita una vez más.
- Deje que el plato se seque en la campana de flujo laminar durante la noche.
- Preparar una dilución de trabajo de fibronectina de 50 g/ml en medio DMEM/F12 frío a partir de la culata (ver paso 1.4). Mantenga la solución en hielo.
- Pipetear 5 l de la dilución de la fibronectina en funcionamiento (ver 3.6) y dispensar cuidadosamente la gota en el centro de cada pocal para cubrir los 12 electrodos. Es importante trabajar rápidamente a través de los 24 pozos para evitar que la gota se seque.
- Coloque inmediatamente la placa MEA multipocilíneda recubierta de fibronectina sobre una superficie elevada dentro de una cámara humidificadora que contenga ddH2O estéril para cubrir toda la superficie del plato. Coloque la cámara con la placa MULTIwell MEA durante 3 h en la incubadora de cultivo celular.
NOTA: Colocar la placa MEA de 24 pocillos en una cámara humidificadora es fundamental para evitar que las gotas de fibronectina se sequen durante el período de incubación.
4. disociación y chapado de hiPSC-CM en la placa Multiwell MEA (Figura 3)
NOTA: Comience este paso aproximadamente 1 h antes de que se complete la incubación de fibronectina MEA. Asegúrese de que la solución de disociación celular esté a 37 oC y que el medio de descongelación iPSC-CM esté a temperatura ambiente. Los métodos de disociación se han optimizado durante 30 días después de los hiPSC-CM diferenciados cultivados en placas de 6 pocillos recubiertas de sustrato (ver paso 2) para obtener aproximadamente un 90% de CM viables para el revestimiento MEA. Se debe tener cuidado de no introducir burbujas de aire mientras se tritura la trituración para evitar la muerte celular.
- Aspirar el medio de cultivo de cada pozo del plato de cultivo de tejido de 6 polos con 30 días de cultivo hiPSC-CM post-diferenciado (ver paso 2.7) y lavar con 2 ml de D-PBS estéril por pozo.
- Añadir 1 ml de solución de disociación celular precalentada (ver Tabla de Materiales)por pozo e incubar durante 4 min a 37oC. Utilice una pipeta de transferencia para triturar suavemente para aflojar las células para la disociación. Si la mayoría de las células siguen siendo adherentes, incubar durante otros 3 minutos a 37 oC y triturar de nuevo. Esta incubación adicional debe ayudar a la máxima recuperación de la célula. No incubar durante más de 7 minutos, ya que esto podría resultar en una baja viabilidad celular.
- Con una pipeta de transferencia, auna todas las células disociadas en un tubo cónico que contenga un medio de descongelación hiPSC-CM (ver paso 1.3). Se recomienda suspender las células en al menos el doble del volumen de medios (2 ml por pozo cosechado) para bloquear la actividad de la solución de disociación celular.
- Centrífuga a 200 x g durante 5 min.
- Aspirar la solución cuidadosamente como el pellet se une libremente a la superficie y resuspender en 0,1 ml de medio de descongelación hiPSC-CM. Utilice una pipeta de transferencia para resuspender el pellet unas cuantas veces por una trituración suave.
- Alícuota de 2 l de células disociadas y diluye con 18 ml de medios en un tubo de microfusión de 1,5 ml. Agregue 20 s de Trypan Blue y mezcle para el recuento de celdas y la evaluación de viabilidad.
- Ajuste la densidad de celdas a 6.000 celdas/L agregando el volumen apropiado del medio de descongelación hiPSC-CM. Suspenda el pellet moviendo suavemente unas cuantas veces. Los hiPSC-CMs se separan fácilmente de las superficies de vidrio, especialmente cuando están chapados a altas densidades. Hemos optimizado la densidad de sembrado y las condiciones de chapado para lograr 15 días de grabaciones eléctricas.
- Cuando esté listo, lleve la placa MEA multipocillos a la campana de flujo laminar para la sembración celular. Es fundamental realizar los siguientes dos pasos uno bien a la vez para evitar que la fibronectina se seque.
- Retire cuidadosamente la gota de fibronectina con una pipeta P10 sin tocar los electrodos.
- Dispensar inmediatamente una gota de celda de 5 l (30.000 celdas) en el centro del pozo de la placa MEA que cubre los 12 electrodos. Repita el paso hasta que todos los 24 pozos estén chapados. Se recomienda la mezcla intermitente de la suspensión celular mediante parpadeo.
- Vuelva a colocar la placa MULTIwell MEA en la cámara humidificadora cubierta libremente y vuelva a la incubadora de cultivo celular a 37oC y 5% CO2 durante 3 h para la fijación celular.
- Agregue cuidadosamente 200 s de medio de descongelación hiPSC-CM a cada pocal sin perturbar las células utilizando una pipeta P200. Agregue el medio en sentido de gota al lado del pozo.
- Vuelva a colocar la placa MEA multipozo en la incubadora de cultivo celular.
- Reemplace por un medio de cultivo hiPSC-CM fresco a 24 h postplato. En este punto se pueden observar palizas espontáneas de cardiomiocitos (Ver vídeo 3).
- Cambie los medios cada 2 días hasta el final de los experimentos.
5. electroporación hiPSC-CM y adquisición de señal (Figuras 4 – 6)
NOTA: Este protocolo es para la grabación simultánea de señales de electrodos de alto rendimiento (12 sitios para cada uno de los 24 pozos). El sistema MEA multipozo de 24 pozos se utiliza con el software de adquisición (consulte Tabla de materiales). Todas las grabaciones de MEA se llevan a cabo a 37 oC.
- Encienda la placa de interfaz e inicie el software de adquisición. Deje tiempo suficiente para que el escenario meado multipozo alcance la temperatura de 37 oC (véase la flecha no 1 en la Figura 4).
- Inserte la placa MEA multipozo del paso 4 en el escenario de MEA multipozo colocándola cubierta sobre la plataforma de grabación y haga clic en el botón Insertar (consulte la flecha no 2 en la Figura4). Deje que la temperatura se estabilice antes de iniciar las grabaciones.
-
Ajuste la configuración de adquisición y electroporación
- Haga clic en el icono Definir flujo experimental (consulte la flecha no 3 en la Figura 4) y establezca el tiempo de grabación en 2 min o como desee.
- Haga clic en el icono Configuración de adquisición de datos (consulte la flecha no 4 en la Figura 4) y establezca la frecuencia de muestreo a 20 kHz, el filtro de paso alto en 0,1 Hz y el filtro de paso bajo a 3500 Hz.
- Haga clic en el icono Configuración del estimulador (consulte la figura5). En la pestaña Definición de estímulo, defina la estimulación como pulsos de tensión simétrica bifásica de 1 mV, 1 ms y 1 Hz. En la pestaña Electrodos de estimulación, seleccione los sitios de electroporación resaltando todos los electrodos relevantes.
- Haga clic en el botón Explorar para visualizar las señales en todos los pozos. Verifique la calidad de la señal y las condiciones de estado constante. Tome notas sobre electrodos con señales FP en el rango mV. Haga clic en el mismo botón para detener la exploración. No se han registrado datos hasta este momento.
- Comience a grabar haciendo clic en el botón Ir!. Los electrodos de cada pozo mostrarán las señales FP en la ventana de datos sin procesar (Figura6). Después de 30 s de grabación, haga clic en el botón Estimular y permita que la electroporación tenga lugar en los sitios seleccionados durante 30 s; a continuación, haga clic en el mismo botón para detener la estimulación y continuar la grabación durante los 60 s restantes.
NOTA: El archivo grabado se puede reproducir cambiando al "Modo Rejugador" en el menú desplegable "Aplicación".
6. Limpieza de placas Multiwell MEA para su reutilización
- Después de los experimentos finales, limpie todos los pozos de la placa multipozo aspirando todo el contenido multimedia de cada pocal y evitando cuidadosamente tocar la superficie del electrodo.
- Añadir 1 ml de ddH estéril2O por pozo. Aspira y repite una vez.
- Añadir 0,3 ml de solución de limpieza multipozo (ver paso 1.5) por pozo. Incubar durante la noche a temperatura ambiente para desalojar células y escombros.
- A la mañana siguiente, aspirar la solución y enjuagar con 1 ml de ddH estéril2O. Incubar durante 5 - 7 min y aspirar. Repita 5 veces.
- Añadir 0,5 ml de ddH estéril2O por pozo. Registre la línea de base de la placa multipocilla limpia para comprobar la calidad de los AEA limpios (Figura7).
- Conservar a 4oC hasta que esté listo para usar.
7. Conversión y exportación de archivos de datos
NOTA: Se generarán cuatro archivos de datos para cada grabación: archivos MWR, MWC, MWD y MWS. Utilizando el software convertidor, el archivo MWD se puede convertir a archivo H5 para su posterior análisis utilizando un script personalizado (consulte Archivo complementario 1).
- Inicie el software del convertidor (consulte Tabla de materiales).
- Seleccione Establecer ruta de entrada en el menú Archivo. Seleccione la carpeta que contiene los archivos de datos de interés.
- Seleccione Establecer ruta de salida en el menú Archivo. Seleccione la carpeta donde se guardarán los archivos convertidos.
- Resalte el archivo MWD de interés.
- Haga clic en el botón EXPORTAR a HDF5.
8. Segmentación y análisis de datos (Figuras 8-10)
NOTA: El software personalizado basado en Matlab se utiliza para segmentar y extraer varios parámetros de datos FP y AP. El software está disponible bajo demanda.
- Ejecute el código de análisis de forma de onda con Matlab (consulte la figura 8 para obtener una vista de la ventana principal de la GUI).
- Haga clic en Archivo y seleccione Procesar .h5.
- Busque y seleccione el archivo mwd.h5 creado según el paso 7 anterior.
- Haga clic en el botón Guardar directorio para cambiar la ubicación de almacenamiento de los archivos de salida.
- Cree una cola de procesamiento de señal seleccionando combinaciones de electrodos/bien de interés y, a continuación, haciendo clic en el botón Cola. Repita este paso para añadir más combinaciones de electrodos/pozos que se procesarán a la cola.
- Edite la cola haciendo clic directamente en Med Name / Med Concentration si las células fueron tratadas con medicamentos ( Figura8).
- Una vez que la cola sea final, haga clic en el botón Inicializar formas de onda. Esto iniciará el procesamiento preliminar en el que se identifican y extraen las señales para la segmentación.
- Haga clic en el botón Acercar y seleccione el área de interés potencial de acción con el cursor (Figura9).
- Haga clic en el botón Mantener y revise los paneles. Los picos (rojo 'x') y los valles (círculos amarillos) se detectan para cada forma de onda y los potenciales de acción normalizados se superponen. Haga clic en el botón Mantener y pase al siguiente seguimiento en la cola (figura10).
- Repita los pasos 8.8-8.9 para el resto de las señales combinadas de electrodo/pozo en la cola.
NOTA: Se generará un archivo .csv con parámetros APD medidos para cada forma de onda. También se guarda un archivo .mat para cada archivo .h5 para permitir el procesamiento adicional de datos segmentados.
Resultados
La viabilidad y la densidad de chapado de los hiPSC-CP posteriores descongelarse es fundamental para la cultura MEA multipozo. El pre-placado de 1-2 millones de hiPSC-C/vial en dos pocillos de una placa de cultivo de tejido de 6 pocillos con 50% o mayor viabilidad producirá un cultivo monocapa saludable con latidos espontáneos a 48 h. La mala viabilidad de los MD resultará en cultivos con un alto porcentaje de viabilidad poblaciones no miocitos. Estas monocapas cuando se disocian para el revestimiento de MEA multipozo generalmente producen resultados inconsistentes y señales de mala calidad y, por lo tanto, deben descartarse. La Figura 1 muestra ejemplos de cultivos óptimos frente a los cultivos de hiPSC-CP subóptimos a 48 h de postchapado. Descongelar los CM en placas de cultivo de tejido recubiertodes de sustrato en lugar de directamente en MEA multipocillos, permite la recuperación celular y la maduración3. No se recomienda el chapado directo de los C crioconservados en la matriz, ya que produjo resultados inconsistentes.
Además de la calidad de los MC disociados, la unión celular en EL MEA multipozo depende en gran medida de la densidad celular y de la técnica de recubrimiento de fibronectina. El tamaño de las gotas de fibronectina es crítico, ya que los MN se ajustarán a los límites del área recubierta de fibronectina. Por esta razón, sólo 5 l de la solución de fibronectina se dispensan directamente sobre el área de la matriz de electrodos. Para asegurarse de que la gota no se dispersa, la superficie del pozo debe estar completamente seca en el momento del recubrimiento. La Figura 2 muestra el diseño de la placa MEA multipozo con esquemas de pretratamiento paso a paso para una preparación óptima. Además, para evitar que la fibronectina seque las placas MULTIwell MEA debe colocarse dentro de una cámara humidificadora durante el período de incubación que no dure más de 3 h (ver paso 3.8). Una vez completado el período de incubación, es importante eliminar la gota de fibronectina de cada pocil justo antes del revestimiento CM y sólo entonces proceder al siguiente revestimiento del pozo. Trabajar rápida y cuidadosamente la dosificación de los MMs es la clave para el apego exitoso de la célula.
Los cultivos hiPSC-CM a los 30 días posteriores a la diferenciación se disocian para el revestimiento de MEA multipozo utilizando el método de disociación de células enzimáticas (ver paso 4). Los PM se unirán a las superficies MEA recubiertas de fibronectina en 3 h y una monocapa que cubra las matrices será visible después de 24 h de post-placado (Figura3). El latido sincrónico de la monocapa se observará a las 24-48 h. La dispersión de las gotas celulares afectará la densidad del cultivo o incluso conducirá al secado y a la muerte celular. La colocación precisa de la célula directamente en la matriz es de suma importancia y por lo tanto la técnica debe practicarse para un revestimiento óptimo. La adhesión celular al electrodo de referencia dificultará la producción de señales eléctricas. Vea la Figura 3 para las imágenes de la colocación óptima de CM, y el cultivo después de 24 h.
Los MM cultivados en los AME multipozos se someten a un control de calidad para la actividad eléctrica a 48 h de post-plating. Típicamente, la amplitud de la señal FP aumenta desde elrango de V a mV en aproximadamente 4 días 3. Si el 50% de los electrodos dentro de una red y el 70% de las redes totales no producen señales FP, entonces la red o el cultivo son subóptimos y deben descartarse. Solo se procesan las referencias culturales que pasan la comprobación de calidad para el análisis FP y AP. La Figura 6 muestra ejemplos de señales FP buenas y subestándar.
Las grabaciones AP mediadas por electroporación se pueden obtener varias veces de los cultivos 48 h post-MEA. Empleando la electroporación, obtuvimos acceso intracelular para registrar AP de alta resolución de múltiples redes de cardiomiocitos derivados de hiPSC. Los pulsos de baja tensión (1 V, 1 ms, 1 Hz) para 30 s se entregaron para la transformación transitoria y reversible de FP a AP. La electroporación permite un acceso intracelular exitoso para la medición AP en aproximadamente el 75% de los electrodos. Las señales eléctricas se registran durante 2 min que incluyen 30 s de preelectroporación, 30 s durante y 1 min después de la electroporación. Un tren de 10 s formas de onda AP 10 s post-electroporación se evalúan en todos los sitios para la calidad de la señal y el análisis. Cualquier traza que no se ajuste a la señal AP pura se descarta. Para investigar si las amplitudes AP se correlacionan con la señal FP electroportamos los 288 sitios para registrar simultáneamente formas de onda. Las señales representativas FP y AP registradas desde el mismo sitio celular de dos electrodos diferentes se muestran en la Figura 11A. No observamos ninguna correlación entre las amplitudes FP y las amplitudes AP posteriores a la electroporación registradas desde el mismo sitio celular. Además, múltiples electroporaciones del mismo sitio celular en 0, 24, 48, 72 y 96 h no tuvieron ningún efecto significativo en la forma AP con el tiempo (Figura11B).
Dada la naturaleza de alto rendimiento del sistema, una técnica manual para extraer y cuantificar parámetros de interés como el intervalo RR, la frecuencia instantánea y la duración del potencial de acción diferencial es ineficiente y requiere mucho tiempo. Se emplea un script MATLAB personalizado disponible para la comunidad de investigación a petición para realizar mediciones de forma de onda con una resolución de 1. Los puntos de tiempo de electroporación se superponen con la señal extraída para identificar 10 s de POSTelectroporación AP para llevar a cabo la extracción de la señal, el aseguramiento de la calidad y el flujo de trabajo de segmentación (Figura8, Figura 9, Figura 10). La interfaz de usuario permite seleccionar el segmento deseado utilizando los indicadores de electroporación superpuestos como guía. La forma de onda segmentada es procesada por subrutinas para identificar más formas de onda AP individuales. Esto se completa a través de la detección de picos, donde se identifica el voltaje más alto y más bajo para cada ciclo. Una vez completado este proceso, las amplitudes se normalizan y los vectores de tiempo de asociación se desplazan para definir el tiempo cero en un valor máximo de 1. La interpolación de puntos de intersección a lo largo de los ciclos individuales se utilizó para determinar las mediciones de APD. Por lo tanto, el flujo de trabajo de automatización parcial para la segmentación de forma de onda AP permite un análisis de datos eficiente para varios parámetros de APD en varios lotes de cultivos en un corto período de tiempo. La automatización adicional de los criterios de inclusión y exclusión para LOS FP y los AP está en curso para el análisis de datos en tiempo real.
Una ventaja significativa de la placa MEA multipocilla es que se puede reutilizar varias veces. Esta restauración permite estudios electrofisiológicos repetitivos para una recopilación de datos rentable y coherente. Las grabaciones de los AP de la misma matriz después de 6 restauraciones se muestran en el cuadro 12. La relación señal-ruido es similar en múltiples reutilizaciones. Para demostrar la fiabilidad de la matriz para estudios electrofisiológicos repetitivos, se agrupan un total de 3815 formas de onda AP a partir de tres lotes de restauración y se extraen datos de duración de AP para examinar la repetibilidad de los resultados. Se muestran gráficas de distribución para la forma de onda individual APD30, APD80, triangulación (APD80—APD30) y acortamiento fraccionario ((APD80—APD30)/(APD80)) (Figura 13).

Figura 1: Pre-plating de hiPSC-CM crioconservado para maduración. (A) Procesamiento celular para pre-plating 1 vial de 10 días post-diferenciación crioconservado hiPSC-CMs. (B) Imágenes de contraste de fase de cultivos hiPSC exitosos (izquierda) y no exitosos (derecha). Barra de escala: 275 m. Consulte Vídeo 1 y Vídeo 2 para ver ejemplos de cultura posteriores a la diferenciación de 14 y 24 días. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Configuración y preparación de placas Multiwell MEA. (A) Esquemas de placa sordos MEA: La placa consta de 24 pocillos (A1 a D6) cada uno que contiene 12 matrices de microelectrodos y 4 electrodos de referencia periféricos. Diámetro del electrodo: distancia de 30 m / interelectrodo: 300 m. Las grabaciones se pueden obtener a partir de los 288 electrodos simultáneamente. (B) Etapas de esterilización y tratamiento hidrófilo que deben realizarse antes del revestimiento hiPSC-CM. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: disociación hiPSC-CM y chapado en placa Multiwell MEA. (A) Esquemas de pasos de chapado de HIPSC-CM MEA para cada poca. (B) Imagen microscópica que ilustra la colocación correcta de las gotas celulares que cubren los 12 electrodos sin extenderse a los 4 electrodos de referencia. (C) Imágenes microscópicas de contraste de fase de un revestimiento hiPSC-CM ejemplar (izquierda) y subóptimo (derecha) en MEA a 24 h post-plating. Barra de escala de 275 m. Consulte el vídeo 3 para obtener un ejemplo de revestimiento de MEA correcto. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Software de adquisición multipantalla. Las flechas indican la ubicación de las características y funciones clave a las que se hace referencia en el texto: el panel Control de temperatura (1) permite la monitorización de la temperatura en tiempo real durante todo el experimento. Inserte/expulse el botón (2) enganche y suelte la placa Multiwell MEA. La función Definir flujo experimental (3) permite al usuario establecer la duración de la grabación. La función Configuración de adquisición de datos (4) permite al usuario establecer la velocidad de muestreo y la configuración del filtro de adquisición. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: hiPSC-CM electroporación y adquisición de señales . La pestaña Definición de estímulo permite al usuario definir los parámetros de pulso electroporata. La pestaña Electrodos de Estimulación permite al usuario seleccionar los electrodos electroporantes. Se puede seleccionar cualquier combinación de los 288 electrodos. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Comprobación de calidad de los AME Multiwell para la actividad eléctrica. Multiwell- Software de adquisición depantalla que muestra ventanas de datos sin procesar con ejemplos representativos de señales FP óptimas (A) y subestándar (B). Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Señales FP y AP de la matriz nueva y restaurada. Pasos de limpieza enzimáticos Multiwell MEA (A). La señal de línea de base de la nueva matriz muestra una relación señal/ruido mínima (B) y las señales FP muestran la actividad eléctrica de la red (C). Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: Segmentación y análisis de datos. Vista de la ventana principal de la GUI para Análisisde forma de onda . Haga clic aquí para ver una versión más grande de esta figura.

Figura 9: Segmentación y análisis de datos. Inicialice el botón Formas de onda para identificar y extraer formas de onda AP para la segmentación e iniciar el procesamiento preliminar ampliando y seleccionando el área de interés potencial de acción. Los círculos rojos son los indicadores de electroporación. Haga clic aquí para ver una versión más grande de esta figura.

Figura 10: Segmentación y análisis de datos. Los picos (rojo 'x') y los valles (círculos amarillos) se detectan para cada forma de onda y los AP normalizados se superponen para una comprobación de calidad de las formas de onda. Haga clic aquí para ver una versión más grande de esta figura.

Figura 11: Dependencia de amplitud AP en la señal FP para las grabaciones múltiples del mismo sitio de celda. La amplitud de FPen rangos de V (A , panel superior izquierdo) o rangos mV (A , panel superior derecho) registrados a partir de dos electrodos independientes producen amplitud AP en rango mV (PanelesA, inferior izquierdo y derecho) que no muestran correlación entre amplitudes FP y amplitudes AP postelectroporación. Las formas de onda AP normalizadas para cada grabación se superponen como se muestra para cada grabación. Múltiples electroporaciones del mismo sitio celular a 0 a 96 h produjeron formas de onda AP de alta calidad que permiten el seguimiento de la electrodinámica de membrana (B). Haga clic aquí para ver una versión más grande de esta figura.
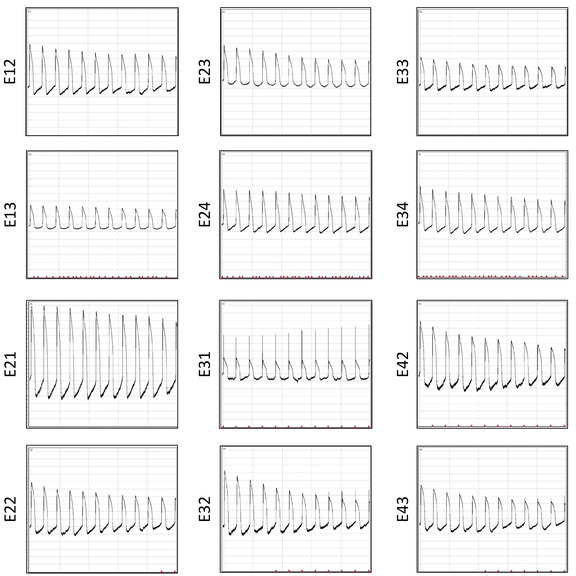
Figura 12: Grabaciones AP después de seis restauraciones. Se muestran formas de onda AP grabadas simultáneamente 10 s después de la electroporación a través de 12 electrodos del mismo pozo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 13: histogramas de parámetros APD de múltiples restauraciones. Gráficas de distribución para forma de onda individual APD30 (A), APD80 (B), triangulación (APD80—APD30) (C) y acortamiento fraccionario ((APD80—APD30)/(APD80)) (D) se muestran. Haga clic aquí para ver una versión más grande de esta figura.
Archivos suplementarios. Videos 1-3. Haga clic aquí para descargar este archivo.
Discusión
A lo largo de los años, la aplicación de meA se ha limitado a realizar mediciones FP de células excitables para estudiar sus propiedades electrofisiológicas36,37,38,39. Sólo unos pocos grupos han reportado trazas AP de células electrogénicas utilizando la tecnología personalizada basada en MEA18,29,30. Sin embargo, estos enfoques no se han investigado para grabaciones repetidas de los mismos preparativos. Desarrollamos una metodología innovadora y precisa para estudiar AP desde el mismo sitio celular durante días en múltiples redes hiPSC-CM simultáneamente3. En nuestro estudio publicado, se empleó una plataforma MEA de microoro multipopara generar bibliotecas de forma de onda AP a partir de múltiples lotes de cultivos hiPSC-CM con alta precisión y con una resolución temporal de 1 s. El protocolo descrito aquí explica la sembración de hiPSC-CM en el arreglo de discos para el desarrollo eficiente de redes CM sincitiales para grabaciones AP de alto rendimiento. Varios pasos críticos en el protocolo son: 1) producción de múltiples lotes de alta pureza de CM de calidad controlada para la banca criopreservativa, 2) CM post-deshielo altamente viables para pre-plating y maduración, 3) tratamiento de la placa MULTIwell MEA para CM sembrado, 4) disociación del cultivo de la hiPSC-CM a los 30 días después de la diferenciación para el revestimiento DEA, y 5) restauración de los AME para la reutilización múltiple.
Es importante tener en cuenta que la variación de lote a lote en la diferenciación hiPSC podría afectar a los resultados experimentales. El método monocapa de diferenciación fue optimizado internamente para la producción de cardiomiocitos de alto porcentaje3,40. El análisis FACS de los marcadores MLC2v y TNNT2 de nuestros cultivos demuestra un fenotipo similar al ventriculardel90 % 3. Estas culturas controladas por la calidad son crioconservadas para estudios experimentales. Los enfoques de diferenciación actuales producen una mezcla heterogénea de células nodales, auriculares y ventrículos3,16,17,41. Por lo tanto, las estrategias empleadas para el enriquecimiento de la población de subtipos CM pueden mejorar aún más la especificidad de las culturas. Además, se pueden emplear enfoques de ingeniería de tejidos para mejorar su maduración. Los métodos propuestos aquí se pueden implementar fácilmente para otras fuentes de CM.
Las formas de onda AP registradas con MEA eran similares a las registradas por redes de cardiomiocitos mediante mapeo óptico42,43, MEA basado en semiconductores de óxido metálico complementario18,21y AP simulado utilizando grabaciones FP20. Para abordar el mecanismo de las mediciones AP a través de MEA Hai y Spira25 demostró que la interfaz electroporo-electrodo imitaba la técnica de microelectrodo de vidrio afilado establecida. Sin embargo, el potencial de membrana en reposo y los verdaderos valores de amplitud en nuestro estudio no pueden establecerse dado que la interfaz electroporo-electrodo en los sistemas MEA no está calibrada, y que la amplitud es una función de la sensibilidad y resolución de la Técnica. Nuestro enfoque comparte limitaciones similares a la asignación óptica cuando se trata de amplitud AP.
Las lecturas multipozos de FP/AP basadas en MEA reportadas aquí abren nuevas posibilidades para la evaluación de la inocuidad de los medicamentos. Aunque espontáneos, estas monocapas hiPSC-CM late a velocidades constantes. El análisis de los parámetros de APD a través de múltiples redes proporciona información sobre la heterogeneidad eléctrica (Figura13). Sin embargo, los análisis exhaustivos de restitución de APD deben incorporar intervalos diastólicos anteriores. Además, las formas de onda AP de alta calidad registradas desde el mismo sitio celular sobre 96 h (Figura11B)es el primer informe para rastrear la electrodinámica de membrana a lo largo del tiempo que será de valor en el desarrollo y en la enfermedad.
El protocolo descrito aquí para cuantificar los parámetros AP se puede utilizar para generar curvas dosis-respuesta para probar compuestos. Como informó recientemente Edwards et al.3, la respuesta de la dosis de norepinefrina, isoproterenol y E 4031 se trazan para el TPA en varias fases de repolarización. El estudio publicado demostró la precisión y fiabilidad del enfoque para la identificación de los cambios sutiles dependientes de la dosis en las formas de onda AP en tiempo real. Esta técnica podría extenderse fácilmente para otros compuestos o bibliotecas de moléculas pequeñas para comprender varias respuestas electrofisiológicas.
El enfoque basado en MEA para las mediciones AP presentadas en este estudio será de interés no sólo para los electrofisiólogos, sino también para los biólogos celulares y los modeladores in-silico. Además, las grabaciones FP/AP desde el mismo sitio celular en hiPSC-CP permitirán a los investigadores generar bibliotecas de datos bioeléctricos de una amplia gama de redes celulares excitables en un corto período de tiempo. La disponibilidad de estos recursos será valiosa para los descubrimientos de drogas y el modelado de enfermedades.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Ninguno
Materiales
| Name | Company | Catalog Number | Comments |
| Accutase | Sigma Aldrich | A6964-100ML | cell dissociation solution |
| Acquisition software | Multichannel Systems | Multiwell-Screen v 1.9.2.0 | |
| B27 Supplement | ThermoFisher | 17504-044 | CM media supplement |
| Converter software | Multichannel Systems | MultiChannel DataManager | |
| DMEM/F12 | ThermoFisher | 11330-032 | |
| D-PBS | ThermoFisher | 14190-250 | |
| FBS | Fisher Scientific | SH3007103HI | |
| Fibronectin | Sigma Aldrich | F1141-5MG | |
| Geltrex | ThermoFisher | A1413202 | coating substrate |
| Interface board | Multichannel Systems | MCS-IFB 3.0 Multiboot Interface Board | |
| Multiwell MEA Plate | Multichannel Systems | 24W300/30G-288 | |
| RPMI 1640 | ThermoFisher | 11875-093 | CM base medium |
| Terg-a-zyme | Sigma Aldrich | Z273287-1EA | enzymatic detergent |
| Transfer pipettes, individually wrapped | Fisher Scientific | 1371148 | |
| Trypan Blue | Sigma Aldrich | T8154-100ML | |
| Ultrapure sterile water | ThermoFisher | 10977-023 | |
| 6-well tissue-culture treated plates | Fisher Scientific | 08-772-1B |
Referencias
- Dambrot, C., Passier, R., Atsma, D., Mummery, C. L. Cardiomyocyte differentiation of pluripotent stem cells and their use as cardiac disease models. Biochemical Journal. 434 (1), 25-35 (2011).
- Dunn, K. K., Palecek, S. P. Engineering Scalable Manufacturing of High-Quality Stem Cell-Derived Cardiomyocytes for Cardiac Tissue Repair. Frontiers in medicine. 5, (2018).
- Edwards, S. L., et al. A Multiwell Cardiac muGMEA Platform for Action Potential Recordings from Human iPSC-Derived Cardiomyocyte Constructs. Stem Cell Reports. 11 (2), 522-536 (2018).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110 (4), 609-623 (2012).
- Huebsch, N., et al. Miniaturized iPS-Cell-Derived Cardiac Muscles for Physiologically Relevant Drug Response Analyses. Scientific Reports. 6, 24726(2016).
- Lundy, S. D., Zhu, W. Z., Regnier, M., Laflamme, M. A. Structural and functional maturation of cardiomyocytes derived from human pluripotent stem cells. Stem Cells and Development. 22 (14), 1991-2002 (2013).
- Ma, J., et al. High purity human-induced pluripotent stem cell-derived cardiomyocytes: electrophysiological properties of action potentials and ionic currents. American Journal of Physiology-Heart and Circulatory Physiology. 301 (5), H2006-H2017 (2011).
- Sharma, A., et al. Use of human induced pluripotent stem cell-derived cardiomyocytes to assess drug cardiotoxicity. Nature Protocols. , (2018).
- Zhang, D., et al. Tissue-engineered cardiac patch for advanced functional maturation of human ESC-derived cardiomyocytes. Biomaterials. 34 (23), 5813-5820 (2013).
- Zhang, J., et al. Extracellular matrix promotes highly efficient cardiac differentiation of human pluripotent stem cells: the matrix sandwich method. Circulation Research. 111 (9), 1125-1136 (2012).
- Burridge, P. W., Holmstrom, A., Wu, J. C. Chemically Defined Culture and Cardiomyocyte Differentiation of Human Pluripotent Stem Cells. Current Protocols in Human Genetics. 87, (2015).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature Methods. 11 (8), 855-860 (2014).
- Burridge, P. W., Zambidis, E. T. Highly efficient directed differentiation of human induced pluripotent stem cells into cardiomyocytes. Methods in Molecular Biology. , 149-161 (2013).
- Laflamme, M. A., et al. Cardiomyocytes derived from human embryonic stem cells in pro-survival factors enhance function of infarcted rat hearts. Nature Biotechnology. 25 (9), 1015-1024 (2007).
- Sharma, A., et al. Derivation of highly purified cardiomyocytes from human induced pluripotent stem cells using small molecule-modulated differentiation and subsequent glucose starvation. Journal of Visualized Experiments. (97), (2015).
- Bhattacharya, S., et al. High efficiency differentiation of human pluripotent stem cells to cardiomyocytes and characterization by flow cytometry. Journal of Visualized Experiments. (91), (2014).
- Zhang, J., et al. Functional cardiomyocytes derived from human induced pluripotent stem cells. Circulation Research. 104 (4), e30-e41 (2009).
- Jans, D., et al. Action potential-based MEA platform for in vitro screening of drug-induced cardiotoxicity using human iPSCs and rat neonatal myocytes. Journal of Pharmacological and Toxicological Methods. 87, 48-52 (2017).
- Strauss, D. G., Blinova, K. Clinical Trials in a Dish. Trends in Pharmacological Science. 38 (1), 4-7 (2017).
- Tertoolen, L. G. J., Braam, S. R., van Meer, B. J., Passier, R., Mummery, C. L. Interpretation of field potentials measured on a multi electrode array in pharmacological toxicity screening on primary and human pluripotent stem cell-derived cardiomyocytes. Biochemical and Biophysical Research Communications. 497 (4), 1135-1141 (2018).
- Braeken, D., et al. Open-cell recording of action potentials using active electrode arrays. Lab Chip. 12 (21), 4397-4402 (2012).
- Otsuji, T. G., et al. Progressive maturation in contracting cardiomyocytes derived from human embryonic stem cells: Qualitative effects on electrophysiological responses to drugs. Stem Cell Research. 4 (3), 201-213 (2010).
- Shinozawa, T., Imahashi, K., Sawada, H., Furukawa, H., Takami, K. Determination of appropriate stage of human-induced pluripotent stem cell-derived cardiomyocytes for drug screening and pharmacological evaluation in vitro. Journal of Biomolecular Screening. 17 (9), 1192-1203 (2012).
- Raphel, F., et al. Identification of Ion Currents Components Generating Field Potential Recorded in MEA From hiPSC-CM. IEEE Transactions on Biomedical Engineering. 65 (6), 1311-1319 (2018).
- Hai, A., Spira, M. E. On-chip electroporation, membrane repair dynamics and transient in-cell recordings by arrays of gold mushroom-shaped microelectrodes. Lab Chip. 12 (16), 2865-2873 (2012).
- Xie, C., Lin, Z., Hanson, L., Cui, Y., Cui, B. Intracellular recording of action potentials by nanopillar electroporation. Nature Nanotechnology. 7 (3), 185-190 (2012).
- Cohen, A., Shappir, J., Yitzchaik, S., Spira, M. E. Reversible transition of extracellular field potential recordings to intracellular recordings of action potentials generated by neurons grown on transistors. Biosensors and Bioelectronics. 23 (6), 811-819 (2008).
- Ojovan, S. M., et al. A feasibility study of multi-site,intracellular recordings from mammalian neurons by extracellular gold mushroom-shaped microelectrodes. Scientific Reports. 5, 14100(2015).
- Shmoel, N., et al. Multisite electrophysiological recordings by self-assembled loose-patch-like junctions between cultured hippocampal neurons and mushroom-shaped microelectrodes. Scientific Reports. 6, 27110(2016).
- Lin, Z. C., Xie, C., Osakada, Y., Cui, Y., Cui, B. Iridium oxide nanotube electrodes for sensitive and prolonged intracellular measurement of action potentials. Nature Communications. 5, 3206(2014).
- Stett, A., Burkhardt, C., Weber, U., van Stiphout, P., Knott, T. CYTOCENTERING: a novel technique enabling automated cell-by-cell patch clamping with the CYTOPATCH chip. Receptors Channels. 9 (1), 59-66 (2003).
- Kanda, Y., Yamazaki, D., Osada, T., Yoshinaga, T., Sawada, K. Development of torsadogenic risk assessment using human induced pluripotent stem cell-derived cardiomyocytes: Japan iPS Cardiac Safety Assessment (JiCSA) update. Journal of Pharmacological Sciences. 138 (4), 233-239 (2018).
- Yang, X., Papoian, T. Moving beyond the comprehensive in vitro proarrhythmia assay: Use of human-induced pluripotent stem cell-derived cardiomyocytes to assess contractile effects associated with drug-induced structural cardiotoxicity. Journal of Applied Toxicology. 38 (9), 1166-1176 (2018).
- Sala, L., Bellin, M., Mummery, C. L. Integrating cardiomyocytes from human pluripotent stem cells in safety pharmacology: has the time come. British Journal of Pharmacology. 174 (21), 3749-3765 (2017).
- Zlochiver, V., Edwards, S., Joshi-Mukherjee, R. Longitudinal Cardiotoxic Effect of Doxorubicin in a Multicellular Cardiac Model. Biophysical Journal. 116 (3), (2019).
- Del Alamo, J. C., et al. High throughput physiological screening of iPSC-derived cardiomyocytes for drug development. Biochimica et Biophysica Acta. 1863 (7 Pt B), 1717-1727 (2016).
- Clements, M. Multielectrode Array (MEA) Assay for Profiling Electrophysiological Drug Effects in Human Stem Cell-Derived Cardiomyocytes. Current Protocols in Toxicology. 68, 21-22 (2016).
- Navarrete, E. G., et al. Screening drug-induced arrhythmia [corrected] using human induced pluripotent stem cell-derived cardiomyocytes and low-impedance microelectrode arrays. Circulation. 128 (11 Suppl 1), S3-S13 (2013).
- Harris, K., et al. Comparison of electrophysiological data from human-induced pluripotent stem cell-derived cardiomyocytes to functional preclinical safety assays. Toxicological Sciences. 134 (2), 412-426 (2013).
- Zlochiver, V., Edwards, S. L., Joshi-Mukherjee, R. Longitudinal Cardiotoxic Effect of Doxorubicin in a Multicellular Cardiac Model. Biophysical Journal. 116 (3), (2019).
- Waas, M., et al. Are These Cardiomyocytes? Protocol Development Reveals Impact of Sample Preparation on the Accuracy of Identifying Cardiomyocytes by Flow Cytometry. Stem Cell Reports. , (2019).
- Gorospe, G., et al. Automated grouping of action potentials of human embryonic stem cell-derived cardiomyocytes. IEEE Transactions on Biomedical Engineering. 61 (9), 2389-2395 (2014).
- Zhu, W., Varga, Z., Silva, J. R. Molecular motions that shape the cardiac action potential: Insights from voltage clamp fluorometry. Progress in Biophysics & Molecular Biology. 120 (1-3), 3-17 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados