Method Article
Uso de imágenes de resonancia magnética y datos de biopsia para guiar los procedimientos de muestreo para la biobanca del cáncer de próstata
En este artículo
Resumen
Este método implica la utilización de datos de diagnóstico clínico para pacientes con cáncer de próstata con el fin de guiar los procedimientos de muestreo, cuando el tejido biobancario después de la prostatectomía radical. Esto supera los problemas con los métodos publicados anteriormente en torno a la eficiencia y la disponibilidad de tejido fresco para una gama más amplia de aplicaciones posteriores.
Resumen
Los métodos anteriores para biobanca de tejido prostático, después de la prostatectomía radical, generalmente implicaban muestreo aleatorio. Con el fin de aumentar la eficiencia, y permitir una mayor gama de aplicaciones aguas abajo, se desarrolló un método más específico de muestreo de tejido prostático. Aquí utilizamos tanto la resonancia magnética (RM) como los datos de biopsia para apuntar a áreas específicas del órgano para el muestreo. El método implica el uso de un dispositivo de corte de próstata publicado previamente que elimina una rebanada transversal de 5 mm de una región predeterminada de la próstata, seguido por la eliminación de biopsias de punzonado de 6 mm de áreas predeterminadas de esta rebanada. Estas muestras pueden almacenarse congeladas o fijas para fines de biobanca, o utilizarse de forma fresca inmediatamente con un 70% de confianza en el contenido tumoral, en comparación con el 10% de confianza del enfoque de muestreo aleatorio. Esto permite el uso de todas las técnicas estándar aguas abajo como la genómica, la proteómica o el trabajo histológico, pero también el trabajo que requiere tejido fresco como imágenes de tejidos vivos o cultivo ex vivo.
Introducción
El acceso a tejido de cáncer de próstata humano de alta calidad es un requisito clave para impulsar la investigación eficaz en el campo. Hay una serie de métodos existentes para tomar muestras de tejido prostático después de la prostatectomía radical para la investigación. Por lo general, estos implican el uso de biopsias de punzonado para tomar muestras aleatorias de una rebanada fresca, congelada o fija de tejido prostático, y confirmar retrospectivamente si el tumor está presente o no en cada muestra por hematoxilina y eosina (H&E) según lo evaluado por un uropatólogo1,2,3,4,5. Una revisión reciente ha compilado una visión general de estos métodos existentes6. Estos métodos son útiles para ciertas aplicaciones posteriores, donde el tejido puede almacenarse y evaluarse para el contenido tumoral en una fecha posterior, como análisis genómicos a gran escala como el Consorcio Internacional del Genoma del Cáncer (ICGC) y el Atlas del Genoma del Cáncer (TCGA) 4,7. Sin embargo, estos métodos podrían mejorarse si usemos imágenes por resonancia magnética (RM) y/o datos de biopsia para apuntar a áreas específicas de la próstata para el muestreo. Esto mejoraría la metodología de dos maneras; en primer lugar, reduciendo el número de muestras de tejido recogidas, aumentando la eficiencia y reduciendo la presión sobre los departamentos de patología y el costo de almacenamiento, y en segundo lugar, permitiendo que el tejido fresco se utilice inmediatamente sin necesidad de confirmación inmediata de contenido tumoral, para nuevas tecnologías de vanguardia como imágenes de tejidos vivos, generación de organoides o cultivo ex vivo. Esta necesidad de investigación ha llevado al desarrollo del método PEOPLE (PatiEnt prOstate samPLes for rEsearch), y los resultados de los primeros 84 casos biofinanciados con PERSONAS se publicaron recientemente8. También se ha publicado una variación de este método con un aparato de corte impreso tridimensional (3D) y un molde específico del paciente, con el fin de facilitar la RMN ex vivo en el tejido de pre y post-fijación9,10.
Protocolo
El protocolo se adhiere a las directrices locales y está aprobado por el Comité de ética de investigación del Biobanco UCL/UCLC (Referencia 15/YH/0311).
NOTA: Dado que este método implica el muestreo de tejido humano, todos los procedimientos locales relativos a la ética y el consentimiento deben observarse antes de comenzar el protocolo. Se pueden incluir casos de prostatectomía radical si se dispone de datos de RMN y biopsia antes de la cirugía, con un diámetro tumoral de 5 mm. Se deben excluir los casos si la lesión del índice no está bien definida, es decir, solo los cambios difusos son visibles por la RMN.
1. Aparato de corte de próstata
- Comprar el aparato de corte de próstata(Tabla de Materiales). Alternativamente, imprima un asa de cuchilla utilizando una impresora 3D como se publicó anteriormente10.
NOTA: El dispositivo y las cuchillas desechables utilizadas aquí fueron comprados bajo el acuerdo de transferencia de material del Instituto de Investigación del Cáncer, Londres, Reino Unido.
2. Objetivo del tumor
- Revise las notas clínicas para identificar la lesión del índice según lo indicado por la biopsia diagnóstica, por ejemplo, la parte posterior izquierda.
- Revise las imágenes de RMN para medir la ubicación del tumor anterior.
- Encuentre la secuencia donde el tumor es más visible en el plano axial, por ejemplo, ponderado en T2.
- Desplácese por las imágenes axiales para encontrar la imagen donde el tumor es más grande e imprima la imagen como referencia.
- En la imagen coronal correspondiente, mida la distancia desde la base de la próstata hasta la posición axial seleccionada, y la longitud completa de la próstata desde el ápice hasta la base (mm), e imprima como referencia.
3. Colección de pProstate
- Compruebe las notas del paciente para asegurarse de que se ha obtenido el consentimiento informado adecuado para este procedimiento y cualquier aplicación de investigación posterior.
- Después de la prostatectomía radical, recoger la próstata en una olla seca. Asegúrese de que no se ha añadido formalina u otro fijador a la próstata.
- Traslado a un lugar estéril adecuado para el muestreo, por ejemplo, una campana de flujo laminar en un laboratorio de patología.
- Proceda al muestreo tan pronto como sea posible si se requiere tejido fresco.
NOTA: Para ciertas aplicaciones (por ejemplo, la evaluación del ADN que no debe degradarse tan rápidamente como el ARN), puede ser apropiado refrigerar la muestra y tomar muestras al día siguiente.
4. Preparación de especímenes
- Preparar la campana de flujo laminar y aparatos de corte de próstata de acuerdo con los procedimientos de descontaminación local, utilizando la técnica estéril. Aquí, rocíe 70% de etanol y limpie todas las superficies. Utilice agujas y bisturíes estériles de un solo uso. Utilice cuchillas de corte hasta tres veces; lavar después de cada uso en agua jabonosa caliente, luego rociar y limpiar con 70% de etanol.
- Pesar la próstata (g) usando una báscula estándar.
- Tinta la próstata. Pinta el lado izquierdo con tinta azul y el lado derecho con tinta negra. Cubra la cápsula completa y las vesículas seminales con tinta para denotar más tarde los márgenes quirúrgicos.
NOTA: Los procedimientos de entrada manuscrita pueden variar localmente y pueden modificarse en consecuencia.
5. Corte de próstata
- Montar el aparato de corte insertando las paredes perpendicularmente en la base del soporte(Figura 1A).
- Coloque la próstata de modo que la base y el ápice estén frente a paredes opuestas, con el lado posterior hacia abajo y hacia arriba. Coloque alfileres de oro alrededor de la próstata. Empuje la próstata hacia adentro ligeramente si es necesario para obtener un ajuste ceñido, que apoyará la próstata durante el corte.
- Mida la longitud de la próstata de la base al ápice, usando una regla, y compárela con la longitud de la próstata medida por la RMN. Si la próstata se ha reducido, aplique una corrección ad hoc a la distancia prevista desde la base hasta la rebanada transversal objetivo. Por ejemplo, si la longitud total de la próstata en la imagen de RMN es de 50 mm, pero cuando se mide con una regla en este punto se ha reducido a 45 mm, reduzca la posición de corte prevista en un 10%.
- Mida desde la base hasta el sector transversal deseado. Elija el pasador que se encuentra más cerca de esta medida para cortar alrededor.
- Usar guantes de cadena para evitar lesiones, sujetar el dispositivo de corte(Figura 1B),colocar cuchillas a ambos lados del pasador identificado y utilizar el espaciador para mantener las cuchillas separadas por 5 mm. Tome la rebanada moviendo lentamente y firmemente las cuchillas hacia abajo, hacia adelante y hacia atrás con trazos largos(Figura 1C). Asegúrese de separar una rebanada completa antes de desmontar el aparato.
- Retire las paredes y los alfileres y retire cuidadosamente la rebanada en una lámina estéril de cartón de corcho usando guantes.
6. Muestreo de tejidos
- Inspeccione visualmente el sector transversal y compárelo con la imagen de RMN axial. En algunos casos, el área del tumor puede parecer más pálida que el tejido circundante.
- Palpate suavemente la rebanada transversal. En algunos casos, el tumor puede sentirse más firme que el tejido circundante.
- Con la imagen de RMN axial como guía, seleccione una o más áreas para el muestreo.
-
Tome punzones de biopsia del área deseada de tejido.
- Con un punzón de 6 mm, empuje hacia abajo en el área deseada del tejido.
- Gire el punzón tisular en el acto y hacia abajo contra el corcho para asegurar la separación completa y utilice un bisturí afilado para separarse si es necesario.
- Retire el punzón y colóquelo en tubos/moldes según sea necesario expulsando con el émbolo.
- Repita para obtener más muestras de tumores y benignas según sea necesario, con punzones de biopsia estériles separados. Tinta los agujeros donde los golpes fueron tomados en rojo.
- Observe la ubicación de cada punzón junto con el peso de la próstata y cualquier observación sobre el color del tejido/firmeza.
7. Envío de próstata para diagnóstico local
- Anclar la próstata al corcho con agujas estériles de un solo uso antes de la fijación con el fin de prevenir la contracción del tejido y la deformación, que podría alterar la apariencia de los márgenes quirúrgicos.
- Después de fijar al corcho, envíe la próstata al departamento de histopatología para un diagnóstico clínico estándar.
8. Descontaminación del Aparato
- Deseche todo el equipo desechable en flujos de residuos biomédicos y/o recipientes de objetos punzantes según lo designado localmente.
- Descontaminar la campana de flujo laminar y el aparato de corte de próstata de acuerdo con las evaluaciones de riesgo locales apropiadas para el tejido humano (por ejemplo, rociando con 70% EtOH y limpiando).
Resultados
El tejido prostático fresco muestreado utilizando el método PEOPLE se puede utilizar para una variedad de técnicas posteriores, incluyendo la secuenciación genómica y el cultivo ex vivo. Los primeros 59 casos muestreados con este método se han publicado previamente en comparación con una versión anterior del método, junto con los datos iniciales de nivel inferior8. El tiempo desde el primer corte de la próstata hasta la congelación/fijación de las biopsias de punzonado aquí fue de aproximadamente 1 min, que se mantuvo al mínimo para evitar la degradación del ARN. El tiempo desde la extirpación de la próstata hasta el corte de próstata también debe mantenerse al mínimo, aunque aquí esto tomó aproximadamente 20 minutos debido a que nuestros laboratorios de teatro y patología están en diferentes lugares.
Dependiendo de la aplicación aguas abajo, normalmente se toman al menos dos muestras: una de un área de tejido tumoral previsto y otra de un área de tejido benigno previsto. La medida clave del éxito para el propio método de muestreo es evaluar el contenido del tumor en una muestra dada.
Para entrar en el proyecto de 100.000 genomas, un uropatólogo debe evaluar una sección de tejido teñido de H&E, y la muestra debe contener al menos un 40% de células tumorales. Las muestras que contienen menos del 40% de tumor todavía pueden incluirse en el proyecto si se macrodiseccionan con éxito. De los primeros 92 casos muestreados de esta manera, el 64% contenía al menos un 40% de tumor y se sometieron al Proyecto de 100.000 Genomas sin macrodisección. Se extrajo ADN y fue de rendimiento y calidad suficientes en todos los casos(Tabla 1). Un subconjunto inicial de 59 de estos ejemplos se publicó previamente en comparación con un método anterior8.
Para el cultivo ex vivo, el tumor emparejado y el tejido benigno deben ser de calidad suficiente para soportar cultivos de 72 h sin degradación significativa. Múltiples muestras de tejido de un total de tres pacientes fueron cultivadas con éxito8.
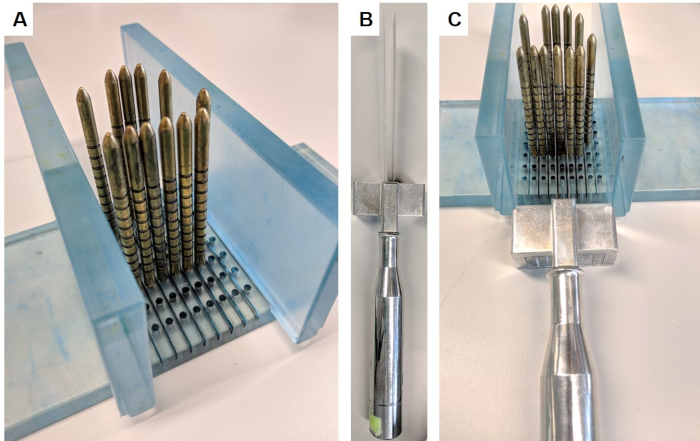
Figura 1: Aparato de corte de próstata. Este aparato se obtuvo en virtud del acuerdo de transferencia de material del Instituto de Investigación del Cáncer. (A) Las paredes se insertan perpendiculares a la base, y los pasadores de oro se insertan en la base que rodea la próstata (prostático no en la imagen). (B) Las cuchillas paralelas reemplazables se insertan en el mango de la cuchilla. (C) Las cuchillas pasan entre los pines dorados para cortar una sección de 5 mm de la próstata. Haga clic aquí para ver una versión más grande de esta figura.
| n (%) | |
| Hit (>40% tumor) | 59 (64%) |
| Golpe parcial (5-30% tumor) | 6 (7%) |
| Señorita (0% tumor) | 27 (29%) |
| Total | 92 (100%) |
Tabla 1: Tasa de impacto del tumor. La tasa de aciertos tumorales fue determinada por un patólogo consultor especializado en cáncer de próstata, después de la revisión del tejido teñido de H&E. Se determinó que el contenido de células tumorales de >40% era adecuado para su inclusión en el Proyecto de 100.000 Genomas, según las directrices de Genomics England.
Discusión
Los pasos críticos dentro de este protocolo incluyen la identificación de la región tumoral para el muestreo, la medición de la próstata y el muestreo de tejido. En primer lugar, la medición de la RMN para identificar el área correcta del muestreo es clave. Demostramos este método en el video que lo acompaña; sin embargo, también recomendamos confirmar las mediciones con un radiólogo en primera instancia. Notas clínicas claras que apuntan al investigador hacia el área de las imágenes de RMN que contiene la lesión de índice son ideales. En segundo lugar, la medición de la próstata debe llevarse a cabo con cuidado, asegurando que la regla se mantiene en un ángulo para medir la longitud completa de la base al ápice, paralela a la anterior de la próstata. En tercer lugar, las áreas tumorales deben confirmarse antes del muestreo inspeccionando visualmente la rebanada de tejido en relación con la imagen original de la RMN, palpando el tejido (en algunos casos el área del tumor puede sentirse más densa) y evaluando visualmente el color del tejido (en algunos casos en que el tumor aparecerá más pálido que el tejido benigno circundante).
Este protocolo ha sido llevado a cabo en su totalidad en UCL/UCLH por investigadores postdoctorales no clínicos, un becario de patología, consultores de patología y técnicos de investigación. En nuestra experiencia, todos los pasos del protocolo se pueden aprender en menos de diez casos, independientemente de sus antecedentes técnicos. Sin embargo, recomendamos la capacitación de un radiólogo con respecto a la medición de la RMN y la capacitación de un patólogo con respecto al corte en primera instancia. El protocolo se puede modificar utilizando un controlador de corte impreso en 3D, como se publicó anteriormente10.
Las posibles limitaciones de la técnica incluyen el riesgo de impedir el diagnóstico. Cortar la próstata es un paso clave, lo que podría impedir la calificación o las tasas de margen positivo si se hace incorrectamente. Hay dos problemas potenciales aquí. En primer lugar, si toda la lesión de índice se elimina y se utiliza para la experimentación de tejido fresco inmediatamente, no se llevarán a cabo diagnósticos clínicos de rutina para esta lesión y el paciente puede ser diagnosticado erróneamente como que tiene un cáncer de grado inferior. Para evitar esto, el investigador debe discutir el plan de muestreo con el patólogo consultor que revisará rutinariamente el caso, antes del muestreo, y acordará el número y la ubicación de las muestras que se tomarán. Los tumores pequeños pueden excluirse localmente por esta razón. En segundo lugar, si la cápsula prostática no se fija correctamente a la tabla de corcho antes de la fijación, esto podría permitir que el tejido interno se abulte hacia afuera durante la fijación, alterando los márgenes quirúrgicos. Esto podría conducir a un margen falso positivo, donde el tumor restante parece residir en la cápsula debido exclusivamente a la deformación del tejido.
La importancia de esta técnica con respecto a los métodos existentes radica principalmente en la segmentación de tumores. Una serie de métodos para el muestreo de muestras de prostatectomía radical se ha publicado hasta la fecha; sin embargo, todos ellos se basan en un enfoque de muestreo total o parcialmente aleatorio1,2,3,4,5,6,7. El uso de biopsia y, en particular, datos de RMN aquí ha mejorado la eficiencia, lo que permite reducir el muestreo con mayor confianza en la obtención de tejido tumoral8.
Las aplicaciones futuras de este método permiten la adopción de una gama más amplia de técnicas posteriores que con los métodos de muestreo anteriores. Por ejemplo, la disponibilidad de tejido fresco que tiene una alta probabilidad de ser tumor significa que se pueden utilizar técnicas de tejido fresco más costosas y/o intensivas en mano de obra, ya que no se requieren muchas muestras para garantizar la presencia de tumor. Esto puede incluir y no se limita a, cultivo ex vivo, resonancia magnética ex vivo, imágenes avanzadas y transcriptomica.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean reconocer a Prostate Cancer UK por financiar SH en el marco del Centro de Excelencia y Premio de Viaje para el Cáncer de Próstata (TLD-PF16-004) y HP bajo INNOVATE (PG14-018-TR2). Este trabajo fue apoyado por investigadores del National Institute for Health Research University College London Hospitals Biomedical Research Centre.
Materiales
| Name | Company | Catalog Number | Comments |
| 6 mm biopsy punch | Fisher Scientific | 13404607 | Disposable biopsy punches for removing 6 mm tissue samples |
| Black Ink | Leica Biosystems | 3801753 | Tissue marking & margin dye |
| Blue Ink | Leica Biosystems | 3801751 | Tissue marking & margin dye |
| Chainmail hand glove | Arco | 1456803 | Chainmail gloves to protect hand during slicing |
| Cork board | Fisher Scientific | 12396447 | Cork board for pinning prostate to following sampling procedure |
| Needles | SLS (Scientific Laboratory supplies) | SYR6112 | Sterile needles to use to pin tissue to cork board following sampling |
| Prostate slicing aparatus | Insitute of Cancer Research, London | NA - must be obtained under MTA | A kit containing the slicer handle, blades, spacer, base, walls and pins |
Referencias
- Sooriakumaran, P., Henderson, A., Denham, P., Langley, S. E. A novel method of obtaining prostate tissue for gene expression profiling. International Journal of Surgical Pathology. 17 (3), 238-243 (2009).
- Jhavar, S. G., et al. Processing of radical prostatectomy specimens for correlation of data from histopathological, molecular biological, and radiological studies: a new whole organ technique. Journal of Clinical Pathology. 58 (5), 504-508 (2005).
- Wheeler, T. M., Lebovitz, R. M. Fresh tissue harvest for research from prostatectomy specimens. The Prostate. 25 (5), 274-279 (1994).
- Esgueva, R., et al. Next-generation prostate cancer biobanking: toward a processing protocol amenable for the International Cancer Genome Consortium. Diagnostic Molecular Pathology. 21 (2), 61-68 (2012).
- Dev, H., et al. Biobanking after robotic-assisted radical prostatectomy: a quality assessment of providing prostate tissue for RNA studies. Journal of Translational Medicine. 9, 121(2011).
- Tolkach, Y., et al. Blind Biobanking of the Prostatectomy Specimen: Critical Evaluation of the Existing Techniques and Development of the New 4-Level Tissue Extraction Model With High Sampling Efficacy. The Prostate. 77 (4), 396-405 (2017).
- Warren, A. Y., et al. Method for sampling tissue for research which preserves pathological data in radical prostatectomy. The Prostate. 73 (2), 194-202 (2013).
- Heavey, S., et al. PatiEnt prOstate samPLes for rEsearch, a tissue collection pathway utilizing magnetic resonance imaging data to target tumor and benign tissue in fresh radical prostatectomy specimens. The Prostate. 79 (7), 768-777 (2019).
- Bailey, C., et al. VERDICT MRI validation in fresh and fixed prostate specimens using patient-specific moulds for histological and MR alignment. NMR in Biomedicine. 32 (5), 4073(2019).
- Bourne, R. M., et al. Apparatus for Histological Validation of In Vivo and Ex Vivo Magnetic Resonance Imaging of the Human Prostate. Frontiers in Oncology. 7, 47(2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados