Method Article
Un sistema implantable para la electromiografía crónica in vivo
En este artículo
Resumen
Aquí se presenta un protocolo para la fabricación de un sistema implantable para la grabación cronológica in vivo de potenciales electromiográficos evocados y espontáneos. El sistema se aplica a la investigación de la reinnervación de los músculos laríngeos después de la lesión nerviosa.
Resumen
La electromiografía (EMG) mide la respuesta muscular a la estimulación eléctrica o actividad espontánea de las unidades motoras y desempeña un papel importante en la evaluación de la función neuromuscular. El registro crónico de la actividad de EMG que refleja el estado de reinnervación de un músculo después de la lesión nerviosa ha sido limitado, debido a la naturaleza invasiva de las técnicas tradicionales de grabación de EMG. En este sentido, un sistema implantable está diseñado para la grabación de EMG in vivo a largo plazo y la estimulación nerviosa. Se ha aplicado y probado en un estudio sobre la reinnervación de los músculos laríngeos. Este sistema consta de 1) dos manguitos nerviosos de electrodo bipolar y cables para estimular cada uno de los dos nervios: el nervio laríngeo recurrente (RLN) y la rama interna del nervio laríngeo superior (SLN); 2) dos electrodos de registro EMG y cables para cada uno de los dos músculos laríngeos: músculo cricoarytenoid posterior (PCA) y complejo muscular cricoarytenoid lateral tirugitenoide (TA-LCA); y 3) un receptáculo de la piel que interpone todos los terminales de plomo implantados a un preamplificador y estimulador de grabación externo utilizando un cable de conexión. Los cables son de acero inoxidable de tipo 316 recubiertos de teflón y multifilamento. Están enrollados y pueden estirarse durante el movimiento corporal del animal despierto para evitar la rotura del plomo y la migración de electrodos. Este sistema se implanta durante una cirugía aséptica. Después, las grabaciones basales de EMG se realizan antes de que la RLN se transecte en la segunda cirugía para estudiar la reinnervación muscular. A lo largo del estudio, se llevan a cabo múltiples sesiones fisiológicas en el animal anestesiado para obtener actividad EMG evocada y espontánea que refleja el estado de reinnervación de los músculos laríngeos. El sistema es compacto, libre de infección en el transcurso del estudio, y altamente duradero. Este sistema implantable puede proporcionar una plataforma fiable para la investigación en la que se requiere el registro a largo plazo o la estimulación nerviosa en un animal anestesiado o en movimiento libre.
Introducción
El registro EMG es una técnica útil para medir la actividad eléctrica producida por un músculo esquelético cuando se activa mediante la estimulación eléctrica de su nervio o el disparo espontáneo de sus unidades motoras. El seguimiento de las señales EMG se puede utilizar para la evaluación de la transmisión neuromuscular y la biomecánica muscular1. La grabación de EMG también juega un papel importante en la caracterización de la calidad y magnitud de la reinnervación muscular después de la lesión nerviosa2,3,4,5. Sin embargo, múltiples grabaciones eMG durante todo el período de reinnervación no se pueden lograr mediante un enfoque invasivo. Por lo tanto, los dispositivos implantables han sido diseñados y desarrollados para la estimulación y grabación repetidas, crónicas en sistemas neuromusculares6,,7,8,9,10,11,12,13. El objetivo de este documento es describir un protocolo para la fabricación e implantación de un sistema estable para la obtención de datos cronológicos fiables de la laringe.
Este sistema se aplica aquí al estudio de la reinnervación muscular laríngea. Se proporciona una breve descripción general de la laringe para la orientación(Figura 1). Una coordinación precisa entre los componentes sensoriales y motores es esencial para un movimiento muscular adecuado durante la respiración, la voz y la protección de las vías respiratorias. El músculo PCA, ubicado en la laringe posterior, es el único secuestrador del pliegue vocal. Este músculo se activa espontáneamente durante la inspiración para aumentar el área glotal para la inhalación. El complejo TA-LCA es el principal aductor del pliegue vocal. La activación de este complejo muscular junto con otro aductor (es decir, el músculo interarytenoid) medializelis el pliegue para la vibración y la producción de sonido y cerrar el pliegue para la protección de las vías respiratorias durante la deglución.
Además, las fibras de neuronas motoras inervan los músculos del abductor y del aductor en la RLN. Los músculos del abductor y del aductor se pueden distinguir en función de la composición de la unidad motora14,,15. El músculo PCA exhibe un aumento de la cocción durante condiciones hipercapnicas y/o hipoxicas16 debido a la presencia de unidades motoras inspiratorias. Por el contrario, las unidades motoras de cierre glotético reflejo (RGC), que cierran la glotis reflexivamente a través de la activación de receptores sensoriales dentro de la mucosa laríngea, están presentes en el complejo muscular TA-LCA. La rama interna del nervio laríngeo superior (SLN) lleva las fibras aferentes de los receptores sensoriales en la laringe17. Aunque la voz es principalmente una función aductora, tanto las unidades motoras de abductor como las de aductor están involucradas en este comportamiento laríngeo altamente evolucionado.

Figura 1: Anatomía de la laringe. También se muestran los componentes de este sistema implantable. SLN - nervio laríngeo superior; RLN - nervio laríngeo recurrente; PCA - músculo cricoarytnoid posterior; TA-LCA - complejo muscular cricoarytenoide tirugitenoideo-lateral; DBS - estimulación cerebral profunda. Esta figura ha sido reproducida con permiso de Wiley27. Haga clic aquí para ver una versión más grande de esta figura.
Las lesiones en el RLN pueden dar lugar a parálisis del pliegue vocal (VFP), que compromete tanto las funciones de secuestro como de aducción debido a la denervación muscular laríngea14,,18,19. Posteriormente, la regeneración de las fibras nerviosas RLN y la reinnervación de los músculos se produce comúnmente. Sin embargo, la reinnervación es un proceso aleatorio y resulta en una reconexión muscular mal dirigida e inapropiada en la mayoría de los casos. Esto se conoce como sinesquina, en la que la activación espontánea de los antagonistas del abductor y aductor es defectuosa y produce un movimiento ineficaz o incluso paradójico de los pliegues vocales14,,19,,20,,21. Con la sinesquina, la función crítica que se pierde es el secuestro de pliegues vocales, lo que resulta en una ventilación inadecuada. Aunque hay intentos continuos de tratar la sinesquirenal laríngea mediante 1) el bloqueo del cierre glottic con Botox22,,23 o 2) estimulando eléctricamente la abertura glottic con un marcapasos implantable24,25, no hay ninguna intervención clínica que prevenga de forma fiable la sinesisquina26. Sin embargo, hay evidencia de que el acondicionamiento eléctrico del músculo PCA durante la reinnervación a baja frecuencia promueve la reconexión neuromuscular adecuada y minimiza la sinesquina de suceder. Actualmente se están llevando a cabo estudios para dilucidar los mecanismos subyacentes2.
El objetivo de este trabajo es describir un sistema implantable simple y barato para la estimulación nerviosa crónica y la grabación de EMG. Este sistema se puede utilizar para investigar los efectos del acondicionamiento eléctrico de baja frecuencia del músculo PCA en la especificidad de su posterior reinnervación. Las señales EMG obtenidas por este sistema pueden reflejar la calidad y cantidad de la reinnervación muscular laríngea a lo largo del tiempo.
Protocolo
Este estudio ha sido aprobado por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad de Vanderbilt y se llevó a cabo de acuerdo con la Guía para el Cuidado y Uso de Animales de Laboratorio (Institutos Nacionales de Salud, Bethesda, Maryland). Este sistema incluye cinco componentes implantables y un cable externo.
1. Dos manguitos de electrodo de estímulo RLN bipolar, cada uno con un par de cables de plomo enrollados y pasadores de terminal
- Utilice alambre de acero inoxidable tipo 316 recubierto de teflón (con diámetro aislado de 0.0078" o 0.198 mm) para cada cable de plomo del manguito. Corte un alambre de 70 cm de longitud y enrolle en un resorte de 12 cm de largo utilizando un dispositivo de bobinado o adquiera cables enrollados prefabricados. Si es necesario, estire el muelle para aumentar su longitud para cada sitio del implante. Deje los extremos de los cables enrollados rectos a 3 mm y 10 mm de longitud y desasustérelos.
- Soldar un pasador hembra de cobre chapado en oro en el extremo de 3 mm del cable enrollado.
- Para preparar el brazalete, corte un segmento de 5 mm de tubo de silicona (OD a 0,156", ID a 0,094"; o OD a 3,96 mm, ID a 2,39 mm) de un rollo de tubo.
- Para insertar un cable en el tubo, utilice una aguja hipodérmica de 25 G para perforar la pared del tubo a 1,5 mm del extremo y fuera del centro cerca de la pared interior. Rellene el extremo de 10 mm del cable en la punta de la aguja. Retire la aguja para depositar la porción desaislada en el tubo. Doblar hacia atrás el extremo del cable desnudo fuera del tubo y girar sobre el cable en su punto de entrada en el tubo.
NOTA: Utilice un microscopio operativo para realizar estos pasos. Se puede colocar una sonda en el tubo para curvar el cable contra la pared interior. El objetivo es posicionar la porción desnuda del alambre para que los estímulos puedan ser entregados al nervio sin riesgo de daño mecánico al nervio. - Inserte el segundo cable a 1,5 mm del extremo opuesto del tubo utilizando el mismo procedimiento. Alinee el punto de entrada con el del primer cable. Perforar la pared con la aguja para que la porción desnuda del alambre se deposite cerca de la pared interior frente al primer cable.
NOTA: Mirando hacia abajo el tubo, los dos electrodos de estímulo deben formar una forma de 45 "V", que se extiende el nervio una vez en su lugar y asegurar la entrega de corriente a través del nervio desde el ánodo hasta el cátodo. - Haga una hendidura en forma de S en la pared del tubo frente a los puntos de entrada del electrodo usando un par de tijeras curvas.
NOTA: Los labios espirales del manguito se pueden abrir para situar el nervio dentro entre los electrodos durante la cirugía. - Inserte una longitud de 6-0 monofilamento, sutura no absorbible en la pared del manguito en cada extremo usando una aguja microquirúrgica curvada para una eventual seguridad del manguito alrededor del nervio.
- Aplique gel de silicona tipo A de grado médico para volver a aislar todo el cable desnudo expuesto fuera del manguito.
2. Dos manguitos de electrodo de estímulo SLN bipolar, cada uno con un par de cables de plomo enrollados y pasadores de terminal
- Montar el manguito de electrodo de estímulo SLN de la misma manera que el manguito de electrodo de estímulo RLN. Sin embargo, utilice el tubo de diámetro más pequeño (OD a 0,125", ID a 0,062"; o OD a 3,18 mm, ID a 1,57 mm), porque el nervio es más pequeño en diámetro.
3. Dos electrodos de grabación EMG muscular PCA, cada uno con cable de plomo enrollado y pasador de terminal
- Montar un cable enrollado para el electrodo muscular PCA como se hace en el paso 1.1.
- Soldar un pasador hembra en el cable como se hace en el paso 1.2.
- Inserte el extremo de 10 mm del cable muscular PCA en la punta de un electrodo de estimulación cerebral profunda (DBS) utilizando la misma estrategia para la inserción de aguja-plomo en un manguito (paso 1.4). Doblar el extremo del cable para formar un gancho y clip para proporcionar un total de 5 mm de longitud de grabación.
NOTA: En esta aplicación, el músculo PCA y sus terminales nerviosos reinnervating están expuestos al acondicionamiento eléctrico. Los estímulos son generados por un generador de pulsos implantable (IPG) y entregados al músculo laríngeo a través de un electrodo DBS(Figura 1,inserción). Este sistema está adaptado de la estimulación cerebral terapéutica (por ejemplo, la enfermedad de Parkinson). El electrodo DBS se insertará en un bolsillo submuscular y se anclará en su lugar. Si no se requiere tecnología para el acondicionamiento eléctrico del músculo, el electrodo PCA EMG puede insertarse directamente en el músculo y anclarse por su gancho.
4. Dos electrodos de grabación EMG del complejo muscular TA-LCA, cada uno con alambre de plomo enrollado y pasador de terminal
- Montar un cable enrollado para el electrodo muscular TA-LCA como se hace en el paso 1.1.
- Soldar un pasador hembra en el cable como se hace en el paso 1.2.
- Exijo una pieza rectangular de 5 mm x 10 mm de injerto de poliéster de punto. Haga un agujero en el centro de la malla con una aguja hipodérmica de 20 G. Introducir el extremo de 10 mm del cable en el agujero con un adicional de 3 mm de bobina que sobresale más allá del agujero. Fije el plomo a la malla usando monofilamento 6-0, sutura no absorbible.
NOTA: Esta pieza de malla se utilizará para anclar el electrodo de plomo al cartílago tiroideo que cubre el complejo muscular. - Doblar el extremo del cable para formar un gancho y clip para proporcionar un total de 5 mm de longitud de grabación.
5. Receptáculo de la piel para conexiones de interconexión entre electrodos y equipos externos
- Utilice un conector de rayas de pasador hembra de una sola fila para hacer el receptáculo. Corte dos piezas (cada una de 17,5 mm de longitud) de la tira, cada una con ocho agujeros de pasador. Primero, rugo las superficies externas de cada pieza con papel de lija, luego pégalas junto con el fenol en una campana de humo para hacer un conector de doble fila. Coloque el conector en agua de 60-80 oC en una campana de humodurante durante 30 minutos para permitir el endurecimiento del pegamento.
NOTA: Este formato de ensamblaje de doble fila proporcionará comodidad en la asignación de agujeros para electrodos del lado izquierdo frente a la derecha. - Corte una pieza de 25,6 mm de longitud de la tira para hacer la placa frontal del conector (la porción que sobresaldrá fuera del sitio del implante para el anclaje de la piel). Corte un orificio rectangular de 5,4 mm x 17,4 mm en el centro de la placa frontal con un bisturí.
- Coloque el conector de doble fila dentro del orificio rectangular de la placa frontal hasta que se enjuague con la superficie de la placa frontal sin protuberancia. Si el conector no cabe en el orificio rectangular de la placa frontal, el taladro se puede ampliar ligeramente con un archivo. Dado que los orificios del conector no son simétricos, inserte la arista del conector con los taladros de mayor diámetro en la placa frontal.
NOTA: Como resultado, un pasador hembra insertado en el borde opuesto del conector con el agujero de diámetro más pequeño se ajustará y se bloqueará en su lugar. - Utilice fenol para pegar el conector y la placa frontal. Coloque el conjunto en agua de 60-80 oC en una campana de humodurante durante 30 minutos para permitir el endurecimiento del pegamento.
- Taladre un agujero de 1,3 mm en cada esquina de la placa frontal y a cada lado de la placa frontal a mitad de camino de los extremos para un total de seis agujeros.
NOTA: Estos orificios se utilizarán para suturar el receptáculo final de la piel en el sitio del implante. - Corte un tubo de 15 mm de longitud de injerto de poliéster de punto para rodear el conjunto debajo de la placa frontal, haciendo el conjunto biocompatible. Para fijar el tubo al conjunto, utilice una aguja hipodérmica para enhebrar cables de acero inoxidable a través de la pared en tres posiciones igualmente espaciadas (cada una de 3,8 mm de separación) a lo largo de su longitud.
- Coloque muescas igualmente espaciadas en cada esquina del conector para anclar los cables contra la superficie del ensamblaje. Gire los extremos de cada alambre con un par de alicates para apretar el tubo al conjunto para formar una falda.
- Haga una marca permanente en el parche de poliéster en un extremo del receptáculo.
NOTA: Utilice esta marca para la orientación para identificar el extremo rostral del receptáculo durante la cirugía del implante. En la dirección rostral a caudal, la siguiente asignación de electrodo de pasador para cada una de las dos filas (lado izquierdo y derecho) debe ser la siguiente: PCA EMG, TA-LCA EMG, agujero vacío, agujero vacío, ánodo RLN, cátodo RLN, ánodo SLN y cátodo SLN.
6. Cable de conexión externo a preamplificador de grabación y estimulador
NOTA: Se utiliza un cable para realizar conexiones entre el receptáculo de la piel implantado y el equipo externo durante las sesiones de grabación de estimulación nerviosa-EMG (secciones 8 y 10). Se compone de 12 cables aislados que terminan con pasadores masculinos para insertar en pasadores femeninos en el receptáculo de la piel. Este cable consta de dos partes: un tapón de grabación EMG y cables de estimulación nerviosa. Un enchufe de grabación es necesario para aislar las señales EMG de baja tensión de artefactos de estímulo de mayor voltaje que irradian de pines de estímulo. Por la misma razón, dos agujeros en cada fila del receptáculo de la piel se dejan desocupados para separar los pines de grabación de los pines de estimulación.
- Para hacer el conector de grabación EMG, utilice un conector de tira macho (misma longitud y anchura, pero la mitad de la altura de un conector hembra). Cortar en dos pedazos, cada uno con teniendo sólo dos agujeros. Fije las dos piezas usando adhesivo fenol usando el mismo enfoque para hacer el conector de doble fila en el receptáculo de la piel (paso 5.1). Tome los cuatro cables de grabación EMG en el cable e inserte sus pasadores macho terminales en cada uno de los cuatro orificios hasta que se bloqueen en su lugar con las puntas que sobresalen más allá del borde de la tira.
- Utilice cemento óseo para sellar la parte superior del enchufe para aislar las uniones de pasador de alambre.
- Utilice los ocho cables restantes en el cable que terminan en pasadores masculinos para hacer conexiones individuales a los manguitos de estimulación nerviosa a través de sus pines femeninos.
7. Primera Cirugía de Implante
- Obtener un 1-2 años de edad, 20-25 kg canino de cualquiera de los dos sexos de una granja con licencia. Aclimatar al animal antes de la cirugía de implante aséptico. Autoclave todo el equipo antes de la cirugía. Retener los alimentos durante 10–12 h antes de la cirugía.
- Prepare al animal para la cirugía.
- Aunar la cabeza y el cuello del animal y limpiar la piel con alcohol y solución exfoliante de betadina. Anestetizar al animal mediante inyección intravenosa de 2-4 mg/kg de tetimina y zolazepam combinación, seguido de 3% de isoflurano en oxígeno a través de la intubación.
- Coloque el animal sobre una mesa de operaciones con una almohadilla de calentamiento en posición supina y cubra quirúrgicamente al animal. Monitoree la frecuencia cardíaca, la frecuencia respiratoria, la temperatura corporal y la saturación de oxígeno de los animales al menos cada 15 minutos durante toda la cirugía para garantizar la estabilidad fisiológica en un plano moderado de la anestesia.
- Haga una incisión del cuello de la línea media desde la muesca de la tiroides hasta el manubrio. Diseccionar la tráquea libre del esófago y exponer el borde inferior del cartílago cricoide.
- Coloque el manguito de estímulo en cada uno de los SLN y RLN bilaterales.
- Haga una ventana de cartílago con un punzón de biopsia (4 mm de diámetro) en la superficie anterior del cartílago tiroideo a cada lado. Exponer los aspectos laterales de ambos complejos musculares TA-LCA. Inserte los electrodos de grabación EMG en los complejos musculares TA-LCA utilizando una aguja de 23 G insertando la barba en la punta de la aguja. Sutura el parche de poliéster del electrodo en el cartílago.
- Coloque el electrodo DBS junto con su electrodo de grabación EMG de cable de gancho complementario debajo del músculo PCA en cada lado. Utilice un endoscopio para confirmar que la estimulación produce un secuestro de pliegue vocal para cada canal. Ancle los electrodos DBS al cartílago cricoide por 4-0 suturas no absorbibles.
- Inserte todos los cables de los electrodos de registro de estimulación nerviosa-EMG en el receptáculo a través de sus pines hembra. Presione los pasadores en agujeros con una herramienta de inserción formada a partir de un hemostat. Sellar la superficie inferior del receptáculo para aislar las uniones de pasador de plomo utilizando cemento óseo.
- Después de que el cemento se endurece, coloque el receptáculo en el extremo rostral de la incisión de la línea media a través de la piel y suturarlo a los tejidos subcutáneos a través de su falda de poliéster. Fije el borde de la piel al receptáculo mediante suturas que pasan a través de los agujeros en la placa frontal.
NOTA: Una mandíbula del hemostat tiene una hendidura final que conduce a un agujero de contra-sink. El cable de plomo se puede colocar a través de la ranura en el agujero y el avellanado colocado contra la cabeza del pasador. La segunda mandíbula se coloca en el lado opuesto del receptáculo. Apretar el hemostat presiona el pasador en su respectivo orificio del receptáculo.
- Después de que el cemento se endurece, coloque el receptáculo en el extremo rostral de la incisión de la línea media a través de la piel y suturarlo a los tejidos subcutáneos a través de su falda de poliéster. Fije el borde de la piel al receptáculo mediante suturas que pasan a través de los agujeros en la placa frontal.
- Haga una incisión en el cuello izquierdo para exponer el músculo trapecio. Realizar disección para hacer un bolsillo submuscular para la colocación del generador de pulsos implantable. Túnel de cada cable DBS por vía subcutánea a la incisión del cuello para su inserción en el IPG.
- Cierre todas las heridas quirúrgicas con suturas. Monitoree al animal de cerca hasta la recuperación completa de la cirugía.
- Proporcionar analgésicos postoperatorios (p. ej., buprenorfina: 0,01–0,02 mg/kg) de forma rutinaria durante un máximo de 48 h. Administrar antibióticos (p. ej., cefpodoxime: 10 mg/kg) por vía oral al animal durante al menos 3 días. A partir de entonces, aloquere al animal por separado durante todo el estudio, y restrinja el ejercicio durante un período de 10 días para permitir la cicatrización normal de la herida y la estabilización del dispositivo implantado.
NOTA: El receptáculo cutáneo debe limpiarse diariamente con una solución antiséptica compatible con el tejido. Además, los pasadores macho ficticios deben insertarse en los pines femeninos del receptáculo de la piel de forma rutinaria, excepto durante las sesiones de grabación de EMG. Esta maniobra evitará la acumulación de escombros en el receptáculo, permitirá realizar conexiones efectivas con el cable externo y evitará la infección.
8. Sesiones de grabación de estimulación nerviosa-EMG en línea de base
NOTA: Realice estas sesiones 2x–3x después de la cirugía de implante (sección 7) y antes de la cirugía de transección nerviosa (sección 9) para obtener señales EMG basales cuando los RlN bilaterales estén intactos. Aplique el siguiente protocolo durante una sesión de grabación estándar de estimulación nerviosa-EMG (secciones 8 y 10).
- Retener los alimentos antes del procedimiento de 10-12 h. Anestetizar al animal con combinación de tiletamina y zolazepam (dosis de carga inicial 2-4 mg/kg por inyección intravenosa, luego mantener con 0,4 mg/kg por hora a través de una línea i.v.). Coloque al animal en una almohadilla de calentamiento en posición supina y mantenga al animal en un plano moderado de anestesia. Supervise los signos vitales del animal durante el procedimiento descrito en el paso 7.2.
- Inserte un endoscopio rígido de cero grados con una cámara de vídeo CCD conectada a través de un laringoscopio para visualizar el movimiento del pliegue vocal a nivel de la glotis.
- Interconecte el cable externo que se conecta al estimulador de laboratorio y los preamplificadores EMG al receptáculo de la piel a través de su enchufe y pasadores. Conecte las salidas de los preamplificadores a un dispositivo de adquisición de datos y/o a un osciloscopio para mostrar, grabar y medir señales EMG.
- Entregar estímulos (pulsos de onda cuadrada única, 0,1–0,5 ms de duración, 0,5–2,0 mA de amplitud) a los RLN izquierdo y derecho, respectivamente, para registrar las respuestas EMG evocadas de complejos bilaterales TA-LCA y músculos PCA bajo cada condición.
- Entregar estímulos (pulsos de onda cuadrada única, 0,1–0,5 ms de duración, 0,5–2,0 mA de amplitud) a los SLN izquierdo y derecho, respectivamente, para registrar las respuestas EMG evocadas de complejos bilaterales TA-LCA y músculos PCA bajo cada condición.
- Entregar CO2 mezclado con aire de la habitación a través de la boca del animal para inducir hipercapnia y aumentar el esfuerzo respiratorio del animal. Limite la exposición a 1 min, durante el cual se producirá el reclutamiento máximo de unidades motoras inspiratorias. Registrar las actividades espontáneas de EMG de complejos TA-LCA y músculos PCA bajo esta condición hipercapnica.
- Monitoree al animal hasta que se recupere por completo de la anestesia y devuelva al animal a la instalación.
9. Segunda cirugía para la transección nerviosa y la anastomosis
- Realice la segunda cirugía 10-14 días después de la primera cirugía. Retener los alimentos durante 10-12 h antes de la cirugía.
- Anestetizar el animal, cubrir y monitorear los signos vitales intraoperatoriamente utilizando la técnica descrita en el paso 7.2.
- Retire las suturas y vuelva a abrir la incisión de la línea media por disección contundente siempre que sea posible. Evite daños en la implantación previa durante la disección. Exponer los RLN bilaterales a través de la disección. Aísle, transecte y anastomosa cada nervio con 7-0 monofilamento, suturas no absorbibles para inducir parálisis laríngea bilateral.
- Irrigar la incisión del cuello con solución salina estéril y antibiótico de gentamicina. Cierre los tejidos musculares y subcutáneos usando 3-0 suturas absorbibles. Cierre la piel con 3-0 suturas monofilamento no absorbibles.
- Monitoree de cerca al animal hasta que se recupere completamente de la cirugía.
- Proporcionar analgésicos (p. ej., buprenorfina: 0,01–0,02 mg/kg) de forma rutinaria durante un máximo de 48 horas postoperatoria. Dar antibióticos (p. ej., cefpodoxime: 10 mg/kg) por vía oral al animal durante al menos 3 días. Restringir el ejercicio del animal durante un período de 10 días para permitir la cicatrización normal de la herida.
10. Sesiones de grabación de estimulación nerviosa-EMG después de lesiones bilaterales de RLN
- Realizar estas sesiones 1 veces por semana durante los primeros 3 meses, luego quincenalmente a partir de entonces. Siga el protocolo descrito en la sección 8 para estas sesiones.
Resultados
En la Figura 2se muestran ejemplos de los componentes. De izquierda a derecha en la Figura 2A son el manguito de estímulo nervioso, electrodo de grabación TA-LCA, electrodo de grabación PCA y receptáculo de interfaz de piel, respectivamente. Se puede apreciar el tamaño relativo de estos componentes. El receptáculo de la piel(Figura 2B)tiene dos filas de orificios en las que se insertan los pasadores hembras al final de cada cable enrollado(Figura 2D). Se insertan frente a la placa frontal (flecha) durante la cirugía de implantación. El receptáculo tiene una falda de poliéster(Figura 2C)unida a sus paredes laterales del conector. Esta falda está diseñada para anclar el receptáculo en posición por infiltración de tejido conectivo. Cada cable EMG de acero inoxidable recubierto de teflón(Figura 2E)se desconecta (5 mm) en la punta para formar un electrodo en forma de gancho para la grabación muscular. El manguito de estimulación tiene dos electrodos roscados contra la pared interior del manguito. Se separan por una distancia de 2 mm(Figura 2F)y forman una forma "V"(Figura 2G)para asegurar la entrega de corriente a través del nervio.

Figura 2: Componentes del sistema de implantes. (A) De izquierda a derecha es el manguito de estímulo nervioso, electrodo de grabación TA-LCA, electrodo de grabación PCA y receptáculo de interfaz de la piel, respectivamente. (B) El receptáculo de la piel que muestra dos filas de agujeros. (C) El receptáculo que muestra una falda de poliéster unida a las paredes laterales del conector. (D) El cable enrollado que contiene pasadores hembra que se insertarán en B. (E) El cable EMG de acero inoxidable recubierto de teflón se desconecta (5 mm) en la punta para formar un electrodo en forma de gancho para la grabación muscular. (F) El manguito de estimulación tiene dos electrodos roscados contra la pared interior del manguito, que están separados por 2 mm. (G) Formación de forma "V" de electrodos para asegurar el suministro de corriente a través del nervio. Esta cifra se ha modificado con el permiso27. Haga clic aquí para ver una versión más grande de esta figura.
La Figura 3 muestra el receptáculo de la piel implantado y cómo el cable del equipo externo se interconecta con los recipientes. Cabe señalar que los pasadores macho ficticios (no mostrados) se insertan en los pines femeninos del receptáculo para mantenerlos libres de escombros entre las sesiones de grabación.
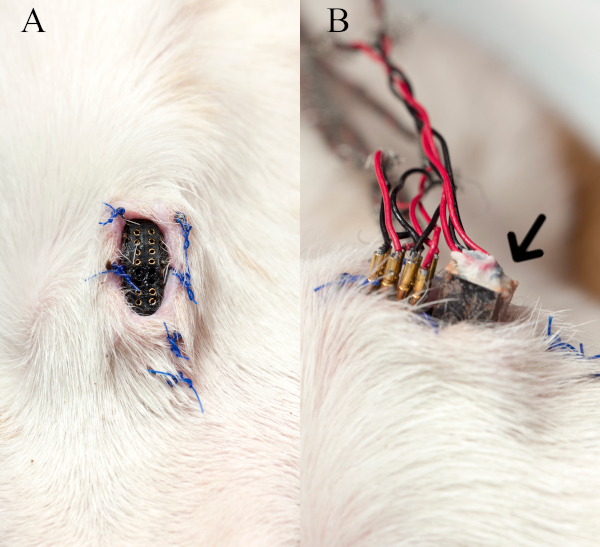
Figura 3: Receptáculode la piel y cable de interfaz. (A) Se muestra el receptáculo de piel implantado en el cuello anterior sin pasadores macho ficticios. (B) La imagen muestra cómo los pines de estímulo y el enchufe de grabación EMG (flecha) del cable del equipo externo se interconectan con el receptáculo durante una sesión de grabación de estimulación nerviosa-EMG. Esta cifra se ha modificado con el permiso27. Haga clic aquí para ver una versión más grande de esta figura.
La Figura 4 muestra una grabación EMG de una de las sesiones de línea de base con los RLN intactos.
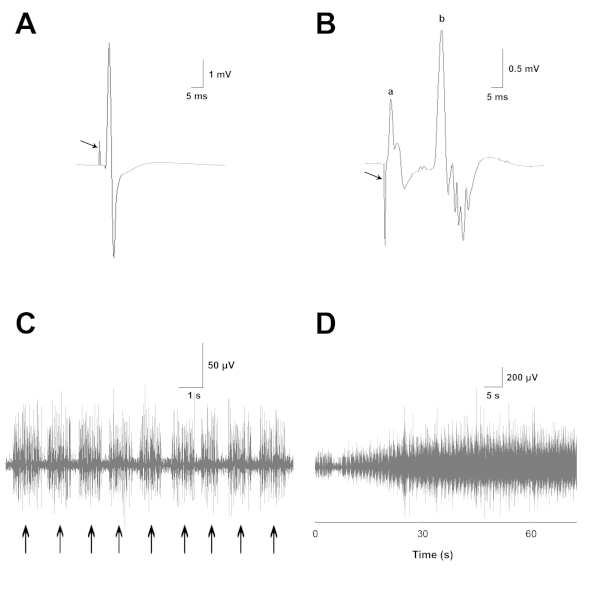
Figura 4: Grabaciones de EMG de músculos laríngeos con inervación normal. (A) Ejemplo de registro desde el músculo PCA donde la estimulación RLN produce un artefacto de estímulo (flecha) seguido de un gran potencial evocado EMG. (B) Ejemplo de registro del complejo muscular TA-LCA, en el que la estimulación SLN produce un artefacto de estímulo (flecha). Representado aquí es(a ) una respuesta muscular monosináptica de latencia corta y (b) una respuesta De RGC polisináptica de latencia más larga. (C) Ráfagas (flechas) de actividad EMG espontánea registradas desde el músculo PCA durante las inspiraciones normales. (D) Aumento de la actividad inspiratoria de EMG en el transcurso de la entrega deCO2. Esta cifra se ha modificado con el permiso27. Haga clic aquí para ver una versión más grande de esta figura.
En una grabación del músculo PCA(Figura 4A),la estimulación RLN produce un artefacto de estímulo (flecha) seguido de un gran potencial evocado de EMG. Las respuestas máximas evocadas por RLN proporcionan un buen índice de la magnitud general de la inervación normal, así como el nivel de reinnervación después de la neurorrhafia posterior, independientemente del tipo de unidad motora. Esto es cierto porque el RLN contiene fibras nerviosas de unidades motoras de cierre glotético inspiratorio y reflejo (RGC). La estimulación RLN recluta ambos tipos de unidades. La actividad de la unidad motora EMG evocada se rectifica e integra durante un período de tiempo de 20 ms para obtener una medida cuantitativa de la inervación muscular.
En una grabación del complejo muscular TA-LCA(Figura 4B),la estimulación SLN produce un artefacto de estímulo (flecha). Este artefacto es seguido por una respuesta muscular monosináptica de latencia corta (a) y una respuesta RGC polisináptica de mayor latencia (b). El potencial (a) es una respuesta directa del músculo cricotiroideo, porque este músculo es inervado por la rama externa cercana del SLN. La activación de esta rama ocurre comúnmente durante la estimulación del manguito nervioso de la rama interna para activar la respuesta RGC. El potencial cricotiroideo es registrado por el electrodo TA-LCA, ya que este músculo se encuentra cerca del complejo. Estudios anteriores han demostrado que el potencial cricotiroideo evocado por la estimulación interna de la rama puede ser abolido selectivamente mediante la sección de la rama externa del SLN (Zealear, observaciones inéditas). Las respuestas EMG máximas evocadas por SLN reflejan la magnitud de la inervación natural del complejo TA-LCA a través de su vía motorsensorial RGC. Antes de la neurorráfia RLN, no hay inervación RGC del músculo PCA, por lo que no se debe detectar ningún potencial de SLN desde este músculo. Después de la transección y reparación nerviosa, los potenciales evocados por SLN reflejan la cantidad de reinnervación RGC correcta del complejo TA-LCA y la reinnervación incorrecta de RGC del músculo PCA. La actividad RGC se cuantifica mediante la rectificación y la integración durante un período de tiempo de 20 ms para capturar toda la forma de onda RGC.
En(Figura 4C),las ráfagas (flechas) de la actividad espontánea de EMG se registran desde el músculo PCA durante las inspiraciones normales. Esta actividad inspiratoria de EMG aumenta en el transcurso de la entrega deCO2, como se muestra en (Figura 4D) a una velocidad de barrido más lenta. La actividad espontánea de PCA EMG proporciona una buena estimación de la magnitud de la inervación normal de este músculo por sus motoneuronas inspiratorias originales. No hay inervación inspiratoria del complejo TA-LCA, por lo que no se deben detectar potenciales inspiratorios de estos músculos. Esto se debe a que sólo las unidades motoras inspiratorias están involucradas en el secuestro del pliegue vocal en el máximo esfuerzo inspiratorio en el animal anestesiado. Después de la transsección nerviosa y la reparación, los potenciales inspiratorios espontáneos reflejan la magnitud de la correcta reinnervación del músculo PCA y la magnitud de la reinnervación incorrecta del complejo TA-LCA. Las grabaciones de la actividad inspiratoria de EMG se amplifican, rectifican e integran durante un período de tiempo de 8 s.
Discusión
Este artículo describe los pasos necesarios en la fabricación de un sistema novedoso, económico e implantable para la estimulación de los nervios laríngeos y el registro de las respuestas EMG de los músculos laríngeos a largo plazo. El protocolo no es complicado y puede producir un implante que es lo suficientemente compacto como para ser utilizado en un animal tan pequeño como una rata. Hay varios pasos críticos que deben enfatizarse. En primer lugar, los cables de plomo deben enrollarse cuidadosamente y uniformemente para evitar el desaislamiento, la torcedura o la rotura del plomo. Si una máquina de bobinado no está disponible, los cables enrollados prefabricados se pueden obtener comercialmente. En segundo lugar, la estrategia de insertar cables de plomo en un tubo de silicona para formar una "V" que se extiende por el nervio es fundamental para promover la entrega actual a través del nervio dentro del manguito. Si ambos cables se colocan en el mismo lado del tubo, puede producirse una derivación de corriente entre electrodos. También es importante que los cables se coloquen contra la pared interna del tubo para evitar la posibilidad de lesiones en rodajas en el nervio.
En tercer lugar, durante la cirugía de implantación, los nervios laríngeos deben diseccionarse cuidadosamente para prevenir daños. En la etapa posterior de la implantación, al insertar pasadores en el receptáculo, se debe aplicar fuerza al pasador en alineación con su orificio para evitar la flexión repentina de la cabeza del pasador. Posteriormente, el cemento óseo debe distribuirse a fondo en la parte inferior del receptáculo para un aislamiento completo y la prevención de la interferencia entre canales. Por último, la prevención de la infección es fundamental para garantizar la integridad del sistema de implantes a lo largo del tiempo. Se puede lograr mediante una combinación de varias maniobras: adición de una falda al receptáculo, administración de antibióticos, limpieza diaria de la herida y receptáculo con solución antiséptica compatible con el tejido, y colocación de pasadores macho ficticios en los pasadores femeninos del receptáculo para mantenerlos limpios de escombros entre sesiones.
El protocolo ha demostrado ser exitoso en este modelo laríngeo para perros. Sin embargo, algunas modificaciones o estrategias alternativas pueden ser consideradas para otras aplicaciones. Por ejemplo, las puntas de sensación desaisladas de los electrodos PCA y TA-LCA EMG están ancladas en los músculos por un medio externo, ya sea el injerto de poliéster o el electrodo DBS. En una aplicación en la que el anclaje externo no es necesario o realizado, la barba del electrodo por sí sola puede servir como el ancla. En tal caso, el alambre monofilamento recubierto de teflón, de acero inoxidable, puede ser preferible al alambre multifilamento en vista de su mayor resistencia a la tracción, proporcionando una barba que es más estable en el tejido. Sin embargo, cabe señalar que los cables multifilamento pueden ser menos propensos a la rotura. Una estrategia alternativa a la fabricación y montaje del receptáculo de la piel es la impresión 3D utilizando polímeros biocompatibles (por ejemplo, MED610 de Stratasys). Esto puede simplificar el proceso de fabricación.
Después de la cirugía de implantación y la recuperación del animal, las sesiones fisiológicas se llevan a cabo con los RLNs intactos para obtener datos de referencia. Durante una sesión, la ausencia de señales EMG de un músculo laríngeo puede ocurrir después de la estimulación de LAN. Para resolver problemas la causa(Tabla 1),primero se debe determinar si el movimiento del pliegue vocal está presente. Si está presente, esto significa que el nervio se activa eficazmente por el manguito, pero hay un problema con el plomo EMG. En esta situación, los usuarios deben mirar más a fondo el artefacto de estímulo EMG. Si el artefacto EMG está ausente, es probable que haya una discontinuidad en la entrada EMG al preamplificador. El ruido de sesenta ciclos también estará presente y grande en amplitud. Si el artefacto es grande, la derivación de un pin de estímulo al pin de grabación puede ser responsable de saturar el preamplificador de canal y destruir la respuesta EMG. Si el artefacto es normal, entonces el plomo EMG probablemente se ha dislocado del músculo y no puede detectar su actividad. Por otro lado, si el movimiento del pliegue vocal está ausente, entonces el nervio no se está activando. Si el artefacto está ausente, puede haber una discontinuidad en el circuito de estimulación, evitando la activación nerviosa. Si el artefacto parece normal, el nervio puede haberse lesionado durante la cirugía del implante o el manguito puede haber migrado del nervio. Una estrategia similar se puede aplicar para resolver problemas la causa de las señales EMG ausentes durante la estimulación SLN.
| Nervio estimulado | Músculo(s) objetivo(es) | Movimiento del pliegue vocal ipsilateral | Artefacto de estímulo | Causas |
| RLN | PCA y/o TA-LCA | Sí | Ausente (ruido de 60 ciclos presente) | Discontinuidad en la entrada EMG al preamplificador (por ejemplo, cable, pasador, cable); |
| Grande | Conversación cruzada entre el estímulo y los pines de grabación en el receptáculo | |||
| Normal | Dislocación del electrodo EMG | |||
| No | Ausente | Discontinuidad en el circuito de estimulación | ||
| Normal | 1. Lesión de RLN; 2. Dislocación del manguito | |||
| Sln | TA-LCA | Sí | Ausente (ruido de 60 ciclos presente) | Discontinuidad en la entrada EMG al preamplificador (por ejemplo, cable, pasador, cable); |
| Grande | Conversación cruzada entre el estímulo y los pines de grabación en el receptáculo | |||
| Normal | Dislocación del electrodo EMG | |||
| No | Ausente | Discontinuidad en el circuito de estimulación | ||
| Normal | 1. Lesión SLN o RLN; 2. Dislocación del manguito |
Tabla 1: Guía de solución de problemas.
Cabe mencionar que hay dos limitaciones menores en la aplicación actual de esta tecnología. En primer lugar, la flexión repentina del pasador femenino durante la inserción en el receptáculo se ha producido en varios casos. Afortunadamente, los pasadores se pueden enderezar e insertar en sus agujeros con éxito. Si el daño del pasador es irreparable, el cable y todo su componente deben ser reemplazados. Por lo tanto, los componentes de respaldo deben estar disponibles antes de la cirugía. En segundo lugar, el tiempo necesario para completar la implantación quirúrgica es largo (10 h). La larga duración refleja parcialmente el gran número de componentes de estimulación y recodificación necesarios para este estudio: cuatro nervios, cuatro músculos, un receptáculo y un IPG. Si se requieren menos componentes utilizando esta tecnología, el tiempo de implantación debe reducirse significativamente (por ejemplo, la lengua de rata modelo28).
Este enfoque tecnológico introduce varias características que tienen ventaja sobre los métodos existentes. El bobinado de cables de plomo es la característica más novedosa e importante de este sistema. Los cables enrollados no están comúnmente disponibles para la experimentación animal no comercial a pesar de los muchos beneficios que proporcionan. Un cable enrollado se puede ampliar a la longitud deseada durante la implantación. Además, se estirará en el animal despierto, en movimiento para evitar la luxación de la punta del electrodo o rotura del cable después de la implantación. Esta característica garantiza la longevidad del implante y la estimulación nerviosa estable y la grabación muscular a largo plazo. Además, la adición de una falda compatible con el tejido alrededor del receptáculo evita la exposición de la herida a este cuerpo extraño y promueve la fibrosis normal y la cicatrización de heridas en ausencia de infección. Estudios previos sin esta falda resultaron en infección temprana y terminación prematura del experimento. Por último, este sistema de implantes es compacto y multicanal, lo que permite la adquisición efectiva de datos de numerosas estructuras neuromusculares en modelos animales de varios tamaños.
Este enfoque técnico ha sido adaptado y traducido con éxito a un modelo de rata. Este estudio fue diseñado para investigar el efecto del acondicionamiento eléctrico en la prevención de la atrofia muscular de la lengua y la disfunción en la rata de envejecimiento. Los nervios hipoglossales fueron implantados con los electrodos del manguito para el acondicionamiento y la lengua implantada con los electrodos de grabación EMG28. Esta tecnología también se puede utilizar en otras aplicaciones de investigación. Como una extensión del protocolo actual en la laringe canina, los efectos del acondicionamiento eléctrico en la promoción de la reinnervación selectiva se están estudiando actualmente en los músculos faciales del conejo. Este estudio puede proporcionar una base para la prevención de la sinesquina facial en pacientes con parálisis de Bell, una condición médica común y debilitante. Un uso potencial final de esta tecnología es estimular y registrar de animales despiertos y en movimiento libre. En la actualidad, dichos datos se han obtenido a través de un cable externo de ratas despiertas y sin restricciones28. En el futuro, este sistema económico también puede combinarse con la tecnología de grabación-estimulación remota (por ejemplo, telemetría) para activar o sondear sistemas neuromusculares de forma inalámbrica.
Divulgaciones
El Dr. David Zealear está comercializando esta tecnología implantable, estimulación nerviosa-EMG para una variedad de sistemas neuromusculares y modelos animales.
Agradecimientos
Los autores agradecen a la Dra. Hongmei Wu su contribución al cuidado de los animales y a la recopilación de datos a lo largo del estudio. Agradecemos a Amy Nunnally, Jamie Adcock y Phil Williams por su ayuda con cirugías estériles. La experiencia y dedicación del personal de vanderbilt University Animal Care Facility fue invaluable. Esta investigación fue apoyada por la subvención de NIH U01DC016033.
Materiales
| Name | Company | Catalog Number | Comments |
| 20 G x 1" Gauge hypodermic needle | BD | 305175 | |
| 23 G x 1" Gauge hypodermic needle | BD | 305145 | |
| 25 G x 1" Gauge hypodermic needle | BD | 305125 | |
| 3-0 absorbable sutures, COATED VICRYL | Ethicon | J219H | |
| 3-0 monofilament, nonabsorbable sutures, Prolene | Ethicon | 8684G | |
| 4-0 monofilament, nonabsorbable sutures, Prolene | Ethicon | 8871H | |
| 6-0 monofilament, nonabsorbable taper needle suture, Prolene | Ethicon | 8805 | |
| 7-0 monofilament, nonabsorbable sutures, Prolene | Ethicon | M8735 | |
| Adhesive silicone solvent-Hexamethydisiloxane 98% | ACROS | code 194790100 | for dilution of modical adhesive silicone |
| Bone cement | Zimmer | 1102-16 | 20g powder 10 mL liquid |
| Buprenorphine (Buprenex, ampules of 1 mLl) | Reckitt Benckiser Healthcare (UK) Ltd | 12496-0757-1 | |
| CCD video camera attached to the endoscope | Sony | MCC500MD | |
| Cefpodoxime (Simplicef 100 mg tablets) | Zoetis | 5228 | |
| Data acquisition device , PowerLab 16/35 | ADInstruments, Inc | 5761-E | |
| Deep-brain stimulation (DBS) electrodes | Abbott | 6172ANS | |
| Digital oscilloscope | Tektronix | DPO71304SX | |
| Implantable pulse generator (IPG), Infinity | Abbott | 6660ANS | |
| Knitted polyester graft | Meadox Medical Inc | 92220 | 20 mm in diameter |
| Medical Grade Polyethylene Micro Tubing | Amazon.com | BB31695-PE/13-10 | OD 0.156", ID 0.094" |
| Metal female pin | Allied Electronics & Automation | 220-S02-100 | |
| Metal male pin | CDM electronics | 220-p02-1 | |
| Prefabricated coiled leads | Medical innovations Inc. | ||
| Silastic Laboratory Tubing | Cole-Parmer | 2415569 | OD 0.125", ID 0.062" |
| Silastic Medical Adhesive Silicone | Dow corning | Type A, 2 oz | |
| Stainless steel monofilament wire | The Harris Products Group | type 316 | 0.008" (coated), 0.005" (bare) |
| Sterile Disposable Biopsy Punch (4 mm) | Sklar Instruments | 96-1146 | |
| Strip connector | CDM electronics | 2.6 x 11.6 x 101.5 mm | single row, round, through hole |
| Teflon-coated multi-filament stainless steel wire | Medwire | Part 316, ss7/44T | |
| Tiletamine and Zolazepam combination, Telazol - 5 mL | Zoetis | 004866 | |
| Tissue-compatible antiseptic solution, Nolvasan - 1 Gallon | Zoetis | 540561 | |
| Zero-degree rigid endoscope | Karl Storz | 8712AA |
Referencias
- Electromyography. Wikipedia, The Free Encyclopedia Available from: https://en.wikipedia.org/wiki/Electromyography (2019)
- Zealear, D. L., et al. Stimulation of denervated muscle promotes selective reinnervation, prevents synkinesis, and restores function. The Laryngoscope. 124 (5), 180-187 (2014).
- Gaweł, M. Electrodiagnostics: MUNE and MUNIX as methods of estimating the number of motor units - biomarkers in lower motor neurone disease. Neurologia i neurochirurgia polska. 53 (4), 251-257 (2019).
- Foerster, G., Mueller, A. H. Laryngeal EMG: Preferential damage of the posterior cricoarytenoid muscle branches especially in iatrogenic recurrent laryngeal nerve lesions. Laryngoscope. 128 (5), 1152-1156 (2018).
- Lin, R. J., Smith, L. J., Munin, M. C., Sridharan, S., Rosen, C. A. Innervation status in chronic vocal fold paralysis and implications for laryngeal reinnervation. Laryngoscope. 128 (7), 1628-1633 (2018).
- Koh, T. J., Leonard, T. R. An implantable electrical interface for in vivo studies of the neuromuscular system. Journal of Neuroscience Methods. 70 (1), 27-32 (1996).
- Grimonprez, A., et al. A Preclinical Study of Laryngeal Motor-Evoked Potentials as a Marker Vagus Nerve Activation. International Journal of Neural Systems. 25 (8), 1550034 (2015).
- Haidar, Y. M., et al. Selective recurrent laryngeal nerve stimulation using a penetrating electrode array in the feline model. The Laryngoscope. 128 (7), 1606-1614 (2018).
- Kneisz, L., Unger, E., Lanmüller, H., Mayr, W. In Vitro Testing of an Implantable Wireless Telemetry System for Long-Term Electromyography Recordings in Large Animals. Artificial Organs. 39 (10), 897-902 (2015).
- Inzelberg, L., Rand, D., Steinberg, S., David-Pur, M., Hanein, Y. A Wearable High-Resolution Facial Electromyography for Long Term Recordings in Freely Behaving Humans. Scientific Reports. 8 (1), (2018).
- Horn, K. M., Pong, M., Batni, S. R., Levy, S. M., Gibson, A. R. Functional specialization within the cat red nucleus. Journal of Neurophysiology. 87 (1), 469-477 (2002).
- Larson, C. R., Kistler, M. K. The relationship of periaqueductal gray neurons to vocalization and laryngeal EMG in the behaving monkey. Experimental Brain Research. 63 (3), 596-606 (1986).
- Zealear, D., Larson, C. A Microelectrode Study of Laryngeal Motoneurons in the Nucleus Ambiguus of the Awake Vocalizing Monkey. Vocal Fold Physiology Volume. 2, 229-238 (1988).
- Zealear, D. L., Billante, C. R. Neurophysiology of vocal fold paralysis. Otolaryngologic Clinics of North America. 37 (1), 1-23 (2004).
- Zealear, D. L., et al. Electrical Stimulation of a Denervated Muscle Promotes Selective Reinnervation by Native Over Foreign Motoneurons. Journal of Neurophysiology. 87 (4), 2195-2199 (2002).
- Insalaco, G., Kuna, S. T., Cibella, F., Villeponteaux, R. D. Thyroarytenoid muscle activity during hypoxia, hypercapnia, and voluntary hyperventilation in humans. Journal of Applied Physiology. 69 (1), 268-273 (1990).
- Ludlow, C. L., Van Pelt, F., Koda, J. Characteristics of Late Responses to Superior Laryngeal Nerve Stimulation in Humans. Annals of Otology, Rhinology & Laryngology. 101 (2), 127-134 (1992).
- Li, Y., et al. Comparison of Ventilation and Voice Outcomes between Unilateral Laryngeal Pacing and Unilateral Cordotomy for the Treatment of Bilateral Vocal Fold Paralysis. ORL. 75 (2), 68-73 (2013).
- Mueller, A. H. Laryngeal pacing for bilateral vocal fold immobility. Current Opinion in Otolaryngology & Head and Neck Surgery. 19 (6), 439-443 (2011).
- Crumley, R. L. Laryngeal Synkinesis Revisited. Annals of Otology, Rhinology & Laryngology. 109 (4), 365-371 (2000).
- Hydman, J., Mattsson, P. Collateral reinnervation by the superior laryngeal nerve after recurrent laryngeal nerve injury. Muscle & Nerve. 38 (4), 1280-1289 (2008).
- Marie, J. P., Navarre, I., Lerosey, Y., Magnier, P., Dehesdin, D., Andrieu Guitrancourt, J. Bilateral laryngeal movement disorder and synkinesia: value of botulism toxin. Apropos of a case. Rev Laryngol Otol Rhinol (Bord). 119 (4), 261-264 (1998).
- Zealear, D. L., Billante, C. R., Sant’anna, G. D., Courey, M. S., Netterville, J. L. Electrically stimulated glottal opening combined with adductor muscle botox blockade restores both ventilation and voice in a patient with bilateral laryngeal paralysis. Annals of Otology, Rhinology and Laryngology. 111 (6), 500-506 (2002).
- Zealear, D. L., et al. Reanimation of the paralyzed human larynx with an implantable electrical stimulation device. Laryngoscope. 113 (7), 1149-1156 (2003).
- Mueller, A. H., et al. Laryngeal pacing via an implantable stimulator for the rehabilitation of subjects suffering from bilateral vocal fold paralysis: A prospective first-in-human study. Laryngoscope. 126 (8), 1810-1816 (2016).
- Li, Y., Garrett, G., Zealear, D. Current Treatment Options for Bilateral Vocal Fold Paralysis: A State-of-the-Art Review. Clinical and Experimental Otorhinolaryngology. 10 (3), 203-212 (2017).
- Li, Y., Huang, S., Zealear, D. An implantable system for In Vivo chronic electromyographic study in the larynx. Muscle & Nerve. 55 (5), 706-714 (2017).
- Connor, N. P., et al. Tongue muscle plasticity following hypoglossal nerve stimulation in aged rats. Muscle & Nerve. 47 (2), 230-240 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados