Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Optimización de procesos mediante microbiorreactores automatizados de alto rendimiento en el cultivo de células de ovario de hámster chino
En este artículo
Resumen
Aquí, presentamos un procedimiento detallado para ejecutar un Diseño de Experimento en un microbiorreactor automatizado seguido de cosecha celular y cuantificación de proteínas usando una columna de Proteína A.
Resumen
La optimización de los bioprocesos para aumentar el rendimiento de los productos deseados es importante en la industria biofarmacéutica. Esto se puede lograr mediante la selección de deformaciones unitarias y mediante el desarrollo de parámetros de bioproceso. Los matraces de agitación se han utilizado para este propósito. Sin embargo, carecen de la capacidad de controlar los parámetros del proceso, como el pH y el oxígeno disuelto (DO). Esta limitación se puede superar con la ayuda de un microbiorreactor automatizado. Estos biorreactores imitan el cultivo a mayor escala. Una de las principales ventajas de este sistema es la integración del Diseño de Experimento (DOE) en el software. Esta integración permite establecer un diseño en el que se pueden variar simultáneamente varios parámetros de proceso. Los parámetros críticos del proceso y las condiciones óptimas del bioproceso se pueden analizar dentro del software. El objetivo del trabajo presentado aquí es introducir al usuario en los pasos involucrados en el diseño de procesos en el software y la incorporación del DOE dentro de la ejecución de cultivo.
Introducción
El mercado biofarmacéutico mundial valía más de 250.000 millones de dólares EE.UU. en 2018 y ha ido en continua expansión1. Las compañías farmacéuticas están pasando de producir pequeños fármacos moleculares a terapias producidas biotecnológicamente, como proteínas recombinantes. Estos son los únicos responsables de un ingreso de más de $150 mil millones1. Las células de mamíferos ahora se utilizan ampliamente para la producción de estas proteínas recombinantes farmacéuticas. En el período actual, entre los 68 productos aprobados producidos por células de mamíferos, 57 son producidos por células de ovario de hámster chino (CHO)2. Las células CHO se utilizan específicamente para la producción de proteínas recombinantes que requieren modificaciones post-traduccionales. Estas células son preferidas ya que crecen en una suspensión y, por lo tanto, permiten resultados reproducibles en un medio libre de suero definido químicamente3,,4. La otra ventaja de utilizar células CHO es que la estructura glicana del producto se asemeja a la del anticuerpo monoclonal humano (mAb) y da como resultado un mayor rendimiento proteico recombinante y una productividad específica debido a la amplificación del gen5.
El rendimiento del cultivo celular CHO recombinante (rCHO) se ha multiplicado por cien en las últimas dos décadas. Esta mejora se atribuye a la optimización de los parámetros del proceso, la estrategia de alimentación y el desarrollo del medio libre de suero definido químicamente6. Con el aumento de los requisitos de los productos farmacéuticos, la presión aumenta en el costo y la eficiencia del tiempo para el desarrollo del proceso de producción7. Para reducir la presión y garantizar la calidad del producto, se ha orientado el enfoque de la industria farmacéutica en la calidad por diseño (QbD). QbD se utiliza para comprender la producción del producto, así como el proceso. Una herramienta vital utilizada en el ObD es el Diseño del Experimento (DOE). Ayuda a aumentar la comprensión del proceso al revelar la relación entre varias variables de entrada y los datos de salida resultantes. La aplicación del enfoque DOE para optimizar el bioproceso es beneficiosa durante las primeras etapas del proyecto al asimilar las condiciones del proceso y aumentar la cantidad y calidad del título. Este enfoque es beneficioso en comparación con la estrategia anticuada: un factor a la vez (OFAT). Los enfoques estadísticos del DOE utilizando Classical, Shainin o Taguchi son muy superiores a los OFAT8.
El proceso y la optimización de medios se pueden realizar en matraces de agitación. Los matraces son relativamente baratos. Sin embargo, no es posible controlar parámetros como la temperatura, el pH y el oxígeno disuelto (DO). Para superar estos inconvenientes, se pueden utilizar biorreactores multiusos de sobremesa que van desde un volumen de trabajo de 0,5 L a 5 L. Los reactores proporcionan una amplia supervisión en línea y control de procesos. Sin embargo, el uso del biorreactor multiusos es intensivo en tiempo y mano de obra. Para superar estas desventajas, se utiliza un novedoso biorreactor de un solo uso que combina el proceso integral de monitorización del biorreactor de sobremesa y fácil manejo del matraz de agitación. El sistema de cribado de alto rendimiento y la tecnología de un solo uso han contribuido a mejorar la eficiencia del rendimiento y desarrollo de los procesos9.
En este artículo, se enumeran las pautas para cargar la receta en el software automatizado de microbiorreactor (AMBR). Durante el transcurso de este experimento se estudia la influencia de diferentes velocidades de agitador y pH en la concentración celular viable (VCC) y el titador. El resultado experimental y el análisis se llevan a cabo con el diseño del software de experimento MODDE 12. Los análisis de productos se llevan a cabo en un sistema de cromatografía líquida de alta presión (HPLC) con una columna de proteína A. Se basa en el principio de que la región Fc del mAb se une a la proteína A con alta afinidad10,,11. Con este método, es posible identificar y cuantificar el mAb. La cuantificación se lleva a cabo en las áreas de pico de elución medida a 280 nm.
Protocolo
1. Procedimiento de precultura
NOTA: Para este protocolo se utilizan células CHO DG44 recombinantes con una concentración celular viable de 1 x 107 células/ml.
- Descongelar el vial que contiene 1,2 ml de células a temperatura ambiente y transferir inmediatamente la suspensión celular a un tubo centrífugo cónico de 15 ml que contenga 10 ml de medio de semilla fría.
- Centrifugar el tubo centrírico cónico durante 5 minutos a 190 x g y temperatura ambiente y desechar el sobrenadante.
- Precalentar 150 ml del medio de semilla en un matraz de batido de 500 ml a 36,8 oC.
- Resuspenda suavemente el pellet celular en 10 ml de medio de semilla precalentado y transfiera las células al matraz de agitación.
- Utilice 1 ml de la muestra del matraz para medir el VCC inicial y la viabilidad utilizando un contador de celdas.
NOTA: La viabilidad debe estar por encima del 70% después de descongelar para un cultivo exitoso. - Incubar el matraz de agitación en un agitador orbital (diámetro del agitador de 19 mm) a 36,8oC y 7,5% deCO2 con una velocidad de agitación de 120 rpm.
NOTA: Estas condiciones varían dependiendo de la tensión celular y el medio. - Tres días después de pasar las células, retire el matraz de agitación de la coctelera y colóquelo debajo del armario de flujo laminar. Tome 1 ml de muestra para medir la concentración celular final. Calcule el volumen que se transferirá al medio de semilla precalentado fresco de forma que la concentración celular inicial en el nuevo pasaje sea de 2 x 105 celdas/ml.
- Paso de las células 5 veces en total antes de transferiralal al biorreactor para el cultivo principal.
2. Cultivo principal
- Mida la concentración celular final de la precultura. Calcule el volumen que se transferirá al biorreactor de forma que la concentración celular inicial en el reactor sea de 3 x 105 células/ml.
- Llenar el reactor con medio de producción un día antes de la inoculación para equilibrar el reactor y establecer los parámetros del proceso como la temperatura, el pH y la DO.
NOTA: Las condiciones de cultivo son 36,8 oC y 60% de concentración de oxígeno disuelto (DO). Probamos velocidades del agitador de 1050 rpm y 1300 rpm junto con pHs de 6.9, 7.1 y 7.3. La duración total del cultivo es de 12 días hasta la cosecha de las células. El proceso por lotes se ejecuta durante 72 horas después de lo cual el medio de alimentación se agrega cada 24 h. El protocolo que se utilizará para el cultivo se enumera en detalle en el siguiente segmento.
3. Escribir la receta en el software automatizado de microbiorreactor
NOTA: Hay dos formas de escribir una receta en el software de referencia cultural de celda SMBR: se crea mediante un asistente o agregando cada paso manualmente. Para el propósito de este protocolo, se muestran los pasos que utilizan el asistente.
- Creación de un nuevo experimento
- Abra el software de referencia cultural de celdaS AMBR y en la pestaña Introducción haga clic en Crear nuevo experimento.
- Cargando la receta
- En la pestaña Nuevo experimento, escriba el nombre del experimento junto con la fecha en la que se va a realizar.
- Active el punto de control de la estación de cultivo y de los buques que se utilizarán durante el cultivo. Las etiquetas Auto Add DOE también se activarán para una transición fácil durante la programación del experimento DOE. Haga clic en Siguiente para cambiar a la siguiente pestaña.
- Establecer información sobre la adición de medios en el recipiente junto con antiespuma, inóculo, alimentación y glucosa.
- Active el punto de comprobación Añadir placa de medios. Defina el tipo de placa, el nombre y la ubicación de la placa que contiene el medio.
ADVERTENCIA: Dependiendo del tipo de placa y si la placa contiene una tapa, active la comprobación Está tapada para garantizar el buen funcionamiento del manipulador de líquidos - Haga clic en Añadir medios a los buques. Introduzca el volumen de los medios que se añadirán a los recipientes. Definir la cartografía de la transferencia del medio de la placa a los buques. Haga clic en Siguiente para cambiar a la siguiente pestaña.
- Active el punto de comprobación Añadir placa de medios. Defina el tipo de placa, el nombre y la ubicación de la placa que contiene el medio.
- Establezca las condiciones de cultivo en el reactor.
- Después de que la información de los medios se haya introducido en el software, asigne las condiciones de cultivo. Haga clic en Medios de condición y rellene la temperatura, el objetivo DO, el límite de pH superior y las RPM de agitación (arriba agitando o agitando hacia abajo).
- Establecer la adición de inóculos en los vasos.
- Activar Añadir placa de celda. Defina el tipo de placa, el nombre y la ubicación de la placa que contiene el medio.
- Haga clic en Agregar celdas a recipientes. Introduzca la hora de inoculación y el volumen de los medios que se añadirán a los buques.
- Defina la ruta recorrida por el controlador de líquidos para la transferencia de la celda de la placa a los recipientes. Haga clic en Siguiente para cambiar a la siguiente pestaña.
NOTA: Asegúrese de que las puntas de la pipeta de reutilización estén desactivadas para evitar la contaminación cruzada y la concentración celular viable inicial incorrecta.
- Conjunto de adición de pienso, glucosa y antiespuma.
NOTA: El procedimiento para la adición de piensos, glucosa y antiespuma es similar entre sí. Por el bien de este protocolo, el procedimiento aparece para "Feed". Esto se puede replicar para glucosa y antiespuma.- Active la placa de alimentación Añadir y defina el tipo de placa, el nombre y la ubicación. Haga clic en Añadir alimentación a los buques e introduzca el volumen de la alimentación que se añadirá a los buques. Definir el mapeo de la transferencia de la alimentación de la placa a los recipientes.
- Dependiendo del cultivo, agregue el número de adición de piensos. Para este cultivo, el reactor se alimenta después de 72 horas por cada 24 horas.
- Agregue manualmente el retardo de tiempo entre la alimentación introduciendo los datos en Retardo de las celdas agregadas. El primer día de alimentación es después de 72 horas de inoculación y el siguiente es después de 96 horas y así sucesivamente.
NOTA: La adición de antiespuma está programada para ser añadida todos los días para evitar la formación de espuma durante el cultivo.
- Establecer muestreo durante el cultivo.
- Active Añadir placa de muestra y defina el tipo de placa, el nombre y la ubicación.
- Compruebe tomar muestras de los recipientes e introduzca el volumen de la muestra que se va a retirar de los recipientes. Defina el mapeo de la transferencia de la muestra de los recipientes a la placa. Asegúrese de que el volumen no disminuya por debajo de 10 ml durante todo el curso de cultivo.
- Añadir el número de muestras a tomar durante el cultivo. De forma similar a la alimentación, añada la hora de la eliminación de la muestra del recipiente para cada punto de muestra de entrada.
- Guarde el proceso. Ahora está listo para su ejecución.
NOTA: Para garantizar el buen funcionamiento del protocolo, cambie a la pestaña Pasos de proceso en el software de referencia cultural de celda AMBR y seleccione la vista Paso de proceso para visualizar el flujo de la receta.
- En la pestaña Nuevo experimento, escriba el nombre del experimento junto con la fecha en la que se va a realizar.
- Diseño del experimento en el microbireactor automatizado
- Para ejecutar el software DOE del biorreactor, asegúrese de que la receta del software principal esté guardada y lista para su uso.
- Abra el software AMBR 15 DOE y haga clic en Investigación y seleccione Nuevo.
- Escriba el nombre de la nueva investigación DOE en el cuadro de diálogo Crear investigación.
- Para asignar un experimento a la investigación DOE, abra la receta creada para estudiar los diferentes parámetros. Haga clic en Examinar y seleccione el experimento respectivo.
- Defina el factor DOE.
- Las etiquetas de recipiente ya están alistadas en la columna. Para definir el factor DOE deseado, seleccione el parámetro y haga clic en la columna dote DOE factor. Seleccione Nuevo y añada las unidades, abreviatura, límite inferior y superior de los factores (por ejemplo, temperatura, DO, pH).
- Defina el factor de respuesta.
- Una vez definidos los factores DOE, defina la respuesta en función de la cual se estructuraría el análisis experimental.
- En la pestaña Respuestas, defina los valores que se deben tener en cuenta para el análisis de los datos.
- Haga clic en Editar respuestas DOE y defina el nombre de la respuesta, abreviatura, unidades, límites mínimos y máximos (por ejemplo, titer, concentración celular viable).
- Una vez definidas las respuestas, seleccione la variable AMBR para cada respuesta y defina la variable. Una respuesta se puede asociar automáticamente con una variable de microbiorreactor, Elija la variable requerida de la lista desplegable.
- Cambie la ecuación para cada una de las respuestas en función del requisito. La elección es entre los datos mínimo, máximo, primero, último y medio.
- Cree un diseño.
- Utilice al Asistente para el diseño del comienzo para seleccionar el tipo de diseño experimental, para agregar o quitar el número de réplicas y puntos centrales.
- Seleccione el objetivo, que determina la elección de diseños y modelos:
Cribado: Utiliza modelos lineales y de interacción para encontrar los factores importantes
Optimización (RSM), utiliza modelos cuadráticos y cúbicos para el modelado y la optimización detallados
Objetivo dividido: Los modelos para la formulación y los factores de proceso se pueden elegir por separado - Una vez decidido el objetivo, seleccione el modelo y el diseño junto con el número de puntos centrales y réplicas.
- Haga clic en Finalizar y cambie a la siguiente pestaña.
- Defina el experimento.
NOTA: Los factores DOE se enumeran en la columna derecha del software. Al seleccionar los factores deseados, se resaltarían los recipientes que ejecutan ese experimento con el parámetro deseado. Los buques dentro de la estación de cultivo se pueden mover haciendo clic derecho en el buque y moviéndolo a la ubicación deseada.- Cree los paquetes de trabajo que se pueden importar en el software de la cultura de la célula AMBR. Dependiendo del número de experimentos, los diferentes paquetes de trabajo se crean y almacenan para su posterior implementación
- Ejecución del experimento en los paquetes de trabajo creados en el portátil de control AMBR
- En la pestaña Experimento, haga clic en Crear experimento DOE y busque el paquete de trabajo creado con el software DOE.
- Inicializar el proceso haciendo clic en Iniciar.
- Análisis de resultados experimentales
- Una vez ejecutado el experimento, exporte los datos mediante Exportar resultados DOE. Se abre la ventana Exportar resultados DOE y las filas que indican el buque de cultivo y la estación se enumeran en la tabla.
- Seleccione las filas deseadas y haga clic en Filas seleccionadas exportadas o Exportar datos experimentales para almacenar todos los resultados y guardar el archivo para su análisis posterior.
- Importe los datos en el módulo AMBR DOE cambiando a la ficha Resultados y seleccionando Importar resultados.
- Busque el archivo de datos deseado y haga clic en Resultados de análisis.
- Analice los resultados más en MODDE.
4. Ejecución del cultivo en el microbiorreactor automatizado
NOTA: Los siguientes pasos son ejecutados por el usuario con la ayuda del protocolo escrito en el software antes mencionado. Los pasos son llevados a cabo por el usuario a menos que se mencione lo contrario.
- Carga de los buques
- Abra los recipientes de cultivo esterilizados con gamma bajo un gabinete de flujo laminar y oriente en la estación de cultivo como se muestra en la Figura 2.
- Limpie la placa de sujeción con un 70% de etanol y agua destilada doble. A continuación, autoclave la placa y colocar en la parte superior de la nave.
- Monte la placa de sujeción con una placa de agitación, asegurándose de que cada pasador esté firmemente fijado.
- Apriete tanto la placa del agitador como la placa de sujeción en el conjunto de agitación.
- Ejecución del software de microbiorreactor
- Utilice el programa escrito en la Sección 3 para ejecutar el cultivo.
- Visualice los pasos del proceso programados o completados en la pestaña Proceso.
- Añadir antiespuma a los recipientes antes de que se inicie el agitador para asegurarse de que no haya espuma excesiva durante el cultivo. El antiespuma se añadirá regularmente, y la espuma detectada visualmente.
- Adición de medios en el buque
- Llene la placa de 24 pocillos provistas de los microbiorreactores manualmente con medios estériles y colóquela en la cubierta designada del sistema. Asegúrese de que la placa esté colocada en la cubierta designada por el programa escrito (sección 3). El llenado del recipiente se llevará a cabo según lo diseñado en la sección 3.2.2.
NOTA: La temperatura y el agitador comienzan inmediatamente después de la adición del medio y el antiespuma. El lector del sensor se activa 1 hora después de que el recipiente esté lleno (paso Del monitor de inicio). El gasa a cada recipiente comienza una vez que el lector ha sido activado. Los medios se dejan equilibrar durante un mínimo de 6 horas antes de la recalibración del pH y la inoculación. Los parámetros del proceso se pueden alterar en el software como se menciona en la sección 3.2.3.
- Llene la placa de 24 pocillos provistas de los microbiorreactores manualmente con medios estériles y colóquela en la cubierta designada del sistema. Asegúrese de que la placa esté colocada en la cubierta designada por el programa escrito (sección 3). El llenado del recipiente se llevará a cabo según lo diseñado en la sección 3.2.2.
- Inoculación
- Mida la concentración celular viable después delpaso 5. Calcular el número de células que se transferirán a los vasos para asegurarse de que la concentración celular inicial en todos los vasos es de 3 x 105 celdas/ml.
- Transfiera las células a una placa de pozo de 24 profundidades de tal forma que el volumen de la suspensión sea al menos 1,6 veces el volumen requerido. Para un volumen requerido de 2 ml del inóculo, transfiera 3,2 ml de suspensión celular a cada pocal de la placa.
- Coloque la placa de 24 pocillos en la cubierta designada. Los buques serán inoculados como en la sección 3.2.4.
- Muestreo y análisis diarios
- Retire una muestra de 460 l de los recipientes todos los días utilizando el manipulador de líquidos. Diluir 200 l de la muestra con 800 l de tampón de PBS filtrado 1x (dilución 5x), y luego colocar en el contador de celdas.
- Centrifugar la muestra restante durante 5 min a 190 x g y la temperatura ambiente y almacenar el sobrenadante para su posterior análisis (glucosa, lactato, glutamina y glutamato).
- Congelar 100 oL del sobrenadante a -20 oC hasta el final del cultivo para la cuantificación de proteínas.
- Fin del cultivo
- Cuando el control de parámetros de proceso (es decir, temperatura, agitación, pH y DO) haya terminado, detenga la supervisión del proceso.
- Desenrosque la placa del agitador y la placa de sujeción.
- Retire los recipientes de cultivo y limpie las estaciones de cultivo. Coloque las placas de secado en las estaciones de cultivo y atornillarlas.
- Mientras tanto, limpie bien las placas de la abrazadera con un 70% de etanol y agua destilada doble.
- Haga clic en Detener en el software del biorreactor una vez que se haya completado el ciclo de secado.
- Cosecha de cultivo celular
- Cosecha las células el día 12 del cultivo eliminando manualmente el contenido de los recipientes en tubos centrífugos de 50 ml. Centrifugar el caldo de celda a 190 x g durante 30 min.
- Deseche el pellet celular y almacene el sobrenadante a -20 oC.
5. Medición de la concentración de mAb
- Utilice una columna de proteína A de 1,7 ml para la cuantificación de la proteína durante la ejecución del cultivo.
-
Prepare el búfer de equilibrio y elución antes de descongelar las muestras.
- Utilice una solución de 0,5 M Na2HPO4 que contenga 0,5 M DeNaCl con un pH de 7,9 como tampón de equilibrio y una solución de glicina de 100 mM que contenga 0,5 M de NaCl con un pH de 2 como tampón de elución.
- Filtrar ambos tampones a través de una membrana de 0,2 m y degasantes antes de ser colocados para el análisis.
- Purgue el sistema de cromatografía líquida de alto rendimiento (HPLC) con tampón de equilibrio recién preparado.
- Cargue la columna de proteína A en el sistema HPLC.
- Llevar a cabo la cromatografía con un caudal de 1 ml/min. Ajuste la temperatura del horno de columna a 30 oC y la temperatura del muestreador automático a 10 oC
- Descongelar las muestras congeladas a temperatura ambiente y filtrar 225 ml de cada muestra a través de una membrana PVDF de 0,22 m. Diluir las muestras con mayor concentración de la proteína deseada se encuentran en una proporción de 1:20 con tampón de equilibrio y filtrar a través de la membrana antes de colocar en el automuestreador.
- Coloque las muestras en el muestreador automático. Cargue el método y la secuencia en el software e inicie la secuencia.
NOTA: El método se compone de tres fases (véase la figura 1):inyección de la muestra en la columna durante los dos primeros minutos; seguido de búfer de elución para 8 min y regeneración de columna con búfer de equilibrio durante 10 min.
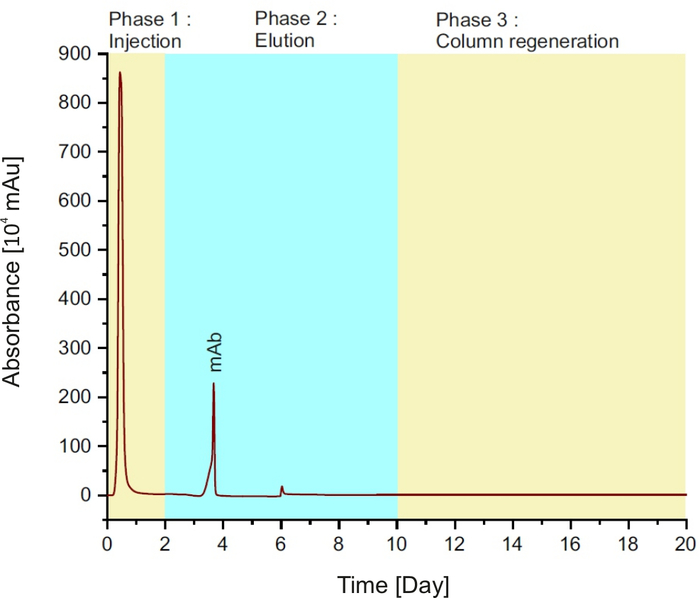
Figura 1: Cromatograma de proteína A, que representa las diferentes fases durante una sola ejecución. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
En la Figura 2se presenta una visión general del cultivo realizado en este estudio.
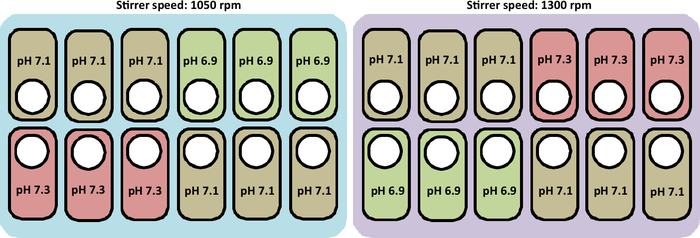
Figura 2: Representación esquemática de las condiciones experimentales para probar perfiles de velocidad de pH y agitador en las estaciones de cultivo. La figura también representa el diseño correcto para colocar los buques.
Discusión
La optimización del proceso para aumentar el rendimiento es de vital importancia en la industria biofarmacéutica. Los matraces de agitación podrían utilizarse potencialmente para el cribado de la cepa; sin embargo, la supervisión de los parámetros del proceso como pH y DO no están disponibles en los matraces. Los microbiorreactores tienen una ventaja, ya que permiten un seguimiento y control continuos del proceso. Estos bucles de control en el microbiorreactor también proporcionan una condición similar a las de ...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores quieren dar las gracias al Bundesministerium f'r Bildung und Forschung (BMBF), al Ministerio Federal de Educación e Investigación de Alemania, y al equipo de Bioprocesamiento de Sartorius Stedim Biotech GmbH, Alemania, por su apoyo.
Materiales
| Name | Company | Catalog Number | Comments |
| 1 mL disposable pipette tips, sterilized | Sartorius Stedim Biotech GmbH | A-0040 | |
| 200 mM L-glutamine | Corning, Merck | 25-005-CV | |
| 24 Well deep well plates | Sartorius Stedim Biotech GmbH | A-0038 | |
| 5 mL disposable pipette tips, sterilized | Sartorius Stedim Biotech GmbH | A-0039 | |
| ambr 15 automated microbioreactor system | Sartorius Stedim Biotech GmbH | 001-2804 | |
| ambr 15 Cell Culture 24 Disposable Bioreactors - Sparged | Sartorius Stedim Biotech GmbH | 001-1B86 | |
| Antifoam C Emulsion | Sigma-Aldrich, Merck | A8011 | |
| Bottle Top Sterile filter | Corning, Merck | CLS431474 | 0.1 μm pore size |
| CEDEX Detergent (3% Mucosol) | Roche Innovatis AG | 05-650-658-001 | |
| Cell counter | Roche Innovatis AG | 05-650-216-001 | CEDEX HiRes |
| CHO DG44 cell line | Cellca, Sartorius Stedim Biotech GmbH | ||
| CHOKO Feed Media A (FMA) | Sigma-Aldrich, Merck | CR80025 | |
| CHOKO Feed Media B (FMB) | Sigma-Aldrich, Merck | CR80026 | |
| CHOKO Production Medium | Sigma-Aldrich, Merck | CR80027 | |
| CHOKO Stock Culture Meium | Sigma-Aldrich, Merck | CR80028 | |
| Chromaster high pressure liquid chromatography system | VWR International | ||
| Conical Centrifuge tube | Corning, Merck | SIAL0790 | |
| Ethanol | Merck | 1070179026 | |
| Glycine | Carl Roth | 56-40-6 | |
| HPLC Vials | VWR International | SUPLSU860181 | |
| PBS | Sigma-Aldrich,Merck | P4417 | |
| Protein A Column | Thermo Fisher Scientific | 1502226 | POROS™ A 1.7 mL |
| Sodium chloride | Sigma-Aldrich,Merck | 7647-14-5 | |
| Sodium phosphate dibasic anhydrous | Sigma-Aldrich,Merck | 7558-79-4 | |
| Trypan Blue | VWR International | VWRVK940 | |
| YSI | YSI Inc | 2900D | YSI 2900 Select |
Referencias
- Walsh, G. Biopharmaceutical benchmarks 2018. Nature Biotechnology. 36, 1136 (2018).
- Kim, J. Y., Kim, Y., Lee, G. M. CHO cells in biotechnology for production of recombinant proteins: current state and further potential. Applied Microbiology and Biotechnology. 93 (3), 917-930 (2012).
- Lai, T., Yang, Y., Ng, S. K. Advances in Mammalian cell line development technologies for recombinant protein production. Pharmaceuticals (Basel). 6 (5), 579-603 (2013).
- Carlage, T., et al. Analysis of dynamic changes in the proteome of a Bcl-XL overexpressing Chinese hamster ovary cell culture during exponential and stationary phases. Biotechnology Progress. 28 (3), 814-823 (2012).
- Hacker, D. L., de Jesus, M., Wurm, F. M. 25 years of recombinant proteins from reactor-grown cells - where do we go from here. Biotechnology Advances. 27 (6), 1023-1027 (2009).
- Shukla, A. A., Gottschalk, U. Single-use disposable technologies for biopharmaceutical manufacturing. Trends in Biotechnology. 31 (3), 147-154 (2013).
- Ao, S., Gelman, L. . Advances in electrical engineering and computational science. Lecture notes in electrical engineering. 39, (2009).
- Bareither, R., et al. Automated disposable small scale reactor for high throughput bioprocess development: a proof of concept study. Biotechnology and Bioengineering. 110 (12), 3126-3138 (2013).
- Kang, Y., Ludwig, D. L., Balderes, P. What can cell culture flocculation offer for antibody purification processes. Pharmaceutical Bioprocessing. 2 (6), 483-485 (2014).
- Choe, W., Durgannavar, T. A., Chung, S. J. Fc-Binding Ligands of Immunoglobulin G: An Overview of High Affinity Proteins and Peptides. Materials (Basel). 9 (12), (2016).
- Schäpper, D., et al. Application of microbioreactors in fermentation process development: a review. Analytical and Bioanalytical Chemistry. 395 (3), 679-695 (2009).
- Zhang, Z., et al. Microbioreactors for Bioprocess Development. Journal of the Association for Laboratory Automation. 12 (3), 143-151 (2007).
- Claßen, J., et al. Spectroscopic sensors for in-line bioprocess monitoring in research and pharmaceutical industrial application. Analytical and Bioanalytical Chemistry. 409 (3), 651-666 (2017).
- Janoschek, S., et al. A protocol to transfer a fed-batch platform process into semi-perfusion mode: The benefit of automated small-scale bioreactors compared to shake flasks as scale-down model. Biotechnology Progress. 35 (2), 2757 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados