Method Article
Programas de propagación cautiva de mariposas en riesgo para mejorar el conocimiento de la historia de la vida y técnicas eficaces de conservación ex situ
En este artículo
Resumen
Aquí, presentamos protocolos para 1) la propagación cautiva de laboratorio de la mariposa azul de Miami en peligro federal (Cyclargus thomasi bethunebakeri), y 2) la evaluación de la información básica de la historia de la vida, como el tiempo de desarrollo inmaduro y el número de estadios larvales. Ambos métodos se pueden adaptar para su uso con otros programas de conservación ex situ.
Resumen
Mejorar el conocimiento de las mejores prácticas ex situ para las mariposas en riesgo es importante para generar resultados exitosos del programa de conservación y recuperación. La investigación sobre estas poblaciones cautivas también puede producir datos valiosos para abordar las brechas clave de información sobre el comportamiento, la historia de la vida y la ecología de los taxones objetivo. Describimos un protocolo para la propagación en cautividad del Cyclargus thomasi bethunebakeri en peligro federal que puede ser utilizado como modelo para otros programas de mariposa ex situ de mariposas en riesgo, especialmente aquellos de la familia Lycaenidae. Además, proporcionamos un protocolo sencillo y directo para registrar varias métricas de la historia de la vida que pueden ser útiles para informar metodologías ex situ, así como adaptadas para estudios de laboratorio de otros lepidópteros.
Introducción
Una creciente lista de estudios indica descensos globales generalizados y graves en las poblaciones de mariposas1,2,3,4,5. Esto incluye la gran mayoría de las especies en riesgo. Los programas de conservación diseñados para mitigar tales disminuciones a menudo emplean una mezcla de estrategias que incluyen monitoreo de la población, manejo y restauración del hábitat, investigación científica, propagación en cautiverio y translocación de organismos6. Sólo dentro de los Estados Unidos y sus territorios, un total de 30 taxones de mariposas están listados bajo la Ley de Especies Amenazadas (ESA, por sus días) como amenazadas o en peligro de extinción, y 21 de ellas han aprobado proyectos o planes de recuperación final. En el caso de estos taxones, más de la mitad de las estrategias de recuperación identificadas recomiendan la propagación en cautividad o afirman que la propagación cautiva debe evaluarse7. El uso de los esfuerzos de conservación ex situ para las mariposas ha crecido considerablemente en los últimos años8,9, y tiene el potencial de ser una herramienta crítica para ayudar a los esfuerzos de recuperación10. Numerosas instituciones, organizaciones y agencias están actualmente involucradas en esfuerzos ex situ por al menos 11 taxones de mariposa incluidos en la LISTA de la ESA (es decir, Cyclargus thomasi bethunebakeri, Euphydryas editha quino, Euphydryas editha taylori, Heraclides aristodemus, Hesperia dacotae, Lycaeides melissa samuelis, Oarisma poweshiek, Pyrgus ruralis lagunae, y Speryeria zerene hippolyta) y varios otros taxones en riesgo (por ejemplo, Callophrys irus, Euphydryas phaeton, Speyeria id, Eumaeus atala)11. A pesar del número de esfuerzos sólidos y exitosos, sigue habiendo una falta de comunicación regular entre los programas y entre los profesionales de la conservación que implican el intercambio de ideas, datos, metodologías eficaces y resultados. Este intercambio de conocimientos es esencial, ya que ayuda a minimizar la duplicación de esfuerzos, mejora las mejores prácticas generales y mejora el impacto en la conservación. Pocos protocolos publicados de arranque de cabeza, cría en cautividad, cría o cría están fácilmente disponibles para taxones de mariposas en riesgo, y aquellos que a menudo carecen de suficientes detalles narrativos y / o ilustraciones. Estos a menudo proporcionan detalles resumidos en su mayoría con instrucciones paso a paso limitadas e imágenes que lo acompañan, lo que hace que la replicación sea difícil o la aplicación a otros taxones difíciles de evaluar12,13,14,15. Muchos de los protocolos disponibles están limitados de alguna manera: sólo existen en la literatura gris, o en diferentes niveles de detalle, edad de publicación, o como componentes en los procedimientos de simposio, informes de agencia / funder, o manuales internos16,17,18,19,20,21,22,23,24.
Para la mayoría de los programas de conservación, la propagación en cautividad se lleva a cabo principalmente para apoyar la translocación de conservación, que abarca la reintroducción, el refuerzo (es decir, el aumento) y la introducción25,26. Estas actividades están destinadas a ser implementadas estratégicamente como un componente de la estrategia global de recuperación con el fin de ayudar a prevenir la extinción de una especie, subespecie o poblaciones enumeradas. Cabe señalar, sin embargo, que este es uno de varios otros roles potenciales que tales programas ex situ pueden servir. Estos también pueden incluir el mantenimiento de un seguro (es decir, la refugia), el rescate temporal de organismos, el apoyo a la investigación y/o formación relacionadas con la recuperación, y la promoción de los esfuerzos de educación y sensibilización relacionados con la conservación27,28. Independientemente de si los programas ex situ tienen un único objetivo definido o una combinación de varios, los profesionales de la conservación deben maximizar las oportunidades de recopilación de datos con el fin de llenar las lagunas clave de información cuando sea posible. Esto es particularmente importante porque la gran mayoría de los taxones en riesgo generalmente han sido mal estudiados antes de una disminución sustancial de la población silvestre. El conocimiento mejorado resultante adquirido sobre diversos aspectos conductuales, ecológicos o de la historia de la vida del taxón focal puede servir para ayudar a avanzar en la conservación y gestión efectiva de las especies29.
Aquí, describimos en detalle el protocolo de propagación cautiva que fue desarrollado para la mariposa azul de Miami en peligro federal (Cyclargus thomasi bethunebakeri)(Figura Suplementaria 1) como parte de un programa de conservación y recuperación más grande. En este caso, el programa de propagación en cautividad cumple tres funciones identificadas específicas: 1) una población de seguros en caso de que se pierda la población silvestre existente, 2) una población de investigación diseñada para llenar las lagunas de conocimiento ecológicas y de historia de la vida identificadas que pueden ayudar a informar la recuperación y/o la gestión, y 3) para producir organismos viables para la translocación de conservación en sitios dentro del rango histórico del taxón. El protocolo resultante ha sido bien investigado y probado, habiendo sido utilizado y mejorado durante más de una década. En consecuencia, creemos que las técnicas y metodologías descritas representan un modelo viable que puede aplicarse o adaptarse fácilmente a otros programas de mariposas de riesgo ex situ, particularmente aquellos que involucran a Lycaenidae o taxones relacionados. Si bien no sugerimos que el protocolo descrito sea superior a otros, creemos que hay oportunidades para aplicar algunos de los métodos de manera más amplia para ayudar a mejorar la productividad, la atención o la eficiencia. Esto es particularmente cierto ya que gran parte de nuestra cría se realiza en condiciones de laboratorio de interior con espacio limitado, similar a los programas de conservación que involucran Euphydryas editha taylori y Speryeria zerene hippolyta17,23. Numerosos otros protocolos a menudo utilizan material en maceta para la oviposición o la cría larval, que a veces puede conducir a mayores complejidades relacionadas con el control de depredadores, control ambiental (es decir, humedad, temperatura), monitoreo del ganado, recopilación de datos, problemas de plagas de plantas, y espacio para nombrar unos21,22. Por último, el protocolo presentado describe los métodos para la cría en cautividad. Muchos otros programas de conservación de mariposas en riesgo implican la crianza en la cabeza o la cría en cautividad con los protocolos representativos que reflejan esas diferencias. Aunque a menudo es menor, creemos que esto ayuda a ampliar el grupo existente de información disponible para que otros programas la revisen. Esto es crítico, porque la mayoría de los programas ex situ representan esfuerzos pioneros para ayudar a facilitar la recuperación de taxones raros y a menudo mal estudiados. Los protocolos disponibles pueden servir como un excelente punto de partida para ayudar a proporcionar información valiosa, reducir la duplicación de esfuerzos y promover la innovación. Debido a "la amplia diversidad interespecífica de comportamientos de mariposas, rasgos de la historia de la vida y requisitos ecológicos combinados con diferencias a menudo marcadas en las instalaciones del programa, presupuestos, experiencia profesional" y otras diferencias inherentes, la dependencia a una sola metodología, incluso para taxones estrechamente relacionados, a menudo es limitante e injustificada30. La flexibilidad para perfeccionar o desarrollar nuevos protocolos adaptados a las necesidades de taxones o programas específicos es esencial para el éxito y, por lo tanto, debe enfatizarse. Además, describimos técnicas de laboratorio para recopilar métricas sobre el desarrollo del organismo en condiciones cautivas, incluyendo el número de estrellas larvales, la duración de las etapas individuales del desarrollo, el tiempo total de desarrollo y la longitud larvaria y pupal. Estas técnicas tienen una amplia aplicabilidad para los estudios de historia de la vida de Lepidoptera que se pueden utilizar para refinar protocolos ex situ o informar datos de campo.
Protocolo
1. Asegurar el cortejo y el apareamiento exitosos de adultos
- Después de una eclosión exitosa, libere mariposas adultas viables en una jaula de vuelo segura, con protección, con mosquiteo y protegida ubicada en un invernadero con temperatura controlada(Figura Suplementaria 2).
NOTA: Los adultos pueden estar marcados en la superficie ventral de las alas con marcadores de tinta permanentes si se desea la identificación de individuos específicos para la separación de líneas genéticas, origen de las existencias, o para la recopilación de datos específicos relacionados con la longevidad del organismo, comportamiento, etcetera.- Mientras que las dimensiones exactas de la jaula pueden variar, asegúrese de que hay un amplio espacio para acomodar el material adecuado de la planta de néctar necesario para soportar la densidad de las mariposas adultas housed y proporcionar espacio para que un humano se ponga libremente de pie y pivote alrededor.
- Más allá de la regulación de la temperatura, asegúrese de que el invernadero es seguro para que pueda proporcionar una segunda capa de contención junto con la protección contra las inclemencias del tiempo (por ejemplo, lluvias intensas, viento).
- Elevar el material vegetal de néctar en maceta para que no haya más de 30 cm de espacio desde la parte superior interior de la jaula hasta las flores en flor más altas(Figura Suplementaria 2). Esto proporciona un acceso óptimo a los recursos de néctar disponibles, ofrece amplias perchas para adultos y minimiza la actividad de vuelo extraña.
- Coloque una planta anfitriona en maceta en la jaula de vuelo. Esto garantiza que incluso si se pierde un par acoplado, se pueden recoger los huevos resultantes puestos.
- Proporcione un flujo de aire constante. Esto mejora la actividad de cortejo y el éxito de apareamiento. En un entorno de invernadero, los sopladores y los ventiladores de circulación de montaje fijo se utilizan mejor para ayudar a mejorar la ventilación y el movimiento del aire. También se puede utilizar una ventilación portátil más pequeña, como ventiladores de caja o de escritorio.
- Mantener la temperatura interna del invernadero entre 27oC y 32oC para promover una óptima actividad adulta y un éxito de apareamiento. La temperatura dentro de la jaula se controla mediante un termómetro de monitoreo de memoria trazable.
- Negocie la jaula de vuelo con mosquiteros regularmente (aproximadamente una vez cada 2 h) con agua utilizando una bomba de mano, pulverizador de tanque de plástico o manguera de jardín.
- Recoja suavemente los pares de apareamiento individuales de la jaula de vuelo con mosquitero utilizando un vial de tapa de presión de plástico transparente de 50 dram(Tabla de materiales),colocando de uno a dos pares por vial, y transporte a una sala de cría interior o laboratorio(Figura suplementaria 3).
2. Maximizar la producción de huevos
- Montar la cámara de oviposición.
- Tome una taza de papel blanco normal de 12 onzas y usando un cuchillo utilitario de cuchilla sin presión, haga dos cortes horizontales a cada lado de la copa uno frente al otro. Cada corte debe ser de aproximadamente 1 cm por debajo de la llanta.
- Cortar un solo hisopo de algodón por la mitad e insertar el extremo de la varilla de cada uno en los dos cortes horizontales a cada lado de la taza de papel para que la porción de hisopo de algodón se extienda aproximadamente 2 cm hacia el interior de la copa.
- Usando un cuchillo utilitario de cuchilla rápida, haga dos cortes "X" en la parte inferior de la taza de papel. Cada corte diagonal debe ser de aproximadamente 1 cm de largo.
- Tome una taza de plástico de 9 onzas y llene la parte inferior con aproximadamente 2 cm de agua del grifo.
- Colocar un corte fresco, de aproximadamente 15 cm de largo, del crecimiento terminal de la planta de host larvario en la copa de papel insertando el tallo a través de uno de los cortes "X" en la parte inferior. Empuje el tallo a través del corte de modo que aproximadamente 4-5 cm sobresalgan por la parte inferior.
- Coloque la taza de papel con material anfitrión en la taza de plástico, asegurándose de que el tallo de la planta esté en agua.
- Llene una jeringa sub-Q de 1 ml (0,45 mm x 16 mm) con una bebida deportiva con sabor y sature ambos hisopos de algodón en la taza de papel. Actúan como flores artificiales.
NOTA: La bebida deportiva con sabor a melón y ponche de frutas proporciona la mejor alternativa de néctar. - Una vez que cada par de apareamiento se separe, coloque 2-3 hembras gravitadas en la configuración de la copa montada (es decir, la cámara de oviposición).
- Cubra la copa con un fragmento cuadrado cortado de tul negro (aproximadamente 15 cm x 15 cm) y fíjela con una banda de goma alrededor de la tapa(Figura suplementaria 4). El tule negro proporciona la mejor visibilidad de la copa y una fácil identificación de cualquier huevo que ocasionalmente se pueda poner en el tule.
- Estimular la actividad y la oviposición de las mariposas adultas.
- Coloque cada cámara de oviposición en un banco de laboratorio o mesa aproximadamente 19 cm por debajo de una luz de sujeción de 8,5 pulgadas (21,59 cm) con un reflector de aluminio que alberga una bombilla incandescente de 40 W(Figura suplementaria 5).
NOTA: La luz incandescente proporciona el calor radiante necesario para estimular la actividad y la oviposición de los adultos. - Coloque un termómetro de monitoreo de memoria trazable adyacente a las luces y ejecute el sensor de temperatura para que se apoye en la parte superior de una cámara de oviposición situada directamente debajo de una luz de abrazadera.
NOTA: El rango de temperatura objetivo está entre 27,5 oC-29 oC. - Añada luces de abrazadera suplementarias según sea necesario dependiendo del número total de cámaras oviposicionales desplegadas.
- Enchufe las luces de abrazadera en un temporizador mecánico enchufable interior programable de 15 amperios 24 h con dos tomas de corriente (programable en intervalos cronometrados de 30 minutos).
- Ajuste el temporizador para encender la luz de abrazadera durante intervalos de 30 minutos (es decir, un ciclo repetible de 30 min encendido, 30 minutos apagado).
NOTA: Este ciclo de luz ayuda a maximizar la producción de óvulos proporcionando períodos repetibles de iluminación para estimular la actividad y la oviposición de las mariposas adultas seguidas de cortos períodos de descanso oscuro. - Refresque los hisopos de algodón en cada taza con una bebida deportiva saborizada a través de la jeringa subQ y neblina regularmente con agua usando una botella de spray de plástico aproximadamente cada 2-3 h o según sea necesario.
NOTA: Esto proporciona un néctar artificial adecuado y humedad para permitir que las mariposas se alimenten libremente como se desee. Por lo tanto, mejora la longevidad de los adultos y la productividad de oviposición en condiciones de laboratorio donde no se puede utilizar fácilmente material vegetal vivo y en floración. - Supervise las tazas regularmente y sustituya la planta anfitriona por esquejes frescos según sea necesario.
- Cuando los huevos comiencen a eclosionar o la densidad de los huevos se vuelva alta, mueva la(s) hembra(s) a una nueva taza con huésped fresco y comience el protocolo de larvas con neonatos.
- Coloque cada cámara de oviposición en un banco de laboratorio o mesa aproximadamente 19 cm por debajo de una luz de sujeción de 8,5 pulgadas (21,59 cm) con un reflector de aluminio que alberga una bombilla incandescente de 40 W(Figura suplementaria 5).
3. Cuidado y mantenimiento larvario
- Repita los pasos 2.3-2.6 para ensamblar tazas para larvas.
- Cuando los huevos comiencen a eclosionar, mueva el material vegetal huésped con huevos y larvas de neonatos en una taza recién montada, colocando el tallo a través de la segunda "X" en la parte inferior asegurando que el tallo de la planta esté en agua y las hojas toquen el corte de huésped fresco adyacente.
- Cuando las larvas sean jóvenes (neonate-2 instar), revise las tazas larvales diariamente para ver si hay frescura del material vegetal huésped y presencia de moho o frass excesivo.
NOTA: No se recomienda la eliminación diaria de material huésped cuando las larvas son jóvenes, ya que esto puede resultar en lesiones en el organismo debido a la manipulación y / o el desperdicio innecesario de material de huésped fresco. - Si el material huésped está marchito o en mal estado, coloque otro corte de material vegetal fresco en la taza para que esté tocando el follaje existente y permita que las larvas se trasladen al nuevo huésped por su cuenta.
- Una vez que las larvas lleguen a la3a estrella, reemplace la taza de papel y agregue material fresco anfitrión diariamente.
- Utilice un pequeño cepillo de pintura de acuarela para cabello de camello para mover suavemente las larvas del material huésped antiguo o la superficie de la taza al material anfitrión fresco en la nueva taza.
- Coloque el material huésped antiguo en un recipiente rectangular vacío de almacenamiento de alimentos de plástico.
- Repita los pasos 3.5-3.7 al día y hasta que se hayan procesado todas las tazas con larvas.
- Cuando haya terminado, agregue una pequeña cantidad de material vegetal fresco encima de los desechos de la planta en el contenedor de almacenamiento de alimentos y coloque libremente una tapa en la parte superior.
NOTA: Esto sirve como medida de seguridad en caso de que se pase por alto cualquier larva durante el procesamiento diario, ya que se arrastran sobre el nuevo material huésped enla parte superior de los residuos de la planta y se pueden retirar al día siguiente. - Mantener las copas a temperatura de laboratorio entre 25oC-28oC para una actividad y desarrollo óptimos de la larva(Figura Suplementaria 6).
NOTA: Para alcanzar temperaturas óptimas de cría en condiciones interiores, a menudo es necesario colocar tazas bajo luces de abrazadera con reflectores de aluminio que alojan bombillas incandescentes de 40 W. Las temperaturas se pueden monitorizar activamente utilizando un termómetro de monitorización de memoria trazable y la altura de la luz ajustada para alcanzar condiciones óptimas de cría.
4. Construcción de la cámara de pupación
- Corte un rollo de papel corrugado de una sola cara en cuadrados de 3,8 cm x 3,8 cm de tamaño igual.
- Coloque un cuadrado en una porción de plástico transparente de 2 onzas.
- Coloque la taza en una bandeja de plástico transparente(Figura Suplementaria 7).
5. Preparación de larvas para la pupación
- Identifique las larvas maduras listas para pupar durante el procesamiento diario de colonias.
NOTA: Estas larvas se tornarán de color marrón verdoso uniforme, perderán sus galones y a menudo se alejarán del huésped. - Retire suavemente cada larva madura con un pequeño cepillo de pintura de acuarela para cabello de camello o fórceps y coloque una en cada cámara de pupación.
- Enganche firmemente la tapa de plástico transparente de la cámara de pupación.
- Repita los pasos 5.1-5.3 hasta que todas las larvas listas para pupar hayan sido transferidas a cámaras de pupación añadiendo nuevas bandejas de plástico según sea necesario(Figura Suplementaria 8).
6. Mantenimiento de las pupupas
- Para cada bandeja de cámaras de pupación, registre la fecha de la primera pupación y cualquier otra información pertinente necesaria (es decir, línea genética, ensayo experimental, etc.).
- Organizar las bandejas por fecha y lugar en un lugar seguro dentro del laboratorio(Figura Suplementaria 8).
- Monitoree las bandejas diariamente para la eclosión de adultos.
NOTA: Las condiciones de laboratorio, como la temperatura, influirán fuertemente en el tiempo de desarrollo. - Antes de la eclosión adulta (normalmente dentro de los 10 días de la primera cría), retire las tapas de las cámaras de pupación individuales y coloque la bandeja en una jaula de cría emergente de malla plegable de 34,29 cm x 34,29 cm x 60,96 cm (Figura suplementaria 9).
NOTA: Las puas fijadas de forma segura dentro de las ranuras de los cuadrados de papel corrugado facilitan la eclosión adulta exitosa(Figura suplementaria 10). - Repita el protocolo completo del paso 1.1 para la generación cautiva subsiguiente.
7. Evaluar el tiempo de desarrollo de las etapas inmaduras y el número de estadios
- Coloque una sola larva bajo un microscopio de disección. Utilice un pequeño cepillo de pintura de acuarela para cabello de camello para mover y aislar cuidadosamente las larvas para evitar lesiones en el organismo.
- Sumerja un solo pelo del pincel en pintura luminosa no tóxica(Tabla de Materiales),y coloque cuidadosamente una pequeña gota de pintura en la parte posterior (dorsum) de la larva. Utilice un color de pintura que destaque del color de fondo y el color de patrón de la larva(Figura Suplementaria 11). Asegúrese de evitar colocar pintura en la cabeza de la larva.
- Una vez que la pintura se seque (alrededor de 30 s más o menos), coloque cada larva individual en su propia porción de plástico transparente de 2 onzas que contenga aproximadamente 1-3 hojas pequeñas de material fresco anfitrión terminal y escriba un identificador único en la taza y la tapa(Figura Suplementaria 12).
- Revise cuidadosamente cada larva diariamente. Retire las hojas y abaste sobre una superficie blanca. Inspeccione la copa, limpie la tapa y examine las hojas bajo un microscopio de disección para detectar la presencia de exuvias larectores (pieles fundidas) y/o cápsulas de la cabeza.
- Si se encuentra una exuvia larval, retírela de la copa y colóquela en un tubo de microcentrífuga etiquetado con el número de copa correspondiente y la fecha (ver pasos 8.1-8.6. a continuación).
- Vuelva a pintar las larvas después de cada muda y registre las fechas fundidas.
- Mida la longitud total del cuerpo (cabeza al último segmento abdominal) de cada larva diariamente usando pinzas digitales. Tome tres mediciones y registre el promedio de los tres, junto con la fecha y la hora. Para las larvas instar tempranas, se debe utilizar una lupa o un alcance de disuado al medir para garantizar mediciones precisas.
- Devolver la larva a su correspondiente taza de porción de plástico.
- Agregue material de host fresco según sea necesario y retire todos los residuos de host antiguos y de refriega. Si se encuentra moho en la taza, deseche y use una taza nueva. Escriba el número de identificador único correcto en la nueva taza.
- Repita los pasos 7.5-7.9 hasta que todas las larvas lleguen a su estrella final y comiencen la etapa prepupal. Cuando las larvas dejan de alimentarse, gire a un color uniforme de color marrón verdoso uniforme, pierda sus galones y a menudo deambule fuera del huésped, minimice los perturbadores.
- Coloque un pequeño trozo de papel corrugado en la taza (ver paso 4.1).
- Una vez que cada larva haya pupado completamente, mida su longitud total como en el paso 7.8 anterior y registre la fecha de la pupación. Este será el fundido final de cada individuo.
- Compruebe las pusias diariamente y registre la fecha de eclosión y el sexo de cada mariposa adulta resultante.
- Mida la longitud del acorde de ala de cada mariposa usando pinzas digitales. Las mariposas se pueden sujetar suavemente con fórceps para la medición. Si la mariposa está demasiado activa para medirla fácilmente, colóquela temporalmente en un refrigerador durante 30 s o menos e inténtelo de nuevo.
8. Recolectar exuvias larvales
- Cuando se observe una exuvia larval, llene un tubo de microcentrífuga con 0,2 l de glicerina. Etiquete la parte superior de la tapa y el lado con el número de larva, la fecha de muda y la cápsula de la cabeza (H.C.).
NOTA: Las larvas de algunas larvas de lepidópteros consumen regularmente sus exuvias, pero la cápsula de la cabeza debe permanecer. - Coloque la exuvia larval y la cápsula de la cabeza asociada en una porción de plástico transparente tapa de la taza y poner un par de gotas de etanol en ella.
- Examine la exuvia larval bajo un microscopio de disección colocándolo en una porción de plástico transparente y poniendo unas gotas de etanol en ella. Si la cápsula de la cabeza larval ya está separada de la exuvia, coloque una gota de glicerina en la punta de fórceps entomológicos puntiagudos y toque suavemente la cápsula de la cabeza hasta la glicerina. Coloque la cápsula de la cabeza en el tubo de microcentrífuga asociado.
- Si la cápsula de la cabeza todavía está unida a la exuvia larval, utilice fórceps puntiagudos y un alfiler de insectos para separar la cápsula de la cabeza de la exuvia larval.
- Una vez separado, utilice la técnica de glicerina para recoger la cápsula de la cabeza. Si hay demasiado etanol, puede usar una pequeña toalla de papel para eliminar algunos, pero tenga cuidado de no retirar accidentalmente la cápsula de la cabeza.
- Coloque la cápsula de la cabeza en un vial lleno de glicerina etiquetado y cierre bien la tapa.
Resultados
En el transcurso de dos iniciativas de conservación separadas dirigidas a la recuperación de Cyclargus thomasi bethunebakeri de febrero de 2003 a diciembre de 2010 y desde noviembre de 2016 hasta la actualidad, este protocolo se utilizó para producir con éxito un exceso de 51.052 organismos viables. Sobre la base de la instantánea resumida de un año de la productividad general de la población cautiva de junio de 2018 a junio de 2019, se produjeron un total de 10.166 organismos viables, lo que representa 782,00 a 118,93 organismos al mes en 13 generaciones. Del mismo modo, la producción media total de huevos por hembra en condiciones de laboratorio fue de 114,00 a 26,12 (n a 12)31. La productividad sustancial del organismo resultante clasifica a este programa entre los mayores esfuerzos ex situ en los Estados Unidos, junto con los de Euphydryas editha taylori, Speyeria zerene hippolyta, y Lycaeides melissa samuelis24. Parte de esta productividad se puede atribuir al hecho de que la mariposa es continuamente meditada, produciendo una generación aproximadamente 4-6 semanas en cautiverio. La mayoría de otros programas de cría de conservación implican taxones que son univoltino o bivoltina. No obstante, incluso para los programas que implican taxones extremadamente fecundos como Speyeria spp., el número total de organismos viables producidos para la translocación de conservación sobre una base anual rara vez supera unos pocos miles32. En consecuencia, nuestra población cautiva ha permitido la investigación dirigida y la extensa recopilación de datos sobre numerosas lagunas de datos clave importantes para mejorar las mejores prácticas de cría y cría de laboratorio(Figura 1),así como ayudar a informar las decisiones de recuperación y gestión.
El tiempo medio de desarrollo total, desde la larva de neonato hasta el adulto, fue de 28,63 días(Tabla 1). La mayoría de las larvas tenían cuatro mudas(Figura 2, Figura 3),aunque dos tenían cinco mudas, y una tenía seis mudas. La longitud media total de todas las estrellas larvales fue de 5,97 mm, y las larvas fueron más grandes en la cuarta etapa de la vida y prepupal(Tabla 1). Cuando sólo se incluyen variables con más de 30 observaciones, el tiempo más corto se pasó en las primeras etapas instar y prepupal, y el más largo se gastó como pupupae(Tabla 1, Figura 2). Las hembras típicamente se desarrollaron más rápido en todas las etapas inmaduras en comparación con los machos, aunque esto no fue un efecto significativo (p - 0.625). Se realizaron análisis estadísticos utilizando RStudio Versión 1.1.463 (R Core Team 2016)33. La longitud media del acorde del ala adulta fue de 12,64 mm(Tabla 2),y hubo una diferencia significativa entre los sexos (p x 0,047). La prueba t de dos lados se ejecutó para evaluar la diferencia de acordes de las alas entre los sexos. El modelo de regresión lineal y la regresión escalonada para la longitud media de cada etapa de vida mostraron que la longitud pupal era el mejor predictor para la longitud de acorde de ala adulta(Tabla 3, Tabla 4). Los modelos de regresión para el tiempo de desarrollo mostraron que el número de días pasados en la segunda y cuarta estrellas y el número total de días fueron los mejores predictores para la longitud del acorde de ala adulta, pero sólo el número de días en la cuarta estrella fue significativo(Tabla 5, Tabla 6). Debido a que las variables eran continuas, se ejecutaron dos modelos de regresión lineal para el tiempo de desarrollo de cada etapa de vida, así como la longitud de cada etapa de vida, con la longitud del acorde de ala adulta como variable dependiente. Las regresiones escalonadas se ejecutaron en ambos modelos de regresión para determinar los mejores predictores de la longitud del acorde de ala adulta.

Figura suplementaria 1: Especímenes anclados de Cyclargus thomasi bethunebackeriadulto. (A) Hombre adulto, dorsal (izquierda), ventral (derecha). (B) Adulto femenino, dorsal (izquierda), ventral (derecha). Haga clic aquí para ver una versión más grande de esta figura.

Figura suplementaria 2: Jaula de vuelo con mosquiteo alojado en invernadero con temperatura controlada. (A) El interior muestra plantas de néctar adulto en maceta y una sola planta huésped larval en maceta. (B) Estanterías metálicas ayuda a elevar las plantas de néctar en maceta para que no haya más de 30 cm de espacio desde la parte superior interior de la jaula hasta las flores en flor más altas. Haga clic aquí para ver una versión más grande de esta figura.

Figura complementaria 3: Procedimiento para recoger parejas adultas en cópula. (A) Apareamiento de Cyclargus thomasi bethunebakeri adulto dentro de la jaula de vuelo con mosquitero (hembra, derecha y macho, izquierda). (B) Pares de apareamiento recogidos de la jaula de vuelo en viales de tapa de presión y llevados al laboratorio. Haga clic aquí para ver una versión más grande de esta figura.

Figura suplementaria 4: Procedimiento para el montaje de la cámara de oviposición. (A) Sistema de dos tazas con material de host terminal y hisopos de algodón. (B) Una jeringa subQ de 1 ml (0,45 mm x 16 mm) con bebida deportiva saborizada saturando hisopos de algodón en la taza de papel. (C) Tazas que alojan hembras gravitas aseguradas con tul negro. Haga clic aquí para ver una versión más grande de esta figura.

Figura suplementaria 5: Configuración de laboratorio para maximizar la producción de huevos. (A) Cámaras de oviposición colocadas en un banco de laboratorio bajo una luz de abrazadera con una bombilla incandescente de 40 W. (B) Se coloca un termómetro de monitorización de memoria trazable junto a las luces con el sensor de temperatura descansando en la parte superior de una cámara de oviposición situada directamente debajo de una luz de abrazadera. (C) Una jeringa subQ de 1 ml y una pequeña bebida deportiva con sabor colocada junto a las cámaras de oviposición para facilitar la refrescación de los hisopos de algodón regularmente durante todo el día. Haga clic aquí para ver una versión más grande de esta figura.

Figura suplementaria 6: Configuración de laboratorio para el cuidado y mantenimiento larvario. (A) Sistema de dos tazas con cada uno de los cuales contiene material fresco del huésped del terminal y larvas. (B) La temperatura en las copas se mantiene entre 25 oC-28 oC para una actividad larvaria óptima y el desarrollo mediante luces de sujeción aéreas con bombillas incandescentes de 40 W. (C) Se utiliza un termómetro de monitorización de memoria trazable con el sensor de temperatura colocado directamente en una taza para controlar la temperatura. Haga clic aquí para ver una versión más grande de esta figura.

Figura suplementaria 7: Cámaras de pupación preparadas. (A) Tazas individuales de porción de plástico alojados en las bandejas de vasos de plástico transparente. (B) Se coloca un cuadrado de papel corrugado en cada taza de porción de plástico. (C) Se colocará una sola larva madura en cada taza de porción de plástico preparada para pupar. Haga clic aquí para ver una versión más grande de esta figura.

Figura Suplementaria 8: Preparación de larvas para la pupación y el mantenimiento del pupal. (A) Larva madura lista para pupate en papel corrugado. Es un uniforme de color marrón verdoso uniforme y ha perdido cualquier chevron. (B) Cámaras de pupación listas para recibir larvas maduras adyacentes a tazas con larvas de alimentación. Todas las cámaras de pupación con tapas albergan larvas que se están preparando para pupar. (C) Cámaras de pupación con pusias. (D) Bancos de cámaras de pupación con pupae organizadas por fecha y mantenidas en condiciones de laboratorio. Haga clic aquí para ver una versión más grande de esta figura.

Figura suplementaria 9: Jaula de emergencia de laboratorio. (A) Una jaula de cría emergente de malla plegable que alberga las cámaras de cría ocupadas. (B) Las tapas de todas las cámaras de pupación se retiran para facilitar la eclosión adulta exitosa. (C) Todas las mariposas adultas viables resultantes serán liberadas en la jaula de vuelo con mosquiteo para asegurar la cópula exitosa. Haga clic aquí para ver una versión más grande de esta figura.

Figura suplementaria 10: Mariposa macho adulto que se cierra con éxito de la pupa en un cuadrado de papel corrugado. (A) Adulto que ecierra desde la pupa. (B) Adulto totalmente retirado de la carcasa del pupal. (C) Adulto posicionado para expandir sus alas. (D) Adulto expandiendo sus alas. Haga clic aquí para ver una versión más grande de esta figura.

Figura suplementaria 11: Quinta larva instar marcada con pintura luminosa no tóxica. (A) Se coloca una pequeña gota de pintura luminosa no tóxica y roja en contraste en el dorso utilizando un pincel para marcar con éxito la larva. Haga clic aquí para ver una versión más grande de esta figura.

Figura suplementaria 12: Configuración de la cría para el estudio de la historia de la vida. (A) Etiquetados de forma única con 2 onzas de tazas de plástico transparente. (B) Se secuestra una sola larva en cada taza. (C) Todas las larvas se rastrean individualmente a través de todas las etapas del desarrollo, desde el neonato hasta la mariposa adulta. Haga clic aquí para ver una versión más grande de esta figura.
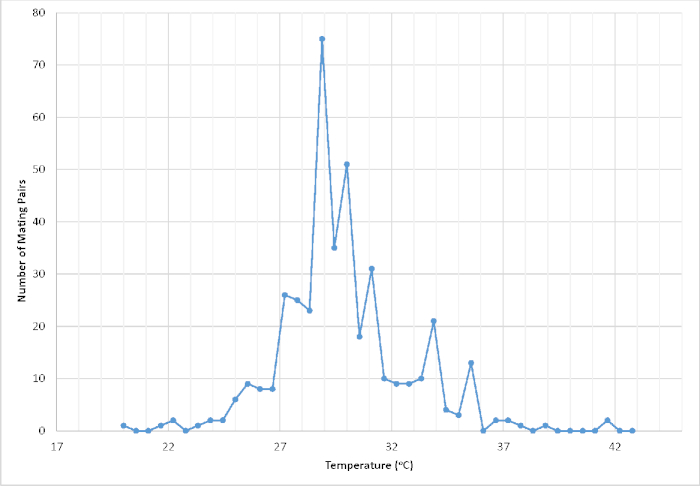
Figura 1: Número de pares registrados en cópula en función de la temperatura (C) dentro de una jaula de vuelo con protección interna en un invernadero con temperatura controlada. La temperatura se registró dentro de los primeros 2 minutos de un evento de emparejamiento exitoso (n.o 411). Los datos resultantes se utilizaron para ayudar a refinar las condiciones ambientales controladas con el fin de maximizar el éxito del acoplamiento y, en última instancia, la productividad general de propagación cautiva. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Tiempo medio de desarrollo (número de días) de cada etapa de vida inmadura. (A) Las barras muestran la media de cada grupo y las barras de error representan los valores de desviación estándar superior e inferior para cada grupo. (B) Las barras azules oscuras representan a las hembras, y el azul claro representan a los machos. Haga clic aquí para ver una versión más grande de esta figura.
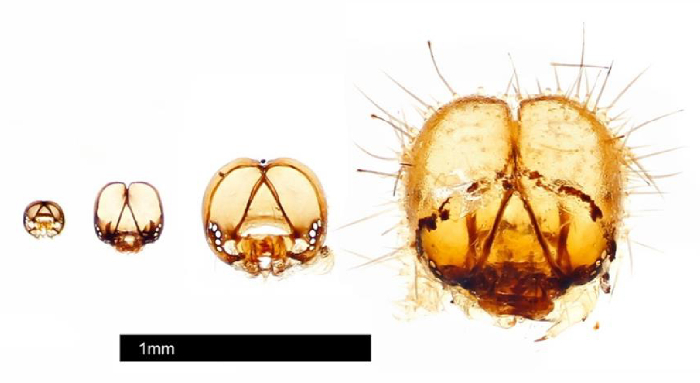
Figura 3: Cápsulas de cabeza recogidas de #25 individuales utilizando el protocolo de historia de la vida. Las cápsulas de la cabeza fueron fotografiadas por Johnathan Bremer usando un sistema de automontaje. Haga clic aquí para ver una versión más grande de esta figura.
| Etapa de vida | Longitud media del cuerpo (mm) | Error de Std. (longitud) | Tiempo medio de desarrollo (número sin días) | Error de Std. (tiempo de desarrollo) |
| Instar I | 1.69478261 (n.o 23) | 0.02152643 | 2.90625 (n-32) | 0.08229783 |
| Instar II | 2.77248958 (n-32) | 0.04302826 | 3.375 (n-32) | 0.16649857 |
| Instar III | 5.45751042 (n-32) | 0.12120829 | 3,5 (n-32) | 0.20080483 |
| Instar IV | 10.2369688 (n-32) | 0.23653991 | 3.875 (n-32) | 0.18917265 |
| Instar V | 8.7625 (n.o 2) | 2.6125 | 1,5 (n.o 2) | 0.5 |
| Instar VI | 10.2666667 (n.o 1) | Na | 3 (n-1) | Na |
| Pre-pupa | 11.0858333 (n-24) | 0.23948251 | 2.9375 (n-32) | 0.21504641 |
| Pupa | 9.0316129 (n-31) | 0.12106792 | 11.6578947 (n-38) | 0.3272288 |
Tabla 1: Duración media y tiempo de desarrollo de cada etapa de la vida. Error estándar incluido para cada variable y tamaño de muestra entre paréntesis.
| Etapa de vida | Longitud media del acorde del ala (mm) | Std. Error |
| Adulto | 12.63895 (n-38) | 0.1365516 |
| Mujer | 12.960 (n-13) | 0.1465588 |
| masculino | 12.472 (n.o 25) | 0.1863205 |
Tabla 2: Longitud media del acorde del ala de las alas delanteras para mariposas adultas. Incluye medios para las hembras, los machos y todos los adultos (ambos sexos combinados).
| LM Modelo 1 | Std. Error de estimación | valor t | valor p |
| Interceptar | 1.9179 | 3.128 | 0.0046 ** |
| Longitud media segunda instar | 0.6822 | -1.11 | 0.278 |
| Longitud media tercera estrella | 0.2928 | 0.476 | 0.6381 |
| Longitud media cuarta estrella | 0.1373 | -0.57 | 0.5739 |
| Puupas de longitud media | 0.246 | 3.957 | 0.0005 *** |
| p < 0.001; ** p < 0.01; * p < 0.05. | |||
Tabla 3: Tabla de coeficientes para el modelo de regresión lineal (LM Modelo 1) para evaluar la relación entre la longitud media de cada etapa de vida (n > 30 incluido en el análisis) y la longitud del acorde de ala adulta. Variable dependiente: longitud del acorde del ala adulta (mm).
| Coeficientes | Std. Error de estimación | valor t | Pr (>-t-) |
| Interceptar | 1.7091 | 3.031 | 0.0053 ** |
| Puupas de longitud media | 0.1878 | 4.414 | 0.0002 *** |
Tabla 4: Regresión escalonada (Paso 1). Variable dependiente: longitud del acorde del ala adulta (mm).
| LM Modelo 2 | Std. Error de estimación | valor t | valor p |
| Interceptar | 1.1888 | 12.643 | 4.21e-12 *** |
| Num. días primera instar | 0.3486 | 0.937 | 0.3583 |
| Num. días segunda instar | 0.2603 | -0.686 | 0.4993 |
| Num. días tercera estrella | 0.2281 | 1.028 | 0.3141 |
| Num. días cuarto instar | 0.2048 | 2.378 | 0.0257 * |
| Num. días pre-pupae | 0.222 | 1.133 | 0.2686 |
| Num. días pupupae | 0.2495 | 0.616 | 0.5435 |
| Total num. días | 0.1913 | -1.454 | 0.1589 |
| p < 0.001; ** p < 0.01; * p < 0.05. | |||
Tabla 5: Tabla de coeficientes para el modelo de regresión lineal (LM Model 2) para evaluar la relación entre el tiempo de desarrollo y la longitud del acorde de ala adulta. Variable dependiente: longitud del acorde del ala adulta (mm).
| Coeficientes | Std. Error de estimación | valor t | valor p |
| Interceptar | 0.89304 | 16.314 | 7.86e-16 *** |
| Num. días segunda instar | 0.17974 | -1.809 | 0.0811 • |
| Num. días cuarto instar | 0.16917 | 2.075 | 0.0473 * |
| Total num. días | 0.04184 | -1.787 | 0.0848 • |
| p < 0.001; ** p < 0.01; * p < 0.05; • p < 0,1 | |||
Tabla 6: Regresión escalonada (Paso 2) para el tiempo de desarrollo. Variable dependiente: longitud del acorde del ala adulta (mm).
Discusión
Aquí, ilustramos la eficacia de este protocolo probado de conservación ex situ para la producción en masa de mariposas en riesgo, y cómo se puede adaptar para la investigación científica para ayudar a abordar brechas clave de datos conductuales, de vida o ecológicos. Se utilizó una mayor comprensión del tiempo medio de desarrollo total (huevo a adulto), duración media en cada etapa de la vida y temperatura óptima para el apareamiento, por ejemplo, para ayudar a refinar el protocolo y mejorar el éxito general del programa. La gran mayoría de los protocolos existentes detallan únicamente los métodos de cría de organismos y no discuten la recopilación de datos, la investigación científica o el uso de dichos resultados para ayudar a informar y adaptar potencialmente los métodos ex situ.
Este protocolo requiere la cría diaria de organismos. La salud y la productividad de los organismos se maximizan mediante condiciones de crianza limpias, una falta de hacinamiento del organismo y la disponibilidad de material vegetal de origen larvaria de alta calidad. En su mayor parte, utilizamos suministros y recipientes de cría desechables (por ejemplo, vasos de papel y plástico), y normalmente los reemplazamos regularmente, a menudo a diario, y nunca reutilizamos el material. Esto es rentable y minimiza la necesidad de un saneamiento de los materiales que requiere más mano de obra. Sin embargo, las herramientas de uso común, como fórceps entomológicos, pinceles de pintura de acuarela y pequeñas jaulas de vuelo pop-up, así como todas las superficies de cría como mesas y sobrepartes de laboratorio se desinfectan regularmente con una solución de lejía del 5%. El programa exacto de saneamiento depende en gran medida de la frecuencia de uso, la fenología del organismo y otras variables, y debe adaptarse a las necesidades específicas de cada programa ex situ. Además, encontramos que el papel de carnicero blanco es útil para cubrir todas las superficies de cría. Proporciona un sustrato limpio barato y fácil de implementar, y el color de fondo blanco facilita el avistamiento de cualquier organismo extraviado. Para la cría diaria, todo el personal de laboratorio siempre debe usar guantes de examen de laboratorio desechables para minimizar la contaminación y proteger al personal de cualquier posible irritación de la piel resultante de la manipulación de plantas u organismos. Esto es particularmente crítico si cualquier personal de laboratorio tiene mascotas domésticas que requieren tratamientos tópicos para pulgas. Incluso una pequeña cantidad de residuos de ingredientes activos puede ser peligroso para el ganado cautivo.
Además, se debe tener cuidado de minimizar el hacinamiento del organismo. El hacinamiento de las larvas puede conducir rápidamente a una reducción de la salud del organismo e incluso al canibalismo en ciertos taxones, particularmente Lycaenidae. Puede ser necesario separar regularmente las larvas para reducir el número dentro de los contenedores de cría y/o incluso aislar larvas individuales como se describe en la parte de la historia de la vida del protocolo. Los números ideales por contenedor pueden variar considerablemente en función de los taxones particulares y de las diversas limitaciones del programa ex situ, como el presupuesto disponible, las instalaciones de laboratorio y el número total de personal de cría. También recomendamos dejar un espacio adecuado entre las tazas que albergan larvas para minimizar el potencial de movimiento del organismo entre los recipientes. Por último, para poblaciones cautivas más grandes, se recomienda encarecidamente separar el stock entre una o más instalaciones de laboratorio. Esta estrategia de salvaguardia puede ayudar a minimizar la pérdida catastrófica de toda la población debido a enfermedades u otros impactos imprevistos.
La calidad y disponibilidad de las plantas anfitrionas de la larva impulsa la producción ganadera e influye fuertemente tanto en las tasas de desarrollo larvaria como en la salud general de la población. No obstante, pocos informes o estudios publicados ponen de relieve este requisito entre bastidores o discuten las mejores prácticas de guardería. La planificación exitosa del programa ex situ debe tener en cuenta las cantidades, la producción y el mantenimiento adecuados del centro. Como muchas larvas también requieren o prefieren ciertas partes de las plantas (por ejemplo, nuevo crecimiento terminal, brotes de flores e inflorescencias, frutas, etc.), se requiere una puesta en escena eficaz para garantizar la fenología vegetal adecuada.
Otras consideraciones incluyen el manejo demográfico y genético adecuado, y la minimización de los posibles efectos negativos del cautiverio. Recomendamos el desarrollo de un plan de manejo genético. Esto puede incluir estrategias para incluir la infusión de nuevo material genético de forma regular, maximizar la diversidad y prevenir la endogamia cercana, evaluar periódicamente las variables clave de la aptitud del organismo y monitorear la genética a algún nivel para permitir la comparación con las poblaciones existente y verificar la salud de las poblaciones cautivas. La comparación periódica de las características de los individuos cautivos con los individuos de las poblaciones fundadoras también está justificada34,35.
Estos protocolos representan prácticas recomendadas comprobadas. Deben ser beneficiosos para una variedad de investigadores y profesionales de la conservación que pueden aplicar o adaptar directamente nuestros métodos a sus propios estudios y programas de conservación y recuperación de mariposas o insectos en riesgo ex situ. El protocolo específico de cría en cautividad es probablemente más aplicable a los programas centrados en otros Lycaenidae, taxones relacionados o taxones de menor tamaño. Sin embargo, numerosos componentes como los que implican asegurar el cortejo y la cópula exitosos, el mantenimiento de adultos con néctar artificial, la maximización de la oviposición y el cuidado larvarios generales podrían aplicarse o adaptarse más ampliamente a una gama más amplia de taxones. Como se mencionó anteriormente, si bien debe hacerse hincapié en la flexibilidad del protocolo, el acceso a otras metodologías establecidas puede ayudar a proporcionar información valiosa y un punto de partida viable para la adaptación y la innovación. Se podría tener una amplia aplicabilidad a otros programas de reproducción de conservación y a los taxones en riesgo. Animamos a otros a ayudar a abordar las brechas clave de datos ecológicos cuando sea posible y a publicar protocolos y resultados de programas examinados.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por subvenciones de la Iniciativa de Recuperación de la Conservación del Servicio de Pesca y Vida Silvestre de los Estados Unidos (F17AP00467) y el Fondo de Conservación de Disney. El Apoyo adicional fue proporcionado por el Museo de Historia Natural de Florida y el Departamento de Entomología y Nematología de la Universidad de Florida.
Materiales
| Name | Company | Catalog Number | Comments |
| 12 oz plain white paper cups (Karat) | Lollicup | C-KC16 | |
| 15-Amp 2-Outlet Mechanical Residential Plug-in Countdown Lighting Timer | Lowes | UTTNI2423 | |
| 1ml sub-Q syringes (0.45 mm x 16 mm) | Fisher Scientific | 14-829-10F | |
| 2 oz clear plastic portion cup lids | Party City | #791091 | |
| 2 oz Clear Plastic Portion Cups | Party City | #791088 | |
| 34.29 cm x 34.29 cm x 60.96 cm collapsible mesh popup rearing cage | Bioquip | 1466BV | |
| 8.5" 1-Watt Incandescent Clamped Work Light | Lowes | PTC301L | |
| Adoric Electronic Digital Caliper | Amazon.com | B07QX2SK2F | |
| Big Kid's Choice Arts & Crafts Brush Set-12/Pkg, assorted sizes | Walmart | #10965135 | |
| Clear Plastic Cup Tray | Frontier Scientific Services | AG_9040 | |
| Fisher Scientific traceable memory monitoring thermometer | Fisher Scientific | 15-077-8D | |
| Forceps, Straight Points, Swiss Style #4, Stainless | BioQuip | 4531 | |
| Humco Glycerin 6 oz | Walmart | #303951037966 | |
| Luminous Paint Kit, Blue, Red, Yellow, 4 Dram | Bioquip | 1166A | |
| Melon flavored Gatorade Fierce Thirst Quencher or fruit punch flavored Gatorade Thirst Quencher sports drink | Walmart | #568456137 | |
| Neoteck Digital 2 in 1 Hygrometer-Thermometer | Amazon.com | NTK026 | |
| Olympus 0.6 ml Microtubes, Clear, Polypropylene, Nonsterile | Amazon.com | 24-272C | |
| Plastic Tank Sprayer | Lowes | #5318 | |
| Q-tips Cotton swabs | Walmart | #551398298 | |
| Rectangular plastic tupperware container with lid (Rubbermaid) | Walmart | #554320171 | |
| Showgard 903 Stamp Tongs, 4 5/8 inch Spade Tip | Amazon.com | #787793151378 | |
| Single face corrugated paper roll | Amazon.com | BXSF12 | |
| Snap blade utility knife | OLFA | #5023 | |
| Solo 9 oz plastic cups | Solo | SQ950 | |
| Thorton Plastics 50 dram clear plastic snap cap vial (6.25 oz.) | Thorton Plastics | #50 | |
| Tulle Spool 9 inch x 150 feet - Black | Jo Ann Fabrics | #16029696 | |
| Zep 32 oz Plastic Spray Bottle | Lowes | HDPRO36 |
Referencias
- Thomas, J. A. Butterfly communities under threat. Science. 352 (6296), 216-218 (2016).
- Swengel, S. R., Schlicht, D., Olsen, F., Swengel, A. B. Declines of prairie butterflies in the Midwestern USA. Journal of Insect Conservation. 15 (1-2), 327-339 (2011).
- Habel, J. C., et al. Butterfly community shifts over two centuries. Conservation Biology. 30 (4), 754-762 (2016).
- Gilburn, A. S., et al. Are neonicotinoid insecticides driving declines of widespread butterflies? Peer J. 3, e1402(2015).
- Sánchez-Bayo, F., Wyckhuys, K. A. G. Worldwide decline of the entomofauna: A review of its drivers. Biological Conservation. 232, 8-27 (2019).
- Daniels, J. C., Magdich, M., Tolson, P. Butterfly recovery planning: Determining how to contribute. Butterfly Conservation in North America: Efforts to Help Save Our Charismatic Microfauna. Daniels, J. C. , Springer Science+Business Media B.V. New York. 1-21 (2015).
- U.S. Fish and Wildlife Service. Environmental Conservation Online System. Listed Animals. , https://ecos.fws.gov/ecp (2019).
- Schultz, C. B., Russell, C., Wynn, L. Restoration, reintroduction and captive propagation efforts for at-risk butterflies: a review. Israel Journal of Ecology and Evolution. 54, 41-61 (2008).
- Grow, S., Allard, R., Luke, D. The role of AZA-accredited zoos and aquariums in butterfly conservation. Butterfly Conservation in North America: Efforts to Help Save Our Charismatic Microfauna. Daniels, J. C. , Springer Science+Business Media B.V. New York. 23-34 (2015).
- Crone, E. E., Pickering, D., Schultz, C. B. Can captive rearing promote recovery of endangered butterflies? An assessment in the face of uncertainty. Biological Conservation. 139, 103-112 (2007).
- Sanchez, S. J., Daniels, J. C. The butterfly conservation initiative: Developing a new conservation vision through compound eyes. News of the Lepidopterists' Society. 49 (3), 75-77 (2007).
- Wardlaw, J. C., Elmes, G. W., Thomas, J. A. Techniques for studying Maculinea butterflies: I. Rearing Maculinea caterpillars with Myrmica ants in the laboratory. Journal of Insect Conservation. 2 (1), 79-84 (1998).
- Mattooni, R., Longcore, T., Krenova, Z., Lipman, A. Mass rearing the endangered Palos Verdes blue butterfly (Glaucopsyche lygdamus palosverdesensis:Lycaenidae). Journal of Research on the Lepidoptera. 37, 55-67 (1998).
- Pearce-Kelly, P., et al. The captive rearing of threatened Orthoptera: a comparison of the conservation potential and practical considerations of two species' breeding programmes at the Zoological Society of London. Journal of Insect Conservation. 2 (3-4), 201-210 (1998).
- Wells, C. N., Edwards, L., Hawkins, R., Smith, L., Tonkyn, D. A rearing method for Agrynnis (Speyeria) diana (Lepidoptera: Nymphalidae) that avoids diapause. Psyche. , 1-6 (2011).
- Grosboll, D. N. Captive Rearing the Endangered Mardon Skipper (Polites mardon) and Taylor's Checkerspot (Euphydryas editha taylori) Butterflies: Initial Results (Lepidoptera, Nymphalidae). Proceedings of the species at risk, pathways to recovery conference. , Species at Risk Pathways to Recovery Conference Organizing Committee. Victoria. 1-6 (2004).
- Barclay, E., Arnold, M., Andersen, M., Shepherdson, D. Husbandry manual: Taylor's checkerspot (Euphydryas editha taylori). , 1st edition, Oregon Zoo. Portland, Oregon. (2009).
- Johnson, J., et al. Captive Rearing of the Laguna Mountains Skipper (Pyrgus ruralis laguanae): Final Report. , (2010).
- Linders, M. Captive rearing and translocation of Taylor's checkerspot in South Puget Sound: 2011-2012. 2012 Annual Progress Report to the ACUB Technical Review Committee. , (2012).
- Linders, M., Lewis, K. Captive rearing and translocation of Taylor's checkerspot butterfly (Euphydryas editha taylori.): South Puget Sound, Washington, 2012–2013. 2013 Annual Report to the US Fish and Wildlife Service (Cooperative Agreement F12ACI00835), Joint Base Lewis-McChord Fish and Wildlife Program and JBLM-ACUB Technical Review Committee. , (2013).
- Department of Conservation and Research, Toledo Zoo. Propagation Handbook for the Karner Blue Butterfly Lycaeides melissa samuelis. , Fourth edition, (2006).
- Johnson, J. J., et al. Captive Rearing of Lange's Metalmark Butterfly, 2011-2015. United States Fish and Wildlife Service, CVPIA Habitat Restoration Program (F11AP00168). , (2016).
- Andersen, M. J., et al. Oregon Silverspot Butterfly Husbandry Manual. , Oregon Zoo. Portland, Oregon. (2010).
- Washington Department of Fish and Wildlife. Threatened and Endangered Wildlife in Washington: 2012 Annual Report. Listing and Recovery Section, Wildlife Program, Washington Department of Fish and Wildlife. , Olympia. (2013).
- McGowan, P. J. K., Traylor-Holzer, K., Leus, K. IUCN guidelines for determining how ex situ management should be used in species conservation. Conservation Letters. 10 (3), 361-366 (2017).
- Pearce-Kelly, P., et al. The conservation value of insect breeding programmes: Rationale, evaluation tools and example programme case studies. Insect Conservation Biology: Proceedings of the Royal Entomological Society's 23nd Symposium. Stuart, A. J. A., New, T. R., Lewis, O. T., et al. , 57-75 (2007).
- U.S. Fish and Wildlife Service. Policy Regarding Controlled Propagation of Species Listed Under the Endangered Species Act. United States Federal Register. 65 (183), 56916-56922 (2000).
- IUCN/SSC. Guidelines on the use of ex situ management for species conservation. Version 2.0. IUCN Species Survival Commission. , Gland, Switzerland. (2014).
- Sutherland, W. J., Pullin, A. S., Dolman, P. M., Knight, T. M. The need for evidence-based conservation. Trends in Ecology & Evolution. 19 (6), 305-308 (2004).
- Daniels, J. C., Nordmeyer, C., Runquist, E. Improving standards for at-risk butterfly translocations. Diversity. 10, 67(2018).
- Saarinen, E. V. Population genetics of the endangered Miami blue butterfly Cyclargus thomasi bethunebakeri.: implications for conservation. , University of Florida. Gainesville. (2009).
- Becker, T. Propagation and repatriation of the regal fritillary butterfly. , http://titag.org/2016/2016papers/beckerregal.pdf (2019).
- R Core Team. R A Language and Environment for Statistical Computing. R Foundation for Statistical Computing. , Vienna, Austria. (2016).
- Schultz, C. B., Dzurisin, J. D., Russell, C. Captive rearing of Puget blue butterflies (Icaricia icarioides blackmorei) and implications for conservation. Journal of Insect Conservation. 13 (3), 309-313 (2009).
- Frankham, R., Loebel, D. A. Modeling problems in conservation genetics using captive Drosophila populations: Rapid genetic adaptation to captivity. Zoo Biology. 11 (5), 333-342 (1992).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados