Method Article
Enfriar o calentar el esófago para reducir la lesión esofágica durante la ablación auricular izquierda en el tratamiento de la fibrilación auricular
En este artículo
Resumen
El objetivo de este protocolo es describir el uso de la modulación de la temperatura esofágica para contrarrestar la lesión térmica esofágica de la ablación auricular izquierda para el tratamiento de la fibrilación auricular.
Resumen
La ablación de la aurícula izquierda utilizando radiofrecuencia (RF) o energía criotérmica es un tratamiento eficaz para la fibrilación auricular (AF) y es el tipo más frecuente de procedimiento de ablación cardíaca realizado. Aunque generalmente es seguro, las lesiones colaterales a las estructuras circundantes, particularmente el esófago, siguen siendo una preocupación. Enfriar o calentar el esófago para contrarrestar el calor de la ablación de RF, o el frío de la crioablación, es un método que se utiliza para reducir la lesión esófago térmica, y hay datos crecientes para apoyar este enfoque. Este protocolo describe el uso de un dispositivo de control de temperatura esofágica disponible comercialmente para enfriar o calentar el esófago para reducir la lesión esofágica durante la ablación auricular izquierda. El dispositivo de gestión de temperatura es alimentado por intercambiadores de calor estándar de manta de agua, y tiene la forma de un tubo orogástrico estándar colocado para succión y descompresión gástrica. El agua circula a través del dispositivo en un circuito de bucle cerrado, transfiriendo calor a través de las paredes de silicona del dispositivo, a través de la pared esofágica. La colocación del dispositivo es análoga a la colocación de un tubo orogástrico típico, y la temperatura se ajusta a través de la consola externa del intercambiador de calor.
Introducción
La ablación auricular izquierda para realizar el aislamiento de venas pulmonares (PVI) se utiliza cada vez más para el tratamiento de la fibrilación auricular1. El logro de LA IPv se puede lograr con energía de radiofrecuencia (RF) para quemar tejido auricular o con la aplicación directa de energía criotérmica; sin embargo, el daño colateral a las estructuras circundantes sigue siendo un riesgo con cualquiera de los dos métodos, siendo la lesión esofágica una de las más graves2,3,4. La lesión esofágica más extrema, la fístula atrioesofágica (AEF), sigue siendo difícil de prevenir y diagnosticar, y conlleva una mortalidad muy alta5,6.
Se han utilizado varias técnicas para reducir el riesgo de AEF, incluida la reducción de la potencia aplicada a regiones vulnerables, el control de la temperatura esofágica luminal (LET), la desviación del esófago durante la ablación y el enfriamiento o calentamiento del esófago7. Contrarrestando directamente la energía térmica suministrada al esófago, principalmente mediante refrigeración contra la calefacción RF, se ha utilizado en una variedad de formatos8,9,10,11,12,13,14,15,16. Una ventaja para el enfriamiento durante la ablación de RF o el calentamiento durante la crioablación es que se toma un enfoque preventivo de las lesiones, en contraste con el monitoreo de la temperatura, que implica un enfoque reactivo (detener la ablación cuando la temperatura sube). El enfoque reactivo, aunque se utiliza a menudo, puede ser de eficacia limitada17, con una revisión reciente señalando que las sondas de sensores discretos disponibles actualmente, ya sean simples o múltiples, no parecen reducir significativamente las tasas de lesiones7. El enfriamiento o el calentamiento también evitan la necesidad de pausas de procedimiento y manipulación de dispositivos requeridas con técnicas de desviación esofágica, que se han informado que causan traumas esofágico e implican dificultades en el uso18,,19. Un meta-análisis reciente de enfriamiento esofágico con el propósito de proteger el esófago durante la ablación RF encontró una reducción del 61% en la formación de lesiones de alto grado en un total de 494 pacientes20. Un ensayo reciente controlado al azar encontró una reducción estadísticamente significativa del 83% en lesiones identificadas endoscópicamente cuando se utiliza un dispositivo de refrigeración dedicado en comparación con la monitorización LET estándar21.
El objetivo de este protocolo es demostrar el uso de enfriamiento esofágico o calentamiento durante la radiofrecuencia auricular izquierda o crio-ablación utilizando un dispositivo de gestión de la temperatura esofágica(Figura 1).
Protocolo
Este protocolo sigue las directrices del comité de ética de la investigación humana de la institución local cuando corresponda.
1. Evaluación antes de la colocación
NOTA: Bajo el etiquetado actual de los Estados Unidos, no hay contraindicaciones formales enumeradas. En el caso de la patología esofágica, como deformidad, traumatismo o ingestión reciente de cáusticas o material ácido, se recomienda precaución.
- Asegúrese de que el equipo necesario, como el intercambiador de calor, el dispositivo de gestión de temperatura esofágica y la lubricación a base de agua, estén disponibles.
- Conecte el dispositivo de gestión de temperatura esofágica al intercambiador de calor a través de los conectores del dispositivo y encienda la unidad, colocándola en modo manual. Asegúrese de que el agua fluye a través del dispositivo de gestión de la temperatura esofágica y confirme la ausencia de fugas.
2. Colocación
- Determine la profundidad de inserción adecuada para el dispositivo de gestión de temperatura esofágica de manera similar a la del tubo orogástrico estándar. Mida desde los labios del paciente hasta el lóbulo de la oreja y desde el lóbulo de la oreja hasta el proceso de xifoide y observe esta profundidad en el dispositivo(Figura 2).
- Utilice lubricante soluble en agua para lubricar generosamente el dispositivo de gestión de la temperatura esofágica, al menos 15 cm y hasta 25 cm del extremo distal(Figura 3).
NOTA: Los pacientes suelen estar bajo anestesia inhalatoria general (por ejemplo, el uso de sevoflurano), pero también pueden estar bajo anestesia intravenosa (por ejemplo, el uso de propofol), o en algunos casos bajo sedación consciente (por ejemplo, el uso de meperidina o midazolam). - Si es posible, extienda la cabeza del paciente para facilitar aún más la inserción del dispositivo de control de temperatura esofágica utilizando una presión suave aplicada hacia atrás y hacia abajo, más allá de la orofaringe y en el esófago. Levantar la mandíbula anteriormente puede ayudar a la paso del dispositivo, al igual que una reducción de la presión en el manguito ETT si se infla en exceso. Aplique presión ligera sobre el dispositivo según sea necesario para alcanzar la profundidad de colocación deseada. (Figura 4).
- Determine la ubicación de colocación por fluoroscopia para comprobar si la punta del dispositivo está por debajo del diafragma(Figura 5).
- Asegure las mangueras de agua y el dispositivo para evitar el desmontaje accidental; un método común es colocar la manguera de conexión debajo del apoyabrazos de espuma izquierdo del paciente.
- Si se desea descompresión estomacal, conecte el lumen central a una succión de baja intermitente utilizando tubos de aspiración estándar.
3. Modulación de temperatura — Ablación RF
- Asegúrese de que el intercambiador de calor esté configurado en modo manual y que se ajuste la temperatura del agua adecuada. Por ejemplo, en un intercambiador de calor típico, presione el botón Control de temperatura y, a continuación, utilice las flechas arriba/abajo para seleccionar la temperatura del agua objetivo. Una vez que la pantalla digital muestre la temperatura deseada, inicie el flujo de agua pulsando el botón Control manual. Un objetivo típico es la temperatura del agua de 4 oC cuando se realiza la ablación por radiofrecuencia en la pared auricular posterior izquierda.
- Para anticipar el tiempo necesario para que el intercambiador de calor reduzca la temperatura, utilice un punto de consigna de temperatura del agua de aproximadamente 14 oC para la inserción inicial en casos de RF mientras espera la punción transseptal. Después de la punción transseptal, y aproximadamente 15-20 minutos antes de la aplicación de energía RF a la pared auricular posterior, cambie el punto de consigna de temperatura del agua a 4 oC (en modo manual).
NOTA: Para efectos antiinflamatorios adicionales del enfriamiento que pueden reducir la gastroparesia o el dolor torácico después del procedimiento, los operadores pueden mantener el punto de consigna de temperatura del agua a 4 oC durante 20 minutos después de la finalización de la ablación posterior de la pared, momento en el que el máquina se puede apagar.
4. Modulación de temperatura — Crioablación
- Para la crioablación, utilice un punto de consigna de temperatura del agua de 42 oC (típico).
- Ajuste esta temperatura del agua poco después de la colocación (colocar mientras que el frío es generalmente más fácil debido al aumento de la rigidez del dispositivo), y continuar durante toda la caja, proporcionando calentamiento adicional del paciente para contrarrestar el efecto de enfriamiento sistémico de la crioablación.
5. Monitoreo de la temperatura del paciente
NOTA: Debido a que la temperatura en el esófago se modula por la presencia de un dispositivo de transferencia de calor esofágico, se recomienda una ubicación diferente para la medición de la temperatura del paciente. Las opciones para la medición de la temperatura del paciente incluyen el termómetro nasofaríngeo (asegúrese de que la profundidad sea inferior a 10 cm), sensor de temperatura Foley, sensor de temperatura rectal, termómetro de membrana timpánica o termómetro de la frente (incluyendo flujo cero termometría).
- Para mantener la temperatura del paciente cuando utilice enfriamiento esofágico, utilice modalidades de calentamiento suplementario, como mantas de calentamiento o cubrecabezas si es necesario. Durante el calentamiento esofágico al realizar la crioablación, la temperatura del paciente generalmente permanecerá en un rango normotérmico.
6. Solución de problemas
- Asegúrese de que no se produzca ningún bloqueo del flujo de agua y de que la rueda de paletas de agua, si está presente, esté girando continuamente o que la alarma de bajo caudal no esté activada.
- El bloqueo del flujo de agua en el sistema hará que la rueda de paleta deje de girar y una alerta de oclusión en el intercambiador de calor externo Detenga el tratamiento y determine la ubicación y la causa de la obstrucción. Si es necesario, retire y reemplace el dispositivo de gestión de la temperatura esofágica.
- Confirme el flujo de agua a la temperatura correcta comprobando el punto de consigna y tocando el dispositivo para garantizar una presión adecuada (el dispositivo estará firme) y la temperatura adecuada.
7. Eliminación del dispositivo
- Pulse el botón correspondiente para pausar el flujo de agua; esto puede estar etiquetado como "Monitor" o "Temp Set", pero puede variar según el modelo.
- Si está presente, cierre las abrazaderas en el conjunto de mangueras y/o el tubo del dispositivo, y retire el dispositivo del paciente tirando suavemente de la vista anterior de manera similar a la eliminación estándar del tubo orogástrico.
- Apague la unidad de intercambio de calor a través del interruptor de alimentación antes de desconectarla de la alimentación de la pared.
- Desconecte los conectores de la manguera de agua del dispositivo y deseche según la política institucional (normalmente a través de un contenedor de residuos contaminado).
Resultados
Se ha estudiado a un gran número de pacientes utilizando enfriamiento esofágico mediante instilación directa de líquido frío en el esófago durante la ablación de RF (por ejemplo, inyectando un bolo de 20 ml de salina helada a través de un tubo orogástrico en el esófago superior cuando la LET aumentó en 0,5 oC por encima del nivel basal). Los resultados de un metaanálisis de estudios existentes utilizando esta técnica se resumen en la Figura 620.
Los datos de un ensayo clínico controlado aleatorizado que evalúa un dispositivo de refrigeración dedicado se presentaron recientemente y se resumen en la Tabla 121. Los parámetros de ablación para los brazos de control y tratamiento, respectivamente, fueron los siguientes: duración de RF, 14,1 frente a 14,5 min; fuerza media, 19,1 frente a 17,8 g, potencia máxima de RF, 33,9 frente a 34,1 W e índice de ablación media, 394 frente a 384, con todas las diferencias no significativas. Todos los pacientes tenían IV con conjuntos de lesiones adicionales cuando fue necesario. En el momento de la presentación, no se encontró ninguna diferencia en la tasa de recurrencia de la fibrilación auricular a los 6 meses entre los dos grupos (4/27 en el grupo de control, 3/17 en el grupo de tratamiento).
Ejemplo de resultado de ablación RF:
Una mujer de 59 años con antecedentes médicos de hiperlipidemia, diabetes y fibrilación auricular paroxística recurrente presentada para un procedimiento de ablación de RF. Se colocó un dispositivo de transferencia de calor esofágico que circulaba agua de 14oC en el esófago, con un punto de consigna reducido a 4oC después de la punción transseptal, aproximadamente 8 minutos antes del inicio de la ablación. La ablación se realizó utilizando un sistema de mapeo tridimensional y un catéter de ablación de 3,5 mm para el aislamiento de venas pulmonares segmentadas. Se utilizó un ajuste de 30 W en el aspecto posterior de las venas pulmonares, con hasta 40 W en la anterior, con una duración de hasta 20 s. PVI, así como aislamiento lineal de la pared posterior (lesión de caja). La temperatura del paciente se midió a través de una sonda nasofaríngea colocada menos de 10 cm en las nares, con una temperatura de inicio del paciente de 36,4oC y una temperatura final de 36,1oC. Aproximadamente 20 minutos después de la finalización de la ablación en la pared posterior, el punto de consigna del dispositivo de transferencia de calor esofágico se elevó a 40 oC para proporcionar calentamiento del paciente mientras se retiraban las vainas de acceso y se completó el cierre vascular. La endoscopia realizada al día siguiente como parte de un protocolo de investigación no demostró lesiones esofágicas.
Ejemplo de resultado de crioablación:
Un hombre de 68 años con antecedentes médicos de hipertensión y episodios crecientes de fibrilación auricular paroxística presentados para la ablación criopulo. Se colocó agua en el esófago un dispositivo de transferencia de calor esofágico que circulaba a temperatura ambiente (22 oC) en el esófago. Una vez colocada, la temperatura de consigna se elevó a 42 oC. Las ablaciones se realizaron con un sistema de crioballoon. La temperatura inicial del núcleo del paciente se midió a 36,3 oC a través del sensor de temperatura del catéter Foley. Las temperaturas en el esófago se midieron con una sonda de temperatura de un solo sensor (no se recomienda el uso rutinario de un dispositivo de sonda de temperatura coubicado con el dispositivo de transferencia de calor, ya que el beneficio óptimo se obtiene con contacto completo entre la transferencia de calor mucosa esofágica, pero se describe aquí para mostrar el efecto en la prevención de disminuciones excesivas de temperatura). Comenzando con la crioablación en la vena pulmonar superior izquierda, la temperatura inicial del esófago medida fue de 38,6 oC y alcanzó un nadir de 36,4 oC durante la crioablación. La temperatura del globo de Nadir fue de -51 oC. Bloque se obtuvo en menos de 30 s, con una sola congelación de 180 segundos realizada. En la vena pulmonar inferior izquierda, la temperatura inicial fue de 38,5 oC y alcanzó un mínimo de 38,0 oC después de dos ciclos de tratamiento (se realizó una congelación adicional de 120 s debido al retraso en la obtención del bloque en la congelación inicial hasta 70 s). La temperatura del globo de Nadir fue de -48 oC. En la vena pulmonar superior derecha, la temperatura inicial del esófago fue de 38,4 oC, se mantuvo sin cambios durante dos ciclos y terminó a 38,5 oC. La temperatura del globo de Nadir fue de -47 oC. Por último, en la vena pulmonar inferior derecha, la temperatura inicial del esófago fue de 38,9oC y alcanzó un nadir de 38,8oC a lo largo de dos ciclos de tratamiento. La temperatura del globo de Nadir fue de -39 oC. La temperatura del paciente al final del procedimiento fue de 36,0oC, y todos los tratamientos con crioglobo sostenidos mantuvieron una temperatura esofágica muy por encima de los umbrales de parada comunes (15 oC a 25 oC).
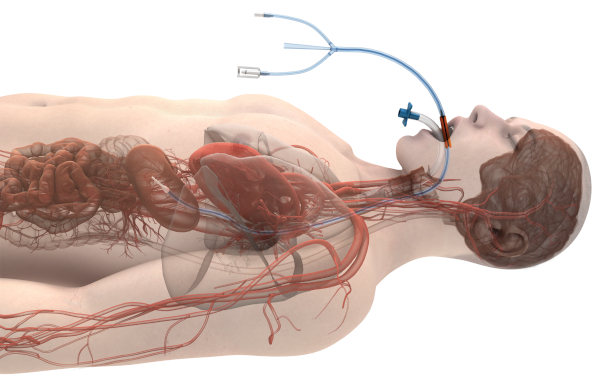
Figura 1: Imagen del dispositivo de gestión de temperatura esofágica in situ (con permiso de Attune Medical). Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Medición de la profundidad de inserción adecuada para el dispositivo de gestión de temperatura esofágica. Esto se realiza extendiendo el dispositivo desde los labios del paciente hasta el lóbulo de la oreja y luego desde el lóbulo de la oreja hasta la punta del proceso de xifoide, y luego marcando la profundidad de inserción en el dispositivo. Haga clic aquí para ver una versión más grande de esta figura.
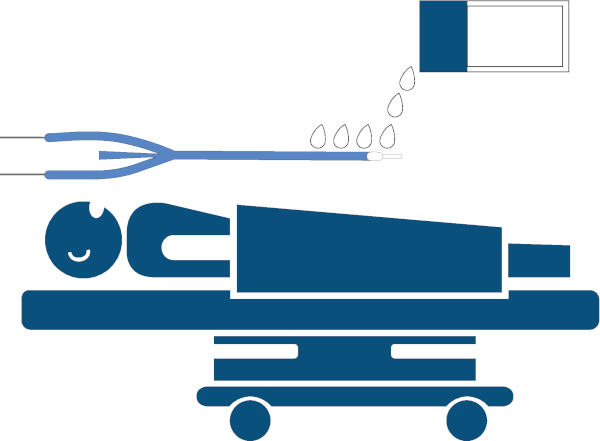
Figura 3: Lubricación del dispositivo. Lubricación del dispositivo de gestión de la temperatura esofágica, aplicando generosamente aproximadamente lubricante a 25 cm del extremo distal con lubricante soluble en agua. Haga clic aquí para ver una versión más grande de esta figura.
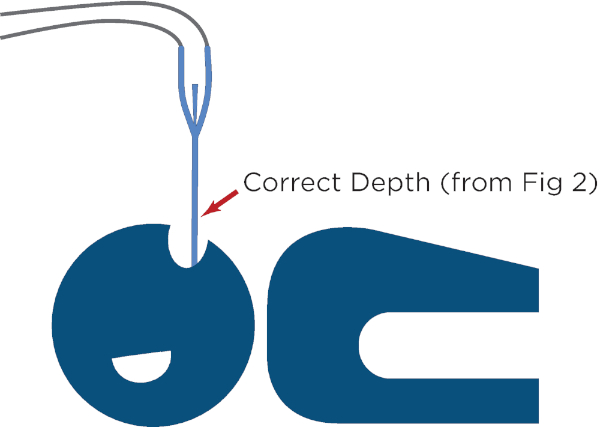
Figura 4: Avance del dispositivo con presión ligera, hasta que se haya insertado la longitud requerida del tubo. Haga clic aquí para ver una versión más grande de esta figura.
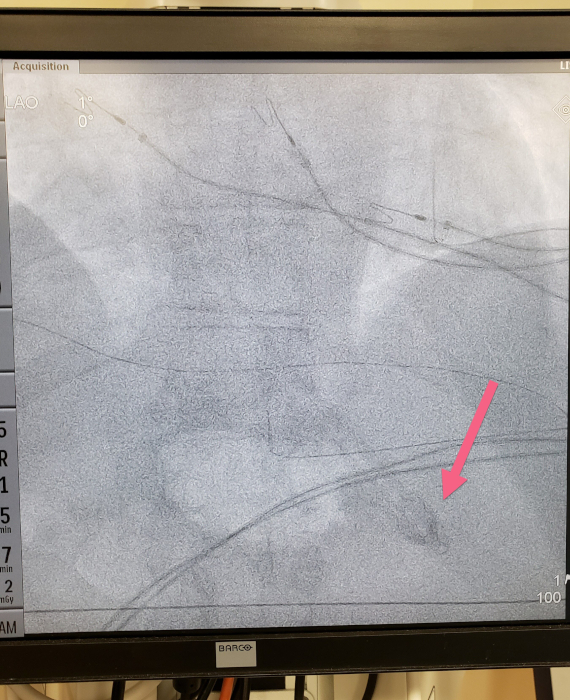
Figura 5: Imagen fluoroscópica que demuestra la punta del dispositivo debajo del diafragma. Haga clic aquí para ver una versión más grande de esta figura.
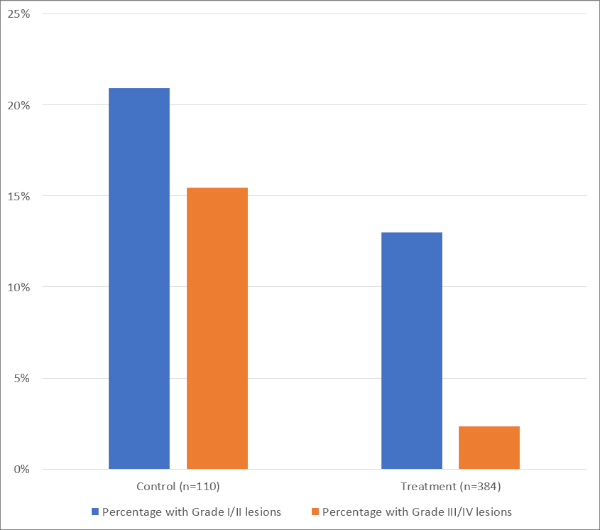
Figura 6: Resumen de los datos del metanálisis de estudios sobre enfriamiento esofágico utilizando la insinstación directa de líquidos. Haga clic aquí para ver una versión más grande de esta figura.
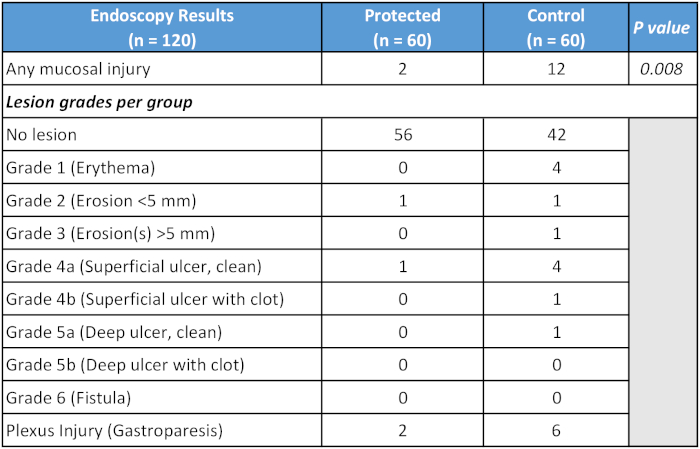
Tabla 1: Resumen del resultado primario del estudio controlado aleatorio del dispositivo de refrigeración esofágica dedicado.
Discusión
La modificación del procedimiento de colocación puede ser necesaria engarzando el tubo de salida de agua, aumentando la rigidez del dispositivo de intercambio de calor durante la colocación. La identificación de qué tubo de conexión es flujo de salida de agua se puede realizar engarzando cualquiera de los tubos y examinando para ver qué hace que el dispositivo se endurezca, y lo que hace que el dispositivo se ablande. El prensado del tubo de entrada disminuirá el flujo de entrada de agua y suavizará el dispositivo, engarzar la salida aumentará la contrapresión del agua y la endurecerá.
Las limitaciones de este método de modulación de la temperatura esofágica para contrarrestar las lesiones térmicas de la ablación auricular izquierda incluyen la limitación inherente de transferencia de calor de cualquier tecnología. Aunque la modulación de la temperatura de todo el cuerpo se puede lograr con el intercambio de calor esofágico, todavía existe el potencial de superar esta capacidad de transferencia de calor si se utiliza suficiente energía en la ablación. Como tal, no se recomiendan cambios con los parámetros de ablación estándar, y se debe mantener la técnica de ablación habitual. En general, el dispositivo se utiliza en pacientes que están endotraquealmente intubados; sin embargo, una serie de sitios utilizan este protocolo en pacientes bajo sedación consciente sin dificultad22. Por último, sigue habiendo cierta incertidumbre en cuanto a los factores necesarios para la formación de la fístula, y los aspectos más allá del intercambio de energía pueden estar involucrados.
El uso de modulación directa de la temperatura esofágica para prevenir lesiones esofágicas durante la ablación auricular se ha utilizado en varias formas en los últimos años. El uso más común ha sido en la refrigeración durante la ablación RF, ya sea utilizando dispositivos de globo o instantación directa de fluido frío8,9,10,11,12,13,14,15. El uso más reciente se ha centrado en el calentamiento para contrarrestar las lesiones criotérmicas durante la crioablación23,,24,,25,26. El uso de un dispositivo de transferencia de calor esofágico dedicado como se describe en este protocolo ofrece la ventaja de apuntar a temperaturas específicas en el esófago, evitando los riesgos significativos y la carga de trabajo logística de la instilación directa de líquido libre en el tracto gastrointestinal.
Las aplicaciones futuras de este método incluyen el apalancamiento de los efectos proteicos conocidos de la modulación de la temperatura del paciente, en particular la reducción de temperatura27,28. Dados los bien descritos efectos protectores de la hipotermia en las neuronas lesionadas, una aplicación adicional puede implicar la reducción de la disfunción cognitiva postoperatoria29,30,31,32. Datos recientes en la literatura de quemaduras revisando 2.495 pacientes destacan la importancia de enfriar la lesión térmica en la reducción de la profundidad de quemadura, injerto y requisitos operativos, señalando que los mecanismos implican algo más que disipación de calor, pero también la alteración del comportamiento celular a través de la disminución de la liberación de lactato e histamina, estabilización de los niveles de trombogenano y prostaglandina, e inhibiendo la actividad de kallikrein33. Si existen mecanismos de acción similares en el esófago, es posible que se anticipen beneficios adicionales a las estructuras circundantes. Los hallazgos preliminares y los datos anecdóticos sugieren que los efectos antiinflamatorios de la refrigeración pueden reducir el tamaño del infarto después de ciertos subconjuntos de lesión miocárdica, disfunción renal después del trasplante, la aparición de pericarditis postoperatoria y la tasa de gastroparesia post-procedimiento34,,35,36,37.
Los pasos críticos incluyen asegurar (a) la colocación adecuada del dispositivo de transferencia de calor (b) el punto de consigna adecuado de la temperatura del agua, y (c) la circulación continua del agua a través del dispositivo de transferencia de calor. La colocación adecuada del dispositivo se confirma fácilmente con fluoroscopia, con especial atención hacia la región epigástrica cerca de donde se espera que termine la punta del dispositivo de intercambio de calor. La temperatura del agua se ajusta fácilmente en la consola del intercambiador de calor, teniendo en cuenta que pueden ser necesarios hasta 7-10 min para que el agua circulante alcance la temperatura de consigna desde la temperatura de arranque. La circulación continua de agua es necesaria para que el dispositivo transfiera correctamente el calor. La circulación del agua se puede confirmar mediante la visualización de la rueda de paletas de flujo de agua giratoria presente en algunos modelos de intercambiadores de calor. En los modelos de intercambiadores de calor que carecen de una rueda de paleta de flujo de agua, se activará una alarma cuando se obstruya el flujo. Una posible causa de obstrucción del flujo de agua es la colocación inadecuada del dispositivo de intercambio de calor (si se coloca demasiado profundo, causando flexión/torcedura del tubo en el estómago distal, o en casos más raros, si se permite enrollar y doblar en la orofaringe o el esófago proximal durante la colocación). La solución de problemas en este caso implica una visualización simple bajo fluoroscopia para determinar el nivel de ubicación y ajustars según sea necesario.
Divulgaciones
EK es propietario de capital de Attune Medical, fabricante de tecnología de transferencia de calor esofágica. MG, PS, CT, JG y BC sirven como Investigadores Principales para estudios de enfriamiento esofágico con fondos para sus instituciones hospitalarias, pero no reciben compensación corporativa directa. MM ha proporcionado servicios de consultoría para Attune Medical. Todos los demás autores no declaran conflictos de intereses con esta obra.
Agradecimientos
Ninguno
Materiales
| Name | Company | Catalog Number | Comments |
| Cincinnati SubZero Blanketrol II | Gentherm | n/a | Compatible heat-exchanger with the ECD02 |
| Cincinnati SubZero Blanketrol III | Gentherm | n/a | Compatible heat-exchanger with the ECD02 |
| EnsoETM | Attune Medical | ECD01 | Device compatible with Gaymar/Stryker Medi-Therm III and Stryker Altrix Precision Temperature Management System |
| EnsoETM | Attune Medical | ECD02 | Device compatible with Cincinnati SubZero Blanketrol II and Cincinnati SubZero Blanketrol III |
| Gaymar/Stryker Medi-Therm III | Stryker | n/a | Compatible heat-exchanger with the ECD01 |
| Stryker Altrix Precision Temperature Management System | Stryker | n/a | Compatible heat-exchanger with the ECD01 |
| Water-soluble lubricant | Various | n/a | Standard water-soluble lubricant used to ease insertion of tubes, catheters, and digits |
Referencias
- Calkins, H., et al. 2017 HRS/EHRA/ECAS/APHRS/SOLAECE expert consensus statement on catheter and surgical ablation of atrial fibrillation: Executive summary. Europace. 20 (1), 157-208 (2018).
- Han, H. C., et al. Atrioesophageal Fistula: Clinical Presentation, Procedural Characteristics, Diagnostic Investigations, and Treatment Outcomes. Circulation: Arrhythmia and Electrophysiology. 10 (11), (2017).
- Kapur, S., Barbhaiya, C., Deneke, T., Michaud, G. F. Esophageal Injury and Atrioesophageal Fistula Caused by Ablation for Atrial Fibrillation. Circulation. 136 (13), 1247-1255 (2017).
- Khakpour, H., et al. Atrioesophageal Fistula After Atrial Fibrillation Ablation: A single center series. Journal of Atrial Fibrillation. 10 (3), 1654 (2017).
- Zakaria, A., Hipp, K., Battista, N., Tommolino, E., Machado, C. Fatal esophageal-pericardial fistula as a complication of radiofrequency catheter ablation. SAGE Open Medical Case Reports. 7, (2019).
- Khan, M. Y., Siddiqui, W. J., Iyer, P. S., Dirweesh, A., Karabulut, N. Left Atrial to Esophageal Fistula: A Case Report and Literature Review. American Journal of Case Reports. 17, 814-818 (2016).
- Kadado, A. J., Akar, J. G., Hummel, J. P. Luminal esophageal temperature monitoring to reduce esophageal thermal injury during catheter ablation for atrial fibrillation: A review. Trends in Cardiovascular Medicine. 29 (5), 264-271 (2019).
- Berjano, E. J., Hornero, F. A cooled intraesophageal balloon to prevent thermal injury during endocardial surgical radiofrequency ablation of the left atrium: a finite element study. Physics in Medicine and Biology. 50 (20), 269-279 (2005).
- Lequerica, J. L., Berjano, E. J., Herrero, M., Hornero, F. Reliability assessment of a cooled intraesophageal balloon to prevent thermal injury during RF cardiac ablation: an agar phantom study. Journal of Cardiovascular Electrophysiology. 19 (11), 1188-1193 (2008).
- Lequerica, J. L., Berjano, E. J., Herrero, M., Melecio, L., Hornero, F. A cooled water-irrigated intraesophageal balloon to prevent thermal injury during cardiac ablation: experimental study based on an agar phantom. Physics in Medicine and Biology. 53 (4), 25-34 (2008).
- Arruda, M. S., Armaganijan, L., Di Biase, L., Rashidi, R., Natale, A. Feasibility and safety of using an esophageal protective system to eliminate esophageal thermal injury: implications on atrial-esophageal fistula following AF ablation. Journal of Cardiovascular Electrophysiology. 20 (11), 1272-1278 (2009).
- Tsuchiya, T., Ashikaga, K., Nakagawa, S., Hayashida, K., Kugimiya, H. Atrial fibrillation ablation with esophageal cooling with a cooled water-irrigated intraesophageal balloon: a pilot study. Journal of Cardiovascular Electrophysiology. 18 (2), 145-150 (2007).
- Scanavacca, M. I., et al. . European Society of Cardiology Congress 2007. , 1-5 (2007).
- Kuwahara, T., et al. Oesophageal cooling with ice water does not reduce the incidence of oesophageal lesions complicating catheter ablation of atrial fibrillation: randomized controlled study. Europace. 16 (6), 834-839 (2014).
- Sohara, H., Satake, S., Takeda, H., Yamaguchi, Y., Nagasu, N. Prevalence of esophageal ulceration after atrial fibrillation ablation with the hot balloon ablation catheter: what is the value of esophageal cooling. Journal of Cardiovascular Electrophysiology. 25 (7), 686-692 (2014).
- John, J., et al. The effect of esophageal cooling on esophageal injury during radiofrequency catheter ablation of atrial fibrillation. Journal of Interventional Cardiac Electrophysiology. , (2019).
- Muller, P., et al. Higher incidence of esophageal lesions after ablation of atrial fibrillation related to the use of esophageal temperature probes. Heart Rhythm. 12 (7), 1464-1469 (2015).
- Palaniswamy, C., et al. The Extent of Mechanical Esophageal Deviation to Avoid Esophageal Heating During Catheter Ablation of Atrial Fibrillation. Journal of the American College of Cardiology: Clinical Electrophysiology. 3 (10), 1146-1154 (2017).
- Koruth, J. S., et al. Mechanical esophageal displacement during catheter ablation for atrial fibrillation. Journal of Cardiovascular Electrophysiology. 23 (2), 147-154 (2012).
- Leung, L. W., et al. Esophageal cooling for protection during left atrial ablation: a systematic review and meta-analysis. Journal of Interventional Cardiac Electrophysiology. , (2019).
- Gallagher, M., et al. IMPACT: Improving Oesophageal Protection During Catheter Ablation For AF- A Double Blind Randomised Controlled Trial. European Journal of Arrhythmia & Electrophysiology. 5, (2019).
- Feher, M., Anneken, L., Gruber, M., Achenbach, S., Arnold, M. Esophageal cooling for prevention of thermal lesions during left atrial ablation procedures: a first in man case series. European Hearth Rhythm Association Congress. , (2019).
- Mercado-Montoya, M., MacGregor, J., Kulstad, E. Esophageal warming with an esophageal heat transfer device to limit temperature decrease during left atrial cryoablation. 12th Annual International Symposium on Catheter Ablation Techniques. , (2018).
- Mercado-Montoya, M., Kulstad, E. Esophageal warming to prevent excessive temperature decreases during cryoablation - Abstracts. 24th International Atrial Fibrillation Symposium Journal of Cardiovascular Electrophysiology. 30 (9), 1734-1761 (2019).
- De Potter, T., Boersma, L., Babkin, A., Mazor, M., Cox, J. Novel Linear Cryoablation Catheter to Treat Atrial Fibrillation. Heart Rhythym Society - Scientific Sessions. , (2018).
- Boersma, L., Cox, J., Babkin, A., Mazor, M., De Potter, T. Treatment of Typical Atrial Flutter with a Novel Cryolinear Ablation Catheter First Experience. Heart Rhythm Society - Scientific Sessions. , (2018).
- Yenari, M. A., Han, H. S. Neuroprotective mechanisms of hypothermia in brain ischaemia. Nature Reviews Neuroscience. 13 (4), 267-278 (2012).
- Polderman, K. H. Mechanisms of action, physiological effects, and complications of hypothermia. Critical Care Medicine. 37, (2009).
- Silveira, R. C., Procianoy, R. S. Hypothermia therapy for newborns with hypoxic ischemic encephalopathy. Jornal de Pediatria. , (2015).
- Shankaran, S., et al. Effect of depth and duration of cooling on deaths in the NICU among neonates with hypoxic ischemic encephalopathy: a randomized clinical trial. Journal of the American Medical Association. 312 (24), 2629-2639 (2014).
- Kotekar, N., Shenkar, A., Nagaraj, R. Postoperative cognitive dysfunction - current preventive strategies. Clinical Interventions in Aging. 13, 2267-2273 (2018).
- Medi, C., et al. Subtle post-procedural cognitive dysfunction after atrial fibrillation ablation. Journal of the American College of Cardiology. 62 (6), 531-539 (2013).
- Griffin, B. R., Frear, C. C., Babl, F., Oakley, E., Kimble, R. M. Cool Running Water First Aid Decreases Skin Grafting Requirements in Pediatric Burns: A Cohort Study of Two Thousand Four Hundred Ninety-five Children. Annals of Emergency Medicine. , (2019).
- Niemann, C. U., et al. Therapeutic Hypothermia in Deceased Organ Donors and Kidney-Graft Function. New England Journal of Medicine. 373 (5), 405-414 (2015).
- Erlinge, D., et al. Therapeutic hypothermia for the treatment of acute myocardial infarction-combined analysis of the RAPID MI-ICE and the CHILL-MI trials. Therapeutic Hypothermia and Temperature Management. 5 (2), 77-84 (2015).
- Matsui, T., Yoshida, Y., Yanagihara, M., Suenaga, H. Hypothermia at 35 degrees C Reduces the Time-Dependent Microglial Production of Pro-inflammatory and Anti-inflammatory Factors that Mediate Neuronal Cell Death. Neurocritical Care. , (2013).
- Horiguchi, A., et al. Abstract 11134: Esophagus Temperature Monitoring Predicts Gastric Hypoperistalsis After Catheter Ablation for Atrial Fibrillation. Circulation. 140, A11134 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados