Method Article
Examen estratégico y caracterización del complejo de señalización de proteínas Visual GPCR-mini-G para una cristalización exitosa
En este artículo
Resumen
Este informe describe el cribado de diferentes detergentes para la preparación del GPCR visual, la rodonina, y su complejo con mini-Go. Se demuestran métodos bioquímicos que caracterizan la calidad del complejo en diferentes etapas durante la purificación. Este protocolo se puede generalizar a otros complejos de proteínas de membrana para sus futuros estudios estructurales.
Resumen
La clave para determinar las estructuras cristalinas de los complejos de proteínas de membrana es la calidad de la muestra antes de la cristalización. En particular, la elección del detergente es fundamental, ya que afecta tanto a la estabilidad como a la monodispersidad del complejo. Recientemente determinamos la estructura cristalina de un estado activo de rodopsina bovina acoplada a una proteína G de ingeniería, mini-Go, a resolución de 3,1o. Aquí, detallamos el procedimiento para optimizar la preparación del complejo de rodopesina-mini-Go. La rodopsina de estado oscuro se preparó en detergentes clásicos y neopentyl glycol (NPG), seguidos de una formación compleja con mini-Go bajo exposición a la luz. La estabilidad de la rodonresina se evaluó mediante espectroscopia ultravioleta-visible (UV-VIS), que monitorea la reconstitución en rodopsina del ligando sensible a la luz, 9-cis retinal. La cromatografía automatizada de exclusión de tamaño (SEC) se utilizó para caracterizar la monodispersidad de la rodonina y el complejo de rodopesina-mini-Go. La electroforesis SDS-poliacrilamida (SDS-PAGE) confirmó la formación del complejo mediante la identificación de una relación molar 1:1 entre la rodonina y la mini-Go después de manchar el gel con azul coomassie. Después de validar todos estos datos analíticos, eliminamos detergentes inadecuados y continuamos con el mejor detergente candidato para la preparación y cristalización a gran escala. Un problema adicional surgió de la heterogeneidad de la Glicosilación N. Se observó que la rodopsina expresada hecilogoriamente en SDS-PAGE tenía dos poblaciones diferentes de N-glicosilados, lo que probablemente habría obstaculizado la cristalogénesis. Por lo tanto, se probaron diferentes enzimas de desglucosilación, y la endoglicosidasa F1 (EndoF1) produjo rodopsina con una sola especie de N-glicosilación. Con este gasoducto estratégico para caracterizar la calidad de las proteínas, la preparación del complejo de rodopsina-mini-Go se optimizó para entregar la estructura cristalina. Esta fue sólo la tercera estructura cristalina de un complejo de señalización de proteínas GPCR-G. Este enfoque también se puede generalizar para otras proteínas de membrana y sus complejos para facilitar la preparación de la muestra y la determinación de la estructura.
Introducción
Determinar las estructuras cristalinas de las proteínas de membrana y sus complejos siempre ha sido un reto debido a las dificultades para obtener cristales bien difractes. A diferencia de las proteínas solubles, las proteínas de membrana integral comprenden un núcleo hidrófobo que abarca la membrana celular. Para eliminar las proteínas de membrana de la membrana celular en tampón acuoso, los detergentes deben utilizarse para formar una micela de proteína detergente, reemplazando así los lípidos alrededor del núcleo hidrófobo de las proteínas de membrana. La estabilidad, la actividad y la integridad de las proteínas de membrana dependen directamente de las propiedades químicas y estructurales del detergente1,y las propiedades del detergente también determinan el tamaño de las micelas. Una micela de detergente grande puede ocluir las superficies hidrófilas de una pequeña proteína de membrana, evitando así la cristalización debido a la falta de contactos de cristal cuando se utiliza el método de difusión de vapor. Una pequeña micela de detergente es ventajosa para la cristalografía, pero los detergentes de cadena corta suelen ser más duros y, por lo tanto, conducen a la desestabilización y agregación de la proteína de membrana. Por lo tanto, antes de la cristalización, es indispensable un procedimiento adicional de cribado de detergentes, que normalmente se dirige a detergentes más cortos que todavía mantienen la estabilidad de las proteínas.
Los receptores acoplados a proteínas G (GPCR) son proteínas de membrana integrales que contienen siete a-helices transmembranas. Los GPCR existen en dos estados principales, ya sea un estado inactivo estabilizado por agonistas o antagonistas inversos, o un estado activo unido a un agonista y estabilizado por una proteína G, aunque es probable que existan una multitud de subestados entre estos dos extremos. La determinación de la estructura de los GPCR se centró inicialmente en estados inactivos vinculados a agonistas y antagonistas inversos debido a su mayor estabilidad que los estados activos2. Cuando los GPCR se activan en la unión agonista, los receptores son altamente dinámicos, y una hendidura se forma transitoriamente en la cara citoplasmática del receptor para el acoplamiento de proteína G. Se cree que este dinamismo es la razón por la que los PCPR ligados a agonistas son a menudo más inestables que el estado inactivo. Por lo tanto, se vuelve esencial detectar detergentes adecuados para el estado de conformación del receptor en estudio, ya que es probable que se requieran detergentes más suaves para estudiar un estado activo en comparación con un estado inactivo.
En este informe, utilizamos el GPCR visual, la rodópsina bovina3, y su complejo con mini-Go proteína4,5 para los experimentos de cribado de detergente, que representan el estado inactivo y el estado activo, respectivamente. El cribado de detergente se centró en los detergentes clásicos de alquil maltoside y glucósido y los detergentes neopentyl glycol (NPG). En este contexto, un detergente clásico se construye a partir de un grupo de cabeza sazuco y una cadena de alquilo, mientras que los detergentes tipo NPG contienen dos detergentes clásicos idénticos que se fusionan con un carbono cuaternario en la interfaz entre los azúcares y las cadenas de alquilo6,,7,8.
Se diseñó un flujo de trabajo experimental a partir de la purificación de la rodonina en diferentes detergentes, seguido de la formación delcomplejo de rodopesina-mini-G y terminando con la caracterización del complejo utilizando varios métodos(Figura 1). Para el estado inactivo de la rodopsina, la reconstitución del ligando sensible a la luz 9-cis retiniana fue monitoreada por espectroscopia ultravioleta-visible (UV-VIS). El espectro revela el estado fisicoquímico de la retina y es indicativo de su entorno en el bolsillo de unión de la retina de la rodonina. Se empleó cromatografía de exclusión de tamaño (SEC) para evaluar la monodispersidad de la rodotropsina purificada, así como la formación del complejo de rodopina-mini-Go. Como la SEC diferencia las moléculas de proteína por su tamaño y forma, la población de proteínas agregadas se puede identificar a medida que eluyen en el volumen vacío. Para confirmar la formación compleja, se evaluaron fracciones de seC mediante electroforesis de gel de dodecilo-poliacrilamida de dodecilo sódico-poliacrilamida (SDS-PAGE) para confirmar la presencia de rodópsina y mini-Go.
Otro factor que debe tenerse en cuenta son las modificaciones post-traduccionales (PTM) en las proteínas de membrana. La PTM, como la Glicosilación N, se observa a menudo en las proteínas de membrana eucariota producidas en sistemas de expresión de células de mamíferos e insectos. Una cepa limitada de N-glicosilación de las células del riñón embrionario humano 293 (HEK293) fue desarrollada por la eliminación del gen que codifica N-acetilglucosaminyltransferasa I (GnTI), dando como resultado la Homogéneación N homogénea por GlcNAc2Man5 en el sitio de consenso Asn-X-Ser/Thr. Aunque la Glicosilación N se puede prevenir mutando un residuo de aminoácidos en el sitio de consenso, esto también puede alterar la función de la proteína o la eficiencia del plegado. En la rodópsina bovina, la mutación del residuo N-glucosilado Asn15 conduce a un plegado incorrecto y reduce la activación de la proteína G9,10. La rodonina utilizada en este informe se expresó en la línea celular deficiente de HEK 293 En GNTI. Sin embargo, SDS-PAGE mostró la presencia de dos especies de rodonina. Esta heterogeneidad podría prevenir la formación de cristales y, por lo tanto, la desglucosilación utilizando péptido-N-glucosidasa F (PNGase F) y endoglicosidasa F1 (Endo F1). El producto desglucosilado se caracterizó por SDS-PAGE y cromatografía líquida-espectrometría de masas (LC-MS) para identificar el nivel de glicosilación y su homogeneidad.
Protocolo
NOTA: Este protocolo para el cribado de detergentes se detalla para 30 g de pellet de célulahe HEK293 como material de partida.
1. Materiales, productos químicos y reactivos
NOTA: Todas las soluciones se preparan utilizando reactivos de grado analítico y agua ultrapura, que se purifica a partir del agua desionizada para alcanzar una resistividad de 18,2 m cm a 25 oC.
- Soluciones de stock de búfer
- Prepare 10x solución salina tamponada de fosfato (10x PBS).
- Prepare el buffer HEPES: 1 M, valorado a pH 7.5 con NaOH.
- Prepare 5 M NaCl.
- Preparar 2 M Mgcl2.
NOTA: Todas las soluciones de stock se pasan a través de un filtro de 0,22 m para mantener su esterilidad.
- Soluciones de stock detergente
- Preparar el maltoside de dodecílico (DDM), 10% (p/v).
- Preparar decyl maltoside (DM), 10% (p/v).
- Preparar 6-cyclohexyl-hexyl maltoside (Cymal-6), 10% (p/v).
- Preparar 5-cyclohexyl-pentyl maltoside (Cymal-5), 10% (p/v).
- Preparar el glucósido no yílico (C9G), 10% (p/v).
- Preparar lauril maltose neopentyl glycol (LMNG), 5% (p/v).
- Preparar decyl maltose neopentyl glycol (DMNG), 10% (p/v).
- Preparar el neopentyl glycol de cymal-6 (C6NG), 10% (p/v).
- Preparar el neopentyl glycol de cymal-5 (C5NG), 10% (p/v).
- Preparar octyl glucose neopentyl glycol (OGNG), 10% (p/v).
NOTA: Para una solución de detergente del 10%, disuelva 1 g de detergente en polvo en agua ultrapura con un balanceo suave y, a continuación, ajuste el volumen final a 10 ml. La solución de stock detergente debe mantenerse a -20 oC para el almacenamiento a largo plazo y sobre hielo mientras se trabaja.
ADVERTENCIA: Por lo general, se recomienda que los detergentes embotellados se almacenen a un congelador de -20 oC. Las botellas que contienen detergente en polvo deben calentarse a temperatura ambiente antes de abrirse. El polvo detergente es higroscópico, por lo que el equilibrio de temperatura evitará la formación de condensación que humedezca el detergente.
- Otros productos químicos y reactivos
- Preparar resina de agarosa de inmunoafinidad 1D4: 10 mL de la suspensión del 50%.
NOTA: La aagarosa de inmunoafinidad 1D4 son las perlas de agarosa vinculadas con el anticuerpo monoclonal Rho1D4, que une los últimos 9 aminoácidos de la rodopsina bovina TETSQVAPA como epítopo. La inmunoafinidad 1D4 de agarosa funciona como material de purificación de afinidad para capturar proteínas que contienen una secuencia C-terminal 1D4. Este material de purificación se puede preparar9,,11 o comprar. - Preparar la solución retiniana de 9-cis: 1 mM, disuelto en etanol 100%.
NOTA: Evite la exposición a la luz de la retina durante la preparación y el almacenamiento. - Preparar el péptido 1D4 (secuencia TETSQVAPA): 800 m, disuelto en agua.
- Preparar resina de agarosa de inmunoafinidad 1D4: 10 mL de la suspensión del 50%.
- Búferes
NOTA: Todos los búferes se mezclan desde las soluciones de stock hasta la concentración deseada. Todos los tampones se enfrían a 4 oC antes de su uso.- Preparar búfer A: PBS, 0.04% DDM.
- Preparar Tampón B: 20 mM HEPES pH 7.5, 150 mM NaCl, 0.04% DDM.
- Preparar Tampón C: 20 mM HEPES pH 7,5, 150 mM NaCl y detergente a su concentración de trabajo enumerada en la Tabla 1.
- Prepare Buffer D: 20 mM HEPES pH 7.5, 150 mM NaCl.
- Preparar tampón de elución: 20 mM HEPES pH 7.5, 150 mM NaCl, 80 m 1D4 péptido, y detergente en su concentración de trabajo.
- Preparar búfer SEC: 20 mM HEPES pH 7.5, 150 mM NaCl, 0.025% DDM; filtrado a través de un filtro de 0,22 m.
- Disolvente para LC-MS
- Preparar el disolvente A: acetonitrilo que contiene 0,1% de ácido fórmico.
- Preparar disolvente B: agua ultrapura que contiene 0,1% de ácido fórmico.
- Preparar disolvente C: isopropanol.
2. Solubilización de membrana celular y extracción de proteínas
- Descongelar 30 g de HEK293 GnTI- pellet celular que expresa el mutante de roddopsina bovina N2C/M257Y/D282C3,9 a temperatura ambiente, añadir 120 mL de 1 x tampón PBS que contenga cóctel inhibidor de proteasa y homogeneizar utilizando un homogeneizador Dounce o un homogeneizador eléctrico (13.000 rpm para 30 s). Recoger la suspensión de celda homogeneizada en un vaso de precipitados y ajustar el volumen a 150 ml.
NOTA: 30 g de pellet celular equivale a 3 L de cultivo celular a 2 x 106 celdas/ml de densidad. - Agregue suavemente un 10% de DDM a las células homogeneizadas para dar una concentración final de 1.25%. Revuelva el hielo durante 1 h.
- Centrifugar el lisado celular a 4oC y 150.000 x g durante 45 min para eliminar los residuos no solubilizados.
- Transfiera el sobrenadante a una botella de 500 ml y añada 10 ml de la resina de agarosa de inmunoafinidad 1D4 (50% lodo). Mezcle suavemente el lisado celular solubilizado y la resina durante 4 h o durante la noche a 4oC.
- Cargue la mezcla de lisado/resina en una columna abierta para recoger la resina.
- Lave la resina con 10 volúmenes de columna (CV) del tampón de lavado A.
NOTA: El volumen de columna es el volumen del embalado (100%) resina de agarosa utilizada. En este caso, 1 CV es de 5 ml. - Resuspenda la resina con 2 CV de Tampón A.
ADVERTENCIA: A partir del paso 2.8, los pasos que deben llevarse a cabo bajo una condición de luz roja tenue se etiquetan con "[Oscuro]" al principio de la descripción. - [Oscuro] Añadir la retina de 9 cis a la resina resuspendida a la concentración final de 50 m. Mezclar suavemente a 4oC durante 4-16 h en la oscuridad.
NOTA: Un tiempo de incubación más corto puede conducir a una reconstitución incompleta de la retina. - [Oscuro] Elimine el flujo de la columna. Lave la resina con 20 CV de búfer A, seguido de 15 CV de búfer B.
- [Oscuro] Resuspenda la resina en 2 CV Buffer B, y luego divida la suspensión de resina por igual en 10 columnas de eliminación de 10 ml.
- [Oscuro] Retirar el flujo a través de la columna, y luego resuspender la resina en 1 mL Tampón C. Incubar durante 1 h a 4 oC.
- [Oscuro] Repita el paso 2.11.
- [Oscuro] Quite el flujo a través de la columna y, a continuación, vuelva a suspender la resina en el búfer de elución de 0,8 ml para cada columna. Mezclar suavemente durante 2 h.
- [Oscuro] Recoger la elución de la columna en un tubo de 2 ml.
- [Oscuro] Resuspenda la resina en 0,7 ml de elución de búfer para cada columna. Mezclar suavemente durante 1 h.
- [Oscuro] Recoger la elución de la columna en el mismo tubo.
3. Espectroscopia UV-VIS
- Prepare el espectrofotómetro para cubrir el rango de medición de 250-650 nm. Registre la línea base utilizando agua o búfer de elución.
- [Oscuro] Cargue la proteína eluted en la cubeta de cuarzo. Mida el espectro de la muestra de proteínas.
- [Oscuro] Ilumina la proteína directamente en la cubeta durante 2 min con la luz pasada a través de un filtro de paso largo de 495 nm.
- Mida el espectro de la muestra iluminada.
- Realice la misma medición para todas las muestras de proteínas purificadas en los otros 9 detergentes, tanto en estados oscuros como iluminados.
- Trazar las curvas (absorbencia frente a longitud de onda) en el gráfico de dispersión X-Y.
4. Cromatografía automatizada de exclusión de tamaño de rhodopsin y rhodopsin-mini-Go complejo
- [Oscuro] Concentrar la proteína a 100 ml por centrifugación utilizando un concentrador de espín con un corte de peso molecular (MWCO) de 30 kDa a 4oC. Las muestras sobreconcentradas se pueden diluir utilizando el flujo a través del concentrador o del búfer C. Para determinar la concentración de la muestra de proteína, mida la absorbancia a 280 nm utilizando un espectrofotómetro.
NOTA: A partir del paso 4.2, el experimento no requiere un entorno oscuro y, por lo tanto, las muestras se pueden preparar bajo luz normal. - Preparar 100 l de roddopsina a 0,7 mg/ml para cada condición de detergente.
- Preparar 100 ml de rodopesina (0,7 mg/ml) y mezcla mini-Go4,,12 (0,2 mg/ml) para cada condición de detergente. Complementar la mezcla con 1 mM MgCl2. Ilumina la mezcla con luz de un filtro de paso largo de 495 nm e incuba durante 30 min.
- Monte una columna de filtración de gel de 24 ml con un rango de fraccionamiento de 10-600 kDa de una proteína globular en un purificador de cromatografía líquida. Equilibrado la columna con búfer SEC.
NOTA: El purificador de cromatografía líquida está equipado con un muestreador automático, un detector de longitud de onda múltiple y un colector de fracciones. - Transfiera las muestras a los viales del muestreador automático y colóquelas en la bandeja de muestras. Programe un archivo de método para automatizar las ejecuciones SEC secuenciales para cada muestra, con el muestreador automático cargando 77 l de la muestra a la columna, y el purificador eluyéndose 24 ml del búfer SEC a un caudal de 0,5 ml/min por ejecución. Registre la absorbancia a 280 nm y 380 nm.
- Recoger las fracciones pico de rodopsina y rhodopsina-mini-Go complejo en el volumen de retención alrededor de 12,9 mL.
- Analizar las muestras de rodopesina izquierda del paso 4.2 y las fracciones máximas de rhodopsin-mini-Go complejo en 4-12% Geles gradiente desnaturalizantes SDS con tinción azul Coomassie.
- Trazar el cromatograma de elución (A280 o A380 frente al volumen de retención).
5. Estudio de desglucosilación y LC-MS
- Para el estudio LC-MS, utilice únicamente la muestra de rodopesina purificada en detergente LMNG.
- Preparar una mezcla de 200 l de rodopesina a 1 mg/ml y PNGase F13 a 0,01 mg/ml. Mezclar bien e incubar a 4oC durante la noche.
- Preparar una mezcla de 200 ml de rodopesina a 1 mg/ml y Endo F113 a 0,01 mg/ml. Mezclar bien e incubar a 4oC durante la noche.
- Analizar el resultado de la digestión mediante la tinción azul SDS-PAGE y Coomassie.
- Concentre muestras de rodonina no tratadas y tratadas con Endo F1 y sujeto a purificación de la SEC en Tampón D.
NOTA: Esto es para preparar la muestra con una cantidad mínima de detergente para el estudio LC-MS. Buffer D no contiene ningún detergente, pero debido a la lenta bajada de LMNG de una proteína de membrana14, la rodonina no se agregará. - Recoja la fracción máxima en el volumen de retención alrededor de 12,9 ml. Concentre a 1 mg/ml utilizando un concentrador de espín (MWCO 30 kDa).
- Inyectar 10 g de la proteína en una columna Reprosil 200 C18-AQ y eluir la columna utilizando el método de gradiente lineal con la composición y los ajustes de disolvente enumerados en la Tabla 2. El flujo se divide al 25% para el espectrómetro de masas y al 75% para la detección UV.
Resultados
El flujo de trabajo experimental para la preparación y el análisis de muestras se resume en la Figura 1. El uso de columnas abiertas para la purificación de afinidad a pequeña escala nos permitió preparar muestras en muchas condiciones de detergente diferentes en paralelo(Figura 1A). Dicha configuración de purificación a pequeña escala produjo suficiente proteína para análisis posteriores utilizando espectroscopia UV-VIS, SEC y SDS-PAGE(Figura 1B-C).
La espectroscopia UV-VIS reveló estabilidad de rodopsina
La estabilidad de la rodonina reconstituida por la retina se evaluó por su absorbancia óptica(Figura 2). En el estado oscuro, 9-cis retinal está ligada covalentemente a Lys296 como una base protentizada Schiff. Después de la iluminación, la retina 9-cis se isomeriza a la isoforma trans y el enlace base de Schiff se desprotona. La retina protestada de 9 cis da un pico de absorción a 488 nm, mientras que la retina desprotonada de trans tiene un pico de 380 nm. Los espectros UV-VIS de rodopina en DDM mostraron la absorción típica de 9-cis retinal-bound y light-activated rhodopsin, donde se observó claramente un desplazamiento azul de 108 nm con aproximadamente la misma densidad óptica(Figura 2A, panel superior izquierdo). Cuando la rodonrina se desestabiliza, y luego el bolsillo de unión para los cambios en la retina, que resulta en la desprotonación de la retina y posiblemente la disociación. Si esto sucede, y entonces el espectro muestra la contribución de la desprotonación, así como la forma libre de la retina15. Por lo tanto, determinamos la eficiencia de la reconstitución de la retina en rodopsina por la relación de absorción entre la proteína (280 nm) y la retina (488 nm para la retina protontizada 9-cis, 380 nm para la retina desprotonada totrans)(Figura 2B). Las muestras de rodonina purificadas en los detergentes clásicos (DDM, DM, Cymal-6, Cymal-5, C9G) muestran el mismo perfil óptico. Sin embargo, las muestras purificadas en los detergentes NPG (LMNG, DMNG, Cymal-6NG, Cymal-5NG) muestran perfiles ópticos que sugieren un entorno de unión subóptimo para la retina, excepto para la muestra OGNG, que dio el mismo perfil óptico que la muestra DDM.
La cromatografía de exclusión de tamaño mostró pureza de la muestra y monodispersidad proteica.
SEC es una herramienta analítica eficiente y robusta para evaluar muestras de proteínas durante la preparación y el cribado. Valida la pureza de la muestra del paso de purificación anterior, así como la monodispersidad de las moléculas de proteína. Para la rodopesina y su complejo mini-Go, la calidad de la muestra se interpretó a partir de las curvas de absorción a 280 nm y 380 nm(Figura 3A). Los rastros de 280 nm mostraron la presencia de proteína, y el rastro de 380 nm mostró la presencia de retina. Cualquier señal que aparece en el volumen vacío (alrededor de 8 ml cuando se utiliza esta columna) se atribuyó a agregados de proteínas. Por lo tanto, los resultados mostraron que las muestras preparadas en los detergentes clásicos estaban en un estado monodisperso, excepto C9G, donde apareció una porción del agregado. Por el contrario, las muestras preparadas con detergentes de tipo NPG contenían muchos más agregados que la muestra C9G; LMNG y Cymal-6NG condujeron a la mayor formación agregada, pero se observaron menos agregados en DMNG y Cymal-5NG. La excepción fue OGNG, que mostró un perfil similar al DDM. Los agregados proteicos que eluyeran al volumen vacío también tenían una ocupación de la retina más pobre, como lo demuestra la relación A280/A380 que había aumentado en comparación con el pico en el volumen de retención de 12,9 ml correspondiente a 135 kDa. Otra característica que observamos fue que tanto la rodonina como la rodonina-mini-Go eluted alrededor del mismo volumen de retención(Figura 3B). Esto no es sorprendente, porque el peso molecular aparente de la rodonina ligada al detergente era de 120 kDa y el de la rodonina-mini-Go 144 kDa. Por lo tanto, no podíamos determinar la formación compleja simplemente a partir de los datos de la SEC, por lo que SDS-PAGE se utilizó para analizar más a fondo la muestra purificada por la SEC.
SDS-PAGE confirmó la formación compleja
SDS-PAGE es un método estándar para identificar los componentes proteicos en una muestra. La rodopina concentrada (antes de la purificación seDE) fue analizada por SDS-PAGE para confirmar su pureza, y mostró dos bandas cerca de 37 kDa y una banda manchada por encima de 50 kDa(Figura 4A). Las dos bandas inferiores fueron confirmadas más tarde para tener diferentes estados de Glicosilación N. La banda por encima de 50 kDa se interpretó como oligómeros de rodonina agregados inducidos por el búfer de muestra SDS-PAGE porque estos agregados no se observaron en seC ni en ningún otro método de detección. Como los datos de la SEC no pudieron confirmar la formación compleja, las fracciones elucidas de la SEC a partir de muestras de rodonina-mini-Go se analizaron utilizando SDS-PAGE. El SDS-PAGE mostró bandas proteicas de rodópsina y mini-Go en todas las condiciones de detergente, lo que sugiere que el complejo se formó independientemente de la elección del detergente(Figura 4B).
La espectrometría LC-MS identificó el patrón de Glicosilación N en rodonasina
Las muestras de rodonina de la purificación de afinidad y sec mostraron dos bandas proteicas que migraron con un peso molecular aparente de unos 37 kDa en un gel SDS-PAGE, que no podía ser separado por SEC cuando se utiliza una columna de 24 ml. Diferentes patrones de N-glicosilación en la roddopsina expresada heterólogamente de HEK 293 GnTI- células fue la explicación más probable. Por lo tanto, dos enzimas, PNGase F y Endo F1, fueron probadas para su capacidad para desglicosilar la rodonina. A partir de los datos de SDS-PAGE, Endo F1 redujo el peso molecular de ambas bandas proteicas en un solo producto, mientras que la digestión PNGase F todavía daba dos poblaciones(Figura 5A). Las muestras no digeridas y tratadas con Endo F1 fueron analizadas utilizando espectrometría LC-MS para identificar las masas de diferentes especies. Los datos mostraron que la rodonina producida en HEK 293 GnTI- células contenían uno o dos N-glicanos, con una diferencia en la masa de 1014-1 Da. La rodonina tratada con Endo F1 no contenía ningún N-glicanos y tenía una diferencia de masa de 2027-1 Da en comparación con la rodopina que contenía dos Glicanos. Estos resultados son consistentes con la ausencia de la enzima N-acetilglucosaminyltransferasa I en la línea celular utilizada para expresar la rodopsina, lo que resulta en todos los N-glicanos que tienen la estructura GlcNAc2Man5, (masa 1014 Da).
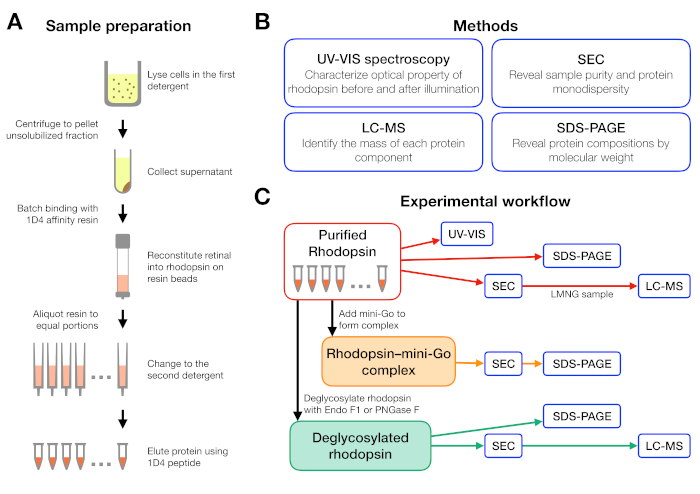
Figura 1: Preparación y caracterización de muestras para el experimento de cribado de detergentes. (A) Preparación de muestras de rodopesina en diferentes detergentes durante la purificación. (B) Métodos utilizados en el protocolo: espectroscopia UV-VIS, cromatografía de exclusión de tamaño (SEC), SDS-PAGE y cromatografía líquida-espectrometría de masas (LC-MS). (C) Flujo de trabajo experimental para la caracterización de la rodonina, la rodonina-mini-Goy el producto de desglucosilación de la rodonquina. Haga clic aquí para ver una versión más grande de esta figura.
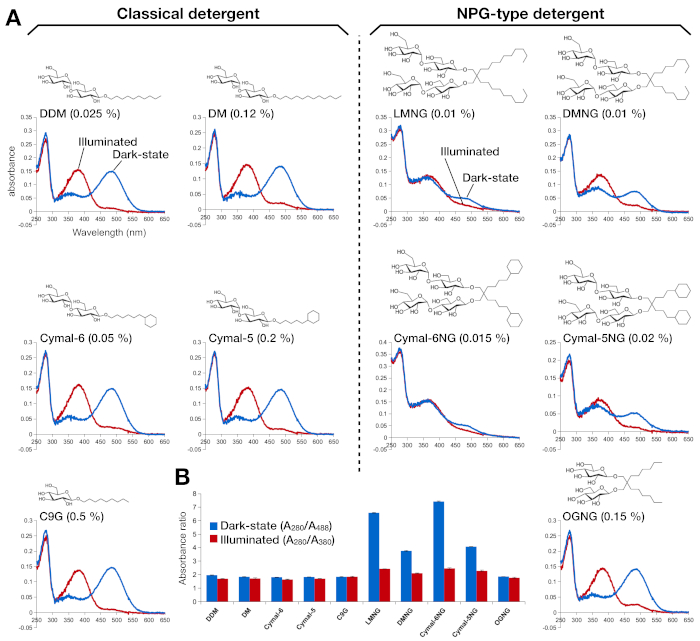
Figura 2: Espectroscopia UV-VIS de rodopsina. (A) espectros UV-VIS de rodopesina. Los espectros de la rodopsina de estado oscuro, 9-cis retiniana se muestran en curvas azules. Después de la iluminación, 9-cis retinal se desprotona e isomeriza en la retina trans, y los espectros de rodopsina iluminada se muestran como curvas rojas. La estructura química de cada detergente se muestra como un recuadro. (B) Las relaciones de A280/A488 (barra azul) y A280/A380 (barra roja) representan la estabilidad de la rodópsina en estado oscuro y estado de luz, respectivamente. Haga clic aquí para ver una versión más grande de esta figura.
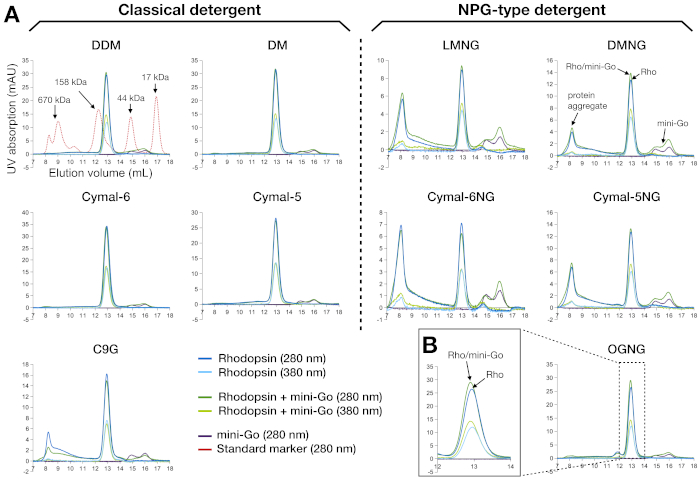
Figura 3: Perfiles de cromatografía de exclusión de tamaño de rodopesina y rodofona–mini-Go complejo purificado en 10 detergentes diferentes. (A) El panel izquierdo muestra los perfiles SEC de muestras purificadas en los detergentes clásicos. El panel derecho representa los perfiles SEC de muestras purificadas en los detergentes de tipo NPG. El perfil de las proteínas marcadoras estándar se muestra como superposición junto con la muestra DDM. La interpretación de los perfiles de pico se muestra para el DMNG, con el escenario ideal (sin agregados) visto para DDM, DM, Cymal-6, Cymal-5 y OGNG. (B) El perfil magnificado de la muestra OGNG en el volumen de retención de 12-14 mL. Todas las muestras se analizaron utilizando una columna Superdex200 Increase 10/300 GL. Haga clic aquí para ver una versión más grande de esta figura.
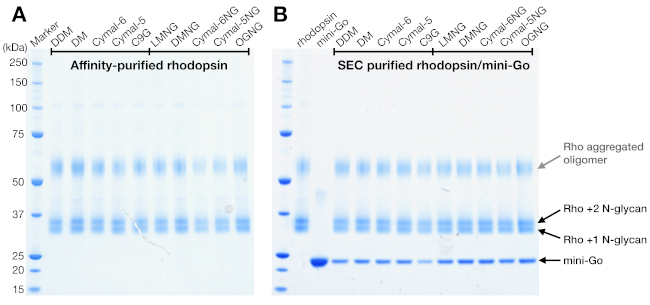
Figura 4: Análisis SDS-PAGE del complejo de rodópsina y rodopsina/mini-Go. (A) Muestras de rodonina purificadas en detergentes. La banda manchada por encima de 50 kDa se atribuye a los oligómeros de rodopsina agregados inducidos por el búfer de muestra SDS-PAGE. (B) Muestras purificadas por SEC del complejo de rodopina/mini-Go. Rhodopsin con 1 y 2 N-glicano y mini-Go se representan. Haga clic aquí para ver una versión más grande de esta figura.
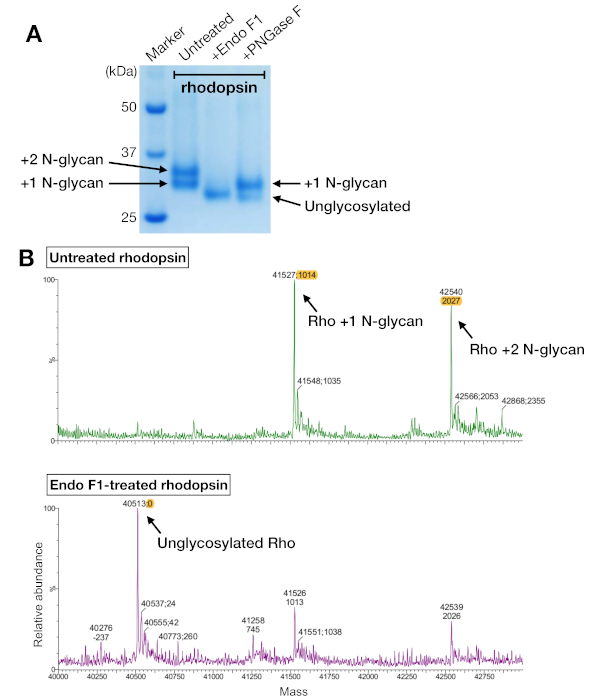
Figura 5: Identificación de la glicosilación en rodopsina. (A) Análisis SDS-PAGE de rodopesina desglucosilada utilizando PNGase F y Endo F1. (B) espectros LC-MS de rodopesina sin (panel superior) y con desglucosilación por Endo F1 (panel inferior). Para preparar el complejo de rodopesina-mini-Go para la cristalización, elegimos Endo F1 sobre PNGase F porque Endo F1 entregó una única especie homogénea de rodonina. Haga clic aquí para ver una versión más grande de esta figura.
| Detergente | Concentración de trabajo (%) | Concentración crítica de micelas (%) |
| Ddm | 0.025 | 0.0087 |
| Dm | 0.12 | 0.087 |
| Cymal-6 | 0.05 | 0.028 |
| Cymal-5 | 0.2 | 0.12 |
| C9G | 0.5 | 0.2 |
| LMNG | 0.01 | 0.001 |
| DMNG | 0.01 | 0.0034 |
| Cymal-6NG | 0.015 | No disponible; debe ser inferior a 0,056 |
| Cymal-5NG | 0.02 | 0.0056 |
| OGNG | 0.15 | 0.058 |
Tabla 1: Concentraciones de detergente Tampón C.
| Tiempo (min) | Disolvente A (%) | Disolvente B (%) | Disolvente C (%) | Caudal (ml/min) |
| 0 | 0 | 95 | 5 | 0.5 |
| 1 | 0 | 95 | 5 | 0.5 |
| 5 | 20 | 75 | 5 | 0.6 |
| 25 | 85 | 10 | 5 | 0.6 |
| 26 | 90 | 5 | 5 | 0.6 |
| 30 | 90 | 5 | 5 | 0.6 |
Tabla 2: Parámetros de elución de columnas.
Discusión
El éxito en la cristalización de proteínas depende en gran medida de la muestra de proteínas, especialmente las proteínas de membrana y sus complejos debido a la complicación causada por los detergentes. Este informe demuestra el cribado de detergentes y la evaluación de la calidad de la muestra para los complejos de señalización de proteínas GPCR-mini-G. Una variedad de métodos se han utilizado ampliamente para estudiar la propiedad bioquímica de las proteínas de membrana, por ejemplo, el ensayo de termoestabilidad utilizando tintes fluorescentes16,17, ensayo de unión para detectar la formación compleja mediante la medición del cambio en la señal de fluorescencia de triptófano18 o la transferencia de energía de resonancia con biosensores19. Sin embargo, los ambientes químicos utilizados en esos métodos son muy diferentes de los de preparación de una muestra de cristalización, ya sea proteínas se encuentran en una concentración mil veces menor para la medición basada en fluorescencia, o las proteínas se incrustan en bicapas de lípidos o en una condición de detergente fijo. En este protocolo, los métodos utilizados también se estandarizan en la preparación de muestras a gran escala antes de la cristalización. Por lo tanto, los parámetros optimizados se pueden transferir fácilmente para la preparación a escala de cristalización sin más cribado y optimización.
El objetivo de este protocolo es optimizar la preparación de un complejo proteico GPCR-mini-G estable y homogéneo para la cristalización del vapor y la determinación de la estructura mediante cristalografía de rayos X. El protocolo integra un conjunto de métodos para evaluar cualitativamente el impacto del detergente yo la desglucosilación durante la preparación del complejo de rodopesina-mini-G. La rodonrina en estado inactivo y el estado activado por la luz unidos con y sin el péptido de transducina se ha cristalizado cuando se purifica en los detergentes octil glucósido (C8G)20,21,22 y C9G23,24. Como la rodonrina-mini-Go compleja purificada en C8G y C9G no produjo cristales (datos no mostrados), luego exploramos una gama más amplia de otros detergentes utilizando la estrategia descrita(Figura 1). Aprovechando la sensibilidad a la luz de la rodonina, podríamos muy bien seguir la reconstitución de la retina a longitudes de onda distintas de 280 nm. Tanto en espectroscopia UV-VIS como en SEC, detectamos la retina a 380 nm o 488 nm. Sin embargo, la mayoría de las proteínas de membrana no tienen un cromóforo tan conveniente para seguir la funcionalidad durante la purificación. Otras opciones serían hacer que un ligando sea detectable añadiendo un cromóforo detectable por la luz o utilizando ensayos de radioligand-binding y de desplazamiento térmico25.
La rodonrina tiene un peso molecular de 40 kDa. Debido a la masa de detergente que se une, su peso molecular aparente en SEC es de unos 120 kDa. Por lo tanto, no es de extrañar que la unión de mini-Go (24 kDa) no se detectó fácilmente en SEC, ya que esto requeriría la diferenciación de proteínas con masas aparentes de 120 kDa y 144 kDa. Por lo tanto, se utilizó el análisis de fracciones SEC por SDS-PAGE para confirmar la pureza de la muestra y la formación compleja. Incluso si los perfiles SEC muestran un cambio claro en la formación compleja, todavía se recomienda realizar análisis SDS-PAGE para confirmar la formación compleja con socios de unión correctos en lugar de otros contaminantes proteicos co-purificados.
Tanto la rodopina como la mini-Go se purificaron en cantidades de miligramos, lo que permitió el uso de la detección de baja sensibilidad de los complejos, como la absorción UV-VIS durante la SEC y la tinción azul de coma de geles SDS-PAGE. Cuando las muestras sean limitadas, se debe utilizar una detección más sensible, como un purificador LC equipado con un detector de fluorescencia para rastrear las señales de triptófano de la proteína (excitación de 280 nm, emisión de 350 nm) y la tinción de plata para geles SDS-PAGE. Otro enfoque sería fusionar una proteína fluorescente, como la proteína de fluorescencia verde (GFP) a la proteína de interés, lo que también permitiría la detección incluso durante la expresión de proteína26, pero debe eliminarse antes de la cristalización.
Es esencial asegurarse de que la proteína purificada también esté libre de heterogeneidad derivada de los MPT variables. En el caso descrito aquí, las dos poblaciones de rodonpsina observadas en geles SDS-PAGE se caracterizaron por tener uno o dos N-glicanos. La modificación variable de una proteína podría prevenir la formación de cristales bien difractantes, por lo que por lo tanto desglucosilada rodonpsina. La endoglicosidasa Endo F1 fue la endoglicosidasa más eficaz probada y el tratamiento dio lugar a una sola especie de receptor sin glucosilar, mientras que PNGase F sólo eliminó parcialmente los glicanos en la rodonina y dio lugar a una mezcla de rodopesina totalmente desenucosilada o con un N-glicano se mantuvo. La rodonpsina sin tratamiento con desglusilasa se ha cristalizado con éxito3,27,28, y el N-glicano en rodopsinas Asn15 es importante para formar contacto con cristal en esos casos. En el caso de la rodonina-mini-Go, es necesario eliminar N-glicanos por Endo F1 para obtener cristales. No existe una regla estandarizada para desglucosilar proteínas de interés antes de la cristalización, pero la eliminación de los PMAT heterogéneos debe considerarse cuando las proteínas no se cristalizan después de extensos ensayos de cristalización.
Los datos y la metodología descritos aquí nos guiaron a elegir OGNG como el detergente preferido para la cristalización del complejo de rodopina-mini-Gdebido a su pequeño tamaño de micelas y su capacidad para estabilizar el complejo. También utilizamos Endo F1 para asegurar que la rodonina purificada fuera una especie homogénea. Posteriormente se obtuvieron cristales y determinamos la estructura cristalina a 3,1 x4, que era sólo la tercera estructura cristalina de un complejo de señalización de proteínas GPCR-G14,,29.
Para las proteínas de membrana unidas con y sin una proteína de socio, deben considerarse como dos proteínas diferentes. Una proteína en diferentes estados funcionales tiene diferentes conformaciones y está en diferentes niveles de energía. Por lo tanto, se recomienda optimizar el protocolo de preparación para cada estado funcional, ya que el parámetro para el estado inactivo puede no ser completamente transferible al estado activado. Además, por no hablar del cambio en la propiedad de la proteína complicado por la unión de una proteína de socio. El protocolo utiliza métodos estandarizados para preparar una muestra de cristalización para preparar proteínas de membrana inactivas en diferentes detergentes, seguidos de activación de proteínas y formación compleja, y para caracterizar la calidad de las proteínas. Por lo tanto, este protocolo se puede generalizar fácilmente a otras proteínas de membrana y sus complejos para estudios estructurales con pequeñas modificaciones.
Divulgaciones
CGT es consultor y miembro del Consejo Asesor Científico de Sosei Heptares. Todos los demás autores no tienen nada que revelar.
Agradecimientos
Agradecemos al Prof. Dr. Gebhard F. X. Schertler por su apoyo a largo plazo en este proyecto, el Dr. Roger J.P. Dawson y Hoffmann La Roche por el apoyo en el cultivo celular. Este trabajo fue patrocinado por la Fundación Nacional Suiza de Ciencias (grants 210030_153145 y 310030B_173335 a GFXS), y la financiación a CGT del Consejo Europeo de Investigación (EMPSI, 339995) y el Consejo de Investigación Médica (MRC U105197215). FP reconoce a ETH Zúrich a través del Centro Nacional de Competencia en Investigación Molecular Ultrafast Science and Technology (NCCR MUST) y los programas ETH Femtosecond y Attosecond Science and Technology (ETH FAST). FP, JM, AB y CJT reconocen el apoyo financiero a largo plazo del Instituto Paul Scherrer.
Materiales
| Name | Company | Catalog Number | Comments |
| 1D4 peptide | Peptide2.0 | Under request | |
| 9-cis retinal | Sigma-Aldrich | R5754 | |
| Autosampler A-900 | GE Healthcare | Discontinued | |
| C9G | Anatrace | N324 | |
| cOmplete, EDTA-free protease inhibitor coctail | Roche | 5056489001 | |
| Cymal-5 | Anatrace | C325 | |
| Cymal-5NG | Anatrace | NG325 | |
| Cymal-6 | Anatrace | C326 | |
| Cymal-6NG | Anatrace | NG326 | |
| DDM | Anatrace | D310 | |
| DM | Anatrace | D322 | |
| DMNG | Anatrace | NG322 | |
| Econo column | Bio-Rad | 7372512 | |
| Ettan LC | GE Healthcare | Discontinued | |
| FRAC-950 | GE Healthcare | Discontinued | |
| HPLC Water 2795 Separation Module | Waters AG | 720000358EN | |
| InstantBlue Protein Stain | Expedeon | ISB1L | |
| LCT Premier mass spectrometer (ESI-TOF) | Waters AG | - | |
| LMNG | Anatrace | NG310 | |
| Monitor UV-900 | GE Healthcare | 18110835 | |
| Nanodrop 1000 | Witec AG/ThermoFisher | Discontinued | |
| NuPAGE 4-12% Bis-Tris gel 1.0 mm, 15 well | ThermoFisher | NP0323BOX | |
| NuPAGE MES SDS buffer (20x) | ThermoFisher | NP0002 | |
| OGNG | Anatrace | NG311 | |
| PAGEr Minigel Chamber | Lonza | 59905 | |
| Reprosil 200 C18-AQ column | Morvay Analytik GmbH | #s1503 | |
| Superdex 200 Increase GL column | GE Healthcare | 28990944 | |
| Tabletop centrifuge 5424R | Eppendorf | 5404000413 | |
| Ultracentrifuge Optima XE-100 | Beckmann Coulter | A94516 | |
| ULTRA-TURRAX T25 | IKA WERKE | 0003725003 | |
| UV-VIS spectrophotometer | Shimadzu | UV-2401PC | |
| Waters 2487 Dual λ Absorbance Detector | Waters AG | - |
Referencias
- Tate, C. G. Practical considerations of membrane protein instability during purification and crystallisation. Methods in Molecular Biology. 601, 187-203 (2010).
- Lebon, G., Bennett, K., Jazayeri, A., Tate, C. G. Thermostabilisation of an agonist-bound conformation of the human adenosine A(2A) receptor. Journal of Molecular Biology. 409 (3), 298-310 (2011).
- Deupi, X., et al. Stabilized G protein binding site in the structure of constitutively active metarhodopsin-II. Proceedings of the National Academy of Sciences. 109 (1), 119-124 (2012).
- Tsai, C. -. J., et al. Crystal structure of rhodopsin in complex with a mini-G o sheds light on the principles of G protein selectivity. Science Advances. 4 (9), (2018).
- Carpenter, B., Tate, C. G. Engineering a minimal G protein to facilitate crystallisation of G protein-coupled receptors in their active conformation. Protein Engineering Design and Selection. 29 (12), 583-594 (2016).
- Chae, P. S., et al. Maltose-neopentyl glycol (MNG) amphiphiles for solubilization, stabilization and crystallization of membrane proteins. Nature Methods. 7 (12), 1003-1008 (2010).
- Loll, P. J. Membrane proteins, detergents and crystals: what is the state of the art. Acta Crystallographica Section F Structural Biology Communications. 70 (12), 1576-1583 (2014).
- Chae, P. S., et al. Glucose-neopentyl glycol (GNG) amphiphiles for membrane protein study. Chemical communications. 49 (23), 2287-2289 (2013).
- Standfuss, J., Xie, G., Edwards, P. C., Burghammer, M., Oprian, D. D., Schertler, G. F. X. Crystal structure of a thermally stable rhodopsin mutant. Journal of Molecular Biology. 372 (5), 1179-1188 (2007).
- Kaushal, S., Ridge, K. D., Khorana, H. G. Structure and function in rhodopsin: the role of asparagine-linked glycosylation. Proceedings of the National Academy of Sciences of the United States of America. 91 (9), 4024-4028 (1994).
- Molday, L. L., Molday, R. S. 1D4: a versatile epitope tag for the purification and characterization of expressed membrane and soluble proteins. Methods in Molecular Biology. 1177 (604), 1-15 (2014).
- Carpenter, B., Tate, C. G. Expression and Purification of Mini G Proteins from Escherichia coli. Bio-Protocol. 7 (8), (2017).
- Grueninger-Leitch, F., D'Arcy, A., D'Arcy, B., Chène, C. Deglycosylation of proteins for crystallization using recombinant fusion protein glycosidases. Protein Science. 5 (12), 2617-2622 (1996).
- Rasmussen, S. G. F., et al. Crystal structure of the β2 adrenergic receptor-Gs protein complex. Nature. 477 (7366), 549-555 (2011).
- Loginova, M. Y., Rostovtseva, Y. V., Feldman, T. B., Ostrovsky, M. A. Light damaging action of all-trans-retinal and its derivatives on rhodopsin molecules in the photoreceptor membrane. Biochemistry (Moscow). 73 (2), 130-138 (2008).
- Alexandrov, A. I., Mileni, M., Chien, E. Y. T., Hanson, M. A., Stevens, R. C. Microscale Fluorescent Thermal Stability Assay for Membrane Proteins. Structure. 16 (3), 351-359 (2008).
- Sonoda, Y., et al. Benchmarking Membrane Protein Detergent Stability for Improving Throughput of High-Resolution X-ray Structures. Structure. 19 (1), 17-25 (2011).
- Maeda, S., et al. Crystallization scale preparation of a stable GPCR signaling complex between constitutively active rhodopsin and G-protein. PloS One. 9 (6), 98714 (2014).
- Boute, N., Jockers, R., Issad, T. The use of resonance energy transfer in high-throughput screening: BRET versus FRET. Trends in Pharmacological Sciences. 23 (8), 351-354 (2002).
- Singhal, A., Guo, Y., Matkovic, M., Schertler, G., Deupi, X., Yan, E. C. Y. Structural role of the T 94 I rhodopsin mutation in congenital stationary night blindness. EMBO Report. 17 (10), 1-10 (2016).
- Choe, H. -. W., et al. Crystal structure of metarhodopsin II. Nature. 471 (7340), 651-655 (2011).
- Mattle, D., et al. Ligand channel in pharmacologically stabilized rhodopsin. Proceedings of the National Academy of Sciences of the United States of America. 115 (14), 3640-3645 (2018).
- Okada, T., Fujiyoshi, Y., Silow, M., Navarro, J., Landau, E. M., Shichida, Y. Functional role of internal water molecules in rhodopsin revealed by X-ray crystallography. Proceedings of the National Academy of Sciences of the United States of America. 99 (9), 5982-5987 (2002).
- Blankenship, E., Vahedi-Faridi, A., Lodowski, D. T. The High-Resolution Structure of Activated Opsin Reveals a Conserved Solvent Network in the Transmembrane Region Essential for Activation. Structure. 23 (12), 2358-2364 (2015).
- Magnani, F., et al. A mutagenesis and screening strategy to generate optimally thermostabilized membrane proteins for structural studies. Nature Protocols. 11 (8), 1554-1571 (2016).
- Kawate, T., Gouaux, E. Fluorescence-detection size-exclusion chromatography for precrystallization screening of integral membrane proteins. Structure. 14 (4), 673-681 (2006).
- Standfuss, J., et al. The structural basis of agonist-induced activation in constitutively active rhodopsin. Nature. 471 (7340), 656-660 (2011).
- Singhal, A., et al. Insights into congenital stationary night blindness based on the structure of G90D rhodopsin. EMBO reports. 14 (6), 520-526 (2013).
- Carpenter, B., Nehmé, R., Warne, T., Leslie, A. G. W., Tate, C. G. Structure of the adenosine A(2A) receptor bound to an engineered G protein. Nature. 536 (7614), 104-107 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados