Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Producción microfluídica de liposomas sensibles a la temperatura que contienen lysolipido
En este artículo
Resumen
El protocolo presenta los parámetros optimizados para preparar liposomas termosensibles utilizando el dispositivo de microfluidos de micromezcladores de espiga escalonado. Esto también permite la co-encapsulación de doxorubicina y verde indocyanina en los liposomas y la liberación fototérmica-activada de doxorubicina para la liberación controlada / desencadenada de fármacos.
Resumen
El protocolo presentado permite una preparación continua de alto rendimiento de liposomas sensibles a la baja temperatura (LTSL), que son capaces de cargar fármacos quimioterápicos, como la doxorubicina (DOX). Para lograresto, se inyecta una mezcla de lípidos etanólicos y una solución de sulfato de amonio en un dispositivo microfluídico escalonado de espiga (SHM). Las soluciones son mezcladas rápidamente por el SHM, proporcionando un ambiente solvente homogéneo para el autoensamblaje de liposomas. Los liposomas recogidos primero se recocidos, luego se dializar para eliminar el etanol residual. Se establece un gradiente de pH de sulfato de amonio mediante el intercambio tampón de la solución externa mediante la cromatografía de exclusión de tamaño. El DOX se carga de forma remota en los liposomas con alta eficiencia de encapsulación (> 80%). Los liposomas obtenidos son homogéneos en tamaño con diámetro medio Z de 100 nm. Son capaces de liberar por ráfaga salpicada por temperatura de DOX encapsulado en presencia de hipertermia leve (42 oC). El verde indocyanina (ICG) también se puede cocargar en los liposomas para la liberación DOX casi infrarroja activada por láser. El enfoque microfluídico garantiza una preparación de LTSL de alto rendimiento, reproducible y escalable.
Introducción
La formulación de LTSL es un producto liposomal clínicamente relevante que se ha desarrollado para suministrar el fármaco quimioterapéutico doxorubicina (DOX) y permite la liberación eficiente del fármaco de ráfaga a hipertermia suave clínicamente alcanzable (T a 41 oC)1. La formulación LTSL consta de 1,2-dipalmitoyl-sn-glicero-3-fosfocolina (DPPC), el lisolípido 1-esteasinoylo-2-hidroxi-sn-glicero-3-fosfatidilcolina (MSPC; M significa "mono") y el lípido PEGylated 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[metoxi(polietilenglicol)-2000] (DSPE-PEG2000). Al llegar a la temperatura de transición de fase (Tm a 41 oC), el lisolípido y el DSPE-PEG2000 facilitan conjuntamente la formación de poros de membrana, lo que resulta en una liberación por ráfaga del fármaco2. La preparación de LTSL utiliza principalmente un enfoque de arriba hacia abajo a granel, a saber, la hidratación y la extrusión de película lipídica. Sigue siendo difícil preparar de forma reproducible grandes lotes con propiedades idénticas y en cantidades suficientes para aplicaciones clínicas3.
Microfluílica es una técnica emergente para la preparación de liposomas, que ofrece un tamaño de nanopartículas ajustable, reproducibilidad y escalabilidad3. Una vez optimizados los parámetros de fabricación, el rendimiento podría ampliarse mediante paralelización, con propiedades idénticas a las preparadas a escala de banco3,4,5. Una de las principales ventajas de los microfluidos sobre las técnicas convencionales a granel es la capacidad de manejar pequeños volúmenes de líquidos con alta capacidad de control en el espacio y el tiempo a través de la miniaturización, permitiendo una optimización más rápida, mientras que opera de manera continua y automatizada6. La producción de liposomas con dispositivos microfluídicos se logra mediante un enfoque de nanoprecipitación de abajo hacia arriba, que es más eficiente en tiempo y energía porque los procesos de homogeneización como la extrusión y la sonicación son innecesarios7. Por lo general, una solución orgánica (por ejemplo, etanol) de lípidos (y carga útil hidrófoba) se mezcla con un no disolvente miscible (por ejemplo, agua y carga útil hidrófila). A medida que el disolvente orgánico se mezcla con el no disolvente, se reduce la solubilidad de los lípidos. La concentración de lípidos finalmente alcanza una concentración crítica en la que se activa el proceso de precipitación7. Los nanoprecipitados de lípidos eventualmente crecen en tamaño y se cierran en un liposoma. Los principales factores que rigen el tamaño y la homogeneidad de los liposomas son la relación entre la relación no solvente y el disolvente (es decir, la relación de caudal acuoso-orgánico; FRR) y la homogeneidad del entorno solvente durante el autoensamblaje de lípidos en liposomas8.
Por lo tanto, la mezcla eficiente de fluidos en microfluidos es esencial para la preparación de liposomas homogéneos, y se han empleado diversos diseños de mezcladores en diferentes aplicaciones9. El micromezclador de espiga escalonada escalonada (SHM) representa una de las nuevas generaciones de mezcladores pasivos, lo que permite un alto rendimiento (en el rango de ml/min) con un factor de dilución bajo. Esto es superior a los dispositivos de mezcla hidrodinámicos microfluídicos tradicionales8,10. El SHM ha estampado ranuras de espina de arenque, que mezclan rápidamente fluidos por advección caótica9,11. La escala temporal de mezcla corta de SHM (< 5 ms, menor que la escala de tiempo de agregación típica de 10-100 ms) permite que el autoensamblaje de lípidos se produzca en un entorno solvente homogéneo, produciendo nanopartículas con distribución de tamaño uniforme3,12.
La preparación de LTSL con microfluidos no es, sin embargo, tan sencilla en comparación con las formulaciones liposomales convencionales debido a la falta de colesterol8,sin las cuales las bicapas lipídicas son susceptibles a la interdigitación inducida por etanol13,14,15. Hasta ahora, el efecto del etanol residual se presenta durante la producción microfluídica de liposomas no se ha entendido bien. La mayoría de las formulaciones notificadas son intrínsecamente resistentes a la interdigitación (que contiene colesterol o lípidos insaturados)16, que a diferencia de los LTSL están saturados y libres de colesterol.
El protocolo presentado aquí utiliza SHM para preparar LOS LTSL para la administración de fármacos de liberación activada por temperatura. En el método presentado, nos aseguramos de que los LTSL preparados microfluídicos sean de tamaño nanométrico (100 nm) y uniformes (dispersidad < 0.2) por dispersión dinámica de luz (DLS). Además, encapsulamos DOX utilizando el método de gradiente de sulfato de amonio transmembrana (también conocido como carga remota)17 como una validación de la integridad de la bicapa lipídica LTSL. La carga remota de DOX requiere que el liposoma mantenga un pH-gradiente para lograr una alta eficiencia de encapsulación (EE), que es poco probable que suceda sin una bicapa de lípidos intacta. En este método presentado, distintivo de los protocolos típicos de preparación de liposoma microfluídico, se requiere un paso de recocido antes de que se elimine el etanol para habilitar la capacidad de carga remota; es decir, para restaurar la integridad de la bicapa lipídica.
Como se mencionó anteriormente, las cargas útiles hidrófilas e hidrófobas también se pueden introducir en las soluciones iniciales para la encapsulación simultánea de cargas útiles durante la formación de LTSL. Como prueba de concepto, el verde indocyanina (ICG), un tinte fluorescente de infrarrojo cercano aprobado por la FDA, que también es un agente fototérmico prometedor, se introduce en la mezcla de lípidos inicial y se cocarga con éxito en los LTSL. Un láser de 808 nm se utiliza para irradiar los LTSL cargados por DOX/ICG e inducir con éxito la liberación de ráfaga sactivó el calentamiento fototérmico de DOX en un plazo de 5 minutos.
Todos los instrumentos y materiales están disponibles comercialmente, listos para usar y sin necesidad de personalización. Dado que se han optimizado todos los parámetros para la formulación de LTSL, siguiendo este protocolo, los investigadores sin conocimiento previo de microfluidos también podrían preparar los LTSL, que sirve como base de un sistema de administración de fármacos termosensibles.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Configuración del equipo
- Montar las bombas de jeringa y SHM de la siguiente manera.
- Conecte el puerto "Al ordenador" de la bomba de jeringa secundaria (Bomba 02, para solución acuosa) al puerto "A la red" de la bomba de jeringa maestra (Bomba 01, para solución de lípidos de etanol) utilizando el cable de red Bomba a bomba(Figura 1, amarillo).
- Conecte el puerto "Al ordenador" de la bomba maestra al puerto "RS232 Serial" del ordenador utilizando el PC al cable de red de la bomba(Figura 1,azul).
- Conecte el tubo a cada una de las entradas y salidas del SHM utilizando una tuerca y una férula. Convierta el terminal del tubo para ambas entradas a Luer hembra utilizando otra tuerca y férula y un conjunto de unión. El tubo más largo de las entradas permite una fijación más fácil a las jeringas(Figura 2).
- Configure el software de control de la bomba.
- Asigne la dirección de la bomba de jeringa maestra y la bomba de jeringa secundaria a "Ad:01" y "Ad:02", respectivamente, utilizando el botón "Configuración" de la bomba de jeringa. Esto sólo tiene que hacerse por primera vez.
- Abra el software de control de la bomba en el ordenador. Las dos bombas de jeringa deben detectarse automáticamente, seguidas de un pitido. De lo contrario, haga clic en Bombas y busque bombas para actualizar la conexión. (Figura 3).
- Asigne Diámetro a 12,45 (mm) seleccionando "HSW Norm-Ject 5 cc (Dia-12.45)".
- Asigne la velocidad a 0,25 ml/min para la bomba 01 (solución de lípidos de etanol) y 0,75 ml/min para la bomba 02 (solución acuosa). Los caudales corresponden a un caudal total (TFR) de 1 ml/min y una relación de caudal acuoso-etanol (FRR) de 3.
- Asigne volumen a cualquier valor superior a 5 ml.
NOTA: El volumen de perfusión objetivo se establece mayor que el volumen de líquido cargado teniendo en cuenta el volumen vacío de la tubería. - Seleccione el modo INF (infusión) para ambas bombas.
- Pulse Set para confirmar los ajustes.
2. Preparar los LTSL
- Preparar una mezcla de lípidos LTSL10 o LTSL10-ICG (ver Tabla 1).
- Retirar 1 ml de mezcla de lípidos y al menos 3 ml de (NH4)2SO4 solución utilizando dos jeringas de bloqueo Luer de 5 ml.
- Instale las dos jeringas en las bombas de jeringa en posición vertical deslizando la brida del barril de la jeringa hasta el retenedor de la jeringa de la bomba y la brida del émbolo de la jeringa hasta el bloque de empuje de la bomba(Figura 4).
- Envuelva el extremo de la cinta de calentamiento en la jeringa con la solución acuosa. Envuelva el otro extremo de la cinta de calentamiento y la sonda de temperatura del termostato alrededor de la jeringa con la solución de lípidos. Es útil practicar este paso con jeringas vacías en su lugar con el fin de facilitar el proceso de montaje(Figura 5A).
- Conecte las dos jeringas a los adaptadores Luer hembra de las entradas correspondientes del SHM. Asegúrese de que las jeringas que contienen la mezcla de lípidos y (NH4)2soluciones SO4 están conectadas a la entrada de etanol y la entrada acuosa, respectivamente. Ajuste la posición del émbolo para eliminar las burbujas de aire de las jeringas(Figura 5B).
NOTA: Asegúrese de que las jeringas aún estén colocadas de forma segura en el retenedor de la jeringa de las bombas. - Caliente las jeringas a más de 51 oC utilizando la cinta de calentamiento utilizando una sesión de calentamiento de 10 s. Permita que el termostato actualice la temperatura de las jeringas. Repita este paso en los pasos siguientes para mantener la temperatura durante la perfusión.
ADVERTENCIA: Apague la cinta de calefacción después de 10 s para evitar el exceso de temperatura y permita que el termostato actualice la temperatura real. La cinta de calefacción también debe manipularse con cuidado, ya que su temperatura aumenta muy rápidamente. La calefacción puede dañar continuamente el equipo y las jeringas, debido al retardo de tiempo del termostato para actualizar la temperatura medida. - Una vez que la temperatura esté por encima de 51 oC, ejecute las bombas de jeringa pulsando Run All en el software de control de la bomba(Figura 3).
- Asegúrese de que el flujo de fluido esté libre de burbujas de aire y cualquier fuga. Deseche el volumen inicial (alrededor de 0,5 ml) de líquido de la salida como residuo.
NOTA: Este volumen inicial de residuos no es definido y depende del volumen interno de la configuración, que es el volumen para que el fluido viaje desde las jeringas a través de la tubería y SHM a la salida. - Recoger el resto del líquido como muestras de liposomas en un tubo de microcentrífuga o vial bijou.
- Pausar/detener la perfusión cuando el líquido de cualquiera de las jeringas esté casi vacío.
NOTA: Las bombas deben detenerse manualmente, ya que es posible que las bombas no detecten con precisión la posición cuando las jeringas están vacías. - Colocar las soluciones de liposomas recogidas en un baño de agua de 60 oC para recocido durante 1,5 h.
NOTA: Este paso es esencial para habilitar la carga de fármacos en los liposomas. - Transfiera las soluciones a los tubos de diálisis. Dialyze las soluciones contra 1 L de 240 mM (NH4)2SO4 a 37 oC durante al menos 4 h para obtener liposomas purificados.
NOTA: El protocolo se puede pausar aquí. Los liposomas en este paso están a 5 mM de fosfolípidos. Los liposomas purificados se pueden almacenar a 4 oC. - Para limpiar el SHM para su uso repetido, enjuague el SHM secuencialmente con agua desionizada, etanol y seque con gas nitrógeno.
3. Carga remota de DOX en LTSL por gradiente de pH transmembrana
- Intercambie el búfer externo de los LTSL a la solución salina almacenada en búfer HEPES (HBS) mediante la cromatografía de exclusión de tamaño (SEC) para establecer un gradiente de pH transmembrana.
- Agregue un total de 25 ml de HBS a la parte superior de una columna SEC para preparar la columna. Permita que todos los eluyentes eluyen a través de la columna y deseche el eluido.
- Añadir 1 mL de liposomas dializados, preparados a partir del paso 2.12, a la columna y desechar el eluido.
- Agregue 1,5 ml de HBS a la columna y deseche el eluido.
- Añadir 3 mL de HBS a la columna y recoger los 3 mL de elute.
NOTA: El protocolo se puede pausar aquí. Los liposomas se recogen en este paso y están a 1,67 mM de fosfolípido. Los liposomas intercambiados en el búfer se pueden almacenar a 4 oC.
- Incubar LTSL con doxorubicina (DOX) y purificar LTSL.
- Añadir la solución DOX en una relación molar de 1:20 DOX a fosfolípidos en 1 ml de solución de liposomas intercambiados en tampón (1,67 mmol) contenida en un vial bijou. Esto se puede lograr mediante la adición de 48,4 l de 1 mg/ml de solución DOX (83,4 mmol).
- Colocar el vial bijou en un baño de agua de 37oC durante 1,5 h para permitir la carga DOX en los liposomas.
- Mezclar 10 l de los liposomas con 170 éL de HBS y 20 ml de 1% (v/v) de tritón X-100 solución en una placa negra de 96 pocillos. Repita para tres pozos. Estos pozos corresponden al contenido DOX "antes de la purificación".
- En caso de preparar LTSL10-ICG, mezcle 40 éL de los liposomas con 160 ml de DMSO en una placa transparente de 96 pocillos. Repita para tres pozos. Estos pozos corresponden al contenido de ICG "antes de la purificación".
- Purificar la solución de liposomas como se describe en el paso 3.1.
NOTA: Para reutilizar la columna para la purificación futura, limpie la columna de DOX libre añadiendo primero 1 ml de solución NaOH diluida de 0,5 M antes de realizar el paso 3.1.1. DoX libre en rojo se volverá azul violeta y eluirá a través de la columna rápidamente. - Mezclar 30 l de la solución de liposomas purificados con 150 ml de HBS y 20 ml de solución Triton X-100 del 1% (v/v) en una placa negra de 96 pocillos. Repita para tres pozos. Estos pozos corresponden al contenido DOX "después de la purificación".
- En el caso de LTSL10-ICG, mezcle 40 ml de la solución de liposomas purificados con 160 ml de DMSO en una placa transparente de 96 pocillos. Repita para tres pozos. Estos pozos corresponden al contenido de ICG "después de la purificación".
- Mida la intensidad de fluorescencia DOX de los pozos antes (paso 3.2.3) y después (paso 3.2.5) de purificación, utilizando un lector de microplacas(por ejemplo, 485 nm,em a 590 nm).
- Calcular la eficiencia de encapsulación de DOX (DOX EE) tomando la relación de las intensidades de fluorescencia antes y después de la purificación.
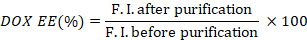
- Mida la absorción ICG de los pozos antes y después de la purificación, utilizando un lector de microplacas (600 a 1000 nm).
- Calcular la eficiencia de encapsulación de ICG (ICG EE) tomando la relación de la absorbancia a 792 nm antes y después de la purificación, teniendo en cuenta el factor de dilución (3 veces) durante la purificación.

4. Dispersión dinámica de la luz (DLS)
- Añadir 50 l de solución de liposomas (paso 2.12) a 450 l de agua desionizada.
- Coloque la cubeta dentro del instrumento DLS y realice la medición de acuerdo con las instrucciones del fabricante.
- Registre el diámetro medio z y la dispersión de tres mediciones para cada muestra.
5. Calorimetría de escaneo diferencial (DSC)
- Concentrar 1 ml de las muestras de liposomas (paso 2.12) con una unidad de filtro centrífugo a 0,5 ml (concentración final de lípidos de 10 mM). Usando un rotor de ángulo fijo, gire a 7500 x g durante aproximadamente 15 min.
- Transfiera 20 ml de (NH4)2SO4 solución y liposomas muestras a dos bandejas DSC respectivas. Selle las sartenes con tapas herméticas DSC utilizando el kit de prensa de muestra DSC.
- Mida la muestra de 30 oC a 60 oC a una velocidad de calentamiento de 1 oC/min utilizando un calorímetro de escaneo diferencial.
- Analice los datos con el software adecuado. Tome la temperatura de transición de fase (Tm) como el inicio de la transición de fase (pico de fusión), que se mide por la intercepción x de la tangente del punto de pendiente máxima.
6. Liberación de doxorubicina
- Precalentar HBS a temperatura designada (37 o 42 oC) utilizando un baño de agua. Prepare un baño de agua helada para aplacar las muestras.
- Añadir 100 l de liposomas purificados con carga DOX (paso 3.2.5) en 1,9 ml de HBS en un tubo de microcentrífuga. Coloque el tubo en el baño de agua de la temperatura designada.
- Retirar inmediatamente 200 l de muestras del tubo y colocarlo rápidamente en el baño de agua helada para saciar cualquier liberación posterior del medicamento. Este ejemplo corresponde al punto de tiempo inicial (t - 0).
- Retirar 200 l de muestras en los puntos de tiempo subsiguientes (t 5, 10, 15, 30, 60 min) y colocarlo rápidamente en el baño de agua helada para saciar cualquier liberación de drogas.
- Mezclar 50 ml de muestra de cada punto de tiempo con 150 ml de HBS en una placa negra de 96 pocillos. Mida la intensidad de la fluorescencia DOX utilizando un lector de placas.
- Añadir 20 s l de 1% (v/v) Triton X-100 en pozos seleccionados al azar preparados en el paso 6.5. Mida la intensidad de fluorescencia DOX de estos pozos utilizando un lector de placas. Estos valores corresponden al punto de tiempo completamente liberado (t a; 100% release).
- Calcular y trazar el porcentaje de DOX liberado interpolando la intensidad de fluorescencia de cada punto de tiempo (I(t)), en comparación con el valor inicial (I(0)) y completamente liberado (I()).
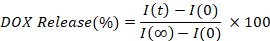
7. Calefacción láser y liberación activada
- Ajuste la temperatura del baño de agua a 37 oC y deje que la temperatura se estabilice.
- Añadir 200 l de LTSL10-ICG cargado por DOX ([ICG] a 10 g/ml) a una placa transparente de 96 pocillos, luego colocarla en el baño de agua, mantener el fondo sumergido en agua.
- Ajuste la corriente del sistema láser a 2,27 A. Coloque el colimador del sistema láser a 5 cm verticalmente por encima de la superficie de la placa de 96 pocillos, que corresponde a un flujo de energía de 0,5 W/cm2 [Figura 6].
ADVERTENCIA: El sistema láser debe funcionar de acuerdo con las medidas de seguridad láser pertinentes. - Encienda el láser y monitoree la temperatura cada minuto utilizando una sonda de temperatura de fibra óptica.
- A los 5 y 10 min, retire 10 ml de liposomas irradiados por láser de la placa transparente de 96 pocillos y mezcle con 190 ol de HBS para tres pocillos en una placa negra de 96 pocillos.
- Mezclar 10 l de los liposomas con 170 éL de HBS y 20 l de 1% (v/v) De tritón X-100 para tres pocillos en una placa negra de 96 pocillos. Estos pozos corresponden al contenido DOX "100% liberado". Mida la intensidad fluorescente DOX y calcule la versión DOX como se describe en el paso 6.7.
Access restricted. Please log in or start a trial to view this content.
Resultados
La preparación de los LTSL por microfluidos requiere la composición lipídica de DPPC/MSPC/DSPE-PEG2000 (80/10/10, relación molar; LTSL10). La Figura 7A (izquierda) muestra la apariencia de LTSL10 preparado del paso 2.9, como un líquido transparente y no viscoso. La formulación LTSL10 se desarrolla a partir de la formulación convencional, LTSL4 (DPPC/MSPC/DSPE-PEG2000, 86/10/4, relación molar) ya que LTSL4 forma u...
Access restricted. Please log in or start a trial to view this content.
Discusión
El protocolo presentado describe la preparación de liposomas sensibles a la baja temperatura (LTSL) utilizando un micromezclador de espiga escalonada (SHM). La formulación LTSL10 permite la liberación de doxorubicina activada por temperatura en 5 minutos a una temperatura hipertérmica clínicamente alcanzable de 42 oC. El verde indocyanina (ICG) también se puede cocargar para el calentamiento fototérmico desencadenado la liberación de DOX. El método se basa en: i) autoensamblaje de fosfolípidos en liposomas bajo...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a Prostate Cancer UK (CDF-12-002 Fellowship) y al Consejo de Investigación de Ingeniería y Ciencias Físicas (EPSRC) (EP/M008657/1) por su financiación.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 1,2-dipalmitoyl-sn-glycero-3-phosphocholine (DPPC) | Lipoid | PC 16:0/16:0 (DPPC) | |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (DSPE-PEG2000) | Lipoid | PE 18:0/18:0-PEG 2000 (MPEG 2000-DSPE) | |
| 1-stearoyl-2-hydroxy-sn-glycero-3-phosphocholine (MSPC) | Avanti Polar Lipid | 855775P-500MG | Distributed by Sigma-Adrich; also known as Lyso 16:0 PC (Not to be confused with 14:0/18:0 PC, which is also termed MSPC) |
| 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) | Sigma-Aldrich | H3375-100G | |
| Adapters, Female Luer Lock to 1/4"-28UNF | IDEX Health & Science | P-624 | Requires 2 units. For the inlets |
| Adapters, Union Assembly, 1/4"-28UNF | IDEX Health & Science | P-630 | Requires 2 units. (One unit included 2 nuts and 2 ferrules) |
| Ammonium Sulfate ((NH4)2SO4) | Sigma-Aldrich | 31119-1KG-M | |
| Bijou vial | VWR | 216-0980 | 7 mL, clear, polystyrene vial |
| Centrifugal Filter Unit | Sigma-Aldrich | UFC801008 | 10 kDa MWCO, Amicon Ultra-4 Centrifugal Filter Unit |
| Centrifuge | ThermoFisher Scientific | Heraeus Megafuge 8R | With HIGHConic III Fixed Angle Rotor |
| Cuvette | Fisher Scientific | 11602609 | Disposable polystyrene cuvette, low volume, for DLS measurement |
| Dialysis Kit - Pur-A-Lyzer Maxi | Sigma-Aldrich | PURX12015-1KT | 12-14 kDa MWCO |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | 34943-1L-M | |
| DLS Instrument | Malvern Panalytical | Zetasizer Nano ZS90 | |
| Doxorubicin Hydrochloride (DOX) | Apollo Scientific | BID0120 | |
| DSC Instrument | TA Instruments | TA Q200 DSC | |
| DSC Tzero Hermetic Lids | TA Instruments | 901684.901 | For DSC measurement |
| DSC Tzero Pans | TA Instruments | 901683.901 | For DSC measurement |
| DSC Tzero Sample Press Kit | TA Instruments | 901600.901 | For DSC measurement |
| Ethanol | VWR | 20821.330 | Absolute, ≥99.8% |
| FC-808 Fibre Coupled Laser System | CNI Optoelectronics Tech | FC-808-8W-181315 | FOC-01-B Fiber Collimator included. |
| Ferrule, 1/4"-28UNF to 1/16" OD | IDEX Health & Science | P-200 | For the outlet |
| Fibre Optic Temperature Probe | Osensa | PRB-G40 | |
| Glass Staggered Herringbone Micromixer (SHM) | Darwin Microfluidics | Herringbone Mixer - Glass Chip | |
| Heating Tape | Omega | DHT052020LD | Can be replaced by other syringe heater such as "HTC" or "SRT series" for slower heating. Manual wiring to a 3-pin plug required for 240V models |
| Indocyanine Green | Adooq | A10473-100 | Distributed by Bioquote Limited (U.K.) |
| Luer-lock Syringe, 5 mL | VWR | 613-2043 | Hanke Sass Wolf SOFT-JECT 3-piece syringes, O.D. 12.45 mm |
| Microplate Reader | BMG Labtech | FLUOstar Omega | Installed with 485 nm (exictation) and 590 nm (emission) filters |
| Microplate, 96-well, Black, Flat-bottom | ThermoFisher Scientific | 611F96BK | For fluorescence measurement in microplate reader |
| Microplate, 96-well, Clear, Flat-bottom | Grenier | 655101 | For absorbance measurement microplate reader |
| Nut, 1/4"-28UNF to 1/16" OD | IDEX Health & Science | P-245 | For the outlet |
| PC to Pump Network Cable for Aladdin, 7ft | World Precision Instruments | NE-PC7 | Optional: Syringe pumps can be operated manually |
| Pump control software - SyringePumpPro Software License for 2 | World Precision Instruments | SYRINGE-PUMP-PRO-02 | Optional: Syringe pumps can be operated manually |
| Pump to Pump Network Cable for Aladdin, 7 ft | World Precision Instruments | NE-NET7 | Optional: Syringe pumps can be operated manually |
| Size exclusion chromatography (SEC) column | GE Life Science | 17085101 | Sephadex G-25 resin in PD-10 Desalting Columns |
| Sodium chloride (NaCl) | Sigma-Aldrich | 31434-1KG-M | |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | S5881-500G | |
| Syringe Pumps & Cable (DUAL-PUMP-NE-1000) | World Precision Instruments | ALADDIN2-220/AL1000-220 | |
| Thermostat Temperature Controller | Inkbird | ITC-308 | Can be replaced by other syringe heater kit/thermostat |
| Triton X-100 | Sigma-Aldrich | X100-100ML | |
| Tubing, ETFE (1/16" OD) | IDEX Health & Science | 1516 | |
| USB To RS-232 Converter | World Precision Instruments | CBL-USB-232 | Optional: For computer without RS-232 port |
| Water Bath | Grant Instruments Ltd. | JB Nova 12 |
Referencias
- Needham, D., Park, J., Wright, A. M., Tong, J. Materials characterization of the low temperature sensitive liposome (LTSL): effects of the lipid composition (lysolipid and DSPE-PEG2000) on the thermal transition and release of doxorubicin. Faraday Discussions. 161, 515-534 (2013).
- Ickenstein, L. M., Arfvidsson, M. C., Needham, D., Mayer, L. D., Edwards, K. Disc formation in cholesterol-free liposomes during phase transition. Biochimica et Biophysica Acta - Biomembranes. 1614 (2), 135-138 (2003).
- Valencia, P. M., Farokhzad, O. C., Karnik, R., Langer, R. Microfluidic technologies for accelerating the clinical translation of nanoparticles. Nature Nanotechnology. 7 (10), 623-629 (2012).
- Chen, D., et al. Rapid discovery of potent siRNA-containing lipid nanoparticles enabled by controlled microfluidic formulation. Journal of the American Chemical Society. 134 (16), 6948-6951 (2012).
- Forbes, N., et al. Rapid and scale-independent microfluidic manufacture of liposomes entrapping protein incorporating in-line purification and at-line size monitoring. International Journal of Pharmaceutics. 556, 68-81 (2019).
- Dittrich, P. S., Manz, A. Lab-on-a-chip: microfluidics in drug discovery. Nature Reviews Drug Discovery. 5 (3), 210-218 (2006).
- Capretto, L., Carugo, D., Mazzitelli, S., Nastruzzi, C., Zhang, X. Microfluidic and lab-on-a-chip preparation routes for organic nanoparticles and vesicular systems for nanomedicine applications. Advanced Drug Delivery Reviews. 65 (11-12), 1496-1532 (2013).
- Cheung, C. C. L., Al-Jamal, W. T. Sterically stabilized liposomes production using staggered herringbone micromixer: Effect of lipid composition and PEG-lipid content. International Journal of Pharmaceutics. 566, 687-696 (2019).
- Suh, Y. K., Kang, S. A. Review on Mixing in Microfluidics. Micromachines. 1 (3), 82-111 (2010).
- Jahn, A., Vreeland, W. N., Gaitan, M., Locascio, L. E. Controlled Vesicle Self-Assembly in Microfluidic Channels with Hydrodynamic Focusing. Journal of the American Chemical Society. 126 (9), 2674-2675 (2004).
- Stroock, A. D. Chaotic Mixer for Microchannels. Science. 295 (5555), 647-651 (2002).
- Belliveau, N. M., et al. Microfluidic Synthesis of Highly Potent Limit-size Lipid Nanoparticles for In Vivo Delivery of siRNA. Molecular Therapy - Nucleic Acids. 1 (8), 37(2012).
- Patra, M., et al. Under the influence of alcohol: The effect of ethanol and methanol on lipid bilayers. Biophysical Journal. 90 (4), 1121-1135 (2006).
- Komatsu, H., Rowe, E. S., Rowe, E. S. Effect of Cholesterol on the Ethanol-Induced Interdigitated Gel Phase in Phosphatidylcholine: Use of Fluorophore Pyrene-Labeled Phosphatidylcholine. Biochemistry. 30 (9), 2463-2470 (1991).
- Lu, J., Hao, Y., Chen, J. Effect of Cholesterol on the in Lysophosphatidylcholine Formation of an Interdigitated Gel Phase and Phosphatidylcholine Binary. Journal of Biochemistry. 129 (6), 891-898 (2001).
- Vanegas, J. M., Contreras, M. F., Faller, R., Longo, M. L. Role of unsaturated lipid and ergosterol in ethanol tolerance of model yeast biomembranes. Biophysical Journal. 102 (3), 507-516 (2012).
- Haran, G., Cohen, R., Bar, L. K., Barenholz, Y. Transmembrane ammonium sulfate gradients in liposomes produce efficient and stable entrapment of amphipathic weak bases. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1151 (2), 201-215 (1993).
- Sadeghi, N., et al. Influence of cholesterol inclusion on the doxorubicin release characteristics of lysolipid-based thermosensitive liposomes. International Journal of Pharmaceutics. 548 (2), 778-782 (2018).
- Lawaczeck, R., Kainosho, M., Chan, S. I. The formation and annealing of structural defects in lipid bilayer vesicles. Biochimica et Biophysica Acta (BBA) - Biomembranes. 443 (3), 313-330 (1976).
- Komatsu, H., Okada, S. Ethanol-induced aggregation and fusion of small phosphatidylcholine liposome: participation of interdigitated membrane formation in their processes. BBA - Biomembranes. 1235 (2), 270-280 (1995).
- Marsh, D., Bartucci, R., Sportelli, L. Lipid membranes with grafted polymers: physicochemical aspects. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1615 (1-2), 33-59 (2003).
- Hood, R. R., Vreeland, W. N., DeVoe, D. L. Microfluidic remote loading for rapid single-step liposomal drug preparation. Lab on a Chip. 14 (17), 3359-3367 (2014).
- Dalwadi, G., Benson, H. A. E., Chen, Y. Comparison of diafiltration and tangential flow filtration for purification of nanoparticle suspensions. Pharmaceutical Research. , (2005).
- Roces, C., Kastner, E., Stone, P., Lowry, D., Perrie, Y. Rapid Quantification and Validation of Lipid Concentrations within Liposomes. Pharmaceutics. 8 (3), 29(2016).
- Kim, S. -H., Kim, J. W., Kim, D. -H., Han, S. -H., Weitz, D. A. Enhanced-throughput production of polymersomes using a parallelized capillary microfluidic device. Microfluidics and Nanofluidics. 14 (3-4), 509-514 (2013).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados