Method Article
Preparación de rebanadas agudas de hipocampo humano para grabaciones electrofisiológicas
En este artículo
Erratum Notice
Resumen
El protocolo presentado describe el transporte y la preparación del tejido hipocampal humano resecado con el objetivo final de utilizar las rebanadas cerebrales vitales como una herramienta de evaluación preclínica para posibles sustancias antiepilépticas.
Resumen
La epilepsia afecta a alrededor del 1% de la población mundial y conduce a una disminución grave de la calidad de vida debido a las convulsiones en curso, así como al alto riesgo de muerte súbita. A pesar de la abundancia de opciones de tratamiento disponibles, alrededor del 30% de los pacientes son resistentes a los medicamentos. Se han desarrollado varias terapias novedosas utilizando modelos animales, aunque la tasa de pacientes farmacorresistentes sigue sin modificaciones. Una de las razones probables es la falta de traducción entre los modelos de roedores y los seres humanos, como una débil representación de la farmacososestencia humana en modelos animales. Tejido cerebral humano resecado como una herramienta de evaluación preclínica tiene la ventaja de cerrar esta brecha traslacional. Descrito aquí es un método para la preparación de alta calidad de las rebanadas cerebrales del hipocampo humano y la posterior inducción estable de la actividad epileptiforma. El protocolo describe la inducción de la actividad de ráfaga durante la aplicación de 8 mM KCl y 4-aminopyridin. Esta actividad es sensible a la lacosamida de AED establecida o a nuevos candidatos antiepilépticos, como la dimetiletanolamina (DMEA). Además, el método describe la inducción de eventos similares a convulsiones en CA1 de las rebanadas de cerebro hipocampo humano mediante la reducción de Mg2+ extracelular y la aplicación de la bicicucula, un bloqueador de receptores GABAA. La configuración experimental se puede utilizar para detectar posibles sustancias antiepilépticas para sus efectos sobre la actividad epileptiforma. Además, los mecanismos de acción postulados para compuestos específicos pueden validarse utilizando este enfoque en el tejido humano (por ejemplo, mediante grabaciones de abrazaderas de parches). Para concluir, la investigación del tejido cerebral humano vital ex vivo (aquí, resectado hipocampo de pacientes que sufren de epilepsia del lóbulo temporal) mejorará el conocimiento actual de los mecanismos fisiológicos y patológicos en el cerebro humano.
Introducción
La epilepsia es uno de los trastornos neurológicos más comunes, que afecta al 1% de la población mundial, y se asocia con un aumento de la morbilidad y mortalidad1,,2. Desafortunadamente, un tercio de los pacientes que sufren de epilepsia son resistentes a los medicamentos, a pesar de la abundancia de opciones de tratamiento disponibles, incluyendo más de 20 medicamentos antiepilépticos aprobados (AED)3. No traducir los resultados de la investigación preclínica en animales a los ensayos clínicos es una de las razones por las que las estrategias de tratamiento prometedoras no son eficaces en muchos pacientes4. Recientemente, neuropéptido Y (NPY) y galanina han demostrado tener efectos antiepilépticos en modelos animales; sin embargo, cuando se probó en tejido cerebral humano resecado, sólo NPY fue eficaz5.
La mayoría de los conocimientos existentes sobre los mecanismos neurológicos básicos y los enfoques de terapia de enfermedades provienen de modelos animales y experimentos de cultivo celular. Aunque informativos, estos modelos sólo representan aspectos individuales de enfermedades humanas complejas y la red cerebral humana adulta. Alternativamente, el tejido cerebral humano tiene el potencial de cerrar la brecha traslacional, pero rara vez está disponible para estudios funcionales. Por ejemplo, el tejido cerebral post mortem ha sido una herramienta valiosa para investigar la expresión de proteínas, la morfología cerebral o las conexiones anatómicas, aunque la actividad neuronal a menudo se ve comprometida es este tejido6,,7,,8,,9,,10,,11.
Por el contrario, se ha investigado el tejido cerebral humano resecreado vivo en relación con la evaluación preclínica de fármacos, las funciones neuronales básicas y los patrones de expresión génica12,,13,14,15,16,17. Una gran ventaja de las rebanadas cerebrales humanas en comparación con las rebanadas de roedores es la viabilidad larga del tejido neuronal después de la resección y preparación. En comparación con las rebanadas cerebrales de roedores, que normalmente se pueden registrar hasta 8 h después de la preparación, las rebanadas cerebrales humanas muestran una actividad neuronal estable durante hasta 72 h, lo que permite una investigación exhaustiva de estas muestras raras y valiosas12,,18.
Varios estudios han investigado las propiedades de la actividad epileptiforma en varias áreas del tejido humano cortical e hipocampal resecado y han utilizado diferentes métodos para la inducción de la actividad epileptiforme. En las rodajas de roedores, la actividad epileptiforme puede ser inducida por varios métodos: estimulación eléctrica de células DG hilar, aumento de K+ extracelular (8-12 mM KCl), bloqueo de receptores GABAA por bicculalina (BIC), bloqueo de canales de potasio por 4-aminopiridina (4-AP), y eliminación o reducción de Mg2+ en solución extracelular19. Sin embargo, la inducción de la actividad epileptiforme en el tejido humano requiere la combinación de al menos dos de los métodos antes mencionados20,21,22.
Aquí se presenta un método para la preparación de rebanadas cerebrales hipocampales humanas, que son viables hasta 20 h y muestran la inducción de la actividad epileptiforma tras la aplicación de K+ (8 mM) y 4-AP o bajo Mg2+ y BIC.
Protocolo
Los pacientes deben dar su consentimiento informado por escrito antes de la operación, y los acuerdos éticos necesarios deben estar en marcha antes del experimento. En cuanto a los resultados representativos, todos los estudios en los que participaron participantes en humanos fueron revisados y aprobados por Charité-Universitétsmedizin, Berlín (EA2/111/14).
1. Preparación de soluciones 10x
NOTA: Debido a las dificultades en la planificación del acceso al tejido cerebral humano, se recomienda preparar soluciones 10x como se describe aquí. Alternativamente, las soluciones finales 1x se pueden preparar recién añadiendo sustancias individuales en la concentración final al agua doble destilada (ddH2O).
- Para soluciones 10x individuales, agregue las sustancias a ddH2O según la Tabla 1 y revuelva hasta que se disuelvan.
- Utilice soluciones 10x hasta 1 mes después de la preparación (hasta 1 año para congelado 10x colina aCSF).
- Para 10x aCSF colina, preparar 50 mL alícuotas de 10x 1.1 colina aCSF (Tabla 1) y congelar a -20 oC o -80 oC hasta su uso posterior.
NOTA: No agregue glucosa y CaCl2 a 10x 1.1 colina aCSF para evitar la contaminación con bacterias y la precipitación de carbonato de calcio. - La solución 10x 2 se puede utilizar para todas las soluciones finales 1x, mientras que las soluciones 10x 1.1–1.4 se personalizan y se nombran en consecuencia(Tabla 1).
2. Preparación de soluciones finales 1x
NOTA: Las soluciones Final 1x deben prepararse frescas o lo más rápido posible el día anterior a su uso. Todas las soluciones finales deben carbogenarse con 5% de CO2 y 95% O2 utilizando un dispersor de gas de vidrio para enriquecer las soluciones con oxígeno, y ajustar el pH a 7,4 (máx. 7,4 x 0,2).
- ACSF de colina para el transporte y la preparación
- Para la solución final de 500 ml, descongele una alícuota de 50 ml de la solución 10x 1,1 alícuota para aCSF de colina en un baño de agua de 37 oC.
- Añadir la alícuota descongelada de 50 ml de la solución 10x 1,1 y 50 ml de solución 10x 2 a aproximadamente 300 ml de ddH2O.
- Añadir las concentraciones finales de glucosa y CaCl2, luego remover hasta que se disuelvan(Tabla 1, solución 1.1).
- Añadir ddH2O a un volumen final de 500 ml y medir la osmolaridad (300 mOsm a 10 mOsm).
- Opcionalmente, utilice un filtro para esterilizar la solución (ver discusión sobre la viabilidad prolongada de la rebanada en condiciones estériles).
- Llenar una botella separada con aproximadamente 100 ml de 1x colina aCSF para el transporte de la sala de operaciones al laboratorio.
- Opcional: dependiendo del tiempo de transporte desde la sala de operaciones hasta el laboratorio, considere el uso de tapas de botellas herméticas a gas para garantizar un pH estable de aCSF durante períodos de transporte más largos.
- Almacene la solución final a 4-8 oC hasta su uso posterior.
- El día de la operación, enfriar 1x colina aCSF en hielo y carrogenate durante al menos 10-15 min utilizando un dispersor de gas de vidrio conectado al gas carbógeno (5% CO2,95% O2).
NOTA: Considere la posibilidad de mantener una botella de gas accesible a la sala de operaciones en caso de tiempos de espera más largos, lo que requerirá la re-carbogenación de la solución de transporte. Sin embargo, hemos transportado tejido hipocampal sin re-carbogenación antes de tiempos de transporte largos y cortos (15 min vs. 60 min) y no observamos diferencias en la inducción de la actividad epileptiforma.
- aCSF para almacenamiento y grabación
- Para una solución final de 2 L, agregue 200 ml de solución 10x 1.2 (aCSF) y 200 ml de 10x solución 2 y glucosa (Tabla 1) a 1500 mL de ddH2O.
NOTA: Los volúmenes de las soluciones finales dependen de los experimentos aplicados y del tipo de cámara utilizada para almacenar y registrar. - Añadir ddH2O a un volumen final de 2 L y medir la osmolaridad (300 mOsm a 10 mOsm).
- Precalienta la solución a 35oC y carbogenate durante al menos 10-15 min antes de su uso.
- Para una solución final de 2 L, agregue 200 ml de solución 10x 1.2 (aCSF) y 200 ml de 10x solución 2 y glucosa (Tabla 1) a 1500 mL de ddH2O.
- HighK++4-AP aCSF para la inducción de la actividad de ráfaga
- Para una solución final de 1 L, agregue 100 ml de solución 10x 1.3 (highK++4-AP aCSF) y 100 ml de solución de 10x de 2 a 700 ml de ddH2O.
- Añadir la glucosa y 4-AP (concentración final a 100 m) de acuerdo con la Tabla 1.
- Añadir ddH2O al volumen final de 1 L y medir la osmolaridad (300 mOsm a 10 mOsm).
- Precalienta la solución a 35oC y carbogenate durante al menos 10-15 min antes de su uso.
- LowMg2++BIC aCSF para la inducción de eventos similares a convulsiones (SLEs)
- Para una solución final de 1 L, agregue 100 ml de solución 10x 1.4 (lowMg2++BIC aCSF) y 100 mL de solución de 10x de 2 a 700 mL de ddH2O.
- Añadir glucosa y BIC (concentración final de 10 oM) de acuerdo con la Tabla 1.
- Añadir ddH2O al volumen final de 1 L y medir la osmolaridad (300 mOsm a 10 mOsm).
- Precalienta la solución a 35oC y carbogenate durante al menos 10-15 min antes de su uso.
3. Preparación de la cámara de interfaz
- En una cámara de interfaz, las rebanadas descansan sobre tres capas de papel de filtro para garantizar una cantidad suficiente de solución por debajo de la rebanada. Para ello, corte dos trozos de papel de filtro de 4 cm x 2 cm para cada compartimiento de sujeción de rodajas (la cámara de interfaz descrita consta de dos compartimentos) y colóquelos uno encima del otro.
- Coloque cuerdas finas de algodón alrededor de los papeles de filtro de 4 cm x 2 cm dentro de los compartimentos para romper la tensión de la solución. Asegúrese de que se utilice un flujo uniforme (aquí, medias de nylon negras cortadas a cuerdas de corte fino de 10 cm de longitud; para la colocación, véase la Figura 1).
- Coloque pequeños trozos de papel de filtro en la parte superior de los papeles de filtro más grandes dentro de los compartimentos de sujeción de la rebanada. Las piezas de tejido de filtro pequeño deben tener aproximadamente el tamaño de una rebanada cerebral (1,5 cm x 1,0 cm) y permitirán un mayor manejo de las rebanadas individuales. Coloque de tres a cuatro trozos de papel de filtro pequeño en cada compartimiento.
- Asegúrese de un caudal aCSF de 1,8 ml/min con una bomba peristáltica.
- Carbogenar y precalentar la cámara de interfaz a 35 oC (la temperatura final de la rebanada debe ser de 32 oC).
4. Configuración del área de preparación
NOTA: La preparación se puede realizar en condiciones estériles para evitar la contaminación y la supervivencia de las rodajas alargadas. Sin embargo, no todos los vibratomes encajan bajo una capucha estéril, y se requieren otras medidas para reducir la contaminación durante la preparación. En esta sección se describen algunas de estas medidas.
- Limpie el área de preparación con 70% EtOH y coloque papel de aluminio o cubiertas estériles en la parte superior de la zona.
- Prepara súper pegamento, dos pinzas afiladas, una espátula, un bisturí con cuchillas y una cuchilla para el corte brusco del tejido cerebral. Las herramientas se pueden esterilizar antes del procedimiento para reducir la contaminación.
- Limpie la bandeja tampón y la placa de muestra del vibratome con 70% EtOH. Una vez que la bandeja de tampón esté completamente seca, cúbrala con papel de aluminio y coloque la bandeja en el baño de hielo. Llene el baño de hielo con hielo triturado y manténgalo a -20 oC hasta la preparación.
- Limpie el vibratome y la cuchilla de afeitar con 70% EtOH y calibrar el vibratome para minimizar las vibraciones verticales y el daño tisular durante el procedimiento de corte.
5. Cortar y almacenar tejidos
- Directamente después de la resección, colocar el tejido inmediatamente en frío, carboxiógena colina aCSF y transportar rápidamente al laboratorio.
ADVERTENCIA: Use guantes y una mascarilla facial en todo momento durante la preparación, ya que el tejido cerebral humano puede contener posibles patógenos. Además, usar una mascarilla facial cuando no se trabaja bajo una capucha estéril reducirá en gran medida la contaminación de las soluciones y el tejido cerebral. - Retire el tejido de la colina aCSF y cortar cualquier porción quemada de tejido.
- Corte una superficie uniforme para pegar la pieza de tejido en la placa de la muestra, teniendo en cuenta el ángulo de corte y las capas de tejido. Idealmente, una rebanada de hipocampo contiene DG, CA1-4 y (si es posible) subiculum.
- Corta el tejido cerebral en rodajas de 400 m de espesor y ajusta la amplitud y la velocidad durante el corte. Debido a la posible pia mater restante, el tejido cerebral humano muestra más resistencia y puede requerir un corte más lento.
NOTA: El grosor de la rebanada afecta en gran medida a la red disponible (más neuronas en rodajas más gruesas) o a la viabilidad de la rebanada (penetración de la solución en la rebanada). Hemos utilizado rebanadas de 500 m para aumentar la microred potencialmente disponible, y no hemos podido observar diferencias en la inducción de la actividad epileptiforma. Las rebanadas de 300 m se utilizan comúnmente para experimentos con patch-clamp, aunque la inducción de la actividad epileptiforma en estas rebanadas aún no se ha probado aquí. Usamos 400 m como un espesor de rebanada estándar, aunque las rodajas de 300–500 m pueden ser suficientes. - Antes de recolectar, usa un bisturí para reducir el tamaño de las rebanadas cerebrales para que quepan en la cámara de grabación. Para el uso de la cámara de membrana (ver sección 6), las rodajas deben ser de 1,5 cm x 1 cm como máximo. Al reducir, tenga en cuenta las capas y conexiones específicas que deben estar intactas para la grabación (por ejemplo, para la grabación en el CA1 y la DG, cortar el subiculum y el tejido blanco circundante).
- Usando una espátula y pequeños fórceps, coloque cuidadosamente las rebanadas en la cámara de interfaz en pequeños papeles de filtro y déjelas reposar durante 1 hora en aCSF hasta la grabación.
- Las rebanadas se pueden grabar hasta 20 h (incluso más cuando están en condiciones estériles).
6. Registro de la actividad epileptiforme
- En la cámara de membrana (cámara de grabación de tipo sumergido), coloque la rebanada cerebral sobre una membrana transparente semipermeable, que está pegada a un anillo de plástico24. Para ello, utilice súper pegamento para unir el anillo de plástico a la membrana de un inserto de cultivo celular.
- Utilice un bisturí para eliminar cualquier membrana en el exterior del anillo de plástico. Asegúrese de que la membrana esté uniforme y completamente unida al anillo antes de colocar la membrana en la cámara.
NOTA: La membrana se puede almacenar en ddH2O a 4-8 oC y reutilizarse durante un máximo de 1 mes. Mantenga la membrana húmeda en todo momento. - Tanto la entrada como la salida de la cámara de membrana están conectadas a tubos para el suministro de la solución. Coloque los tubos en una bomba peristáltica para que la entrada y el flujo se muevan en direcciones opuestas.
- Coloque el tubo de entrada y salida en aCSF carmógenos y precalificados hasta que todos los tubos y la cámara estén llenos de solución. Ajuste la velocidad de la bomba peristáltica para lograr un caudal uniforme de 10-13 ml/min.
NOTA: La cámara de membrana utilizada aquí es una cámara de grabación de tipo sumergido de alto caudal que permite un flujo de solución de hasta 14 ml/min24. En el caso de utilizar una cámara de grabación de tipo sumergido diferente, es necesario ajustar los caudales. Sin embargo, para la inducción de la actividad epileptiforme, es muy recomendable utilizar la cámara de membrana. - Utilice un elemento calefactor conectado a la entrada cerca de la cámara de membrana para garantizar una temperatura estable de 32 oC.
- Prepare pipetas de vidrio de 1 a 2 M con un tirador vertical. Llene las pipetas con una solución NaCl de 154 mM y colóquelas en un soporte de electrodo.
- Usando pinzas y una espátula, retire una rebanada del hipocampo de la cámara de interfaz tomando la rebanada con el papel de filtro pequeño y colocándolas en una placa de Petri llena de aCSF carbogenado. Retire el papel de filtro pequeño de la rebanada del hipocampo y (si es necesario) aplique algo de fuerza con una pipeta para separar la rebanada del papel del filtro. Tenga cuidado de no voltear la rebanada.
- Coloque la rebanada en la cámara de grabación y sosténjéquela en su lugar usando malla de corte.
NOTA: Debido al principio de Bernoulli, en la cámara de membrana de tipo sumergido utilizada, las rodajas son generalmente estables sin el uso de una malla de corte adicional. - Coloque los electrodos en la región y la capa de interés (aquí, CA1) y comience a grabar.
- Registre la actividad potencial del campo en el modo de abrazadera actual con una frecuencia de muestreo de 10–20 kHz y paso bajo filtrado a 2 kHz.
- Registre la actividad basal en aCSF durante un máximo de 5 minutos.
- Cambie los tubos de entrada de aCSF a highK++4AP o lowMg2++BIC aCSF y el tubo de salida a un contenedor de residuos para evitar la mezcla de soluciones. Después de 2 min, coloque el tubo de salida en la misma solución que la entrada para conservar la solución.
- La actividad de ráfaga inducida por highK++4-AP debe ser visible 2-5 min después del lavado. Sin embargo, la inducción de SLEs por lowMg2++BIC puede tardar hasta 30 min. Si es necesario, cambie cuidadosamente las posiciones de los electrodos para obtener resultados óptimos.
- Una vez en la posición final, registre la actividad de línea base durante al menos 20 min. Si graba SLEs, considere grabaciones de línea base más largas debido a la baja frecuencia de SLEs.
- En el caso de que la actividad basal sea estable (la meseta de la frecuencia del evento), lave en el medicamento deseado. Tenga en cuenta que debido a la alta tasa de flujo lavado en medicamentos toma sólo 2-5 minutos, lo que permite el intercambio rápido de soluciones.
- Registre la actividad durante la aplicación del medicamento de al menos 20 minutos, después del lavado. La actividad debe ser estable durante al menos 60-90 minutos, lo que permite grabaciones más largas.
7. Análisis
- El análisis de frecuencia y amplitud se puede realizar con cualquier software disponible. Hasta ahora, no hemos podido establecer un análisis automático fiable de las SLEs o la actividad de ráfaga, y en su lugar hemos utilizado un análisis semiautomático con confirmación visual de la actividad identificada.
- La actividad de ráfaga se caracteriza por una desviación bifásica, positiva y negativa y una duración de 100 ms. Todos los eventos identificados visualmente como actividad de ráfaga (por ejemplo, semiautomáticamente por análisis de umbral) deben indicarse manualmente para un análisis adicional de la frecuencia del evento (intervalo entre eventos, IEI), amplitud y número total de eventos durante el período de tiempo analizado.
NOTA: Debido a la alta frecuencia de actividad de ráfaga, los últimos 5 minutos de cada fase de aplicación se analizan normalmente20. - Los SLEs se pueden analizar como se describe en Heuzeroth et al. Los SLEs identificados se pueden analizar más a fondo para la duración, amplitud, frecuencia de pico, y la duración de la duración de la fase tónica (alta frecuencia) frente a la duración de la fase clonic (pico de baja frecuencia). Los SLEs con una duración de <10 s deben excluirse del análisis.
NOTA: Para la evaluación preclínica de posibles sustancias antiepilépticas, se están investigando los efectos sobre la actividad de ráfaga (inducido por highK++4AP), debido a la inducción establecida en el tejido hipocampal resecado. Se han notificado resultados preliminares sobre la inducción de SLEs utilizando lowMg2++BIC(Figura 2),aunque el análisis de estos datos no se incluye aquí.
Resultados
La actividad epileptiforma se ha registrado con éxito en tejido hipocampal humano resecado procedente de hasta 15 pacientes. Establecer procedimientos estables de transporte y preparación es fundamental para la inducción exitosa de la actividad epileptiforma en el tejido cerebral humano. Los resultados publicados recientemente han demostrado 1) inducción estable de la actividad epileptiforma en tejidos resecados de diferentes pacientes, así como 2) el uso del tejido cerebral humano resecado como herramienta preclínica para la evaluación de nuevos mecanismos antiepilépticos14,,20.
Aplicación de actividad epileptiforma inducida por highK++4-AP en forma de actividad de ráfaga en pocos minutos (Figura 2A,B,C,D).Figure 2A,B,C,D Debido a la baja distribución neuronal en el tejido del hipocampo humano o a la alta pérdida de células neuronales debido a la epilepsia del lóbulo temporal (TLE), la colocación de electrodos se puede ajustar al comienzo de la grabación. En los casos en que la actividad de ráfaga de las rebanadas no sea visible en el área CA1 después de 10 minutos (independientemente de la colocación del electrodo), la viabilidad de la rebanada puede verse comprometida y la rebanada tendrá que ser reemplazada.
Los SSE, con una duración de >10 s, se pueden inducir con la aplicación de lowMg2++BIC (Figura 2E,F). La Figura 2E muestra la inducción estable de los SES después de unos minutos y la frecuencia estable a lo largo de la grabación. Aquí, la actividad de LES se indujo con éxito en dos de cuatro rebanadas del paciente investigado. Un sector solo mostró actividad de ráfaga después de 15 minutos de actividad de LES, mientras que el otro sector no mostraba SLEs incluso después de 40 min.
Para la evaluación preclínica de los efectos de las sustancias, se investigó un posible efecto antiepiléptico sobre la actividad de ráfaga inducida por highK++4-AP. Se probaron sustancias antiepilépticas conocidas y potenciales (lacosamida, DMEA, dynorfina14),y aquí se muestran ejemplos para la lacosamida AED convencional (un bloqueador de canales de sodio) así como DMEA (una nueva sustancia antiepiléptica potencial)20. El número de eventos y el intervalo entre eventos (IEI) de los eventos de ráfaga disminuyó tanto durante la aplicación de lacosamida como de DMEA (Figura 3C), aunque las amplitudes no se vieron afectadas en su mayoría(Figura 3D). En un subconjunto de sectores, aunque la inducción de eventos de ráfaga se logró en los primeros minutos, la frecuencia de actividad no se recuperó durante el lavado de los DEA aplicados (datos no mostrados aquí, véase Kraus et al.20). Aquí, los fármacos aplicados fueron considerados para inducir efectos; sin embargo, las disminuciones en la actividad de ráfaga pueden haber sido afectadas por la decadencia gradual en la actividad durante grabaciones largas. Por lo tanto, los resultados deben ser interpretados cuidadosamente.
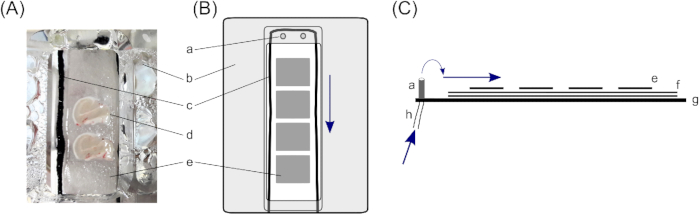
Figura 1: Cámara de interfaz. Para el almacenamiento de rebanadas cerebrales de hipocampo humano, se utiliza una cámara de interfaz con dos compartimentos de retención de rebanadas cerebrales (A); específicamente, una cámara de interfaz de tipo Haas23. Aquí, las rebanadas cerebrales hipocampales descansan sobre (d) tres capas de papel de filtro, (e) piezas más pequeñas para permitir el manejo de rebanadas cerebrales individuales, y (f) piezas de papel de filtro más grandes para asegurar una capa suficiente de solución debajo de la rebanada. (c) Una cuerda de algodón que rodea las rebanadas cerebrales, en la parte superior de los papeles del filtro, asegura que la solución fluya uniformemente desde las entradas en la parte superior del compartimiento (a). (b) Una tapa de cubierta dirige el oxígeno desde debajo del compartimiento a la rebanada. (B) Vista superior de un compartimiento de sujeción de rodajas. (C) Vista lateral para ilustrar las capas de papeles de filtro. (g) Parte inferior de la cámara. (h) Tubo para la entrada de solución, que está conectado a una bomba peristáltica (flechas azules marcan la dirección del flujo de la solución). Haga clic aquí para ver una versión más grande de esta figura.
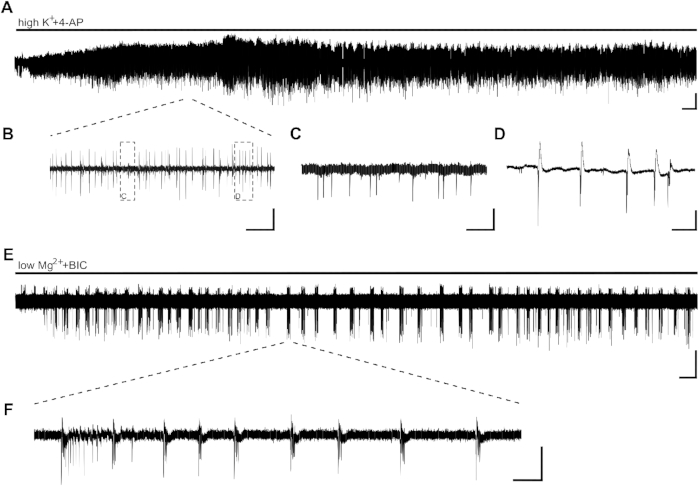
Figura 2: Actividad epileptiforma en rodajas de hipocampo humano inducidas por highK++4-AP y lowMg2++BIC. CA1 ejemplos de grabaciones y extractos de aplicación de highK+ (8 mM)+4-AP (100 m) (A,B,C,D) y lowMg2++BIC (10 m) (E,F). (A) La aplicación de baño de highK++4-AP induce la actividad epileptiforme en pocos minutos, y la actividad es estable durante al menos 60 min. Los detalles de (A) se pueden ver en (B). Dos tipos diferentes de actividad se inducen en el área CA1 de las rebanadas de hipocampo humano: picos interictales (C, detalles de [B]) y actividad de ráfaga (D, detalles de [B]). Se demostró que la actividad de ráfagas era sensible a los medicamentos antiepilépticos y, por lo tanto, se analizó para detectar el efecto de posibles sustancias antiepilépticas (Figura 3). (E,F) La aplicación de lowMg2++BIC induce LAS ES con una duración de >10 s (F) en CA1 en pocos minutos. Sin embargo, la inducción de LAS SLEs puede tardar hasta 30 minutos en otras rebanadas. Barras de escala: 0,2 mV, 2 min (A,E), 5 s (B), 500 ms (C,D), 5 min (E) y 2 s (F). Esta cifra ha sido adaptada de Kraus et al.20. Haga clic aquí para ver una versión más grande de esta figura.
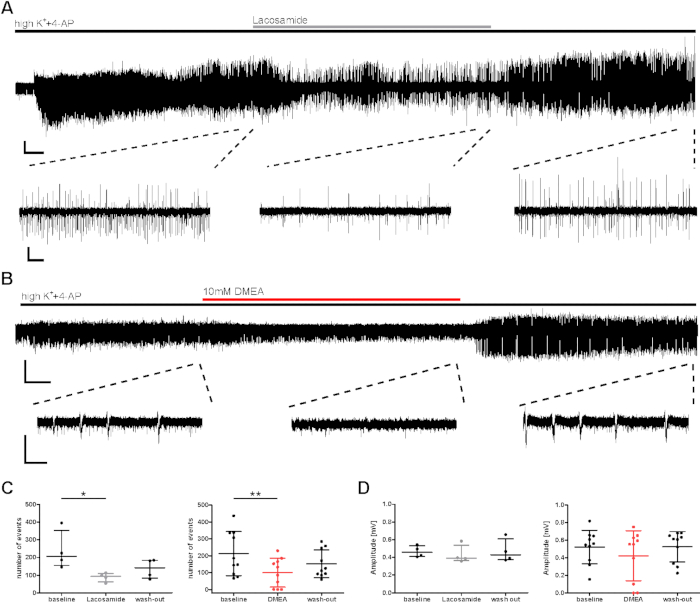
Figura 3: Disminución de la actividad de ráfagas epilépticas de rebanadas humanas durante la aplicación de lacosamida o DMEA. La actividad de ráfaga disminuyó durante la aplicación de (A) lacosamida y (B) DMEA, una nueva molécula antiepiléptica potencial. (A) y (B) muestran grabaciones ejemplares del área CA1 con extractos de las regiones utilizadas para el análisis en los apartados C y (D). La actividad de ráfaga disminuyó durante la aplicación de lacosamida (100 m) y DMEA (10 mM), como se ve en los extractos medios y aumenta de nuevo durante el lavado. (C,D) El número y la amplitud de la actividad de ráfaga se analizaron durante los últimos 5 minutos de cada fase de aplicación (línea de base, lacosamida/DMEA, lavado) y se mostraron como resultados resumidos para todos los pacientes (número de eventos, C; amplitud, D) como media de SD. Cada punto indica un paciente. Los asteriscos marcan diferencias significativas evaluadas por la prueba de Friedman y post-hoc con la comparación múltiple de Dunnett de grupos para el análisis de la aplicación de lacosamida (*p < 0,05, n a 4) o por medición repetida ANOVA y post-hoc con la comparación de Tukey para el análisis de la aplicación DMEA (**p < 0,01, n a 10). Barras de escala: 0,2 mV, 2 min (grabación completa, A), 5 s (extractos, A), 3 min (grabación completa, B) y 1 s (extractos, B). Esta cifra ha sido adaptada de Kraus et al.20. Haga clic aquí para ver una versión más grande de esta figura.
| Solución 1.1 colina aCSF | |||
| Sustancia | Concentración 10x (mM) | Concentración 1x (mM) | Nota |
| colina Cl | 1100 | 110 | |
| (+)-Na L-ascorbate | 116 | 11.6 | |
| MgCl2x6H2O | 70 | 7 | |
| Na piruvate | 31 | 3.1 | |
| Kcl | 25 | 2.5 | |
| NaH2PO4 | 12.5 | 1.25 | |
| NaHCO3 | 260 | 26 | |
| CaCl2 | - | 0.5 | añadir a la solución final |
| Glucosa | - | 10 | añadir a la solución final |
| Solución 1.2 aCSF | |||
| Sustancia | Concentración 10x (mM) | Concentración 1x (mM) | Nota |
| Nacl | 1290 | 129 | |
| NaH2PO4 | 12.5 | 1.25 | |
| CaCl2 | 16 | 1.6 | |
| Kcl | 30 | 3 | |
| MgSO4 | 18 | 1.8 | |
| Glucosa | - | 10 | añadir a la solución final |
| Solución 1.3 highK++4-AP aCSF | |||
| Sustancia | Concentración 10x (mM) | Concentración 1x (mM) | Nota |
| Nacl | 1240 | 124 | |
| NaH2PO4 | 12.5 | 1.25 | |
| CaCl2 | 16 | 1.6 | |
| Kcl | 80 | 8 | |
| MgSO4 | 18 | 1.8 | |
| Glucosa | - | 10 | añadir a la solución final |
| 4-AP | - | 0.1 | añadir a la solución final |
| Solución 1.4 lowMg2++BIC aCSF | |||
| Sustancia | Concentración 10x (mM) | Concentración 1x (mM) | Nota |
| Nacl | 1300 | 130 | |
| NaH2PO4 | 12.5 | 1.25 | |
| CaCl2 | 16 | 1.6 | |
| Kcl | 30 | 3 | |
| Glucosa | - | 10 | añadir a la solución final |
| Bic | - | 0.01 | añadir a la solución final |
| Solución 2 | |||
| Sustancia | Concentración 10x (mM) | Concentración 1x (mM) | Nota |
| NaHCO3 | 210 | 21 | |
Tabla 1: Preparación de soluciones 10x y finales 1x para el transporte, preparación y grabación.
Discusión
Vivir tejido cerebral humano resecreido es una herramienta muy valiosa en la evaluación preclínica de los DEA, ya que representa correctamente una microred cerebral humana intacta. El protocolo presentado describe un método para el transporte y la preparación de tejidos, que garantiza rebanadas hipocampales de alta calidad, así como un método de inducción estable para la actividad epileptiforma crítica para la evaluación de AED.
Otros grupos han mostrado previamente la investigación de la actividad epileptiforme, así como métodos de inducción química o eléctrica en rodajas cerebrales humanas17,,20,,21,,22. Este protocolo describe la inducción de la actividad de ráfaga estable en sectores de diferentes pacientes a través de la aplicación de K++4-AP alto, así como la inducción de SLEs en el área CA1 a través de la aplicación de bajo Mg2++BIC. Se encontró que la inducción de la actividad de ráfaga es más consistente (80% de las rodajas probadas en 15 pacientes) que la inducción de SLEs (50% de las rodajas probadas en un paciente). Sin embargo, hasta ahora, la inducción de las SSE sólo se ha realizado la prueba en un paciente. Sin embargo, se recomienda la inducción de SLEs por mg2++BIC bajo, ya que los SLA aún no han podido ser inducidos usando K++4-AP alto.
Varios estudios han introducido métodos para el transporte y la preparación del tejido cerebral humano y a menudo destacan tres factores críticos para la supervivencia neuronal: tiempo de transporte, soluciones de transporte usadas y condiciones de almacenamiento.
Para una viabilidad óptima de la rebanada, algunos grupos sugieren que el transporte del tejido cerebral resecado sea lo más corto posible. Sin embargo, las salas de operaciones y los laboratorios rara vez están cerca, lo que significa que la calidad de las rebanadas puede verse comprometida debido al transporte prolongado. Algunos grupos han superado este obstáculo aplicando constante O2 a la solución durante el transporte12. Hemos transportado tejido cerebral por corto (máx. 15 min) y largo (hasta 1 h) períodos de tiempo sin suministro constante adicional de O2 durante el transporte, similar a otros grupos18,,25. En estos casos, no se observaron diferencias en la calidad del tejido durante las grabaciones epileptiformes. En la comunicación con otros grupos de nuestro instituto, la calidad de las rebanadas tampoco cambió para los experimentos de patch-clamp. Por el contrario, la varianza en la calidad del tejido posiblemente se debe a daños durante las operaciones, resección prolongada y procedimiento de corte.
En cuanto a la solución de transporte y corte, todos los métodos publicados omiten NaCl de las soluciones para reducir la hinchazón celular debido a la presión osmótica, similar al procedimiento estándar para los experimentos de la abrazadera de parches de roedores. Sin embargo, hasta ahora se han introducido varios sustitutos (es decir, sacarosa basada en aCSF13,22, aCSF12basado enNMDG,26, y aCSF27basado en colina). Ting y sus colegas introdujeron el aCSF basado en NMDG para la preparación de la rebanada en 201426 y más tarde agregaron un protocolo de recuperación, que lentamente reintroduce NaCl a las rebanadas28. Sin embargo, como se describe en Ting et al., las neuronas de tejido cerebral preparadas en aCSF basado en NMDG muestran una mayor resistencia a la membrana, afectando así el sello de células enteras durante los experimentos de sujeción de parches26. Por lo tanto, hemos pasado de aCSF basado en NMDG al uso de aCSF20basado en colina, que produce rebanadas de alta calidad para grabaciones de potencial de campo y de sujeción de parches.
En cuanto al almacenamiento de rodajas, generalmente se acepta que las condiciones de la interfaz proporcionan una oxigenación óptima crítica para la supervivencia de la rebanada larga18. Sin embargo, otros grupos muestran la supervivencia de las rebanadas hasta 72 h en condiciones sumergidas12. Contrariamente a la hipótesis anterior, las rebanadas cerebrales humanas parecen ser más resistentes a la baja oxigenación o estrés oxidativo en comparación con las rodajas de roedores. Principalmente, las cámaras de interfaz se han utilizado previamente para el almacenamiento de rodajas de hipocampo humano, aunque se recomiendan condiciones sumergidas para el mantenimiento de rebanadas cerebrales humanas en experimentos de parche-pinza.
Como lo han comentado otros grupos, un paso crítico adicional para la supervivencia de la rebanada larga (interfaz para <48 h18, sumergido para <72 h12) es la prevención de la contaminación bacteriana. Las rebanadas cerebrales de roedores se utilizan típicamente en grabaciones electrofisiológicas de hasta 8 h, y no se considera que la contaminación bacteriana afecte la viabilidad de las rebanadas durante este período. Un alto número de rebanadas preparadas a partir de una resección y la disponibilidad poco común de tejido cerebral humano pone de relieve la necesidad de prolongar la viabilidad de las rebanadas cerebrales humanas. Este método describe con éxito la preparación de rebanadas cerebrales del hipocampo humano vivo, que se pueden adaptar fácilmente a condiciones estériles. Sin embargo, para las grabaciones realizadas aquí, la supervivencia de las rebanadas que se extiende 20 h no era una prioridad.
También se ha demostrado que el registro en cámaras de interfaz es esencial para la inducción de la actividad epileptiforma, como las SLEs22. Las condiciones sumergidas, debido a la baja oxigenación, rara vez se utilizan para el registro de las ESE; sin embargo, son necesarios para la alta resolución óptica necesaria para los experimentos de abrazadera de parche. El uso de una cámara de grabación de tipo sumergido optimizado permite el registro de la actividad epileptiforma (campo extracelular o neurona única) en las rebanadas cerebrales humanas, debido a la alta oxigenación y la aplicación rápida de fármacos29. Aquí, se describen los métodos y resultados para las grabaciones potenciales de campo, pero se debe enfatizar que las grabaciones de la abrazadera de parches se han realizado con éxito en los cortes de ratón y cerebro humano utilizando esta cámara de grabación modificada (datos no mostrados).
El tejido cerebral humano resecado tiene un mayor valor traslacional en comparación con los modelos de roedores. Representa una red neuronal adulta y enferma que no puede ser reproducida por iPSCs. Sin embargo, como en cualquier sistema in vitro, las rebanadas cerebrales humanas no representan un cerebro humano intacto. Además, las redes neuronales registradas de tejido cerebral resecado pueden sufrir cambios moleculares y funcionales sustanciales debido al daño durante la operación o preparación. Se ha demostrado que los procedimientos de corte afectan a la función GABAérgica y pueden afectar a la inducción de la actividad epileptiforme30. Estas limitaciones deben tenerse en cuenta al formular una hipótesis. Al probar fármacos antiepilépticos potenciales, se debe considerar el uso de diferentes áreas cerebrales, ya que los objetivos de drogas podrían no expresarse en todas las regiones del cerebro humano o en todos los pacientes. En particular, los hipocampos de los pacientes con LES a menudo muestran signos de esclerosis hipocampal acompañados de pérdida grave de células neuronales. Se recomienda obtener información del paciente sobre los cambios patológicos y la historia de la enfermedad, como los posibles refractarios hacia los medicamentos, y considerar esto durante la interpretación de los datos.
En conclusión, este método describe con éxito la preparación de rebanadas cerebrales del hipocampo humano vivo y técnicas de inducción para registrar dos tipos diferentes de actividad epileptiforma. Dado que la disponibilidad de tejido cerebral humano vivo es poco frecuente, se deben utilizar condiciones optimizadas de transporte y registro para garantizar la máxima producción de experimentos con rebanadas cerebrales humanas. Se sugiere que el tejido cerebral humano resecado se puede utilizar como una herramienta de validación preclínica además de modelos de roedores y experimentos de cultivo celular.
Divulgaciones
Los autores no declaran ningún conflicto de intereses.
Agradecimientos
Agradecemos a Mandy Marbler-Pétter (Charite-Unversit-tsmedizin, Berlín) por su excelente asistencia técnica. P.F. fue financiado por la Fundación Alemana de Investigación (DFG, Deutsche Forschungsgemeinschaft) bajo la Estrategia de Excelencia de Alemania-EXC-2049-390688087. Este trabajo ha sido apoyado por el Quest Center for Transforming Biomedical Research del Instituto de Salud de Berlín.
Materiales
| Name | Company | Catalog Number | Comments |
| (+)-Na L-ascorbate | Sigma Aldrich | A4034 | |
| 4-AP | Sigma Aldrich | 275875-5G | |
| Blades | eliteSERVE GmbH | HW3 | used for the vibratome |
| CaCl2 | Merck | 102382 | |
| Choline Cl | Sigma Aldrich | C1879 | |
| Filter paper | Tiffen | EK1546027T | |
| Gas-tight bottle caps | Carl Roth GmbH+Co.KG | E694.1 | |
| Glass filaments | Science Products | GB150F-8P | for recording electrodes |
| Glass gas disperser | DWK Life Sciences GmbH | 258573309 | |
| Glucose | Sigma Aldrich | G7528 | |
| Interface Chamber | inhouse made | - | see Haas et al., 1979 |
| KCl | AppliChem | 131494.1210 | |
| Membrane (Cell culture inserts) | Merck | PICM030050 | |
| Membrane chamber | inhouse made | - | see Hill and Greenfield, 2011 |
| MgCl2?6H2O | Carl Roth | HNO3.2 | |
| MgSO4 | Sigma Aldrich | M7506 | |
| Na pyruvate | Sigma Aldrich | P8574 | |
| NaCl | Carl Roth | 3957.1 | |
| NaH2PO4 | Merck | 106346 | |
| NaHCO3 | Carl Roth | HNO1.2 | |
| Peristaltic pump | Gilson | Minipuls 3 | |
| Slice holder | Warner instruments | SHD-41/15 | |
| Vertical puller | Narishige | PC-10 | |
| Vibratome | Leica | VT1200S |
Referencias
- Hirtz, D., et al. How common are the "common" neurologic disorders. Neurology. 68 (5), 326-337 (2007).
- Ngugi, A. K., Bottomley, C., Kleinschmidt, I., Sander, J. W., Newton, C. R. Estimation of the burden of active and life-time epilepsy: a meta-analytic approach. Epilepsia. 51 (5), 883-890 (2010).
- Kwan, P., Brodie, M. J. Early Identification of Refractory Epilepsy. New England Journal of Medicine. 342 (5), 314-319 (2000).
- Löscher, W. Critical review of current animal models of seizures and epilepsy used in the discovery and development of new antiepileptic drugs. Seizure. 20 (5), 359-368 (2011).
- Ledri, M., et al. Differential Effect of Neuropeptides on Excitatory Synaptic Transmission in Human Epileptic Hippocampus. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 35 (26), 9622-9631 (2015).
- Qi, X. R., et al. Alterations in the steroid biosynthetic pathways in the human prefrontal cortex in mood disorders: A post-mortem study. Brain Pathology. 28 (4), 536-547 (2018).
- Verwer, R. W. H., et al. Post-mortem brain tissue cultures from elderly control subjects and patients with a neurodegenerative disease. Experimental Gerontology. 38 (1-2), 167-172 (2003).
- Verwer, R. W. H., et al. Cells in human postmortem brain tissue slices remain alive for several weeks in culture. FASEB journal official publication of the Federation of American Societies for Experimental Biology. 16 (1), 54-60 (2002).
- Le Maître, T. W., Dhanabalan, G., Bogdanovic, N., Alkass, K., Druid, H. Effects of Alcohol Abuse on Proliferating Cells, Stem/Progenitor Cells, and Immature Neurons in the Adult Human Hippocampus. Neuropsychopharmacology. 43 (4), 690-699 (2018).
- Dennis, C. V., Suh, L. S., Rodriguez, M. L., Kril, J. J., Sutherland, G. T. Human adult neurogenesis across the ages: An immunohistochemical study. Neuropathology and Applied Neurobiology. 42 (7), 621-638 (2016).
- Verwer, R. W. H., et al. Mature astrocytes in the adult human neocortex express the early neuronal marker doublecortin. Brain. 130 (12), 3321-3335 (2007).
- Ting, J. T., et al. A robust ex vivo experimental platform for molecular-genetic dissection of adult human neocortical cell types and circuits. Scientific Reports. 8 (1), 8407 (2018).
- Le Duigou, C., et al. Imaging pathological activities of human brain tissue in organotypic culture. Journal of Neuroscience Methods. 298, 33-44 (2018).
- Agostinho, A. S., et al. Dynorphin-based "release on demand" gene therapy for drug-resistant temporal lobe epilepsy. EMBO molecular medicine. 11 (10), 9963 (2019).
- Hodge, R. D., et al. Conserved cell types with divergent features in human versus mouse cortex. Nature. 573 (7772), 61-68 (2019).
- Beaulieu-Laroche, L., et al. Enhanced Dendritic Compartmentalization in Human Cortical Neurons. Cell. 175 (3), 643-651 (2018).
- Sandow, N., et al. Drug resistance in cortical and hippocampal slices from resected tissue of epilepsy patients: no significant impact of p-glycoprotein and multidrug resistance-associated proteins. Frontiers in Neurology. 6, 30 (2015).
- Wickham, J., et al. Prolonged life of human acute hippocampal slices from temporal lobe epilepsy surgery. Scientific Reports. 8 (1), (2018).
- Avoli, M., Jefferys, J. G. R. Models of drug-induced epileptiform synchronization in vitro. Journal of Neuroscience Methods. , (2015).
- Kraus, L., et al. Dimethylethanolamine Decreases Epileptiform Activity in Acute Human Hippocampal Slices in vitro. Frontiers in Molecular Neuroscience. 12, 209 (2019).
- Antonio, L. L., et al. In vitro seizure like events and changes in ionic concentration. Journal of Neuroscience Methods. , (2016).
- Gabriel, S., et al. Stimulus and Potassium-Induced Epileptiform Activity in the Human Dentate Gyrus from Patients with and without Hippocampal Sclerosis. Journal of Neuroscience. 24 (46), 10416-10430 (2004).
- Haas, H. L., Schaerer, B., Vosmansky, M. A simple perfusion chamber for the study of nervous tissue slices in vitro. Journal of Neuroscience Methods. 1 (4), 323-325 (1979).
- Hill, M. R. H., Greenfield, S. A. The membrane chamber: a new type of in vitro recording chamber. Journal of neuroscience methods. 195 (1), 15-23 (2011).
- Andersson, M., et al. Optogenetic control of human neurons in organotypic brain cultures. Scientific Reports. 6, 24818 (2016).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods in molecular biology. 1183, 221-242 (2014).
- Testa-Silva, G., et al. Human synapses show a wide temporal window for spike-timing-dependent plasticity. Frontiers in Synaptic Neuroscience. 2, 12 (2010).
- Ting, J. T., et al. Preparation of Acute Brain Slices Using an Optimized N-Methyl-D-glucamine Protective Recovery Method. Journal of Visualized Experiments. (132), (2018).
- Morris, G., Jiruska, P., Jefferys, J. G. R., Powell, A. D. A New Approach of Modified Submerged Patch Clamp Recording Reveals Interneuronal Dynamics during Epileptiform Oscillations. Frontiers in Neuroscience. 10, 519 (2016).
- Valeeva, G., Valiullina, F., Khazipov, R. Excitatory actions of GABA in the intact neonatal rodent hippocampus in vitro. Frontiers in Cellular Neuroscience. , (2013).
Erratum
Formal Correction: Erratum: Preparation of Acute Human Hippocampal Slices for Electrophysiological Recordings
Posted by JoVE Editors on 7/13/2020. Citeable Link.
An erratum was issued for: Preparation of Acute Human Hippocampal Slices for Electrophysiological Recordings. Step 2.1.3 in the Protocol was corrected.
Step 2.1.3 in the Protocol was updated from:
Add final concentrations of glucose and MgCl, then stir until dissolved (Table 1, solution 1.1).
to:
Add final concentrations of glucose and CaCl2, then stir until dissolved (Table 1, solution 1.1).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados