Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Caracterización de las propiedades de transporte intracartílago de los portadores de péptidos catiónicos
En este artículo
Resumen
Este protocolo determina la absorción de equilibrio, la profundidad de penetración y la tasa de difusión sin equilibrio para los portadores de péptidos catiónicos en el cartílago. La caracterización de las propiedades de transporte es fundamental para garantizar una respuesta biológica eficaz. Estos métodos se pueden aplicar para diseñar un portador de medicamentos con carga óptima para apuntar a los tejidos cargados negativamente.
Resumen
Varios tejidos cargados negativamente en el cuerpo, como el cartílago, presentan una barrera a la administración de fármacos dirigidos debido a su alta densidad de aggrecanos cargados negativamente y, por lo tanto, requieren métodos de focalización mejorados para aumentar su respuesta terapéutica. Debido a que el cartílago tiene una alta densidad de carga fija negativa, los medicamentos se pueden modificar con portadores de medicamentos cargados positivamente para aprovechar las interacciones electrostáticas, lo que permite un mejor transporte de fármacos dentro del cartílago. Por lo tanto, estudiar el transporte de los portadores de fármacos es crucial para predecir la eficacia de los fármacos para inducir una respuesta biológica. Mostramos el diseño de tres experimentos que pueden cuantificar la absorción de equilibrio, la profundidad de penetración y la tasa de difusión sin equilibrio de los portadores de péptidos catiónicos en explantes de cartílago. Los experimentos de absorción de equilibrio proporcionan una medida de la concentración de soluto dentro del cartílago en comparación con su baño circundante, que es útil para predecir el potencial de un portador de fármacos en la mejora de la concentración terapéutica de fármacos en el cartílago. Los estudios de profundidad de penetración mediante microscopía confocal permiten la representación visual de la difusión del soluto 1D desde la zona superficial hasta la profunda del cartílago, lo que es importante para evaluar si los solutos alcanzan sus sitios de matriz y diana celular. Los estudios de tasa de difusión sin equilibrio que utilizan una cámara de transporte diseñada a medida permiten medir la fuerza de las interacciones de unión con la matriz tisular mediante la caracterización de las tasas de difusión de los solutos etiquetados fluorescentemente a través del tejido; esto es beneficioso para diseñar portadores de resistencia óptima de unión con cartílago. Juntos, los resultados obtenidos de los tres experimentos de transporte proporcionan una guía para diseñar portadores de medicamentos con carga óptima que aprovechan las interacciones de carga débiles y reversibles para aplicaciones de administración de medicamentos. Estos métodos experimentales también se pueden aplicar para evaluar el transporte de fármacos y conjugadores portadores de fármacos. Además, estos métodos se pueden adaptar para su uso en la orientación a otros tejidos cargados negativamente como el menisco, la córnea y el humor vítreo.
Introducción
La administración de drogas a los tejidos cargados negativamente en el cuerpo sigue siendo un desafío debido a la incapacidad de los fármacos para penetrar profundamente en el tejido para llegar a los sitios diana celular y matriz1. Varios de estos tejidos comprenden aggrecanos densamente embalados y cargados negativamente que crean una alta densidad de carga fija negativa (FCD)2 dentro del tejido y actúan como una barrera para la entrega de la mayoría de las macromoléculas3,4. Sin embargo, con la ayuda de portadores de medicamentos cargados positivamente, esta barrera tisular cargada negativamente puede convertirse en un depósito de fármacos a través de interacciones de carga electrostática para la administración sostenida de fármacos1,5,6,7(Figura 1).
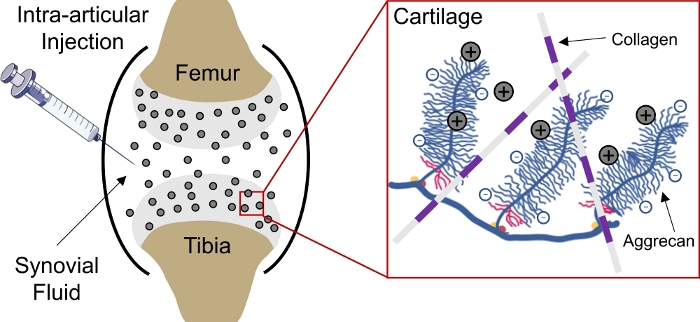
Figura 1: Entrega intracartílago basada en carga de CPC. Inyección intraarticular de CPC en el espacio de la articulación de la rodilla. Las interacciones electrostáticas entre los CPC cargados positivamente y los grupos agregcanos cargados negativamente permiten una penetración rápida y completa de la profundidad a través del cartílago. Esta cifra ha sido modificada de Vedadghavami et al4. Haga clic aquí para ver una versión más grande de esta figura.
Recientemente, los portadores de péptidos catiónicos de corta duración (CPC) fueron diseñados con el objetivo de crear pequeños dominios catiónicos capaces de transportar terapias de mayor tamaño para el suministro al cartílago cargado negativamente4. Para la entrega eficaz de fármacos al cartílago para el tratamiento de8,9 y enfermedades degenerativas como la osteoartritis (OA)10, es fundamental que las concentraciones terapéuticas de fármacos penetren profundamente dentro del tejido, donde la mayoría de las células del cartílago (condrocitos) se encuentran11. Aunque hay varios medicamentos modificadores de enfermedades potenciales disponibles, ninguno ha obtenido la aprobación de la FDA porque estos son incapaces de apuntar eficazmente al cartílago12,,13. Por lo tanto, la evaluación de las propiedades de transporte de los portadores de medicamentos es necesaria para predecir la eficacia de los fármacos en la inducción de una respuesta terapéutica. Aquí, hemos diseñado tres experimentos separados que se pueden utilizar para evaluar la absorción de equilibrio, la profundidad de penetración y la tasa de difusión sin equilibrio de los CPC4.
Para garantizar que haya una concentración de fármaco suficiente dentro del cartílago que pueda proporcionar una respuesta terapéutica óptima, se diseñaron experimentos de absorción para cuantificar la concentración de CPC de equilibrio en el cartílago4. En este diseño, después de un equilibrio entre el cartílago y su baño circundante, la cantidad total de soluto dentro del cartílago (ya sea unida a la matriz o libre) se puede determinar utilizando una relación de absorción. Esta relación se calcula normalizando la concentración de solutos dentro del cartílago a la del baño de equilibrio. En principio, los solutos neutros, cuya difusión a través del cartílago no está asistida por interacciones de carga, tendrían una relación de absorción inferior a 1. Por el contrario, los solutos catiónicos, cuyo transporte se mejora a través de interacciones electrostáticas, muestran una relación de absorción superior a 1. Sin embargo, como se muestra con los CPC, el uso de una carga positiva óptima puede dar lugar a ratios de absorción mucho más altos (superiores a 300)4.
Aunque la alta concentración de drogas dentro del cartílago es importante para lograr beneficios terapéuticos, también es fundamental que los fármacos se difundan a través de todo el espesor del cartílago. Por lo tanto, se requieren estudios que muestren la profundidad de penetración para asegurar que los fármacos lleguen a lo profundo del cartílago para que se pueda alcanzar la matriz y los sitios celulares de destino, proporcionando así una terapia más eficaz. Este experimento fue diseñado para evaluar la difusión unidireccional de los solutos a través del cartílago, simulando la difusión de fármacos en cartílago después de la inyección intraarticular in vivo. Las imágenes de fluorescencia mediante microscopía confocal permiten evaluar la profundidad de penetración en el cartílago. La carga neta de partículas desempeña un papel clave en la moderación de cómo los fármacos profundos pueden difundirse a través de la matriz. Se requiere una carga neta óptima basada en una FCD tisular para permitir interacciones de unión débil-reversibles entre las partículas catiónicas y la matriz de tejido aniónico. Esto implica que cualquier interacción es lo suficientemente débil para que las partículas puedan desvincularse de la matriz pero de naturaleza reversible para que pueda unirse a otro sitio de unión de matriz más profundo dentro del tejido4. Por el contrario, la carga neta positiva excesiva de una partícula puede ser perjudicial para la difusión, ya que la unión de matriz demasiado fuerte evita el desprendimiento de partículas del sitio de unión inicial en la zona superficial del cartílago. Esto resultaría en una respuesta biológica insuficiente, ya que la mayoría de los sitios objetivo se encuentran en lo profundo del tejido11.
Para cuantificar aún más la fuerza de las interacciones de unión, el análisis de las tasas de difusión de fármacos a través del cartílago es ventajoso. Los estudios de difusión sin equilibrio permiten comparar las tasas de difusión en tiempo real entre diferentes solutos. A medida que los fármacos se difunden a través de las zonas superficiales, medias y profundas del cartílago, la presencia de interacciones vinculantes puede alterar en gran medida las tasas de difusión. Cuando las interacciones de unión están presentes entre los fármacos y la matriz del cartílago, se define como la difusividad efectiva(D EFF). En este caso, una vez que todos los sitios de enlace han sido ocupados, la tasa de difusión de los medicamentos se rige por la difusión de estado estacionario (DSS). La comparación entre elEFF D de diferente soluto determina la fuerza de unión relativa de los solutos con la matriz. Para un soluto dado, si el DEFF y DSS están dentro del mismo orden de magnitud, implica que hay una unión mínima presente entre el fármaco y la matriz durante la difusión. Sin embargo, si DEFF es mayor que DSS,existe una unión sustancial de partículas a la matriz.
Los experimentos diseñados individualmente permiten la caracterización del transporte de soluto a través del cartílago, sin embargo, se requiere un análisis holístico que incluya todos los resultados para diseñar un portador de fármacos con carga óptima. La naturaleza débil y reversible de las interacciones de carga controla la tasa de difusión de partículas y permite una absorción de alto equilibrio y una rápida penetración de profundidad completa a través del cartílago. A través de experimentos de absorción de equilibrio, debemos buscar portadores que muestren una alta absorción como resultado de interacciones de carga que se pueden verificar mediante estudios de tasa de difusión sin equilibrio. Sin embargo, estas interacciones de unión deben ser débiles y reversibles en la naturaleza para permitir la penetración de espesor completo del soluto a través del cartílago. Un portador de fármacos ideal poseería una carga óptima que permite una unión lo suficientemente fuerte para la absorción y altas concentraciones de fármacos intracartílagos, pero no demasiado fuerte como para impedir la difusión de espesor completo4. Los experimentos presentados ayudarán en las características de diseño de los tejidos basados en la carga dirigidos a los portadores de fármacos. Estos protocolos se utilizaron para caracterizar el transporte de CPC a través del cartílago4,sin embargo, estos también se pueden aplicar a una variedad de fármacos y portadores de fármacos a través del cartílago y otros tejidos cargados negativamente.
Protocolo
Se obtuvieron aprobaciones universitarias para la realización de los experimentos con tejidos muertos. Las juntas bovinas se obtuvieron comercialmente de un matadero.
1. Extracción de explant de cartílago
- Usando un bisturí (#10 cuchilla), corta y elimina la grasa, los músculos, los ligamentos, los tendones y todo el resto del tejido conectivo para exponer el cartílago de la ranura femoropatelar de las articulaciones de las rodillas bovinas.
- Usando punzones dérmicos de 3 mm y 6 mm, haga punzones perpendiculares en el cartílago para extraer tapones cilíndricos. Coloque inmediatamente los tapones en pozos individuales de una placa de 48 pocillos que contenga 500 l de solución salina tamponada de 1x fosfato (PBS) complementada con 1% v/v antibiótico antimicótico.
- Coloque el lado superficial de un tapón de cartílago mirando hacia abajo en un pozo en el accesorio de corte (Figura 2). Usando una cuchilla de afeitar, corta el tapón a lo largo de la superficie del accesorio de corte para obtener un explano de cartílago de 1 mm de espesor que incluya la zona superficial. Repita el procedimiento para cada tapón de cartílago.
- Almacene los explantes de cartílago individualmente en tubos de polipropileno que contengan 500 l de 1x PBS complementados con inhibidores de la proteasa (PBS-PI, 1 minitabla PI por 50 ml 1x PBS) a -20 oC.
- Antes de llevar a cabo cada uno de los siguientes experimentos de transporte, descongele los viales que contienen explantes durante 30 minutos en un baño de agua de 37oC.
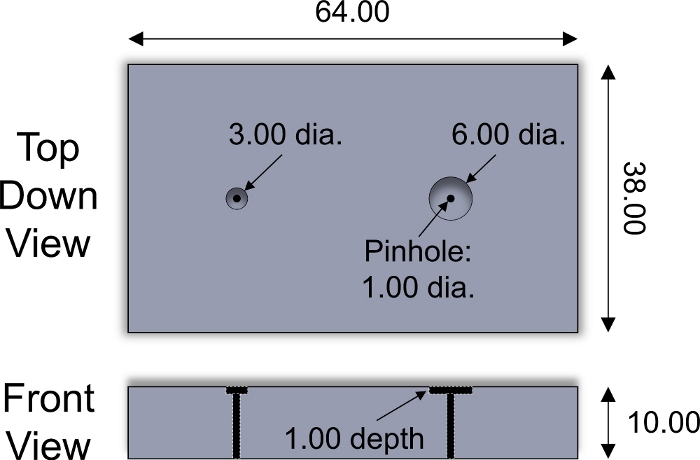
Figura 2: Accesorio de corte diseñado a medida. Parámetros de diseño del accesorio de corte de acero inoxidable utilizado para cortar explantas de cartílago de 3 y 6 mm de diámetro. Se colocaron inserciones de plástico de espesor variable dentro de pozos para ajustar el grosor de las plantas en rodajas. Se utilizó un pasador cilíndrico de acero inoxidable de <1 mm de diámetro para expulsar la explanta de la luminaria. Todos los valores numéricos se presentan en mm. Haga clic aquí para ver una versión más grande de esta figura.
2. Equilibrio de la absorción de CPC en el cartílago
- Explanamiento de cartílago suavemente dab (3 mm de diámetro X 1 mm de espesor)) con una delicada toallita de tarea para eliminar el exceso de 1x PBS de la superficie del explano. Usando un equilibrio, registre rápidamente el peso húmedo de cada explant y luego coloque inmediatamente en un baño 1x PBS para prevenir la deshidratación.
- Preparar soluciones de 30 m (300 ml por explanta) de CPC con etiqueta fluorescente en 1x PBS-PI. Utilice tubos de polipropileno sin RNase para la reconstitución.
- En una placa de 96 pocillos, pipetear 300 l de cada solución de CPC de 30 m en pozos separados. Evite el uso de pozos cerca del borde de la placa para evitar la evaporación. Usando una espátula, transfiera cada explant a la solución que contiene pozos.
- Llene los pozos circundantes con 300 l de 1x PBS y cubra la placa de pozo con tapa. Selle los bordes de la placa con una película flexible para minimizar la evaporación.
- Dentro de una incubadora de 37oC, coloque la placa sobre un agitador de placas para limitar la sedimentación de partículas. Incubar durante 24 h bajo rotación suave (50 rpm con una órbita de 15 mm) para permitir la absorción de equilibrio de CPC en el cartílago (Figura 3).
- Generar una curva estándar para la correlación de la fluorescencia con la concentración de CPC
- Preparar diluciones en serie de soluciones de CPC de 30 m a 0 m (10 diluciones de 2 veces) en 1x PBS-PI en tubos de polipropileno. Asegúrese de que haya al menos 500 l de cada dilución.
- Añadir 200 l de cada dilución a pozos consecutivos en una placa negra de 96 pocillos. Duplicar en otra fila para aumentar el tamaño de la muestra.
- Obtenga lecturas de fluorescencia de cada muestra utilizando un lector de placas en las longitudes de onda de excitación y emisión de la etiqueta fluorescente utilizando un lector de placas.
- Trazar la lectura de fluorescencia frente a la concentración de CPC y derivar una ecuación para la parte lineal de la curva.
NOTA: Para limitar la variabilidad en las lecturas de fluorescencia, incubar la solución de stock CPC en las mismas condiciones que la placa de muestra antes de la generación de la curva estándar.
- Después de 24 horas de incubación, recoger el baño de equilibrio de cada pozo en tubos de polipropileno separados.
- Transfiera 200 l de cada solución a pozos separados de una placa negra de 96 pocillos. Obtenga lecturas de fluorescencia de cada muestra bajo los mismos ajustes fluorescentes que para la curva estándar. Si es necesario, diluya la muestra en 1x PBS-PI para asegurarse de que las lecturas se encuentran dentro de la parte lineal de la curva estándar.
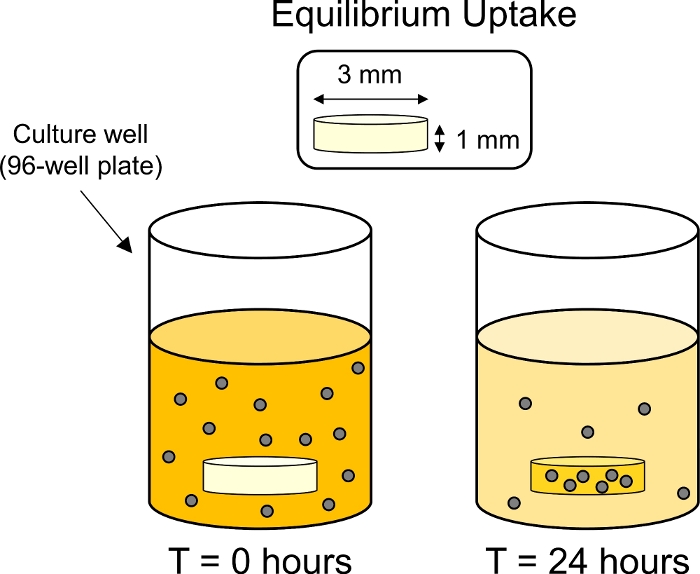
Figura 3: Esquema de experimentos de absorción de equilibrio. Los explantes de cartílago (3 mm de diámetro x 1 mm de espesor) se colocaron en pozos individuales en una placa de 96 pozos que contenía una solución de CPC etiquetada fluorescentemente. Después de 24 h CPC fueron tomados por el cartílago, reduciendo así la fluorescencia del baño circundante. Haga clic aquí para ver una versión más grande de esta figura.
3. Profundidad de penetración de las CPC en el cartílago
- Preparar soluciones de 30 m (300 ml por explanta) de CPC con etiqueta fluorescente en 1x PBS-PI. Utilice tubos de polipropileno sin RNase para la reconstitución.
- Usando un bisturí, corte los explantes de cartílago (6 mm de diámetro x 1 mm de espesor) por la mitad para hacer medio disco. Mantenga el explant hidratado con una capa de 1x PBS-PI durante el corte.
- Pegue una explant de medio disco en el centro de un pozo de la cámara de transporte de 1 dimensión diseñada a medida utilizando un epoxi (Figura 4, Figura 5). Asegúrese de que la epoxi se aplica al lado circunferencial (curvado) del explant. Retire el exceso de pegamento del pozo para evitar el contacto con la superficie de difusión del cartílago y tomar nota del lado superficial del explant.
- Añadir 80 l de 1x PBS-PI a ambos lados del explant. Pipetear el líquido hacia arriba y hacia abajo desde un lado del explant para comprobar si hay fugas en el otro lado. Si se produce una fuga, reajuste el explano y aplique epoxi según sea necesario.
- Sustituya el PBS-PI 1x del lado que da a la superficie superficial del cartílago (ascendente) por 80 l de solución de CPC de 30 oM. Mantener 80 l de 1x PBS-PI en el lado que mira la zona profunda del cartílago (aguas abajo).
- Coloque cuidadosamente la cámara de transporte en un recipiente con cubierta. Cubra la base del recipiente con una capa 1x PBS para evitar la evaporación de las soluciones. Asegúrese de que no haya contacto directo entre las soluciones de las cámaras ascendentes y descendentes.
- Coloque el recipiente cubierto en un agitador de placas para limitar la sedimentación de partículas. Incubar durante 4 o 24 h a temperatura ambiente bajo rotación suave (50 rpm con una órbita de 15 mm).
- Después de la incubación, retire el explant de la cámara y corte la rebanada de 100 m del centro del explant.
NOTA: Esta sección transversal incluye las zonas superficiales, medias y profundas del cartílago. - Coloque la rebanada entre un portaobjetos de vidrio y un cubreobjetos. Hidratar la rebanada con una capa de 1x PBS-PI.
- Con un aumento de 10x, la imagen a través del grosor completo de la rebanada para obtener la pila z de imágenes fluorescentes utilizando un microscopio confocal.
- Usando ImageJ proyectar la intensidad media de las imágenes dentro de la pila z para determinar la profundidad de penetración de los CPC en el cartílago.
- Abra la pila de imágenes haciendo clic en Archivo . Abrir.
- Haga clic en'Imagen'en la barra de tareas y haga clic en Imagen ? Pilas ? Z Proyecto desde el menú desplegable.
- Introduzca los números de sectores de 1 al sector final. Seleccione 'Intensidad media' en Tipo de proyección. Haga clic en 'Aceptar.'
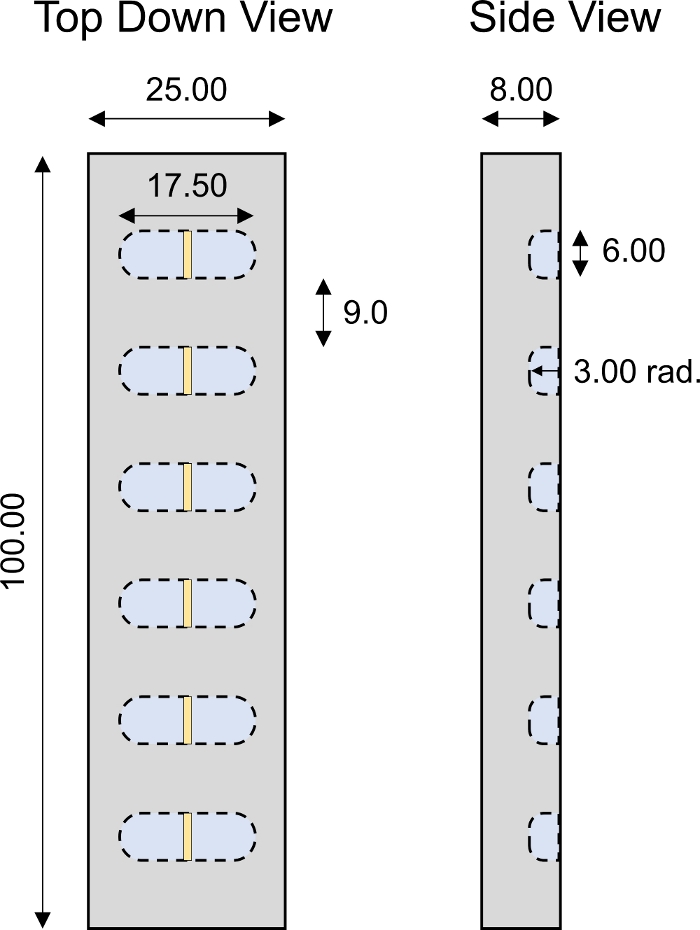
Figura 4: Cámara de transporte 1D diseñada a medida. Parámetros de diseño de la cámara de transporte PMMA 1D con 6 pozos individuales. Todos los valores numéricos se presentan en mm. Haga clic aquí para ver una versión más grande de esta figura.
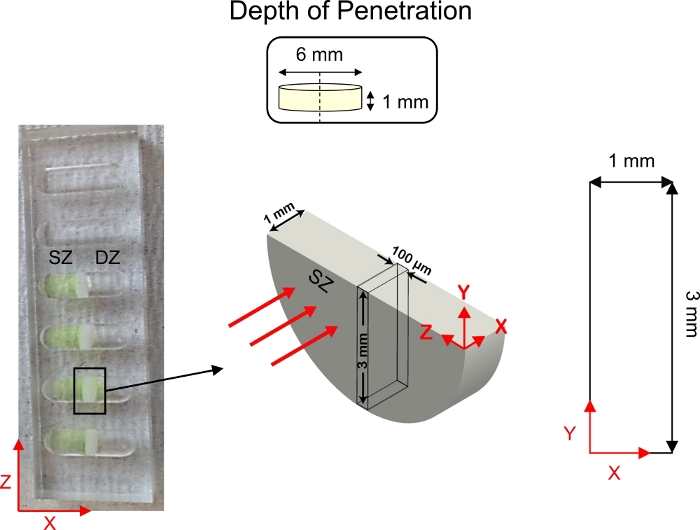
Figura 5: Esquema de estudios de profundidad de penetración. Los explantes de cartílago (6 mm de diámetro x 1 mm de espesor) se cortaron por la mitad y se fijaron al centro de los pozos de transporte difusivos 1-D. Se añadió una solución de CPC con etiqueta fluorescente al lado del pozo en contacto con la zona superficial (SZ) del cartílago. 1x PBS-PI se añadió al lado del pozo en contacto con la zona profunda (DZ) del cartílago. Después de la difusión, se probó una sección transversal del cartílago (3 mm x 1 mm) utilizando microscopía confocal. Esta cifra ha sido modificada de Vedadghavami et al.4 y Bajpayee et al.3Por favor, haga clic aquí para ver una versión más grande de esta figura.
4. Tasa de difusión no equilibrio de las CPC en el cartílago
- Reúna las dos mitades de la cámara de transporte diseñada a medida (Figura 6) para montar y cerrar la cámara. Utilice arandelas, tuercas y pernos para cerrar firmemente la cámara con una llave.
NOTA: La cámara de transporte debe ser translúcida para no interferir con las lecturas fluorescentes. Las cámaras de transporte utilizadas en este protocolo están hechas de polimetilmetacrilato (PMMA). - Recubrir el espacio interior de la cámara con una solución de leche bovina sin grasa del 0,5% p/v en 1x PBS (2 ml para cada cámara) durante 15 min para evitar la unión no específica de CPC a las paredes de la cámara. A continuación, enjuague la cámara con 1x PBS (2 ml para cada cámara).
- Usando el accesorio de corte diseñado a medida (Figura 2) y una cuchilla de afeitar, corte un explano de cartílago de 6 mm de diámetro (plano transversal) a un espesor de 500-800 m, incluyendo la zona superficial. Mantenga el explant hidratado con 1x PBS.
- Usando punzones dérmicos y accionados por martillo, cree juntas a partir de láminas de goma como se muestra en la Figura 7.
- Montar cada media cámara de transporte para incluir 1 junta de goma grande, 1 inserto PMMA y 1 junta de goma pequeña cada una. Coloque el explant en los pozos de la plaquita de plástico, con la zona superficial orientada a la cámara aguas arriba. Sandwich las dos mitades juntas para completar el montaje y atornillar firmemente usando una llave(Figura 7).
- Llene la cámara aguas arriba con 2 ml de 1x PBS-PI y observe la cámara aguas abajo para detectar fugas de líquido de la cámara aguas arriba. Si hay fugas, vuelva a montar la cámara, ajustando la posición de la junta y la estanqueidad de los tornillos. Si no hay fugas, llene la cámara aguas abajo con 2 mL 1x PBS-PI también.
- Agregue una barra de mini-stir a las cámaras arriba y aguas abajo y coloque la cámara en una placa de agitación. Alinee la cámara para que el láser del espectrofotómetro se enfoque hacia el centro de la cámara aguas abajo. Coloque la parte del receptor de señal del espectrofotómetro detrás de la cámara descendente(Figura 8).
NOTA: El láser y el receptor del espectrofotómetro deben estar equipados con los filtros adecuados para excitar, emitir y transmitir señales de la proteína etiquetada fluorescentemente. Proteja la cámara de transporte de la luz utilizando una caja negra durante la experimentación para evitar interferencias en la señal de fluorescencia. Es mejor hacer sellar las aberturas en la parte superior de la cámara con película flexible para evitar la evaporación. - Recoja lecturas de emisión de fluorescencia aguas abajo en tiempo real y asegure una señal estable durante al menos 5 minutos.
NOTA: Las alícuotas de la cámara descendente se pueden obtener y evaluar para la fluorescencia utilizando un lector de placas si no hay disponible un espectrofotómetro diseñado a medida o una cámara de transporte translúcida. - Pipetear un volumen precalificado de solución de stock de CPC con etiquetas fluorescentes en la cámara aguas arriba para garantizar una concentración final de 3 m dentro de la cámara aguas arriba. Observe la señal de fluorescencia aguas abajo y permita que el transporte de soluto alcance un aumento constante de la pendiente.
NOTA: Un explano de cartílago más grueso requerirá más tiempo para alcanzar el estado estacionario. - Una vez que se ha alcanzado el estado estacionario, tome 20 l de la cámara ascendente y agréguelo a la cámara aguas abajo ("prueba de pico").
NOTA: Se observará un pico en la fluorescencia aguas abajo. Esto permitirá la correlación entre las lecturas de fluorescencia y la concentración de CPC. - Recoge lecturas de fluorescencia aguas abajo en tiempo real.
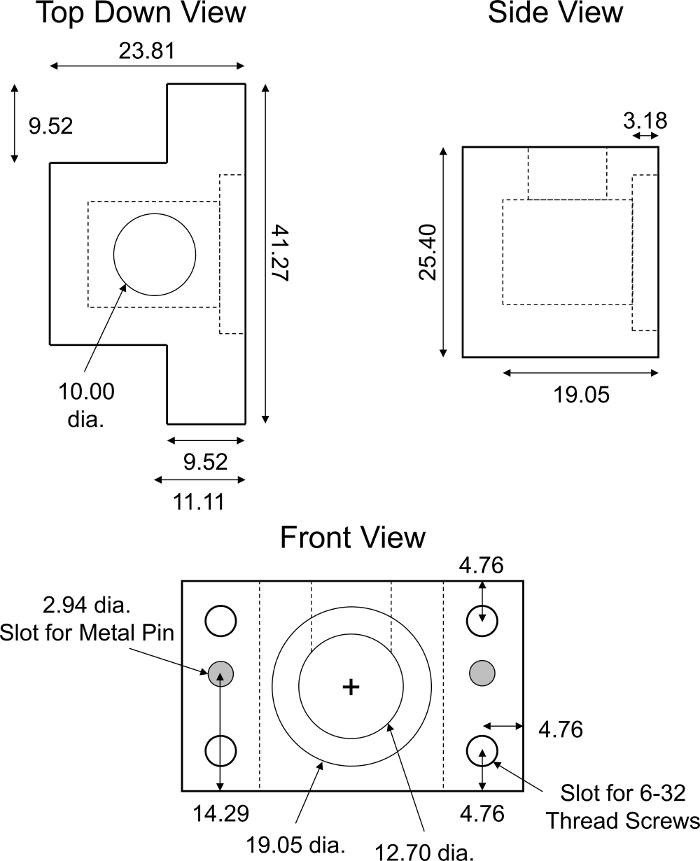
Figura 6: Cámara de transporte de difusión sin equilibrio diseñada a medida. Parámetros de diseño de la cámara de transporte de difusión no equilibrio PMMA. La cámara debe ser translúcida para no interferir con las lecturas de fluorescencia. La cámara de transporte completa consistía en dos mitades idénticas del aparato mostrado. Se requerían dos pasadores cilíndricos de acero inoxidable (2,94 mm de diámetro, 18 mm de largo) para garantizar la alineación y el cierre completo de las mitades de la cámara. Se hicieron cuatro ranuras idénticas para 6-32 tornillos de rosca en cada esquina de la cámara para el montaje hermético de tornillo. Todos los valores numéricos se presentan en milímetros. Haga clic aquí para ver una versión más grande de esta figura.
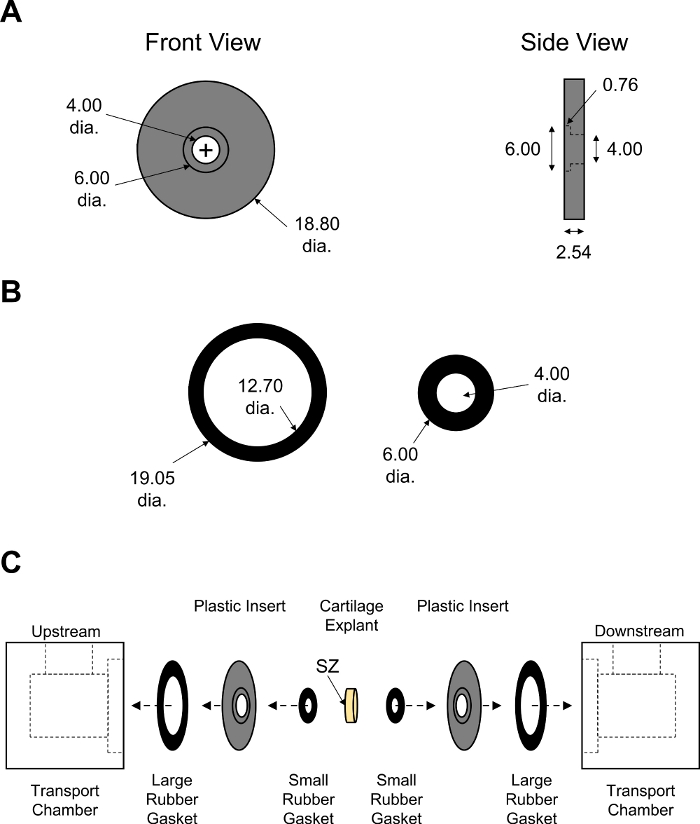
Figura 7: Montaje de la cámara de transporte de difusión sin equilibrio. Parámetros de diseño de (A) insertos PMMA negros y (B) juntas de goma grandes y pequeñas. El espesor de las juntas de goma se ajustó para asegurar un cierre ajustado de la cámara. Todos los valores numéricos se presentan en mm. (C) Esquema que muestra el orden de montaje de dos mitades de la cámara de transporte con explant de cartílago colocado en el centro. SZ indica la zona superficial del cartílago que estaba frente a la cámara aguas arriba. Haga clic aquí para ver una versión más grande de esta figura.
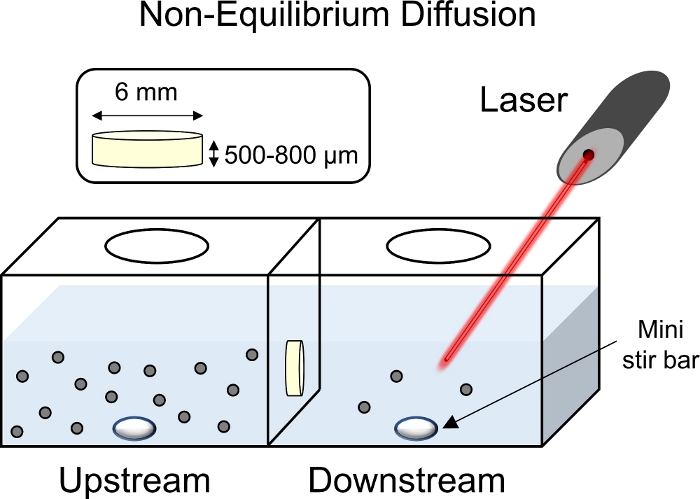
Figura 8: Esquema de experimentos de difusión sin equilibrio. Los explantes de cartílago (6 mm de diámetro x 1 mm de espesor) se colocaron en el centro de la cámara de transporte con la superficie superficial orientada a la cámara aguas arriba. Tanto los lados ascendente como aguas abajo de la cámara se llenaron con 1x PBS-PI y se mezclaron utilizando una mini barra de agitación. Con un láser apuntando hacia la cámara aguas abajo para recoger lecturas fluorescentes, se agregó una solución DE CPC etiquetada fluorescentemente a la cámara aguas arriba. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Después de la absorción de equilibrio de CPC por cartílago, la fluorescencia del baño disminuye cuando el soluto ha sido tomado por el tejido. Sin embargo, si el valor de fluorescencia del baño final sigue siendo similar al inicial, indica que no hay/mínimo absorción de soluto. Otra confirmación de la absorción de soluto es si el tejido ha cambiado visiblemente el color al color del tinte fluorescente. La absorción cuantitativa de solutos en el cartílago se determinó utilizando la relación de absorción (R
Discusión
Los métodos y protocolos descritos aquí son significativos para el campo de la administración de fármacos dirigidos a los tejidos cargados negativamente. Debido a la alta densidad de aggrecanos cargados negativamente presentes en estos tejidos, se crea una barrera, evitando así que los fármacos lleguen a sus sitios de destino celular que se encuentran profundamente dentro de la matriz. Para hacer frente a este desafío excepcional, los medicamentos pueden ser modificados para incorporar portadores de medicamentos c...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado por el Departamento de Defensa de los Estados Unidos a través de los Programas de Investigación Médica Dirigidos por el Congreso (CDMRP) bajo el contrato W81XWH-17-1-0085, y el Instituto Nacional de Salud R03 EB025903-1. AV fue financiado por la Beca del Decano de la Facultad de Ingeniería en la Universidad Northeastern.
Materiales
| Name | Company | Catalog Number | Comments |
| 316 Stainless Steel SAE Washer | McMaster-Carr | 91950A044 | For number 5 screw size, 0.14" ID, 0.312" OD |
| 96-Well Polystyrene Plate | Fisherbrand | 12566620 | Black |
| Acrylic Thick Gauge Sheet | Reynolds Polymer | N/A | For non-equilibrium diffusion and 1-D diffusion transport chamber |
| Antibiotic-Antimycotic | Gibco | 15240062 | 100x |
| Bovine Cartilage | Research 87 | N/A | 2-3 weeks old, femoropatellar groove |
| Bovine Serum Albumin | Fisher BioReagents | BP671-1 | |
| CPC+14 | LifeTein | LT1524 | Custom designed peptide |
| CPC+20 | LifeTein | LT1525 | Custom designed peptide |
| CPC+8 | LifeTein | LT1523 | Custom designed peptide |
| Delicate Task Wipers | Kimberly-Clark Professional | 34155 | |
| Dermal Punch | MedBlades | MB5-1 | 3, 4 and 6 mm |
| Economy Plain Glass Microscope Slides | Fisherbrand | 12550A3 | |
| Flat Bottom Cell Culture Plates | Corning Costar | 3595 | Clear, 96 well |
| Flexible Wrapping Film | Bemis Parafilm M Laboratory | 1337412 | |
| Gold Seal Cover Glass | Electron Microscopy Sciences | 6378701 | # 1.5, 18x18 mm |
| Hammer-Driven Hole Punch | McMaster-Carr | 3427A15 | 1/2" Diameter |
| Hammer-Driven Hole Punch | McMaster-Carr | 3427A19 | 3/4" Diameter |
| Laser | Chroma Technology | AT480/30m | Spectrophotometer Laser Light |
| Low-Strength Steel Hex Nut | McMaster-Carr | 90480A007 | 6-32 Thread size |
| LSM 700 Confocal Microscope | Zeiss | LSM 700 | |
| Micro Magnetic Stirring Bars | Bel-Art Spinbar | F37119-0007 | 7x2 mm |
| Multipurpose Neoprene Rubber Sheet | McMaster-Carr | 1370N12 | 1/32" Thickness |
| Non-Fat Dried Bovine Milk | Sigma Aldrich | M7409 | |
| Petri Dish | Chemglass Life Sciences | CGN1802145 | 150 mm diameter |
| Phosphate-Buffered Saline | Corning | 21-040-CMR | 1x |
| Plate Shaker | VWR | 89032-088 | |
| Protease Inhibitors | Thermo Scientific | A32953 | |
| Razor Blades | Fisherbrand | 12640 | |
| R-Cast Acrylic Thin Gauge Sheet | Reynolds Polymer | N/A | Black transport chamber inserts |
| RTV Silicone | Loctite | 234323 | Epoxy, Non-corrosive, clear |
| Scalpel | TedPella | 549-3 | #10, #11 blades |
| Signal Receiver | Chroma Technology | ET515lp | Spectrophotometer Laser Signal Receiver |
| Snap-Cap Microcentrifuge Tubes | Eppendorf | 22363204 | 1.5 mL |
| Spatula | TedPella | 13508 | |
| Synergy H1 Microplate Reader | Biotek | H1M | |
| Zinc-Plated Alloy Steel Socket Head Screw | McMaster-Carr | 90128A153 | 6-32 Thread size, 1" Long |
Referencias
- Bajpayee, A. G., Grodzinsky, A. J. Cartilage-targeting drug delivery: can electrostatic interactions help. Nature Reviews Rheumatology. 13 (3), 183-193 (2017).
- Maroudas, A. Transport of solutes through cartilage: permeability to large molecules. Journal of Anatomy. 122, 335-347 (1976).
- Bajpayee, A. G., Wong, C. R., Bawendi, M. G., Frank, E. H., Grodzinsky, A. J. Avidin as a model for charge driven transport into cartilage and drug delivery for treating early stage post-traumatic osteoarthritis. Biomaterials. 35 (1), 538-549 (2014).
- Vedadghavami, A., et al. Cartilage penetrating cationic peptide carriers for applications in drug delivery to avascular negatively charged tissues. Acta Biomaterialia. 93, 258-269 (2019).
- Mehta, S., Akhtar, S., Porter, R. M., Önnerfjord, P., Bajpayee, A. G. Interleukin-1 receptor antagonist (IL-1Ra) is more effective in suppressing cytokine-induced catabolism in cartilage-synovium co-culture than in cartilage monoculture. Arthritis Research & Therapy. 21 (1), 238 (2019).
- Vedadghavami, A., Zhang, C., Bajpayee, A. G. Overcoming negatively charged tissue barriers: Drug delivery using cationic peptides and proteins. Nano Today. 34, 100898 (2020).
- Young, C. C., Vedadghavami, A., Bajpayee, A. G. Bioelectricity for Drug Delivery: The Promise of Cationic Therapeutics. Bioelectricity. , (2020).
- Felson, D. T. Osteoarthritis of the knee. New England Journal of Medicine. 354 (8), 841-848 (2006).
- Wieland, H. A., Michaelis, M., Kirschbaum, B. J., Rudolphi, K. A. Osteoarthritis - An untreatable disease. Nature Reviews Drug Discovery. 4 (4), 331-344 (2005).
- Martel-Pelletier, J. Pathophysiology of osteoarthritis. Osteoarthritis and Cartilage. 7 (4), 371-373 (1999).
- Sophia Fox, A. J., Bedi, A., Rodeo, S. A. The basic science of articular cartilage: Structure, composition, and function. Sports Health. 1 (6), 461-468 (2009).
- Chevalier, X., et al. Intraarticular injection of anakinra in osteoarthritis of the knee: A multicenter, randomized, double-blind, placebo-controlled study. Arthritis Care and Research. 61 (3), 344-352 (2009).
- Cohen, S. B., et al. A randomized, double-blind study of AMG 108 (a fully human monoclonal antibody to IL-1R1) in patients with osteoarthritis of the knee. Arthritis Research and Therapy. 13 (4), 125 (2011).
- Evans, C. H., Kraus, V. B., Setton, L. A. Progress in intra-articular therapy. Nature Reviews Rheumatology. 10 (1), 11-22 (2014).
- He, T., et al. Multi-arm Avidin nano-construct for intra-cartilage delivery of small molecule drugs. Journal of Controlled Release. 318, 109-123 (2020).
- Bajpayee, A. G., Scheu, M., Grodzinsky, A. J., Porter, R. M. A rabbit model demonstrates the influence of cartilage thickness on intra-articular drug delivery and retention within cartilage. Journal of Orthopaedic Research. 33 (5), 660-667 (2015).
- Bajpayee, A. G., Quadir, M. A., Hammond, P. T., Grodzinsky, A. J. Charge based intra-cartilage delivery of single dose dexamethasone using Avidin nano-carriers suppresses cytokine-induced catabolism long term. Osteoarthritis and Cartilage. 24 (1), 71-81 (2016).
- Zhang, C., et al. Avidin-biotin technology to synthesize multi-arm nano-construct for drug delivery. MethodsX. , 100882 (2020).
- Wagner, E. K., et al. Avidin grafted dextran nanostructure enables a month-long intra-discal retention. Scientific Reports. 10.1, 1-14 (2020).
- Troeberg, L., Nagase, H. Proteases involved in cartilage matrix degradation in osteoarthritis. Biochimica et Biophysica Acta - Proteins and Proteomics. 1824 (1), 133-145 (2012).
- Kirk, T. B., Wilson, A. S., Stachowiak, G. The effects of dehydration on the surface morphology of articular cartilage. Journal of Orthopaedic Rheumatology. 6 (2-3), 75-80 (1993).
- Ateshian, G. A., Maas, S., Weiss, J. A. Solute transport across a contact interface in deformable porous media. Journal of Biomechanics. 45 (6), 1023-1027 (2012).
- Arbabi, V., Pouran, B., Weinans, H., Zadpoor, A. A. Multiphasic modeling of charged solute transport across articular cartilage: Application of multi-zone finite-bath model. Journal of Biomechanics. 49 (9), 1510-1517 (2016).
- Arbabi, V., Pouran, B., Zadpoor, A. A., Weinans, H. An experimental and finite element protocol to investigate the transport of neutral and charged solutes across articular cartilage. Journal of Visualized Experiments. 2017 (122), (2017).
- Sampson, S. L., Sylvia, M., Fields, A. J. Effects of dynamic loading on solute transport through the human cartilage endplate. Journal of Biomechanics. 83, 273-279 (2019).
- Bajpayee, A. G., Scheu, M., Grodzinsky, A. J., Porter, R. M. Electrostatic interactions enable rapid penetration, enhanced uptake and retention of intra-articular injected avidin in rat knee joints. Journal of Orthopaedic Research : Official Publication of the Orthopaedic Research Society. 32 (8), 1044-1051 (2014).
- Bajpayee, A. G., et al. Sustained intra-cartilage delivery of low dose dexamethasone using a cationic carrier for treatment of post traumatic osteoarthritis. European Cells & Materials. 34, 341-364 (2017).
- Malda, J., et al. Of Mice, Men and Elephants: The Relation between Articular Cartilage Thickness and Body Mass. PLoS One. 8 (2), 57683 (2013).
- Frisbie, D. D., Cross, M. W., McIlwraith, C. W. A comparative study of articular cartilage thickness in the stifle of animal species used in human pre-clinical studies compared to articular cartilage thickness in the human knee. Veterinary and Comparative Orthopaedics and Traumatology. 19 (3), 142-146 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados