Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Habilitación de la compensación en tiempo real en oxidaciones fotoquímicas rápidas de proteínas para la determinación de los cambios en la topografía proteica
En este artículo
Resumen
La oxidación fotoquímica rápida de proteínas es una técnica emergente para la caracterización estructural de proteínas. Diferentes aditivos solventes y ligandos tienen variadas propiedades de barrido hidroxilo radical. Para comparar la estructura proteica en diferentes condiciones, se requiere una compensación en tiempo real de los radicales hidroxilo generados en la reacción para normalizar las condiciones de reacción.
Resumen
La oxidación fotoquímica rápida de proteínas (FPOP) es una técnica de biología estructural basada en espectrometría de masas que sondea la superficie accesible al solvente de las proteínas. Esta técnica se basa en la reacción de las cadenas laterales de aminoácidos con radicales hidroxilo que se difunden libremente en solución. FPOP genera estos radicales in situ por fotólisis láser de peróxido de hidrógeno, creando una ráfaga de radicales hidroxilo que se agota en el orden de un microsegundo. Cuando estos radicales hidroxilo reaccionan con una cadena lateral de aminoácidos accesibles al disolvente, los productos de reacción presentan un cambio de masa que se puede medir y cuantificar mediante espectrometría de masas. Dado que la tasa de reacción de un aminoácido depende en parte de la superficie accesible del disolvente promedio de ese aminoácido, los cambios medidos en la cantidad de oxidación de una región determinada de una proteína pueden correlacionarse directamente con los cambios en la accesibilidad del disolvente de esa región entre diferentes conformaciones (por ejemplo, ligando-unido versus ligando-libre, monómero vs. agregado, etc.) FPOP se ha aplicado en una serie de problemas en la biología, incluyendo interacciones proteína-proteína, cambios en la conformación de proteínas, y unión proteína-ligand. Dado que la concentración disponible de radicales hidroxilo varía en función de muchas condiciones experimentales en el experimento FPOP, es importante controlar la dosis radical efectiva a la que está expuesto el analito proteico. Este monitoreo se logra eficientemente mediante la incorporación de un dosímetro en línea para medir la señal de la reacción FPOP, con fluencia láser ajustada en tiempo real para lograr la cantidad deseada de oxidación. Con esta compensación, los cambios en la topografía proteica que reflejan cambios en la conformación, superficies de unión de ligandos y/o interfaces de interacción proteína-proteína se pueden determinar en muestras heterogéneas utilizando cantidades de muestra relativamente bajas.
Introducción
La oxidación fotoquímica rápida de proteínas (FPOP) es una técnica emergente para la determinación de cambios topográficos proteicos mediante la modificación covalente ultrarrápida de la superficie expuesta al disolvente de proteínas seguida de la detección por LC-MS1. FPOP genera una alta concentración de radicales hidroxilo in situ por fotolisis flash láser UV de peróxido de hidrógeno. Estos radicales hidroxilo son muy reactivos y de corta duración, consumidos en aproximadamente una escala de tiempo de microsegundos bajo condiciones FPOP2. Estos radicales hidroxilo se difunden a través del agua y oxidan varios componentes6 orgánicos en solución a tasas cinéticas que generalmente van desde rápido (10 M-1 s-1) a3controlado por difusión. Cuando el radical hidroxilo se encuentra con una superficie de proteína, el radical oxidará las cadenas laterales de aminoácidos en la superficie de la proteína, lo que resulta en un cambio de masa de ese aminoácido (más comúnmente la adición neta de un átomo de oxígeno)4. La velocidad de la reacción de oxidación en cualquier aminoácido depende de dos factores: la reactividad inherente de ese aminoácido (que depende de la cadena lateral y del contexto de secuencia)4,5 y la accesibilidad de esa cadena lateral al radical hidroxilo difusor, que se correlaciona estrechamente con la superficie accesible del disolvente medio6,7. Todos los aminoácidos estándar excepto la glicina se han observado como etiquetado por estos radicales hidroxilo altamente reactivos en experimentos FPOP, aunque con rendimientos muy diferentes; en la práctica, Ser, Thr, Asn y Ala rara vez se consideran oxidados en la mayoría de las muestras, excepto bajo dosis de radicales altos e identificados por la cuidadosa y sensible fragmentación específica de ETD8,,9. Después de la oxidación, las muestras se apagan para eliminar el peróxido de hidrógeno y los oxidantes secundarios (superóxido, oxígeno singlete, hidroperóxidos de peptidil, etc.) Las muestras insaciadas se digieren proteolíticamente para generar mezclas de péptidos oxidados, donde la información estructural se congela como una "instantánea" química en los patrones de los productos de oxidación de los diversos péptidos (Figura 1). La cromatografía líquida acoplada a la espectrometría de masas (LC-MS) se utiliza para medir la cantidad de oxidación de aminoácidos en un péptido proteolítico determinado basado en las intensidades relativas de las versiones oxidadas y no oxidadas de ese péptido. Al comparar esta huella oxidativa de la misma proteína obtenida en diferentes condiciones de conformacional (por ejemplo, ligando frente frente frente a ligando libre), las diferencias en la cantidad de oxidación de una región determinada de la proteína pueden correlacionarse directamente con las diferencias en la superficie accesible al disolvente de esa región6,,7. La capacidad de proporcionar información topográfica de proteínas hace de FPOP una tecnología atractiva para la determinación de la estructura de orden superior de las proteínas, incluso en el descubrimiento terapéutico proteico y el desarrollo10,,11.

Figura 1: Visión general de FPOP. La superficie de la proteína es modificada covalentemente por radicales hidroxilo altamente reactivos. Los radicales hidroxilo reaccionarán con las cadenas laterales de aminoácidos de la proteína a una velocidad fuertemente influenciada por la accesibilidad del disolvente de la cadena lateral. Los cambios topográficos (por ejemplo, debido a la unión de un ligando como se muestra arriba) protegerán los aminoácidos en la región de interacción de reaccionar con radicales hidroxilo, lo que resulta en una disminución en la intensidad del péptido modificado en la señal LC-MS. Haga clic aquí para ver una versión más grande de esta figura.
Diferentes componentes presentes en la solución FPOP (por ejemplo, ligandos, excipientes, tampones) tienen diferente actividad de barrido hacia los radicales hidroxilo generados sobre la fotólisis láser de peróxido de hidrógeno3. Del mismo modo, un pequeño cambio en la concentración de peróxido, la fluencia láser y la composición del tampón puede cambiar la dosis radical efectiva, haciendo que la reproducción de datos FPOP sea un reto entre las muestras y entre diferentes laboratorios. Por lo tanto, es importante poder comparar la dosis radical hidroxilo disponible para reaccionar con la proteína en cada muestra utilizando uno de los varios dosímetros radicales hidroxilo disponibles12,13,14,15,16. Los dosímetros radicales hidroxilo actúan compitiendo con el analito (y con todos los carroñeros en solución) para la piscina de radicales hidroxilo; la dosis efectiva de los radicales hidroxilo se mide midiendo la cantidad de oxidación del dosímetro. Tenga en cuenta que "dosis radical hidroxilo eficaz" es una función tanto de la concentración inicial de hidroxilo radical generado y la vida media del radical. Estos dos parámetros dependen parcialmente entre sí, haciendo que el modelado cinético teórico sea algo complejo(Figura 2). Dos muestras podrían tener vida media radical inicial muy diferente mientras se mantiene la misma dosis radical efectiva cambiando la concentración inicial de hidroxilo radical formado; seguirán generando huellas idénticas17. Adenina13 y Tris12 son convenientes dosímetros radicales hidroxilo porque su nivel de oxidación se puede medir por espectroscopia UV en tiempo real, lo que permite a los investigadores identificar rápidamente cuando hay un problema con la dosis efectiva de radical hidroxilo y para solucionar su problema. Para resolver este problema, es importante un dosímetro en línea ubicado en el sistema de flujo directamente después del sitio de irradiación que puede monitorear la señal de los cambios de absorbancia de la adenina en tiempo real. Esto ayuda a llevar a cabo experimentos FPOP en amortiguadores o cualquier otro excipiente con niveles ampliamente diferentes de capacidad de barrido radical hidroxilo17. Esta compensación de dosis radical se puede realizar en tiempo real, dando resultados estadísticamente indistinguibles para el mismo conformerlo mediante el ajuste de la dosis radical efectiva.
En este protocolo, tenemos procedimientos detallados para realizar un experimento típico de FPOP con compensación de dosificación radical utilizando adenina como un dosímetro radical óptico interno. Este método permite a los investigadores comparar huellas entre condiciones FPOP que tienen diferente capacidad de barrido mediante la realización de compensación en tiempo real.
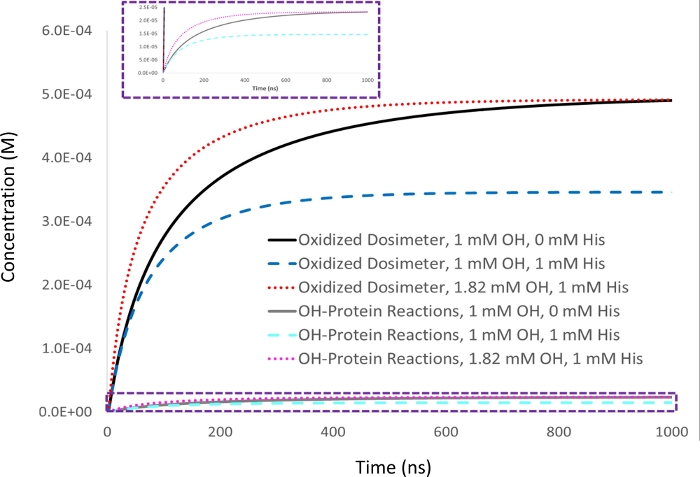
Figura 2: Simulación cinética de la compensación basada en la dosimetría. La respuesta del dosímetro de adenina de 1 mM se mide en un analito de cilima de 5 mM con una concentración inicial de 1 mM de «1 mM" en un sensor radical hidroxilo inicial (▪OH t1/2a53 ns) y se establece como respuesta del dosímetro objetivo (negro). Tras la adición de 1 mM de la histidina excipiente carroñera, la respuesta del dosímetro (azul) disminuye junto con la cantidad de oxidación de proteínas de manera proporcional (cian). La vida media del radical hidroxilo también disminuye (▪OH t1/2a39 ns). Cuando la cantidad de radical hidroxilo generado se incrementa para dar un rendimiento equivalente de dosímetro oxidado en la muestra con 1 mM histidina carroñero como se logra con 1 mM de radical hidroxilo en ausencia de carroñero (rojo), la cantidad de oxidación de proteína que se produce de forma similar se convierte en idéntica (magenta), mientras que la vida media radical hidroxilo disminuye aún más (▪OH t1/2=ns). Adaptado con permiso de Sharp J.S., Am Pharmaceut Rev 22, 50-55, 2019. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
1. Prepare el banco óptico y el capilar para FPOP
ADVERTENCIA: Los láseres de excimer KrF son peligros oculares extremos, y la luz directa o reflejada puede causar daños oculares permanentes. Use siempre la protección adecuada para los ojos, evite la presencia de objetos reflectantes cerca de la trayectoria del haz cuando sea posible y utilice controles de ingeniería para evitar el acceso no autorizado a un láser activo y para restringir cualquier reflejo perdido.
- Prepare el banco óptico FPOP.
- Encienda el láser para calentar. Ajuste el láser a Disparador externo, Energía constante, Sin reemplazo de gas. Ajuste la energía láser por pulso (normalmente entre 80-120 mJ/pulso).
- Configure el banco óptico con la lente plano-convexa (30 mm de diámetro x 120 mm FL sin recubrimiento) directamente en la trayectoria del rayo láser y un backstop no reflectante para absorber la luz como se muestra en la Figura 3A.

Figura 3: Banco óptico para el experimento FPOP. (A) La muestra se mezcla con H2O2, dosímetro radical de adenina, y el carroñero de glutamina y se carga en la jeringa. La muestra se empuja a través del capilar de sílice fusionada a través de la trayectoria de haz enfocada de un láser UV excimer KrF. La luz UV fotoliza H2O2 en radicales hidroxilo, que oxida la proteína y el dosímetro de adenina. El flujo de la jeringa empuja la muestra iluminada fuera de la trayectoria del láser antes del siguiente pulso láser, con un volumen de exclusión no contaminado entre las regiones iluminadas. Inmediatamente después de la oxidación, la muestra se pasa a través de un espectrofotómetro UV en línea, que mide la absorción UV de la adenina a 265 nm. A continuación, la muestra se deposita en un tampón de enfriamiento para eliminar los oxidantes H2O2 y secundarios restantes. (B) El tamaño del punto se mide después de irradiar una nota adhesiva de color colocada detrás del capilar con el láser a 248 nm. La anchura del punto se utiliza para calcular el caudal de la muestra, y la silueta del capilar en el centro del punto se utiliza para alinear el banco óptico. Haga clic aquí para ver una versión más grande de esta figura.
- Cortar una longitud adecuada del capilar de sílice fusionada (diámetro exterior de 360 m y diámetro interior de 100 m) y con un manguito, conéctelo a la jeringa hermética al gas utilizando un conector de bajo volumen muerto.
- Quemar suavemente el recubrimiento de poliimida del capilar con una antorcha de butano en el lugar donde el dosímetro en línea lee la señal de absorbancia a 265 nm después de la exposición láser de las muestras. Limpie suavemente los restos del capilar con metanol en una toallita sin pelusas. El recubrimiento de poliimida en el lugar de incidencia láser puede quemarse de manera similar con la antorcha de butano o quemarse con el láser excimer disparando a baja potencia.
NOTA: Espere a que el capilar se enfríe, ya que es un peligro de incendio utilizar el metanol en el capilar caliente. - Coloque este capilar a través de la trayectoria del haz del láser y en el dosímetro en línea.
- Presione la palanca en la parte superior del dosímetro en línea para abrir la bisagra. Retire los soportes magnéticos. Coloque el capilar en la ranura mecanizada del dosímetro en línea, utilizando los soportes magnéticos para mantener el capilar en su lugar. Cierre la bisagra del dosímetro sobre el capilar, presionándola hasta que la palanca se bloquee en su lugar.
- Con el software de dosimetría, haga clic en el botón Iniciar Flash para comenzar a disparar el láser excimer. Establezca la potencia láser preestablecida entre 50-100 mJ/pulso en el propio software de control láser y establezca la velocidad de repetición preestablecida entre 10-20 Hz en la pestaña Configuración del software de dosimetría.
- Enfoque el rayo láser utilizando una lente convexa plano montada en una etapa motorizada lineal. Mida la anchura y la altura del punto láser en la posición del capilar en una nota adhesiva utilizando con precisión una pinza para calcular la fluencia incidente (mJ/mm2) como se muestra en la Figura 3B.
- Coloque una abertura opaca cerca del capilar para asegurar una anchura iluminada uniforme del capilar independientemente de los cambios en el tamaño del haz debido al movimiento de la lente o cambiando la energía por pulso del láser18.
- Con el disparo láser, mueva la etapa motorizada a través de su rango de movimiento. Asegúrese de que la viga se mantenga centrada en la abertura y que la silueta del capilar se pueda observar en todo momento. El diámetro de la abertura debe ser menor que la anchura de la viga focalizada en cada punto del rango de la etapa motorizada.
- Pase agua a través del capilar a 20 ml/min durante al menos un minuto para lavar el capilar.
- Haga clic en el botón Iniciar datos + AutoZero en el software del dosímetro para poner a cero el dosímetro para regar y comenzar la recopilación de datos.
NOTA: Si el sistema tampón para FPOP tiene una absorción UV significativa a 265 nm, el sistema FPOP debe ponerse a cero en el tampón, no en el agua.
- Haga clic en el botón Iniciar datos + AutoZero en el software del dosímetro para poner a cero el dosímetro para regar y comenzar la recopilación de datos.
- Ajuste el caudal calculado en la bomba de la jeringa.
- El caudal de la muestra de proteína depende del volumen irradiado por inyección(VIrr),del número de inyecciones láser por segundo(R) y de la fracción de volumen de exclusión sinradiada deseada (FEx) para corregir los efectos de flujo laminar y la difusión de muestras (0,15-0,30 recomendado)2,19,20. Calcule el VIrr (en L) en función del diámetro interior del capilar en mm (d) y la anchura del punto láser que afectan al capilar (es decir, la anchura de la abertura) en mm (w) utilizando la siguiente ecuación:
VIrr á π(d/2)2w - Calcule el caudal deseado (en L/min) basándose en la siguiente ecuación:
Flujo 60 R[VIrr (1 + FEx)]
- El caudal de la muestra de proteína depende del volumen irradiado por inyección(VIrr),del número de inyecciones láser por segundo(R) y de la fracción de volumen de exclusión sinradiada deseada (FEx) para corregir los efectos de flujo laminar y la difusión de muestras (0,15-0,30 recomendado)2,19,20. Calcule el VIrr (en L) en función del diámetro interior del capilar en mm (d) y la anchura del punto láser que afectan al capilar (es decir, la anchura de la abertura) en mm (w) utilizando la siguiente ecuación:
2. Preparación de la solución proteica para FPOP
- Preparar la proteína en las dos o más condiciones diferentes a comparar (por ejemplo, ligando y libre de ligandos; agregado y monómero; solo y con un socio de unión a proteínas; etc.) para detectar los cambios de conformación.
- Establezca el volumen total utilizado para FPOP para que se ajuste a las necesidades del experimento. El límite mínimo generalmente depende del volumen del capilar de irradiación y del material necesario para la detección robusta y la cuantificación relativa, y variará dependiendo en gran medida del sistema LC-MS/MS utilizado y del método de procesamiento de muestras posteriores al etiquetado. El volumen total de las soluciones FPOP que se utilizan comúnmente en nuestro grupo es de 20 l después de la adición de peróxido de hidrógeno. La concentración final de la proteína es comúnmente de 1-10 m, con 17 mM de glutamina (para limitar la vida útil del radical hidroxilo), 1 mM de adenina (para actuar como un dosímetro radical)13,17 y 10 mM tampón de fosfato (un tampón que es un pobre carroñero de radicales hidroxilo). Las muestras generalmente se preparan con múltiples réplicas para permitir el modelado estadístico de los resultados.
- Para la mayoría de los propósitos generales, preparar muestras en triplicado en ambos estados, además de al menos una muestra para utilizar como control sin láser para medir la oxidación de fondo. Prepare 18 l de esta mezcla de solución FPOP.
NOTA: Muchos tampones y aditivos comúnmente utilizados en la bioquímica son carroñeros radicales hidroxilo. Estos aditivos y tampones se pueden utilizar; sin embargo, pueden producirse reducciones en la oxidación debido al barrido radical hidroxilo del tampón. En general, mantenga todos los aditivos al mínimo requerido por el sistema biológico para maximizar el rendimiento de oxidación de proteínas. Se debe evitar el sulfóxido de dimetil debido a la propensión a generar radicales secundarios; dimetilformamida ha sido una alternativa útil en nuestras manos. Cuando se utilizan tampones que son fuertes carroñeros radicales hidroxilo, la glutamina a menudo se puede excluir de la mezcla de solución FPOP.
- Para la mayoría de los propósitos generales, preparar muestras en triplicado en ambos estados, además de al menos una muestra para utilizar como control sin láser para medir la oxidación de fondo. Prepare 18 l de esta mezcla de solución FPOP.
- Preparar 1 M de peróxido de hidrógeno inmediatamente antes del experimento FPOP.
NOTA: 30% de peróxido de hidrógeno como comúnmente vendido por los vendedores incluye un estabilizador, que aumenta la vida útil. Una vez diluido, peróxido de hidrógeno debe utilizarse rápidamente, definitivamente dentro del mismo día. El peróxido de hidrógeno también debe ser probado regularmente para la descomposición por FPOP utilizando un dosímetro radical hidroxilo. - Preparar tubos de microcentrífuga que contengan 25 ml de solución de enfriamiento de 0,5 g/l de metionina amida y 0,5 g/l de catalasa. Si se utiliza un volumen de muestra superior a 20 oL para FPOP, aumente proporcionalmente el volumen de la solución de enfriamiento.
3. Realizar el experimento FPOP
- Añadir 2 l de peróxido de hidrógeno en los 18 l de la mezcla de solución FPOP. Mezclar el contenido suavemente con una pipeta y girar rápidamente hacia abajo la solución a la parte inferior de los tubos de microcentrífuga. Recoja inmediatamente con una jeringa hermética y cargue en la bomba de la jeringa.
- Inicie el flujo en la bomba de la jeringa con el caudal determinado en el paso 1.8.1 (normalmente entre 8-16 l/min) haciendo clic en el botón Iniciar bomba del software del dosificador.
- Supervise la lectura de adenina en tiempo real utilizando el dosímetro en línea (ver Tabla de materiales)y recoja la muestra en residuos. Espere a que la señal Abs265 se estabilice.
- Haga clic en el botón Start Flash en el software dosímetro para comenzar a disparar el láser a la velocidad de repetición y la energía preestablecidas.
- Supervisar la lectura de adenina en tiempo real utilizando un dosímetro en línea (ver Tabla de materiales); la diferencia en Abs265 con el láser apagado y el láser encendido es la lectura delos 265.
NOTA: La aparición de abs265 lecturas altamente inestables al disparar el láser en presencia de peróxido de hidrógeno se debe a la generación de burbujas en solución. Reducir la fluidez del láser y/o la concentración de peróxido de hidrógeno para eliminar las burbujas.
4. Realizar la compensación
NOTA: Diferentes ligandos, tampones, etc. pueden tener diferente capacidad de barrido hacia los radicales hidroxilo. Es importante asegurarse de que se disponga de dosis efectivas comparables de radicales hidroxilo para reaccionar con proteínas a través de diferentes muestras. Esto se logra asegurando la misma respuesta del dosímetro radical hidroxilo entre las muestras. Usando dosimetría de adenina, el cambio en la absorbancia UV a 265 nm (Abs265) refleja la dosis efectiva de hidroxilo radical; cuanto mayor sea la265,mayor será la dosis efectiva de radical hidroxilo.
- Compare la lectura del abs265 obtenida con el dosímetro en línea con la lectura deseada de la obtenciónde 265 obtenida mediante experimentos o controles previos. Una lectura deabs 265 inferior a la lectura deseada indica una dosis efectiva insuficiente de radicales hidroxilo; una lectura de Abs265 indica una dosis radical efectiva que es demasiado alta. Si la lectura de la fuente265 está en el nivel deseado, recoja la muestra inmediatamente después de la irradiación láser en el búfer de enfriamiento17.
- Compensar la dosis radical efectiva para igualar el sAbs265. Esta compensación se puede realizar de tres maneras: cambiar la concentración de peróxido de hidrógeno, aumentar la fluidez del láser cambiando la energía del láser por pulso, o aumentar la fluencia láser cambiando el plano focal de la lente de enfoque.
- Para realizar un cambio importante (>10 mAU) en la lectura de la página265, vuelva a hacer el rehacer la muestra con más o menos peróxido de hidrógeno y vuelva a ejecutar la muestra según la Sección 3.
- Para realizar un pequeño cambio en la lectura de los anchos265 en tiempo real, ajuste el plano focal del haz incidente ajustando la posición de la lente de enfoque utilizando el escenario motorizado de 50 mm. Acercar el plano focal a la posición del capilar aumentará la lectura delAbs 265; llevar el plano focal más lejos de la posición del capilar disminuirá la lectura delos 265 años.
- Vigilar la adenina -Abs265 para medir la cantidad efectiva de radical hidroxilo presente en la muestra después de la irradiación láser13. La monitorización en tiempo real con un detector capilar UV en línea permite una compensación en tiempo real como se describe en 4.2.2; ajuste la posición de la lente utilizando la etapa motorizada hasta que la lectura de la barra265 sea igual a la lectura deseada. Las mediciones de absorbancia post-experimental con un espectrofotómetro UV también son precisas, pero requieren nuevas muestras para ser utilizadas para cada dosis efectiva de radical.
5. Digerir las muestras de proteínas
NOTA: La tripina se utiliza más comúnmente para digerir muestras de proteínas para FPOP, y es la proteasa utilizada en este protocolo. Es una proteasa fiable que genera péptidos con sitios básicos tanto en el término N como en C, promoviendo multiplicar los iones peptídicos cargados en em. Por otra parte, se corta después de lisina y arginina, dos aminoácidos que son sólo moderadamente reactivos a los radicales hidroxilo; por lo tanto, los cambios en el patrón de digestión debido a la oxidación de analitos son raros. Otras proteasas se han utilizado con éxito con FPOP21,pero se debe tener cuidado para garantizar que los patrones de digestión sean comparables entre las muestras no oxidadas y oxidadas.
- Mida el volumen final de la muestra de FPOP apretada. Añadir 500 mM Tris, pH 8.0 con 10 mM CaCl2 que contiene 50 mM de ditiothreitol (TDT) a la solución proteica después de apagar a una concentración final de 50 mM Tris, 1 mM CaCl2 y 5 mM DTT.
- Calentar la muestra de proteína a 95 oC durante 15 minutos.
- Enfríe inmediatamente la muestra sobre hielo durante 2 minutos.
- Agregue la relación peso de 1:20 de trippsina/proteína a las muestras.
- Digerir la proteína durante la noche a 37oC con la mezcla.
- Detener la reacción de digestión mediante la adición de 0,1% de ácido fórmico y/o calentar la muestra a 95oC durante 10 min.
- Añadir 2 mM de TDT a las muestras y calentar a 60oC durante 15 min inmediatamente antes de LC-MS/MS.
NOTA: Mientras que otros grupos han reportado alquilación de tioles en experimentos FPOP, en nuestras manos hemos observado productos secundarios sobre la alquilación de proteínas oxidadas (posiblemente debido a la reacción con carbonilos nucleófilos formados como un producto de oxidación menor). Por lo tanto, elegimos evitar la alquilación de tiols cuando sea posible.
6. Realizar espectrometría de masas tándem de cromatografía líquida (LC-MS/MS)
- Preparar la fase móvil A que consiste en agua que contiene 0,1% de ácido fórmico y fase B móvil que consiste en acetonitrilo con 0,1% de ácido fórmico.
- Cargue la muestra primero en una columna de trampa C18 (300 m I.D. x 5 mm de tamaño de poro de 100o, tamaño de partícula de 5 m) y lave con un 2% de disolvente B durante 3 minutos a un caudal de 5,0 l/min para eliminar sales y moléculas pequeñas hidrófilas.
- A continuación, separe los péptidos en nanocolumna C18 (0,75 mm x 150 mm, tamaño de partícula de 2 m, tamaño de poro de 100o) a un caudal de 300 nL/min. El gradiente consiste en un aumento lineal de 2 a 35% de disolvente B durante 22 min, rampaado al 95% de disolvente B durante 5 min y mantenido durante 3 minutos para lavar la columna, y luego regresó al 2% B durante 3 min y se mantuvo durante 9 minutos para reequilibrar la columna.
NOTA: Este gradiente es suficiente para LC-MS/MS de la mayoría de las mezclas de FPOP de una y dos proteínas que buscan hacer la cuantificación a nivel de péptido. El porcentaje de disolvente B puede necesitar ser alterado para aumentar la resolución de péptidos en casos raros donde los péptidos interfieren entre sí debido a tiempos de retención similares y valores m/z. Los diseños experimentales A escala proteome FPOP22 o experimentales que buscan separar los isómeros de productos de oxidación de péptidos1,,23,,24,25 pueden requerir gradientes LC más largos y están fuera del alcance de este informe. - Eluda los péptidos directamente en la fuente de nanospray de un espectrómetro de masas de alta resolución utilizando un emisor de nanospray conductor.
- Adquiera los datos en modo iónico positivo. Ajuste la tensión de pulverización a 2400 V, y la temperatura del tubo de transferencia de iones a 300 oC.
- Adquiera las exploraciones de MS completas de m/z 250 a 2000 a una resolución nominal a m/z 200 de 60.000 seguidas de ocho exploraciones posteriores de trampa de iones lineales dependientes de datos MS/MS en los ocho iones de péptidos más abundantes que utilizan una disociación inducida por colisión a una energía normalizada del 35% para identificar los péptidos. Fragmente los péptidos hasta cinco veces dentro de 30 s y luego transfiera a una lista de exclusión durante 60 s.
7. Procesamiento de datos y cálculo de la oxidación media de péptidos
- Determinar la cobertura de secuencia de los valores de proteína, m/z y los tiempos de retención de los péptidos no oxidados utilizando el motor de búsqueda proteómica MS/MS.
- Establezca la tolerancia de masa precursora en 10 ppm y permita hasta dos sitios de escote perdidos para las muestras digeridas de la trippsina, utilizando la especificidad estándar de la escisión de la trippsina.
- Establezca la tolerancia de masa del fragmento de masa del péptido en 0,4 Daltons.
- Sobre la base de la relación m/z de los péptidos no modificados detectados y los cambios de masa conocidos de los principales productos de oxidación, calcular la m/z de los diversos productos teóricos de oxidación de cada péptido4,26,27,28,29.
- Identifique el cromatograma iónico extraído de estos valores m/z utilizando software para ver la ejecución espectrométrica de masas (Figura 4). Identificar los productos de oxidación de péptidos en función de su m/z,su estado de carga y la similitud en el tiempo de elución con el péptido no modificado. En nuestras manos, los productos de oxidación de péptidos se eluen entre 240 segundos antes y 180 segundos después del péptido no modificado utilizando el gradiente LC anterior. Como la oxidación a menudo dará lugar a múltiples productos de oxidación isomérica, es común observar múltiples picos parcialmente resueltos en los cromatogramas iónicos extraídos de productos de oxidación de péptidos, como se muestra en la Figura 4. Los productos de oxidación de péptidos se cuantifican en función del área de los picos en los cromatogramas iónicos extraídos.
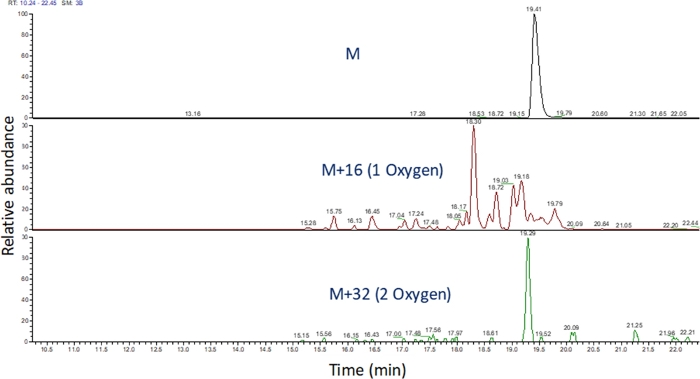
Figura 4: Cromatograma iónico extraído de un péptido y sus productos de oxidación después de FPOP. La m/z de los productos de oxidación de péptidos se calcula sobre la base de la m/z del péptido no oxidado y los productos de oxidación conocidos; y se determinan las áreas de estos productos peptídicos. El área de los productos peptídicos se utiliza entonces para el cálculo de los eventos de oxidación promedio por péptido. Haga clic aquí para ver una versión más grande de esta figura.
- Calcular la oxidación media de los péptidos utilizando la siguiente ecuación.
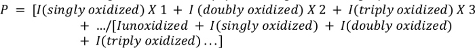
donde P denota el número promedio de eventos de oxidación por molécula de péptido, y yo representa el área pico del péptido nooxidado (Iunoxidized)y el péptido con n eventos de oxidación. Tenga en cuenta que yo(singly oxidaized) incluiría no sólo adiciones de un solo átomo de oxígeno, sino también otros eventos de oxidación individual menos comunes que el investigador puede elegir medir (por ejemplo, descarboxilación oxidativa, formación de carbonilo, etc.) 4,26,27,28,29.
Resultados
La comparación de la huella de péptido de cadena pesada del adalimumab biosimilar en tampón de fosfato y cuando se calienta a 55 oC durante 1 h muestra resultados interesantes. La prueba t del estudiante se utiliza para la identificación de péptidos que se cambian significativamente en estas dos condiciones (p ≤ 0,05). Los péptidos 20-38, 99-125, 215-222, 223-252, 260-278, 376-413 y 414-420 muestran una protección significativa contra el disolvente cuando la proteína se calienta para formar agregados (
Discusión
Las técnicas estructurales basadas en espectrometría de masas, incluyendo el intercambio de hidrógeno-deuterio, la reticulación química, el etiquetado covalente y la espectrometría de masas de pulverización nativa y la movilidad de iones han crecido rápidamente en popularidad debido a su flexibilidad, sensibilidad y capacidad para manejar mezclas complejas. FPOP cuenta con varias ventajas que han aumentado su popularidad en el área de técnicas estructurales basadas en espectrometría de masas. Al igual que la m...
Divulgaciones
Joshua S. Sharp revela un interés financiero significativo en GenNext Technologies, Inc., una pequeña empresa que busca comercializar tecnologías para el análisis de la estructura de mayor orden de proteínas, incluyendo la huella de proteínas de radicales hidroxilo.
Agradecimientos
Reconocemos la financiación de investigación del Instituto Nacional de Ciencias Médicas Generales subvención R43GM125420-01 para apoyar el desarrollo comercial de un dispositivo FPOP de sobremesa y R01GM127267 para el desarrollo de protocolos de estandarización y dosimetría para FPOP de alta energía.
Materiales
| Name | Company | Catalog Number | Comments |
| Adenine | Acros Organics | 147440250 | Soluble in water upto 3.5 mM |
| Aperture | Edmund Optics | 39-905 | 1000 μm Aperture Diameter, Gold-Plated Copper Aperture |
| Aperture holder | Edmund Optics | 53-287 | 25.8mm Outer Diameter, Precision Pinhole Mount |
| Catalse | Sigma Aldrich | C-40 | Catalase from bovine liver, lyophilized powder, ≥10,000 units/mg protein |
| COMPex Pro laser | Coherent | 1113836 | COMPexPRO 102, F-Vversion, KrF laser, No XeCl |
| Dithiotheitol (DTT) | Promega | V3151 | DTT, Molecular Grade (DL-Dithiothreitol) |
| Fraction collector | GenNext Technologies, Inc. | N/A | Automated fraction collector |
| Fused silica capillay | Molex | 1068150023 | Polymicro Flexible Fused Silica Capillary Tubing, Inner Diameter 100 µm, Outer Diameter 375 µm, TSP100375 |
| Glutamine | Acros Organics | 119951000 | L(+)-Glutamine, 99% |
| Holder for lens | Edmund Optics | 03-668 | 53 mm Outer Diameter, Three-Screw Adjustable Ring Mount |
| Hydrogen peroxide | Fisher Scientific | H325-100 | Hydrogen Peroxide, 30% (Certified ACS), Fisher Chemical |
| LC-MS/MS system | Thermo Scientific | IQLAAEGAAPFADBMBCX | Dionex Ultimate 3000 coupled to Orbitap Fusion Tribrid mass spectrometer |
| Mas spec grade Acetonitrile | Fisher Scientific | A955-1 | Acetonitrile, Optima LC/MS Grade, Fisher Chemical |
| Mass spec grade formic acid | Fisher Scientific | A117-50 | Formic Acid, 99.0+%, Optima™ LC/MS Grade, Fisher Chemical |
| Mass spec grade water | Fisher Scientific | W6-4 | Water, Optima LC/MS Grade, Fisher Chemical |
| MES buffer | Sigma Aldrich | M0164 | MES hemisodium salt |
| Methionine amide | Bachem | 4000594.0005 | H-met-NH2.HCl |
| Micro V clamp | Thor Labs | VK250 | Micro V-clamp with stainless steel blades |
| Motorized stage | Edmund Optics | 68-638 | 50mm Travel Motorized Stage System with Manual Control |
| Nano C18 colum | Thermo Scientific | 164534 | Acclaim PepMap 100 C18 HPLC Columns |
| Optical bench | Edmund Optics | 56-935 | 18" x 18" breadboard |
| Pioneer FPOP Module System | GenNext Technologies, Inc. | N/A | Inline FPOP Radical Dosimetry System |
| Post holder | Edmund Optics | 58-979 | 3" Length, ¼-20 Thread, Post Holder |
| Sodium phosphate dibasic | Fisher Scientific | BP331-500 | Sodium Phosphate Dibasic Heptahydrate (Colorless-to-White Crystals), Fisher BioReagents |
| Sodium phosphate monobasic | Fisher Scientific | BP330-500 | Sodium Phosphate Monobasic Monohydrate (Colorless-to-white Crystals), Fisher BioReagents |
| Syringe | Hamilton | 81065 | 100 µL, Model 1710 RN SYR, Small Removable NDL, 22s ga, 2 in, point style 3 |
| Syringe pump | KD Scientific | 788101 | Legato 101 syringe pump |
| Trap C18 column | Thermo Scientific | 160454 | Thermo Scientific Acclaim PepMap 100 C18 HPLC Columns |
| Tris | Sigma Aldrich | 252859 | Tris(hydroxymethyl)aminomethane |
| Trypsin | Promega | V5111 | Sequencing Grade Modified Trypsin |
| UV plano convex lens | Edmund Optics | 84-285 | 30 mm Dia. x 120 mm FL Uncoated, UV Plano-Convex Lens |
Referencias
- Kaur, P., Kiselar, J., Yang, S., Chance, M. R. Quantitative protein topography analysis and high-resolution structure prediction using hydroxyl radical labeling and tandem-ion mass spectrometry (MS). Molecular & Cellular Proteomics. 14 (4), 1159-1168 (2015).
- Hambly, D. M., Gross, M. L. Laser flash photolysis of hydrogen peroxide to oxidize protein solvent-accessible residues on the microsecond timescale. Journal of the American Society for Mass Spectrometry. 16 (12), 2057-2063 (2005).
- Buxton, G. V., Greenstock, C. L., Helman, W. P., Ross, A. B. Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (·OH/·O- in Aqueous Solution. Journal of Physical and Chemical Reference Data. 17 (2), 513 (1988).
- Xu, G., Chance, M. R. Radiolytic modification and reactivity of amino acid residues serving as structural probes for protein footprinting. Analytical Chemistry. 77 (14), 4549-4555 (2005).
- Sharp, J. S., Tomer, K. B. Effects of anion proximity in peptide primary sequence on the rate and mechanism of leucine oxidation. Analytical Chemistry. 78 (14), 4885-4893 (2006).
- Huang, W., Ravikumar, K. M., Chance, M. R., Yang, S. Quantitative mapping of protein structure by hydroxyl radical footprinting-mediated structural mass spectrometry: a protection factor analysis. Biophysical Journal. 108 (1), 107-115 (2015).
- Xie, B., Sood, A., Woods, R. J., Sharp, J. S. Quantitative protein topography measurements by high resolution hydroxyl radical protein footprinting enable accurate molecular model selection. Scientific Reports. 7 (1), 4552 (2017).
- Li, Z., et al. High structural resolution hydroxyl radical protein footprinting reveals an extended Robo1-heparin binding interface. Journal of Biological Chemistry. 290 (17), 10729-10740 (2015).
- Li, X., et al. Structural analysis of the glycosylated intact HIV-1 gp120-b12 antibody complex using hydroxyl radical protein footprinting. Biochemistry. 56 (7), 957-970 (2017).
- Li, K. S., Shi, L., Gross, M. L. Mass spectrometry-based fast photochemical oxidation of proteins (FPOP) for higher order structure characterization. Accounts of Chemical Research. 51 (3), 736-744 (2018).
- Li, J., Chen, G. The use of fast photochemical oxidation of proteins coupled with mass spectrometry in protein therapeutics discovery and development. Drug Discovery Today. 24 (3), 829-834 (2019).
- Roush, A. E., Riaz, M., Misra, S. K., Weinberger, S. R., Sharp, J. S. Intrinsic buffer hydroxyl radical dosimetry using Tris(hydroxymethyl)aminomethane. Journal of the American Society for Mass Spectrometry. 31 (2), 169-172 (2020).
- Xie, B., Sharp, J. S. Hydroxyl radical dosimetry for high flux hydroxyl radical protein footprinting applications using a simple optical detection method. Analytical Chemistry. 87 (21), 10719-10723 (2015).
- Niu, B., Zhang, H., Giblin, D., Rempel, D. L., Gross, M. L. Dosimetry determines the initial OH radical concentration in fast photochemical oxidation of proteins (FPOP). Journal of the American Society for Mass Spectrometry. 26 (5), 843-846 (2015).
- Niu, B., et al. Incorporation of a reporter peptide in FPOP compensates for adventitious scavengers and permits time-dependent measurements. Journal of the American Society for Mass Spectrometry. 28 (2), 389-392 (2017).
- Garcia, N. K., Sreedhara, A., Deperalta, G., Wecksler, A. T. Optimizing hydroxyl radical footprinting analysis of biotherapeutics using internal standard dosimetry. Journal of the American Society for Mass Spectrometry. 31 (7), 1563-1571 (2020).
- Sharp, J. S., Misra, S. K., Persoff, J. J., Egan, R. W., Weinberger, S. R. Real time normalization of fast photochemical oxidation of proteins experiments by inline adenine radical dosimetry. Analytical Chemistry. 90 (21), 12625-12630 (2018).
- Zhang, B., Cheng, M., Rempel, D., Gross, M. L. Implementing fast photochemical oxidation of proteins (FPOP) as a footprinting approach to solve diverse problems in structural biology. Methods. 144, 94-103 (2018).
- Konermann, L., Stocks, B. B., Czarny, T. Laminar flow effects during laser-induced oxidative labeling for protein structural studies by mass spectrometry. Analytical Chemistry. 82 (15), 6667-6674 (2010).
- Gau, B. C., Sharp, J. S., Rempel, D. L., Gross, M. L. Fast photochemical oxidation of protein footprints faster than protein unfolding. Analytical Chemistry. 81 (16), 6563-6571 (2009).
- Li, K. S., et al. Hydrogen-Deuterium exchange and hydroxyl radical footprinting for mapping hydrophobic interactions of human bromodomain with a small molecule Inhibitor. Journal of the American Society for Mass Spectrometry. 30 (12), 2795-2804 (2019).
- Espino, J. A., Jones, L. M. Illuminating biological interactions with in vivo protein footprinting. Analytical Chemistry. 91 (10), 6577-6584 (2019).
- Charvatova, O., et al. Quantifying protein interface footprinting by hydroxyl radical oxidation and molecular dynamics simulation: application to galectin-1. Journal of the American Society for Mass Spectrometry. 19 (11), 1692-1705 (2008).
- Gau, B., Garai, K., Frieden, C., Gross, M. L. Mass spectrometry-based protein footprinting characterizes the structures of oligomeric apolipoprotein E2, E3, and E4. Biochemistry. 50 (38), 8117-8126 (2011).
- Gau, B. C., Chen, J., Gross, M. L. Fast photochemical oxidation of proteins for comparing solvent-accessibility changes accompanying protein folding: Data processing and application to barstar. Biochimica et Biophysica Acta. 1834 (6), 1230-1238 (2013).
- Garrison, W. M. Reaction mechanisms in the radiolysis of peptides, polypeptides, and proteins. Chemical Reviews. 87 (2), 381-398 (1987).
- Xu, G., Chance, M. R. Radiolytic modification of sulfur-containing amino acid residues in model peptides: fundamental studies for protein footprinting. Analytical Chemistry. 77 (8), 2437-2449 (2005).
- Xu, G., Chance, M. R. Radiolytic modification of acidic amino acid residues in peptides: probes for examining protein-protein interactions. Analytical Chemistry. 76 (5), 1213-1221 (2004).
- Xu, G., Takamoto, K., Chance, M. R. Radiolytic modification of basic amino acid residues in peptides: probes for examining protein-protein interactions. Analytical Chemistry. 75 (24), 6995-7007 (2003).
- Misra, S. K., Orlando, R., Weinberger, S. R., Sharp, J. S. Compensated hydroxyl radical protein footprinting measures buffer and excipient effects on conformation and aggregation in an adalimumab biosimilar. AAPS Journal. 21 (5), 87 (2019).
- Simmons, D. A., Konermann, L. Characterization of transient protein folding intermediates during myoglobin reconstitution by time-resolved electrospray mass spectrometry with on-line isotopic pulse labeling. Biochemistry. 41 (6), 1906-1914 (2002).
- Vahidi, S., Konermann, L. Probing the time scale of FPOP (fast photochemical oxidation of proteins): radical reactions extend over tens of milliseconds. Journal of the American Society for Mass Spectrometry. 27 (7), 1156-1164 (2016).
- Chance, M. R. Unfolding of apomyoglobin examined by synchrotron footprinting. Biochemical and Biophysical Research Communications. 287 (3), 614-621 (2001).
- Xu, G., Chance, M. R. Hydroxyl radical-mediated modification of proteins as probes for structural proteomics. Chemical Reviews. 107 (8), 3514-3543 (2007).
- Zhang, Y., Rempel, D. L., Zhang, H., Gross, M. L. An improved fast photochemical oxidation of proteins (FPOP) platform for protein therapeutics. Journal of the American Society for Mass Spectrometry. 26 (3), 526-529 (2015).
- Cornwell, O., Radford, S. E., Ashcroft, A. E., Ault, J. R. Comparing hydrogen deuterium exchange and fast photochemical oxidation of proteins: a structural characterisation of wild-type and ΔN6 β(2)-microglobulin. Journal of the American Society for Mass Spectrometry. 29 (2), 2413-2426 (2018).
- Xie, B., Sharp, J. S. Relative Quantification of sites of peptide and protein modification using size exclusion chromatography coupled with electron transfer dissociation. Journal of the American Society for Mass Spectrometry. 27 (8), 1322-1327 (2016).
- Srikanth, R., Wilson, J., Vachet, R. W. Correct identification of oxidized histidine residues using electron-transfer dissociation. Journal of Mass Spectrometry. 44 (5), 755-762 (2009).
- Li, X., Li, Z., Xie, B., Sharp, J. S. Improved identification and relative quantification of sites of peptide and protein oxidation for hydroxyl radical footprinting. Journal of the American Society for Mass Spectrometry. 24 (11), 1767-1776 (2013).
- Li, X., Li, Z., Xie, B., Sharp, J. S. Supercharging by m-NBA Improves ETD-Based Quantification of Hydroxyl Radical Protein Footprinting. Journal of the American Society for Mass Spectrometry. 26 (8), 1424-1427 (2015).
- Khaje, N. A., Sharp, J. S. Rapid quantification of peptide oxidation isomers from complex mixtures. Analytical Chemistry. 92 (5), 3834-3843 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados