Method Article
Puesta en marcha del irradiador y dosimetría para la evaluación de los parámetros LQ α y β, esquema de dosificación de radiación y deposición de dosis in vivo
* Estos autores han contribuido por igual
En este artículo
Resumen
La dosimetría de radiación proporciona una técnica para mejorar la precisión de los experimentos preclínicos y garantizar que las dosis de radiación suministradas estén estrechamente relacionadas con los parámetros clínicos. Este protocolo describe los pasos a seguir en cada fase durante los experimentos de radiación preclínica para garantizar un diseño experimental adecuado.
Resumen
La dosimetría de radiación es fundamental en la entrega precisa y reproducibilidad de los esquemas de radiación en modelos preclínicos para una alta relevancia traslacional. Antes de realizar cualquier experimento in vitro o in vivo, se debe evaluar la salida de dosis específica para el irradiador y los diseños experimentales individuales. Utilizando una cámara de ionización, electroómetro y configuración de agua sólida, se puede determinar la salida de dosis de campos anchos en isócenter. Utilizando una configuración similar con películas radiocromáticas en el lugar de la cámara de ionización, también se pueden determinar las tasas de dosis para campos más pequeños a diferentes profundidades. Los ensayos de supervivencia clonogénicos in vitro de las células cancerosas en respuesta al tratamiento con radiación son experimentos baratos que proporcionan una medida de la radiosensibilidad inherente de las líneas celulares mediante la adaptación de estos datos con el modelo lineal-cuadrático tradicional. Los parámetros del modelo estimados a partir de estos ensayos, combinados con los principios de las dosis efectivas biológicas, permiten desarrollar diferentes calendarios de fraccionamientos para el tratamiento de radiación que proporcionan dosis efectivas equivalentes en experimentos con animales portadores de tumores. Este es un factor importante a considerar y corregir para comparar los horarios de radioterapia in vivo para eliminar la posible confusión de resultados debido a la varianza en las dosis efectivas entregadas. En conjunto, este artículo proporciona un método general para la verificación de la salida de dosis irradiadores preclínicos de animales y gabinetes, evaluación in vitro de la radiosensibilidad y verificación de la administración de radiación en pequeños organismos vivos.
Introducción
Los cánceres representan colectivamente la segunda causa de muerte en los Estados Unidos y en muchos países del mundo1. La radioterapia es una piedra angular del tratamiento para muchos subtipos tumorales y se administra a aproximadamente la mitad de todos los pacientes con cáncer2,3. Los resultados de los pacientes para casi todos los cánceres han mejorado con el tiempo, ya que el equipo utilizado para suministrar dosis de radiación ha avanzado constantemente y se desarrollaron algunos enfoques eficaces de terapia multimodal4,5,6,pero las tasas de recurrencia y mortalidad para pacientes con ciertos tipos de tumores siguen siendo altas7,8,9. Así, la radioterapia para el cáncer sigue siendo un área activa de investigación básica y clínica. Muchos estudios de radioterapia preclínica emplean el uso de irradiadores a pequeña escala para suministrar dosis de radiación a modelos in vitro o animales de cánceres. Con una multitud de experimentos potenciales para llevar a cabo la exploración de detalles radiobiología mecanicistas o tratamientos novedosos, se pueden encontrar escollos comunes que conducen a conclusiones incorrectas, mala reproducibilidad y recursos desperdiciados. Estos escollos se encuentran dentro de tres áreas importantes: dosimetría del irradiador, caracterización in vitro de las líneas celulares modelo, y programación y configuración de dosificación de irradiación in vivo. Los resultados precisos y reproducibles de experimentos más avanzados son difíciles de lograr sin atención previa a estos aspectos fundamentales de la investigación de radioterapia.
El protocolo aquí detallado describe una estrategia generalizada para evitar o mitigar estas cuestiones y se basa en varias metodologías previamente desarrolladas destinadas a uso independiente. Estos métodos distintos se han fusionado para que un investigador interesado en comenzar o mejorar los experimentos de radioterapia preclínica pueda utilizar esto como un diseño experimental robusto. El marco sugerido incluye metodología para la puesta en marcha de irradiadores animales a pequeña escala, para determinar las propiedades radiobiológicas básicas de las líneas celulares cancerosas modelo, y para diseñar y administrar adecuadamente un calendario de dosificación y fraccionamiento para modelos tumorales in vivo.
Protocolo
Cualquier medida de este protocolo que implique el uso de animales de laboratorio, incluyendo manejo y procedimientos, fue aprobada por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Virginia Occidental en Morgantown, Virginia Occidental (Número de protocolo: 1604001894).
1. Determinación de la salida de dosis
- Utilice este protocolo, basado en el protocolo "Método In-phantom" de la Asociación Americana de Físicos en El Grupo de Tareas de Medicina (AAPM TG) 6110 y similar al protocolo de puesta en marcha establecido por Xstrahl, para determinar la salida del haz del irradiador animal pequeño con respecto a la geometría particular en las siguientes condiciones de configuración.
- Ajuste el irradiador para suministrar radiación a 220 kVp y 13 mA, con un campo abierto (17 cm por 17 cm) situado en isócono, o a 35 cm de la fuente. Además, filtre la viga con un filtro Cu de 0,15 mm con un enfoque amplio. Algunos irradiadores celulares contienen sólo una fuente radiactiva, este protocolo sólo se puede utilizar para irradiadores de rayos X.
- Alinee los fantasmas de agua maciza en el siguiente orden: losa de 1 cm, losa de 2 cm con ranura de cámara de ionización, losa de 2 cm, losa de 1 cm. El apilamiento de los fantasmas de agua sólida en este orden coloca la cámara de ionización a una profundidad de 2 cm, lo que permite 4 cm también para el backscatter. Consulte la Figura 1 para obtener una representación gráfica de la configuración de dosimetría.
NOTA: Para acomodar la pila grande y bastante pesada de agua sólida, los autores recomiendan la adquisición de un sofá impreso 3D personalizado con soporte variable para garantizar que la pila fantasma esté nivelada y a la distancia correcta de la fuente a través de la superficie del material, no sólo en el centro.
- Utilice el equipo de medición (es decir, la cámara de ionización calibrada ADCL, el electrometro) y una explicación de los factores de corrección utilizados se pueden encontrar en la Tabla de Materiales y la Tabla 1 respectivamente.
NOTA: Que el ADCL proporciona valores de Nk en un par de puntos para diferentes capas de medio valor (HVL, medida de la calidad del haz). El valor de Nk que se utilizará en el protocolo debe basarse en una interpolación de los valores ADCL para el HVL medido de la unidad. El fabricante midió el HVL de nuestra unidad y lo usamos en nuestra determinación de salida de velocidad de dosis. - Configure la pila fantasma e inserte la cámara de ionización en el fantasma como se especifica en el paso 1.1.2.
- Ajuste la pila fantasma de tal manera que la distancia de origen a superficie (SSD), o la distancia desde la fuente de radiación a la primera superficie, sea de 33 cm cuando esté adecuadamente nivelada.
NOTA: Los autores sugieren crear un sofá impreso en 3D personalizado, lo suficientemente grande como para soportar las dimensiones de las losas de agua sólida. Además, el utilizado en este protocolo tiene un componente ajustable para nivelar la pila fantasma.
- Ajuste la pila fantasma de tal manera que la distancia de origen a superficie (SSD), o la distancia desde la fuente de radiación a la primera superficie, sea de 33 cm cuando esté adecuadamente nivelada.
- Tome el promedio de tres exposiciones separadas de rayos X, lecturas de un minuto con el voltaje de sesgo del electrometro establecido en 300 V. El resultado se denominará M+.
NOTA: Las irradiaciones se realizan con el conjunto de instrumentos para suministrar radiación a 220 kVp y 13 mA. Esto es lo mismo para los dos pasos siguientes (pasos 1.5-1.6). Para la seguridad del usuario, asegúrese de que las puertas permanezcan cerradas durante los tratamientos. - Realice otro conjunto de tres exposiciones de rayos X separadas, lecturas de 1 min con el voltaje de sesgo del electrometro establecido en -150 V. El resultado se denominará ML.
- Realice otro conjunto de tres exposiciones de rayos X separadas, lecturas de 1 min con el voltaje de sesgo del electrometro establecido en -300 V. El resultado se denominará MH, o también M-.
- Calcule Ppol y Pion usando la Ecuación 1 y la Ecuación 2 respectivamente como se describe a continuación:
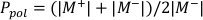 (Ecuación 1)
(Ecuación 1)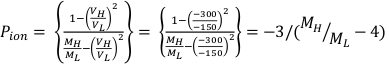 (Ecuación 2)
(Ecuación 2) - Mida la temperatura, en Celsius, y la presión, en kPa, dentro del irradiador usando un termómetro digital calibrado y barómetro. A continuación, calcule PTP como se indica a continuación en la ecuación 3.
NOTA: Este cálculo supone que el ADCL utilizó valores estándar de temperatura y presión de 22 °C y 101,33 kPa al indicar su valor para el factor de calibración del kerma de aire.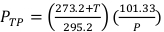 (Ecuación 3)
(Ecuación 3) - Calcular la lectura de la cámara corregida, M, multiplicando la lectura de la cámara cruda, MH, por Pelec,Ppol,Piony PTP. Esta ecuación se puede encontrar a continuación en la Ecuación 4.
NOTA: Este cálculo asume que el ADCL realizó su calibración con la tensión de sesgo establecida en -300V, que es una práctica bastante común.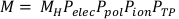 (Ecuación 4).
(Ecuación 4). - Multiplique aún más la lectura de la cámara corregida por Nk, [(μen/p)wair]water, PQ, chamy Psheath. Lavaina P sólo es necesaria para las mediciones obtenidas en agua. Por lo tanto, para este protocolo Psheath es sólo 1.
NOTA: Utilizando las condiciones de este protocolo, estos tres últimos elementos dan un valor de 1,0731. Este valor depende de la calidad del haz, por lo que el HVL debe ser conocido para determinarlo. El valor de 1.0731 es específico de nuestra unidad y se da como ejemplo. Para determinar los valores de PQ, cham y [(μen/p)wair]agua específica de su unidad, utilice el HVL medido e interpole desde la Tabla VIIy la Tabla VIII, y corrija para el tamaño del campo de referencia según la Figura 3 y la Figura 4 del protocolo AAPM TG6110. En nuestro caso, multiplicar Nk por 1.0731 proporciona la dosis al agua, Dw, en Gy durante un tiempo nominal de 1 min, suponiendo que el valor de ADCL Nk se da en Gy/Coulumbs. - Determine el efecto final del irradiador que se está utilizando. Cuando se generan los rayos X por primera vez, la salida alcanza su valor total durante algún tiempo finito. Del mismo modo, cuando la fuente de rayos X está apagada, la salida disminuye a cero durante algún tiempo finito.
- Tener en cuenta el tiempo de esta transición o el efecto final. Esto se puede hacer tomando el promedio de tres lecturas con el voltaje de sesgo del electrometro establecido en -300 V, para una variedad de ajustes de tiempo. Haga esto durante 6, 12, 18, 24, 30 y 60 segundos.
- Trace las lecturas del electrometro contra el tiempo y encuentre la mejor línea recta. El tiempo total, t, para un tratamiento de 1 minuto se puede calcular mediante la ecuación 5:
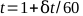 (Ecuación 5).
(Ecuación 5).
- Calcular la velocidad de dosis de un irradiador dado por la ecuación 6:
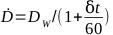 (Ecuación 6)
(Ecuación 6)
2. Creación de una curva de calibración de película radiocromática
- Para obtener una lista de los materiales necesarios, consulte Tabla de materiales.
- Usando una configuración casi idéntica como el protocolo anterior, coloque la película a una profundidad de 2 cm en la pila fantasma de agua sólida. El orden de los fantasmas de agua sólida es insignificante siempre y cuando haya 2 cm de agua sólida por encima y 4 cm de agua sólida por debajo para efectos de acumulación y backscatter.
- Utilizando la dosis determinada encargada en el protocolo 1, determine los tiempos de tratamiento de las dosis enumeradas en el Cuadro 2 utilizando la ecuación 7:
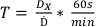 (Ecuación 7)
(Ecuación 7) - Preparar varias piezas de película asegurando que cada película es del mismo tamaño y permanece en la misma orientación desde el tratamiento hasta la adquisición de escaneos. Esto se puede hacer colocando un pequeño corte diagonal en la esquina inferior izquierda. Cada película a partir de este momento debe ser del mismo lote de película.
NOTA: Preparar 3 réplicas separadas para cada punto de dosis a evaluar. - Escanee las piezas cortadas con un escáner fotográfico a color de 48 bits con todas las correcciones desactivadas. Asegúrese de que cada película se coloca en el centro exacto de la cama de escaneo. Los valores obtenidos son los escaneos de preexposición utilizados para determinar la densidad óptica no expuesta11,12. Guarde todas las imágenes en el archivo . Tiff formato de archivo para evitar la compresión de datos clave.
NOTA: Los autores recomiendan escanear las películas tres veces y utilizar el promedio obtenido como valor único para una película determinada. - Comience la irradiación de las películas colocando una pieza de película encima de 4 cm de agua sólida y colocando los 2 cm restantes de agua sólida arriba, como se describió anteriormente en esta sección.
- Ajuste el conjunto fantasma para que la película esté a la misma distancia de la fuente que la cámara de ionización al determinar la salida de la dosis. Este es el punto isocéntrico del irradiador.
- Programe el tiempo de tratamiento calculado en el paso 2.3 anterior para una dosis prescrita.
- Repita el tratamiento para cada una de las dosis enumeradas en la Tabla 2.
- Permita que las películas descansen durante 24 horas protegidas de la luz.
- Adquiera los escaneos de película posteriores a la exposición de la misma manera que lo anterior.
- Importe imágenes al software de análisis ImageJ y realice todas las mediciones en el canal rojo.
- Arrastre la imagen en . Formato de archivo Tiff en ImageJ.
- Haga clic en el menú desplegable Imagen. Seleccione Color en el menú desplegable Imagen. Seleccione canales divididos en la opción Color.
- Usando solo el canal de imagen rojo, dibuje una región de interés usando la herramienta rectángulo. Pulse Ctrl+M. Transcriba el valor medio desde la ventana de resultados.
- Repita los pasos 2.12.1-2.12.4 para todas las películas escaneadas.
- Obtenga el valor de píxel en un cuadrado de 1 cm por 1 cm situado centralmente para las películas no expuestas y expuestas. Estos valores se denotan como PVU(D) y PV(D) respectivamente, y se pueden utilizar para calcular la densidad óptica neta como se describe en la ecuación 8.
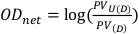 (Ecuación 8) 13
(Ecuación 8) 13
- Repita el paso 2.13 para cada par de imágenes de película, tanto antes de la exposición como después de la exposición.
- Trace un gráfico de la dosis frente a la densidad óptica neta y ajuste la curva a un polinomio cúbico en el formato de y = ax3 + bx2 + cx + d. Un ejemplo se puede encontrar en la figura 2B.
3. Determinación del valor α/β para líneas celulares específicas contra el cáncer a través de ensayos clonogénicos
NOTA: El siguiente protocolo es una versión modificada de los métodos descritos por Franken et al14 y se puede ver en la Figura 3.
- Cultivar células a ~80% de confluencia. Evite el uso de fuentes de células excesivamente confluentes para este experimento, ya que es necesario que las células estén en la fase de registro del crecimiento celular. Para los resultados representativos del ensayo clonógeno mostrados en la Figura 3C,las células de cáncer de mama MDA-MB-231 del trópico cerebral fueron cultivadas en el Medio Águila Modificado (DMEM) de Dulbecco complementado con 10% suero bovino fetal y penicilina/estreptomicina y fueron incubados a 37 °C y 5% dióxido de carbono en una incubadora humidificada.
- Sembrar las células a la densidad deseada para el ensayo de colonia. Las diluciones precisas durante la siembra son cruciales para determinar la eficiencia de chapado del ensayo. Asegúrese de chapar varias réplicas.
- Continúe con este paso si el tratamiento con radiación precederá al revestimiento celular (Figura 3A). Alternativamente, proceda al paso 3.4 si el revestimiento celular precederá al tratamiento de radiación.
- Realice el tratamiento de radiación deseado en frascos de cultivo. Cualquier tratamiento adicional (es decir, tratamientos farmacológicos) se puede realizar en cualquier momento antes o después de esto. Para los resultados representativos en la Figura 3C,el tratamiento de radiación se produjo después de las células de chapado, detalladas en el paso 3.4.
- Extraiga las celdas utilizando el método de trypsinización preferido y cree una sola suspensión de celda. Retire los medios de cultivo y agregue la enzima recombinante (por ejemplo, TrypLE Express) para separar las células del matraz. Incubar células con la enzima durante aproximadamente 3 minutos hasta que las células se separaron como se detectó utilizando un microscopio de luz. Neutralizar la enzima utilizando un volumen igual de medios de cultivo celular. Células centrífugas a 300 x g durante 10 min y resuspend a la concentración deseada en el medio de cultivo.
- Platee las celdas en las densidades deseadas en varias réplicas.
- Sustituir por medios frescos después de las primeras 24 h.
- Continúe reemplazando los medios cada 2-3 días.
- Continúe culturando células hasta que las colonias de control superen las 50 células por colonia, ~9-14 días. Las colonias de control son aquellos grupos de tratamiento que no reciben dosis de radiación. Para experimentos con tratamientos farmacológicos también, otro grupo de control con dosificación de fármacos pero sin radioterapia también será necesario.
- Proceda con este paso al sembrar células antes del tratamiento con radiación ( Figura3B).
- Extraiga las celdas utilizando el método de trypsinization preferido y cree una sola suspensión de celda.
- Coloque las celdas en las densidades deseadas en varias réplicas.
- Permita que las células se adhieran a la placa durante la noche.
- Realice las dosis de radiación deseadas. Se pueden realizar tratamientos adicionales, como la dosificación de fármacos, en cualquier momento antes o después de este paso, siempre y cuando las células se hayan unido a sus placas de tratamiento. Para los resultados representativos en la Figura 3C, 1250 cerebro-trópico MDA-MB-231 células fueron chapadas antes del tratamiento (paso 3.4). Luego, las células fueron tratadas con 15 nM de doxorubicina 3 horas antes de la irradiación con 3 Gy de rayos X.
- Reemplace el soporte después de las 24 h iniciales.
- Reemplace los medios cada 2-3 días.
- Culta las células tratadas hasta que las colonias del grupo de control superen las 50 células, ~9-14 días. Las colonias de control son aquellos grupos de tratamiento que no reciben dosis de radiación. Para experimentos con tratamientos farmacológicos también, otro grupo de control con dosificación de fármacos pero sin radioterapia también será necesario.
- Retire los medios de cultivo de los pozos o platos, y lave con PBS.
- Corrija las células durante 15 minutos en una solución de 1:7 (v:v) de ácido acético glacial y metanol.
- Quite la solución de fijación.
- Después de la fijación, las células de manchas durante 30 minutos, o 2 h si el tiempo está disponible, a temperatura ambiente con una solución de 2,5-5,0 mg/ml de violeta cristalina en una solución de 4:1 (v:v) de agua destilada y metanol.
- Retire la solución de tinción y lave las células en un baño de agua grande y a temperatura ambiente.
NOTA: No lave bajo agua corriente. - Cuente el número resultante de colonias en cada grupo de tratamiento y calcule la fracción de supervivencia de cada plato.
- Trace la fracción de supervivencia contra la dosis correspondiente administrada y ajuste la curva con un ajuste exponencial.
- Para estimar el valor α/β, utilice un ajuste exponencial de la gráfica anterior para estimar los valores de cada uno de los parámetros ajustables en la ecuación lineal-cuadrática que se encuentra a continuación:
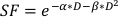 (Ecuación 9)
(Ecuación 9)
NOTA: La irradiación de las células normalmente se puede hacer en el isócono sin ninguna colimación siempre que el tamaño del campo sea lo suficientemente grande como para acomodar platos bien platillos o placas de Petri. Los posibles escollos en este protocolo pueden incluir rendimientos como la no formación de colonias, la migración celular significativa con un crecimiento celular claro pero sin colonias verdaderas, o la contaminación debida al tratamiento en una cámara irradiadora no estéril.
4. Determinación de la salida de dosis específica para diseños experimentales variables
- Decida el tamaño de campo deseado y la distancia de la fuente.
NOTA: La intercalación alterará la velocidad de dosis sin importar el tamaño o la distancia del colimador de la fuente de rayos X. - Usando fantasmas de agua sólida para proporcionar acumulación y backscatter, coloque una pieza de película en la orientación correcta que mejor retrata el diseño experimental.
NOTA: Para cualquier configuración experimental, es posible que el agua sólida no proporcione la representación más precisa de un diseño determinado. En su lugar, recomendamos el uso de los recipientes del experimento real (es decir, placa De Petri, platos acomodos, pequeños fantasmas animales, etc.). - Irradia películas durante 1 (N=3) y 2 (N=3) minutos.
- Permita que las películas descansen durante 24 horas protegidas de la luz.
- Determine la densidad óptica neta de cada una de las películas siguientes a los procedimientos de la Sección 2. Utilice la curva de calibración de película para determinar la dosis a partir de la densidad óptica de la red.
- Determine la dosis a 1 minuto, D1, como la tasa de dosis de salida, Ḋ, para esta configuración experimental definida por la Ecuación 10 de la siguiente manera:
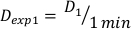 (Ecuación 10)
(Ecuación 10) - Del mismo modo, caluclar la dosis a 2 minutos por la ecuación 11 de la siguiente manera:
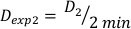 (Ecuación 11)
(Ecuación 11) - Debido al efecto final, la tasa de dosis para los cálculos anteriores puede ser ligeramente diferente. Por esta razón para calcular Dexp para el diseño experimental deseado, utilice un promedio del Dexp individual como se indica en la ecuación 12:
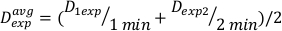 (Ecuación 12)
(Ecuación 12) - Utilizando este promedio, defina el tiempo para el tratamiento de cualquier dosis deseada para esta configuración en particular en la Ecuación 13:
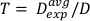 (Ecuación 13)
(Ecuación 13)
5. Tratamiento de ratones con tumores en lugares anatómicos de interés
- Ratón anestesiado con técnicas de anestesia seguras y humanas aprobadas por el IACUC de la institución.
- Coloque el animal anestesiado en contención como se indica en el diseño experimental deseado.
- Este paso es opcional, si no está disponible, continúe con el paso 5.6. Obtener un radiograma, utilizando una cámara portal a bordo, del ratón sin intercalación utilizando un filtro de aluminio.
- Obtenga un segundo radiograma con la intercalación en su lugar.
- Superponga los radiogramas en ImageJ para demostrar el posicionamiento del haz.
- Utilizando el valor predeterminado α/β, determinar el esquema de dosis que proporciona el enfoque más razonable para responder a una pregunta de investigación (es decir, si desea modelar los efectos de una dosis de 30Gy entregado en 10 fracciones de 3 Gy, pero sólo desea dar cuatro fracciones). Usando la ecuación 14, con un valor de α/β asumido de 10 (este valor se puede determinar para líneas celulares cancerosas individuales en el protocolo 3)y un BED similar al de 30 Gy/10 F, tratar con 24 Gy en 4 fracciones de 6 Gy.
- Tratar animal durante el tiempo prescrito dado para la dosis deseada.
6. Confirmación histológica de la deposición de dosis in vivo
- Siguiendo el protocolo 5, recoger tejido de interés dentro de las 1 hora del tratamiento15,16. Después de la cosecha de tejidos, continúe con el protocolo de inmunohistoquímica preferido. A continuación se muestra un ejemplo.
- Animal perfusible con frío helado 4% paraformaldehído (PFA).
- Post-arreglo en PFA a 4 °C.
- Después de la fijación, fije el tejido secuencialmente en 10%, 20% y 30% sacarosa durante 24 horas cada uno a temperatura ambiente.
- Tejido incrustado en gelatina y fija secuencialmente en 4% PFA y de nuevo en 10-30% sacarosa durante 24 horas cada uno a temperatura ambiente.
- Recorte el bloque y colóquelo a -80 °C durante 30 minutos.
- Corte el tejido en secciones de 20-30 μm.
- Inmunostain se desliza como secciones flotantes libres en un seis bien placa17,18.
- Lavar tres veces y permeabilizar durante 30 minutos en una coctelera con 1,83% lisina en 1% Tritón, y 4% suero de cabra inactivado por calor.
- Incuba secciones con anticuerpos anti-ḥH2AX durante 24 horas, seguido de una incubación de 2 horas con anticuerpo secundario deseado.
- Portaobjetos con tapas de vidrio utilizando los medios de montaje preferidos.
- Imagen en un microscopio fluorescente.
Resultados
Siguiendo el protocolo 1 proporcionará una tasa de dosis en Gy/min, que es específica del irradiador que se está utilizando. Sin embargo, independientemente del tipo de irradiador, con una tasa de dosis conocida se puede generar una curva de calibración utilizando el protocolo 2 que produce películas similares y una curva de calibración similar a la de la Figura 2A-B. Un ensayo exitoso del protocolo 3 producirá colonias distintas y bien demarcadas de células que manchan homogéneamente violeta. La estimación de α/β se puede comparar con valores literarios u otros grupos de tratamiento para interpretar la sensibilidad radioeléctosa de la línea celular dada. Utilizando la curva de calibración desarrollada siguiendo el protocolo 2 y mostrada en la Figura 2B,el protocolo 4 producirá dos muestras de película similares a la Figura 2A que se pueden utilizar para estimar los tiempos de irradiación experimental requeridos. Si hay una cámara de imágenes del portal a bordo disponible para el irradiador que se está utilizando, se pueden obtener radiogramas de animales pequeños con y sin colimación. La superposición de estas imágenes demostrará el posicionamiento exacto del haz de radiación colimado en relación con el animal pequeño que se trata como se muestra en la Figura 4A. La correcta deposición de dosis en el protocolo 5 se puede confirmar siguiendo el protocolo 6. Una indicación de que la radiación se está depositando en un sistema in vivo o in vitro es mediante la detección de roturas de ADN de doble cadena. Ilustrado en la Figura 4B, el mismo ratón tratado únicamente a través del hemisferio derecho en la Figura 4A, muestra la tinción positiva ḥH2AX sólo en el hemisferio tratado. En esta figura, los núcleos están manchados con DAPI para mostrar dos cosas; 1) el conjunto son del cerebro al que se aplicó el anticuerpo antiH2AX durante el análisis histológico, y 2) el hemisferio no tratado del cerebro permanece sin manchar.
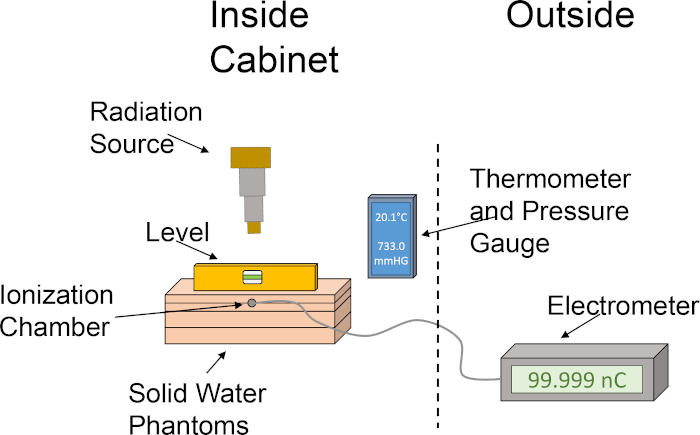
Figura 1: Configuración aproximada de la cámara de ionización y el fantasma del agua configurados para la determinación de la salida de dosis. El pictograma ilustra una configuración básica utilizando los diversos componentes necesarios para la dosimetría utilizando una cámara de ionización y fantasmas de agua sólida dentro del gabinete del irradiador. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Generación de una curva de calibración utilizando película radiocromática. (A) Cambio de color representativo de la película radiocromática con dosis crecientes. Parte superior izquierda (0 cGy); parte inferior derecha (2000 cGy). (B) Curva potencial de calibración de película radiocromática comparando la densidad óptica neta y la dosis. Haga clic aquí para ver una versión más grande de esta figura.
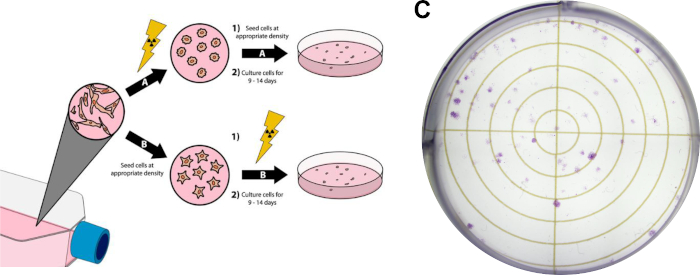
Figura 3: Ensayo clonogénico de células cancerosas. El tratamiento radioerápico de las células se puede realizar antes del chapado en seis placas de pozo /placas de Petri (A), o después (B). En el panel (C), se muestra una imagen representativa de un ensayo clonogénico exitoso con células de cáncer de mama MDA-MB-231 después de seguir la Sección 3 del Protocolo. Haga clic aquí para ver una versión más grande de esta figura.
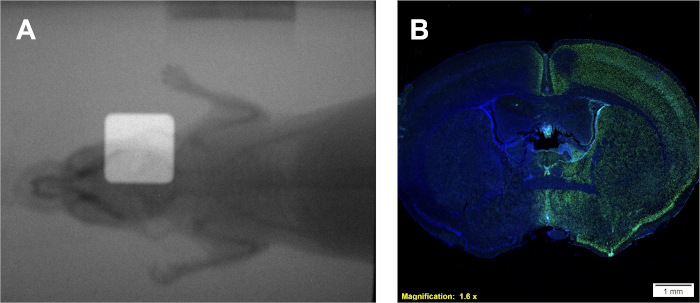
Figura 4: Uso de radiogramas superpuestos duales para posicionamiento (si está disponible) y tinción inmunohistoquímica positiva ḥH2AX para la confirmación de la deposición de dosis. (A) Radiogramas superpuestos representativos que representan la colocación de haz de radiación. B) Resultados representativos que indican la deposición de dosis en el hemisferio derecho, como lo demuestra el aumento de la intensidad ḥH2AX. Haga clic aquí para ver una versión más grande de esta figura.
| Factor de corrección | Explicación | |
| Nκ | Factor de calibración del kerma de aire | |
| [(μen/ρ)Wair] agua | Ración de coeficientes de absorción de energía masiva de agua a aire; aproximadamente 1.05 | |
| Pq, Cham | Corrección de la contabilización del tallo de la cámara que afecta la perterbación de la fluencia fotónica por cámara; aproximadamente 1.022 | |
| Psheath | Corrección que explica la cámara de ionización que protege la eslata; valor de 1, ya que la cámara es impermeable | |
| Ppol | Factor de corrección que explica la polaridad; determinado en el Protocolo 1 | |
| Pion | Factor de corrección que explica la recombinación de iones; determinado en el Protocolo 1 | |
| PTp | Factor de corrección acocunting para temerpature y presión el día del experimento; determinado en el Protocolo 1 | |
Cuadro 1: Factores de corrección necesarios para la determinación de la tasa de dosis en el Protocolo 1.
| Dosis | N |
| 0.5 | 3 |
| 1 | 3 |
| 2 | 3 |
| 3 | 3 |
| 4 | 3 |
| 6 | 3 |
| 8 | 3 |
| 10 | 3 |
| 12* | 3 |
| 15* | 3 |
| 20* | 3 |
| * Sólo es necesario para dosis superiores a 10 para experimentos individuales. | |
Tabla 2: Dosis que se utilizarán en la generación de curva de calibración de película radiocromática.
Discusión
El protocolo anterior describe un enfoque fácil de usar para la dosimetría de radiación, la determinación de los valores de α/β en las líneas celulares cancerosas y un breve ejemplo de un enfoque para la irradiación en un modelo preclínico de metástasis cerebral del cáncer de mama. Estos métodos se pueden utilizar para estudiar cualquier modelo de cáncer y no sólo se limitan a la metástasis cerebral del cáncer de mama. En esta sección discutiremos los entresijos relevantes subyacentes a los experimentos de radioterapia preclínica.
La dosimetría implica dos partes: 1) calibrar la salida con una cámara de agricultor, de modo que se establezca la tasa de dosis de la unidad de rayos X, y 2) preparar un práctico sistema de medición de dosimetría utilizando película radiocromática. Con respecto a la calibración de salida, el TG-61 proporciona un método reproducible en agua. El protocolo aquí utiliza el agua sólida Gammex RMI 457, según lo recomendado por XStrahl, el fabricante del irradiador. Aunque el análisis relativo de dosimetría (perfiles o curvas de dosis de profundidad normalizadas a dosis máximas) con agua sólida, coincide en que mejor que el 1% con el agua, hay una diferencia de aproximadamente 3 a 4% en dosis absolutas debido a un coeficiente de absorción de energía de masa más alto para agua sólida en comparación con el agua. Sin embargo, como todas las instalaciones del sistema XStrahl utilizan el protocolo de agua sólida para la calibración de salida, no corrigimos estas diferencias. Conocer la salida permite calcular el tiempo de exposición necesario para administrar la dosis deseada. Colocar la película en el mismo montaje que la cámara del granjero nos permite entregar dosis conocidas a la película. El escaneo de la película proporciona densidades ópticas. A continuación, la dosis de la película se puede graficar con la densidad óptica neta correspondiente (diferencia en la densidad óptica después y antes de la exposición). Esto produce una curva de calibración de película. Cuando cambiamos las configuraciones experimentales, la tasa de dosis en esa situación podría cambiar, ya que la tasa de dosis depende del tamaño del campo, la profundidad y el material que se está irradiando. Exponer la película con la configuración experimental nos proporciona una densidad óptica neta, y utilizando la curva de calibración de la película, podemos determinar la dosis correspondiente. Dividiendo esta dosis para cuando la película fue irradiada, obtenemos la tasa de dosis. Esta tasa de dosis se puede utilizar para calcular el tiempo de exposición para administrar la dosis deseada para la configuración experimental dada. El protocolo descrito anteriormente maneja varios matices asociados con la dosimetría de película. Por ejemplo, después de la exposición, la película requiere aproximadamente 24 horas para que las reacciones químicas en la capa activa de la película estén prácticamente completas. No esperar a esta cantidad de tiempo conducirá a una menor densidad óptica.
Para cualquier estudio tener dosimetría reproducible es importante conocer y entender varios de los elementos clave de un irradiador dado. En particular, es crucial conocer y detallar a otros investigadores la marca y el modelo del irradiador utilizado, el tipo de fuente (rayos X, radiactivo, etc.), la energía, la capa de medio valor, el tamaño del campo, la fuente a la superficie y la fuente a distancias isóconas, el tamaño del material irradiado, la atenuación antes y el backscatter después del material irradiado, la tasa de dosis específica del experimento, el esquema de fraccionamiento, el equipo exacto de dosimetría utilizado y el protocolo de dosimetría utilizado. Todos estos puntos de información son lo que describe cohesivamente la calidad del haz de un irradiador dado antes de administrar una dosis a cualquier animal o célula19. Otro punto pertinente de información de este protocolo y otros es que la tasa de dosis alcanzada en el Protocolo 1 es simplemente la salida del irradiador que se utiliza. Para cualquier experimento dado es importante definir la velocidad de dosis para esa configuración en particular (Protocolo 4) en comparación con una curva de calibración de película radiocromática generada (Protocolo 2).
La experimentación in vitro proporciona detalles importantes sobre el comportamiento radiobiológico de las líneas celulares cancerosas. Los ensayos in vitro de supervivencia celular clonogénica estiman y cuantifican con precisión la radiosensibilidad inherente de una línea celular20,ayudando en el diseño de horarios de fraccionamiento en experimentos celulares o de animales pequeños posteriores21. En concreto, estos ensayos auguran valores aproximados para los parámetros α y β que se utilizan en el modelo lineal-cuadrático para predecir la muerte celular en respuesta a la radioterapia según la ecuación:
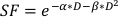 (Ecuación 9)
(Ecuación 9)
donde SF es la fracción sobreviviente de células clonógenamente viables, D es dosis de radiación en Gy, y α y β se ajustan los parámetros22. La relación α/β proporciona una medida inherente de la radiosensibilidad celular, con valores más altos que se correlacionan con una mayor sensibilidad de una línea celular22. Dado que esta relación funcional no es lineal con respecto a la dosis, los efectos biológicos de un esquema de fraccionamiento de radioterapia no sólo están relacionados con la dosis total administrada, sino también con el número y tamaño de las fracciones23. La dosis efectiva biológica (BED) es una medida de la verdadera dosis biológica suministrada a un tejido y permite la comparación directa de diferentes esquemas de fraccionamientos24,25. La ecuación BED solo requiere una estimación de α/β, y se muestra a continuación:
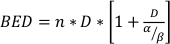 (Ecuación 14)
(Ecuación 14)
donde n es el número de fracciones de la dosis D. Ensayos de supervivencia celular clonogénicos estiman α/β y facilitan la comparación directa de esquemas de fraccionamiento de radioterapia a través de la ecuación BED. Se pueden extraer conclusiones incorrectas con respecto a una respuesta de tejido u órgano a la radioterapia (o combinaciones de radioterapia con otras modalidades) si el BED en los grupos de tratamiento no es equitativo dentro o entre experimentos. Por ejemplo, 2 fracciones de 10 Gy en comparación con 4 fracciones de 5 Gy no producen el mismo BED, y por lo tanto estos esquemas de dosificación no se pueden comparar directamente en términos de respuesta biológica. La ecuación BED, aunque imperfecta debido a limitaciones inherentes en el modelo lineal-cuadrático, estima de forma fiable efectos equitativos para una amplia gama de condiciones de tratamiento experimental24,25.
Los ensayos de supervivencia celular clonogénica claramente juegan un papel importante en el estudio de los efectos de radioterapia en modelos de cáncer, pero la experimentación in vitro ofrece una serie de opciones adicionales para explorar aún más los detalles mecanicistas de la radiobiología de las células cancerosas. Se utilizaron modificaciones simples del ensayo de supervivencia celular clonogénica para determinar los modos de acción de algunas quimioterapias radio-sensibilizantes, como paclitaxel o etoposide26,27. Otras opciones experimentales in vitro incluyen estudios de inmunocitoquímica para examinar vías específicas de reparación celular, como γ-H2AX foci y/o tinción de 53BP1 para reparación de rotura de ADN de doble cadena28. Estos experimentos pueden ser de particular interés al comparar la radioterapia como una sola modalidad con terapias combinadas, especialmente al sondear detalles mecanicistas para una línea celular determinada. Otras opciones experimentales incluyen mediciones de citoquinas para examinar el papel innato de la respuesta inflamatoria de una célula a la irradiación o análisis del modo de muerte celular (es decir, apoptosis, necrosis, catástrofe mitotica, etc.) en diferentes condiciones terapéuticas29,30,31. Este tipo de experimentación puede complementar o reemplazar la experimentación con animales y proporcionar una comprensión más completa de la radiobiología de una línea de células cancerosas. Independientemente de la elección de experimentos adicionales para llevar a cabo, un ensayo estándar de supervivencia celular clonogénico como se describe en el protocolo 3 es una evaluación radiobiológica inicial importante de una línea celular.
Los ensayos clonogénicos y la dosimetría de radiación proporcionan al investigador un medio para planificar con precisión experimentos para parecerse más directamente a escenarios clínicos. Con la adición de modelos de roedores pequeños de cáncer preclínico, es posible estudiar la respuesta a la radiación solo o en el contexto de un plan de tratamiento in vivo. Antes de utilizar animales, es importante determinar la salida de dosis relativa de la configuración específica si difiere de la configuración utilizada para la determinación de la salida de dosis32,33. Cuando se trata de determinar una tasa de dosis para tamaños de campo de <10 mm, el uso de una cámara de ionización se vuelve menos preciso debido a la alineación dentro de un campo pequeño y los efectos de promediación de volumen parcial33. El uso de película radiocromática para determinar la salida en combinación con experimentos inmunohistoquímicos in vivo se ha utilizado para determinar la salida y la deposición de dosis en los últimos16,34,35,36,37,38.
Divulgaciones
Los autores no tienen divulgaciones que hacer.
Agradecimientos
Los autores quieren agradecer al Microscopio y Modelos Animales Imaging Facilites de WVU por el uso de sus equipos apoyados por el número de subvención P20GM103434. Además, este trabajo fue apoyado por el número de subvención P20GM121322 de la Institue Nacional de Ciencias Médicas Generales, por el número de subvención del Instituto Nacional del Cáncer F99CA25376801, y el Fondo de Dotación de Sillas Mylan.
Materiales
| Name | Company | Catalog Number | Comments |
| Acetic acid, glacial | Sigma-Aldrich | A6283 | This or comparable glacial acetic acid products are acceptable. |
| Crystal Violet | Sigma-Aldrich | C6158 | This or comparable crystal violet products are acceptable. |
| Digital Baraometer | Fisher Scientific | 14-650-118 | For pressure and temperature measurements. |
| Electrometer | Standard Imaging | CDX 2000B | Calibrated by an ADCL; Need correction factor, Pelec |
| Film | Gafchromic | EBT3 Film | Comes in sheets of 25; calibration films and experimental films must come from same set |
| Ionization Chamber | Farmer | PTW TN30013 | Calibrated by an ADCL @ two calibration points |
| Methanol | Sigma-Aldrich | 34860 | This or comparable methanol products are acceptable. |
| Photo Scanner | Epson | Perfection V700 | Equivalent scanners are V800, V10000, V11000, V12000 |
| XenX | Xstrahl | NA | Irradiator used. |
Referencias
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2019. CA: A Cancer Journal for Clinicians. 69 (1), 7-34 (2019).
- Allen, C., Her, S., Jaffray, D. A. Radiotherapy for Cancer: Present and Future. Advanced Drug Delivery Reviews. 109, 1-2 (2017).
- Delaney, G., Jacob, S., Featherstone, C., Barton, M. The role of radiotherapy in cancer treatment: estimating optimal utilization from a review of evidence-based clinical guidelines. Cancer. 104 (6), 1129-1137 (2005).
- Chen, H. H. W., Kuo, M. T. Improving radiotherapy in cancer treatment: Promises and challenges. Oncotarget. 8 (37), 62742-62758 (2017).
- Le, Q. T., Shirato, H., Giaccia, A. J., Koong, A. C. Emerging Treatment Paradigms in Radiation Oncology. Clinical Cancer Research. 21 (15), 3393-3401 (2015).
- Baumann, M., et al. Radiation oncology in the era of precision medicine. Nature Reviews Cancer. 16 (4), 234-249 (2016).
- Leeman, J. E., et al. Patterns of Treatment Failure and Postrecurrence Outcomes Among Patients With Locally Advanced Head and Neck Squamous Cell Carcinoma After Chemoradiotherapy Using Modern Radiation Techniques. JAMA Oncology. 3 (11), 1487-1494 (2017).
- Coy, P., et al. Patterns of failure following loco-regional radiotherapy in the treatment of limited stage small cell lung cancer. International Journal of Radiation Oncology - Biology - Physics. 28 (2), 355-362 (1994).
- Achrol, A. S., et al. Brain metastases. Nature Reviews Disease Primers. 5 (1), 5(2019).
- Ma, C. M., et al. AAPM protocol for 40-300 kV x-ray beam dosimetry in radiotherapy and radiobiology. Medical Physics. 28 (6), 868-893 (2001).
- Wang, Y. F., Lin, S. C., Na, Y. H., Black, P. J., Wuu, C. S. Dosimetric verification and commissioning for a small animal image-guided irradiator. Physics in Medicine and Biology. 63 (14), 145001(2018).
- Wack, L., et al. High throughput film dosimetry in homogeneous and heterogeneous media for a small animal irradiator. Physical Medicine. 30 (1), 36-46 (2014).
- Devic, S. Radiochromic film dosimetry: past, present, and future. Physical Medicine. 27 (3), 122-134 (2011).
- Franken, N. A., Rodermond, H. M., Stap, J., Haveman, J., van Bree, C. Clonogenic assay of cells in vitro. Nature Protocols. 1 (5), 2315-2319 (2006).
- Ford, E. C., et al. Localized CT-guided irradiation inhibits neurogenesis in specific regions of the adult mouse brain. Radiation Research. 175 (6), 774-783 (2011).
- Zarghami, N., et al. Half brain irradiation in a murine model of breast cancer brain metastasis: magnetic resonance imaging and histological assessments of dose-response. Radiation Oncology. 13 (1), 104(2018).
- Nwafor, D. C., et al. Loss of tissue-nonspecific alkaline phosphatase (TNAP) enzyme activity in cerebral microvessels is coupled to persistent neuroinflammation and behavioral deficits in late sepsis. Brain, Behavior, and Immunity. , (2019).
- Amtul, Z., Hepburn, J. D. Protein markers of cerebrovascular disruption of neurovascular unit: immunohistochemical and imaging approaches. Reviews in Neuroscience. 25 (4), 481-507 (2014).
- Draeger, E., et al. A Dose of Reality: How 20 Years of Incomplete Physics and Dosimetry Reporting in Radiobiology Studies May Have Contributed to the Reproducibility Crisis. International Journal of Radiation Oncology - Biology - Physics. 106 (2), 243-252 (2020).
- Dunne, A. L., et al. Relationship between clonogenic radiosensitivity, radiation-induced apoptosis and DNA damage/repair in human colon cancer cells. British Journal of Cancer. 89 (12), 2277-2283 (2003).
- Yang, Y., Xing, L. Optimization of radiotherapy dose-time fractionation with consideration of tumor specific biology. Medical Physics. 32 (12), 3666-3677 (2005).
- Hall, E. J., Giaccia, A. J. Radiobiology for the radiologist. Eighth edition. , Wolters Kluwer. (2019).
- van Leeuwen, C. M., et al. The alfa and beta of tumours: a review of parameters of the linear-quadratic model, derived from clinical radiotherapy studies. Radiation Oncology. 13 (1), 96(2018).
- Fowler, J. F. 21 years of biologically effective dose. British Institute of Radiology. 83 (991), 554-568 (2010).
- Jones, B., Dale, R. G., Deehan, C., Hopkins, K. I., Morgan, D. A. The role of biologically effective dose (BED) in clinical oncology. Clinical Oncology journal | The Royal College of Radiologists. 13 (2), 71-81 (2001).
- Choy, H., Rodriguez, F. F., Koester, S., Hilsenbeck, S., Von Hoff, D. D. Investigation of taxol as a potential radiation sensitizer. Cancer. 71 (11), 3774-3778 (1993).
- Ng, C. E., Bussey, A. M., Raaphorst, G. P. Inhibition of potentially lethal and sublethal damage repair by camptothecin and etoposide in human melanoma cell lines. International Journal of Radiation Biology. 66 (1), 49-57 (1994).
- Kurashige, T., Shimamura, M., Nagayama, Y. Differences in quantification of DNA double-strand breaks assessed by 53BP1/gammaH2AX focus formation assays and the comet assay in mammalian cells treated with irradiation and N-acetyl-L-cysteine. Journal of Radiation Research. 57 (3), 312-317 (2016).
- Schaue, D., Kachikwu, E. L., McBride, W. H. Cytokines in radiobiological responses: a review. Radiation Research. 178 (6), 505-523 (2012).
- Mery, B., et al. In Vitro Cell Death Determination for Drug Discovery: A Landscape Review of Real Issues. Journal of Cell Death. 10, 1179670717691251(2017).
- Galluzzi, L., et al. Molecular mechanisms of cell death recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death & Differentiation. 25 (3), 486-541 (2018).
- Felix, M. C., et al. Collimator optimization for small animal radiation therapy at a micro-CT. Z Medical Physics. 27 (1), 56-64 (2017).
- Newton, J., et al. Commissioning a small-field biological irradiator using point, 2D, and 3D dosimetry techniques. Medical Physics. 38 (12), 6754-6762 (2011).
- Wong, J., et al. High-resolution, small animal radiation research platform with x-ray tomographic guidance capabilities. International Journal of Radiation Oncology - Biology - Physics. 71 (5), 1591-1599 (2008).
- Ghita, M., et al. Small field dosimetry for the small animal radiotherapy research platform (SARRP). Radiation Oncology. 12 (1), 204(2017).
- Biglin, E. R., et al. Preclinical dosimetry: exploring the use of small animal phantoms. Radiation Oncology. 14 (1), 134(2019).
- Munoz Arango, E. T., Peixoto, J. G., de Almeida, C. E. Small field dosimetry with a high-resolution 3D scanning water phantom system for the small animal radiation research platform SARRP: a geometrical and quantitative study. Physics in Medicine and Biology. , (2019).
- Murrell, D. H., et al. Evaluating Changes to Blood-Brain Barrier Integrity in Brain Metastasis over Time and after Radiation Treatment. Translational Oncology. 9 (3), 219-227 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados