Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Muestreo y procesamiento del cepillado nasal mediante videomicroscopía ciliar digital de alta velocidad: adaptación para la pandemia de COVID-19
En este artículo
Resumen
Para garantizar un análisis funcional ciliar exitoso y de alta calidad para el diagnóstico de PCD, es esencial un método preciso y cuidadoso para el muestreo y procesamiento del epitelio respiratorio. Para continuar brindando el servicio de diagnóstico de PCD durante la pandemia de COVID-19, el protocolo de videomicroscopía ciliar se ha actualizado para incluir medidas adecuadas de control de infecciones.
Resumen
La discinesia ciliar primaria (DCP) es una ciliopatía móvil genética, que conduce a una enfermedad otosinopulmonar significativa. El diagnóstico de PCD a menudo se pasa por alto o se retrasa debido a los desafíos con diferentes modalidades de diagnóstico. La videomicroscopía ciliar, que utiliza videomicroscopía digital de alta velocidad (DHSV), una de las herramientas de diagnóstico para PCD, se considera el método óptimo para realizar el análisis funcional ciliar (CFA), que comprende la frecuencia de latido ciliar (CBF) y el análisis de patrón de latido (CBP). Sin embargo, DHSV carece de un procedimiento operativo estandarizado y publicado para procesar y analizar muestras. También utiliza epitelio respiratorio vivo, un importante problema de control de infecciones durante la pandemia de COVID-19. Para continuar brindando un servicio de diagnóstico durante esta crisis sanitaria, se ha adaptado el protocolo de videomicroscopía ciliar para incluir medidas adecuadas de control de infecciones.
Aquí, describimos un protocolo revisado para el muestreo y el procesamiento de laboratorio de muestras respiratorias ciliadas, destacando las adaptaciones realizadas para cumplir con las medidas de control de infecciones por COVID-19. Se describen los resultados representativos de CFA de muestras de cepillado nasal obtenidas de 16 sujetos sanos, procesadas y analizadas de acuerdo con este protocolo. También ilustramos la importancia de obtener y procesar tiras ciliadas epiteliales de calidad óptima, ya que las muestras que no cumplen con los criterios de selección de calidad ahora permiten CFA, lo que podría disminuir la confiabilidad diagnóstica y la eficiencia de esta técnica.
Introducción
La discinesia ciliar primaria (DCP) es una ciliopatía móvil heterogénea hereditaria, en la que los cilios respiratorios son estacionarios, lentos o discinéticos, lo que lleva a un aclaramiento mucociliar alterado y a una enfermedad oto-sino-pulmonar crónica 1,2,3,4. Las manifestaciones clínicas de la DCP son tos húmeda crónica y congestión nasal crónica a partir de la primera infancia, infecciones recurrentes o crónicas del tracto respiratorio superior e inferior que conducen a bronquiectasias, otitis media recurrente o crónica y sinusitis 5,6,7. Aproximadamente la mitad de los pacientes con DCP presentan defectos de lateralidad orgánica como situs inversus o situs ambiguus. Algunos pacientes también presentan problemas de infertilidad debido a espermatozoides inmóviles en hombres y cilios inmóviles en las trompas de Falopio en mujeres 1,2,8. La DCP es rara, pero la prevalencia es difícil de definir, y oscila entre 1:10.000 y 1:20.000 9,10. Sin embargo, se cree que la prevalencia real de DCP es mayor debido a las dificultades en el diagnóstico y la falta de sospecha clínica. Los síntomas de la DCP imitan las manifestaciones respiratorias comunes de otras afecciones respiratorias agudas o crónicas, y los desafíos diagnósticos para confirmar el diagnóstico son bien conocidos, lo que lleva a un tratamiento y seguimiento inadecuados 2,5,9,11.
La videomicroscopía ciliar, que utiliza videomicroscopía digital de alta velocidad (DHSV), es una de las herramientas de diagnóstico para PCD 4,8,12,13. La DHSV se considera el método óptimo para realizar el análisis funcional ciliar (CFA), que comprende el análisis de frecuencia de latido ciliar (CBF) y patrón de latido (CBP) 2,14,15,16. DHSV utiliza epitelio respiratorio vivo, generalmente obtenido del cepillado nasal13.
En vista del brote actual de COVID-19, la confirmación de un diagnóstico de PCD es ahora aún más importante, ya que la evidencia sugiere que la enfermedad respiratoria subyacente puede conducir a peores resultados después de la infección por COVID-1917,18. Un servicio de diagnóstico de PCD seguro y eficiente durante la pandemia actual también permitirá que los pacientes confirmados con PCD se beneficien de medidas de protección adicionales, en comparación con la población general19.
La transmisión de COVID-19 ocurre principalmente a través de la propagación de gotitas20. El alto potencial de transmisión de pacientes asintomáticos (o mínimamente sintomáticos) es sugerido por la alta carga viral en la muestra de nariz20. Además, si las partículas virales se aerosolizan, permanecen en el aire durante al menos 3 horas21. Por lo tanto, los trabajadores de la salud respiratoria están expuestos a un alto reservorio de carga viral mientras realizan la atención clínica y la recolección de muestras para las técnicas de diagnóstico22. Además, la manipulación de muestras respiratorias vivas expone al técnico a la contaminación por COVID-19. Si bien se están implementando recomendaciones de mejores prácticas para médicos respiratorios y cirujanos otorrinolaringólogos que atienden a pacientes con COVID-1923, faltan recomendaciones para realizar DHSV durante la pandemia de COVID-19.
Para continuar brindando un servicio de diagnóstico de PCD, al tiempo que se garantiza la seguridad del trabajador de la salud (que realiza la recolección de muestras) y del técnico (que realiza el procesamiento de muestras), el protocolo de videomicroscopía ciliar tuvo que adaptarse durante la pandemia de COVID-19. La técnica de videomicroscopía ciliar se limita actualmente al servicio de investigación y centros de diagnóstico especializados, ya que la CFA requiere una amplia formación y experiencia. Además, actualmente, existe una falta de estandarización y un procedimiento operativo preciso para procesar y analizar muestras utilizando DHSV 4,13.
El objetivo de este artículo es describir los procedimientos operativos estándar para DHSV, con especial referencia a las medidas de control de infecciones y la seguridad al muestrear y procesar epitelio nasal vivo. Esto permitirá que el diagnóstico y la atención de PCD de alta calidad continúen, a pesar del brote actual de COVID-19.
Protocolo
Se obtuvo la aprobación del comité de ética del hospital de Lieja y del Departamento de Higiene y Protección de la Salud en el Trabajo de la Universidad.
1. Muestreo de epitelio ciliado respiratorio
- Asegúrese de que los sujetos estén libres de infección durante al menos 4-6 semanas, y libres de medicamentos nasales e inhalados, antes de la toma de muestras.
- Preparar la preparación suplementada de M199: Suplemento medio de cultivo celular 199 (M199) (500 ml) con solución antibiótica (5 ml de estreptomicina/penicilina (50 μg/ml)) y solución antimicótica (5 ml de anfotericina B (2,5 μg/ml)).
- Prepare 2 (uno para cada fosa nasal) tubos cónicos de 15 ml con tapas, y llene cada uno de ellos con 3 ml de M199 suplementado.
- Preparar un cepillo de citología bronquial (grosor: 2 mm y longitud: 11 mm). Corte el extremo del alambre para asegurarse de que el cepillo tenga unos 15 cm de largo (Figura 1A, B). Para sostener el cepillo al realizar el cepillado nasal, use un fórceps nasal de Weil-Blakesley (Figura 1B).
- Adaptación COVID-19: Evite procesar una muestra de epitelio nasal vivo de estado desconocido para COVID-19, analice al paciente para COVID-19 de 48 a 72 horas antes del cepillado nasal para videomicroscopía ciliar. Esta prueba de COVID-19 consiste en la reacción en cadena de la polimerasa a partir de una muestra de hisopo nasofaríngeo24,25. Como el estado del paciente para COVID-19 es desconocido en este momento, el médico y los miembros del personal deben estar adecuadamente protegidos23,26, incluida la máscara FFP2, guantes, protector facial o gafas, y bata resistente al agua de manga larga. En caso de pruebas PCR no disponibles, imposibles o dudosas, se realiza todo el procesamiento del cepillado nasal en el laboratorio de bioseguridad L2. En caso de estado positivo de COVID-19, posponga las pruebas de diagnóstico de PCD y considere enfoques alternativos para manejar al paciente.
CAUTELA: Este muestreo de hisopado nasofaríngeo para la prueba de COVID-19 podría inducir discinesia ciliar secundaria al dañar el epitelio ciliar respiratorio nasal27,28. Para evitar esto, introducir un hisopo de algodón fino en la cavidad nasal hasta la nasofaringe bajo control endoscópico rígido, evitando dañar los cornetes o el tabique. Luego se toma la muestra de la nasofaringe y se retira el hisopo de algodón bajo el control del endoscopio rígido. Con el equipo adecuado, una endoscopia rígida de 0 ° se realiza fácilmente en adultos y niños sin trauma.
2. Obtención de muestras de epitelio ciliado respiratorio
Adaptación a COVID-19: Incluso si el estado de COVID-19 del paciente es negativo, debido a la tasa de falsos negativos, se le pide al paciente que mantenga una máscara quirúrgica en la boca durante el procedimiento, y el médico usa guantes, máscara FFP2 y protector facial.
- Preparación para el cepillado nasal
- Pídale al paciente que se suene la nariz.
- Realizar cepillado nasal bajo endoscopia nasal o cegado. Si usa una endoscopia nasal, examine las 2 fosas nasales antes del cepillado nasal (no repita si se hizo 48-72 previamente para el hisopo nasal COVID-19). El examen permite verificar el estado de la mucosa (un alto grado de inflamación puede causar sangrado cuando se realiza el cepillado nasal, ...), la condición de cornetes inferiores (para excluir la presencia de telangiectasias, por ejemplo) y si el tabique nasal es recto (Figura 1C).
- Pídale al paciente que se acueste o que se siente cómodamente, con la cabeza apoyada hacia atrás en la silla (porque el cepillado nasal hace que un reflejo mueva la cabeza hacia atrás). Un segundo cuidador sostiene la cabeza durante el cepillado nasal, particularmente en niños.
- Agite el cepillo en el M199 suplementado antes del cepillado nasal (humedecer el cepillo reduce la irritación del cepillado).
NOTA: El cepillo puede humedecerse dentro del M199 suplementado; Si el paciente es alérgico a los antibióticos (la penicilina y la estreptomicina están presentes en el medio de cultivo celular suplementado), humedezca el cepillo en solución salina.
- Cepillado nasal
- Inserte suavemente el cepillado nasal sin anestesia local o general13. Si usa endoscopia nasal, coloque el endoscopio en la entrada de la nariz para visualizar el cornete nasal inferior, luego inserte el cepillo de citología en la nariz. Si realiza un cepillado nasal "ciego", inserte el cepillo en la nariz, siguiendo el piso nasal (Figura 1D).
NOTA: Algunos centros de diagnóstico utilizan anestesia local con un tampón de nafazolina para realizar el cepillado nasal. - Mueva el cepillo posterior y anterior varias veces sobre la parte posterior del cornete nasal inferior y luego retírelo. El operador debe sentir que el cepillo frota el epitelio, y el paciente puede sentir un ojo lloroso unilateral en el lado del cepillado.
NOTA: Si el cepillado nasal se realiza demasiado anterior, no se obtendrán células ciliadas, ya que la cavidad nasal anterior está revestida con un epitelio transicional no ciliado. - Después del muestreo, coloque inmediatamente las muestras de cepillado nasal dentro del medio de cultivo. Las tiras epiteliales respiratorias obtenidas se desprenden agitando el cepillo en el tubo que contiene el M199 suplementado, luego se cierra el tubo (Figura 1E).
- Adaptación COVID-19: No desaloje las tiras epiteliales agitando el cepillo en el M199 suplementado inmediatamente después del muestreo. Coloque el cepillo en el tubo, corte el alambre para que pueda caber completamente dentro del tubo y cierre el tubo inmediatamente. Coloque la muestra en una bolsa doble hermética.
- Inserte suavemente el cepillado nasal sin anestesia local o general13. Si usa endoscopia nasal, coloque el endoscopio en la entrada de la nariz para visualizar el cornete nasal inferior, luego inserte el cepillo de citología en la nariz. Si realiza un cepillado nasal "ciego", inserte el cepillo en la nariz, siguiendo el piso nasal (Figura 1D).
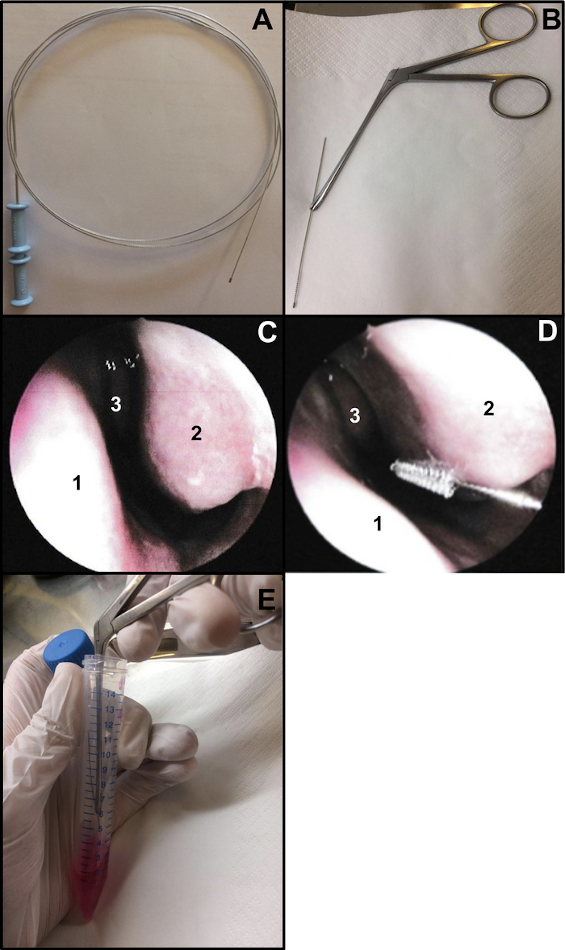
Figura 1: Técnica de cepillado nasal. (A) Cepillo de citología bronquial completo (B) Listo para cepillar: se corta el extremo de cepillado del alambre (aproximadamente 15 cm de largo) y se sostiene mediante un fórceps nasal de Weil-Blakesley (C) Vista endoscópica de la cavidad nasal: tabique (1) cornete inferior (2) y cornete medio (3) (D) El cepillado nasal se realiza en la parte posterior del cornete inferior (2). Tabique nasal (1) Cornetes medios (3). (E) Las tiras epiteliales respiratorias se desprenden agitando el cepillo en el medio de cultivo celular M199 suplementado. Haga clic aquí para ver una versión más grande de esta figura.
3. Procesamiento del epitelio ciliado respiratorio
- Analice las muestras de cepillado nasal bajo el microscopio dentro de las 9 horas posteriores al muestreo, ya que tanto CBF como CBP son estables dentro de este marco de tiempo (datos no publicados).
- Utilice un microscopio vertical o de luz invertida, con un contraste de fase de inmersión en aceite x100 o una lente de contraste de interferencia. Lo ideal es colocar el microscopio sobre una mesa antivibratoria, ya que el batido ciliar puede estar sujeto a artefactos debido a vibraciones externas (por ejemplo, desde el banco de laboratorio)13.
Adaptación COVID-19: El operador utiliza equipo de protección personal para realizar el procesamiento nasal, incluida la máscara FFP2, guantes y bata resistente al agua de manga larga.
- Prepare la cámara de visualización.
- Suspenda las tiras epiteliales ciliadas en una cámara de visualización abierta construida en laboratorio, permitiendo que los cilios latan libremente mientras se analizan bajo el microscopio. Esta cámara se crea mediante la separación de un cubreobjetos (22 mm x 40 mm) y un portaobjetos de vidrio mediante dos cubobjetos cuadrados adyacentes (20 mm x 20 mm), separados por una distancia de 15 mm, y pegados en el portaobjetosde vidrio 12 (Figura 2, Figura 4A).
Adaptación COVID-19: La cámara construida en laboratorio descrita anteriormente es abierta y permite el intercambio de gases y humedad entre la muestra y el ambiente13. En el contexto de la pandemia de COVID-19, es posible utilizar una cámara de visualización cerrada utilizando un espaciador atascado de doble cara, de 0,25 mm de profundidad (Figura 3, Figura 4B). El espaciador se pega en la corredera de vidrio, y luego se pega un deslizamiento de cubierta (22 mm x 40 mm) en la parte superior del espaciador.

Figura 2: Montaje de la cámara abierta construida en laboratorio. (A) Los 2 cubreobjetos cuadrados (20 mm x 20 mm) se colocan en el portaobjetos de vidrio. (B) Los cubreobjetos cuadrados están separados por una distancia de unos 15 mm y pegados en el portaobjetos de vidrio. (C) La cámara se llena entre los dos cubobjetos cuadrados adyacentes con una pequeña muestra (aproximadamente 60 μL) de epitelio ciliado en M199 suplementado. (D) Un cubreobjetos rectangulares largos (22 mm x 40 mm) se coloca en los dos cubreobjetos cuadrados adyacentes, y cubre la cámara. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Montaje de la cámara cerrada utilizando un espaciador atascado de doble cara. (A) La corredera de vidrio y el espaciador de doble cara pegado. (B) La protección se retira en un lado del espaciador, y el espaciador se pega en la corredera de vidrio. (C) La protección se retira del otro lado del espaciador atascado de doble cara, y luego el espaciador se llena con una pequeña muestra (aproximadamente 60 μL) de epitelio ciliado en M199 suplementado. (D) Un cubreobjetos rectangular largo (22 mm x 40 mm) se pega en el espaciador y cierra la cámara. Haga clic aquí para ver una versión más grande de esta figura.
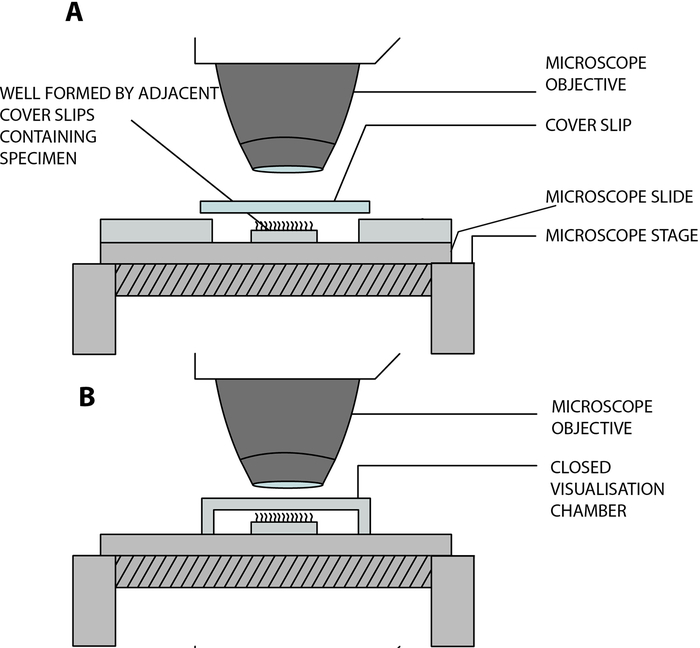
Figura 4: Diagrama esquemático que muestra las principales cámaras de visualización utilizadas para realizar videomicroscopía ciliar utilizando videomicroscopía digital de alta velocidad (DHSV). (A) La técnica de gota colgante abierta: la muestra ciliada se suspende en una gota de medio de cultivo celular en una cámara abierta creada por la separación de un cubreobjetos y un portaobjetos de vidrio por dos cubreobjetos adyacentes. (B) La técnica de gota colgante cerrada: la muestra ciliada se suspende en una gota de medio de cultivo celular en una cámara cerrada creada por un espaciador intercalado entre un lado de vidrio y un cubreobjetos. El espaciador se adhiere firmemente tanto a la corredera de vidrio como al deslizamiento de la cubierta. Reproducido y modificado a partir de Kempeneers et al.13. Haga clic aquí para ver una versión más grande de esta figura.
- Control de temperatura
- Rodee el microscopio con plástico de burbujas (Figura 5A, B).
- Fije el calentador de lente alrededor del objetivo con una correa Velcro (Figura 5C)
- Encienda el controlador del calentador de lente 1 hora antes de realizar la comprobación de temperatura de control.
- Encienda el microscopio y verifique que la configuración del microscopio esté hecha, ya que la cantidad de luz a través de la muestra puede cambiar la temperatura en el portaobjetos.
- Encienda el controlador de la caja calefactada (Figura 5D).
- Compruebe que la sonda de referencia funciona correctamente antes de empezar. Sostenga la punta de la sonda de referencia entre los dedos; Debe medir la temperatura corporal.
- Coloque los medios libres en el centro de la diapositiva, entre los dos cubos cuadrados adyacentes (20 mm x 20 mm) pegados en él.
- Coloque la punta de la sonda de referencia en el M199 suplementado. Cubierta con cubreobjetos rectangulares (22 mm x 40 mm). Asegúrese de que la sonda esté completamente rodeada de medios (de lo contrario, la temperatura podría bajar).
- Adaptación COVID-19: Para realizar el control de temperatura en la cámara cerrada utilizando un espaciador, corte un lado del espaciador (este orificio debe ser del mismo tamaño que la sonda de referencia). Pegue el espaciador en la diapositiva de vidrio, coloque los medios libres en el centro del espaciador. Coloque la punta de la sonda de referencia en la solución, a través del orificio del espaciador, luego pegue un cubreobjetos rectangular (22 mm x 40 mm) en el espaciador.
- Coloque la corredera en la placa de la caja calentada. Cierre la caja caliente con la tapa.
- Agregue aceite en el objetivo de inmersión en aceite.
- Coloque la caja calentada en la platina del microscopio.
- Ajuste la temperatura de la placa y la tapa (la temperatura de la tapa debe ser 2 °C más alta que la temperatura de la placa para evitar la condensación) para medir 37 °C con la sonda de referencia dentro del medio.
- Espere 5 minutos (tiempo necesario para elevar la temperatura de la muestra a 37 °C).
- Ajusta el objetivo, acercándolo a la diapositiva hasta tocar el cubreobjetos con la punta de la lente.
- Mueva el objetivo para ver el centro de la sonda en el microscopio.
NOTA: Asegúrese de que la sonda se vea en la pantalla del ordenador (para comprobar que el sistema de la cámara funciona antes de mirar la muestra ciliada). Al ver el centro de la sonda, la pantalla es completamente negra. - Ajuste la temperatura del calentador de la lente (para compensar la pérdida de temperatura cuando la lente de inmersión en aceite está en contacto con el cubreobjetos). Asegúrese de medir 37 °C con la sonda de referencia dentro del medio cuando el objetivo toque el cubierto.
NOTA: Lo ideal es trabajar en una habitación con una temperatura controlada, de modo que estas temperaturas configuradas no cambien. Si la temperatura de la habitación no está controlada, debe realizar esta comprobación de control de temperatura todos los días antes de realizar la videomicroscopía ciliar. - Después de verificar la temperatura, retire el portaobjetos de la caja calentada.
- Limpie el portaobjetos y la punta de la sonda de referencia con alcohol y guárdelo.
- Limpie la lente con isopropanol y los pañuelos de limpieza de la lente con movimientos circulares.

Figura 5: Equipo utilizado en el laboratorio DHSV. (A) El microscopio equipado con una lente de contraste de fase de inmersión en aceite 100x, se coloca sobre una mesa antivibración para evitar que las vibraciones externas causen artefactos para el análisis funcional ciliar (B) El microscopio está rodeado por plástico de burbujas para evitar la pérdida de calor del aire ambiente. (C) El objetivo de inmersión en aceite crea pérdida de calor. Esto se puede evitar usando un calentador de lente (flechas). (D) La muestra se calienta utilizando una caja de calentamiento. Haga clic aquí para ver una versión más grande de esta figura.
4. Preparación de las muestras epiteliales ciliadas respiratorias
- Agite el tubo suavemente para permitir que los cilios se extiendan por todo el tubo (para evitar que los cilios se atasquen en otras tiras ciliadas, moco o desechos, lo que evita que latan libremente).
NOTA: Este paso es esencial para obtener "bordes óptimos" del epitelio ciliado (Figura 12). - Extraer aproximadamente 50 μL de epitelio ciliado en M199 suplementado en el centro del tubo con una pipeta.
- Coloque la muestra en la cámara construida en laboratorio (entre los dos cubreobjetos cuadrados adyacentes (20 mm x 20 mm)) y cubra con un cubreobjetos rectangular (22 mm x 40 mm). Tenga cuidado de no agregar burbujas.
- Adaptación COVID-19: Realice los pasos 4.1-4.3 en un armario de seguridad microbiológica. Procedimiento en el armario de seguridad microbiológica.
- Encienda el gabinete de seguridad microbiológica 10 minutos antes de preparar la muestra (para asegurarse de que el ambiente sea estéril).
- Antes de cualquier manipulación, desinfecte todo el gabinete de seguridad microbiológica con etanol al 70%.
- Desinfecte todo el material necesario con etanol al 70% antes de colocarlo en el gabinete de seguridad microbiológica.
- Abra los tubos cónicos de 15 ml que contienen las muestras solo una vez debajo del gabinete de seguridad microbiológica, luego desaloje las tiras epiteliales agitando el cepillo (usando pinzas nasales de Weil-Blakesley) en M199 suplementado.
- Pegue el espaciador en la corredera de vidrio y retire la protección del espaciador atascado de doble cara.
- Agite el tubo suavemente para permitir que los cilios se extiendan por todo el tubo.
- Extraiga una pequeña muestra de epitelio ciliado en M199 suplementado del centro del tubo con una pipeta (aproximadamente 60 μL) y llene el espaciador.
- Pegue el cubreobjetos rectangular (22 mm x 40 mm) en el espaciador para cerrar la cámara.
- Desinfecte el portaobjetos antes de salir del gabinete de seguridad microbiológica.
- Retire el portaobjetos del armario de seguridad microbiológica.
- Cámbiese los guantes al salir del armario de seguridad microbiológica.
- Espere 10 minutos antes de apagar el gabinete de seguridad microbiológica después de su uso (para asegurarse de que el ambiente del gabinete de seguridad microbiológica sea estéril antes de cerrar la puerta).
- Coloque la corredera en la placa de la caja calentada. Cierre la caja caliente con la tapa.
- Agregue aceite en el objetivo de inmersión en aceite.
- Coloque la caja calentada en el escenario del microscopio.
- Encienda la caja calefactada y el calentador de lente.
NOTA: El calentador de lente debe estar encendido 1 hora antes de su uso. - Ajuste los ajustes de temperatura de la caja calentada y los controladores del calentador de la lente de acuerdo con los valores obtenidos en el paso 3.4.
- Espere 5 minutos (tiempo necesario para elevar la temperatura de la muestra hasta 37 °C cuando se utilizan ajustes predeterminados tanto para la caja calentada como para el calentador del objetivo).
- Acércate al objetivo a la diapositiva hasta tocar el cubreobjetos con la punta de la lente.
5. Visualización de bordes ciliados respiratorios
- Fije la cámara de vídeo de alta velocidad en el microscopio, conecte la cámara al ordenador y encienda la cámara.
- Encienda el equipo.
- Conecte la cámara digital de videomicroscopía de alta velocidad al ordenador (de modo que la imagen vista a través de las lentes oculares se proyecte en el monitor) a través del software.
- Abra el software y, a continuación, el menú principal se abrirá automáticamente (Figura 6A).
NOTA: El software es el programa utilizado en el laboratorio para la adquisición y procesamiento de imágenes. El sistema permite grabar y reproducir secuencias de vídeo a una velocidad de fotogramas reducida o fotograma a fotograma. Se puede descargar de forma gratuita. - Cámara abierta (Figura 6A).
- Cuando aparezca el filtro de enumeración de cámaras , elija Aceptar (Figura 6B).
- Seleccione Actualizar lista; seleccione el nombre de la cámara; elija Interfaz: Experto y, a continuación, seleccione Abrir (Figura 6C).
- En la línea de control de la cámara situada en la parte superior del menú de diálogo acoplado, seleccione Live (Figura 6D).
- Elija Reproducir para ver la imagen y Detener para finalizar la visualización (Figura 6D).
- Abra el software y, a continuación, el menú principal se abrirá automáticamente (Figura 6A).

Figura 6: Descripción del uso del software: visualización de bordes ciliados respiratorios en el monitor. (A) El menú principal aparece directamente al abrir el software. (b) Cierre el filtro de enumeración de cámaras. (C) Elija la cámara y seleccione Interfaz: Experto. (D) El modo en vivo permite visualizar en el monitor la imagen vista a través del microscopio. Haga clic aquí para ver una versión más grande de esta figura.
- Ajuste la configuración de adquisición de la cámara (en la esquina superior derecha) (Figura 7).
- En Configuración de adquisición , elija Cámara y, a continuación, ajuste la velocidad de fotogramas: Velocidad (Hz): 500 (ver más abajo) (Figura 7A).
- En Ajustes de adquisición , elija Cámara y, a continuación, ajuste la región de interés (ROI) (Figura 7A).
NOTA: El ROI se calcula utilizando una escala graduada vista con el objetivo de inmersión en aceite x100 y proyectada en el monitor, para definir el número de píxeles correspondientes a 50 μm (ya que desea grabar bordes ciliados que miden aproximadamente 50 μm (ver más abajo)). - En Configuración de adquisición , elija Grabar, luego ajuste la duración del video y el número total de cuadros grabados (una duración de 2 segundos, corresponde a 1000 cuadros si la velocidad de fotogramas elegida es 5OO Hz) (Figura 7B).
NOTA: En nuestra experiencia, es necesario un mínimo de 2 segundos de duración de video para permitir un análisis completo tanto de CBF como de CBP. - Seleccione Archivo y, a continuación, Save Camera Cfg ( Guardar cámara Cfg) para guardar el nuevo ajuste de adquisición (introduzca un nombre y, si es necesario, un comentario para esta nueva configuración) (Figura 7C,D).
- Para abrir esta nueva configuración de cámara, abra File and Load Camera Cfg (Figura 7C).
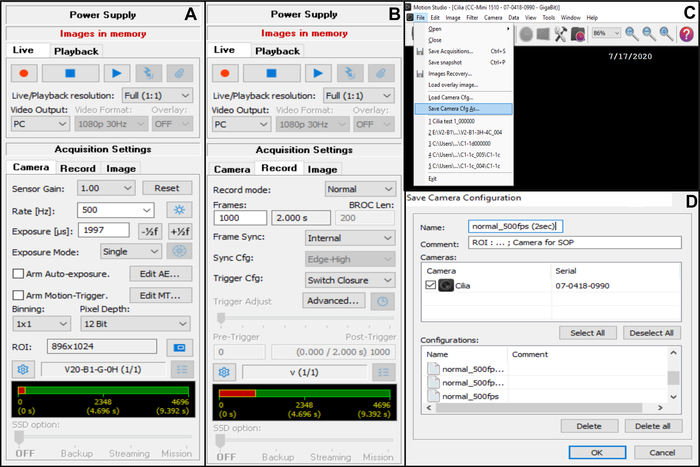
Figura 7: Descripción del uso del software: ajuste de la configuración de adquisición de la cámara para la grabación de vídeo de los bordes ciliados palpitantes. (A) En la configuración de adquisición de la cámara, ajuste la región de interés (ROI) y la velocidad de fotogramas para la grabación de video (Tasa). (B) En el ajuste de adquisición Grabar, ajuste la duración de la grabación de vídeo (número de fotogramas necesarios para la duración de grabación elegida, de acuerdo con la velocidad de fotogramas elegida anteriormente). (C) Estos nuevos ajustes de configuración de la cámara se pueden guardar utilizando la función Guardar cámara Cfg . Cargar cámara Cfg permite volver a abrir los ajustes de configuración guardados para su posterior uso. (D) Se puede nombrar los nuevos ajustes de configuración de la cámara y se puede agregar un comentario si es necesario. Haga clic aquí para ver una versión más grande de esta figura.
- Vea a través de lentes oculares y busque células o desechos dentro de la muestra, luego enfoque.
- Compruebe que la imagen es visible en el monitor y mejore la calidad de la imagen ajustando el condensador (y el prisma DIC si utiliza una lente de contraste de interferencia) y ajuste el enfoque si es necesario.
- Busque tiras de epitelio ciliado.
6. Selección de bordes ciliados respiratorios
NOTA: El sistema experimental permite ver los cilios batidos en tres planos distintos: un perfil lateral, latiendo directamente hacia el observador, y desde directamente arriba (Figura 8).
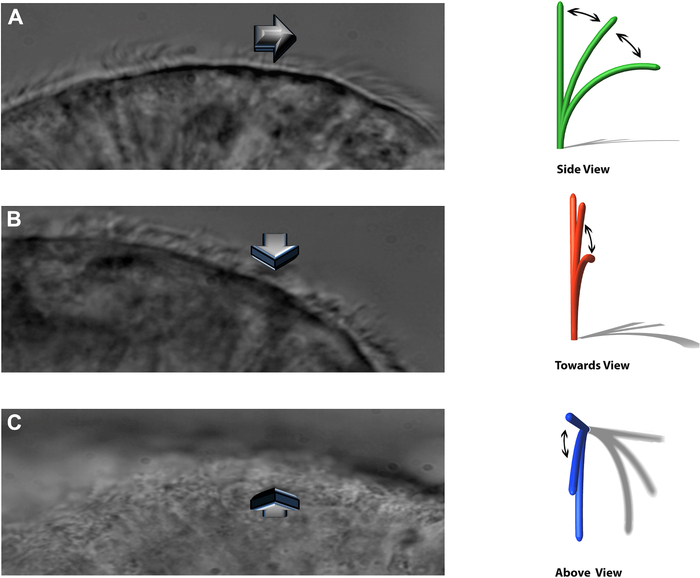
Figura 8: La técnica DHSV permite ver los cilios batidos en tres planos distintos. A) en el perfil lateral. (B) golpeando directamente hacia el observador y. (C) desde directamente arriba. Reproducido de Kempeneers et al.16. Haga clic aquí para ver una versión más grande de esta figura.
- Registre solo los bordes epiteliales ciliados intactos no interrumpidos que midan al menos 50 μm de longitud.
- Para los registros realizados en el perfil lateral, determinar la calidad del borde de acuerdo con el sistema de puntuación de Thomas et al.29 (Figura 9). Utilice sólo aristas normales (Figura 9A) o aristas con proyecciones menores (Figura 9B) para el análisis funcional ciliar. Excluir células aisladas (Figura 9E).

Figura 9: Imagen representativa del sistema de puntuación de Thomas et al29 para la diferente calidad de los bordes epiteliales ciliados. (A) Borde normal: definido como una tira de epitelio ciliada uniforme intacta > 50 μm de longitud (B) Borde ciliado con proyecciones menores: definido como un borde >50 μm de longitud, con células que se proyectan fuera de la línea del borde epitelial, pero sin ningún punto de la membrana celular apical que se proyecta por encima de las puntas de los cilios en las células adyacentes (C) Borde ciliado con proyecciones principales: definido como un borde >50 μm de longitud, con células que se proyectan fuera de la línea del borde epitelial, con al menos un punto de la membrana celular apical que se proyecta por encima de las puntas de los cilios en las células adyacentes (D) Célula ciliada aislada: definida como la única célula ciliada en un borde epitelial >50 μm de longitud (E) Células individuales: definidas como células ciliadas que no tienen contacto entre sí ni entre sí ni entre ningún otro tipo de célula. Barra de escala: 5,5 μm. Reproducido de Thomas et al.29Haga clic aquí para ver una versión más grande de esta figura.
- Realice CFA utilizando solo cilios libres de moco y escombros, y batiendo en el perfil elegido para el borde grabado. Seleccione solo aristas ciliadas que permitan un mínimo de 2 evaluaciones CBF y CBP (ver más abajo) a lo largo del borde.
- Utilícese solo para muestras de CFA que produzcan un mínimo de 6 bordes que latan en el perfil lateral y cumplan con los criterios anteriores; Analiza un máximo de 20 aristas en el perfil lateral.
- Use un mínimo de 1 borde adicional de cilios golpeando desde arriba del perfil del observador para caracterizar el CBP.
7. Registro de borde ciliado
- Grabe el borde de los cilios con una velocidad de fotogramas de la cámara de 500 fotogramas por segundo y proyecte en un monitor de alta resolución. Se requiere una velocidad de cuadro mínima de 400 Hz para permitir el análisis de CBF y CBP13. Grabe un borde a una velocidad de fotogramas de 30 fotogramas por segundo para evaluar la eficiencia de la eliminación de partículas.
- Seleccione En vivo, en la línea de control de la cámara en la parte superior del menú de diálogo acoplado (Figura 6D)
- Elija Reproducir para ver la imagen y Detener para finalizar la visualización (Figura 6D)
- Para grabar una arista, pulse Grabar (Figura 6D). Para ver la grabación antes de guardarla, vaya a la línea de control de la cámara en la parte superior del menú de diálogo acoplado y seleccione Reproducción. Elija Reproducir para ver el video grabado y Detener para finalizar la visualización (Figura 10A).
NOTA: Deje de ver el borde grabado antes de guardar.
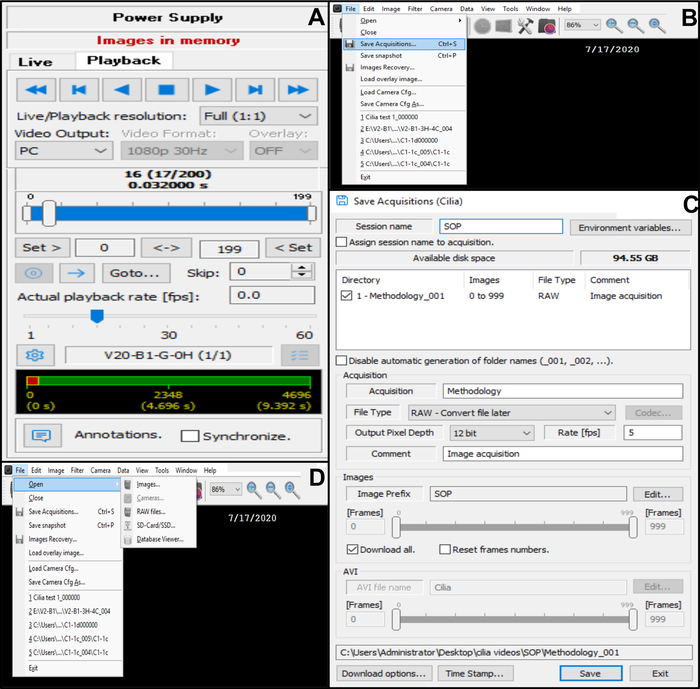
Figura 10: Descripción del uso del software. (A) modo de reproducción. Para revisar una secuencia de vídeo grabada de borde ciliado batido, elija el Modo de reproducción. Elija Reproducir para ver la imagen y Detener para finalizar la visualización. La tasa de fama se puede ajustar para mejorar el análisis de la función ciliar (B, C) Guardar las grabaciones de vídeo de batir bordes ciliados (B) Para guardar el vídeo, elija Archivo y, a continuación, Guardar adquisiciones. (C) Ingrese el nombre del video grabado y elija el emplazamiento donde se graba el video. Asegúrese de que la grabación se guarda como . Archivo RAW (D) elección de una grabación de bordes ciliados batidos a analizar: Para abrir una grabación de vídeo, elija Archivo, luego Abrir y, a continuación, Imágenes. Haga clic aquí para ver una versión más grande de esta figura.
- Guarde el video en la base de datos (Figura 10B,C).
- Abra Archivo en la esquina superior izquierda y, a continuación, guarde las adquisiciones (Figura 10B).
- En Guardar adquisiciones, escriba el nombre del vídeo grabado y asegúrese de que la grabación se guarde como un formato de tipo de archivo RAW (Figura 10C).
- Cuando se guarde el vídeo, vuelva al modo en directo (vuelva a la línea de control de la cámara en la parte superior del menú de diálogo acoplado y seleccione en directo) (Figura 6D).
- Repita el procedimiento para registrar el número de aristas que cumplen los criterios de selección requeridos para CFA.
NOTA: Es posible grabar varios bordes ciliados que cumplen los criterios de selección de una diapositiva, dentro de un máximo de 20 minutos después de la preparación de la diapositiva (para evitar la desecación). Después de 20 minutos, si no es posible obtener suficientes bordes que cumplan con los criterios de selección, prepare una nueva diapositiva. - Retire la corredera de la caja calentada.
- Retire el cubreobjetos rectangular y tírelo en el contenedor específico de desechos médicos peligrosos.
- Limpie la diapositiva (con los dos cubreobjetos cuadrados pegados en ella) con etanol al 70% y papel absorbente. Una vez que la diapositiva esté limpia, se puede usar nuevamente.
- Adaptación COVID-19: Coloque la corredera con el cubreobjetos y el espaciador en una bolsa hermética, quítese los guantes y la máscara y colóquelos en la bolsa hermética. Coloque la bolsa hermética en el contenedor específico de desechos médicos peligrosos.
8. Análisis funcional ciliar
- Preparación preliminar para realizar la evaluación manual CBF y CBP
- Abra el software.
- Abra Archivo en la esquina superior izquierda, luego Abrir y luego Imágenes (Figura 10D).
- Elija el video para analizar.
- Vaya a la línea de control de la cámara en la parte superior del menú de diálogo acoplado y seleccione Reproducción (Figura 10A). Elija Reproducir para ver el video grabado y Detener para terminar de verlo.
- Análisis manual de frecuencia de latido ciliar (CBF)
- Realice la evaluación de CBF utilizando solo los bordes laterales.
- Divida los bordes ciliados en aproximadamente 5 áreas adyacentes, cada una de las cuales mide aproximadamente 10 μm (Figura 11).
- Identifique y visualice cilios o grupos de cilios a una velocidad de fotogramas reducida, y se realiza un máximo de 2 mediciones de CBF en cada área, lo que resulta en un máximo de 10 mediciones de CBF a lo largo de cada borde (Figura 11).
- Registre el número de fotogramas necesarios para que un grupo de cilios complete 5 ciclos de latido.
- Convertir a CBF mediante un cálculo simple: (CBF = velocidad de fotogramas de grabación (Hz) / (número de cuadros para 5 pulsaciones) x 5) 13,16,30. Se informa que los cilios inmóviles tienen un CBF de 0 Hz13.
NOTA: Ajuste la velocidad de fotogramas al reproducir los vídeos grabados (Figura 10A). Esto es especialmente útil cuando los cilios analizados laten muy lentamente. El aumento de la velocidad de fotogramas ayuda a definir si los cilios laten muy lentamente o son inmóviles. - Para cada muestra, calcular la media del CBF como la media (DE) o (IC del 95%) de todos los CBF registrados en el perfil lateral, incluidos los cilios estáticos.
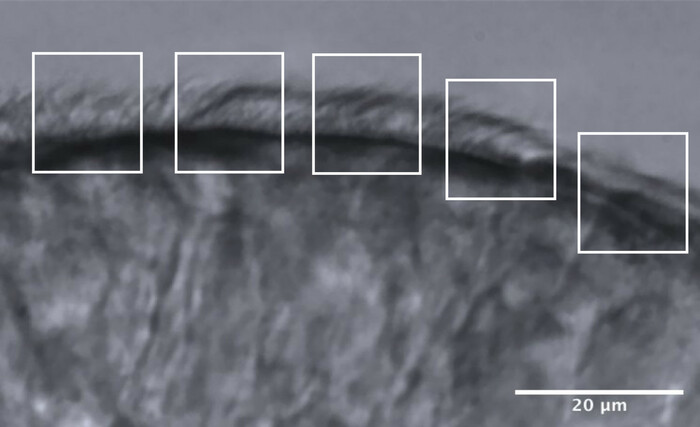
Figura 11: Imagen representativa de un borde de calidad óptimo, y la división en 5 áreas para permitir el análisis CFA. Un borde epitelial ciliado de calidad óptima se fragmenta en 5 áreas adyacentes de 10 μm, cada una. Se realiza un máximo de 2 mediciones de CBF (y 2 evaluaciones de CBP) en cada área, lo que resulta en un máximo de 10 mediciones de CBF (y evaluaciones de CBP) a lo largo de cada borde. Barra de escala = 20 μm. Haga clic aquí para ver una versión más grande de esta figura.
- Análisis manual del patrón de latido ciliar (CBP)
- Para evaluar los marcadores de discinesia, utilice únicamente el perfil lateral; usar los planos hacia el observador y desde arriba para caracterizar el tipo de CBP13. Existen diferentes métodos y puntajes para la evaluación de CBP. A continuación se describe el método utilizado en el laboratorio con la definición de los marcadores de discinesia.
- El porcentaje de cada CBP distinto dentro de la muestra
- Para cada cilio o grupo de cilios identificados y utilizados para una medición de CBF (Figura 11), realice un análisis de CBP a una velocidad de fotogramas reducida: compare la ruta precisa tomada por los cilios durante un ciclo de latido completo con la CBP normal observada en el análisis DHSV12,30.
- Atribuir un CBP distinto (normal, inmóvil, rígido, circular, asíncrono (latido ciliar descoordinado) o discinético13) a cada cilio o grupo de cilios analizados.
- Para cada muestra, calcular el porcentaje de cada CBP distinto dentro de la muestra; el CBP atribuido a la muestra es el CBP predominante observado.
- Calcular los 3 marcadores de discinesia.
- Calcular el índice de inmotilidad (IMI): el porcentaje de cilios inmóviles dentro de la muestra (número de CBF = 0 / número total de lecturas de CBF en la muestra X 100). Expresar el IMI como media (DE) o (IC 95%)1,16,31.
- Calcular la puntuación de discinesia (DKS). Divida cada borde ciliado en cuadrantes, y se determina el número de cuadrantes con cilios discinéticos (o que laten anormalmente). Esto permite calcular un DKS entre 0 y 4 (0: CBP normal en todo el borde; 1: CBP anormal en ≤ 25% de los cilios; 2: CBP anormal en ≤ 50% de los cilios; 3: patrón de latido anormal en ≤ 75% de los cilios; y 4: CBP anormal en todos los cilios). La mediana de DKS (rango intercuartílico) se calcula para la muestra 16,29.
- Calcular el porcentaje de latido normal: definido como el porcentaje de cilios con un CBP normal dentro de la muestra (número de lecturas normales de CBP / número total de lecturas de CBP para la muestra x100).
Resultados
Para ilustrar la eficacia de la técnica, presentamos los resultados de la CFA en una serie de 16 voluntarios adultos sanos (5 varones, rango de edad 22-54 años).
Las muestras de cepillado nasal de 14 (4 hombres, rango de edad 24-54 años) del total de 16 voluntarios proporcionaron suficientes bordes epiteliales apropiados que cumplieron con los criterios de selección necesarios para realizar CFA. De estas 14 muestras de cepillado nasal, se registraron un total de 242 bordes ciliados, y 212 ...
Discusión
Este documento tiene como objetivo proporcionar un procedimiento operativo estándar para CFA utilizando muestras de cepillado nasal, con ajustes realizados para las consideraciones apropiadas de control de infecciones durante la pandemia de COVID-19. El diagnóstico de PCD es desafiante, y actualmente requiere un panel de diferentes pruebas de diagnóstico, de acuerdo con la recomendación internacional, incluida la medición nasal de óxido nítrico, CFA usando DHSV, análisis ultraestructural ciliar usando microscopí...
Divulgaciones
Estos autores no tienen nada que revelar.
Agradecimientos
Nos gustaría agradecer a Jean-François Papon, Bruno Louis, Estelle Escudier y a todos los miembros del equipo del centro de diagnóstico PCD de Paris-Est por su disponibilidad y cordial bienvenida durante la visita a su centro de diagnóstico PCD, y los numerosos intercambios. También agradecemos a Robert Hirst y a todos los miembros del equipo en el centro PCD de Leicester por su bienvenida y tiempo, asesoramiento y experiencia.
Materiales
| Name | Company | Catalog Number | Comments |
| 15 mL conical tubes | FisherScientific | 352096 | 15 ml High-Clarity Polypropylene Conical Tube with lid |
| Amphotericin B | LONZA | 17-836E | Antifungal solution |
| Blakesley-weil nasal forceps | NOVO SURGICAL | E7739-12 | Used to hold the brush to perform the nasal brushing |
| Bronchial cytology brush | CONMED | 129 | Used for nasal brushing |
| Cotton swab | NUOVA APTACA | 2150/SG | Used for COVID-19 testing |
| Digitial high-speed videomicroscopy camera | IDTeu Innovation in motion | CrashCam Mini 1510 | |
| Glass slide | ThermoScientific | 12372098 | Microscope slides used to create the visualization chamber |
| Heated Box | IBIDI cells in focus | 10918 | Used to heat the sample |
| Inverted Light microscope | Zeiss | AXIO Vert.A1 | |
| Lens Heater | TOKAI HIT | TPiE-LH | Used to heat the oil immersion lens |
| Medium 199 (M199), HEPES | TermoFisher Scientific | 12340030 | Cell Culture Medium |
| Motion Studio X64 | IDT Motion | version 2.14.01 | Software |
| Oil | FischerScientific, Carl Zeiss | 11825153 | |
| Rectangular cover slip | VWR | 631-0145 | Used to cover the visualization chamber |
| Spacer (Ispacer) 0.25 mm | Sunjinlab | IS203 | Used for the creation of the hermetic closed visualization chamber |
| Square cover slip | VWR | 631-0122 | Used for the creation of lab-built open visualization chamber |
| Streptomycin/Penicillin | FisherScientific, Gibco | 11548876 | Antiobiotics solution |
Referencias
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Ciliary beat pattern is associated with specific ultrastructural defects in primary ciliary dyskinesia. Journal of Allergy Clinical Immunology. 112 (3), 518-524 (2003).
- Werner, C., Onnebrink, J. G., Omran, H. Diagnosis and management of primary ciliary dyskinesia. Cilia. , 1-9 (2015).
- Kempeneers, C., Chilvers, M. A. To beat, or not to beat, that is question! The spectrum of ciliopathies. Pediatric Pulmonology. 53 (8), 1122 (2018).
- Lucas, J. S., et al. European Respiratory Society guidelines for the diagnosis of primary ciliary dyskinesia. The European Respiratory Journal. 49 (1), (2017).
- Knowles, M. R., Zariwala, M., Leigh, M. Primary Ciliary Dyskinesia. Clinics in chest medicine. 37 (3), 449-461 (2016).
- Shapiro, A. J., et al. Diagnosis, monitoring, and treatment of primary ciliary dyskinesia: PCD foundation consensus recommendations based on state of the art review. Pediatric Pulmonology. , (2016).
- Fitzgerald, D. A., Shapiro, A. J. When to suspect primary ciliary dyskinesia in children. Paediatric Respiratory Reviews. , (2016).
- Shoemark, A., Dell, S., Shapiro, A., Lucas, J. S. ERS and ATS diagnostic guidelines for primary ciliary dyskinesia: similarities and differences in approach to diagnosis. European Respiratory Journal. 54 (3), (2019).
- Mirra, V., Werner, C., Santamaria, F. Primary ciliary dyskinesia: An update on clinical aspects, genetics, diagnosis, and future treatment strategies. Frontiers in Pediatrics. 5, 1-13 (2017).
- Ardura-Garcia, C., et al. Registries and collaborative studies for primary ciliary dyskinesia in Europe. European Respiratory Journal Open Research. 6 (2), (2020).
- Leigh, M. W., et al. Clinical features and associated likelihood of primary ciliary dyskinesia in children and adolescents. Annals of the American Thoracic Society. , (2016).
- Chilvers, M. A., O'Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. The European respiratory journal. 34 (6), 1264-1276 (2009).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of Ciliary Beat Pattern in Three Different Beating Planes in Healthy Subjects. Chest. 151 (5), 993-1001 (2017).
- Götzinger, F., et al. COVID-19 in children and adolescents in Europe: a multinational, multicentre cohort study. The Lancet Child & Adolescent Health. , (2020).
- Yang, J., et al. Prevalence of comorbidities and its effects in coronavirus disease 2019 patients: A systematic review and meta-analysis. International Journal of Infectious Diseases. 94, 91-95 (2020).
- Brough, H. A., et al. Managing childhood allergies and immunodeficiencies during respiratory virus epidemics - The 2020 COVID-19 pandemic: A statement from the EAACI-section on pediatrics. Pediatric Allergy and Immunology. 31 (5), 442-448 (2020).
- Zou, L., et al. SARS-CoV-2 Viral Load in Upper Respiratory Specimens of Infected Patients. The New England journal of medicine. 382 (12), 1177-1179 (2020).
- van Doremalen, N., et al. Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. The New England journal of medicine. 382 (16), 1564-1567 (2020).
- Tran, K., Cimon, K., Severn, M., Pessoa-Silva, C. L., Conly, J. Aerosol generating procedures and risk of transmission of acute respiratory infections to healthcare workers: a systematic review. PloS one. 7 (4), 35797 (2012).
- Van Gerven, L., et al. Personal protection and delivery of rhinologic and endoscopic skull base procedures during the COVID-19 outbreak. Rhinology. 58 (3), 289-294 (2020).
- Marty, F. M., Chen, K., Verrill, K. A. How to Obtain a Nasopharyngeal Swab Specimen. New England Journal of Medicine. 382 (22), 76 (2020).
- Petruzzi, G., et al. COVID-19: Nasal and oropharyngeal swab. Head & Neck. 42, (2020).
- George, A., Prince, M., Coulson, C. Safe nasendoscopy assisted procedure in the post-COVID-19 pandemic era. Clinical Otolaryngology. , (2020).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PLoS ONE. 9 (2), (2014).
- Jorissen, M., Willems, T., Van der Schueren, B. Ciliary function analysis for the diagnosis of primary ciliary dyskinesia: advantages of ciliogenesis in culture. Acta oto-laryngologica. 120 (2), 291-295 (2000).
- Thomas, B., Rutman, A., O'Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Stannard, W. A., Chilvers, M. A., Rutman, A. R., Williams, C. D., O'Callaghan, C. Diagnostic testing of patients suspected of primary ciliary dyskinesia. American Journal of Respiratory and Critical Care Medicine. 181 (4), 307-314 (2010).
- Boon, M., et al. Primary ciliary dyskinesia: critical evaluation of clinical symptoms and diagnosis in patients with normal and abnormal ultrastructure. Orphanet Journal of Rare Diseases. 9 (1), 11 (2014).
- Armengot, M., Milara, J., Mata, M., Carda, C., Cortijo, J. Cilia motility and structure in primary and secondary ciliary dyskinesia. American Journal of Rhinology & Allergy. 24 (3), 175-180 (2010).
- Papon, J. F., et al. Quantitative analysis of ciliary beating in primary ciliary dyskinesia: a pilot study. Orphanet Journal of Rare Diseases. 7 (1), 78 (2012).
- Wallmeier, J., et al. Mutations in CCNO and MCIDAS lead to a mucociliary clearance disorder due to reduced generation of multiple motile cilia. Molecular and Cellular Pediatrics. 2, 15 (2015).
- Boon, M., et al. MCIDAS mutations result in a mucociliary clearance disorder with reduced generation of multiple motile cilia. Nature Communications. 5 (6), 4418 (2014).
- Shapiro, A. J., et al. Diagnosis of Primary Ciliary Dyskinesia. An Official American Thoracic Society Clinical Practice Guideline. American Journal of Respiratory and Critical Care Medicine. 197 (12), 24-39 (2018).
- Rubbo, B., et al. Accuracy of high-speed video analysis to diagnose primary ciliary dyskinesia. Chest. (19), 30205 (2019).
- Horani, A., Ferkol, T. W. Advances in the Genetics of Primary Ciliary Dyskinesia. Chest. 154 (3), 645-652 (2018).
- MacCormick, J., Robb, I., Kovesi, T., Carpenter, B. Optimal biopsy techniques in the diagnosis of primary ciliary dyskinesia. The Journal of Otolaryngology. 31 (1), 13-17 (2002).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Jackson, C. L., Goggin, P. M., Lucas, J. S. Ciliary Beat Pattern Analysis Below 37°C May Increase Risk of Primary Ciliary Dyskinesia Misdiagnosis. Chest. 142 (2), 543-544 (2012).
- Green, A., Smallman, L. A., Logan, A. C., Drake-Lee, A. B. The effect of temperature on nasal ciliary beat frequency. Clinical otolaryngology and allied sciences. 20 (2), 178-180 (1995).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Smith, C. M., et al. ciliaFA: a research tool for automated, high-throughput measurement of ciliary beat frequency using freely available software. Cilia. 1 (1), 14 (2012).
- Sisson, J. H., Stoner, J. a., Ammons, B. a., Wyatt, T. a. All-digital image capture and whole-field analysis of ciliary beat frequency. Journal of Microscopy. 211, 103-111 (2003).
- Blanchon, S., et al. Deep phenotyping, including quantitative ciliary beating parameters, and extensive genotyping in primary ciliary dyskinesia. Journal of Medical Genetics. , (2019).
- Feriani, L., et al. Assessing the Collective Dynamics of Motile Cilia in Cultures of Human Airway Cells by Multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Sears, P. R., Thompson, K., Knowles, M. R., Davis, C. W. Human airway ciliary dynamics. American Journal of Physiology - Lung Cellular and Molecular Physiology. 304 (3), 170-183 (2013).
- Quinn, S. P., et al. Automated identification of abnormal respiratory ciliary motion in nasal biopsies. Science translational medicine. 7 (299), (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados