Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Imágenes de calcio in vivo de las respuestas de las neuronas ganglionares geniculadas de ratón a los estímulos del gusto
En este artículo
Resumen
Aquí presentamos cómo exponer el ganglio geniculado de un ratón de laboratorio vivo y anestesiado y cómo usar imágenes de calcio para medir las respuestas de conjuntos de estas neuronas a los estímulos del sabor, lo que permite múltiples ensayos con diferentes estimulantes. Esto permite comparaciones en profundidad de qué neuronas responden a qué saborantes.
Resumen
En los últimos diez años, los avances en los indicadores de calcio codificado genéticamente (GECI) han promovido una revolución en la imagen funcional in vivo. Utilizando el calcio como un sustituto de la actividad neuronal, estas técnicas proporcionan una forma de monitorear las respuestas de las células individuales dentro de grandes conjuntos neuronales a una variedad de estímulos en tiempo real. Nosotros, y otros, hemos aplicado estas técnicas para obtener imágenes de las respuestas de las neuronas ganglionares geniculadas individuales a los estímulos de sabor aplicados a las lenguas de ratones anestesiados vivos. El ganglio geniculado está compuesto por los cuerpos celulares de las neuronas gustativas que inervan la lengua y el paladar anteriores, así como algunas neuronas somatosensoriales que inervan el pabellón auricular del oído. La obtención de imágenes de las respuestas evocadas por el gusto de las neuronas ganglionares geniculadas individuales con GCaMP ha proporcionado información importante sobre los perfiles de sintonía de estas neuronas en ratones de tipo salvaje, así como una forma de detectar fenotipos periféricos de mal cableado del gusto en ratones manipulados genéticamente. Aquí demostramos el procedimiento quirúrgico para exponer el ganglio geniculado, la adquisición de imágenes de fluorescencia GCaMP, los pasos iniciales para el análisis de datos y la solución de problemas. Esta técnica se puede utilizar con GCaMP codificado transgénicamente, o con expresión GCaMP mediada por AAV, y se puede modificar para obtener imágenes de subconjuntos genéticos particulares de interés (es decir, expresión GCaMP mediada por Cre). En general, las imágenes de calcio in vivo de las neuronas ganglionares geniculadas son una técnica poderosa para monitorear la actividad de las neuronas gustativas periféricas y proporcionan información complementaria a las grabaciones más tradicionales de la cuerda del nervio entero tympani o los ensayos de comportamiento del gusto.
Introducción
Un componente clave del sistema de sabor periférico de los mamíferos es el ganglio geniculado. Además de algunas neuronas somatosensoriales que inervan el pabellón auricular del oído, el geniculado está compuesto por los cuerpos celulares de las neuronas gustativas que inervan la lengua y el paladar anteriores. Al igual que otras neuronas sensoriales periféricas, las neuronas ganglionares geniculadas son pseudo-unipolares con un axón largo que se proyecta periféricamente a las papilas gustativas, y centralmente al núcleo del tronco encefálico del tracto solitario1. Estas neuronas se activan principalmente por la liberación de ATP por las células receptoras del gusto que responden a los estímulos gustales en la cavidad oral2,3. El ATP es un neurotransmisor esencial para la señalización del gusto, y los receptores P2rx expresados por las neuronas ganglionares gustativas son necesarios para su activación4. Dado que las células receptoras del gusto expresan receptores de sabor específicos para una modalidad de sabor particular (dulce, amargo, salado, umami o agrio), se ha planteado la hipótesis de que las respuestas de las neuronas ganglionares gustativas a los estímulos gustativos también estarían estrechamente sintonizadas5.
Las grabaciones de nervios enteros han demostrado que tanto la cuerda tímpano como los nervios petrosales superiores mayores conducen señales gustativas que representan las cinco modalidades de sabor al ganglio geniculado6,7. Sin embargo, esto todavía dejaba preguntas sobre la especificidad de las respuestas neuronales a un sabor dado: si hay neuronas específicas de la modalidad del gusto, neuronas polimodales o una mezcla de ambas. Los registros de fibra única dan más información sobre la actividad de las fibras individuales y sus sensibilidades químicas8,9,10,pero esta metodología se limita a recopilar datos de un pequeño número de fibras. Del mismo modo, los registros electrofisiológicos in vivo de neuronas ganglionares geniculadas de ratas individuales dan información sobre las respuestas de neuronas individuales11,12,13, pero aún pierden la actividad de la población y producen relativamente pocos registros de neuronas por animal. Para analizar los patrones de respuesta de los conjuntos neuronales sin perder de vista la actividad de las neuronas individuales, fue necesario emplear nuevas técnicas.
Las imágenes de calcio, especialmente utilizando indicadores de calcio codificados genéticamente como GCaMP, han proporcionado este avance técnico14,15,16,17,18. GCaMP utiliza el calcio como un sustituto de la actividad neuronal, aumentando la fluorescencia verde a medida que aumentan los niveles de calcio dentro de la célula. Se siguen desarrollando nuevas formas de GCaMP para mejorar la relación señal/ruido, ajustar la cinética de unión y adaptarse a experimentos especializados19. GCaMP proporciona resolución de una sola neurona, a diferencia de la grabación de todo el nervio, y puede medir simultáneamente las respuestas de conjuntos de neuronas, a diferencia de la grabación de una sola fibra o de una sola célula. Las imágenes de calcio de los ganglios geniculados ya han proporcionado información importante sobre los perfiles de sintonía de estas neuronas en ratones de tipo salvaje16,20, y ha identificado fenotipos de mal cableado de sabor periférico en ratones manipulados genéticamente18.
Una dificultad importante para aplicar técnicas de imagen de calcio in vivo al ganglio geniculado es que está encapsulado dentro de la bulla timpánica ósea. Para obtener acceso óptico al geniculado, se requiere una cirugía delicada para eliminar las capas de huesos, manteniendo el ganglio intacto. Para ello, hemos creado esta guía para ayudar a otros investigadores a acceder al ganglio geniculado e imaginar las respuestas fluorescentes mediadas por GCaMP de estas neuronas para saborear estímulos in vivo.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Los protocolos de animales fueron revisados y aprobados por los Comités Institucionales de Cuidado y Uso de Animales de la Universidad de Texas en San Antonio.
1. Configuración preoperatoria
NOTA: Tenga en cuenta que la configuración inicial del equipo no se aborda aquí, ya que variará según el sistema de bombeo, el microscopio, la cámara y el software de imágenes utilizado. Para obtener instrucciones de configuración, consulte los materiales de instrucción proporcionados por el proveedor del equipo. Para el equipo utilizado por los autores, consulte la Tabla de materiales.
- Asegúrese de que el líquido fluya a través de todas las líneas de vehículos (agua) y sabor. Si la línea está bloqueada, desconéctese y enjuague con agua. Si la línea está torcida, masajee hasta que fluya el líquido. Asegúrese de que el líquido comience y se detenga en la señal.
- Una vez que se confirme que todas las líneas están desbloqueadas, ejecute el vehículo durante 10 s y luego cierre todas las válvulas.
- Asegúrese de que el software de imágenes esté listo con todas las variables requeridas (por ejemplo, longitud de prueba, nombres de archivo, velocidad de fotogramas, etc.). Usando μManager, un paquete de software de adquisición de imágenes de código abierto, ingrese 200 ms en el campo etiquetado Tiempo de exposición para un cuadro por segundo de 5Hz, seleccione x2 en binningy presione el botón etiquetado Live. Cuando se inicie el video, presione el botón en el lado izquierdo etiquetado ROI. Esto dará como resultado un campo de visión de 512x512.
2. Anestesiar e inmovilizar al animal
NOTA: El siguiente protocolo es un procedimiento terminal optimizado para ratones de cualquier sexo que pesan 18-35 g. Se recomienda su uso con animales entre las semanas 10 y 12 de edad. Se puede usar con animales transgénicos que expresan indicadores de calcio codificado genéticamente (GECI) como los Snap25-GCaMP6, o animales inyectados estereotáxicamente con GECI virales. Se deben usar guantes, bata de laboratorio y máscara facial durante todo el protocolo.
- Escruff animal y realizar una inyección intraperitoneal de Ketamina (100 mg/kg) y Xilazina (10 mg/kg). Evalúe la profundidad de la anestesia mediante pellizco del dedo del dedo del dedo del día antes de continuar.
- Afeitarse la parte superior de la cabeza y el área quirúrgica en la parte frontal del cuello.
- Encienda la almohadilla térmica y coloque al animal propenso en la almohadilla.
- Aplique ungüento en los ojos del animal para evitar el secado de los ojos.
- Haga una incisión (~ 1 cm) en la línea media de la cabeza para exponer el cráneo del animal. Retire el tejido conectivo con un hisopo estéril para que el hueso desnudo sea accesible. Use un aplicador con punta de algodón para asegurarse de que el cráneo esté seco.
- Aplique la unión veterinaria al cráneo. Asegúrese de cubrir el cráneo expuesto. Espere a que el pegamento se seque.
- En una tapa de placa de Petri, mezcle y aplique una capa de cemento dental al cráneo. El extremo posterior del aplicador con punta de algodón utilizado en el paso 2.5 funcionará bien para este proceso. Coloque el poste de la cabeza en la parte superior del cemento dental y aplique una segunda capa de cemento dental para intercalar el poste de la cabeza en su lugar en el cráneo.
- Déjalo reposar hasta que el cemento dental esté seco y sólido. Rompa el aplicador con punta de algodón por la mitad y use los extremos puntiagudos para pinchar el cemento dental para probar. Si el cemento dental no cede a ser pinchado, el animal puede ser girado a una posición supina.
3. Traqueotomía
- Aplicar exfoliante prequirúrgico en la zona quirúrgica. Después de frotar, haga una incisión en la línea media ~ 2 cm en la piel de la garganta desde el esternón hasta la barbilla.
- Retraiga la piel y las glándulas submaxilares, asegurándose de exponer completamente los músculos digástricos.
- Encuentre la costura en la musculatura paratraqueal, sepárese con disección roma y retraiga la apertura.
- Corte con cuidado una abertura en la parte superior de la tráquea lo suficientemente grande como para caber en tubos de polietileno (I.D. 0.86 mm, O.D. 1.27 mm). No corte más de la mitad del diámetro de la tráquea. Inserte tubos en la tráquea hacia los pulmones.
- Reposicione los retractores para liberar la musculatura paratraqueal y retraer las glándulas submaxilares.
- Pegar la musculatura paratraqueal sobre tubos con una cantidad mínima de pegamento veterinario (ver Figura 1A).
4. Romper la bulla timpánica
- Burle suavemente el músculo digástrico deseado (izquierdo o derecho) hacia arriba y separe el tejido conectivo. Corte en el extremo anterior del músculo, evitando los vasos sanguíneos, y tire hacia atrás hacia atrás hasta que esté libre de la bulla timpánica.
- Incline la cabeza hacia atrás ligeramente para levantar la bulla timpánica. Localice la rama de la arteria carótida anterior al punto de inserción posterior del músculo digástrico. Se siente justo después de este vaso sanguíneo para la estructura convexa de la bulla timpánica.
- Busque una costura en la musculatura en esta ubicación (ver Figura 1B). Usando dos juegos de fórceps finos, diseccionar romamente en la costura hasta que el hueso de la bulla timpánica sea visible. Use retractores para mantener una visión clara de la bulla timpánica.
- Encuentre la costura que corre de anterior a posterior en la bulla (ver Figura 1C). Usando una sonda quirúrgica, haga un agujero en el hueso en el centro de esta costura. Use un juego de tijeras de extremo fino para cortar un área circular en el hueso, teniendo cuidado de no cortar los vasos sanguíneos anteriores, posteriores y profundos debajo de la bulla.
5. Exponer el geniculado
- Dentro de este agujero hay un trozo convexo de hueso, esta es la cóclea. Anterior a la cóclea hay un músculo, el tensor tímpano (ver Figura 1D). Usando las tijeras de resorte, corte el tensor tímpano y retírelo.
- Realice un pellizco en el dedo del dedo del día. Si el animal responde, dé una mezcla de ketamina/xilazina ata 1/3 dosis para la redosión.
- Prepare el líquido de riego y una línea de succión. Usando la sonda quirúrgica, haga un agujero en el promontorio coclear. Inmediatamente irrigar el líquido que fluye hacia afuera y eliminarlo con succión. Este líquido fluirá más o menos continuamente desde este punto y deberá abordarse periódicamente.
- Agrandar el agujero en la cóclea. Tenga cuidado con el vaso sanguíneo que rodea la cóclea hasta el borde posterior y lateral.
- Incline la cabeza del ratón hacia adelante. Localice el agujero en el hueso temporal debajo de lo que era la cóclea (ver Figura 1E). Tome nota de la cresta anterior a este agujero, esta cresta se encuentra directamente sobre el séptimo nervio.
- Inserte una sonda quirúrgica en el orificio y levante cuidadosamente el hueso temporal para exponer el séptimo nervio (ver Figura 1F). Haga un balance de cuánto del séptimo nervio es visible y si el geniculado no está completamente expuesto, incline la cabeza del animal hacia atrás e intente extraer el hueso de la parte anterior al nervio.
- Si el ganglio aún no es completamente visible, saque más hueso de debajo. Tenga mucho cuidado de no colocar la sonda profundamente debajo del hueso, ya que hacer esto puede dañar el geniculado.
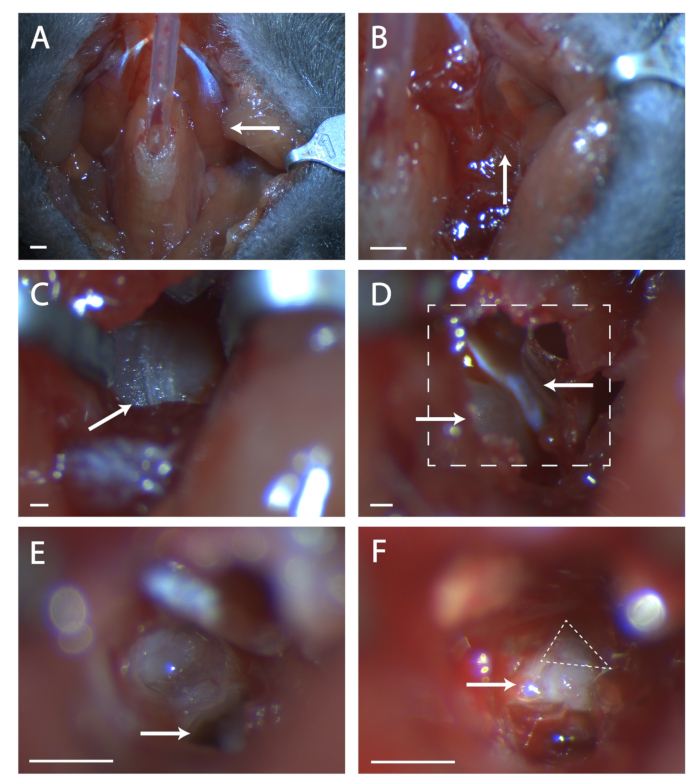
Figura 1: Exposición quirúrgica del ganglio geniculado. (A) Imagen de la cavidad del cuello del ratón después de la traqueotomía. Arrow apunta al músculo digástrico que se encuentra sobre el área quirúrgica explorada en el resto de la figura. (B) Imagen de la región bajo el músculo digástrico previamente indicado. La flecha indica la costura en la musculatura para la disección roma. (C) Imagen de la Bulla Timpánica. La flecha indica que la costura en el hueso se rompe con una sonda quirúrgica. (D) Imagen del área quirúrgica después de abrir la bulla. La flecha inferior izquierda indica la cóclea, la flecha superior apunta al tensor tímpano. La línea en caja indica el área en (E) y (F). (E) Imagen del área quirúrgica después de que la cóclea se ha roto y el contenido eliminado. La flecha blanca indica dónde colocar la sonda quirúrgica a la que se hace referencia en el paso 5.6 del protocolo. (F) Una imagen del ganglio geniculado expuesto. La flecha indica el cuerpo del séptimo nervio, el triángulo discontinuo rodea el ganglio geniculado. Paneles A-B, Escala = 5 mm. Paneles C-F, Escala = 1 mm. Haga clic aquí para ver una versión más grande de esta figura.
6. Ejecute el panel de sabor
- Use la succión para eliminar el líquido de sobre el geniculado. Opcionalmente, coloque un punto absorbente para ayudar a mitigar la filtración y ayudar en la navegación del microscopio.
- Coloque al animal en una almohadilla absorbente bajo el microscopio. Localice el ganglio geniculado: los puntos de referencia útiles incluyen el agujero dejado en la bulla, el agujero en el hueso temporal y el séptimo nervio. Usando el filtro FITC/GFP en el endoscopio de epifluorescencia, verifique si hay neuronas ganglionares geniculadas que expresen GCaMP individuales. Un objetivo 10x (distancia de trabajo de 10 mm) proporcionará una resolución suficiente para rastrear la actividad de células individuales, pero también se puede usar un objetivo de 20x (distancia de trabajo de 12 mm).
- Coloque la aguja dispensadora para la línea de sabor firmemente en la boca del animal. Coloque una placa de Petri debajo de la boca del animal para atrapar líquido.
- Asegúrese de que la cámara está viendo el campo de visión del microscopio. Sincronice el inicio de la grabación de video con el inicio de la presentación sabrosa.
- Durante la grabación, vea la transmisión en vivo para obtener respuestas, deriva y filtraciones.
- Si se produce una filtración, succionar el líquido hasta que la vista del geniculado sea clara y repetir. Si se produce una deriva, compruebe que todas las partes del poste de la cabeza estén firmemente apretadas. Si no se producen respuestas, compruebe que el líquido está fluyendo y que el microscopio y la cámara están enfocados en la ubicación adecuada sin que nada oscurezca el campo de visión.
- Repita hasta que se haya obtenido el número deseado de videos. Alivie suavemente los retractores, luego repita los pasos 3-6 en el lado opuesto.
- Después de que se hayan obtenido los videos deseados para todos los ganglios deseados, eutanasia al animal a través de la dislocación cervical.
Access restricted. Please log in or start a trial to view this content.
Resultados
Siguiendo el protocolo, se sedó a un animal transgénico Snap25-GCaMP6s, se expusieron ganglios geniculados y se aplicó sabor a la lengua mientras se grababa el video. El objetivo del experimento fue definir qué saborantes provocaron respuestas de cada célula. Los tastantes (30 mM AceK, 5 mM Quinina, 60 mM NaCl, 50 mM IMP + 1 mM MPG, 50 mM Ácido Cítrico)18 se disolvieron en agua DI y se aplicaron a la lengua durante 2 s separados por 13 s de agua DI.
Access restricted. Please log in or start a trial to view this content.
Discusión
Este trabajo describe un protocolo paso a paso para exponer quirúrgicamente el ganglio geniculado y registrar visualmente la actividad de sus neuronas con GCaMP6s. Este procedimiento es muy similar al descrito anteriormente17,con algunas excepciones notables. En primer lugar, el uso de un poste de la cabeza permite un fácil ajuste de la posición de la cabeza durante la cirugía. En segundo lugar, con respecto a la entrega de estímulos, el enfoque de Wu y Dvoryanchikov hace fluye los estímulos...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen ningún conflicto de intereses que informar.
Agradecimientos
Los autores agradecen a S. Humayun por la cría de ratones. El financiamiento para este trabajo ha sido proporcionado en parte por el Brain Health Consortium Graduate and Postdoctoral Seed Grant (B.E.F.) de UTSA y NIH-SC2-GM130411 a L.J.M.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 1 x #5 Inox Forceps | Fine Science Tools | NC9792102 | |
| 1ml Syringe with luer lock | Fisher Scientific | 14-823-30 | |
| 2 x #3 Inox Forceps | Fine Science Tools | M3S 11200-10 | |
| 27 Gauge Blunt Dispensing Needle | Fisher Scientific | NC1372532 | |
| 3M Vetbond | Fisher Scientific | NC0398332 | |
| 4-40 Machine Screw Hex Nuts | Fastenere | 3SNMS004C | |
| 4-40 Socket Head Cap Screw | Fastenere | 3SSCS04C004 | |
| Absorbent Points | Fisher Scientific | 50-930-668 | |
| Acesulfame K | Fisher Scientific | A149025G | |
| Artificial Tears | Akorn | 59399-162-35 | |
| BD Allergist Trays with Permanently Attached Needle | Fisher Scientific | 14-829-6D | |
| Blunt Retractors | FST | 18200-09 | |
| Breadboard | Thor Labs | MB8 | |
| Citric Acid | Fisher Scientific | A95-3 | |
| Cohan-Vannas Spring Scissors | Fine Science Tools | 15000-02 | |
| Contemporary Ortho-Jet Liquid | Lang | 1504 | |
| Contemporary Ortho-Jet Powder | Lang | 1520 | |
| Cotton Tipped Applicators | Fisher | 19-062-616 | |
| Custom Head Post Holder | eMachineShop | See attached file 202410.ems | |
| Custom Metal Head Post | eMachineShop | See attached file 202406.ems | |
| DC Temperature Controller | FHC | 40-90-8D | |
| Digital Camera, sCMOS OrcaFlash4 Microscope Mounted | Hamamatsu | C13440 | |
| Disection Scope | Leica | M80 | |
| Hair Clippers | Kent Scientific | CL7300-Kit | |
| IMP | Fisher Scientific | AAJ6195906 | |
| Ketamine | Ketaved | NDC 50989-996-06 | |
| LED Cold Light Source | Leica Mcrosystems | KL300LED | |
| Luer Lock 1/16" Tubing Adapters | Fisher | 01-000-116 | |
| Microscope | Olympus | BX51WI | |
| Mini-series Optical Posts | Thorlabs | MS2R | |
| MPG | Fisher Scientific | AAA1723230 | |
| MXC-2.5 Rotatable probe Clamp | Siskiyou | 14030000E | |
| NaCl | Fisher Scientific | 50-947-346 | |
| petri dishes | Fisher Scientific | FB0875713A | |
| Pressurized air | Airgas | AI Z300 | |
| Quinine | Fisher Scientific | AC163720050 | |
| Self Sticking Labeling Tape | Fisher Scientific | 159015R | |
| Silicone Pinch Valve Tubing 1/32" x 1/16" o.d. (per foot) | Automate Scientific | 05-14 | |
| Sola SM Light Engine | Lumencor | ||
| Snap25-2A-GCaMP6s-D | JAX | 025111 | |
| Student Fine Scissors | Fine Science Tools | 91460-11 | |
| Surgical Probe | Roboz Surgical Store | RS-6067 | |
| Surgical Probe Holder | Roboz Surgical Store | RS-6061 | |
| Thread | Gütermann | 02776 | |
| BD Intramedic Tubing | Fisher Scientific | 22-046941 | |
| Two Stage Gas Regulator | Airgas | Y12FM244B580-AG | |
| Tygon vinyl tubing - 1/16" | Automate Scientific | 05-11 | |
| Valvelink8.2 digital/manual controller | Automate Scientific | 01-18 | |
| Valvelink8.2 Pinch Valve Perfusion System | Automate Scientific | 17-pp-54 | |
| Xylazine | Anased | NADA# 139-236 |
Referencias
- Krimm, R. F. Factors that regulate embryonic gustatory development. BMC Neuroscience. 8, Suppl 3 4(2007).
- Taruno, A., Matsumoto, I., Ma, Z., Marambaud, P., Foskett, J. K. How do taste cells lacking synapses mediate neurotransmission? CALHM1, a voltage-gated ATP channel. Bioessays. (35), 1111-1118 (2013).
- Taruno, A., et al. Taste transduction and channel synapses in taste buds. Pflugers Archiv-European Journal of Physiology. 473, 3-13 (2021).
- Kinnamon, S. C., Finger, T. E. A taste for ATP: neurotransmission in taste buds. Frontiers in Cell Neuroscience. 7, 264(2013).
- Chandrashekar, J., Hoon, M. A., Ryba, N. J., Zuker, C. S. The receptors and cells for mammalian taste. Nature. 444 (7117), 288-294 (2006).
- Yarmolinsky, D. A., Zuker, C. S., Ryba, N. J. Common sense about taste: from mammals to insects. Cell. 139 (2), 234-244 (2009).
- Ninomiya, Y., Tonosaki, K., Funakoshi, M. Gustatory neural response in the mouse. Brain Research. 244 (2), 370-373 (1982).
- Formaker, B. K., MacKinnon, B. I., Hettinger, T. P., Frank, M. E. Opponent effects of quinine and sucrose on single fiber taste responses of the chorda tympani nerve. Brain Research. 772 (1-2), 239-242 (1997).
- Frank, M. The classification of mammalian afferent taste nerve fibers. Chemical Senses. 1 (1), 53-60 (1974).
- Ogawa, H., Yamashita, S., Sato, M. Variation in gustatory nerve fiber discharge pattern with change in stimulus concentration and quality. Journal of Neurophysiology. 37 (3), 443-457 (1974).
- Sollars, S. I., Hill, D. L. In vivo recordings from rat geniculate ganglia: taste response properties of individual greater superficial petrosal and chorda tympani neurones. Journal of Physiology. 564, Pt 3 877-893 (2005).
- Yokota, Y., Bradley, R. M. Geniculate ganglion neurons are multimodal and variable in receptive field characteristics. Neuroscience. 367, 147-158 (2017).
- Breza, J. M., Curtis, K. S., Contreras, R. J. Temperature modulates taste responsiveness and stimulates gustatory neurons in the rat geniculate ganglion. Journal of Neurophysiology. 95 (2), 674-685 (2006).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits: A decade of progress. Neuron. 98 (4), 865(2018).
- Barreto, R. P. J., et al. The neural representation of taste quality at the periphery. Nature. 517, 373-376 (2015).
- Wu, A., Dvoryanchikov, G. Live animal calcium imaging of the geniculate ganglion. Protocol Exchange. , 106(2015).
- Lee, H., Macpherson, L. J., Parada, C. A., Zuker, C. S., Ryba, N. J. P. Rewiring the taste system. Nature. 548 (7667), 330-333 (2017).
- Dana, H., et al. High-performance calcium sensors for imaging activity in neuronal populations and microcompartments. Nature Methods. 16 (7), 649-657 (2019).
- Wu, A., Dvoryanchikov, G., Pereira, E., Chaudhari, N., Roper, S. D. Breadth of tuning in taste afferent neurons varies with stimulus strength. Nature Communications. 6, 8171(2015).
- Yarmolinsky, D. A., et al. Coding and plasticity in the mammalian thermosensory system. Neuron. 92 (5), 1079-1092 (2016).
- Li, K. The image stabilizer plugin for ImageJ. , Available from: http://www.cs.cmu.edu/~ kangli/code/Image_Stabilizer. html (2008).
- Ackman, J. dF Over F movie ImageJ Plugin. , Available from: https://gist.github.com/ackman678/5817461 (2014).
- Cantu, D. A., et al. EZcalcium: Open-source toolbox for analysis of calcium imaging data. Frontiers in Neural Circuits. 14, 25(2020).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, (2019).
- Zhang, J., et al. Sour sensing from the tongue to the brain. Cell. 179 (2), 392-402 (2019).
- Lee, D., Kume, M., Holy, T. E. A molecular logic of sensory coding revealed by optical tagging of physiologically-defined neuronal types. bioRxiv. , 692079(2019).
- Moeyaert, B., et al. Improved methods for marking active neuron populations. Nature Communication. 9 (1), 4440(2018).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados