Method Article
Preparación de la rejilla microscópica crio-electrónica para estudios resueltos en el tiempo utilizando un nuevo sistema robótico, Spotiton
En este artículo
Resumen
El protocolo presentado aquí describe el uso de Spotiton, un novedoso sistema robótico, para entregar dos muestras de interés en una rejilla de nanocables auto-absorbentes que se mezclan durante un mínimo de 90 ms antes de la vitrificación en criógeno líquido.
Resumen
La captura de estados moleculares de corta duración desencadenados por el encuentro temprano de dos o más partículas que interactúan sigue siendo un desafío experimental de gran interés para el campo de la crio-microscopía electrónica (crio-EM). Se han desarrollado algunas estrategias metodológicas que apoyan estos estudios "resueltos en el tiempo", uno de los cuales, Spotiton, un novedoso sistema robótico, combina la dispensación de gotas de muestra del tamaño de un picolitro con un control temporal y espacial preciso. El flujo de trabajo de Spotiton resuelto en el tiempo ofrece un enfoque excepcionalmente eficiente para interrogar los primeros reordenamientos estructurales a partir de un volumen mínimo de muestra. Disparadas desde dispensadores piezoeléctricos controlados de forma independiente, dos muestras aterrizan y se mezclan rápidamente en una rejilla EM de nanocables a medida que se sumerge hacia el criógeno. Potencialmente, cientos de rejillas se pueden preparar en rápida sucesión a partir de solo unos pocos microlitros de una muestra. Aquí, se presenta un protocolo detallado paso a paso del funcionamiento del sistema Spotiton con un enfoque en la solución de problemas específicos que surgen durante la preparación de la red.
Introducción
El potencial de crio-EM para capturar y revelar estados conformacionales transitorios de proteínas en la escala de tiempo inferior a un segundo (crio-EM resuelto en el tiempo) ha sido realizado por varios grupos, comenzando con Berriman y Unwin1, cuya técnica se basó en el método estándar de congelación por inmersión desarrollado por Dubochet para preparar rejillas crio-EM2. Agregaron un atomizador justo encima de la copa criogénica que usaba gas nitrógeno comprimido para rociar una niebla fina de una segunda muestra en una rejilla EM que contenía una primera muestra que se había aplicado y borrado a una capa acuosa delgada. Aunque este sistema podía lograr tiempos de mezcla tan bajos como 1 ms, todavía exigía el borrado manual de la primera muestra por parte del usuario, una tarea técnicamente desafiante, y un volumen relativamente alto de la segunda muestra. Además, en la práctica, era difícil saber dónde se había producido la mezcla de las dos muestras, lo que requería el uso de nanopartículas de ferritina como marcador fiduciario en la muestra mixta. Los esfuerzos posteriores de Howard White y sus compañeros de trabajo mejoraron el control y la reproducibilidad de este enfoque de pulverización-mezcla al incorporar el control por computadora de los pasos de secado y pulverización3,4. Para abordar qué tan bien y dónde se mezclan las muestras, el mismo grupo5 y otros6,7,8,9,10 se han movido a un enfoque de mezcla-pulverización11 en el que dos muestras se mezclan en tubos capilares estrechos bajo la presión de bombas de jeringa o en chips microfabricados y microfluídicos impulsados por gas nitrógeno. Estos sistemas de premezcla no solo garantizan una mezcla completa, sino que también permiten el ajuste fino de los tiempos de mezcla para aumentar la resolución de los estudios resueltos en el tiempo.
La introducción de dispensadores piezoeléctricos como una forma alternativa de aplicar muestras a las rejillas EM en el sistema Spotiton permitió tanto la orientación precisa de la deposición de la muestra como el requisito de un volumen de muestra mucho más pequeño para hacer una rejilla12. Más tarde, el uso de rejillas de nanocables y la aplicación de muestra en ruta (detección "sobre la marcha") eliminó la necesidad de un paso de borrado y redujo los tiempos de aplicación a vitrificación13,14. Para el nuevo enfoque de crio-EM resuelto en el tiempo descrito aquí, se agregó un segundo dispensador junto con las actualizaciones necesarias de hardware y software de control al sistema Spotiton para permitir la entrega de una segunda muestra en una rejilla de nanocables en movimiento casi inmediatamente después de la deposición de los primeros15. Las dos muestras superpuestas se mezclan en la rejilla, ya que son perversas por los nanocables en una capa acuosa delgada antes de la vitrificación. Se pueden lograr tiempos de mezcla tan bajos como 90 ms. Este protocolo tiene la intención de proporcionar información práctica sobre cómo llevar a cabo experimentos resueltos en el tiempo utilizando la dispensación piezoeléctrica y las rejillas de nanocables. Además, a medida que el hardware y el software se modifican para mejorar la facilidad de uso, la coherencia y el rendimiento, este protocolo también sirve como una descripción actualizada del método15informado anteriormente.
Protocolo
1. Configure la máquina y el software Spotiton
- Preparar el sistema a dispensar (Figura 1).
- Abra la válvula principal del tanque de suministro de nitrógeno. Asegúrese de que el depósito del sistema esté lleno de agua desgasificado y ultrapura. Encienda el equipo. Encienda el sistema Spotiton en la tira de potencia multisalida.
- Haga clic en el icono del escritorio (Figura 2A) para abrir la interfaz de usuario (UI) del software Spotiton (Figura 2B). En el menú Herramientas, seleccione Inicializar etapas para inicializar y alojar los robots de 3 ejes (etapa de cuadrícula y etapa de pipeta) y el conjunto de cabezal de dispensador giratorio (etapa theta). Asegúrese de que las puntas del dispensador apunte hacia abajo antes de la inicialización y el homing.
- En la ventana principal, haga clic en Ir a SafePosition para enviar los robots a SafePosition (Figura 3).
NOTA: El traslado a SafePosition se puede hacer con robots en cualquier posición sin riesgo de colisión. - En la pestaña Aspirar, seleccione Prime para enjuagar los cabezales del dispensador varias veces con agua del depósito. Continúe hasta que se puedan ver corrientes ininterrumpidas de agua emergiendo de las dos puntas.
NOTA: Es posible que sea necesario repetir esto si un volumen significativo de aire entró en las líneas de fluido cuando las puntas se enjuagaron con metanol en el último apagado.
- Inspeccionar el rendimiento del dispensador
- En la pestaña Inspeccionar, envíe cada punta a la cámara de inspección para probar el agua de fuego y hacer coincidir el patrón de producción de gotas de los dos dispensadores(Figura S1).
NOTA: Si una punta no se dispara debido a una burbuja (Figura S2A) o escombros, limpie las puntas en la estación de lavado (Figura S2B) utilizando la función de lavado ultrasónico a la que se accede en la pestaña Aspirar. - Ajuste la amplitud de cocción (sin unidad) para cada dispensador y muestra para lograr un flujo de gotas discretas de tamaño constante.
- Confirme visualmente la producción de gotas equivalentes por parte de los dos dispensadores.
- Presione el botón Grabar en el monitor superior de la cámara para grabar un video de la punta 1 disparando. Reproduzca el video de tip 1 disparando en el monitor del lado derecho al mismo tiempo que el tip 2 se dispara en el monitor superior de la cámara(Figura S1).
NOTA: Los videos de cada disparo de punta se graban y almacenan.
- Presione el botón Grabar en el monitor superior de la cámara para grabar un video de la punta 1 disparando. Reproduzca el video de tip 1 disparando en el monitor del lado derecho al mismo tiempo que el tip 2 se dispara en el monitor superior de la cámara(Figura S1).
- Los dispensadores ahora están listos para probar el fuego en una rejilla.
NOTA: Este protocolo asume que se ha verificado la alineación correcta de las etapas de rejilla y pipeta en sus respectivas posiciones de hundimiento. Si no se confirma la alineación correcta, podría resultar en una colisión, dañando las puntas o los robots.
- En la pestaña Inspeccionar, envíe cada punta a la cámara de inspección para probar el agua de fuego y hacer coincidir el patrón de producción de gotas de los dos dispensadores(Figura S1).
- Pruebe el agua en una rejilla.
- Asegúrese de que los robots estén en la posición segura.
- Retire las pinzas del soporte del robot de rejilla con la llave Allen suministrada.
- En un banco cercano, coloque una rejilla de prueba, con el lado de nanocables hacia arriba, en el borde del bloque de rejilla. Agarre con cuidado el borde de la rejilla, colóquelo correctamente en las pinzas(Figura S3)y vuelva a montar las pinzas.
- En la pestaña Cryo, haga clic en Sugerencia a la cámara para mover las puntas al campo de visión de la cámara de trayectoria de inmersión superior(cámara superior). Asegúrese de que Live esté seleccionado en el monitor superior de la cámara y que la luz superior de la cámara esté encendida (marque en la parte frontal del gabinete de la máquina (Figura 1).
- Monte las pinzas en el robot de rejilla. Sugerencia de posición 1, visible en el monitor superior de la cámara, haciendo clic con el ratón dentro del monitor.
NOTA: Solo el Consejo 1 será visible y se moverá a la ubicación del clic. - Haga clic en Cuadrícula a cámara para colocar la cuadrícula delante de la cámara superior. Ajuste la posición de tip 1 como antes, si es necesario.
- Elija Tip1, Tip2o Tip1 y Tip2 para seleccionar uno o ambos dispensadores para probar el fuego.
NOTA: Cuando pruebe el disparo de las puntas individualmente, use el mouse para colocar la punta 1 en el monitor superior de la cámara en diferentes ubicaciones laterales de la cuadrícula. Esto depositará rayas líquidas de las dos puntas en un patrón no superpuesto y permitirá al usuario confirmar que cada punta se ha disparado. - En la pestaña Cryo, asegúrese de que Vitrify Grid no esté seleccionado, haga clic en Destino de colay luego en Plunge.
NOTA: La etapa de pipeta aumentará ligeramente, seguida de la etapa de cuadrícula. El robot de rejilla luego sumerge la rejilla más allá de los dispensadores de disparo y las cámaras superiores e inferiores, llegando a descansar justo encima de la cubierta. Una captura de imagen de la cámara superior aparece encima de una captura de imagen de la cámara inferior en el lado izquierdo de la interfaz de usuario. - Evalúe las imágenes superior e inferior: ¿Se disparó cada punta cuando se seleccionó? Cuando se disparan juntos, ¿el líquido de las dos puntas se superpone completamente, creando una franja notablemente más gruesa que cuando se dispara individualmente?
- Si alguna de las puntas no se disparó, realice uno o varios ciclos de lavado ultrasónico hasta que se observe una cocción clara.
- Si las rayas de muestra no se superponen completamente, ajuste la alineación lateral de uno de los dispensadores con una llave Allen para girar el tornillo de ajuste lateral en uno de los dispensadores un cuarto de vuelta y realice una inmersión de prueba. Repita hasta que las rayas se superpongan por completo.
NOTA: Si ambas puntas se dispararon con éxito y como se esperaba, el sistema está listo para preparar cuadrículas de muestra.
2. Prepare cuadrículas mixtas de dos muestras
- Actualice los valores de aceleración, desaceleración y velocidad en el archivo XML Parámetros del equipo para alcanzar el tiempo de mezcla de interés.
NOTA: Las tablas que correlacionan estos valores con los tiempos de mezcla se han reportado previamente15. - Prepara la muestra y las rejillas.
NOTA: A partir de este punto del protocolo, transcurren 20-30 minutos antes de que se prepare la primera rejilla, y las muestras deben mantenerse a una temperatura adecuada durante este intervalo de tiempo.- Diluya dos muestras (es decir, proteína y ligando u otro compañero que interactúe) a las concentraciones deseadas con un tampón apropiado, idealmente, el mismo para ambos.
NOTA: Las rejillas Spotiton requieren concentraciones de proteínas 1.5-2 veces más altas que las que normalmente se usan para los congeladores automáticos. Esto puede deberse al tiempo mínimo que la proteína pasa en una capa acuosa delgada en la superficie de la rejilla durante una inmersión, lo que brinda a las partículas menos oportunidades de concentrarse en la interfaz aire-agua. - Llene el recipiente de criógenos con nitrógeno líquido.
- Plasma limpia 3-4 rejillas de nanocables. Utilizar 5 W, hidrógeno y oxígeno, 1,5 min como punto de partida.
NOTA: La duración y la receta de limpieza con plasma más efectivas pueden cambiar de un día a otro según la temperatura y la humedad ambiente y el lote de rejillas de nanocables utilizadas. Las mezclas de gases alternativas o un descargador de resplandor también pueden ser efectivos, pero no han sido probados para este propósito. Como el agua y la proteína en la solución tampón a menudo son perversas a diferentes velocidades por nanocables, es una buena práctica evaluar la absorción de las rejillas que se utilizarán ese día en una inmersión en la que se dispensa la muestra real.
- Diluya dos muestras (es decir, proteína y ligando u otro compañero que interactúe) a las concentraciones deseadas con un tampón apropiado, idealmente, el mismo para ambos.
- Establezca el nivel de humedad en el sistema.
NOTA: Además de las condiciones utilizadas para hacer y limpiar con plasma las rejillas, la humedad es otro factor principal que afecta la velocidad de absorción de las rejillas de nanocables. Aunque el porcentaje de humedad objetivo para una sesión en particular se determina empíricamente para cada día y lote de rejillas, 90-95% es un buen punto de partida.- Asegúrese de que el nebulizador esté suficientemente lleno de agua ultrapura. Conecte el nebulizador y observe la salida de vapor del puerto central de la tapa del nebulizador.
- Observe el monitor de humedad en vivo en la ventana principal o abra el rastreador de humedad ambiental en Informes | Ambiente (Figura S4). Compruebe los niveles de humedad en las dos zonas: Cámara y Sudario.
NOTA: La cámara incluye todas las áreas dentro del recinto de Spotiton. El sudario es el área que abarca inmediatamente las posiciones "en la cámara" de la rejilla y las puntas del dispensador. La cubierta de resina negra mantiene el nivel de humedad establecido cuando se abren las puertas del recinto para cargar una rejilla. - Una vez que se alcancen los valores de humedad objetivo, mantenga estos valores de forma automática o manual desde la pestaña Humedad. Seleccione Control automáticoy elija un punto de consigna y un umbral para mantener el punto de consigna dentro del límite de umbral elegido. Alternativamente, seleccione Control manualy ajuste el nivel de humedad utilizando los dos controles del ventilador: ventilador de cámara y ventilador de cubierta.
NOTA: Encender el ventilador de la cámara extrae el vapor a través de un filtro en el puerto izquierdo y evita que las gotas de agua más grandes entren en la cámara, evitando un mayor aumento de la humedad ambiental. Mientras las puertas de la cámara permanezcan cerradas, el nivel de humedad se estabilizará en el porcentaje deseado. Al encender el ventilador de la cubierta, se tira del vapor a través del puerto derecho hacia la cubierta. Esto reduce la liberación de vapor en la cámara y aumenta el nivel de humedad dentro de la cubierta.
- Cargue la muestra en los dispensadores.
- Añadir 5 μL de cada muestra en las tazas de muestra.
NOTA: Para evitar la introducción de burbujas, dispense el volumen con mucho cuidado en la pared lateral interior de la taza, luego agite para forzar la muestra al fondo de la taza. - Cargue las tazas de muestra en la bandeja de retención, la muestra para la punta 1 a la izquierda, para la punta 2 a la derecha. Empuje la bandeja hacia atrás en la máquina hasta que se asiento.
- En la pestaña Aspirar, seleccione 3 μL para el volumen que aspira cada punta. Asegúrese de que la bandeja de muestras se haya asentado de forma segura, luego haga clic en Aspirar y observe cómo la etapa de pipeta mueve los cabezales del dispensador hacia las tazas de muestra.
- Verifique la aspiración exitosa de ambas muestras retirando las tazas de muestra y observando una caída en el nivel de líquido.
- En la pestaña Inspeccionar, envíe cada punta a la cámara de inspección para confirmar la dispensación sin obstáculos. Ajuste la amplitud según sea necesario para que coincida con la formación de gotas de cada punta (ver sección 1.2).
NOTA: Es probable que sea necesario aumentar la amplitud para la punta que dispensa la muestra de proteína. - El sistema ya está listo para preparar una cuadrícula de muestra.
- Añadir 5 μL de cada muestra en las tazas de muestra.
- Congelar cuadrículas de muestra
- Cargue una rejilla recién limpiada con plasma en las pinzas, pero aún no monte las pinzas. Asegúrese de que el nivel de humedad sea elevado, ~ 90-95%. Llene la taza de etano.
- Realice una prueba de fuego final de ambas puntas frente a la cámara de inspección, confirmando que no hay obstrucción. En la pestaña Cryo, haga clic en Consejo para la cámara.
- Llene la taza de etano. Si se forma hielo de etano, derría según sea necesario con gas etano adicional.
NOTA: Los pasos 2.5.4 y 2.5.5 deben completarse con relativa rapidez (<20 s) para minimizar (i) la saturación de los nanocables en la alta humedad de la cámara y (ii) la probabilidad de que la punta que dispara la muestra de proteína se obstruya. - Monte las pinzas con la rejilla en el escenario de la rejilla. En la pestaña Cryo, haga clic en Cuadrícula a la cámara. Asegúrese de que la sugerencia 1 esté colocada correctamente en el monitor superior de la cámara (consulte los pasos 1.3.4-1.3.5).
- Haga clic en Vitrify Grid, Queue Target,luego Plunge. Haga clic en Aceptar cuando se le pida que ordene al robot de rejilla que salte la rejilla del etano al nitrógeno líquido y la suelte en el estante sumergido.
NOTA: Las pinzas luego se elevan de nuevo a la cámara. Después del salto al nitrógeno líquido, aparece un mensaje preguntando si la rejilla cayó de las pinzas. Si no se cae, haga clic en No, y las pinzas se abrirán y cerrarán varias veces para separar la cuadrícula. - Examine las imágenes de la cuadrícula (Figura S5) para decidir si debe conservarse o descartarse.
- Si mantiene la rejilla, transfiérala a la caja de rejilla preenfriada. Alternativamente, detecte las rejillas posteriores y luego transfiera todas las cuadrículas a la vez a la caja de cuadrícula, teniendo cuidado de que cada cuadrícula se pueda identificar por su posición en el área de descanso.
- Para transferir la rejilla a una caja de rejilla, enfríe previamente las torzas de punta fina, agarre suavemente la rejilla por el borde y colóquela en una ranura de caja de rejilla, comenzando con la primera ranura a la izquierda de la muesca en el sentido de las agujas del reloj.
- Cuando todas las rejillas estén cargadas, conecte la tapa de la caja de rejilla a la herramienta de la tapa y enfrie en nitrógeno líquido. Atornille la tapa a la caja de rejilla y apriete con una herramienta de tapa o un destornillador preenfriado.
- Use forróceps grandes para transferir rápidamente la caja de rejilla cerrada a un pequeño dewar para obtener imágenes o almacenamiento a largo plazo.
- Evalúe la idoneidad de la cuadrícula para las imágenes EM aguas abajo.
- Observe las imágenes de las cámaras de ruta de inmersión superior e inferior que se muestran en el lado izquierdo de la interfaz de usuario inmediatamente después de que se sumerge una cuadrícula. Utilice estas imágenes para evaluar la velocidad de absorción, el disparo exitoso de ambas puntas y el grado de superposición de las dos franjas de muestra.
- Revise y compare las imágenes de cuadrícula de las cámaras superior e inferior junto con la configuración de la máquina y las mediciones de humedad en el momento de la inmersión utilizando el visor de experimentos: Informes | Experimento.
- Seleccione rejillas para obtener imágenes en el microscopio electrónico que demuestren evidencia de buena absorción.
Resultados
La Figura 4 muestra imágenes de rejillas preparadas durante una sola sesión de Spotiton resuelta en el tiempo mezclando ARN polimerasa y un oligómero de ADN de 105 pb que lleva una secuencia promotora durante 150 ms antes de la vitrificación15. En la figura se ven imágenes tomadas por las dos cámaras de alta velocidad de seis cuadrículas en dos puntos de tiempo después de la aplicación de muestra. Estas cámaras, únicas entre los congeladores de estilo inmersión, permiten al usuario decidir inmediatamente si mantener o descartar una rejilla en función del grado observado de absorción por los nanocables y la probabilidad de que las muestras líquidas se extraigan en una capa acuosa lo suficientemente delgada como para obtener imágenes EM. Aunque una sola cuadrícula puede proporcionar suficiente hielo para un conjunto de datos completo, una vez que se han logrado las condiciones óptimas, varias rejillas están preparadas para mantenerse a mano en caso de que una o más se pierdan o se contaminen. De las seis cuadrículas preparadas en esta sesión, las capturas de imagen muestran solo una con absorción subóptima(Figura 4F).
Las cuadrículas mostradas se prepararon (pasos 2.5.1 a 2.5.8) sucesivamente durante un período de 40 minutos después de una hora para preparar las muestras y la máquina como se describe en el protocolo (pasos 1.1.1 a 2.4.6). De las seis cuadrículas, dos se utilizaron para la recopilación de datos, y el resto se guardó para su posterior análisis si fuera necesario. El patrón de hielo en una rejilla vitrificada(Figura 5C)coincide estrechamente con el patrón de líquido depositado que se ve en la imagen superior de la cámara(Figura 5B). La absorción efectiva de las muestras mixtas, que se hace evidente por la falta de una franja líquida visible en la imagen inferior de la cámara(Figura 5A),ocurre a lo largo de las barras de rejilla cubiertas de nanocables, y la muestra rara vez se desborda en cuadrados adyacentes a aquellos en los que aterrizó. Dentro de los cuadrados llenos de hielo, el hielo es típicamente más grueso dentro de los agujeros en el centro del cuadrado y se vuelve más delgado en los agujeros más cercanos a las barras de la rejilla(Figura 5E). A menudo, los agujeros inmediatamente adyacentes a las barras de la rejilla están vacíos debido a la proximidad a los nanocables(Figura 5F).

Figura 1: El sistema Spotiton resuelto en el tiempo. 1. Estación de trabajo del operador; 2. Cámara ambiental; 3. Suministro de nitrógeno; 4. Suministro de etano 5. Control de retroiluminación para la cámara de trayectoria de inmersión superior 6. Controladores de dispensadores piezoeléctricos; 7. Bombas de jeringa; 8. Bomba de vacío; 9. Lave el suministro de agua y las botellas de desecho. Haga clic aquí para ver una versión más grande de esta figura.
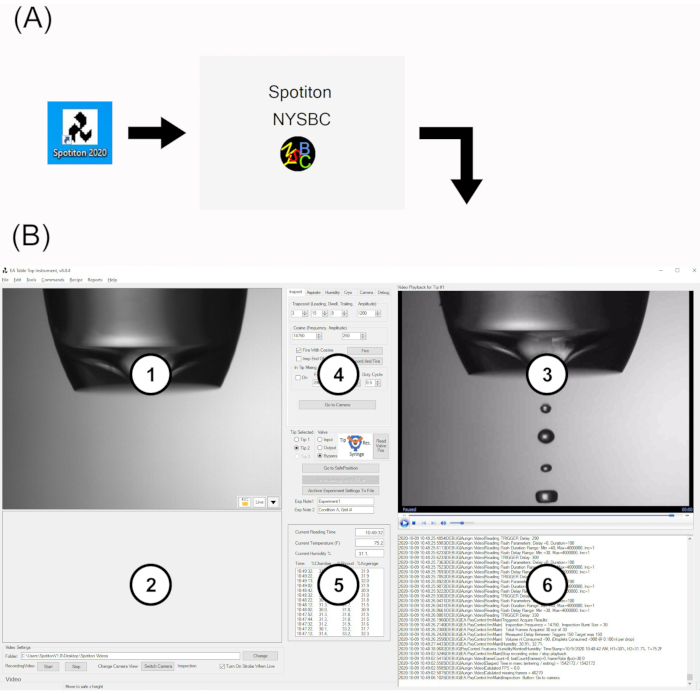
Figura 2: Interfaz de usuario del software Spotiton. (A) Icono de escritorio y pantalla de presentación. (B) La interfaz de usuario principal se compone de seis áreas: 1. área de visualización para la trayectoria de inmersión superior ("superior") y cámaras de inspección de punta; 2. área de visualización para la cámara de trayectoria de inmersión inferior ("inferior"); 3. Área de reproducción para videos de inspección de puntas; 4. Área de pestaña multifunción; 5. Monitor de humedad en vivo; 6. Archivo de registro del sistema en vivo. Abreviatura: UI = interfaz de usuario. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Vista interior de la cámara Spotiton (robots en SafePosition). 1. Robot de cuadrícula (rojo); 2. Robot dispensador (amarillo); 3. Cámara de trayectoria de inmersión superior (rosa); 4. Cámara de trayectoria de inmersión inferior (azul claro); 5. Cámara de inspección de punta (naranja); 6. Cubierta de humedad (verde); 7. bandeja de muestra; 8. Conjunto del nebulizador (azul oscuro); 9. Sistema de embalse y líneas de agua. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Imágenes representativas de la cámara del sistema de una sesión de creación de cuadrícula de Spotiton resuelta en el tiempo. (A -F) Imágenes de cámara de trayectoria de inmersión superior (izquierda) e inferior (derecha) de seis rejillas sobre las que se aplicó ARN polimerasa y una secuencia de ADN promotor utilizando Spotiton. Barra de escala = 500 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Patrón de deposición de hielo en una rejilla preparada por Spotiton. Partes de las imágenes de la cámara (A) inferior y (B) superior y (C) atlas de la cuadrícula que se muestra en la Figura 4F. Las ubicaciones aproximadas del hielo resultantes de la deposición y mezcla de la muestra son de color lavanda. Las áreas dentro del cuadrado marcadas con una punta de flecha amarilla se imaginan en (E-G). La región que se muestra en (E) se recuadro en amarillo en (D). Cuadrado representativo (E), agujero (F) y (G) imágenes de exposición recogidas de la cuadrícula que se muestra en (A-D). Las áreas en caja en las imágenes cuadradas y de agujero corresponden a las imágenes de agujero y exposición, respectivamente. Barras de escala = 100 μm (A-D), 5 μm (E), 2 μm (F), 100 nm (G). Haga clic aquí para ver una versión más grande de esta figura.
Figura S1: Inspección del disparo de la punta. Una vista en vivo del disparo de Tip 2 se ve en el monitor superior de la cámara a la izquierda de la interfaz de usuario, mientras que una grabación realizada anteriormente del disparo de Tip 1 se reproduce en un bucle para su comparación en el área de reproducción de video a la derecha. Haga clic aquí para descargar este archivo.
Figura S2: Limpieza ultrasónica de las puntas del dispensador. Una burbuja de aire en la punta(A)interrumpirá la formación de gotas y evitará el disparo de la punta. (B) Puntas sumergidas en agua en la estación de limpieza ultrasónica para eliminar una burbuja de aire o proteína seca clara que bloquea el orificio de la punta. Haga clic aquí para descargar este archivo.
Figura S3: Rejilla de carga en pinzas. (A) Una rejilla colocada de lado nanocable hacia arriba en el borde del bloque de rejilla. (B) Una rejilla colocada correctamente en las pinzas de cierre propio. Haga clic aquí para descargar este archivo.
Figura S4: Rastreador de humedad. El porcentaje de humedad relativa en la cámara (azul oscuro) y la cubierta (azul claro) registrado durante una sesión típica de creación de rejillas. Los tiempos de las caídas de la cuadrícula (cuadrados verdes) se trazan en el gráfico. Haga clic aquí para descargar este archivo.
Figura S5: Absorción en rejillas de nanocables durante una inmersión. Imágenes representativas de la cámara de trayectoria de inmersión superior (A, C, E) e inferior (B, D, F) de absorción en rejillas de nanocables que es demasiado lenta (A, B), ideal (C, D) y demasiado rápida (E, F). Un ligero engrosamiento (puntas de flecha blancas) indica barras de rejilla con nanocables que han sido saturadas por la muestra. Los cuadrados en estas regiones generalmente contienen hielo de espesor apropiado para imágenes microscópicas electrónicas. Barra de escala = 500 μm. Haga clic aquí para descargar este archivo.
Discusión
Este protocolo describe el uso del sistema robótico Spotiton para preparar rejillas para imágenes crio-EM que llevan dos muestras, generalmente una proteína de interés y un ligando activador, que se han mezclado durante 90-500 ms. Aunque el flujo de trabajo es sencillo, hay algunas consideraciones que el usuario debe tener en cuenta para garantizar una sesión productiva de creación de redes. En primer lugar, no es raro que una de las puntas del dispensador piezoeléctrico se obstruya o bloquee impidiendo que se dispare. Tal falla resultará en una franja líquida, vista en las capturas de imágenes de la cámara superior o inferior, que es visiblemente más estrecha que la que se ve después de que ambas puntas se dispararon. Un bloqueo podría ser el resultado de un alojamiento de burbujas de aire en la punta, interrumpiendo la formación de gotas, o de una muestra de proteína que se ha secado y sellado el orificio estrecho de la punta. Aunque la muestra aspirada se pierde en el proceso, ambos problemas se pueden resolver mediante un lavado ultrasónico de las puntas y una nueva aspiración de la muestra. Para evitar la obstrucción posterior y el desperdicio de muestras, es crucial cebar (enjuagar) a fondo las líneas de fluido antes de la aspiración de la muestra y mantener un nivel de humedad alto y constante dentro de la cámara y el sudario. Además, una muestra de proteína con una concentración particularmente alta puede afectar la cocción de la punta a pesar de la humedad bien mantenida. Aunque el aumento de la amplitud de cocción en la pestaña Inspect puede compensar parcialmente la cocción débil debido a la alta concentración de proteínas, diluir la muestra al menos 1: 2 mejorará el disparo de la punta y evitará la obstrucción.
En segundo lugar, puede ser difícil lograr la velocidad de absorción ideal que se necesita para generar hielo de espesor óptimo para la duración de mezcla objetivo. En general, los tiempos de mezcla más rápidos requerirán una absorción más rápida, los tiempos de mezcla más lentos requerirán una absorción más lenta. Para la rejilla idealmente malvada, una franja líquida es claramente discernible en la imagen superior de la cámara, mientras que en la cámara inferior, solo queda visible un engrosamiento muy leve de las barras de la rejilla en la ubicación de la raya. La absorción lenta, indicada por una franja oscura en la imagen inferior de la cámara, generalmente deja hielo que es demasiado grueso para la obtención de imágenes. La ausencia de una raya en cualquiera de las imágenes indica una absorción rápida que puede no haber dejado agua en los orificios(Figura S5). Varios factores, como la densidad de nanocables, la configuración y la duración de la limpieza del plasma, y el tiempo de exposición y el nivel establecido de humedad de la cámara pueden afectar la velocidad de absorción. La absorción deficiente (lenta) puede ser el resultado de un recubrimiento escaso de nanocables en la rejilla. Al diluir ligeramente y aumentar el tiempo de exposición a la solución de nanocables16,la densidad y la cobertura de los nanocables en las barras de la rejilla aumentarán, facilitando una absorción más rápida. Si la densidad de nanocables es suficiente, aumentar el ajuste de vatios o la duración de la limpieza con plasma también mejorará la absorción. La configuración recomendada aquí es relativamente baja y de larga duración, pero se puede cambiar si es necesario.
Sin embargo, si tanto el lote específico de rejillas como los ajustes de limpieza por plasma han funcionado bien en una sesión anterior, el rendimiento de absorción lento puede surgir de la exposición excesiva de los nanocables a la alta humedad dentro de la cámara, lo que lleva a su saturación con humedad y una capacidad reducida de retención de líquidos. El efecto de saturación de la rejilla de la humedad de la cámara se puede reducir minimizando el tiempo transcurrido entre el montaje de la pinza y la caída de la rejilla o disminuyendo el nivel de humedad del sistema antes de una inmersión. Cabe señalar, sin embargo, que este último conlleva el riesgo asociado de que la punta cargada con muestra de proteína se obstruya. Para compensar este riesgo, mantener las puntas en la cubierta donde se mantiene un alto nivel de humedad, puede aumentar la cantidad permitida de tiempo para montar pinzas que sostienen una nueva rejilla. Finalmente, debe tenerse en cuenta que un tiempo de inmersión reducido (logrado al aumentar la aceleración de la red y / o la velocidad máxima) puede resultar en rejillas con hielo más delgado sin cambiar realmente las características de absorción de la rejilla. Sin embargo, como el tiempo de mezcla de las dos muestras también se reducirá, el tiempo de inmersión no es un factor que generalmente se cambia para abordar la absorción lenta. Para abordar la absorción que es demasiado rápida, lo que resulta en hielo que es demasiado delgado o ausente en los orificios de la rejilla, se puede tomar lo contrario de las medidas descritas anteriormente.
Spotiton presenta ciertas ventajas y desventajas en comparación con otras técnicas desarrolladas para estudios de subsecón y tiempo resuelto. Como la franja de muestra mixta contiene solo 2-4 nL de líquido de cada dispensador, una sola alícuota de 3 μL de cada muestra es suficiente para preparar muchas rejillas, una ventaja clave cuando la muestra es limitada. Además, la observación de la deposición de muestras utilizando cámaras integradas, aunque no es del todo exclusiva de Spotiton17,no es una característica de otros dispositivos de mezcla y permite que las rejillas sumergidas se sometan a una evaluación cruda de aprobación / falla, lo que reduce en gran medida el tiempo de detección. Una desventaja clave del sistema es un tiempo mínimo de mezcla de 90 ms, restringido por las limitaciones físicas de los componentes mecánicos, que pone el interrogatorio de reacciones biológicas más rápidas fuera de su alcance. En comparación, se logran rutinariamente tiempos inferiores a 10 ms en los sistemas microfluídicos existentes. En el sistema camaleónico basado en Spotiton, disponible comercialmente, las mejoras de diseño y construcción han reducido el tiempo mínimo de inmersión a 54 ms y aumentan la posibilidad de que la adición de un segundo dispensador pueda permitir tiempos de mezcla más rápidos de lo que Spotiton puede ofrecer actualmente.
Hasta la fecha, se ha llevado a cabo una serie de experimentos para investigar estados moleculares tempranos y de corta duración utilizando Spotiton, incluido el ensamblaje del ribosoma 70S, los cambios conformacionales desencadenados por el calcio en un canal iónico transmembrana y la constricción de dinamina en respuesta a la hidrólisis GTP15. Desde la publicación de estos resultados, se han incorporado varios cambios al sistema para mejorar el rendimiento, la reproducibilidad y la presentación de informes de las sesiones de creación de cuadrículas de Spotiton. Estos incluyen, entre otros, el sistema de monitoreo y control automático de humedad de doble zona, la función de visor de experimentos, la función de inspección de puntas lado a lado y varias actualizaciones menores de la interfaz de usuario. El sistema mejorado apoyará mejor los futuros experimentos de mezcla de dos muestras similares a los reportados anteriormente, así como los ensayos de unión rápida, como entre una molécula pequeña terapéutica y su objetivo de proteína o incluso la formación de complejo anticuerpo-antígeno. Si bien los experimentos actuales y futuros resueltos en el tiempo que involucran a dos socios que interactúan ciertamente continuarán, la adición de un tercer dispensador piezoeléctrico y hardware asociado podría ampliar aún más la gama de posibles experimentos. Por ejemplo, la deposición inicial de un detergente seguida de la proteína de interés, seguida de la interacción o activación del ligando podría eliminar cualquier impacto negativo potencial de la exposición prolongada al detergente, a menudo necesaria para prevenir resultados de imagen subóptimos comunes, como la orientación preferida. A la luz tanto del trabajo ya publicado como de las posibles aplicaciones futuras, Spotiton representa una herramienta importante para la comunidad crio-EM para facilitar la realización de estudios de subsectores y resueltos en el tiempo.
Divulgaciones
B.C./C.S.P. tienen una relación comercial con SPT Labtech, una empresa que produce un instrumento disponible comercialmente, chameleon, que se basa en el prototipo Spotiton.
Agradecimientos
Nos gustaría agradecer a Peter A. Kahn y Terry Rohde en Engineering Arts LLC (Arizona, EE.UU.) por el diseño inicial y el posterior desarrollo del sistema Spotiton. Agradecemos al personal del Centro de Microscopía Electrónica Simons en el Centro de Biología Estructural de Nueva York por su ayuda y apoyo técnico. El trabajo presentado aquí se llevó a cabo en el Recurso Nacional de Microscopía Molecular Automatizada ubicado en el Centro de Biología Estructural de Nueva York, apoyado por subvenciones de los NIH (GM103310) y la Fundación Simons (SF349247).
Materiales
| Name | Company | Catalog Number | Comments |
| Buffer | N/A | N/A | |
| cryogenic grid storage boxes | EMS (Hatfield, PA; USA) | N/A | |
| Cu/Rh 300 mesh EM grids | EMS (Hatfield, PA; USA) | EMS300-Cu-Rh | treated to coat with nanowires as previously described (Wei et al, 2018) |
| ethane gas | TW Smith Corp. (Brooklyn, NY; USA) | N/A | |
| Grid-handling forceps | EMS (Hatfield, PA; USA) | 78320-5B | |
| liquid nitrogen | Airgas, Inc. (Radnor, PA; USA) | N/A | |
| liquid nitrogen reservoir with brass ethane cup (from FEI Vitrobot) | ThermoFisher Scientific (Waltham, MA; USA) | ||
| Picosystem | Hydro System and Supplies (Durham, NC; USA) | N/A | water purification system |
| Protein/other sample | N/A | N/A | |
| Solarus 950 plasma cleaner | Gatan, Inc. (Pleasanton, CA; USA) | N/A |
Referencias
- Berriman, J., Unwin, N. Analysis of transient structures by cryo-microscopy combined with rapid mixing of spray droplets. Ultramicroscopy. 56 (4), 241-252 (1994).
- Dubochet, J., McDowall, A. W. Vitrification of pure water for electron microscopy. Journal of microscopy. 124 (3), 3-4 (1981).
- White, H. D., Walker, M. L., Trinick, J. A computer-controlled spraying-freezing apparatus for millisecond time-resolution electron cryomicroscopy. Journal of Structural Biology. 121 (3), 306-313 (1998).
- White, H. D., Thirumurugan, K., Walker, M. L., Trinick, J. A second generation apparatus for time-resolved electron cryo-microscopy using stepper motors and electrospray. Journal of Structural Biology. 144 (1-2), 246-252 (2003).
- Kontziampasis, D., et al. A cryo-EM grid preparation device for time-resolved structural studies. IUCrJ. 6, 1024-1031 (2019).
- Lu, Z., et al. Gas-assisted annular microsprayer for sample preparation for time-resolved cryo-electron microscopy. Journal of Micromechanics and Microengineering: Structures, Devices, and Systems. 24 (11), 115001 (2014).
- Chen, B., et al. Structural dynamics of ribosome subunit association studied by mixing-spraying time-resolved cryogenic electron microscopy. Structure. 23 (6), 1097-1105 (2015).
- Kaledhonkar, S., et al. Late steps in bacterial translation initiation visualized using time-resolved cryo-EM. Nature. 570 (7761), 400-404 (2019).
- Fu, Z., et al. The structural basis for release-factor activation during translation termination revealed by time-resolved cryogenic electron microscopy. Nature Communications. 10 (1), 2579 (2019).
- Mäeots, M. -. E., et al. Modular microfluidics enables kinetic insight from time-resolved cryo-EM. Nature Communications. 11 (1), 3465 (2020).
- Kaledhonkar, S., Fu, Z., White, H., Frank, J. Time-resolved cryo-electron microscopy using a microfluidic chip. Methods in Molecular Biology. 1764, 59-71 (2018).
- Jain, T., Sheehan, P., Crum, J., Carragher, B., Potter, C. S. Spotiton: a prototype for an integrated inkjet dispense and vitrification system for cryo-TEM. Journal of Structural Biology. 179 (1), 68-75 (2012).
- Razinkov, I., et al. A new method for vitrifying samples for cryoEM. Journal of Structural Biology. 195 (2), 190-198 (2016).
- Dandey, V. P., et al. Spotiton: New features and applications. Journal of Structural Biology. 202 (2), 161-169 (2018).
- Dandey, V. P., et al. Time-resolved cryo-EM using Spotiton. Nature Methods. 17, 897-900 (2020).
- Wei, H., et al. Optimizing "self-wicking" nanowire grids. Journal of Structural Biology. 202 (2), 170-174 (2018).
- Ravelli, R. B. G., et al. Cryo-EM structures from sub-nl volumes using pin-printing and jet vitrification. Nature Communications. 11 (1), 2563 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados