Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Aislamiento de hepatocitos primarios de rata con control de perfusión multiparamétrico
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo detalla el uso de un catéter intravenoso especial, tubos desechables estériles estandarizados, control de temperatura complementado con monitoreo en tiempo real y un sistema de alarma para el procedimiento de perfusión de colagenasa de dos pasos para mejorar la consistencia en la viabilidad, el rendimiento y la funcionalidad de los hepatocitos primarios aislados de ratas.
Resumen
Los hepatocitos primarios son ampliamente utilizados en la investigación básica sobre enfermedades hepáticas y para pruebas de toxicidad in vitro. El procedimiento de perfusión de colagenasa de dos pasos para el aislamiento primario de hepatocitos es técnicamente desafiante, especialmente en la canulación de la vena porta. El procedimiento también es propenso a la contaminación ocasional y las variaciones en las condiciones de perfusión debido a dificultades en el montaje, la optimización o el mantenimiento de la configuración de perfusión. Aquí, se presenta un protocolo detallado para un procedimiento mejorado de perfusión de colagenasa de dos pasos con control de perfusión multiparamétrico. Los hepatocitos primarios de rata se aislaron de manera exitosa y confiable tomando las precauciones técnicas necesarias en los pasos críticos del procedimiento, y reduciendo la dificultad operativa y mitigando la variabilidad de los parámetros de perfusión a través de la adopción de un catéter intravenoso especial, tubos desechables estériles estandarizados, control de temperatura y monitoreo y sistema de alarma en tiempo real. Los hepatocitos primarios de rata aislados exhiben consistentemente una alta viabilidad celular (85% -95%), rendimiento (2-5 x 108 células por rata de 200-300 g) y funcionalidad (actividad de albúmina, urea y CYP). El procedimiento se complementó con un sistema de perfusión integrado, que es lo suficientemente compacto como para instalarse en la campana de flujo laminar para garantizar un funcionamiento aséptico.
Introducción
Los hepatocitos primarios son herramientas importantes para la investigación básica relacionada con el hígado, el tratamiento de enfermedades y la aplicación, como las pruebas de drogas. El estándar de oro actual para el aislamiento primario de hepatocitos es el procedimiento de perfusión de colagenasa de dos pasos 1,2,3 introducido por Seglen en la década de 19704. Sin embargo, este procedimiento es técnicamente desafiante y tiene una alta tasa de fracaso cuando es realizado por cirujanos novatos. Incluso cuando una perfusión se considera exitosa, se pueden observar diferencias drásticas en la viabilidad de los hepatocitos (típicamente 60%-95%) y el rendimiento (0.5-5 x 108 por 200-300 g de rata) entre los aislamientos. Esto influye en la calidad y la escala de los experimentos posteriores. Aparte del procedimiento técnico, la configuración de perfusión utilizada para el aislamiento, ya sea disponible comercialmente o hecha a medida, es un factor contribuyente. Se debe prestar atención al montaje, optimización y mantenimiento de la configuración de perfusión. El propósito de este protocolo es mejorar la tasa de éxito y la estabilidad entre los aislamientos de hepatocitos primarios de rata a través del control de perfusión multiparamétrico del procedimiento técnico y la configuración de perfusión del procedimiento de perfusión de colagenasa de dos pasos.
Desde el aspecto técnico, el paso más difícil en el procedimiento es la canulación de la vena porta. En cuanto a los otros pasos, si se observan buenas prácticas y se toman precauciones generales, se puede mejorar la estabilidad del aislamiento. Por lo tanto, la comprensión del razonamiento para cada paso es importante para que el cirujano pueda responder a varias variables que pueden ocurrir durante el procedimiento.
Se han publicado diversos protocolos para el aislamiento de hepatocitos y células hepáticas no parenquimatosas de rata y ratón 1,2,5,6,7,8,9. Las configuraciones de perfusión utilizadas en estos protocolos tenían varias desventajas, que incluyen la reutilización de tubos de perfusión, problemas con el control de la temperatura, la necesidad de optimización rutinaria de los parámetros de perfusión y / o el uso de un tipo inadecuado de catéter intravenoso (IV) para la canulación de la vena porta. La reutilización de los tubos de perfusión aumentará las posibilidades de contaminación, especialmente si los tubos no se limpiaron y desinfectaron adecuadamente. La reutilización de tubos sin reemplazo de rutina también expondrá la configuración de perfusión a problemas como tubos o conectores con fugas, trampa de burbujas obstruida y tubos constreñidos, todo lo cual reducirá sustancialmente la presión de perfuso y la tasa de flujo, lo que afectará la eficiencia de la digestión hepática. Sin una fuente de calor constante en algunas configuraciones para el control de la temperatura, los tampones precalentados se enfriarán con el tiempo, lo que provocará una baja actividad y digestión de la colagenasa. Aunque otras configuraciones utilizan un condensador de vidrio con camisa conectado a un circulador de agua para calentar el amortiguador, son voluminosas y requieren una limpieza cuidadosa. La temperatura, la presión y el caudal del tampón que sale del catéter deben medirse y optimizarse antes del inicio del aislamiento para garantizar una condición de perfusión estable. Incluso después de la optimización, los parámetros aún podrían cambiar a mitad de camino durante el aislamiento debido a las acciones del operador, lo que lleva a una perfusión y digestión subóptimas. La mayoría de los tipos de catéter intravenoso no son adecuados para la canulación de la vena porta porque no permiten la perfusión continua durante la canulación. No pueden informar inmediatamente al cirujano cuando la canulación es exitosa. Además, es difícil asegurar la vena porta en el catéter blando sin deformarla.
Aquí, abordamos estos problemas utilizando tubos estériles desechables estandarizados, una camisa de calentador de silicona para un control de temperatura preciso y estable, monitoreo en tiempo real y sistema de alarma con almacenamiento de datos y administración y uso de un catéter IV especial, que permite la perfusión continua mientras perfora la vena porta durante la canulación. Hasta donde sabemos, somos el primer grupo en combinar todas estas características en un sistema de perfusión integrado (IPS) que es compacto, lo que lo hace altamente portátil y capaz de caber en una campana de flujo laminar para garantizar un funcionamiento aséptico.
Protocolo
Todos los procedimientos y alojamientos de animales se llevaron a cabo bajo los números de protocolo R15-0027 y R19-0669 de acuerdo con los requisitos del Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad Nacional de Singapur.
1. Preparación de soluciones e instrumentos quirúrgicos
- Prepare tampones y medios de cultivo celular en la Tabla 1 utilizando agua ultrapura.
- Precaliente el tampón libre de calcio y el tampón de colagenasa a 37 °C en un baño de agua antes de usarlo.
- Autoclave los siguientes instrumentos quirúrgicos y equipos de laboratorio: un par de tijeras quirúrgicas afiladas-contundentes, un par de tijeras quirúrgicas contundentes-contundentes, un par de tijeras quirúrgicas curvas, dos pares de pinzas de tejido dental, dos pares de pinzas curvas, dos pinzas de venas, una sutura quirúrgica de seda 3-0 de 5 cm de largo, un filtro de malla de nylon de 100 μm, un vaso de precipitados de 400 ml, y una etapa (rack de tubos de microcentrífuga flotante).
2. Configuración del IPS (consulte la Figura 1)
- Limpie la campana de flujo laminar con etanol al 70%. Limpie el IPS con etanol al 70% y muévalo a la campana de flujo laminar. Esterilizar por UV durante >15 min antes de encender la campana.
PRECAUCIÓN: La exposición a la luz UV puede causar dolor en los ojos y quemaduras en la piel. Asegúrese de que la hoja esté completamente cerrada cuando se encienda la luz UV. - Ensamble un nuevo juego de tubos desechables en el IPS. Envuelva el tubo aguas abajo de la bomba peristáltica en una camisa de calentador de silicona. Ensamble el monitor de perfusión en el tubo aguas abajo de la camisa del calentador de silicona.
- Asegúrese de que las abrazaderas de rodillos para ambas entradas de tubos estén completamente aflojadas. Conecte cada entrada de tubo al extremo cónico de una pipeta de aspiración estéril de 2 ml. Deje las pipetas de aspiración (entradas) y el catéter intravenoso (salida) en un frasco de 1 L con tampón libre de calcio para permitir la recirculación del tampón durante los pasos de cebado posteriores.
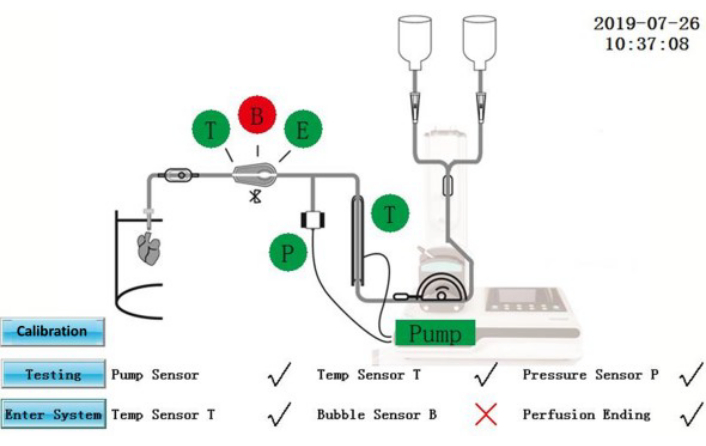
Figura 2: Interfaz de autocomprobación. Haga clic aquí para ver una versión más grande de esta figura.
- Encienda el IPS. Realice las siguientes operaciones en el panel de control de la pantalla táctil. El software realizará una autoprueba completa cada vez que se inicie.
PRECAUCIÓN: El IPS es un equipo eléctrico que está conectado a una fuente de alimentación externa. Los derrames de líquidos en el IPS o los cables de alimentación pueden producir riesgos eléctricos.- Asegúrese de que el estado de la autoprueba se muestre en la pantalla (Figura 2). Los componentes que hayan pasado la autoprueba se mostrarán en verde; los que hayan fallado se mostrarán en rojo. Después de la rectificación, toque el icono Prueba para repetir la autoprueba nuevamente o toque el ícono Ingresar sistema para ingresar directamente a la interfaz de operación.
- Toque en cualquier lugar de la pantalla para iniciar sesión en la interfaz de operación.
- En la esquina superior izquierda de la interfaz de operación (Figura 3), toque cualquiera de los iconos de flecha circular para establecer la dirección de rotación de la bomba peristáltica. En el panel derecho de la interfaz, toque los iconos de flecha arriba / abajo para establecer valores para los parámetros correspondientes. Establezca el flujo en modo de flujo constante; temperatura de la camisa del calentador a 42 °C (que se ajustará para garantizar que la temperatura del perfusato se mantenga a 37 °C); y velocidad de la bomba a 38 rpm para un caudal de ~33 mL/min.
- En el panel inferior derecho de la interfaz de operación, compruebe el estado de la alarma de burbujas, la alarma de parada de perfusión y el icono de silencio.
- Compruebe la temperatura, la presión y el caudal del perfusato en el panel izquierdo. Establezca manualmente los intervalos haciendo clic en las flechas hacia arriba y hacia abajo en la parte superior e inferior de las columnas. Compruebe los datos en tiempo real que se muestran como valores en la mitad de las columnas. El color de la columna cambiará de verde a rojo si los datos en tiempo real se mueven más allá del rango establecido.
- Localice los iconos para iniciar, pausar y detener la perfusión, y el icono para cambiar de la visualización de datos en tiempo real al modo de gráfico en el panel central. Toque el icono de inicio para comenzar la perfusión y cebar el tubo con un tampón libre de calcio. Se creará un nuevo registro. Introduzca el nombre de archivo y el nombre de usuario en la ventana emergente (Figura 4).
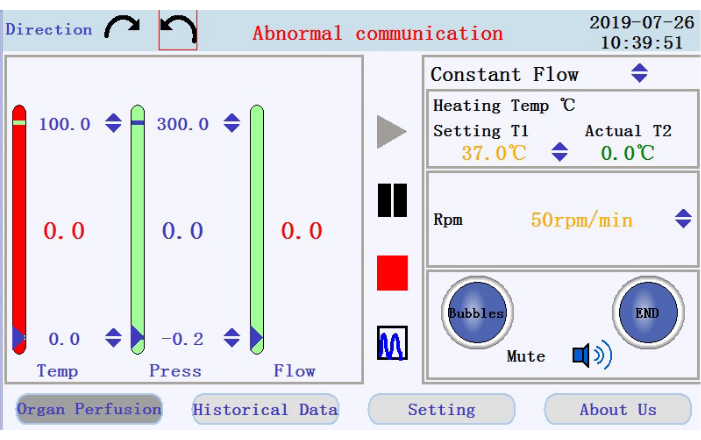
Figura 3: Interfaz de operación. Haga clic aquí para ver una versión más grande de esta figura.
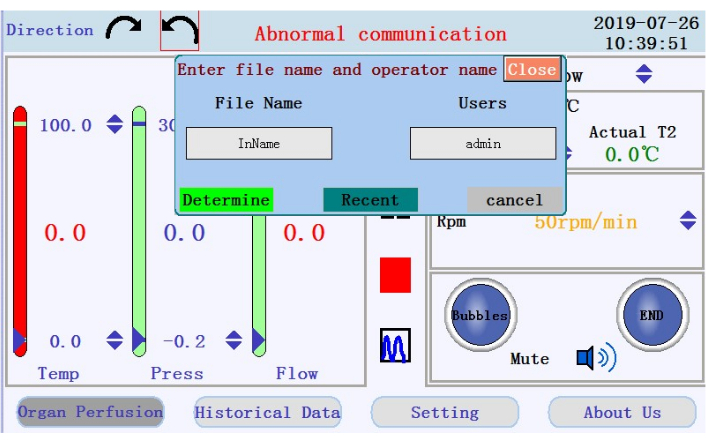
Figura 4: Ventana emergente que solicita el nombre de archivo y el nombre de usuario. Haga clic aquí para ver una versión más grande de esta figura.
- Llene la cámara de goteo hasta la mitad llena. Asegúrese de que no haya bolsas de aire atrapadas en el tubo durante el cebado.
- Retire cualquier burbuja que se forme aguas abajo del filtro de burbujas moviendo el tubo para separar la burbuja y permitir que se elimine.
NOTA: Se pueden formar burbujas a lo largo del tubo a medida que el amortiguador se calienta con la camisa del calentador. - Llene un vaso de precipitados de 400 ml con 200 ml de tampón de colagenasa. Coloque el escenario encima del vaso de precipitados. Sin introducir aire en el tubo, apriete completamente la abrazadera del rodillo para una de las entradas del tubo y mueva la pipeta de aspiración para la entrada en el vaso de precipitados.
3. Procedimiento animal
- Prepare una rata Wistar macho adulto joven alrededor de 200-300 g de peso corporal.
NOTA: Este protocolo fue optimizado para ratas de alrededor de 200-300 g de peso corporal. Se prefieren las ratas macho ya que los cambios hormonales durante el ciclo estral en ratas hembra afectarán la función de los hepatocitos. - Anestesia
- Extraiga el volumen requerido de heparina anticoagulante (5.000 UI/ml; 0,2 ml/100 g de peso corporal) y el cóctel de ketamina/xilazina con anestesia de rata (37,5 mg/ml de ketamina, 5 mg/ml de xilazina; 0,2 ml/100 g de peso corporal) en jeringas de 1 ml con aguja de 27 G.
PRECAUCIÓN: La anestesia y la heparina son sustancias nocivas. Tenga cuidado al manipular objetos punzantes. - Sujeta a la rata. Inyecte heparina por vía intraperitoneal seguido de un cóctel de ketamina/xilazina en el cuadrante inferior derecho del abdomen.
NOTA: El ciego tiene una mayor probabilidad de estar ubicado a la izquierda. Evite perforar el ciego durante la inyección para reducir el riesgo de contaminación. - Después de 10 min, verifique la profundidad de la anestesia evaluando el reflejo del pedal en ambos pies de la rata. Continúe revisando de vez en cuando y espere hasta que la rata ya no responda a los pellizcos de los dedos de los pies. Se puede inyectar anestesia adicional, según sea necesario.
- Extraiga el volumen requerido de heparina anticoagulante (5.000 UI/ml; 0,2 ml/100 g de peso corporal) y el cóctel de ketamina/xilazina con anestesia de rata (37,5 mg/ml de ketamina, 5 mg/ml de xilazina; 0,2 ml/100 g de peso corporal) en jeringas de 1 ml con aguja de 27 G.
- Coloque a la rata en posición supina con las extremidades extendidas en una plataforma de poliestireno cubierta de papel de aluminio en la parte superior de una bandeja. Pega los pies de la rata y fija la cinta de forma segura en la plataforma con agujas de 27 G.
- Desinfecte el pecho y el abdomen rociándolos y empapándolos con etanol al 70%. El afeitado antes de la desinfección es opcional. Pon la rata en la capucha. Continúe el siguiente paso mientras el pelaje todavía está mojado.
NOTA: El empapamiento con etanol al 70% también mantiene la caspa y el polvo de piel al mínimo. - Separe la piel del músculo.
- Con un par de pinzas de tejido dental en una mano, levante la piel cerca de la base del abdomen. Con un par de tijeras quirúrgicas afiladas y romas en la otra mano, corte la piel de la tienda. Empuje el extremo afilado de las tijeras debajo de la piel y haga una incisión en la línea media de la piel desde justo encima de las patas traseras hasta justo debajo de las patas delanteras.
- Mientras tira hacia arriba y estira ligeramente la piel con las pinzas, corte cualquier tejido conectivo que sostenga la piel sobre el músculo en el pecho y el abdomen. Para reducir el riesgo de contaminación, evite que el pelaje suelto caiga sobre el músculo. Para eliminar el pelaje suelto acumulado en las tijeras, límpielos en el lado exterior desinfectado de la piel.
- Haga incisiones laterales en la piel, desde la línea media hasta ambos lados de la rata ligeramente por encima de las patas traseras y ligeramente por debajo de las patas delanteras. Empuje los colgajos de la piel hacia los lados para exponer el músculo.
- Abra el músculo abdominal para exponer los órganos.
- Con un nuevo par de pinzas de tejido dental en una mano, levante el músculo cerca de la base del abdomen. Con un par de tijeras quirúrgicas contundentes-contundentes en la otra mano, corte cuidadosamente a través del músculo sin cortar ninguno de los órganos. Haga una incisión en la línea media en el músculo desde ligeramente por encima de las patas traseras hasta el esternón.
- Haga incisiones laterales en el músculo, desde la línea media hasta ambos lados de la rata ligeramente por encima de las patas traseras y justo debajo de la caja torácica, sin cortar ninguno de los órganos. Empuje los colgajos del músculo hacia los lados para exponer los órganos. Asegúrese de que las incisiones laterales de la piel y el músculo lleguen a los lados de la rata para permitir que la sangre y los amortiguadores fluyan desde la cavidad abdominal en pasos posteriores.
- Canulación de la vena porta
- Con la parte posterior de las pinzas curvas, empuje suavemente los intestinos hacia la derecha. Voltee suavemente los lóbulos del hígado para exponer la vena porta.
- Use una sutura quirúrgica de seda 3-0 para hacer una ligadura muy suelta alrededor de la vena porta cerca del hígado, justo antes de que la vena se ramifique a izquierda y derecha en diferentes lóbulos hepáticos. No apriete la ligadura para evitar interrumpir el flujo sanguíneo a través de la vena porta. Una membrana muy delgada debajo del conducto biliar deberá romperse con la punta de las pinzas curvas antes de que la sutura pueda pasar por debajo y ser enrollada alrededor de la vena porta (y el conducto biliar).
- Usando las puntas de dos pares de fórceps curvas, perfore cuidadosamente un orificio a través del tejido debajo de la vena porta, sin dañar la vena porta. Haga esto aproximadamente 2-3 cm aguas arriba de la primera ligadura, justo antes de que la vena gástrica se ramifique de la vena porta. El tejido es más delgado en esta ubicación específica.
- Estira con cuidado el orificio más grande con las pinzas. Este orificio permitirá que los fórceps apoyen la vena porta durante la canulación.
- Reduzca la velocidad de la bomba a 4 rpm para un caudal de ~3 mL/min. Asegúrese de que la salida del tampón libre de calcio del catéter intravenoso se reduzca a un goteo lento.
NOTA: La acumulación de presión en el hígado causará la muerte de los hepatocitos. Un caudal más bajo debería ralentizar la acumulación de presión en el hígado tras la inserción exitosa de la cánula en la vena porta en un paso posterior. - Apoye suavemente la vena porta con fórceps. Con la otra mano, sostenga el catéter intravenoso con el bisel de la aguja hacia arriba. Dirija la aguja hacia la vena porta en un ángulo de 10-20 ° y avance lentamente hasta que todo el bisel esté dentro de la vena. Una vez que la aguja se inserta correctamente en la vena porta, el hígado comenzará a blanquearse y perderá su color rojo oscuro.
NOTA: Todo el bisel de la aguja debe insertarse en la vena para crear un orificio lo suficientemente grande como para la inserción de la cánula. Sin embargo, no inserte la aguja demasiado profundamente para evitar perforar demasiado la vena. - Avance la cánula sobre la aguja y hacia la vena. Luego, retraiga la aguja hasta que esté a 2-3 mm detrás de la cánula; lo suficiente para que la punta afilada esté segura dentro de la cánula. Use el pulgar y el dedo medio para sujetar el catéter y use el dedo índice para tirar hacia atrás del ala para retraer la aguja.
- Asegure rápidamente la vena porta en el catéter con un clip para la vena. No enganche directamente en el orificio lateral de la aguja para evitar interrumpir el flujo de perfusato. En su lugar, recorte debajo de él.
- Corte inmediatamente la vena cava inferior infrahepática (IVC) para evitar la acumulación de presión en el hígado. A estas alturas, la IVC infrahepática y los vasos sanguíneos adyacentes estarán oscurecidos por la sangre de la vena porta. Para asegurarse de que el IVC se cortó y cortó correctamente, observe si la sangre brota en pulsos; la sangre solo saldrá de los vasos adyacentes.
NOTA: Tomar demasiado tiempo para cortar el IVC infrahepático después de la canulación o no cortarlo antes de pasar al siguiente paso causará la muerte del hepatocito. El animal es sacrificado bajo anestesia por exsanguinación (a través del corte de la CIV) durante este paso. El procedimiento debe continuar mientras la pérdida de sangre está en curso. La muerte se puede confirmar mediante la observación visual del cese de los latidos del corazón / respiración cuando la cavidad torácica se abre en un paso posterior. - Aumente la velocidad de la bomba a 38 rpm para un caudal de ~33 mL/min. Enjuague el hígado tres veces cerrando el IVC con fórceps durante 2-3 s (pero no durante demasiado tiempo) y volviéndolo a abrir.
NOTA: Durante el enrojecimiento, el hígado se expandirá ligeramente antes de volver a la normalidad. El enrojecimiento facilita la permeación del perfusato en todo el hígado. Después del enrojecimiento, el hígado debe ser de color marrón claro. - Asegúrese de que la punta de la cánula se coloque antes del punto donde la vena porta se ramifica en diferentes lóbulos hepáticos, para garantizar la perfusión de todos los lóbulos hepáticos. Si es necesario, desenganche la vena porta y ajuste la posición de la cánula. Vuelva a recortar después.
- Apriete la ligadura suelta alrededor de la vena porta, ligeramente aguas arriba del punto de ramificación. Haga tres nudos en donde la cánula blanda esté sostenida por la aguja de metal duro, entre el bisel y el orificio lateral. Asegúrese de que los nudos fijen la cánula en su posición, asegurándola a la vena porta y evite el reflujo de los amortiguadores.
- Reseque todo el hígado intacto.
- Perfundir el hígado con tampón libre de calcio a la velocidad de flujo de ~ 33 ml / min durante los próximos 12 minutos (ver Figura 5A). Mientras tanto, realice una resección hepática. El tiempo de perfusión se puede extender si es necesario, pero asegúrese de que el tampón libre de calcio no se agote.
- Usando un par de tijeras curvas, separe cuidadosamente la vena porta de los intestinos cortando el mesenterio que los conecta entre sí. No corte el tracto gastrointestinal (esófago, estómago e intestino delgado y grueso) para asegurarse de que no se produzca contaminación.
NOTA: Esto es para evitar que la vena porta se desgarre cuando el hígado se mueve durante la resección. - Separe el hígado del tracto gastrointestinal cortando los tejidos conectivos, el páncreas y el mesenterio que conecta el hígado con el tracto gastrointestinal. Para desprenderse, corte siempre con tijeras y no tire para rasgar. Una vez más, no corte ni corte el tracto gastrointestinal.
- Voltee suavemente el hígado para exponer el diafragma. Cortar el diafragma siguiendo las paredes de las costillas. Asegúrese de que la mayor parte del diafragma permanezca conectado al hígado. Tenga cuidado de no pinchar o herir el hígado.
- Una vez abierta la cavidad torácica, se pueden ver dos conductos: el IVC suprahepático blanquecino a la izquierda y el esófago amarillento a la derecha. Recorte el IVC suprahepático y córtelo justo encima del clip. El recorte del IVC suprahepático es opcional. Evita que la cavidad torácica se inunde.
NOTA: Observe visualmente el cese de los latidos del corazón / respiración para confirmar la muerte del animal. - El esófago está rodeado por el diafragma. Para aislar el esófago del diafragma, corte a través del diafragma desde la derecha hacia el esófago. Corte los tejidos conectivos restantes que conectan el esófago y el estómago con el hígado y el diafragma.
- Empuje el tracto gastrointestinal hacia la derecha. Transfiera el clip venoso del IVC suprahepático al IVC infrahepático; el búfer ahora se perfundirá fuera de la IVC suprahepática.
NOTA: Durante la perfusión, la cánula y la CIV infrahepática estarán cubiertas por el hígado. La fuerte salida amortiguadora de la CIV suprahepática ayudará al cirujano a descartar fugas de perfusión. - Corte cualquier diafragma restante que conecte el hígado con la cavidad torácica. Cortar los tejidos que conectan el hígado con la cavidad abdominal. Tenga cuidado de no cortar el IVC infrahepático por encima del clip para evitar separar el clip del hígado.
- Para asegurarse de que el hígado esté completamente resecado, levante cuidadosamente el hígado aferrándose al diafragma con fórceps. Si hay tejidos restantes que conectan el hígado con la cavidad abdominal, córtelos. Si el riñón y el bazo todavía están conectados al hígado, desconéctelos.
4. Perfusión hepática y digestión
- Si la resección se completó temprano, espere hasta que el hígado haya sido perfundido con tampón libre de calcio durante 12 minutos.
- Cambie el tampón de perfusión a tampón de colagenasa. Afloje completamente la abrazadera del rodillo para el tampón de colagenasa antes de apretar completamente la abrazadera del rodillo para el tampón libre de calcio (consulte la Figura 5B). Una vez que el tampón de colagenasa llega al hígado a través del tubo, enjuague el hígado tres veces cerrando el IVC suprahepático durante 2-3 s y reabriéndolo.
- Mueva cuidadosamente el hígado a la etapa en la parte superior del vaso de precipitados para la recirculación del tampón de colagenasa. Mueva el hígado sosteniendo el diafragma con fórceps mientras apoya el catéter. Evite tirar del catéter para evitar el desprendimiento accidental del catéter.
NOTA: Si el catéter se separa y la vena porta está demasiado dañada para la re-canulación, canule la CIV suprahepática y permita que el tampón se perfunda fuera de la vena porta. Asegúrese de que el IVC infrahepático permanezca recortado. - Digerir el hígado durante 12 min. Observe la aparición de manchas / redes translúcidas a medida que el hígado comienza a perder su textura marrón lisa. El hígado se hará más grande y más suave a medida que se digiere. Una vez que el hígado tenga una consistencia blanda, detenga la perfusión. El tiempo de digestión se puede extender, si es necesario.
NOTA: Si la cápsula de Glisson se ha roto, el tampón de colagenasa en el vaso de precipitados podría volverse turbio debido a las células hepáticas escapadas.
5. Aislamiento de hepatocitos
- Retire con cuidado la cánula cortando la vena porta. Retire con cuidado el clip. Transfiera el hígado a un plato de 150 mm que contenga 60 ml de Dulbecco's Modified Eagle Medium (DMEM) frío.
- Golpee suavemente el hígado con la parte posterior de las pinzas curvas para romper y despegar la cápsula de Glisson. Luego, balancee suavemente el hígado de lado a lado en DMEM para liberar células hepáticas. Continúe haciendo esto hasta que las células hepáticas estén completamente disociadas en el DMEM.
NOTA: Ocasionalmente, todo el hígado o ciertos lóbulos solo se digieren parcialmente. Al no raspar el hígado que eliminará por la fuerza y dañará los hepatocitos no disociados, se puede obtener una viabilidad celular más alta y consistente. - Mece suavemente el plato de 150 mm hasta que las células hepáticas se distribuyan bien en DMEM. Para eliminar piezas de tejido y grupos de células, vierta la suspensión celular a través de un filtro de malla de nylon de 100 μm de tamaño de poro colocado sobre un nuevo plato de 150 mm. Enjuague el plato viejo con 30 ml de DMEM y transfiera la suspensión al filtro de malla. Toque suavemente el filtro de malla para permitir que pasen las células hepáticas individuales atrapadas.
- Retire el filtro de malla y balancee suavemente el nuevo plato de 150 mm hasta que las células hepáticas se distribuyan bien. Divida la suspensión en partes iguales en tubos de 4 x 50 ml. Enjuague el plato con 30 ml de DMEM y divida la suspensión por igual en los mismos tubos. Asegúrese de que cada tubo tenga el mismo volumen de suspensión celular.
- Centrifugar los tubos de 4 x 50 ml de suspensión celular a 50 x g durante 2 min a 4 °C. Aspire con cuidado el sobrenadante sin molestar la bolita suelta. Deseche el sobrenadante. Agregue 20 ml de DMEM en cada tubo y balancee suavemente los tubos para resuspendir el pellet celular. Combine la suspensión celular de cuatro tubos en dos.
- Centrifugar los tubos de 2 x 50 ml a 20 x g durante 2 min a 4 °C. Aspirar y desechar el sobrenadante. Agregue 20 ml de DMEM en cada tubo y balancee suavemente los tubos para resuspendir el pellet celular. Combine la suspensión celular de dos tubos en uno. Mantenga las células en hielo hasta su uso.
- Prepare la solución de azul de tripano mezclando 400 μL de 1x PBS con 50 μL de azul de tripano. Añadir 50 μL de suspensión de hepatocitos en la solución de azul tripano. Cuente el número de hepatocitos viables y muertos con un hemocitómetro bajo el microscopio de luz.
6. Cultura de hepatocitos
- Realizar todos los pasos de cultivo celular en la capucha. Agregue 1 ml de solución de recubrimiento de colágeno en un plato de 35 mm e incube durante 4 h. Enjuague los platos tres veces con 1x PBS.
- Diluir la suspensión de hepatocitos en medio de cultivo de hepatocitos a una concentración de 0,8 millones de células/ml. Añadir 1 ml de suspensión diluida de hepatocitos en el plato de 35 mm.
NOTA: Los hepatocitos son sensibles al esfuerzo cortante durante el pipeteo. Considere el uso de puntas de pipeta de diámetro ancho. - Mece el plato para distribuir los hepatocitos de manera uniforme. Incubar a 37 °C, 5% CO2 durante 3-4 h para permitir que los hepatocitos se adhieran.
- Para la cultura del sándwich.
- Eliminar el medio de cultivo de hepatocitos. Enjuague una vez con 1 ml de medio de cultivo de hepatocitos para eliminar las células no adheridas. Agregue 1 ml de solución de superposición de colágeno. Agregue la solución de superposición de colágeno en las paredes del plato para evitar la introducción de burbujas en la solución.
- Incubar a 37 °C, 5% CO2 durante la noche para permitir la gelificación del colágeno.
- Añadir 1 ml de medio de cultivo de hepatocitos frescos. Incubar a 37 °C, 5% CO2.
- Para cultivo monocapa.
- Después del paso 6.3, retire el medio de cultivo de hepatocitos. Enjuague una vez con 1 ml de medio de cultivo de hepatocitos para eliminar las células no adheridas.
- Añadir 1 ml de medio de cultivo de hepatocitos frescos. Incubar a 37 °C, 5% CO2.
- Evaluar la pureza y función de los hepatocitos mediante la realización de inmunotinción para marcadores específicos de hepatocitos y ensayos funcionales como se describió anteriormente10,11.
Resultados
Un cirujano podría saber si la perfusión hepática está ocurriendo sin problemas observando el resultado después de ciertos pasos. El primer resultado se puede observar en la canulación, el corte de la CIV infrahepática y la restauración del caudal de perfusión. El hígado debe haber cambiado completamente de color de rojo oscuro a marrón, manteniendo su volumen. Si el hígado se ve ligeramente desinflado y tiene un tinte rojizo o manchas de rojo, significa que la tasa de flujo de perfusión se estableció erró...
Discusión
Hay algunos puntos que son particularmente importantes a observar para el procedimiento de perfusión de colagenasa de dos pasos en general. En primer lugar, se debe tener especial cuidado al resecar el hígado. Asegúrese de que el tracto gastrointestinal no esté dañado, ya que la fuga del contenido dará lugar a la contaminación bacteriana. Además, evite dañar la cápsula de Glisson, que cubre la superficie del hígado durante el procedimiento animal. Si el desgarro es lo suficientemente grande, podría permitir l...
Divulgaciones
Zhou Yan y Hanry Yu declaran intereses contrapuestos ya que poseen acciones en Vasinfuse, que fabrica y comercializa el Sistema Integrado de Perfusión. Hanry Yu tiene acciones en Histoindex, Invitrocue, Osteopore, Pishon Biomedical, Ants Innovate y Synally Futuristech que no tienen intereses en competencia con la información reportada aquí.
Agradecimientos
Este trabajo está respaldado en parte por MOE ARC (MOE2017-T2-1-149); NUHS Innovation Seed Grant 2017 (NUHSRO/2017/051/InnovSeed/02); Instituto de Mecanobiología de Singapur (R-714-106-004-135); y el Instituto de Bioingeniería y Nanotecnología, Consejo de Investigación Biomédica, Agencia de Ciencia, Tecnología e Investigación (A*STAR) (Números de proyecto IAF-PP H18/01/a0/014, IAF-PP H18/01/a0/K14 y MedCaP-LOA-18-02) financiación a Hanry Yu. Ng Chan Way es un investigador de la Universidad Nacional de Singapur. Nos gustaría agradecer a la Unidad de Microscopía Confocal y a la Unidad de Citometría de Flujo de la Universidad Nacional de Singapur por su ayuda y asesoramiento en el análisis de la pureza de los hepatocitos.
Materiales
| Name | Company | Catalog Number | Comments |
| Material/Equipment | |||
| 1 mL syringe | Nipro | ||
| 27G needle | Nipro | ||
| Black braided silk non-absorbable, non-sterile surgical suture | Look | SP117 | |
| Bochem 18/10 stainless steel forceps, sharp tip contain bent round tip | Bochem | 10333511 | |
| Disposable Perfusion Set | Vasinfuse | BPF-112 | |
| Floating circular 1.5 mL microcentrifuge tube rack | Sigma-Aldrich | R3133 | |
| German Standard Tissue Forceps, Serrated / 1×2 teeth , 14.5cm | Walentech | ||
| Greiner Cellstar aspirating pipette | Merck | GN710183 | |
| Haemocytometer | |||
| Integrated Perfusion System | Vasinfuse | IPS-001 | |
| Iris Scissors curved, stainless, 11cm | Optimal Medical Products Pte Ltd | CVD | |
| Light microscope with 10X lens | Olympus | ||
| Mesh Sheet 100µM Nylon | Spectra-Teknic(s) Pte Ltd | 06630-75 | |
| Operating Scissors, BL/BL, 13cm | Optimal Medical Products Pte Ltd | STR – BL/BL | |
| Operating Scissors, SH/BL, 13cm | Optimal Medical Products Pte Ltd | STR – SH/BL | |
| Reverse force hemostatic clip | Shanghai Jin Zhong Pte Ltd | XEC230 | |
| Water bath | Grant | ||
| Reagents/Chemicals | |||
| 10X Phosphate buffered saline (PBS) | Sigma-Aldrich | ||
| Bovine serum albumin (BSA) | Sigma-Aldrich | A9056 | |
| CaCl2·2H2O | Merck | 137101 | |
| Collagenase Type IV | Gibco | 17104019 | |
| Dexamethasone | TCI | D1961 | |
| DMEM | Gibco | 31600-034 | |
| Glutamax | Gibco | 35050061 | |
| HEPES | Invitrogen | 11344-041 | |
| Insulin | Sigma-Aldrich | 1-9278 | |
| KCl | VWR | VWRC26764.298 | |
| KH2PO4 | Sigma-Aldrich | P5379 | |
| Linoleic acid | Sigma-Aldrich | L9530 | |
| NaCl | Sigma-Aldrich | S5886 | |
| NaHCO3 | Sigma-Aldrich | S8875 | |
| NaOH | Merck | 106462 | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | |
| Type I bovine collagen | Advanced BioMatrix | 5005-100ml | |
| William’s E Media | Sigma-Aldrich | W1878 |
Referencias
- Shen, L., Hillebrand, A., Wang, D. Q. H., Liu, M. Isolation and primary culture of rat hepatic cells. Journal of Visualized Experiments: JoVE. (64), e3917 (2012).
- Cabral, F., et al. Purification of hepatocytes and sinusoidal endothelial cells from mouse liver perfusion. Journal of Visualized Experiments: JoVE. (132), e56993 (2018).
- Green, C. J., et al. The isolation of primary hepatocytes from human tissue: optimising the use of small non-encapsulated liver resection surplus. Cell and Tissue Banking. 18 (4), 597-604 (2017).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Gopalakrishnan, S., Harris, E. N. In vivo liver endocytosis followed by purification of liver cells by liver perfusion. Journal of Visualized Experiments: JoVE. (57), e3138 (2011).
- Wen, J. W., Olsen, A. L., Perepelyuk, M., Wells, R. G. Isolation of rat portal fibroblasts by in situ liver perfusion. Journal of Visualized Experiments: JoVE. (64), e3669 (2012).
- Korelova, K., Jirouskova, M., Sarnova, L., Gregor, M. Isolation and 3D collagen sandwich culture of primary mouse hepatocytes to study the role of cytoskeleton in bile canalicular formation in vitro. Journal of Visualized Experiments: JoVE. (154), e60501 (2019).
- Shi, W., et al. Isolation and purification of immune cells from the liver. International Immunopharmacology. 85 (95), 106632 (2020).
- Salem, E. S. B., et al. Isolation of primary mouse hepatocytes for nascent protein synthesis analysis by non-radioactive L-azidohomoalanine labeling method. Journal of Visualized Experiments: JoVE. (140), e58323 (2018).
- Xia, L., et al. Tethered spheroids as an in vitro hepatocyte model for drug safety screening. Biomaterials. 33 (7), 2165-2176 (2012).
- Kegel, V., et al. Protocol for isolation of primary human hepatocytes and corresponding major populations of non-parenchymal liver cells. Journal of Visualized Experiments: JoVE. (109), e53069 (2016).
- Zhu, L., et al. A vertical-flow bioreactor array compacts hepatocytes for enhanced polarity and functions. Lab on a Chip. 16 (20), 3898-3908 (2016).
- Du, Y., et al. Synthetic sandwich culture of 3D hepatocyte monolayer. Biomaterials. 29 (3), 290-301 (2008).
- Tong, W. H., et al. Constrained spheroids for prolonged hepatocyte culture. Biomaterials. 80, 106-120 (2016).
- Xia, L., et al. Laminar-flow immediate-overlay hepatocyte sandwich perfusion system for drug hepatotoxicity testing. Biomaterials. 30 (30), 5927-5936 (2009).
- Gupta, K., et al. Bile canaliculi contract autonomously by releasing calcium into hepatocytes via mechanosensitive calcium channel. Biomaterials. 259, 120283 (2020).
- Horner, R., et al. Impact of Percoll purification on isolation of primary human hepatocytes. Scientific Reports. 9 (1), 6542 (2019).
- Osypiw, J. C., et al. Subpopulations of rat hepatocytes separated by Percoll density-gradient centrifugation show characteristics consistent with different acinar locations. The Biochemical Journal. 304, 617-624 (1994).
- Beal, E. W., et al. A small animal model of ex vivo normothermic liver perfusion. Journal of Visualized Experiments: JoVE. (136), e57541 (2018).
- Hillebrandt, K., et al. Procedure for decellularization of rat livers in an oscillating-pressure perfusion device. Journal of Visualized Experiments: JoVE. (102), e53029 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados