Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Generación de un modelo tridimensional simplificado de piel en un chip en una plataforma microfluídica micromecanizado
En este artículo
Resumen
Aquí, presentamos un protocolo para generar un modelo tridimensional de piel simplificado e indiferenciado utilizando una plataforma microfluídica micromecanizado. Un enfoque de flujo paralelo permite la deposición in situ de un compartimento dérmico para la siembra de células epiteliales en la parte superior, todo controlado por bombas de jeringa.
Resumen
Este trabajo presenta una plataforma microfluídica nueva, rentable y confiable con el potencial de generar tejidos complejos de múltiples capas. Como prueba de concepto, se ha modelado una piel humana simplificada e indiferenciada que contiene un compartimento dérmico (estromal) y epidérmico (epitelial). Para ello, se ha desarrollado un dispositivo versátil y robusto, a base de vinilo dividido en dos cámaras, superando algunos de los inconvenientes presentes en los dispositivos microfluídicos basados en polidimetilsiloxano (PDMS) para aplicaciones biomédicas, como el uso de equipos costosos y especializados o la absorción de moléculas y proteínas pequeñas e hidrofóbicas. Además, se desarrolló un nuevo método basado en el flujo paralelo, que permite la deposición in situ de los compartimentos dérmico y epidérmico. La construcción de la piel consiste en una matriz de fibrina que contiene fibroblastos primarios humanos y una monocapa de queratinocitos inmortalizados sembrados en la parte superior, que posteriormente se mantiene en condiciones de cultivo dinámico. Esta nueva plataforma microfluídica abre la posibilidad de modelar enfermedades de la piel humana y extrapolar el método para generar otros tejidos complejos.
Introducción
Recientemente, se han realizado avances hacia el desarrollo y producción de modelos de piel humana in vitro para el análisis de la toxicidad de productos cosméticos y farmacéuticos1. Los investigadores de las industrias farmacéutica y de cuidado de la piel han estado utilizando animales, siendo los ratones los más comunes, para probar sus productos2,3,4,5. Sin embargo, la prueba de productos en animales no siempre es predictiva de la respuesta en humanos, lo que con frecuencia conduce a la falla del medicamento o efectos adversos en humanos y, en consecuencia, a pérdidas económicas5,6. El Reino Unido fue el primer país que prohibió el uso de animales para pruebas cosméticas en 1998. Más tarde, en 2013, la UE prohibió las pruebas y la aprobación de cosméticos en animales (Reglamento de Cosméticos de la UE nº 1223/2009)7.
Esta prohibición también está siendo considerada por otros países, como en 'The Humane Cosmetics Act' en los EE.UU.8. Además de las preocupaciones éticas, las diferencias anatómicas entre la piel animal y humana hacen que las pruebas en animales consuman mucho tiempo, sean costosas y, a menudo, ineficaces. Además, se espera que el tamaño del mercado global de pruebas de toxicología in vitro alcance los USD 26.98 mil millones para 20259. Por estas razones, existe la necesidad de desarrollar nuevos métodos y alternativas para esos estudios in vitro, como los modelos de piel humana de bioingeniería, que permitan realizar pruebas de seguridad y efectos tóxicos de cosméticos y medicamentos sin el uso de animales.
Hay dos tipos diferentes de modelos de piel humana disponibles comercialmente, in vitro. El primer tipo consiste en equivalentes epidérmicos estratificados que contienen múltiples capas de queratinocitos diferenciadores que se siembran en diferentes materiales. Algunos de ellos han sido aprobados por la Organización para la Cooperación y el Desarrollo Económicos (OCDE) y validados por el (Centro Europeo para la Validación de Métodos Alternativos (ECVAM) para pruebas de corrosión e irritación cutánea, como EpiDerm o SkinEthic10,11,12. El segundo tipo son equivalentes de piel completa con una capa de queratinocitos humanos diferenciadores sembrados en un andamio tridimensional (3D) que contiene fibroblastos, como T-Skin y EpiDerm-FT. Sin embargo, estos modelos se cultivan en condiciones estáticas, lo que los hace incapaces de representar con precisión las condiciones fisiológicas humanas.
El interés reciente se ha centrado en la generación in vitro de modelos de piel 3D en formatos de inserción de cultivo celular (CCI) con perfusión dinámica13,14,15, 16,17,18,19. Sin embargo, estos sistemas no pueden considerarse stricto sensu como microfluídica piel en chips según su definición clásica en el campo. La definición de Ingber para órganos en un chip establece que el órgano debe colocarse dentro de los canales microfluídicos, que es una condición que solo unos pocos dispositivos cumplen20,21. Skin-on-chips ha modelado hasta ahora epitelios en su mayoría simples como capas unicelulares y/o capas de células dérmicas separadas por una membrana porosa22,23. Aunque ha habido algunos avances en el modelado de la piel en sistemas microfluídicos16,24, actualmente no hay literatura que muestre un sistema de órgano en un chip que se ajuste a la definición de Ingber, capaz de producir una piel de múltiples capas in situ e incluir componentes epiteliales y estromales.
En este trabajo, se presenta una nueva plataforma microfluídica rentable, robusta y basada en vinilo para aplicaciones skin-on-a-chip. Esta plataforma fue producida por micromecanismo, lo que proporciona más simplicidad en el proceso de fabricación, así como una mayor flexibilidad y versatilidad en el diseño del dispositivo, superando algunas de las limitaciones de PDMS25. También se diseñó una forma de introducir una construcción de piel simplificada a través de un flujo paralelo controlado con bombas de jeringa. El flujo paralelo permite que dos fluidos con viscosidades muy diferentes (un tampón y un pre-gel de fibrina en este caso) se perfundan a través de un canal sin mezclarse entre sí. Como prueba de concepto, se introdujo en el dispositivo una construcción dermoepírmica que contenía fibroblastos incrustados en una matriz de fibrina que imitaba la dermis, sobre la cual se cargó una monocapa de queratinocitos para emular la epidermis indiferenciada. La altura del compartimento dérmico se puede modular modificando los caudales. La principal novedad de este trabajo, frente a los modelos22,26,27,28, 29descritosanteriormente, es el desarrollo de un constructo 3D dentro de una microcámara mediante microfluídica. Aunque este artículo presenta una piel indiferenciada simplificada, el objetivo a largo plazo es generar y caracterizar una construcción de piel totalmente diferenciada para demostrar su viabilidad y funcionalidad para fines de pruebas de medicamentos y cosméticos.
Protocolo
1. Diseño de chips y parámetros de micromecanizado
- Diseñe las capas de chips microfluídicos con el software de diseño de código abierto FreeCAD; consulte la Tabla 1 para conocer las dimensiones de los canales. Incluya cuatro orificios de 2,54 mm de diámetro en el diseño para usar un alineador personalizado para una superposición de capa correcta.
| Longitud (μm) | Ancho (μm) | |
| Cámara baja | 28,400 | 800 |
| Cámara alta | 31,000 | 800 |
Tabla 1: Dimensiones de los canales superior e inferior del dispositivo.
- Corte láminas de vinilo transparentes, adhesivas y de 95 μm de espesor en cuadrados de 30 cm x 30 cm para que quepan correctamente en el plotter.
- Utilice el software Brother CanvasWorkspace para crear un espacio de trabajo de 30 cm x 30 cm, y llénelo con los patrones diseñados para las diferentes capas del chip (Figura 1A). Guárdelo en un archivo .svg.
- Cortar las láminas de vinilo de 30 cm x 30 cm con el trazador de bordes (Figura 1B-D).
- Pegue la lámina de vinilo a una alfombra adhesiva de baja adherencia y elimine todas las burbujas de aire si es necesario.
- Cargue el archivo de .svg en el trazador y establezca los parámetros de corte: cuchilla de corte: nivel 3; presión de corte: nivel 0; velocidad de corte: nivel 1. Coloque la alfombra adhesiva con el vinilo en el plotter y comience el proceso de corte.
- Corte el patrón de canal superior en vinilo de cinta de doble cara de 12 μm de espesor siguiendo los pasos anteriores.

Figura 1: Diseño del chip y proceso de micromecanizado. (A) Diseño del software que muestra el espacio de trabajo lleno de los patrones superior e inferior diseñados para el chip. (B) Trazador de bordes durante el proceso de corte; se muestra la cuchilla de corte, la lámina de vinilo entera y la estera adhesiva. (C) Vinilo estampado que se separa de la hoja cortada. (D) Muestra de una capa de vinilo adhesivo estampada con el diseño del canal superior. Haga clic aquí para ver una versión más grande de esta figura.
2. Fabricación de capas PDMS
- Mezcle el PDMS y el agente de curado en una proporción de 10: 1 (v / v) y coloque la mezcla al vacío durante 15 minutos para eliminar las burbujas de aire. Vierta 55 ml de la mezcla en un plato de cultivo cuadrado de 55 cmy 2 para obtener una capa de 2 mm de espesor. Retire las burbujas con una aguja.
- Curar la mezcla (paso 2.1) en un horno durante 1 h a 80 °C. Desmolda el PDMS y córtalo en rectángulos con las dimensiones del chip. Haga agujeros para el tubo con una aguja de jeringa de 18 G.
3. Montaje de chips
NOTA: Para una mejor comprensión, consulte la Figura 2.
- Ensamble todo el dispositivo con un alineador para ajustar los canales, las entradas y las salidas correctamente. Apila cuatro capas de vinilo (con el micropatrón inferior correspondiente) para ensamblar el canal inferior, manteniendo la cinta de cubierta de la capa inferior para evitar que se pegue al alineador.
- Corte y coloque la membrana porosa de policarbonato (PC) en la parte superior del canal inferior para separarla del superior. Tenga cuidado de no cubrir las entradas del canal inferior.
- Agregue diez capas de vinilo con el diseño de la cámara superior. Pegue una capa de vinilo de cinta de doble cara con el patrón de canal superior en la parte superior. Retire el chip del alineador y péguelo en el portaobjetos de vidrio.
- Coloque una lámina PDMS de 2 mm de espesor sobre la capa de vinilo de cinta de doble cara para proporcionar un anclaje adecuado para el tubo y evitar fugas. Deje un peso en la parte superior del chip durante la noche para asegurarse de que el chip sea completamente estanco. Esterilizar el chip enjuagando etanol al 70% v/v durante 5 min, y luego lavar con H2O destilado.
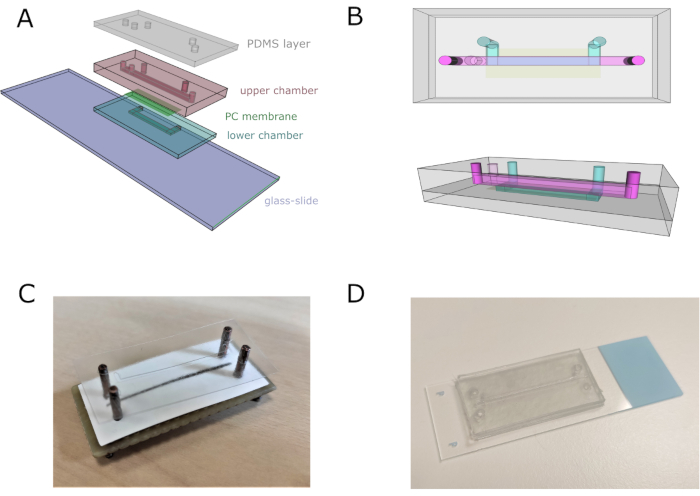
Figura 2: Ensamblaje de chips microfluídicos. (A) Esquema general del montaje del dispositivo. Las cámaras inferior y superior están compuestas por cuatro y once láminas de vinilo superpuestas, respectivamente. (B) Vistas superiores y laterales del chip microfluídico. Los canales superior e inferior están representados en rosa y azul, respectivamente. (C) Imagen del conjunto del chip utilizando un alineador hecho a medida. (D) Imagen del chip después del ensamblaje completo. Haga clic aquí para ver una versión más grande de esta figura.
4. Conexiones de bomba
NOTA: La representación gráfica de las conexiones de las bombas se muestra en la Figura 3.
- Conecte la bomba 1 a la entrada 1 de la cámara superior (UCi1).
- Conecte la bomba 2 a la entrada 2 de la cámara superior (UCi2).
- Conecte la bomba 3 a la entrada de la cámara inferior (LCi).
- Conecte la toma de la cámara superior (UCo) y la salida de la cámara inferior (LCo) a un tubo de desecho.
- Conecte las jeringas a cada entrada mediante tubos de politetrafluoroetileno (PTFE) y conectores de acero inoxidable de 18 G.
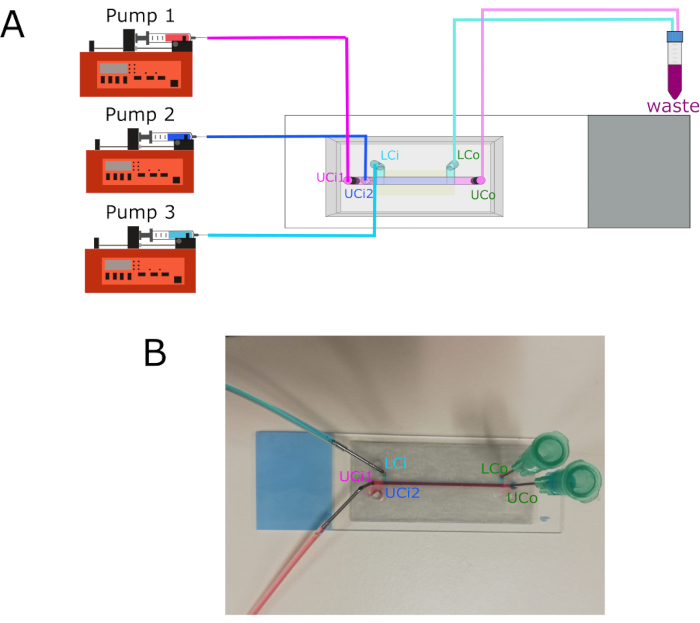
Figura 3: Conexiones de la bomba y ubicación de las entradas/salidas. (A) Diagrama que muestra la conexión de las tres bombas diferentes a sus respectivas entradas. Los enchufes se conectan a un contenedor de residuos. (B) Imagen del chip con entradas y salidas etiquetadas. Abreviaturas: LCi = entrada de cámara inferior; LCo = salida de la cámara inferior; UCi1 = entrada de la cámara superior 1; UCi2 = entrada de la cámara superior 2; UCo = salida de la cámara superior. Haga clic aquí para ver una versión más grande de esta figura.
5. Cultivo celular
NOTA: La línea celular HaCaT tiene un origen comercial. Los fibroblastos primarios humanos proceden de donantes sanos y se obtuvieron de la recogida de muestras biológicas de origen humano inscritas en el Registro Nacional de Biobancos para Investigación Biomédica del Instituto de Salud Carlos III.
- Trabajar en una campana de cultivo celular, previamente esterilizada bajo luz ultravioleta y limpiada con etanol.
- Descongelar las células H2B-GFP-HaCaT (queratinocitos de piel inmortalizados humanos, hKCs) y los fibroblastos primarios GFP-humanos (hFBs) a 37 °C, añadir 2 mL de medio de cultivo y centrifugar durante 7 min a 20 °C a 250 × g.
NOTA: Las células H2B-GFP-HaCaT son queratinocitos humanos inmortalizados modificados para expresar una histona híbrida H2B-proteína fluorescente verde (GFP), proporcionando a sus núcleos fluorescencia verde. Los GFP-hFB son fibroblastos primarios humanos transformados con el vector pLZRS-IRES-EGFP para expresar fluorescencia verde citoplasmática. Estas células fueron modificadas siguiendo protocolos previamente publicados30,31 - Cultice tanto hKCs como hFBs en 1x DMEM suplementado con 10% de suero fetal bovino y 1% de solución antibiótica/antimicótica. Precalente el medio de cultivo a 37 °C antes de su uso.
- Separe las células lavándolas con 1 solución salina tamponada con fosfato (PBS), agregando 2 ml de ácido tetraacético de tripsina/etilendiamina (EDTA) e incubándolas durante 10 min a 37 °C.
- Inactivar tripsina añadiendo 4 ml de medio de cultivo. Resuspend las células y transfiéralas a un tubo de 15 ml. Extraer 10 μL para contar las células en una cámara de Neubauer y determinar la concentración adecuada.
- Centrifugar el tubo de 15 ml durante 7 min a 20 °C a 250 × g. Retire el sobrenadante y resuspónda los gránulos a la concentración deseada: hFBs a 50.000 células/ml y hKCs a 5·× 106 células/ml.
6. Preparación de pre-gel de fibrinógeno
- Activar la trombina añadiendo 1 ml de CaCl2 (1% p/v en NaCl) al vial.
- Añadir los siguientes componentes para obtener 1 mL de hidrogel de fibrina a una concentración final de fibrina de 3,5 mg/mL: 59 μL de trombina activada (10 unidades NIH/mL), 59 μL de ácido tranexámico (Tabla de Materiales,100 mg/mL), 764 μL de medio de cultivo que contiene 50.000 hFBs/mL, 118 μL de fibrinógeno (20 mg/mL en NaCl (0,9% p/v)).
NOTA: El fibrinógeno debe agregarse en el último momento.
7. Protocolo de flujo paralelo
- Bombee 1x PBS con bomba 3 a través del LCi a 50 μL/min durante todo el proceso.
- Bomba de fluido de sacrificio (1x PBS) con bomba 2 a través del UCi2 a 100 μL/min.
- Cargue la jeringa con el pregel, colóquela rápidamente en la bomba 1 y ejecóquela a 200 μL/min (Figura 4A).
- Detenga las bombas 1 y 2 una vez que el pre-gel salga de la UCo.
- Deje el chip sin quitar el tubo a 37 °C durante al menos 10 minutos para permitir la gelificación.
- Medio de cultivo de bomba a 50 μL/h con bomba 3 a UCi2 durante la noche.
- Bloque UCi1 con una tapa.
8. Siembra monocapa de hKCs
- Compruebe bajo el microscopio que los hFB se propagan 24 h después de la generación del compartimento dérmico.
- Introducir los hKCs con bomba 2 a través de UCi2 a 5 ×·106 celdas/mL a 40 μL/min durante 1 min (Figura 4B).
- Deje el chip durante la noche a 37 ° C en una incubadora saturada de humedad para la fijación de la célula.
- Bombee el medio de cultivo fresco con la bomba 3 solo a través de LCi a 50 μL/min (Figura 4C).
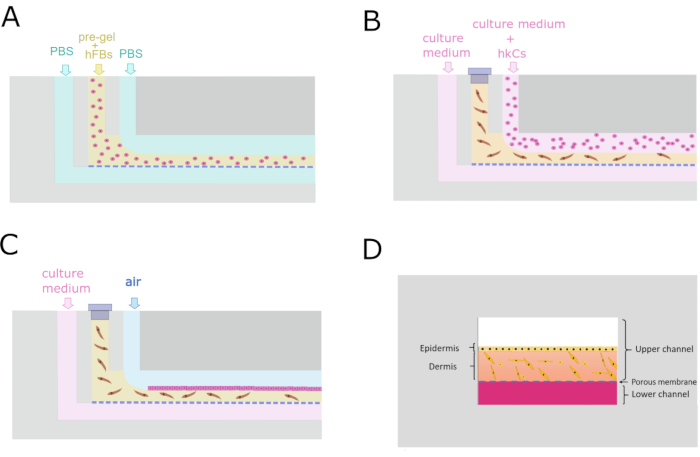
Figura 4: Protocolo microfluídico para la generación del constructo dermo-epidérmico. (A) Sección transversal transversal que muestra el proceso de flujo paralelo para generar el compartimento dérmico. (B) Siembra monocapa de queratinocitos 24 h después de la generación del compartimento dérmico. (C) Mantenimiento del cultivo celular dentro del dispositivo microfluídico. (D) Recreación transversal de la piel dentro del chip. Haga clic aquí para ver una versión más grande de esta figura.
9. Ensayo de viabilidad celular
NOTA: El kit vivo /muerto tiñe las células con fluorescencia verde o roja dependiendo de su estado vivo o muerto. Para una adecuada diferenciación de viabilidad, se deben utilizar hKC y hFB no fluorescentes en este paso. Todos los pasos del procedimiento se realizan a través de UCi2 con bomba 2.
- Lave el canal superior con 1x PBS durante 5 min a 50 μL/min para eliminar el medio de cultivo.
- Bombee aire para eliminar el 1x PBS a 50 μL/min.
- Prepare la solución Calcein AM/Ethidium homodimer-1 Kit (Live/Dead) siguiendo las instrucciones del fabricante.
- Bombee la solución Live/Dead a 50 μL/min durante 2 min.
- Incubar 30 min a 37 °C en la oscuridad.
- Lave el canal superior bombeando 1x PBS a 50 μL/min durante 2 min para eliminar cualquier reactivo restante.
- Observe la muestra bajo el microscopio confocal. Utilice una longitud de onda de excitación de 495/590 nm y una longitud de onda de emisión de 519/617 nm para células vivas y muertas, respectivamente.
Resultados
El chip diseñado está compuesto por dos cámaras fluídicas separadas por una membrana PC de tamaño de poro de 5 μm que permite el crecimiento de la célula al permitir el paso de moléculas promotoras del crecimiento desde la cámara inferior. La cámara superior sostiene la construcción tisular, en este caso, de una monocapa de hKCs sobre un hidrogel de fibrina que contiene hFBs.
La altura de los canales está determinada por el número de láminas adhesivas añadidas a cada canal. La c...
Discusión
La motivación para desarrollar este método fue el deseo de modelar las enfermedades de la piel y estudiar los efectos de las terapias nuevas e innovadoras en una plataforma de alto rendimiento. Hasta la fecha, este laboratorio produce estos equivalentes dermo-epidérmicos mediante la fundición, ya sea manualmente o con la ayuda de la tecnología de bioimpresión 3D, el gel de fibrina con fibroblastos en una placa de inserción de cultivo celular y la siembra de los queratinocitos sobre ella. Una vez que los queratinoc...
Divulgaciones
Los autores declaran que no tienen intereses financieros contrapuestos.
Agradecimientos
Agradecemos sinceramente al Dr. Javier Rodríguez, a la Dra. María Luisa López, a Carlos Matellán y a Juan Francisco Rodríguez por sus sugerencias, discusiones y/o datos preliminares muy útiles. También agradecemos amablemente las contribuciones de Sergio Férnandez, Pedro Herreros y Lara Stolzenburg a este proyecto. Un agradecimiento especial a la Dra. Marta García por los hFB y hKC etiquetados con GFP. Finalmente, reconocemos la excelente asistencia técnica de Guillermo Vizcaíno y Angélica Corral. Este trabajo ha sido apoyado por el "Programa de Actividades de I+D entre Grupos de Investigación de la Comunidad de Madrid", Proyecto S2018/BAA-4480, Biopieltec-CM. Este trabajo también fue apoyado por el "Programa de excelencia", Proyecto EPUC3M03, CAM. CONSEJERÍA DE EDUCACIÓN E INVESTIGACIÓN.
Materiales
| Name | Company | Catalog Number | Comments |
| Amchafibrin | Rottafarm | Tranexamic acid | |
| Antibiotic/antimycotic | Thermo Scientific HyClone | ||
| Calcium chloride | Sigma Aldrich | ||
| Culture plates | Fisher | ||
| DMEM | Invitrogen Life Technologies | ||
| Double-sided tape vynil | ATP Adhesive Systems | GM 107CC, 12 µm thick | |
| Edge plotter | Brother | Scanncut CM900 | |
| FBS | Thermo Scientific HyClone | ||
| Fibrinogen | Sigma Aldrich | Extracted from human plasma | |
| Glass slide | Thermo Scientific | ||
| GFP-Human dermal fibroblasts | - | Primary. Gift from Dr. Marta García | |
| H2B-GFP-HaCaT cell line | ATCC | Immortalized keratinocytes. Gift from Dr. Marta García | |
| Live/dead kit | Invitrogen | ||
| PBS | Sigma Aldrich | ||
| Polycarbonate membrane | Merk TM | 5 µm pore size | |
| Polydimethylsiloxane | Dow Corning | Sylgard 184 | |
| Sodium chloride | Sigma Aldrich | ||
| Syringes | Terumo | 5 mL | |
| Thrombin | Sigma Aldrich | 10 NIH/vial | |
| Transparent adhesive vinyl | Mactac | JT 8500 CG-RT, 95 µm thick | |
| Trypsin/EDTA | Sigma Aldrich | ||
| Tubing | IDEX | Teflon, 1/16” OD, 0.020” ID |
Referencias
- McNamee, P., et al. A tiered approach to the use of alternatives to animal testing for the safety assessment of cosmetics: Eye irritation. Regulatory Toxicology and Pharmacology. 54 (2), 197-209 (2009).
- Mathes, S. H., Ruffner, H., Graf-Hausner, U. The use of skin models in drug development. Advanced Drug Delivery Reviews. 69-70, 81-102 (2014).
- Abd, E., et al. Skin models for the testing of transdermal drugs. Clinical Pharmacology: Advances and Applications. 8, 163-176 (2016).
- Flaten, G. E., et al. In vitro skin models as a tool in optimization of drug formulation. European Journal of Pharmaceutical Sciences. 75, 10-24 (2015).
- Avci, P., et al. Animal models of skin disease for drug discovery. Expert Opinion on Drug Discovery. 8 (3), 331-355 (2014).
- Mak, I. W., Evaniew, N., Ghert, M. Lost in translation: animal models and clinical trials in cancer treatment. American Journal of Translational Research. 6 (2), 114-118 (2014).
- Pronko, P. P., VanRompay, P. A., Zhang, Z., Nees, J. A. Pronko et al. Reply. Physical Review Letters. 86 (7-12), 1387 (2001).
- H.R.2858 - Humane Cosmetics Act. 114th Congress Available from: https://congress.gov/bill/114th-congress/house-bill/2858 (2016)
- . Global in-vitro toxicology testing market report: size, share & trends analysis 2014-2015 Available from: https://www.prnewswire.com/news-releases/global-in-vitro-toxicology-testing-market-report-size-share--trends-analysis-2014-2025-300704958.html (2018)
- Zhang, Z., Michniak-Kohn, B. B. Tissue engineered human skin equivalents. Pharmaceutics. 4 (1), 26-41 (2012).
- OECD. In vitro skin corrosion: reconstructed human epidermis (RhE) test method. Test Guideline No.431. OECD Guideline for Testing of Chemicals. , (2019).
- Almeida, A., Sarmento, B., Rodrigues, F. Insights on in vitro models for safety and toxicity assessment of cosmetic ingredients. International Journal of Pharmaceutics. 519 (1-2), 178-185 (2017).
- vanden Broek, L. J., Bergers, L. I. J. C., Reijnders, C. M. A., Gibbs, S. Progress and future Prospectives in Skin-on-Chip Development with Emphasis on the use of Different Cell Types and Technical Challenges. Stem Cell Reviews and Reports. 13 (3), 418-429 (2017).
- Ataç, B., et al. Skin and hair on-a-chip: In vitro skin models versus ex vivo tissue maintenance with dynamic perfusion. Lab on a Chip. 13 (18), 3555-3561 (2013).
- Abaci, H. E., Gledhill, K., Guo, Z., Christiano, A. M., Shuler, M. L. Pumpless microfluidic platform for drug testing on human skin equivalents. Lab on a Chip. 15 (3), 882-888 (2015).
- Wu, R., et al. Full-thickness human skin-on-chip with enhanced epidermal morphogenesis and barrier function. Materials Today. 21 (4), 326-340 (2017).
- Materne, E. -. M., et al. The multi-organ chip - a microfluidic platform for long-term multi-tissue coculture. Journal of Visualized Experiments: JoVE. (98), e52526 (2015).
- Schimek, K., et al. Bioengineering of a full-thickness skin equivalent in a 96-well insert format for substance permeation studies and organ-on-a-chip applications. Bioengineering. 5 (2), 43 (2018).
- Alberti, M., et al. Multi-chamber microfluidic platform for high-precision skin permeation testing. Lab on a Chip. 17, 1625-1634 (2017).
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature BIotechnology. 32 (8), 760-772 (2014).
- Huh, D., Hamilton, G. A., Ingber, D. E. From 3D cell culture to organs-on-chips. Trends in Cell Biology. 21 (12), 745-754 (2011).
- Wufuer, M., et al. Skin-on-a-chip model simulating inflammation, edema and drug-based treatment. Scientific Reports. 6, 37471 (2016).
- Ramadana, Q., Ting, F. C. W. In vitro micro-physiological immune-competent model of the human skin. Lab on a Chip. 16, 1899-1908 (2016).
- Kim, K., Jeon, H. M., Choi, K. C., Sung, G. Y. Testing the effectiveness of Curcuma longa leaf extract on a skin equivalent using a pumpless skin-on-a-chip model. International Journal of Molecular Sciences. 21 (11), 3898 (2020).
- Halldorsson, S., Lucumi, E., Gómez-Sjöberg, R., Fleming, R. M. T. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices. Biosensors and Bioelectronics. 63, 218-231 (2015).
- Huh, D., Matthews, B. D., Mammoto, A., Montoya-Zavala, M., Hsin, H. Y. Reconstituting organ-level lung functions on a chip. Science. 328 (5986), 1662-1668 (2010).
- Huh, D. A human disease model of drug toxicity - induced pulmonary edema in a lung-on-a-chip microdevice. Scientific Translational Medicine. 4 (159), (2012).
- Beckwitt, C. H., et al. Liver ' organ on a chip '. Experimental Cell Research. 363 (1), 15-25 (2018).
- Poceviciute, R., Ismagilov, R. F. Human-gut-microbiome on a chip. Nature Biomedical Engineering. 3 (7), 500-501 (2019).
- Kanda, T., Sullivan, K. F., Wahl, G. M. Histone-GFP fusion protein enables sensitive analysis of chromosome dynamics in living mammalian cells. Current Biology. 8 (7), 377-385 (1998).
- Escámez, M. J., et al. Assessment of optimal virus-mediated growth factor gene delivery for human cutaneous wound healing enhancement. Journal of Investigative Dermatology. 128 (6), 1565-1575 (2008).
- Llames, S. G., et al. Human plasma as a dermal scaffold for the generation of a completely autologous bioengineered skin. Transplantation. 77 (3), 350-355 (2004).
- Llames, S., et al. Clinical results of an autologous engineered skin. Cell Tissue Bank. 7 (1), 47-53 (2006).
- Cubo, N., Garcia, M., del Cañizo, J. F., Velasco, D., Jorcano, J. L. 3D bioprinting of functional human skin: production and in vivo analysis. Biofabrication. 9 (1), 015006 (2016).
- Mori, N., Morimoto, Y., Takeuchi, S. Skin integrated with perfusable vascular channels on a chip. Biomaterials. 116, 48-56 (2017).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), 7-15 (2016).
- Shah, P., et al. A microfluidics-based in vitro model of the gastrointestinal human-microbe interface. Nature Communications. 7, 11535 (2016).
- Marx, U., et al. Human-on-a-chip' developments: A translational cuttingedge alternative to systemic safety assessment and efficiency evaluation of substances in laboratory animals and man. Alternatives to Laboratory Animals. 40 (5), 235-257 (2012).
- Bein, A., et al. Microfluidic organ-on-a-chip models of human intestine. Cellular and Molecular Gastroenterology and Hepatology. 5 (4), 659-668 (2018).
- Bennet, D., Estlack, Z., Reid, T., Kim, J. A microengineered human corneal epithelium-on-a-chip for eye drops mass transport evaluation. Lab on a Chip. 18, 1539-1551 (2018).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a chip. 12, 2165-2174 (2012).
- Kim, H. J., Ingber, D. E. Gut-on-a-chip microenvironment induces human intestinal cells to undergo villus differentiation. Integrative Biology. 5 (9), 1130-1140 (2013).
- O'Neill, A. T., Monteiro-Riviere, N. A., Walker, G. M. Characterization of microfluidic human epidermal keratinocyte culture. Cytotechnology. 56 (3), 197-207 (2008).
- Ren, K., Chen, Y., Wu, H. New materials for microfluidics in biology. Current Opinion in Biotechnology. 25, 78-85 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados