Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Montaje con temperatura controlada y caracterización de una bicapa de interfaz de gota
En este artículo
Resumen
Este protocolo detalla el uso de un sistema de calentamiento de temperatura controlada de retroalimentación para promover el ensamblaje de monocapas lipídicas y la formación de bicapas de interfaz de gotitas para lípidos con temperaturas de fusión elevadas, y mediciones de capacitancia para caracterizar los cambios impulsados por la temperatura en la membrana.
Resumen
El método de la bicapa de interfaz de gotitas (DIB) para ensamblar bicapas lipídicas (es decir, DIB) entre gotitas acuosas recubiertas de lípidos en aceite ofrece beneficios clave en comparación con otros métodos: los DIB son estables y a menudo duraderos, el área de la bicapa se puede ajustar reversiblemente, la asimetría de las valvas se controla fácilmente a través de composiciones de gotitas, y las redes de bicapas similares a tejidos se pueden obtener al contiguas muchas gotitas. La formación de DIBs requiere el ensamblaje espontáneo de lípidos en monocapas lipídicas de alta densidad en las superficies de las gotitas. Mientras que esto ocurre fácilmente a temperatura ambiente para los lípidos sintéticos comunes, una monocapa suficiente o bicapa estable no puede formarse en condiciones similares para los lípidos con puntos de fusión por encima de la temperatura ambiente, incluyendo algunos extractos celulares del lípido. Este comportamiento probablemente ha limitado las composiciones y quizás la relevancia biológica de los DIB en los estudios de membranas modelo. Para abordar este problema, se presenta un protocolo experimental para calentar cuidadosamente el depósito de aceite que alberga gotas dib y caracterizar los efectos de la temperatura sobre la membrana lipídica. Específicamente, este protocolo muestra cómo utilizar un accesorio de aluminio térmicamente conductor y elementos de calentamiento resistivos controlados por un bucle de retroalimentación para prescribir temperaturas elevadas, lo que mejora el ensamblaje de monocapas y la formación de bicapas para un conjunto más amplio de tipos de lípidos. Las características estructurales de la membrana, así como las transiciones de fase termotrópicas de los lípidos que componen la bicapa, se cuantifican midiendo los cambios en la capacitancia eléctrica del DIB. En conjunto, este procedimiento puede ayudar en la evaluación de fenómenos biofísicos en membranas modelo a lo largo de varias temperaturas, incluida la determinación de una temperatura de fusión efectiva(TM)para mezclas de lípidos multicomponente. Por lo tanto, esta capacidad permitirá una replicación más cercana de las transiciones de fase naturales en las membranas modelo y fomentará la formación y el uso de membranas modelo de una franja más amplia de componentes de la membrana, incluidos aquellos que capturan mejor la heterogeneidad de sus contrapartes celulares.
Introducción
Las membranas celulares son barreras selectivamente permeables compuestas por miles de lípidos tipo1,proteínas, carbohidratos y esteroles que encapsulan y subdividen todas las células vivas. Comprender cómo sus composiciones afectan sus funciones y revelar cómo las moléculas naturales y sintéticas interactúan, se adhieren, interrumpen y translocan las membranas celulares son, por lo tanto, áreas importantes de investigación con implicaciones de amplio alcance en biología, medicina, química, física e ingeniería de materiales.
Estos objetivos para el descubrimiento se benefician directamente de las técnicas probadas para ensamblar, manipular y estudiar las membranas modelo, incluidas las bicapas lipídicas ensambladas a partir de lípidos sintéticos o naturales, que imitan la composición, la estructura y las propiedades de transporte de sus contrapartes celulares. En los últimos años, el método2,3,4 de la bicapa de interfaz de gotitas (DIB) para construir una bicapa lipídica plana entre gotas de agua recubiertas de lípidos en aceite ha recibido una atención significativa5,6,7,8,9,10, 11,12,13, 14,15, 16,17, 18,19,20,21,22,23,y ha demostrado ventajas prácticas sobre otros enfoques para la formación de membranas modelo: el método DIB es fácil de realizar, no requiere fabricación o preparación sofisticada (por ejemplo, "pintura") de un sustrato para soportar la membrana, produce consistentemente membranas con membranas superiores longevidad, permite mediciones electrofisiología estándar, y simplifica la formación de membranas modelo con composiciones asimétricas de foliolos3. Debido a que la bicapa se forma espontáneamente entre las gotitas y cada gotita se puede adaptar en posición y composición, la técnica DIB también ha atraído un interés considerable en el desarrollo de sistemas de materiales inspirados en las células que se basan en el uso de membranas sensibles a losestímulos18,24,25, 26,27, 28,29,compartimentación y transporteequilibrados 14,30, 31,y materiales similares a los tejidos17,23,32,33,34,35,36.
La mayoría de los experimentos publicados en membranas modelo, incluidas aquellas con DIBs, se han realizado a temperatura ambiente (RT, ~ 20-25 ° C) y con un puñado de lípidos sintéticos (por ejemplo, DOPC, DPhPC, etc.). Esta práctica limita el alcance de las preguntas biofísicas que se pueden estudiar en membranas modelo y, basándose en la observación, también puede restringir los tipos de lípidos que se pueden utilizar para ensamblar DIBs. Por ejemplo, un lípido sintético como dppc, que tiene una temperatura de fusión de 42 °C, no ensambla monocapas apretadas ni forma DIBs aRT 37. La formación de DIB a temperatura ambiente también ha resultado difícil para los extractos naturales, como los de mamíferos (por ejemplo, extracto lipídico total cerebral, BTLE)38 o bacterias (por ejemplo, extracto lipídico total de Escherichia coli, ETLE)37,que contienen muchos tipos diferentes de lípidos y se originan en células que residen a temperaturas elevadas (37 °C). Por lo tanto, permitir el estudio de diversas composiciones brinda oportunidades para comprender los procesos mediados por membranas en condiciones biológicamente relevantes.
Elevar la temperatura del aceite puede servir para dos propósitos: aumenta la cinética del ensamblaje de monocapas y puede hacer que los lípidos se sometan a una transición de fusión para alcanzar una fase desordenada líquida. Ambas consecuencias ayudan en el montaje monocapa39, un requisito previo para un DIB. Además del calentamiento para la formación de bicapas, el enfriamiento de la membrana después de la formación se puede utilizar para identificar transiciones dermatotrópicas en bicapas lipídicas individuales38,incluidas las de mezclas lipídicas naturales (por ejemplo, BTLE) que pueden ser difíciles de detectar mediante calorimetría. Además de evaluar las transiciones termotrópicas de los lípidos, la variación precisa de la temperatura del DIB se puede utilizar para estudiar los cambios inducidos por la temperatura en la estructura de la membrana38 y examinar cómo la composición lipídica y la fluidez afectan a la cinética de las especies activas en la membrana (por ejemplo, péptidos formadores de poros y proteínas transmembrana37),incluidas las membranas modelo de mamíferos y bacterias a una temperatura fisiológicamente relevante (37 °C).
Aquí, se explicará una descripción de cómo ensamblar un depósito de aceite DIB modificado y operar un controlador de temperatura de retroalimentación para permitir el ensamblaje de monocapas y la formación de bicapas a temperaturas superiores a RT. A diferencia de un protocolo anterior40,se incluye detalle explícito respecto a la integración de la instrumentación necesaria para medir y controlar la temperatura en paralelo al montaje y caracterización del DIB en el depósito de aceite. Por lo tanto, el procedimiento permitirá a un usuario aplicar este método para formar y estudiar DIBs en un rango de temperaturas en una variedad de contextos científicos. Además, los resultados representativos proporcionan ejemplos específicos para los tipos de cambios medibles tanto en la estructura de la membrana como en el transporte de iones que pueden ocurrir a medida que se varía la temperatura. Estas técnicas son adiciones importantes a los muchos estudios biofísicos que se pueden diseñar y realizar con eficacia en DIBs, incluyendo el estudio de la cinética de especies membrana-activas en diversas composiciones de la membrana.
Protocolo
1. Preparación del accesorio calentado
- Reúna 2 piezas de caucho aislante de 1 mm de espesor recortadas a 25 mm x 40 mm de ancho y largo, respectivamente, 2 piezas de una goma de 6 mm de espesor que también son de 25 mm x 40 mm, un conjunto de accesorio de base de aluminio preparado y un depósito de aceite acrílico que cabe en la ventana de visualización del accesorio de base de aluminio (consulte las figuras S1, S2 y S3 para obtener detalles sobre la fabricación y una vista explotada del ensamblaje). Prepare primero el accesorio de aluminio uniendo a la parte inferior del accesorio una ventana de visualización de cubiertas de vidrio con adhesivo curable UV y adhiriendo 1 elemento de calentamiento resistivo a la parte superior de cada brida lateral de 25 mm x 25 mm del accesorio.
- Coloque las piezas de goma más delgadas en el escenario del microscopio de tal manera que el borde largo de cada pieza sea tangencial a la abertura del escenario como se muestra en (Figura 1).
- Coloque el accesorio de base de aluminio en la parte superior de las almohadillas aislantes con la ventana de visualización del accesorio centrada sobre la lente objetivo. Se requiere una alineación adecuada para obtener imágenes de las gotitas conectadas.
- Coloque una pieza de goma más gruesa en la parte superior de cada elemento de calentamiento resistivo y use un clip de etapa de microscopio para mantenerlo en su lugar. Estas piezas protegen los elementos calefactores de los daños causados por los clips del escenario y aíslan contra el cortocircuito eléctrico accidental entre los elementos de calefacción y tanto el accesorio de aluminio como la etapa del microscopio.
- Doble cuidadosamente el extremo de medición de un termopar para lograr un ángulo de 90° a ~ 4 mm desde el extremo.
- Inserte la punta doblada del termopar en la esquina inferior izquierda del accesorio de aluminio y alíquela suavemente con el tornillo de bloqueo.
- Coloque el depósito de acrílico en el pozo del accesorio de aluminio. Esto se hace antes de agregar aceite de hexadecano al pozo (paso 1.8) del accesorio de aluminio para minimizar el riesgo de atrapar burbujas de aire entre la ventana de visualización y el fondo del depósito de acrílico, lo que puede obstruir la vista de las gotas.
NOTA: El aceite agregado al compartimiento de visualización del accesorio de aluminio se utiliza para que coincida con los índices de refracción del acrílico y el vidrio para obtener imágenes más claras de las gotitas contenidas dentro del depósito de acrílico. Por lo tanto, vale la pena señalar que el aceite en el pozo del accesorio de aluminio no entra en contacto con el contenido del depósito de acrílico y no se requiere una limpieza rigurosa del accesorio de aluminio. - Dispense ~ 1,000 μL de aceite de hexadecano en el pozo de accesorio de aluminio (es decir, entre las paredes del depósito de acrílico y el accesorio de aluminio), teniendo cuidado de no llenar en exceso. El nivel de aceite en el pozo del accesorio de aluminio debe ser tan alto como sea posible para maximizar el área de superficie para la transferencia de calor, sin permitir que el aceite se derrame sobre los bordes del accesorio en la etapa del microscopio o la lente objetivo.
- Dispense ~ 1,000 μL de aceite de hexadecano en el depósito de acrílico, sin dejar de tener en cuenta no llenar en exceso.
NOTA: El depósito de acrílico siempre debe limpiarse a fondo entre experimentos. El usuario debe emplear un regimiento que consiste en enjuagues sucesivos con alcohol etílico y agua desionizada seguidos de secado en un recipiente desecador durante más de 12 h.

Figura 1:Montaje de la etapa calentada. Las imágenes muestran el montaje del accesorio térmicamente conductor y el depósito de aceite para la formación de DIB; los números debajo de cada imagen identifican el paso correspondiente del protocolo. Haga clic aquí para ver una versión más amplia de esta figura.
2. Instrumentación para el control simultáneo de la temperatura de realimentación y caracterización eléctrica de un DIB
NOTA: Este protocolo integra los siguientes instrumentos para permitir el control de temperatura de retroalimentación y la caracterización eléctrica simultánea de un DIB: una computadora personal (PC) con dos conexiones de bus serie universal (USB) disponibles, un amplificador de abrazadera de parche emparejado a un sistema dedicado de adquisición de datos (DAQ-1), un generador de forma de onda, un segundo DAQ programable (DAQ-2) con módulos de salida de voltaje y entrada de temperatura, y una fuente de alimentación / amplificador. Los siguientes pasos describen las conexiones necesarias de estos instrumentos (como se ilustra en la Figura 2a)necesarias para aislar la medición y el control de la temperatura de la electrofisiología simultánea de un DIB. Las sustituciones de instrumentos equivalentes pueden efectuarse según sea necesario.
- Establezca conexiones de salida y entrada a los módulos DAQ-2.
- Seleccione dos pares de terminales de tornillo en el módulo de salida de voltaje para conexiones de voltaje diferenciales y conecte cables a estas ubicaciones. Los terminales de número impar son conexiones de tierra comunes, y los terminales de número par son salidas sin conexión a tierra, como se muestra en (Figura 2c). Conecte cada uno de estos dos pares de cables de cables de cable a adaptadores BNC de terminal de tornillo separados y, a continuación, conecte cada adaptador a un cable BNC independiente utilizado para enrutar las señales de voltaje a otros instrumentos.
NOTA: En esta configuración, las conexiones diferenciales en los terminales 0 y 1 se asignan para la salida de control de temperatura al amplificador de potencia, mientras que otro par de conexiones en los terminales 6 y 7 se designan para que la salida de voltaje se envíe a las gotas a través del amplificador de abrazadera de parche. - Refiriéndose a (Figura 2c), seleccione un conjunto de terminales de termopar (por ejemplo, los terminales 2 y 3 se designan como el par TC1) en el módulo de entrada del termopar y conecte a él los cables del termopar.
- Seleccione dos pares de terminales de tornillo en el módulo de salida de voltaje para conexiones de voltaje diferenciales y conecte cables a estas ubicaciones. Los terminales de número impar son conexiones de tierra comunes, y los terminales de número par son salidas sin conexión a tierra, como se muestra en (Figura 2c). Conecte cada uno de estos dos pares de cables de cables de cable a adaptadores BNC de terminal de tornillo separados y, a continuación, conecte cada adaptador a un cable BNC independiente utilizado para enrutar las señales de voltaje a otros instrumentos.
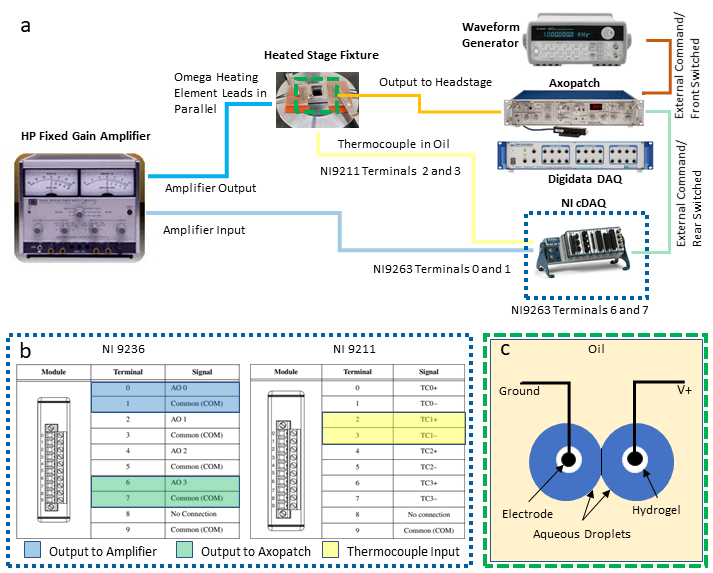
Figura 2:Conexiones de cableado del sistema. Un esquema de los dispositivos y el cableado necesarios para el sistema se muestra en(a ), mientras que una mirada detallada a las conexiones DAQ-2 se proporciona en (b). La ilustración en (c) muestra gotitas acuosas en electrodos recubiertos de hidrogel sumergidos en aceite para la formación de DIB. Los dos electrodos están conectados a las conexiones a tierra y sin conexión a tierra (V +), respectivamente, en la unidad de cabeza del amplificador de abrazadera de parche. Haga clic aquí para ver una versión más amplia de esta figura.
- Una vez realizadas las conexiones eléctricas a los módulos DAQ-2, conecte el chasis DAQ-2 a un PC a través de una conexión USB y conéctese a una fuente de alimentación eléctrica. A continuación, confirme la instalación correcta del controlador y del software antes de usarlo con un software comercial.
- Configure y conecte un amplificador de potencia entre daq-2 y elementos de calefacción resistivos.
- Configure el amplificador para que funcione en modo de amplificación de ganancia fija con una ganancia de 10X.
- Utilizando un adaptador banana jack-BNC, conecte el cable BNC procedente de los terminales 0 y 1 del módulo de salida de tensión(Figura 2b)a las conexiones de entrada del amplificador de potencia.
- Utilizando adaptadores BNC y cableado adicionales, conecte los terminales de salida del amplificador de potencia a ambos conjuntos de elementos de calefacción, que están cableados en paralelo entre sí y el amplificador para garantizar que ambos elementos mantengan la misma caída de tensión durante el uso.
- Establecer las conexiones necesarias para los equipos de electrofisiología.
- Conecte un cable BNC procedente de los terminales 6 y 7 del módulo de salida de tensión(Figura 2b)a los conectores BNC de comando externo conmutado traseros en la parte posterior del amplificador de abrazadera de parche.
- Conecte un segundo cable BNC entre la salida del generador de forma de onda y la conexión de comando externo del interruptor frontal en la parte posterior del amplificador de abrazadera de conexión.
NOTA: Estas dos conexiones proporcionan métodos alternativos para generar formas de onda de voltaje que se aplican a los electrodos de gotas a través del amplificador de abrazadera de parche. El generador de forma de onda es especialmente útil para generar voltajes de forma de onda triangulares utilizados para medir la capacitancia de la membrana. El usuario puede decidir cuáles, en su caso, son necesarios para su propia aplicación. - Con un tercer cable BNC, conecte la salida de la corriente medida ubicada en el panel frontal del amplificador de abrazadera de parche a un conector BNC de entrada analógica disponible en la parte frontal del DAQ-1.
- Con un cuarto cable BNC, conecte la salida del voltaje de membrana medido (en la parte posterior del amplificador de abrazadera de parche) a un conector de entrada analógico separado en DAQ-1. Esto permite la digitalización del voltaje aplicado a través de los electrodos.
- Con los dos electrodos de gotitas preparados y soportados en micromanipuladores como se describe en los pasos 7-9 en la ref.40,conecte los cables del electrodo a la tapa de la abrazadera de parche, que es el cable conectado a través del amplificador de abrazadera de parche.
NOTA: La función de la cabeza es controlar el voltaje entre los electrodos y medir la corriente resultante, que se convierte en un voltaje proporcional que obtiene la salida del amplificador de abrazadera de parche a DAQ-1. - Conecte el DAQ-1 a un PC a través de una conexión USB y conecte los cables de la fuente de alimentación correspondientes tanto al amplificador de abrazadera de conexión como al DAQ-1.
- Enciba todos los equipos de medición.
NOTA: Quizás el detalle más importante en esta configuración es asegurarse de que las conexiones de salida del amplificador de potencia (mA-A) estén aisladas eléctricamente de la unidad de cabeza del amplificador de abrazadera de parche, que utiliza un circuito sensible para medir las corrientes de nivel pA-nA en un DIB.
3. Control de temperatura de retroalimentación de bicapas de interfaz de gotas
NOTA: Los siguientes pasos para operar el sistema de control de temperatura de retroalimentación se basan en una interfaz gráfica de usuario (GUI) personalizada creada para implementar el control de temperatura de retroalimentación proporcional-integral (PI)40,41 (consulte Archivos de codificación suplementarios). En su lugar, se pueden utilizar otros algoritmos de software y control. Una copia de este programa se proporciona al lector con la información complementaria para el papel, sin embargo, el usuario es responsable de configurarlo para su propio equipo y necesidades.
- Inicie el software DAQ-2 en el PC y abra el archivo del programa de control de temperatura. Una vez que se abra la GUI, abra el programa de nuevo haciendo clic en el icono de carpeta en la esquina inferior izquierda de la GUI y seleccionando el programa de control de temperatura (Figura 3).
- Introduzca valores numéricos apropiados para la ganancia de control proporcional (KP) y la ganancia de control integral (KI).
NOTA: KP y KI valores de 0,598 y 0,00445, respectivamente, se encontraron para trabajar bien en la configuración. Estos valores se determinaron de forma iterativa mediante simulación utilizando un modelo de sistema que incorpora parámetros obtenidos a partir de las respuestas de calentamiento de bucle abierto medidas (ver Figura 4). Durante el calentamiento de circuito abierto,la potencia de calentamiento prescrita es independiente de la temperatura medida. En contraste, el calentamiento de circuito cerrado consiste en ajustar continuamente la potencia aplicada a los calentadores de una manera que ayuda a acercar la temperatura medida a la temperatura deseada. Esto se logra aquí utilizando un esquema de control de PI. - Para probar el esquema de control de temperatura, introduzca una temperatura de punto de ajuste deseada (por encima de la temperatura ambiente) y, a continuación, active el control de temperatura de realimentación dentro de la GUI. Observe la señal de temperatura medida bajo control de retroalimentación (bucle cerrado), que se muestra en la GUI durante los próximos minutos. Si la temperatura medida del aceite sobrepasa en gran medida la temperatura deseada, reacciona demasiado lentamente a los cambios o no converge al punto de ajuste deseado, el usuario tendrá que ajustar las ganancias de control para lograr el rendimiento de bucle cerrado deseado.
NOTA: El programa define un límite de saturación para la potencia (y por lo tanto el voltaje) suministrado a los elementos de calefacción resistivos. Por ejemplo, dos elementos notificados en este documento consumen hasta 5 W de potencia cada uno. Cableado en paralelo significa que el consumo total de energía no debe exceder de 10 W. Se recomienda al usuario que considere la cantidad máxima de energía que se debe suministrar a los dispositivos y sepa que este límite puede afectar a la velocidad a la que el sistema de circuito cerrado responderá a los cambios de temperatura deseados. Los elementos de calefacción de mayor potencia permiten un calentamiento más rápido y temperaturas de punto de juego más altas, pero requieren corrientes suministradas más altas para la calefacción. - Con el sistema ajustado a un rendimiento aceptable de bucle cerrado, ingrese la temperatura de aceite deseada para la formación de DIB como punto de ajuste en la GUI.
NOTA: Por ejemplo, una temperatura de punto de ajuste de 60 °C produjo buenos resultados en experimentos con liposomas BTLE en las gotitas acuosas37. El usuario es referido a otra parte2,40 para protocolos que explican el ensamblaje de DIB entre gotitas que cuelgan en electrodos de tipo alambre y la configuración del equipo de electrofisiología utilizando el amplificador de abrazadera de parche, DAQ-1 y el software de medición de electrofisiología. Específicamente, el protocolo de Najem, et al.40 se puede seguir de cerca hasta el Paso 13. Más allá de ese paso, se emplea un enfoque ligeramente diferente para la formación exitosa de monocapas y bicapas cuando se usan lípidos que requieren calentamiento para promover la formación de monocapas o bicapas. - Baje las puntas de los electrodos de plata / cloruro de plata (Ag / AgCl) en el aceite hasta que casi toquen el fondo del depósito de acrílico. Este posicionamiento de las puntas del electrodo es crucial para mantener la gota en el electrodo en aceite calentado, donde se han observado corrientes convectivas en el aceite para separar las gotas de los electrodos recubiertos de hidrogel (Figura 2c).
- Pipetee una gotita de 250 nL de solución lipídica acuosa que contenga 2 mg/mL de BTLE, cloruro de potasio (KCl) de 100 mM y ácido propanesulfónico (MOPS) 3-(N-morfolino) de 3 mM sobre cada punta de electrodo y déjelos incubar en el aceite calentado durante un mínimo de 10 minutos para promover la formación de monocapas.
- Cubra el headtage y el accesorio de escenario calentado con una jaula de Faraday puesta a tierra.
- Ponga las gotitas en contacto suave lentamente
manipulando las posiciones horizontales de los electrodos hasta que el usuario vea que las gotitas se deforman por el contacto o comienzan a desplazarse unas a otras y esperar unos minutos hasta que comience la formación de bicapas. Si después de varios minutos una bicapa no se ha formado, las gotitas pueden ser forzadas juntas más para facilitar la formación de bicapas. La formación de una bicapa interfacial adelgazada puede confirmarse mediante inspección visual(Figura 5a)o midiendo el aumento de la amplitud de una corriente capacitiva de forma de onda cuadrada inducida por un generador de forma de onda que emite una tensión triangular de 10 mV y 10 Hz22. Deje que la bicapa se equilibre durante un mínimo de 10 minutos para alcanzar un área interfacial estable, tras la formación inicial y antes de la caracterización posterior en el punto de ajuste inicial.
NOTA: El tipo de aceite puede tener un impacto significativo en el adelgazamiento de la bicapa, el espesor de la membrana y el ángulo de contacto entre gotas. En general, cuanto más pequeña es la molécula de aceite, más fácilmente puede permanecer en el núcleo hidrofóbico de la bicapa ocupada por cadenas de acilo lipídico. La retención de aceite aumenta las tensiones y el espesor de la monocapa y la bicapa y disminuye el área y el ángulo de contacto entre las gotitas. Estas métricas significan un estado de adhesión más débil. Las moléculas más grandes y voluminosas ejercen el efecto contrario. Por ejemplo, el escualeno es una molécula más voluminosa que los alcanos como el hexadecano, lo que permite que se excluya fácilmente de entre las monocapas durante el adelgazamiento de las bicapas. Como tal, los DIBs formados en escualeno son más delgados, muestran áreas y ángulos de contacto más altos, y exhiben mayores energías libres de formación22,42 (una medida de adhesión gota-gota).
4. Caracterización de comportamientos dependientes de la temperatura en DIBs
NOTA: Muchos procesos físicos se pueden estudiar en membranas modelo basadas en DIB, incluyendo cómo los cambios de temperatura afectan la estructura y las propiedades de transporte de la membrana. Los siguientes pasos deben realizarse después de la formación exitosa de bicapas a una temperatura deseada.
- Medir la capacitancia nominal de la membrana bajando la temperatura del baño de aceite desde un punto de ajuste que permita la formación de bicapas para identificar las transiciones de fase termotrópicas de los lípidos en la membrana38.
- Haga clic con el botón derecho en el gráfico de temperatura en la GUI y borre los datos mostrados. Esto garantiza que haya suficiente espacio disponible en el búfer para grabaciones posteriores.
- Utilizando el generador de forma de onda conectado al amplificador de abrazadera de parche, aplique una forma de onda de voltaje triangular (por ejemplo, 10 mV, 10 Hz) a través de los electrodos DIB y registre la respuesta de corriente inducida a través de la bicapa.
- Enfríe la bicapa reduciendo la temperatura del punto de ajuste en incrementos de 5 °C y esperando un mínimo de 5 min a la nueva temperatura de estado estacionario entre cambios de temperatura hasta que se logre la temperatura deseada. Alternativamente, intente enfriar pasivamente la bicapa apagando el sistema de control de retroalimentación. Tenga en cuenta, sin embargo, que los experimentos que implementan el enfriamiento pasivo de 50-60 ° C resultaron en tasas más altas de coalescencia.
- Después de que el baño de aceite y la bicapa se enfríen a la temperatura mínima deseada, haga clic con el botón derecho en el gráfico de temperatura en la GUI nuevamente y exporte los datos de temperatura versus el tiempo a un software de hoja de cálculo. Detenga la grabación actual.
- A partir de la corriente medida, calcule la capacitancia nominal de la respuesta de onda cuadrada-corriente versus el tiempo durante el período de enfriamiento.
- Trace la capacitancia nominal(C)versus la temperatura(T)para observar cómo cambió la capacitancia de la membrana. Localice los cambios nonmonotonic en C contra T para identificar TM.
NOTA: La capacitancia nominal se puede calcular a partir de la amplitud de la corriente de onda cuadrada43 (| I|) utilizar el | de relación Yo| = C dv/dt, donde dv/dt es igual a cuatro veces el producto de la amplitud de tensión (| V|) y la frecuencia(f) de la tensión triangular aplicada. A partir de estas ecuaciones, C = | I|/(4| V|f).
- Del mismo modo, evaluar la capacitancia específica cuasi-estática (Cm) de la bicapa a temperaturas fijas incrementando sucesivamente la temperatura del baño de aceite y el área de la bicapa.
- Cambie la temperatura del punto de ajuste en incrementos de 10 °C utilizando la GUI y permita que el sistema se equilibre a la nueva temperatura.
- Realice el paso 4.1.2 para iniciar la medición de la corriente capacitiva y la grabación.
- Cambie el área de la bicapa ajustando cuidadosamente las posiciones de los electrodos utilizando los micro-manipuladores (es decir, separar los electrodos reduce el área de la bicapa). Permita que la corriente de onda cuadrada alcance una amplitud de estado estacionario y recopile imágenes del DIB para permitir el cálculo del área de la membrana frente al tiempo mediante el uso de una cámara montada en el microscopio para obtener imágenes de la bicapa como se ve desde la apertura de la etapa del microscopio. Simultáneamente, agregue una etiqueta digital en el software de grabación actual para marcar el punto de tiempo correspondiente para la colección de imágenes.
NOTA: Los micro-manipuladores permiten el control preciso de los electrodos y, por lo tanto, el contacto suave entre las gotas. La manipulación gruesa de las gotitas puede conducir a un experimento fallido por coalescencia de las gotitas o haciendo que una gota se caiga del electrodo. Como se discutió en otra parte22,el área de bicapa se calcula a partir de la longitud de contacto entre las gotas, que aparecen como círculos superpuestos en una imagen de vista inferior. Las posiciones y dimensiones de las gotas, y la longitud de la línea de contacto, se pueden calcular utilizando un software de procesamiento de imágenes o con otras herramientas de programación científica. - Repita el paso 4.2.1.2 un mínimo de 4 veces para obtener un total de 5 imágenes DIB y regiones de estado estacionario de corriente bicapa.
- Repita el paso 4.2.1 a cada temperatura deseada.
- En los puntos de tiempo etiquetados correspondientes a las áreas bicapa de estado estacionario para las imágenes adquiridas, analice las grabaciones actuales y las imágenes DIB para extraer datos C y A para cada temperatura.
- Graficar los datos C versus A para cada temperatura y calcular la pendiente de una regresión de primer orden, que representa el Cm de la bicapa en cada temperatura22.
- Valores de la gráfica de Cm obtenidos del Paso 4.2.4 versus T.
- Examine los datos de Cm versus T en busca de variaciones no monotónicas para identificar temperaturas de fusión, TM.
- Cambie la temperatura del punto de ajuste en incrementos de 10 °C utilizando la GUI y permita que el sistema se equilibre a la nueva temperatura.
- Evalúe la dinámica de la formación de canales iónicos dependientes del voltaje generando una entrada de paso de voltaje de CC a través de la bicapa.
- Establezca voltaje inicial en el valor de paso deseado en mV (por ejemplo, 100 mV).
- Establezca el voltaje final y el tamaño del paso en un valor superior al paso deseado (por ejemplo, voltaje final de 110 mV y tamaño de paso de 110 mV).
- Establezca un tiempo de duración deseado para la entrada de paso en segundos (por ejemplo, 90 s).
- Elija la polaridad deseada para la entrada de paso (por ejemplo, positiva).
- Cambie el amplificador de abrazadera de parche para enviar al headtage el voltaje de comando que se origina en el módulo de salida gui/voltaje.
- Iniciar grabaciones actuales.
- Encienda el voltaje y registre la respuesta de corriente inducida, que debe exhibir una respuesta en forma de S a un voltaje crítico (por ejemplo, ~ 70 mV para 1 μg / mL Mz en 2 mg / mL BTLE).
- Por separado, las relaciones dinámicas de corriente-voltaje para una membrana se pueden obtener a las temperaturas deseadas para revelar relaciones dependientes de voltaje, como los comportamientos del canal iónico.
- Cambie el amplificador de abrazadera de parche para enviar a la cabeza el voltaje de comando que se origina en el generador de forma de onda e inicie las grabaciones de corriente.
- En el generador de forma de onda, genere una forma de onda sinusoidal continua con una amplitud, desplazamiento y frecuencia deseados.
- Registre la respuesta de corriente inducida a través de uno o varios ciclos.
- Repita como desee para diferentes amplitudes de onda sinusoidal y frecuencias y temperaturas.
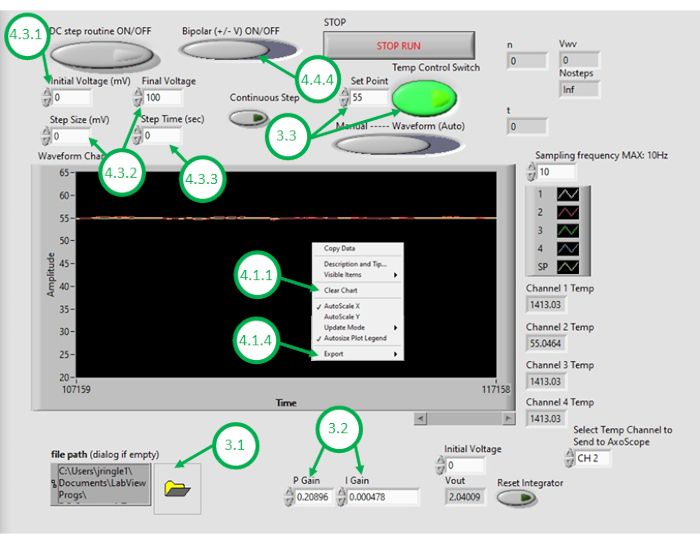
Figura 3:La GUI de control de temperatura. Esta figura resalta y etiqueta los pasos críticos necesarios para utilizar la GUI del programa para controlar la temperatura del baño de aceite. Haga clic aquí para ver una versión más amplia de esta figura.
Resultados
La Figura 1 muestra cómo el accesorio de aluminio y el depósito de aceite acrílico se preparan en la etapa de microscopio para la formación de DIB. Los pasos de montaje 1.2-1.4 sirven para aislar térmicamente el accesorio del escenario para una calefacción más eficiente. Los pasos 1.5-1.7 muestran cómo conectar correctamente el termopar al accesorio y colocar el depósito de aceite, y los pasos 1.8-1.9 muestran las ubicaciones recomendadas para dispensar aceite en estos pedazos.
...Discusión
El protocolo descrito aquí proporciona instrucciones para ensamblar y operar un sistema experimental para controlar la temperatura del aceite y las gotas utilizadas para formar DIBs. Es especialmente beneficioso para permitir la formación de DIB utilizando lípidos que tienen temperaturas de fusión por encima de RT. Por otra parte, variando con precisión la temperatura del depósito de aceite, la temperatura de la bicapa puede ser manipulada para estudiar los efectos de las temperaturas elevadas sobre diversas propie...
Divulgaciones
Los autores no tienen conflictos de intereses.
Agradecimientos
El apoyo financiero fue proporcionado por la Subvención de la Fundación Nacional de Ciencias CBET-1752197 y la Beca de la Oficina de Investigación Científica de la Fuerza Aérea FA9550-19-1-0213.
Materiales
| Name | Company | Catalog Number | Comments |
| 25 mm x 40 mm x 1 mm insulative rubber (x2) | Any | Insulates the bottom of the aluminum fixture from the stage of the microscope | |
| 25 mm x 40 mm x 6 mm insulative rubber (x2) | Any | Protects heating elements from being damaged by the microscope stage clips and insulates the top of the heating elements. | |
| 3-(N-morpholino) propanesulfonic acid | Sigma Aldrich | M3183 | Buffering agent for lipid solution |
| Acrylic substrate | Fabricated in house | HTD_STG_2 | ~1000 uL acrylic well with a poka-yoke exterior profile to fix orientation |
| Aluminum fixture | Fabricated in house | HTD_STG_1 | Base fixture with an oil well that holds the acylic fixture and includes two flat pads adjacent to the oil well for the heating elements |
| Brain Total Lipid Extract | Avanti | 131101C-100mg | 25 mg/mL porcine lipid extract |
| Compact DAQ Chassis (cDAQ) | National Instruments | cDAQ-9174 | Chassis to house multiple types of sensor measurement or output modules |
| Data Acquisition System (DAQ) | Molecular Devices | Digidata 1440A | High resolution analog to digital converter |
| Fixed gain amplifier/power supply | Hewlitt Packard | HP 6826A | Amplifies DC voltage output from the voltage output module |
| Glass Cover Slip | Corning | CLS284525 | Seals bottom of aluminum base and allows for optical characterization of the bilayer |
| Heating element (x2) | Omega | KHLV-101/5 | 25 mm x 25 mm polymide film kapton heating element with a 5 watt power limit. |
| M3 Stainless Steel Screw | McMaster Carr | 90116A150 | Secures thermocouple to aluminum fixture |
| Patch clamp amplifier | Molecular Devices | AxoPatch 200B | Measures current and outputs voltage to the headstage |
| Personal computer | Any | Computer with mulitiple high speed usb ports and a minimum of 6 Gb of ram | |
| Potassium Chloride | Sigma Aldrich | P3911 | Electrolyte solution of dissociated ions |
| Temperature input module | National Instruments | NI 9211 | Enables open and cold junction thermocouple measurements for the cDAQ chassis |
| Thermocouple | Omega | JMTSS-020U-6 | U-type thermocouple with a diameter of 0.02 inches and 6 inches in length |
| UV Curable Adhesive | Loctite | 19739 | Secures glass coverslip to aluminum base fixture |
| Voltage output module | National Instruments | NI 9263 | Analog voltage output module for use with the cDAQ chassis |
| Waveform generator | Agilent | 33210A | Used to output a 10 mV 10 Hz sinusoidal waveform |
Referencias
- van Meer, G., de Kroon, A. I. P. M. Lipid map of the mammalian cell. Journal of Cell Science. 124 (1), 5-8 (2011).
- Bayley, H., et al. Droplet interface bilayers. Molecular BioSystems. 4 (12), 1191-1208 (2008).
- Hwang, W. L., Chen, M., Cronin, B., Holden, M. A., Bayley, H. Asymmetric droplet interface bilayers. Journal of the American Chemical Society. 130 (18), 5878-5879 (2008).
- Holden, M. A., Needham, D., Bayley, H. Functional bionetworks from nanoliter water droplets. Journal of the American Chemical Society. 129 (27), 8650-8655 (2007).
- Sarles, S. A., Leo, D. J. Physical encapsulation of droplet interface bilayers for durable, portable biomolecular networks. Lab on a Chip. 10 (6), 710-717 (2010).
- Stanley, C. E., et al. A microfluidic approach for high-throughput droplet interface bilayer (DIB) formation. Chemical Communications. 46 (10), 1620-1622 (2010).
- Gross, L. C. M., Heron, A. J., Baca, S. C., Wallace, M. I. Determining membrane capacitance by dynamic control of droplet interface bilayer area. Langmuir. 27 (23), 14335-14342 (2011).
- Huang, J., Lein, M., Gunderson, C., Holden, M. A. Direct quantitation of peptide-mediated protein transport across a droplet, interface bilayer. Journal of the American Chemical Society. 133 (40), 15818-15821 (2011).
- Leptihn, S., Thompson, J. R., Ellory, J. C., Tucker, S. J., Wallace, M. I. In vitro reconstitution of eukaryotic ion channels using droplet interface bilayers. Journal of the American Chemical Society. 133 (24), 9370-9375 (2011).
- Castell, O. K., Berridge, J., Wallace, M. I. Quantification of membrane protein inhibition by optical ion flux in a droplet interface bilayer array. Angewandte Chemie International Edition. 51 (13), 3134-3138 (2012).
- Dixit, S. S., Pincus, A., Guo, B., Faris, G. W. Droplet shape analysis and permeability studies in droplet lipid bilayers. Langmuir. 28 (19), 7442-7451 (2012).
- Elani, Y., deMello, A. J., Niu, X., Ces, O. Novel technologies for the formation of 2-D and 3-D droplet interface bilayer networks. Lab on a Chip. 12 (18), 3514-3520 (2012).
- Michalak, Z., Fartash, D., Haque, N., Lee, S. Tunable crystallization via osmosis-driven transport across a droplet interface bilayer. CrystEngComm. 14 (23), 7865-7868 (2012).
- Punnamaraju, S., You, H., Steckl, A. J. Triggered release of molecules across droplet interface bilayer lipid membranes using photopolymerizable lipids. Langmuir. 28 (20), 7657-7664 (2012).
- Boreyko, J. B., Mruetusatorn, P., Sarles, S. A., Retterer, S. T., Collier, C. P. Evaporation-induced buckling and fission of microscale droplet interface bilayers. Journal of the American Chemical Society. 135 (15), 5545-5548 (2013).
- Leptihn, S., et al. Constructing droplet interface bilayers from the contact of aqueous droplets in oil. Nature Protocols. 8 (6), 1048-1057 (2013).
- Villar, G., Graham, A. D., Bayley, H. A Tissue-like printed material. Science. 340 (6128), 48-52 (2013).
- Barriga, H. M. G., et al. Droplet interface bilayer reconstitution and activity measurement of the mechanosensitive channel of large conductance from Escherichia coli. Journal of The Royal Society Interface. 11 (98), (2014).
- Boreyko, J. B., Polizos, G., Datskos, P. G., Sarles, S. A., Collier, C. P. Air-stable droplet interface bilayers on oil-infused surfaces. Proceedings of the National Academy of Sciences. 111 (21), 7588-7593 (2014).
- Mruetusatorn, P., et al. Dynamic morphologies of microscale droplet interface bilayers. Soft Matter. 10 (15), 2530-2538 (2014).
- Najem, J., Dunlap, M., Sukharev, S., Leo, D. J. The gating mechanism of mechanosensitive channels in droplet interface bilayers. MRS Proceedings. , 1755 (2015).
- Taylor, G. J., Venkatesan, G. A., Collier, C. P., Sarles, S. A. Direct in situ measurement of specific capacitance, monolayer tension, and bilayer tension in a droplet interface bilayer. Soft Matter. 11 (38), 7592-7605 (2015).
- Bayley, H., Cazimoglu, I., Hoskin, C. E. G. Synthetic tissues. Emerging Topics in Life Sciences. 3 (5), 615-622 (2019).
- Oliver, A. E., et al. Protecting, patterning, and scaffolding supported lipid membranes using carbohydrate glasses. Lab on a Chip. 8 (6), 892-897 (2008).
- Maglia, G., et al. Droplet networks with incorporated protein diodes show collective properties. Nature Nanotechnology. 4 (7), 437-440 (2009).
- Najem, J. S., et al. Activation of bacterial channel MscL in mechanically stimulated droplet interface bilayers. Scientific Reports. 5, 13726 (2015).
- Freeman, E. C., Najem, J. S., Sukharev, S., Philen, M. K., Leo, D. J. The mechanoelectrical response of droplet interface bilayer membranes. Soft Matter. 12 (12), 3021-3031 (2016).
- Tamaddoni, N., Sarles, S. A. Toward cell-inspired materials that feel: measurements and modeling of mechanotransduction in droplet-based, multi-membrane arrays. Bioinspiration & Biomimetics. 11 (3), 036008 (2016).
- Restrepo Schild, V., et al. Light-patterned current generation in a droplet bilayer array. Scientific Reports. 7, 46585 (2017).
- Milianta, P. J., Muzzio, M., Denver, J., Cawley, G., Lee, S. Water permeability across symmetric and asymmetric droplet interface bilayers: Interaction of cholesterol sulfate with DPhPC. Langmuir. 31 (44), 12187-12196 (2015).
- Mruetusatorn, P., et al. Control of membrane permeability in air-stable droplet interface bilayers. Langmuir. 31 (14), 4224-4231 (2015).
- Wauer, T., et al. Construction and manipulation of functional three-dimensional droplet networks. ACS Nano. 8 (1), 771-779 (2013).
- Bayley, H. Building blocks for cells and tissues: Beyond a game. Emerging Topics in Life Sciences. 3 (5), 433-434 (2019).
- Booth, M., Restrepo Schild, V., Downs, F., Bayley, J. Droplet network, from lipid bilayer to synthetic tissues. Encyclopedia of Biophysics. , (2019).
- Booth, M. J., Cazimoglu, I., Bayley, H. Controlled deprotection and release of a small molecule from a compartmented synthetic tissue module. Communications Chemistry. 2 (1), 142 (2019).
- Gobbo, P., et al. Programmed assembly of synthetic protocells into thermoresponsive prototissues. Nature Materials. 17 (12), 1145-1153 (2018).
- Taylor, G. J., Sarles, S. A. Heating-enabled formation of droplet interface bilayers using escherichia coli total lipid extract. Langmuir. 31 (1), 325-337 (2015).
- Taylor, G. J., et al. Capacitive detection of low-enthalpy, higher-order phase transitions in synthetic and natural composition lipid membranes. Langmuir. 33 (38), 10016-10026 (2017).
- Lee, S., Kim, D. H., Needham, D. Equilibrium and dynamic interfacial tension measurements at microscopic interfaces using a micropipet technique. 2. Dynamics of phospholipid monolayer formation and equilibrium tensions at the water-air interface. Langmuir. 17 (18), 5544-5550 (2001).
- Najem, J. S., et al. Assembly and characterization of biomolecular memristors consisting of ion channel-doped lipid membranes. Journal of Visualized Experiments. (145), e58998 (2019).
- Wang, Y. G., Shao, H. H. Optimal tuning for PI controller. Automatica. 36 (1), 147-152 (2000).
- Needham, D., Haydon, D. A. Tensions and free energies of formation of "solventless" lipid bilayers. Measurement of high contact angles. Biophysical Journal. 41 (3), 251-257 (1983).
- Sarles, S. A., Leo, D. J. Physical Encapsulation of Interface Bilayers for durable portable biolayer network. Lab on a Chip. 10 (6), 710-717 (2010).
- Muller, R. U., Peskin, C. S. The kinetics of monazomycin-induced voltage-dependent conductance. II. Theory and a demonstration of a form of memory. The Journal of General Physiology. 78 (2), 201-229 (1981).
- Nenninger, A., et al. Independent mobility of proteins and lipids in the plasma membrane of Escherichia coli. Molecular Microbiology. 92 (5), 1142-1153 (2014).
- Venkatesan, G. A., et al. Adsorption kinetics dictate monolayer self-assembly for both lipid-in and lipid-out approaches to droplet interface bilayer formation. Langmuir. 31 (47), 12883-12893 (2015).
- Najem, J. S., et al. Memristive ion channel-doped biomembranes as synaptic mimics. ACS Nano. 12 (5), 4702-4711 (2018).
- Tamaddoni, N., Taylor, G., Hepburn, T., Michael Kilbey, S., Sarles, S. A. Reversible, voltage-activated formation of biomimetic membranes between triblock copolymer-coated aqueous droplets in good solvents. Soft Matter. 12, 5096-5109 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados