Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Evaluación funcional de la barrera de unión estrecha intestinal y la permeabilidad iónica en tejido nativo mediante la técnica de cámara de Ussing
En este artículo
Resumen
El epitelio intestinal confiere no solo la absorción de nutrientes, sino también la protección contra sustancias nocivas. La unión intercelular epitelial más apical, es decir, la unión estrecha, regula el soluto paracelular y la permeabilidad iónica. Aquí, se describe un protocolo para la preparación de láminas mucosas y la evaluación de la selectividad iónica de uniones estrechas utilizando la técnica de cámara de Ussing.
Resumen
La técnica de la cámara de Ussing fue inventada por primera vez por el científico danés Hans Ussing en 1951 para estudiar el transporte transcelular de sodio a través de la piel de rana. Desde entonces, esta técnica se ha aplicado a muchos tejidos diferentes para estudiar los parámetros fisiológicos del transporte a través de las membranas. El método de la cámara de Ussing es preferible a otros métodos porque se puede usar tejido nativo, lo que lo hace más aplicable a lo que está sucediendo in vivo. Sin embargo, debido a que se utiliza tejido nativo, el rendimiento es bajo, el tiempo es limitado y la preparación del tejido requiere habilidad y entrenamiento. Estas cámaras se han utilizado para estudiar proteínas transportadoras específicas en diversos tejidos, comprender la fisiopatología de enfermedades como en la fibrosis quística, estudiar el transporte y la absorción de fármacos, y especialmente contribuyeron a la comprensión del transporte de nutrientes en el intestino. Dado todo el proceso de transporte epitelial de un tejido, no solo las vías transepiteliales, sino también las vías paracelulares son importantes. Las uniones estrechas son un determinante clave de la permeabilidad paracelular específica del tejido a través del intestino. En este artículo, la técnica de la cámara de Ussing se utilizará para evaluar la permselectividad paracelular de los iones mediante la medición de la conductancia transepitelial y los potenciales de dilución.
Introducción
El método de la cámara de Ussing fue desarrollado por primera vez por el científico danés Hans Ussing. Ussing lo usó por primera vez para medir la corriente de cortocircuito del transporte de sodio a través de la piel de rana después de que se observó que el NaCl podía transportarse a través de la piel contra un gradiente de concentración pronunciado1. Su sistema consistía en la piel de rana montada entre dos cámaras con acceso a cada lado de la piel. Cada cámara contenía la solución de Ringer que circulaba y aireaba. Dos estrechos puentes de timbre de agar situados cerca de la piel y conectados a electrodos Saturados de KCl-calomel midieron la diferencia de potencial según lo leído por un potenciador. Un segundo par de puentes de timbre de agar se situaron en el extremo opuesto de cada cámara conectados a vasos de precipitados con KCl saturado saturado de AgCl para aplicar una fuerza electromotriz proporcionada por una batería. Se utilizó un divisor de potencial para ajustar el voltaje de modo que la diferencia de potencial a través de la piel permaneciera cero, creando así condiciones de cortocircuito. También se conectó un medidor de microamperios para leer la corriente que pasa a través de la piel (consulte la figura en ref.1 para el diseño original de la cámara).
En los últimos 70 años, esta técnica se ha aplicado a muchos tejidos diferentes, particularmente al tejido intestinal, para estudiar el transporte de nutrientes e iones. Por ejemplo, el mecanismo de la diarrea inducida por el cólera se estudió montando íleon de conejo en estas cámaras, y se encontró que la diarrea inducida por la toxina del cólera está mediada por cAMP2. Además, estas cámaras también se utilizaron para estudiar el mecanismo subyacente al transporte de glucosa a través del cotransportador de Na+-Glucosa 1 (SGLT1)3. Nuestro laboratorio se centra en el transporte transcelular y paracelular en células epiteliales intestinales. Utilizando el método de la cámara de Ussing, se evaluó el transporte de péptidos en ratones knockout Claudin 15, que han deteriorado el transporte de sodio paracelular, utilizando cámaras de Ussing para medir la absorción del dipéptido no hidrolizable glicilsarcosina. Se encontró que la homeostasis luminal de Na+ es importante para el transporte de péptidos acoplados a protones4. Además, estas cámaras también se utilizaron para investigar la secreción de aniones en el ciego murino en respuesta a la activación submucosa del receptor 1 activado por la proteinasa por la serina proteasa tripsina5.
Las cámaras de ussing también se han utilizado recientemente para evaluar las vías paracelulares en el tejido epitelial. Las vías paracelulares están reguladas por uniones estrechas, que son complejos de proteínas que se forman en el punto donde dos o más células se encuentran6. La función de barrera y la selectividad iónica (si los aniones o cationes son selectivamente capaces de pasar a través de la unión estrecha) está determinada por la presencia de proteínas de la familia de la claudina; algunos de los cuales actúan como barreras (claudina 3 y 7), poros aniónicos (claudina 10a) o poros catiónicos (claudina 2, 10b y 15)7. Se han utilizado otros métodos para evaluar la vía paracelular, como la sonda oral de FITC acompañada de concentración plasmática de FITC8, o EDTA-Cr9; sin embargo, estas técnicas son de menor resolución y no pueden evaluar la selectividad iónica o una sección específica de las secciones del tracto intestinal. Las cámaras de ussing, sin embargo, se pueden utilizar para evaluar el potencial de dilución de los iones objetivo y, por lo tanto, determinar la selectividad iónica de las uniones estrechas. Por ejemplo, con NaCl, la selectividad de las uniones estrechas para Na+ y Cl- se puede calcular diluyendo un lado de la membrana (generalmente el lado de la mucosa) y midiendo el cambio en la diferencia de potencial transepitelial. Las permeabilidades relativas de Na+ y Cl- pueden estimarse mediante la ecuación de Goldman-Hodgkin-Katz10 y la selectividad de la unión estrecha puede estimarse utilizando la ecuación de Kimizuka-Koketsu11. Estas cámaras, por lo tanto, tienen la ventaja de medir los parámetros electrofisiológicos del tejido y, como resultado, proporcionan más información sobre el paso de iones a través de las uniones estrechas que otros métodos de menor resolución.
El método de la cámara de Ussing no solo se limita al tracto intestinal, aunque es ampliamente utilizado en estudios relacionados con el intestino, sino que también tiene muchas otras aplicaciones. Por ejemplo, estas cámaras se han utilizado para estudiar la Fibrosis Quística, y específicamente el regulador de la conductancia transmembrana de la fibrosis quística del canal cloruro (CFTR)12. La fibrosis quística es causada por una mutación en CFTR13, que resulta en una alteración de la secreción de cloruro y el transporte de líquido por las células epiteliales respiratorias, y una capa mucosa más gruesa y seca resultante14. El estudio del CFTR epitelial de las vías respiratorias se ha realizado con estas cámaras no solo para comprender la enfermedad, sino también para descubrir formas de tratar la enfermedad. Por ejemplo, en pacientes con mutaciones raras que causan Fibrosis Quística, el análisis de las células epiteliales respiratorias del paciente se ha utilizado para probar terapias como Orkambi y una coterapia amplificadora15.
Las cámaras de ussing también se han utilizado para estudiar las vías de administración de fármacos, como con el tejido de biopsia humana para estudiar la captación de fármacos y la farmacocinética16. La absorción intestinal no es la única vía de administración de fármacos. Estas cámaras también se han utilizado para estudiar los sistemas nasales de administración de fármacos17. También se han realizado estudios de administración de fármacos con cámaras de Ussing para el ojo. En la córnea del conejo, se realizaron estudios de permeabilidad y captación con Labrasol, un fármaco diseñado para aumentar la absorción de fármacos a través de los tejidos18. Otro estudio examinó el efecto del cloruro de bencilalconio en la administración transescleral de fármacos en la esclerótica del conejo19.
El método de la cámara de Ussing es útil porque se puede utilizar tejido nativo. Como tal, es preferible a los modelos in vitro como las líneas celulares Caco-2. Sin embargo, la técnica requiere habilidad y tiempo para preparar especímenes, por lo que no es adecuada para aplicaciones de alto rendimiento. Las propiedades electrofisiológicas de las monocapas celulares se pueden estudiar utilizando insertos de cultivo celular en estas cámaras. Descubrimientos recientes han permitido el cultivo de organoides que son mini-órganos cultivados en cultivo a partir de la cosecha de células madre epiteliales o endoteliales20. El cultivo de organoides puede ser manipulado para ser cultivado en una monocapa, lo que permite montar organoides en una cámara de Ussing21. Se pueden estudiar organoides de diversos tejidos epiteliales y endoteliales, reduciendo el número de animales requeridos, ya que el cultivo de organoides se puede mantener a largo plazo. Esto también aumentará el rendimiento, ya que no se necesitarán pasos laboriosos y de disección y preparación de tejidos que consumen mucho tiempo. En el futuro, los estudios de cámara de Ussing seguirán siendo muy útiles para estudiar el transporte de tejidos y serán especialmente importantes en el campo de la medicina personalizada.
El siguiente protocolo demuestra la aplicación del método de la cámara de Ussing para evaluar la permselectividad y la función de barrera de las uniones estrechas en el intestino delgado de ratones Claudin 15 knockout (Cldn15-/-) y controles de tipo salvaje (WT) midiendo el potencial de dilución de NaCl. Las uniones estrechas (TJ) se forman en el punto donde dos o más células se encuentran en el tejido epitelial y endotelial. Se cree que las uniones estrechas bicelulares (bTJ), particularmente las proteínas de la familia de la claudina que se encuentran dentro de la bTJ, determinan la función de barrera y la permselectividad de TJ7. Los ratones Cldn15-/- tienen un mega intestino delgado22 y una capacidad reducida de absorción de nutrientes debido a la pérdida de reciclaje intestinal de Na+ que se produce a través de la claudina 154,23,24. Los ratones Cldn15-/- tienen una homeostasis de Na+ deteriorada, lo que los convierte en un modelo interesante para estudiar la permselectividad del TJ. El siguiente protocolo evalúa la permeabilidad del TJ al NaCl midiendo el potencial de dilución del NaCl (PNa/PCl) en el intestino delgado medio. Brevemente, el cambio en la diferencia de potencial de membrana que se produce al diluir un lado de la membrana (lado M o lado S, ambos se miden en el protocolo a continuación) se puede utilizar para calcular la permeabilidad de Na + (PNa) y Cl- (PCl), y el potencial de dilución (PNa / PCl) mostrará si la unión estrecha tiene una selectividad catiónica o aniónica.
Los experimentos en este protocolo se llevaron a cabo utilizando una cámara ussing personalizada (Figura 1A), que consta de dos mitades, entre las cuales se monta verticalmente la preparación intestinal, amplificador de pinza de voltaje, registrador eléctrico, electrodos, puentes de sal, solución de Ringer, tampón HEPES (150 mM NaCl), tampón HEPES diluido (75 mM NaCl), preparación intestinal (para detalles sobre el equipo, consulte la Tabla de materiales).
Protocolo
Todos los animales utilizados en estos experimentos se mantuvieron en el centro de cuidado de animales de la Universidad de Shizuoka y los experimentos se llevaron a cabo de acuerdo con las pautas para la investigación con animales establecidas por la Universidad de Shizuoka. Todos los experimentos se llevaron a cabo con la aprobación del Comité de Cuidado y Uso de Animales de la Universidad de Shizuoka (Permisos # 205272 y # 656-2303).
1. Preparación de electrodos de NaCl
NOTA: Los electrodos utilizados en estos experimentos consisten en NaCl concentrado o KCl. Los electrodos KCl/calomel se compran comercialmente. Antes de comenzar el experimento, asegúrese de que todos los electrodos estén llenos hasta la parte superior con una solución concentrada de NaCl o KCl.
- Prepare frascos de vidrio pequeños con tapas de plástico (volumen 20 ml).
- Perfore dos orificios en las tapas de plástico, uno para el puente de sal de NaCl (2,5 mm de diámetro) y el otro para el alambre de plata (1 mm de diámetro; Figura 1C, electrodo de NaCl).
- Llene el frasco de vidrio con una solución saturada de NaCl (aproximadamente 15 ml, hasta que esté lleno).
- Inserte alambre de plata (0,8 mm de diámetro, 7 cm de largo) en el frasco, pero asegúrese de que la parte del cable fuera del frasco se pueda conectar a través de clips de cocodrilo (tamaño pequeño) al sistema amplificador.
- Cuando no esté en uso, envuelva los electrodos y asegúrese de que los orificios estén cubiertos, con parapelícula para evitar el secado.
2. Preparación de puentes de sal
NOTA: Prepare puentes de sal al menos un día antes del experimento para proporcionar el tiempo adecuado para solidificarse. Los puentes de sal se pueden usar repetidamente, pero no se recomienda su uso después de 2 meses.
- Puentes de sal de NaCl
- Prepare tubos de polietilo # 7 (diámetro exterior 2.3 mm, diámetro interior 1.3 mm), aguja de 19 G y jeringa tipo cerradura, 200 ml de solución de NaCl de 1 M, agar de 2 g, recipiente de plástico sellable para el almacenamiento en puentes de sal.
- Prepare el número adecuado de puentes de sal cortando los tubos al tamaño necesario para la configuración de la cámara ussing (cada cámara requiere dos puentes de sal).
- Antes de la inyección de agar, haga una forma de U con los tubos y colóquelos en un vaso de precipitados de agua tibia (para crear una forma fácil de colocar puentes de sal).
- Hacer 200 mL de 1 M de NaCl disolviendo 11.688 g de NaCl en 200 mL en agua desionizada.
- Dividir 1 M de NaCl en porciones de 100 mL: Hacer 100 mL de agar al 2% en 1 M de NaCl (mezclar 2 g de agar en NaCl, calentar en microondas para disolver).
- Con una aguja de 19 G y una jeringa de bloqueo, llene la jeringa con 1 M de Solución de NaCl/agar. Comience suavemente a expulsar la solución gota a gota y, mientras lo hace, inserte la aguja en un extremo del tubo y llene hasta que la mezcla salga del otro lado.
- Retire lentamente la aguja mientras sigue expresando la solución y repita hasta que se hayan hecho todos los puentes de sal necesarios. (Si la solución se solidifica en la jeringa o aguja, caliéntela brevemente en agua caliente hasta que la solución pueda expresarse nuevamente).
- Revise los puentes de sal para asegurarse de que no haya burbujas y guárdela en la solución restante de 1 M de NaCl en un recipiente sellable.
- Puentes de sal KCl
NOTA: Los tubos más delgados se utilizan para los puentes de agar KCl para evitar el incremento de la concentración de K + en el tampón, ya que las puntas del puente de sal pueden disolverse y K + puede filtrarse en el búfer.- Prepare tubos de polietilo # 3 (diámetro exterior 1.0 mm, diámetro interior 0.5 mm), aguja de 23 G y jeringa tipo cerradura, 200 ml de solución KCl de 1 M, agar de 2 g, recipiente de plástico sellable para almacenamiento en puente de sal.
- Prepare el número adecuado de puentes de sal cortando el tubo al tamaño necesario para la configuración de la cámara ussing (cada cámara requiere dos puentes de sal).
- Hacer 200 mL de 1 M KCl disolviendo 14,91 g de KCl en 200 mL de agua desionizada.
- Dividir en dos porciones de 100 mL: Hacer 100 mL de agar al 2% en 1 M KCl (mezclar 2 g de agar en KCl, calentar en un microondas para disolver).
- Usando una aguja de 23 G y una jeringa de bloqueo, inyecte el tubo con una mezcla de agar al 2% y 1 M KCl (asegúrese de que los tubos estén completamente llenos y no haya burbujas) de la misma manera que con los puentes de sal de NaCl.
- Revise los puentes de sal para asegurarse de que no haya burbujas y guárdela en la solución restante de 1 M KCl en un recipiente sellable.
3. Preparación de la solución de Ringer y el tampón HEPES
NOTA: Dependiendo del tejido montado en la cámara de Ussing, los componentes de la solución de Ringer pueden diferir. Las recetas presentadas aquí son específicas para el intestino delgado y grueso.
- Haga que la solución de Ringer sea fresca el día de los experimentos como se describe en la Tabla 1.
- Burbujear la solución con 95% de O2/5% de CO2 para proporcionar O2 al tejido y una capacidad de amortiguación.
| Solución de Ringer (intestino delgado) | Solución de Ringer (intestino grueso) |
| NaHCO3 – 21.0 mM | NaHCO3 – 21.0 mM |
| K2HPO4 – 2,4 mM | K2HPO4 – 2,4 mM |
| KH2PO4 – 0,6 mM | KH2PO4 – 0,6 mM |
| NaCl – 119.0 mM | NaCl – 119.0 mM |
| MgCl2 – 1.2 mM | MgCl2 – 1.2 mM |
| CaCl2 – 1.2 mM | CaCl2 – 1.2 mM |
| Indometacina – 10 μM (Haga 1 mM de caldo en 21 mM de NaHCO3, agregue 10 ml de caldo para 1 L de solución de Ringer) | Indometacina – 10 μM (Haga 1 mM de caldo en 21 mM de NaHCO3, agregue 10 ml de caldo para 1 L de solución de Ringer) |
| 1 mM de glutamina (0,146 g/L) | 10 mM de glucosa |
Tabla 1: Receta de la solución de Ringer. Para hacer la solución de Ringer, mezcle todos los componentes con agua desionizada. La solución de Ringer se hace mejor fresca antes de los experimentos. Mantener en el refrigerador o en hielo hasta su uso. Antes de usar, gas con 95% de O2/5% de CO2.
- Haga que el tampón HEPES sea fresco el día del experimento como se describe en la Tabla 2 mezclando los ingredientes en agua desionizada.
- No se ajuste al volumen final del tampón hasta después del ajuste del pH.
- Caliente el tampón HEPES a 37 °C y ajuste el pH a 7.4 agregando lentamente gotas de solución tris de 1 M mientras se agita.
- Ajuste al volumen final agregando la cantidad adecuada de agua desionizada.
| Búfer HEPES | Tampón HEPES de dilución |
| HEPES – 10 mM | HEPES – 10 mM |
| Glucosa – 10 mM (Intestino grueso) | Glucosa – 10 mM (Intestino grueso) |
| 1 mM de glutamina (0,146 g/L) (intestino delgado) | 1 mM de glutamina (0,146 g/L) (intestino delgado) |
| NaCl – 150 mM | NaCl – 75 mM + 150 mM manitol (para ajustar las diferencias de osmolalidad) |
| MgCl2 – 1 mM | MgCl2 – 1 mM |
| CaCl2 – 2 mM | CaCl2 – 2 mM |
| Indometacina – 10 μM (Haga 1 mM de caldo en 21 mM de NaHCO3, agregue 10 ml de caldo para 1 L de solución de Ringer) | Indometacina – 10 μM (Haga 1 mM de caldo en 21 mM de NaHCO3, agregue 10 ml de caldo para 1 L de solución de Ringer) |
| Ajuste a pH 7.40 (37°C) usando 1 M Tris | |
Tabla 2: Receta del búfer HEPES. Para hacer hepes buffer y dilución HEPES buffer, disuelva todos los ingredientes en agua desionizada. Las soluciones deben ajustarse al pH con una solución de 1 M Tris, por lo que no agregue un volumen completo de agua (por ejemplo, al hacer 1 L, disuelva todos los ingredientes en aproximadamente 800 ml de agua). Luego caliente la solución a 37 ° C, ajuste el pH a 7.4 y luego ajuste el volumen final.
4. Configuración de la cámara de ussing
NOTA: Las cámaras Ussing utilizadas en este protocolo son cámaras de perfusión continua hechas a medida. Para evaluar la función de barrera intestinal del ratón o la absorción de nutrientes, se recomiendan cámaras con una abertura de 4 o 5 mm de diámetro25 (Figura 1A-C).
- Para reducir el efecto de borde26 y ayudar a sellar las cámaras, coloque una película de parafina perforada de 4 o 5 mm (aproximadamente 4 cm2) antes de instalarla (Figura 1B).
- Configurado en condiciones de circuito abierto para la medición del potencial de dilución. Establecido en modo de abrazadera actual. Establezca la salida como corriente y establezca el pulso de corriente en ±20 μA.
- Cuando se configura en condiciones de cortocircuito para la medición de corriente de cortocircuito y resistencia transmucosa, se configura en modo de abrazadera de voltaje. Configure la salida como voltaje y ajuste el pulso de voltaje a ±5 mV.
- Asegúrese de que el agua a 37 °C circule en la camisa de agua.
- Llene cada cámara con la solución de Ringer o el tampón HEPES (la cantidad depende del sistema utilizado, las cámaras utilizadas aquí requieren 5 ml para cada lado) y asegúrese de que no haya fugas.
- Conecte puentes de sal y electrodos.
- Asegúrese de que el voltaje sea 0 y estable, corriente de pulso para garantizar que los puentes de sal y los electrodos estén configurados correctamente.
- Permita que la temperatura del sistema y de la solución de Ringer se equilibre durante al menos 20 minutos.
- Después del equilibrio, corrija la diferencia de voltaje asimétrica entre los electrodos KCl y compense la resistencia del fluido cambiándola a cero (consulte el manual del sistema de cámara ussing utilizado para determinar la forma correcta).
5. Disección del tejido intestinal
NOTA: Toda experimentación animal debe llevarse a cabo dentro de las regulaciones establecidas por el país y la universidad.
- Antes de tomar el tejido intestinal, prepare la solución fresca y helada de Ringer y burbujee con 95% de O2 y 5% de CO2 durante 15 min (paso 3).
- Anestesiar ratones de acuerdo con las pautas que rigen el uso de animales en la investigación. Para este experimento, los ratones fueron anestesiados con 2% -3% de isoflurano administrado por un anestesista. Verifique la anestesia adecuada pellizcando los dedos de los pies y asegurándose de que no haya respuesta al dolor.
- Hacer una incisión en el abdomen con tijeras desde la pelvis hasta el diafragma; localizar el estómago y cortar el extremo pilórico del estómago.
- Agarre la porción del estómago unida al intestino delgado con fórceps y tire suavemente del intestino delgado mientras corta los accesorios mesentéricos. Tenga cuidado de no cortar o dañar el tejido intestinal de ninguna manera.
- Continúe diseccionando el intestino hasta el ano. Para la extirpación completa del intestino grueso, corte los huesos pélvicos para revelar la porción distal del intestino grueso y elimine cuidadosamente el resto del intestino cortando los accesorios.
- Mida la longitud del intestino y divídala en segmentos deseados. Para este experimento, divida el intestino delgado en tres segmentos y use el segmento medio.
- Coloque los segmentos deseados en la solución de Ringer helada y burbujeada; luego, abra cada segmento longitudinalmente cortando a lo largo de los accesorios mesentéricos. Recorte la grasa y el tejido conectivo.
- Devuelva los segmentos a la solución de Ringer helada y lávelos bien (incluso en la solución helada, la oxigenación del epitelio luminal es importante para mantener la función epitelial).
6. Extracción de la capa muscular y preparación de la lámina intestinal
NOTA: La eliminación de la serosa (capa muscular) es importante para los estudios de transporte utilizando el intestino. Si la serosa permanece, el tejido intestinal puede estar sujeto a contracciones musculares aleatorias que distorsionarán los datos electrofisiológicos, y el transporte puede ser inhibido. El tejido no recortado se deteriora rápidamente cuando se monta en cámaras de Ussing, ya que la serosa es una barrera de difusión significativa para el sustrato y el oxígeno. En algunos casos especiales, puede ser necesario mantener la capa muscular, por lo que la decisión depende del investigador y del diseño experimental. Las láminas intestinales se pueden preparar de dos maneras dependiendo de qué capa se elimine (Figura 2). Para este experimento, se requieren preparaciones de mucosa y submucosa (Figura 2, 2º panel).
- Prepare placas de disección (10 cm de diámetro) cubiertas con goma de silicona, pasadores (agujas de acupuntura pequeñas), papel de filtro perforado de 5 mm y cuadrados de parafilm (2 cm x 2 cm; puede no ser necesario para otros sistemas).
- Vierta la solución de Ringer fresca, helada y burbujeada en la placa de disección (suficiente para cubrir el tejido, aproximadamente 2-3 ml).
- Debajo de un estereomicroscopio, fije los extremos del tejido intestinal (lado de la mucosa hacia abajo).
- Usando fórceps finos, diseccione sin rodeos la capa muscular de la mucosa subyacente.
- Tenga cuidado de no rasgar ni introducir ningún agujero en el tejido.
- Una vez que se retira la capa muscular, corte una pieza lo suficientemente grande como para una abertura de 5 mm de diámetro. Al preparar el intestino delgado, la eliminación de la capa serosa-muscular debe realizarse dentro de los 10 minutos, ya que la oxigenación luminal es difícil en estas condiciones.
- Humedezca el cuadrado de papel de filtro perforado de 5 mm en la solución de Ringer y coloque el tejido intestinal sobre él con el lado de la mucosa hacia abajo, ya que las preparaciones submucosas se envuelven espontáneamente con el lado de la mucosa exterior.
- Asegúrese de que la abertura esté completamente cubierta por el tejido intestinal y que no haya arrugas presentes. Use una pizarra negra debajo de la preparación para examinar si la abertura está completamente cubierta.
- Repita este procedimiento para el número requerido de preparaciones de mucosa (en este experimento se requieren dos preparaciones: una preparación se utilizará para medir el potencial de dilución y la otra se utilizará para medir los parámetros eléctricos basales).
7. Montaje de preparaciones intestinales en cámaras Ussing
NOTA: La configuración dependerá del tipo de sistema de cámara Ussing y del sistema de grabación utilizado.
- Succiona la solución de Ringer/tampón HEPES de la cámara ussing.
- Desmonte la cámara ussing y coloque el papel de filtro con el lado de la mucosa de preparación intestinal hacia abajo en la cámara lateral de la mucosa y ajuste para que la ventana de la cámara se alinee con el orificio del papel de filtro (Figura 1A, la marca negra alrededor de la ventana de la cámara es útil para la alineación de las preparaciones).
- Coloque con cuidado la cámara lateral serosal en la cámara lateral mucosa y ciérrela con fuerza, pero asegúrese de que la lámina intestinal no se haya movido durante la conexión.
- Rellene rápidamente ambas cámaras con la solución de Ringer o tampón HEPES, y coloque varitas burbujeantes (solución de Ringer: 95% O2/5% CO2; Tampón HEPES: 100% O2) en el extremo opuesto de las cámaras, lejos de la membrana (burbujear demasiado cerca de la preparación podría tener un efecto en las mediciones).
- Vuelva a conectar los puentes de sal y compruebe si el voltaje es estable y la corriente de pulso para asegurarse de que las conexiones estén bien (Figura 1C).
- Repetir para cada preparación intestinal.
- Deje que el sistema se equilibre durante unos 15 minutos. Si utiliza un sistema de grabación, deje que la diferencia de conductancia y de potencial Isc/membrana se estabilice antes de comenzar los experimentos.
8. Experimento de potencial de dilución (condiciones de circuito abierto)
- Lave ambos lados de la cámara succionando el tampón HEPES y agregando 5 ml de tampón HEPES fresco precalentado a cada lado.
- Encienda el sistema de grabación. Establezca el rango a 250 mV (el sistema utilizado aquí amplifica el voltaje de salida 10x), establezca las posiciones de los marcadores y configure el sistema de grabación para medir.
- Gire los sistemas de cámara Ussing al modo de abrazadera y comience a medir. Una vez que el potencial de membrana se ha estabilizado (~ 15-20 min), la evaluación puede comenzar.
- Succiona el tampón HEPES desde el lado de la mucosa y reemplázalo rápidamente con 5 ml de tampón HEPES de dilución calentada que contiene 75 mM de NaCl.
- Una vez que el potencial de membrana haya alcanzado su punto máximo (5-10 min), retire el tampón de dilución del lado "Mucosal" y reemplácelo con el tampón HEPES.
- Si es necesario, repita el paso 3 para el lado serosal, agregando el tampón HEPES de dilución al lado serosal.
- Para asegurarse de que el tejido es viable, agregue el activador de la adenilato ciclasa Forskolin (concentración final 10 μM) al lado serosal.
- Una vez que la diferencia de potencial de la membrana ha alcanzado un pico y ha comenzado a disminuir, el experimento ha terminado.
9. Medición de la conductancia eléctrica transepitelial y la línea de base Isc (condiciones de cortocircuito)
- Lave ambos lados de la cámara succionando la solución de Ringer y agregando 5 ml de solución de Ringer fresca burbujeada a cada lado.
- Encienda el sistema de grabación. Establezca el rango a 2.5 V (el sistema utilizado aquí amplifica el voltaje de salida 10x), establezca las posiciones de los marcadores y configure el sistema de grabación para medir.
- Gire los sistemas de cámara Ussing al modo de abrazadera y comience a medir; una vez que el Isc y la conductancia se han estabilizado (~ 15-20 min), se pueden obtener mediciones de referencia.
- Para asegurarse de que el tejido es viable, agregue el activador de adenilato ciclasa Forskolin (concentración final 10 μM) al lado serosal.
- Una vez que la diferencia de potencial de la membrana ha alcanzado un pico y ha comenzado a disminuir, el experimento se realiza.
10. Análisis de resultados
- En condiciones de circuito abierto, calcule la conductancia transmucosa a partir del cambio de voltaje en respuesta a los pulsos de corriente de acuerdo con la ley de Ohm. Determine la corriente de cortocircuito equivalente (Isc) a partir del voltaje transmucoso y la conductancia aplicando la ley de Ohm.
- Utilizar el potencial de dilución de NaCl para calcular la selectividad iónica relativa (PNa/PCl) con la ecuación de Goldman-Hodgkin-Katz10.
- Estimar la selectividad absoluta de la unión estrecha para cada ion utilizando la ecuación de Kimizuka-Koketsu11.
- Calcular PNa/PCl utilizando la ecuación de Goldman-Hodgkin-Katz a partir de potenciales de dilución, y determinar permeabilidades absolutas PNa y PCl a partir de la ecuación de Kimizuka-Koketsu descrita por Yu et al.10 de la siguiente manera:
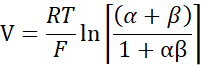

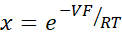

donde, V: Potencial de dilución (mV); α: Ratio de actividad. La actividad calculada de NaCl en el tampón HEPES dividida por la actividad calculada de NaCl en el tampón HEPES de dilución (para este experimento se calculó como 1,8966); e: Constante matemática, 2.71828; GM: Conductancia transmucosa (mS/cm2); F: Constante de Faraday (96.485,3329 C/mol); R: Constante de gas (8.314 J/mol K); T: Temperatura (310.15 K)
Resultados
Los resultados mostrados en este trabajo son resultados que formaban parte de un proyecto más amplio que se ha completado (ver ref.4,23,24).
La conductancia eléctrica transepitelial del intestino delgado disminuye en ratones Cldn15-/-.
La conductancia transmucosa basal (en condiciones de cortocircuito) del se...
Discusión
En este experimento, se utilizaron cámaras de Ussing para medir los parámetros eléctricos basales y el potencial de dilución de NaCl en el intestino delgado de ratones Cldn15-/- y WT. Es muy importante al hacer experimentos de cámara ussing verificar que la preparación de membrana utilizada en los experimentos sea viable. Esto generalmente se hace agregando glucosa o el activador de la adenilato ciclasa forskolina y viendo si hay un aumento apropiado en Isc (100-300 μA /
Divulgaciones
Los autores no tienen conflictos de intereses potenciales que revelar.
Agradecimientos
Este trabajo está respaldado por 17K00860 (a HH) y 19K20152 (a NI). WH desea agradecer a la Fundación de Becas Otsuka Toshimi por su apoyo financiero de 2018-2021.
Materiales
| Name | Company | Catalog Number | Comments |
| #3 polyethyl tubing | Hibiki | outer diameter 1.0 mm; inner diameter 0.5 mm | |
| #7 polyethyl tubing | Hibiki | outer diameter 2.3 mm; inner diameter 1.3 mm | |
| 10 mL locking syringe | Terumo | SS-10LZ | Locking syringes are necessary to prevent the needle from dislodging during filling |
| 19 g needle | Terumo | NN-1938R | Please use caution when working with needles and dispose of in sharps container |
| 23 g needle | Terumo | NN-2332R | Please use caution when working with needles and dispose of in sharps container |
| 5 mm punch | NA | NA | Use to punch holes in filter paper and parafilm |
| acupuncture needles | Seirin | NS | Used as dissection pins to pin tissue to dissection plate |
| Agar | Fujifilm Wako | 010-15815 | |
| Alligator clips | NA | NA | Connects the electrode to the amplifier |
| CaCl2 | Fujifilm Wako | 038-00445 | |
| D(-)-Mannitol | Fujifilm Wako | 133-00845 | This is used to correct for the osmolality difference in dilution HEPES buffer |
| D(+)-Glucose | Fujifilm Wako | 049-31165 | |
| Dissection kit | You will need, scissors and curved forceps | ||
| Dissection plates | We used 10 cm cell culture plates and covered with silicon rubber | ||
| DMSO | Sigma | 472301-500ML | For making forskolin stock |
| Electrical recorder | TOA Electronics | PRR-5041 | Other equivalent electrical recorders are available commercially |
| Epithelial voltage clamp amplifier | Nihon Kohden | CEZ9100 | Other equivalent amplifiers are available commerically |
| filter paper, cut into squares | NA | NA | Punched with a 5 mm punch, used to hold intestinal preparation |
| fine forceps | Fast Gene | FG-B50476 | For blunt dissection of the muscle layer |
| Forskolin | Alomone Labs | F-500 | Make 10 mM stock in DMSO, final concentration will be 10 µM |
| HEPES | Sigma | H4034-1KG | |
| Indomethacin | Sigma | I7338-5G | Make a 1 mM stock in 21 mM NaHCO3, final concentration is 10 µM |
| K2HPO4 | Fujifilm Wako | 164-04295 | |
| KCl | Fujifilm Wako | 163-03545 | |
| KCl/calomel electrode | Asch Japan Co. | SCE-100 | |
| KH2PO4 | Kanto chemical | 32379-00 | |
| L(+)-Glutamine | Fujifilm Wako | 074-00522 | |
| MgCl2 | Fujifilm Wako | 135-00165 | |
| Mixed Gas (95% O2/5% CO2) | Shizuoka Oxygen Company | Used for bubbling Ringer solution and chambers when using Ringer solution | |
| NaCl | Fujifilm Wako | 191-01665 | |
| NaCl electrode | NA | NA | Handmade electrodes which require concentrated NaCl and Silver wire |
| NaHCO3 | Fujifilm Wako | 191-01305 | |
| O2 Gas | Shizuoka Oxygen Company | Used for bubbling chambers when using HEPES buffer | |
| parafilm | Bemis | PM-996 | Used to help seal Ussing chambers |
| pH meter | DKK-TOA Corp | HM-305 | HEPES buffer needs to be adjusted to pH 7.4 at 37 °C |
| pH meter electrode | DKK-TOA Corp | GST-5311C | |
| silicone rubber | Shinetsu Chemical | KE-12 | Used to fill dissection plates |
| silver wire | Used for making NaCl electrodes | ||
| Small jars w/ plastic lids | NA | NA | Use for NaCl electrodes |
| stereomicroscope | Zeiss | Stemi 305 | A stereomicroscope allows you to see depth, so you can dissect the tissue more easily |
| Tris (Trizma base) | Sigma | T1503-1KG | Make a 1M solution to adjust pH of HEPES buffers |
| Ussing chambers | Sanki Kagaku Kougei | These chambers are custom made continuous perfusion Ussing chambers with a window diameter of 5 mm | |
| Water pump and heating system | Tokyo Rikakikai Co. Ltd. | NTT-110 |
Referencias
- Ussing, H. H., Zerahn, K. Active transport of sodium as the source of electric current in the short-circuited isolated frog skin. Acta Physiologica Scandinavica. 23, 110-127 (1951).
- Field, M. Ion transport in rabbit ileal mucosa. II. Effects of cyclic 3', 5'-AMP. American Journal of Physiology - Legacy Content. 221, 992-997 (1971).
- Herrmann, J. R., Turner, J. R. Beyond Ussing's chambers: contemporary thoughts on integration of transepithelial transport. American Journal of Physiology - Cell Physiology. 310, 423-431 (2015).
- Ishizuka, N., et al. Luminal Na + homeostasis has an important role in intestinal peptide absorption in vivo. American Journal of Physiology - Gastorintestinal and Liver Physiology. 315, 799-809 (2018).
- Ikehara, O., et al. Subepithelial trypsin induces enteric nerve-mediated anion secretion by activating proteinase-activated receptor 1 in the mouse cecum. Journal of Physiological Sciences. 62, 211-219 (2012).
- Furuse, M. Molecular basis of the core structure of tight junctions. Cold Spring Harbor Perspectives in Biology. 2, 002907 (2010).
- Tsukita, S., Tanaka, H., Tamura, A. The claudins: From tight junctions to biological systems. Trends in Biochemical Sciences. 44, 141-152 (2019).
- Li, B. R., et al. In vitro and in vivo approaches to determine intestinal epithelial cell permeability. Journal of Visual Experiments: JoVE. , e57032 (2018).
- Schoultz, I., Keita, &. #. 1. 9. 7. ;. V. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9, (2020).
- Yu, A. S. L., et al. Molecular basis for cation selectivity in claudin-2-based paracellular pores: Identifi cation of an electrostatic interaction site. Journal of General Physiology. 133, 111-127 (2009).
- Kimizuka, H., Koketsu, K. Ion transport through cell membrane. Journal of Theoretical Biology. 6, 290-305 (1964).
- Li, H., Sheppard, D. N., Hug, M. J. Transepithelial electrical measurements with the Ussing chamber. Journal of Cystic Fibrosis. 3, 123-126 (2004).
- Riordan, J. R., et al. Identification of the cystic fibrosis gene: Cloning and characterization of complementary DNA. Science. 245, 1066-1073 (1989).
- Smith, J. J., Karp, P. H., Welsh, M. J. Defective fluid transport by cystic fibrosis airway epithelia. Journal of Clinical Investigation. 93, 1307-1311 (1994).
- Molinski, S. V., et al. Orkambi and amplifier co-therapy improves function from a rare CFTR mutation in gene-edited cells and patient tissue. EMBO Molecular Medicine. 9, 1224-1243 (2017).
- Kisser, B., et al. The Ussing chamber assay to study drug metabolism and transport in the human intestine. Current Protocols in Pharmacology. 77, 1-19 (2017).
- Östh, K. . The horizontal Ussing chamber method in studies of nasal drug delivery - Method Delopment and Applications Using Different Formulations. , (2002).
- Guo, P., et al. Study of penetration mechanism of labrasol on rabbit cornea by Ussing chamber, RT-PCR assay, Western blot and immunohistochemistry. Asian Journal of Pharmaceutical Sciences. 14, 329-339 (2019).
- Okabe, K., et al. Effect of Benzalkonium Chloride on transscleral drug delivery. Investigative Opthalmology & Visual Science. 46, 703 (2005).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141, 1762-1772 (2011).
- Kozuka, K., et al. Development and characterization of a human and mouse intestinal epithelial cell monolayer platform. Stem Cell Reports. 9, 1976-1990 (2017).
- Tamura, A., et al. Megaintestine in claudin-15-deficient mice. Gastroenterology. 134, 523-534 (2008).
- Nakayama, M., Ishizuka, N., Hempstock, W., Ikari, A., Hayashi, H. Na+-coupled nutrient cotransport induced luminal negative potential and Claudin-15 play an important role in paracellular Na+ recycling in mouse small intestine. International Journal of Molecular Sciences. 21, 376 (2020).
- Tamura, A., et al. Loss of claudin-15, but not claudin-2, causes Na+ deficiency and glucose malabsorption in mouse small intestine. Gastroenterology. 140, 913-923 (2011).
- Clarke, L. L. A guide to Ussing chamber studies of mouse intestine. American Journal of Physiology - Gastrointestinal and Liver Physiology. 296, (2009).
- Dobson, J. G., Kidder, G. W. Edge damage effect in in vitro frog skin preparations. American Journal of Physiology. 214, 719-724 (1968).
- Corman, B. Streaming potentials and diffusion potentials across rabbit proximal convoluted tubule. Pflügers Archiv: European Journal of Physiology. 403, 156-163 (1985).
- Shen, L., Weber, C. R., Raleigh, D. R., Yu, D., Turner, J. R. Tight junction pore and leak pathways: A dynamic duo. Annual Review of Physiology. 73, 283-309 (2011).
- Frizzell, R. A., Schultz, S. G. Ionic conductances of extracellular shunt pathway in rabbit ileum. Journal of General Physiology. 59, 318-346 (1972).
- Otani, T., et al. Claudins and JAM-A coordinately regulate tight junction formation and epithelial polarity. Journal of Cell Biology. 218, 3372-3396 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados