Method Article
Detección directa de isolevuglandinas en tejidos utilizando una proteína de fusión de fosfatasa alcalina scFv D11 e inmunofluorescencia
* Estos autores han contribuido por igual
En este artículo
Erratum Notice
Resumen
Este artículo proporciona una metodología detallada para la medición de isolevuglandinas en tejidos por inmunofluorescencia utilizando el anticuerpo ScFv D11 conjugado con fosfatasa alcalina. Los modelos de hipertensión tanto en ratones como en humanos se utilizan para explicar los procedimientos paso a paso y los principios fundamentales asociados con la medición de isolevuglandina en muestras de tejido.
Resumen
Las isolevuglandinas (IsoLG) son cetoaldehídos gamma altamente reactivos formados a partir de isoprostanos H2 a través de la peroxidación lipídica y las proteínas de reticulación que conducen a la inflamación y diversas enfermedades, incluida la hipertensión. La detección de la acumulación de IsoLG en los tejidos es crucial para arrojar luz sobre su participación en los procesos de la enfermedad. Sin embargo, la medición de IsoLG en tejidos es extremadamente difícil, y las herramientas disponibles actualmente, incluido el análisis de espectrometría de masas, son laboriosas y extremadamente costosas. Aquí describimos un nuevo método para la detección in situ de IsoLGs en tejidos utilizando ScFv D11 conjugado con fosfatasa alcalina y un anticuerpo recombinante de visualización de fagos producido en E. coli por microscopía inmunofluorescente. Se utilizaron cuatro controles para validar la tinción: (1) tinción con y sin D11, (2) tinción con extracto periplásmico bacteriano con el ligador de fosfatasa alcalina, (3) tinción de anticuerpos scFV irrelevante y (4) control competitivo con IsoLG antes de la tinción. Demostramos la eficacia de la fosfatasa alcalina conjugada D11 en tejidos humanos y de ratón con o sin hipertensión. Este método probablemente servirá como una herramienta importante para estudiar el papel de los IsoLG en una amplia variedad de procesos de enfermedad.
Introducción
Las isolevugglandinas (IsoLGs), también conocidas como isocetales, son isómeros de la familia 4-cetoaldehído, que son productos de la peroxidación lipídica, y reaccionan y se adducen a aminas primarias en proteínas 1,2. Los IsoLGs han sido implicados en varias enfermedades, incluyendo enfermedades cardiovasculares, de Alzheimer, pulmonares y hepáticas, y muchos tipos de cáncer3. Los IsoLG se han estudiado más ampliamente en su contribución a la enfermedad cardiovascular (ECV), que es una carga económica y de salud significativa a nivel mundial, incluidos los Estados Unidos. Se estima que 92,1 millones de adultos estadounidenses tienen al menos un tipo de ECV, con proyecciones estimadas para 2030 que alcanzan el 43,9% de la población adulta de los Estados Unidos4. La disminución de la presión arterial, el colesterol y el abandono del hábito de fumar reduce el riesgo general y la aparición de eventos de ECV5.
La hipertensión arterial o hipertensión es un factor de riesgo importante para la enfermedad cardiovascular y afecta aproximadamente a la mitad de la población estadounidense6. Estudios previos han encontrado que la inflamación es una causa subyacente de hipertensión y que los IsoLGs juegan un papel7. Los estímulos hipertensivos, incluyendo angiotensina II, catecolaminas, aldosterona y exceso de sal dietética, inducen la acumulación de IsoLG en las células presentadoras de antígenos, incluidas las células dendríticas (DC), que a su vez activan las células T para proliferar y producir citoquinas inflamatorias que contribuyen a la hipertensión 8,9.
Anteriormente, los IsoLGs se han medido mediante inmunohistoquímica, espectrometría de masas, ensayo de inmunoadsorción ligado a enzimas y citometría de flujo10,11. Para facilitar la medición de IsoLGs, se desarrolló un anticuerpo recombinante (D11) de variable de fragmento de cadena única (scfv) contra IsoLGs12. Inicialmente, este anticuerpo D11 contenía una etiqueta E de 11 aminoácidos y requería un anticuerpo secundario para la detección inmunohistoquímica11. Sin embargo, fue difícil encontrar un anticuerpo secundario confiable contra la etiqueta E después de la interrupción de su producción por parte del fabricante. Por lo tanto, hemos desarrollado un protocolo confiable para la tinción inmunofluorescente de IsoLGs utilizando D11 conjugado con fosfatasa alcalina (D11-AP), que hemos demostrado en tejidos de ratón y humanos con y sin hipertensión.
Protocolo
El Comité Institucional de Cuidado y Uso de Animales de la Universidad de Vanderbilt aprobó todos los procedimientos descritos en este manuscrito. Los ratones son alojados y cuidados de acuerdo con la Guía para el Cuidado y Uso de Animales de Laboratorio. Todos los sujetos dieron su consentimiento informado por escrito antes de inscribirse en el estudio según lo aprobado por la Junta de Revisión Institucional de la Universidad de Vanderbilt. Todos los procedimientos se realizaron de acuerdo con la Declaración de Helsinki.
1. Preparación de plásmidos que codifican la proteína de fusión fosfatasa D11-alcalina y vectores de control negativo
- Construir una versión modificada del plásmido pCANTAB5E13,14 en el que el segmento de variable de fragmento de cadena simple (scFv) está vinculado en su extremo 3' a una secuencia que codifica la fosfatasa alcalina bacteriana (AP).
NOTA: Inmediatamente aguas abajo del sitio de restricción NotI de la secuencia scFv, el plásmido modificado ya no contiene la secuencia codificante de la etiqueta E y en su lugar codifica la secuencia de enlace GGSGGHMGSGG, seguida de la secuencia para AP (número de acceso de GenBank AXY87039.1, T16-K464)15,16. Aguas abajo de AP, el plásmido codificará etiquetas 8xHis y DYKDDDDK. En el extremo 3' de las etiquetas, la secuencia de codificación termina con un codón de parada ámbar. El plásmido modificado se llama pCANTAB5-AP. - Clone D11 scFv (número de acceso de GenBank AAW28931.1) en pCANTAB5-AP con los sitios de restricción SfiI/NotI.
- Clone D20 scFv en pCANTAB5-AP con los sitios de restricción SfiI/NotI.
NOTA: D20 scFv es un control negativo diseñado para evaluar el patrón de interacción tisular de un scFv irrelevante. Este scFv fue seleccionado originalmente por la visualización de fagos por su capacidad para interactuar con un grupo glicanos conocido como A2. - Genere un vector "vacío" eliminando la porción scFv del plásmido por completo y reemplazándola con una secuencia de codificación "AP linker" que consiste en aminoácidos GGGGSGRAGSGGGGS.
- Transformar todos los plásmidos en TG1 E. coli competente y cultivar bacterias durante la noche a 30 °C, en placas de agar al 0,5% que contienen 2xYT suplementado con 100 μg/ml de ampicilina y 2% de glucosa (2xYTAG) medio.
NOTA: Las cepas con el gen supE (como TG1 E. coli) no suprimen el codón de parada ámbar al 100%. Las estimaciones oscilan entre el 0,8 y el 20% del tiempo, por lo que todavía hay una gran cantidad de productos que terminan justo aguas abajo de BAP, ya que está destinado a estos experimentos17. TG1 E. coli se utiliza principalmente por razones prácticas, como la reducción de tiempo y costos, su compatibilidad con el sistema de expresión de proteínas pCANTAB y su uso en la visualización de fagos, que se realiza comúnmente en el laboratorio. Aguas abajo del codón de parada ámbar después de BAP hay una secuencia para el gen III. Las proteínas de fusión GeneIII deben expresarse raramente para que la visualización de fagos funcione según lo previsto porque las proteínas de fusión scFv-geneIII interfieren con esa proteína genIII en particular para reinfectar bacterias ingenuas. Por lo tanto, las proteínas del gen III libres de fusión deben existir durante el ensamblaje del virión para la generación de fagos funcionales, es decir, los productos de proteína scFv-geneIII suelen ser relativamente raros dentro de la bacteria. D11-AP, D20-AP, vector vacío y todas las construcciones utilizadas en este artículo se ven afectadas de manera similar por la expresión ocasional de proteínas de fusión geneIII. Todavía se observan diferencias en cómo se comportan estas proteínas. - Elija una colonia individual e inocule 5 ml frescos de cultivo 2xYTAG. Deje que las bacterias crezcan durante la noche a 30 °C y agite a 150 rpm.
- Granular las células por centrifugación a 3.000 x g durante 10 min a temperatura ambiente. Desechar el sobrenadante y resuspender el pellet en 2 mL de 85% 2xYTAG y 15% de glicerol.
- Mantener las existencias de glicerol en un congelador a -80 °C.
2. Expresión proteica y generación de extracto periplásmico
NOTA: La generación del extracto periplásmico es un método comúnmente utilizado para la expresión de proteínas en la visualización de fagos, principalmente porque la formación de enlaces disulfuro es importante en la generación de scFv y anticuerpos. El método evita la necesidad de generar lisados (que comúnmente contienen cuerpos de inclusión) y asegura que las proteínas se plieguen correctamente. pCANTAB tiene una secuencia de señal gIII aguas arriba de la porción scFv de la proteína de fusión D11-BAP. La secuencia de señal asegura que la proteína sea transportada al espacio periplásmico de la bacteria, y luego la secuencia de señal se divide. El espacio periplásmico proporciona un ambiente oxidante, que es crucial para la formación adecuada de puentes disulfuro. El choque osmótico se utiliza para derivar extractos periplásmicos porque interrumpe la membrana externa lo suficiente como para liberar las proteínas periplásmicas en el medio circundante, manteniendo intacta la bacteria.
- Inocular las existencias de glicerol de TG1 E. coli que contengan los plásmidos relevantes en un cultivo de 60 ml de 2xYTAG y cultivar durante la noche a 30 °C con agitación a 150 rpm.
- Para inducir la expresión de proteínas, granular cultivos bacterianos a 3.000 x g durante 10 min, resuspender en 60 mL de medio 2xYTA y cultivar durante la noche a 30 °C con agitación a 150 rpm.
NOTA: El cambio de medio 2xTYAG a 2xYTA ayuda en la inducción suficiente de la expresión de proteínas18. Cuando la glucosa está presente en el medio bacteriano, el promotor lac se suprime porque las bacterias consumen preferentemente glucosa e ignoran la lactosa, ya que la glucosa requiere menos energía para procesar. Cuando la glucosa se elimina después del cambio del medio, las bacterias dependen de los carbohidratos proporcionados por el medio 2xYT. El extracto de levadura (el componente Y en 2xYT) contiene carbohidratos, entre ellos lactosa, y es, por lo tanto, capaz de impulsar la expresión de proteínas a través del promotor lac. IPTG no es necesario con la construcción pCANTAB y puede resultar en una expresión excesiva de proteínas, junto con cuerpos de inclusión que resultan en proteínas no funcionales. - Generar extractos periplásmicos mediante choque osmótico.
- Cultivos bacterianos en pellets a 3.000 x g durante 10 min.
- Resuspender en 20 mL de 1xTES (0.2 M Tris-HCl pH 8.0, 0.5 mM EDTA, 0.5 M sacarosa) e incubar durante 1 h en hielo.
- Granular de nuevo a 3.000 x g durante 10 min, y resuspender en 15 mL de 0,05 M Tris, pH 7,6.
- Incubar esta suspensión en hielo durante 1 h, luego aclarar por centrifugación a 5.000 x g durante 10 min.
- Transfiera los sobrenadantes a un tubo nuevo y guárdelos a -20 °C hasta que sea necesario para la purificación o el uso directo en experimentos.
- Evaluar la lisis celular por la presencia de D11-BAP activo en el ELISA. Agregue 3-5 μL del extracto periplásmico a un ml de pNPP, luego observe si ocurre un cambio de color en los próximos 10 minutos (el color pasa de amarillo claro a amarillo intenso).
NOTA: El color se puede comparar lado a lado con un tubo de pNPP que no ha recibido ningún lisado o un tubo de pNPP que recibió lisado de bacterias TG1 ingenuas. Cuantificar con absorbancia a 405 nm.
4. Caracterización del título D11-AP en ELISA
- Cubra una placa de poliestireno de 384 pocillos durante la noche a 4 °C con solución salina tamponada con fosfato (PBS) de 25 μL/pocillo (1,8 mM KH 2 PO 4, 10 mM Na 2 HPO4,2,7mM KCl, 137 mM NaCl) que contenga 5 μg/ml de albúmina sérica de ratón (MSA) (control negativo) o 5 μg/ml de IsoLG/MSA (control positivo).
- Vacíe el plato y seque con grifo. Lavar una vez con PBS + 0.1% Tween (PBS-T). Vacíe el plato y seque con grifo.
- Llene la placa con PBS-T como tampón de bloqueo (120 μL/pocillo). Incubar durante 1 h a temperatura ambiente.
- Vacíe el plato y seque con grifo. Aplicar diluciones seriadas 1:2 de extractos periplásmicos D11-AP a 25 μL/pocillo y diluidos en PBS-T. Incluya un pozo que contenga solo PBS-T como control negativo.
NOTA: Los rangos de dilución típicos para extractos periplásmicos son 1:8 - 1:4096. Para un volumen de ensayo de 25 μL, comience con 50 μL de la concentración inicial "1:8": 6,25 μL de extracto periplásmico y 43,75 μL de PBS-T. Luego, realice una dilución de 2 veces eliminando 25 μL de esta solución y agregándola al siguiente pocillo que contiene 25 μL de PBS-T y pipetearla hacia arriba y hacia abajo. Este pozo ahora contiene la dilución "1:16". Siga repitiendo la dilución de 2 veces para generar la serie de dilución 1:2 descrita. - Incubar durante 1,5 h a temperatura ambiente.
- Vacíe el plato y seque con grifo. Lavar 5 veces con PBS-T. Vacíe y seque con grifo.
- Preparar la solución de pNPP disolviendo 1 g de pNPP en 1 L de 930 mM de dietanolamina (solución madre al 98% diluida 1:10 enH2O), con 0,5 mM de MgCl2 y ajustado a pH 9,5 con HCl.
- Aplicar una solución de pNPP de 25 μL/pocillo para desarrollar AP. Incubar durante 1 h a temperatura ambiente y determinar la absorbancia a 405 nm dentro de cada pocillo utilizando un lector de placas compatible.
- Compare la señal generada por los pocillos IsoLG/MSA con el ruido generado por los pocillos MSA y encuentre el rango de diluciones en las que la señal es al menos 5 veces mayor que el ruido.
- Trazar esta serie de dilución de señal D11-AP en un gráfico, determinar el rango lineal de la curva y establecer la dilución donde se puede observar el 50% de la señal.
NOTA: Si esta dilución es equivalente a aproximadamente 1:1.000, entonces la solución D11-AP puede utilizarse a una concentración de 1:10 en IHC/IF.
5. Inmunofluorescencia
- Cortar secciones seriadas de tejidos embebidos en parafina de ratón y humano (5 μm de espesor) utilizando un micrótomo y colocarlos en un baño de agua tibia (37 °C). Monte secciones de tejido en portaobjetos de vidrio y deje secar durante la noche.
NOTA: Para este estudio, las aortas se obtuvieron de ratones. Las secciones de colon de humanos normotensos e hipertensos se obtuvieron de la Red Cooperativa de Tejidos Humanos de Vanderbilt. - Sumerja los portaobjetos en xileno tres veces durante 5 minutos para desparafinar los tejidos.
- Rehidratar los tejidos en 2 lavados cada uno de 95%, 70% y 50% de etanol enH2O.
- Lave las diapositivas en solución salina tamponada con Tris (TBS) con 0,1% de Tween20 (TBST) tres veces con lavados rápidos llenando el portaportaportaobjetos con TBST y luego desechando TBST.
NOTA: Los portaobjetos hidratados pueden almacenarse en TBST a 4 °C durante no más de una semana antes de la recuperación del antígeno. - Para realizar la recuperación de antígenos inducidos por calor de los portaobjetos, coloque los portaobjetos en tampón de citrato de sodio precalentado (80-95 °C) (citrato de sodio de 10 mM, interpolación 20 al 0,05%, pH 6,0) e incubar en una olla a presión a presión a presión de 4 minutos para un tiempo total de recuperación de antígenos de 20 min.
- Retire los portaobjetos de la olla a presión y déjelos enfriar durante 20 minutos a temperatura ambiente.
- Lave las diapositivas en TBST tres veces con lavados rápidos.
NOTA: Los portaobjetos se pueden almacenar en TBST después de la recuperación del antígeno durante no más de una semana antes de la tinción. - Agregue un 2% de BSA disuelto en TBST para bloquear diapositivas. Cubra los portaobjetos con una tira de película de parafina e incube a temperatura ambiente durante 15 min.
- Deseche el búfer de bloqueo de las diapositivas.
- Agregue 200 μL de 1:10 D11-AP en TBST a los portaobjetos y cubra con una tira de película de parafina.
- Incubar en una cámara humidificada para minimizar la evaporación de la solución de anticuerpos durante 3 h a temperatura ambiente.
- Lave las diapositivas tres veces en TBST.
- Desarrollar con un revelador de fosfatasa alcalina colorimétrica o fluorescente para inmunohistoquímica o inmunofluorescencia, respectivamente. Lave las diapositivas una vez con TBST para eliminar el exceso de revelador y evitar un mayor desarrollo del color.
- Contramanchas con tinción nuclear de Hoechst a 1 μg/mL en PBS para inmunofluorescencia. Lave las diapositivas una vez en TBST para eliminar cualquier exceso de contramancha.
- Aplique los cubreobjetos utilizando el medio de montaje.
- Vea las diapositivas bajo un microscopio de luz invertida para inmunohistoquímica o un microscopio fluorescente confocal para inmunofluorescencia.
6. Controles negativos
NOTA: Se pueden realizar cuatro experimentos de control negativo para confirmar la especificidad de la tinción D11-AP para IsoLG. Los experimentos de control negativo deben realizarse en el mismo equipo de tinción en las mismas condiciones.
- En el primer experimento de control negativo, incubar tejidos con D11-AP diluido en TBST o TBST solo.
- Incubar tejidos con D11-AP diluido en TBST y extracto periplásmico bacteriano sin D11-AP (AP Linker) diluido en TBST.
- Realizar un ensayo competitivo con IsoLG/MSA o MSA no aducido como se describió anteriormente12.
- Preparar IsoLG e IsoLG aducidos a albúmina sérica de ratón (MSA) como se describió anteriormente19, en una relación molar de 8 IsoLG: 1 MSA (8:1 IsoLG/MSA).
- Diluir D11-AP 1:10 en TBST.
- Incubar D11-AP diluido con 50 μg/ml de IsoLG/MSA o MSA no aducido durante 1 h a temperatura ambiente.
- Agregue D11-AP con IsoLG/MSA o D11-AP con MSA no aducido a los tejidos para teñir.
- Use el anticuerpo scFv irrelevante, D20, para teñir los tejidos para el conjunto de control negativo final.
Resultados
En experimentos representativos, D11 scfv con una conjugación de fosfatasa alcalina (D11-AP) se utilizó en inmunofluorescencia para detectar IsoLGs presentes en ratones tratados con angiotensina II en comparación con ratones simulados normales y humanos con hipertensión en comparación con humanos normotensos. Los ratones fueron tratados con angiotensina II a una dosis de 490 ng/kg/min durante dos semanas, y la hipertensión se confirmó con un aumento de la presión arterial sistólica en comparación con los ratones simulados10. Para asegurar la especificidad de D11-AP, los tejidos se tiñeron con o sin la presencia de D11-AP. Como lo demostró la tinción D11-AP, la aorta de ratones con hipertensión inducida por angiotensina II mostró una concentración elevada de IsoLGs en comparación con los ratones control (Figura 1). La tinción de fondo o la autofluorescencia fueron limitadas, como lo demuestran los controles negativos que no se tiñeron con D11-AP.
D11-AP se utilizó para detectar IsoLGs presentes en tejidos intestinales de pacientes humanos con hipertensión (HTA) o humanos normotensos (NTN). El estado de hipertensión se estableció a partir de los registros hospitalarios como presión arterial sistólica superior a 140 y presión arterial diastólica superior a 80 mmHg. Los investigadores que desarrollaron el protocolo de inmunofluorescencia para D11-AP fueron cegados al estado de hipertensión de los tejidos humanos. Las secciones se tiñeron en presencia y ausencia de D11-AP para garantizar la especificidad de anticuerpos y mostrar tinción de fondo o autofluorescencia. Como se muestra en la Figura 2, encontramos que los tejidos de pacientes con HTA tenían concentraciones elevadas de IsoLGs en comparación con los pacientes con NTN. La tinción sin D11-AP también mostró una tinción de fondo mínima y autofluorescencia. La fosfatasa alcalina endógena se expresa por epitelio intestinal, por lo que la fluorescencia limitada de los tejidos teñidos sin D11-AP muestra que la recuperación de antígenos utilizada en este protocolo fue suficiente para inactivar la fosfatasa alcalina endógena presente en los tejidos. En combinación con los resultados en ratones, estos resultados también muestran que el protocolo de inmunofluorescencia muestra efectivamente IsoLGs elevados en la hipertensión en comparación con el estado normotenso.
D11-AP se aisló y almacenó en el extracto periplásmico bacteriano. Los tejidos de ratón y humanos se tiñeron con D11-AP y extracto periplásmico que contenía el enlazador AP sin D11 para asegurar que otros factores que pueden estar presentes en el extracto periplásmico, como el exceso o la fosfatasa alcalina no conjugada, no contribuyen a la tinción observada en tejidos tratados con D11-AP (Figura 3). Los tejidos teñidos con D11-AP dieron lugar a una tinción más brillante en comparación con los tejidos teñidos con extracto periplásmico. Estos resultados confirman que D11-AP está teñiendo los tejidos, y la tinción no se debe a la fosfatasa alcalina bacteriana no conjugada que potencialmente puede estar presente en el extracto periplásmico y dar lugar a una tinción falsa de IsoLGs o contribuir a la tinción de fondo.
Se realizó un control competitivo mediante la preincubación de D11-AP con IsoLG aducido a MSA o MSA no aducido antes de teñir los tejidos para mostrar la especificidad de D11-AP a IsoLG. Si D11-AP es específico para IsoLG, el anticuerpo se uniría a IsoLG-MSA, lo que resultaría en una disponibilidad agotada de D11-AP para teñir tejidos, y D11-AP incubado con MSA no aducido tendría una tinción similar a D11-AP normal. En tejidos teñidos con D11-AP preincubados con el competidor IsoLG, encontramos una disminución de la tinción en comparación con los tejidos que fueron teñidos con D11-AP sin ninguna preincubación (Figura 4). En tejidos teñidos con D11-AP preincubados con MSA no aducido, encontramos que la tinción es similar a la tinción observada en tejidos con D11-AP. Estos resultados muestran la especificidad de D11-AP a IsoLGs debido a la reducción de la tinción de los tejidos cuando D11-AP se incubó previamente con IsoLG/MSA, pero no con MSA no aducido. En el control negativo final, el tejido del ratón se tiñó con D11-AP o el anticuerpo scFv irrelevante, D20. La tinción de la aorta del ratón con D11-AP resultó en una tinción fuerte en comparación con D20, lo que indica la especificidad de D11-AP a IsoLGs en aortas hipertensas (Figura 5).
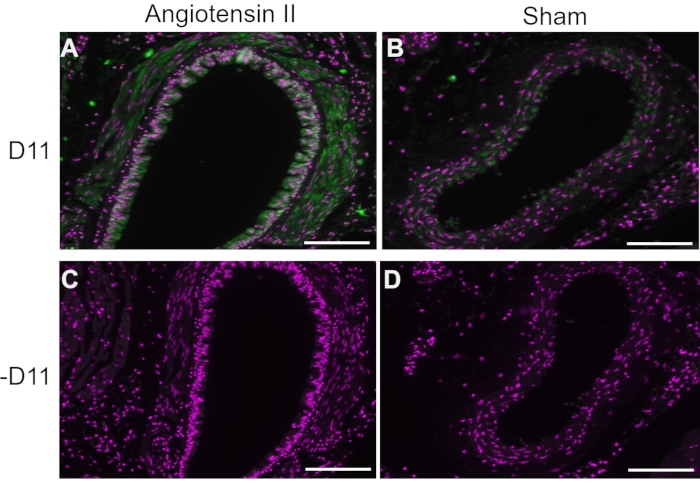
Figura 1: Inmunofluorescencia de la aorta en ratones hipertensos y normotensos. Las arterias de la angiotensina II y los ratones infundidos simulados se tiñeron con y sin D11-AP (D11) para mostrar la presencia de IsoLG. (A) Arteria de un ratón tratado con angiotensina II sondeado con D11-AP (verde) y contratinción nuclear (magenta), (B) Arteria de un ratón tratado con control simulado sondeado con D11-AP, (C) Arteria de un ratón tratado con angiotensina II sin D11-AP, (D) Arteria de un ratón tratado con control simulado sin D11-AP (barra de escala = 100 μm). Haga clic aquí para ver una versión más grande de esta figura.
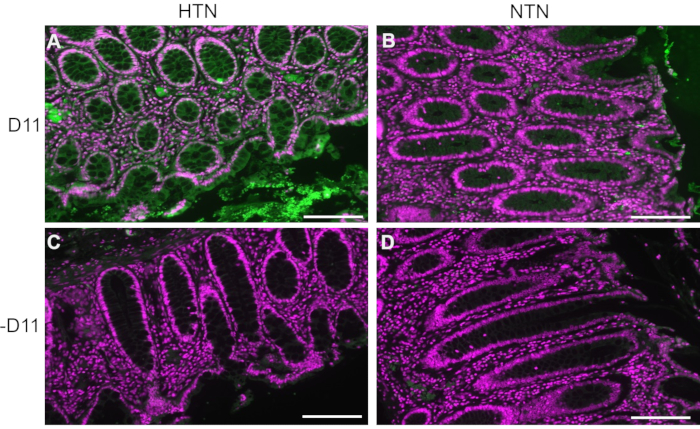
Figura 2: Inmunofluorescencia de tejidos intestinales humanos de pacientes hipertensos y normotensos. Los tejidos de pacientes con hipertensión (HTA) y humanos normotensos (NTN) se tiñeron con y sin D11-AP (D11) para mostrar la presencia de IsoLGs en pacientes con HTA. (A) tejidos HTA teñidos con D11-AP (verde) y contratinción nuclear (magenta), (B) tejidos NTN teñidos con D11-AP, (C) tejidos HTA teñidos sin D11-AP, (D) tejidos NTN teñidos sin D11-AP (barra de escala = 100 μm). Haga clic aquí para ver una versión más grande de esta figura.
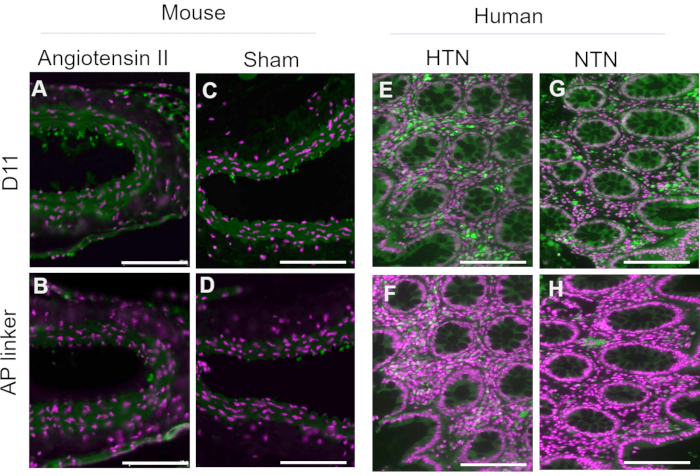
Figura 3: Tejidos de ratón y humanos teñidos con extracto periplásmico con y sin D11-AP. Los tejidos de ratón y humanos se tiñeron con extractos periplásmicos con y sin D11-AP. Las imágenes muestran una tinción limitada de los tejidos con extracto periplásmico sin D11-AP, que muestran que la tinción se debe principalmente a la unión a D11-AP en lugar de otro componente que puede estar presente en el extracto periplásmico. (A) Aorta de ratón Ang teñida con D11-AP (verde) y contratinción nuclear (magenta), (B) Aorta de ratón Ang teñida con extracto periplásmico, (C) Aorta de ratón simulada teñida con D11-AP, (D) Aorta de ratón simulada teñida con extracto periplásmico, (E) tejido intestinal humano hipertenso teñido con D11-AP, (F) tejido intestinal humano hipertenso teñido con extracto periplásmico, (G) tejido intestinal humano normotenso teñido con D11-AP, (H) tejido intestinal humano normotenso teñido con extracto periplásmico (barra de escala = 100 μm). Haga clic aquí para ver una versión más grande de esta figura.
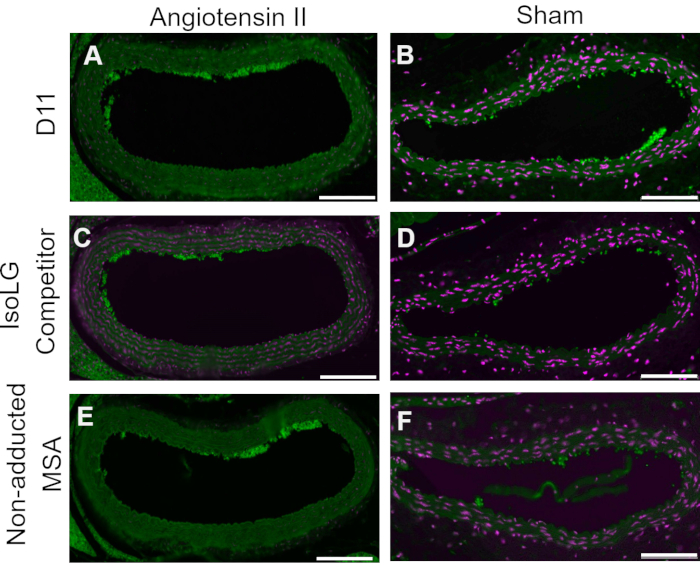
Figura 4: Control competitivo en recipientes de ratones Ang y Sham. En este control competitivo, D11-AP se incubó previamente con MSA aducido por IsoLG o MSA no aducido. D11-AP sin pre-incubación se utilizó como control. Estos resultados muestran la especificidad de D11-AP a IsoLGs porque hay una tinción reducida de los tejidos con el competidor IsoLG-MSA en comparación con D11-AP. Esta reducción se debe a IsoLG y no a MSA porque la preincubación de MSA no aducida resultó en una tinción similar al control D11-AP. Aortas de ratón de angiotensina II (A) y Sham (B) teñidas con D11-AP (verde) y contratinción nuclear (magenta), aortas de ratón de angiotensina II (C) y Sham (D) teñidas con D11-AP después de incubar con aortas de ratón IsoLG-MSA, angiotensina II (E) y Sham (F) teñidas con D11-AP después de incubar con MSA no aducida (barra de escala = 100 μm). Haga clic aquí para ver una versión más grande de esta figura.
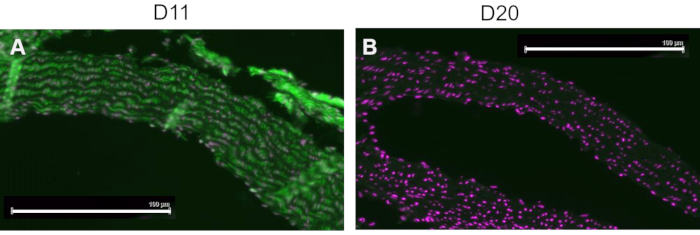
Figura 5: Aorta de ratón teñida con D11 y scFv irrelevante, D20. El tejido del ratón se tiñó con D11-AP y se comparó con un anticuerpo de control irrelevante, D20, que es específico para la glicoproteína A2. La tinción del tejido con D11-AP (verde) y contratinción nuclear (magenta) (A) dio lugar a una inmunofluorescencia intensa en comparación con D20 (verde) y la contratinción nuclear (magenta) (B), lo que indica la especificidad de D11-AP a IsoLGs (barra de escala = 100 μm). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
D11 se ha utilizado ampliamente para detectar proteínas aducidas por IsoLG en células o tejidos como marcador de inflamación o estrés oxidativo en la enfermedad 8,9,20. Anteriormente, D11 contenía una etiqueta E y el desarrollo de IHQ requería el uso de un anticuerpo secundario anti-E conjugado con HRP10,20,21. Aquí, hemos desarrollado y optimizado el protocolo para la detección de proteínas aducidas por IsoLG utilizando el anticuerpo D11 conjugado con fosfatasa alcalina en lugar de la etiqueta E, lo que elimina la necesidad de una incubación secundaria de anticuerpos.
Para determinar la especificidad de D11-AP, se realizaron cuatro experimentos de control negativo. Realizamos el protocolo sin la presencia de D11 y tuvimos un desarrollo mínimo. Estos resultados tienen una doble indicación: la fosfatasa alcalina endógena no contribuye al desarrollo, y la tinción observada se debe a D11 y no a otro factor contribuyente. A continuación, teñimos las diapositivas con el enlazador AP sin D11. Este experimento resultó en poca tinción, lo que indica que AP libre u otros factores en el extracto periplásmico no están causando la tinción que observamos en presencia de D11. Para garantizar la especificidad de D11 a IsoLG, preincubamos D11-AP con IsoLG purificado antes de teñir los portaobjetos. Vimos una disminución en el desarrollo que indica que el D11-AP se unió a la proteína IsoLG, agotando así la cantidad de D11-AP libre para unirse a IsoLG presente en el tejido. Finalmente, para asegurarnos de que D11-AP se unía a IsoLG y no a la proteína MSA a la que se unía IsoLG, preincubamos D11-AP solo con MSA. No hubo cambios en el desarrollo, lo que indica que D11-AP no se unía a MSA sino a la proteína IsoLG. Por último, los investigadores que desarrollaron el protocolo de tinción estaban ciegos al estado hipertensivo del tejido intestinal humano. Las diferencias en la tinción observadas entre pacientes con hipertensión y pacientes con normotensión no fueron debidas a sesgo y han sido descritas previamente22,23.
Aunque nuestro protocolo para la detección de proteínas aducidas por IsoLG utilizando el anticuerpo D11 conjugado con fosfatasa alcalina en lugar de la etiqueta E es riguroso y robusto y elimina la necesidad de una incubación secundaria de anticuerpos, tiene algunas limitaciones. Una limitación es que utilizamos D11 conjugado con fosfatasa alcalina en el extracto periplásmico, y podría haber tinción falsa de fosfatasa alcalina endógena en el extracto periplásmico o ciertos tejidos, como el intestino24. Sin embargo, el primer paso para desarrollar este protocolo incluyó la desactivación de la fosfatasa alcalina endógena que puede estar presente en los tejidos25. Inicialmente, se probó la eficiencia del ácido acético frío, el BME y el levamisol26 . Ninguno de estos disminuyó completamente la presencia de fosfatasa alcalina endógena activa. El calor se ha utilizado para desactivar la fosfatasa alcalina27, por lo que probamos la desactivación térmica de la fosfatasa alcalina en diferentes tampones. Encontramos que los portaobjetos hidratados y montados en el calentamiento en el tampón citrato eliminaron la mayoría de la fosfatasa alcalina endógena. Las diapositivas se desarrollaron inicialmente utilizando un sustrato quimioluminiscente / fluorescente, pero cuando se obtuvieron imágenes sin este sustrato, hubo una gran cantidad de autofluorescencia. VectorRed es un sustrato que se desarrolla en presencia de fosfatasa alcalina para producir un cromógeno que se puede visualizar en el rango de canales Texas Red/TRITC. Usando este sustrato, pudimos observar más fácilmente la señal sobre la autofluorescencia de fondo. Se debe tener cuidado durante el proceso de tinción para minimizar la tinción artificial. Secado de los tejidos en portaobjetos después de la hidratación hasta que las imágenes hayan resultado en un mayor desarrollo. D11-AP debe ser alícuota y almacenado a -20 °C. Se deben evitar múltiples ciclos de congelación-descongelación cuando se trabaja con D11-AP. La solución salina tamponada con fosfato (PBS) también puede afectar la actividad enzimática de la fosfatasa alcalina y no debe utilizarse como tampón de lavado28. Al igual que con cualquier enfoque basado en anticuerpos, se deben llevar a cabo pruebas exhaustivas y optimización para garantizar que la tinción sea específica y que la señal no se amplifique en exceso o en exceso.
En conclusión, hemos desarrollado un protocolo optimizado potente, riguroso y robusto para detectar proteínas aducidas por IsoLG utilizando el anticuerpo D11 conjugado con fosfatasa alcalina en lugar de la etiqueta E. Este protocolo presenta varias ventajas: En primer lugar, el uso de D11 como proteína de fusión de fosfatasa alcalina es más barato. D11 se derivó originalmente de una biblioteca de anticuerpos de fagos que no se podía comercializar y era costosa de purificar. Aunque D11 en el extracto periplásmico de E. coli podría proporcionar una alternativa económica, fue ineficaz en la mayoría de los ensayos. En segundo lugar, el enfoque de fusión de fosfatasa alcalina permite que D11 scfv tenga un informador útil15 (fosfatasa alcalina) fusionado y no necesitaría ser purificado para su uso en inmunoensayos, ya que los sustratos están disponibles comercialmente. En tercer lugar, la fosfatasa alcalina E. coli forma dímeros29. Por lo tanto, D11, cuando se fusiona con la fosfatasa alcalina, también formaría dímeros y esto aumentaría la avidez del anticuerpo y la actividad de unión30. Finalmente, D11 conjugado con fosfatasa alcalina en extracto periplásmico se puede limpiar fácilmente usando Cibacron Blue Sepharose. D11 tiene un punto isoeléctrico alto (~9.2 pH). Como tal, está cargado positivamente y puede unirse a Cibacron Blue a través de interacciones de pi-cation. La mayoría de las impurezas en el extracto periplásmico de E. coli se pueden eluir de la resina. El D11 conjugado con fosfatasa alcalina puede ser eluydo usando sal alta (~1.5M NaCl) en agua. El D11 eluyido conjugado con fosfatasa alcalina es bastante estable a 4-8 °C en la solución de alta sal. Por lo tanto, hemos desarrollado un protocolo que no solo hace que el anticuerpo D11 esté disponible a bajo costo, sino que también elimina los pasos adicionales y la necesidad de la incubación secundaria de anticuerpos. Este protocolo facilita la medición reproducible de IsoLGs, que se acumulan en tejidos en múltiples enfermedades donde el aumento del estrés oxidativo juega un papel.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por las subvenciones de los Institutos Nacionales de Salud K01HL130497, R01HL147818, R01HL144941 y R03HL155041 a A.K. Agradecemos al recurso compartido de histología digital - Vanderbilt Health Nashville, TN https://www.vumc.org/dhsr/46298 por la visualización y el escaneo de diapositivas.
Materiales
| Name | Company | Catalog Number | Comments |
| 1 ml TALON HiTrap column (Cobalt-CMA) | Cytiva | 28953766 | |
| 200 Proof Ethanol | Pharmco | 111000200 | |
| 2xYT powder | MP Biomedicals | 3012-032 | |
| 384-well, clear, flat-bottom polystyrene microplates | ThermoFisher (NUNC) | 242757 | |
| 4-Nitrophenyl phosphate disodium salt hexahydrate (pNPP) | Carbosynth | EN08508 | |
| 5-Bromo-4-chloro-3indoxyl phosphate, p-toluidine salt (BCIP) | Carbosynth | EB09335 | |
| Ampicillin, sodium salt | Research Products International (RPI) | A40040 | |
| Bovine Serum Albumin | RPI | A30075 | |
| Chemically competent TG1 E. coli | Amid Biosciences | TG1-201 | |
| Diethanolamine, >98% | Sigma-Aldrich | D8885 | |
| EDTA | Sigma-Aldrich | ED | |
| Fluoromount-G | SouthernBiotech | 0100-01 | Mouting medium |
| Glucose | Research Products International (RPI) | G32045 | |
| Glycerol | Sigma-Aldrich | G7893 | |
| Histoclear | National Diagnostics | HS-200 | Xylene alternative |
| Hoechst 33342 | ThermoFisher | H3570 | stock solution = 10 mg/mL |
| Hydrochloric acid (HCl), 30%, Macron Fine Chemicals | ThermoFisher | MK-2624-212 | |
| Imidazole | Research Products International (RPI) | I52000 | |
| MgCl2 (anhydrous) | Sigma-Aldrich | M8266 | |
| Mouse Serum Albumin (MSA) | Sigma-Aldrich/Calbiochem | 126674 | |
| Nitroblue tetrazolium chloride (NBT) | Carbosynth | EN13587 | |
| Potassium chloride (KCl) | Sigma-Aldrich | P4504 | |
| Potassium phosphate, monobasic (KH2PO4) | Sigma-Aldrich | P0662 | |
| Pressure Cooker | Cuisinart | CPC-600 | |
| Slide-a-Lyzer Dialysis cassettes, 10K MWCO, 3 ml | ThermoFisher | 66380 | |
| Sodium chloride (NaCl) | Research Products International (RPI) | S23020 | |
| Sodium Citrate | Sigma-Aldrich | 1064461000 | |
| Sodium phosphate, dibasic (Na2HPO4) | Research Products International (RPI) | S23100 | |
| Sucrose | Research Products International (RPI) | S24065 | |
| Tris base | Research Products International (RPI) | T60040 | |
| Tris-buffered Saline | Boston Bio-Products | 25mM Tris, 2.7mM KCl, 137 mM NaCl, pH 7.4 | |
| Tris-HCl | Research Products International (RPI) | T60050 | |
| Tween20 | Sigma-Aldrich | P9416 | |
| Vector Red | Vector Labs | SK-5105 |
Referencias
- Brame, C. J., Salomon, R. G., Morrow, J. D., Roberts, L. J. Identification of extremely reactive gamma-ketoaldehydes (isolevuglandins) as products of the isoprostane pathway and characterization of their lysyl protein adducts. Journal of Biological Chemistry. 274, 13139-13146 (1999).
- Brame, C. J., et al. Modification of proteins by isoketal-containing oxidized phospholipids. Journal of Biological Chemistry. 279, 13447-13451 (2004).
- May-Zhang, L. S., et al. Scavenging reactive lipids to prevent oxidative injury. Annual Review of Pharmacology and Toxicology. 61, 291-308 (2021).
- Benjamin, E. J., et al. Heart disease and stroke statistics-2019 update: A report from the American Heart Association. Circulation. 139, 56 (2019).
- Collins, D. R., et al. Global cardiovascular risk assessment in the primary prevention of cardiovascular disease in adults: Systematic review of systematic reviews. BMJ Open. 7, 013650 (2017).
- Whelton, P. K., et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the prevention, detection, evaluation, and management of high blood pressure in adults: Executive summary: A report of the American College of Cardiology/American Heart Association Task Force on clinical practice guidelines. Circulation. 138, 426-483 (2018).
- Patrick, D. M., Van Beusecum, J. P., Kirabo, A. The role of inflammation in hypertension: Novel concepts. Current Opinion in Physiology. 19, 92-98 (2021).
- Davies, S. S., et al. Isolevuglandins as mediators of disease and the development of dicarbonyl scavengers as pharmaceutical interventions. Pharmacology and Therapeutics. 205, 107418 (2020).
- Dixon, K. B., Davies, S. S., Kirabo, A. Dendritic cells and isolevuglandins in immunity, inflammation, and hypertension. American Journal of Physiology-Heart and Circulation Physiology. 312, 368-374 (2017).
- Kirabo, A., et al. DC isoketal-modified proteins activate T cells and promote hypertension. Journal of Clinical Investigation. 124, 4642-4656 (2014).
- Yan, H. P., et al. Isolevuglandins as a gauge of lipid peroxidation in human tumors. Free Radical Biology and Medicine. 106, 62-68 (2017).
- Davies, S. S., et al. Localization of isoketal adducts in vivo using a single-chain antibody. Free Radical Biology and Medicine. 36, 1163-1174 (2004).
- Shen, Z., et al. Single-chain fragment variable antibody piezoimmunosensors. Analytical Chemistry. 77, 797-805 (2005).
- Hennig, E. E., Mernaugh, R., Edl, J., Cao, P., Cover, T. L. Heterogeneity among Helicobacter pylori strains in expression of the outer membrane protein BabA. Infections and Immunity. 72, 3429-3435 (2004).
- Martin, C. D., et al. A simple vector system to improve performance and utilisation of recombinant antibodies. BMC Biotechnology. 6, 46 (2006).
- Han, Z., Karatan, E., Scholle, M. D., McCafferty, J., Kay, B. K. Accelerated screening of phage-display output with alkaline phosphatase fusions. Combinatorial Chemistry and High Throughput Screening. 7, 55-62 (2004).
- Miller, J. . Handbook for a short course in bacterial genetics. , (1992).
- Nair, R., et al. Yeast extract mediated autoinduction of lacUV5 promoter: An insight. New Biotechnology. 26 (6), 282-288 (2009).
- Davies, S. S., Amarnath, V., Roberts, L. J. Isoketals: Highly reactive γ-ketoaldehydes formed from the H2-isoprostane pathway. Chemistry and Physics of Lipids. 128 (1-2), 85-99 (2004).
- Ngwenyama, N., et al. Isolevuglandin-modified cardiac proteins drive CD4+ T-Cell activation in the heart and promote cardiac dysfunction. Circulation. 143 (12), 1242-1255 (2021).
- Prinsen, J. K., et al. Highly reactive Isolevuglandins promote atrial fibrillation caused by hypertension. Basic to Translational Science JACC. 5 (6), 602-615 (2020).
- Ferguson, J. F., et al. High dietary salt-induced dendritic cell activation underlies microbial dysbiosis-associated hypertension. JCI Insight. 5 (13), 126241 (2019).
- Madhur, M. S., et al. Hypertension: Do inflammation and immunity hold the key to solving this epidemic. Circulation Research. 128 (7), 908-933 (2021).
- Estaki, M., DeCoffe, D., Gibson, D. L. Interplay between intestinal alkaline phosphatase, diet, gut microbes and immunity. World Journal of Gastroenterology. 20 (42), 15650-15656 (2014).
- Millán, J. L. . Mammalian alkaline phosphatases: From biology to applications in medicine and biotechnology. , (2006).
- Ponder, B. A., Wilkinson, M. M. Inhibition of endogenous tissue alkaline phosphatase with the use of alkaline phosphatase conjugates in immunohistochemistry. Journal of Histochemistry and Cytochemistry. 29 (8), 981-984 (1981).
- Goldstein, D. J., Rogers, C. E., Harris, H. Expression of alkaline phosphatase loci in mammalian tissues. Proceedings of the National Academy of Science U. S. A. 77 (5), 2857-2860 (1980).
- Ramos-Vara, J. A. Technical aspects of immunohistochemistry. Veterinary Pathology. 42 (4), 405-426 (2005).
- Coleman, J. E. Structure and mechanism of alkaline phosphatase. Annual Review of Biophysics and Biomolecular Structure. 21, 441-483 (1992).
- Harper, J. E., Toth, R. L., Mayo, M. A., Torrance, L. Properties of a panel of single chain variable fragments against Potato leafroll virus obtained from two phage display libraries. Journal of Virological Methods. 81 (1-2), 159-168 (1999).
Erratum
Formal Correction: Erratum: Direct Detection of Isolevuglandins in Tissues using a D11 scFv-Alkaline Phosphatase Fusion Protein and Immunofluorescence
Posted by JoVE Editors on 4/11/2023. Citeable Link.
An erratum was issued for: Direct Detection of Isolevuglandins in Tissues using a D11 scFv-Alkaline Phosphatase Fusion Protein and Immunofluorescence. The Authors section was updated from:
Cassandra Warden1
Alan J. Simmons2
Lejla Pasic3
Sean S. Davies4
Justin H. Layer5
Raymond L. Mernaugh3
Annet Kirabo4,6
1Vanderbilt Eye Institute, Vanderbilt University Medical Center
2Department of Cell and Developmental Biology, Vanderbilt University
3Department of Biochemistry, Vanderbilt University
4Division of Clinical Pharmacology, Department of Medicine, Vanderbilt University Medical Center
5Division of Hematology and Oncology, Indiana University School of Medicine
6Department of Molecular Physiology and Biophysics, Vanderbilt University
to:
Cassandra Warden1
Alan J. Simmons2
Lejla Pasic3
Ashley Pitzer4,6
Sean S. Davies4
Justin H. Layer5
Raymond L. Mernaugh3
Annet Kirabo4,6
1Vanderbilt Eye Institute, Vanderbilt University Medical Center
2Department of Cell and Developmental Biology, Vanderbilt University
3Department of Biochemistry, Vanderbilt University
4Division of Clinical Pharmacology, Department of Medicine, Vanderbilt University Medical Center
5Division of Hematology and Oncology, Indiana University School of Medicine
6Department of Molecular Physiology and Biophysics, Vanderbilt University
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados