Method Article
Ensayo de liberación de mediadores humanizados como lectura para la potencia de los alérgenos
En este artículo
Resumen
Aquí presentamos el ensayo de liberación de mediadores, utilizando una línea celular de leucemia basofílica de rata transfectada con el receptor de IgE humano, para simular la degranulación de células efectoras típicamente observadas en reacciones alérgicas tipo 1. Este método investiga la actividad biológica de los alérgenos de una manera altamente sensible, reproducible y personalizable.
Resumen
Los ensayos de liberación de mediadores analizan la degranulación mediada por inmunoglobulina E (IgE) in vitro y la secreción de mediadores por células efectoras, como mastocitos y basófilos, tras la estimulación con diluciones seriadas de alérgenos putativos. Por lo tanto, estos ensayos representan una herramienta esencial que imita el proceso de degranulación in vivo, que ocurre tras la exposición a alérgenos en pacientes sensibilizados o en pruebas de punción cutánea. Además, estos ensayos generalmente se emplean para investigar el potencial alergénico de las proteínas y la reactividad de la reactividad de los sueros de los pacientes. Aquí, describimos un protocolo simple de 2 días utilizando una línea celular de leucemia basófila de rata inmortalizada transfectada y humanizada con el receptor de membrana plasmática IgE humano de alta afinidad (FcεRI). Esta variante del ensayo de liberación de mediadores es un sistema robusto, sensible y reproducible basado en células in vitro sin la necesidad de inmovilizar el antígeno a matrices sólidas. El protocolo consta de los siguientes pasos: (1) inactivación del complemento de sueros humanos, (2) recolección, siembra y sensibilización pasiva de las células, (3) estimulación con antígeno para causar la liberación del mediador y (4) medición de la actividad de la β-hexosaminoidasa como sustituto de los mediadores inflamatorios liberados, como la histamina. El ensayo representa una herramienta útil para evaluar la capacidad de la reticulación alérgeno-IgE para desencadenar la degranulación celular y se puede implementar para estandarizar los extractos de alérgenos, comparar la reactividad de los pacientes con alérgenos menores o mayores y con extractos alergénicos (polen, caspa de gato, etc.), para investigar la potencia de los homólogos de alérgenos, isoformas y variantes de pliegue (por ejemplo, hipoalergenicidad), así como los efectos de los ligandos en la actividad alergénica. Una aplicación más reciente incluye el uso del ensayo para monitorear la eficacia del tratamiento en el curso de la inmunoterapia con alérgenos.
Introducción
Las reacciones de hipersensibilidad de tipo I, caracterizadas por la producción de inmunoglobulina E (IgE) específica para un antígeno respectivo, afectan a casi un tercio de la población mundial. Estas reacciones se asocian con varias manifestaciones alérgicas como el asma y la rinoconjuntivitis e incluso pueden conducir a reacciones sistémicas potencialmente mortales1. A diferencia de las pruebas in vivo, los enfoques inmunoquímicos, como el ensayo de inmunoabsorción ligado a enzimas (ELISA), son los únicos adecuados para investigar la unión objetivo de los anticuerpos, pero no abordan el aspecto funcional de las proteínas que pueden causar reacciones de hipersensibilidad inmediatas. La inmovilización de los alérgenos en soportes sólidos (por ejemplo, placas ELISA) podría causar cambios en su integridad estructural y la destrucción de epítopos relevantes para la alergia2. Incluso las pruebas de punción cutánea (SPT), la herramienta más común para confirmar la sensibilización contra ciertos alérgenos, tienen sus límites en cuanto a la detección de alergia alimentaria sintomática mediada por IgE o disponibilidad de alérgenos3,4. Con el fin de encontrar un método ético, altamente específico, sensible y rentable para probar la potencia biológica de los alérgenos para causar una reacción de hipersensibilidad de tipo I, se han establecido los llamados ensayos de liberación de mediadores.
El principio de estos ensayos se basa en los eventos posteriores a la fase de sensibilización y la capacidad acompañante de la IgE para unirse a la cadena α de los receptores de alta afinidad expresados en la superficie de las células efectoras, como los mastocitos y los basófilos. La IgE es producida principalmente por las células plasmáticas en el tejido linfoide asociado a la mucosa. Aunque es la inmunoglobulina menos abundante (alrededor del 0,05% en individuos no atópicos) en la sangre, posee una actividad biológica extraordinariamente alta siendo la principal causa de síntomas alérgicos. La vida media de la IgE puede aumentar de 2-3 días a varias semanas e incluso meses cuando se une a sus receptores en las células efectoras. La unión posterior de un antígeno a la región variable de dos moléculas de IgE unidas al receptor conduce a su reticulación seguida de la inducción de una cascada de señalización aguas abajo en la célula efectora que conduce a la degranulación y la liberación de varios mediadores proinflamatorios que causan vasodilatación, como histamina, serina proteasas (por ejemplo, triptasa) y prostaglandinas5,6,7. La secreción de citoquinas como la interleucina 4 (IL-4) y la IL-13 son responsables del mantenimiento de la respuesta inflamatoria T helper 2 (Th2) y del cambio de clase de las células B a células plasmáticas productoras de IgE5,8,9. Por otro lado, el tromboxano liberado causa broncoconstricción, y los leucotrienos estimulan la contracción del músculo liso, así como la fuga vascular, y desempeñan un papel crucial en la inflamación de las vías respiratorias que conduce al asma o rinitis alérgica10,11.
Se han establecido herramientas de investigación para analizar la mayoría de los mediadores antes mencionados, aunque con algunas desventajas importantes. Los ensayos de triptasa son enfoques clínicos adecuados para la medición de la anafilaxia sistémica a través de la activación de mastocitos, pero su sensibilidad y especificidad en los diagnósticos de alergia es demasiado inexacta en comparación con los métodos estándar de oro como el SPT. Por otro lado, los ensayos de cisteinil leucotrienos no son capaces de diagnosticar alergias a β-lactámicos o antiinflamatorios no esteroideos12. Los protocolos para la medición de la histamina como mediador principal liberado en las reacciones alérgicas ya se establecieron en la década de 1960. Una vez liberada en la sangre periférica, la histamina es inmediatamente degradada por las histaminas metiltransferasas, lo que resulta en una vida media plasmática de solo unos minutos, lo que hace que su análisis sea bastante desafiante13. Aparte de su inestabilidad, se demostró que el monitoreo de la histamina tiene una baja especificidad y sensibilidad para las alergias a los medicamentos, así como las proteínas de los alimentos comerciales y los venenos de avispa12.
Se han introducido modelos in vitro con líneas celulares efectoras como alternativa a los procedimientos intensivos en mano de obra de aislamiento y cultivo de basófilos de pacientes alérgicos para realizar ensayos de liberación. Por lo tanto, se ha establecido el ensayo basado en leucemia basófila en rata (RBL) utilizando la línea celular RBL-2H33. Dado que esta línea celular no es capaz de unirse a la IgE humana, primero se transfectó con la cadena de α, β y γ del receptor de membrana plasmática IgE humana (FcεRI). Se han generado y probado varios clones para determinar los niveles de expresión y la homogeneidad de la cadena de α humana, de los cuales el clon RBL-30/25 surgió como el candidato más prometedor para las pruebas in vitro. La cascada de señalización inducida tras la activación del receptor del clon transfectado se probó a través de ensayos de movilización de calcio. Como indicador de degranulación y sustituto de la liberación de histamina, se midió la enzima lisosomal β-hexosaminoidasa, que tiene la ventaja significativa de una mayorestabilidad 14. La liberación del mediador utilizando células RBL-30/25 alcanza hasta el 100% y, por lo tanto, se utiliza para probar sueros derivados de pacientes alérgicos. El ensayo se probó para la liberación del mediador después de desafiar las células sensibilizadas con extractos de alérgenos comerciales. Esto llevó al hallazgo de que existe una tremenda variación en la composición (de hasta 60 veces con respecto al contenido total de proteínas) de extractos de alérgenos derivados de diferentes fabricantes y utilizados para enfoques diagnósticos (por ejemplo, SPT) o terapéuticos3,15,16.
Aquí, proporcionamos una descripción detallada del protocolo RBL para realizar el ensayo de liberación del mediador utilizando suero de donantes alérgicos. Durante la sensibilización pasiva, la IgE en el suero es capturada por el receptor FcεR1 de alta afinidad expresado en la superficie de las células basófilas. Tras la estimulación del antígeno, las IgEs unidas específicas para el antígeno se entrecruzan, lo que desencadena la degranulación celular y la liberación del mediador β-hexosaminidasa. La actividad de la β-hexosaminadasa se mide posteriormente utilizando un sustrato adecuado. Para el ensayo, se utilizaron células huRBL-2H3, denominadas huRBL en el siguiente protocolo. El protocolo describe una serie de dilución de antígenos estándar con 8 pasos diluidos 1:10 que van desde 1 μg/mL hasta 0,1 pg/mL de alérgeno.
Protocolo
La aprobación ética para usar sueros derivados de pacientes alérgicos al polen de abedul se obtuvo del comité ético holandés (número de aprobación: NL65758.018.18).
1. Procedimientos de seguridad
- Trabajar en condiciones estériles utilizando un banco de trabajo de clase 2 de seguridad biológica durante el primer día del experimento (Nivel de Bioseguridad 2). Siga las pautas de seguridad de la institución para el uso de suero humano.
2. Inactivación del complemento de sueros humanos
- Cosechar un cultivo denso de células P3X63Ag8.653 (denominadas células Ag8 en adelante), del matraz de cultivo celular y transferirlas a un tubo de centrifugación.
- Utilice el siguiente medio de cultivo para estas células: Medio esencial mínimo de águila modificado con concentración sérica reducida, 1% de penicilina-estreptomicina (100 unidades Pen., 0,1 mg/ml de estreptococo), 5% de suero fetal de terneros/bovinos inactivado por calor (FCSi).
- Centrífuga las células Ag8 durante 5 min a 250 x g a temperatura ambiente.
- Vuelva a suspender el pellet celular a una concentración final de aproximadamente 1 x 106 células/ml en medio huRBL (Medio Esencial Mínimo Águila con Modificación Alfa, 4 mM L-Glutamina, 5% FCSi, 1% G418 (100% stock: 10 g/125 mL dH2O).
NOTA: Mantenga las células Ag8 pasando para uso futuro también. - Diluir sueros humanos 1:10 en suspensión celular Ag8. La dilución sérica final en el ensayo será de 1:20.
NOTA: Para sueros con igE específica baja, se puede usar un 1: 5 (dilución final 1: 10). - Incubar durante 1 h a 37 °C y 5%-7% CO2.
3. Cosecha y siembra de células huRBL
- Aspire el medio desde un matraz de cultivo celular T-75 con cuidado sin tocar las células huRBL (las células huRBL son adherentes). Asegúrese de que las células sean alrededor del 50% -90% confluentes.
NOTA: Dependiendo de la confluencia celular, el contenido celular de un matraz de cultivo celular T-75 denso suele ser suficiente para una o dos placas de 96 pozos. - Lave las células dos veces agregando 10 ml de solución salina tamponada con fosfato (DPBS) de Dulbecco. Agregue DPBS al lado opuesto del matraz y no directamente a las celdas.
- Aspire DPBS y agregue 5 ml de 1x tripsina-EDTA precalentada (0.05% / 0.02% EDTA diluido en DPBS) para el desprendimiento celular.
- Incubar el matraz durante 5 min a 37 °C.
- Separe las células golpeando cuidadosamente el matraz.
- Transfiera la suspensión celular a un tubo de centrifugación de 15 ml y llénelo con medio huRBL o DPBS para diluir la tripsina-EDTA.
- Centrifugar las células a 250 x g durante 5 min a temperatura ambiente.
- Aspire el sobrenadante y resuspante el pellet en 5 ml de medio huRBL para el recuento celular.
- Contar las células y diluirlas en medio huRBL para obtener una concentración final de 2 x 106 células/ml.
- Use una placa estéril de 96 pozos y agregue 50 μL de suspensión celular huRBL por pozo, lo que equivale a 1 x 105 células / pozo.
4. Sensibilización pasiva de células huRBL
- Centrifugar la suspensión preincubada de Ag8/suero durante 5 min a 250 x g.
- Transfiera 50 μL de la suspensión centrifugada de Ag8/suero a cada pozo que contenga células huRBL sin perturbar el gránulo de células Ag8.
- Incluya el control sin antígenos, que son células sensibilizadas, pero no estimuladas (no agregue antígeno), que sirven como una indicación para la meseta / fondo de la señal inferior. Los pozos de control de fondo y de lisis máxima no necesitan ser sensibilizados con suero. Agregue 50 μL de medio huRBL para controlar los pozos en su lugar.
- Cubra la placa con la tapa e incube durante la noche a 37 °C y 5%-7% CO2.
5. Degranulación estimulada por antígenos y liberación de mediadores
- Prepare la dilución del antígeno en 1x tampón de Tyrode (9,5 g / L sales de Tyrode, 0,1% de albúmina sérica bovina (BSA), 0,5 g / L de carbonato de hidrógeno sódico (NaHCO3) en dH2O) con anticipación. Se necesita una cantidad final de 100 μL por pozo.
NOTA: No todos los alérgenos, ya sea purificados de fuentes naturales o producidos recombinantemente, pueden ser estables en el tampón de 1x Tyrode. Por lo tanto, realice pruebas de estabilidad en el búfer de 1x Tyrode antes del procedimiento de ensayo. Alternativamente, diluya 1x tampón de Tyrode en óxido de deuterio (D2O) para aumentar la relación señal-ruido del ensayo. - Hacer 8 diluciones del antígeno de interés de una serie de dilución 1:10 en tubos de reacción comenzando con 10 o 1 μg/mL de proteína.
NOTA: Siempre pruebe la serie de dilución de antemano. Alternativamente, adapte la serie de dilución 1:10 (por ejemplo, 1:5, 1:20 o 1:30) para cubrir la curva de liberación completa. Además, la concentración inicial puede variar dependiendo de la configuración experimental. - Para lavar las células huRBL chapadas en la placa de 96 pozos, retire primero el medio celular que contiene sueros aspirando, invirtiendo y golpeando la placa en papel absorbente.
- Lavar las células con 200 μL de 1x tampón de Tyrodes por pozo. Trate todos los pozos de manera similar.
NOTA: Agregue la solución de lavado lentamente a las celdas para no molestarlas. - Déjelo durante aproximadamente 30 s y repita el paso de lavado tres veces en total.
- Después de agregar la solución de lavado por última vez, deje la solución en los pozos hasta que esté lista para continuar con la adición de la dilución del antígeno.
NOTA: Evite exponer las células al aire durante demasiado tiempo. - Transferir 100 μL de solución de antígeno a cada pozo que contenga las células huRBL presensibilizadas.
NOTA: Si analiza varios parámetros diferentes, transfiera las muestras individuales de la serie de dilución a una placa adicional de 96 pozos no vinculante (use el mismo diseño que en la placa huRBL) y transfiéralas después con una pipeta multicanal directamente en la placa de celda huRBL. De esta manera, se puede evitar exponer las células al aire durante demasiado tiempo, lo que podría resultar en un rendimiento deficiente del ensayo (menor / ninguna señal). - Cubra los pozos de control (lisis máxima y células de fondo no sensibilizadas) con 100 μL de 1x tampón de Tyrode. No estimule estos pozos de control con el antígeno.
- Además, agregue 100 μL de tampón de 1x Tyrode a los pozos sensibilizados sin antígeno de la serie de dilución, lo que es necesario para tener en cuenta la liberación espontánea independiente del antígeno de células sensibilizadas durante el análisis de datos.
- Incubar células huRBL durante 1 h a 37 °C y 5%-7% CO2.
6. Medición de fluorescencia de la actividad de la β-hexosalinaidasa
- Tratar los pozos del control máximo de lisis con 10 μL de Tritón X-100 al 10% por pozo y mezclar adecuadamente para lisiar las células por completo y obtener la liberación del 100% de β-hexosalinaidasa.
- Agregue 50 μL de solución de sustrato en una nueva placa de 96 pozos no vinculante. Solución de sustrato para una placa de 96 pozos: 5 ml de tampón de ensayo cítrico de 0,1 M, pH 4,5; y 80 μL de 10 mM de 4-metilumbelliferil N-acetil-β-D-glucosaminida.
- Transfiera 50 μL de sobrenadante celular de todos los pozos a la nueva placa que contiene la solución de sustrato.
NOTA: Pipetee el sobrenadante cuidadosamente de la placa huRBL para no interrumpir las células huRBL. - Incubar la placa con solución de sustrato y sobrenadante celular durante 1 h a 37 °C para permitir la conversión del sustrato fluorogénico.
NOTA: Mantenga la placa huRBL para el ensayo de viabilidad celular. - Añadir 100 μL de solución de parada (15 g/L de glicina, 11,7 g/L de NaCl disuelto en dH2O, pH 10,7) por pozo.
- Mida la fluorescencia a 360 nm de excitación y 465 nm de emisión utilizando un lector de placas.
7. Análisis de datos
- Para los cálculos básicos de la liberación porcentual, utilice cualquier software de hoja de cálculo.
- Para la sustracción de fondo/eliminación de la línea de base, reste el promedio de los pozos de fondo de todos los demás pozos.
- Calcular la media de los pozos máximos de lisis y expresar los datos de la serie de dilución en porcentaje. De esta manera se pueden expresar los datos como un porcentaje de liberación celular normalizada a la liberación máxima de enzimas causada por la lisis celular.
- Las curvas completas de liberación del mediador dosis-respuesta se representan mejor como gráficos XY con la concentración de antígenos en un registro en el eje X y el porcentaje de liberación del mediador en el eje Y.
- Agregue los valores del control sin antígeno como una línea discontinua para indicar el fondo o la meseta inferior.
NOTA: Varios sueros tratados de manera similar se pueden comparar utilizando esta estrategia de normalización. Para la comparación directa, se recomienda además calcular la liberación máxima de la mitad, que es la concentración de antígeno (en ng/ ml) necesaria para la liberación máxima de la mitad definida como el promedio de los valores máximos y mínimos por curva. La concentración de antígeno para estimular la liberación media máxima se calcula mediante la interpolación del valor de liberación máxima de la mitad en una línea de regresión logarítmica.
Resultados
El ensayo de liberación del mediador, basado en células huRBL(Figura 1A y B),da como resultado una curva dosis-respuesta en forma de campana(Figura 1C). Para una representación simplificada de los datos, la concentración de antígenos necesaria para la liberación media máxima del mediador se puede calcular mediante regresión lineal(Figura 1D). Se realiza un ensayo de viabilidad celular para excluir los efectos citotóxicos derivados del suero sensibilizante o del antígeno utilizado para la estimulación(Figura 1E). El ensayo se puede utilizar para probar la reactividad de diferentes sueros a un determinado antígeno. En nuestro caso, 4 de cada 5 sueros, derivados de pacientes alérgicos al polen de abedul, respondieron a la estimulación de Bet v 1. El suero #1 mostró la mayor liberación del mediador(Figura 2). El suero # 5 no respondió a la estimulación de Bet v 1 y, por lo tanto, podría reaccionar a otros alérgenos de polen de abedul (por ejemplo, Bet v 2, profilin). Estos datos indican que Bet v 1 es un potente alérgeno responsable de los síntomas alérgicos mediados por IgE. Mediante el uso del ensayo huRBL, se puede evaluar la reactividad cruzada de IgE a alérgenos homólogos (Figura 3). Aquí, ambos pacientes alérgicos al polen de abedul respondieron bien a Bet v 1, mientras que solo el paciente # 2 respondió también a Cor a 1, el alérgeno alimentario homólogo Bet v 1 que se encuentra en las avellanas. Según estos datos, lo más probable es que el paciente # 2 tenga niveles más altos de IgE de Cor a 1-cross-reactive que el paciente # 1, lo que resulta en síntomas de alergia oral al consumir avellanas. Incluso la evaluación de la naturaleza hipoalergénica de las variantes mutantes de alérgenos (disminución de la potencia) puede analizarse y compararse con su contraparte de tipo salvaje(Figura 4). En el ejemplo proporcionado, la curva de liberación de la variante de pliegue se desplazó hacia una mayor concentración de antígeno en comparación con el alérgeno de tipo silvestre, lo que resultó en una concentración significativamente mayor de antígeno necesaria para provocar la liberación media máxima(Figura 4B). Estos datos implican que la variante mutante/pliegue generada es menos alergénica en comparación con la proteína de tipo salvaje. Esta potencia reducida para desencadenar la degranulación mediada por IgE resalta el carácter hipoalergénico de la variante de pliegue. Sobre la base de este ensayo, la variante de pliegue es un candidato interesante para la inmunoterapia específica de alérgenos, ya que podría causar efectos secundarios reducidos asociados a IgE durante el tratamiento.
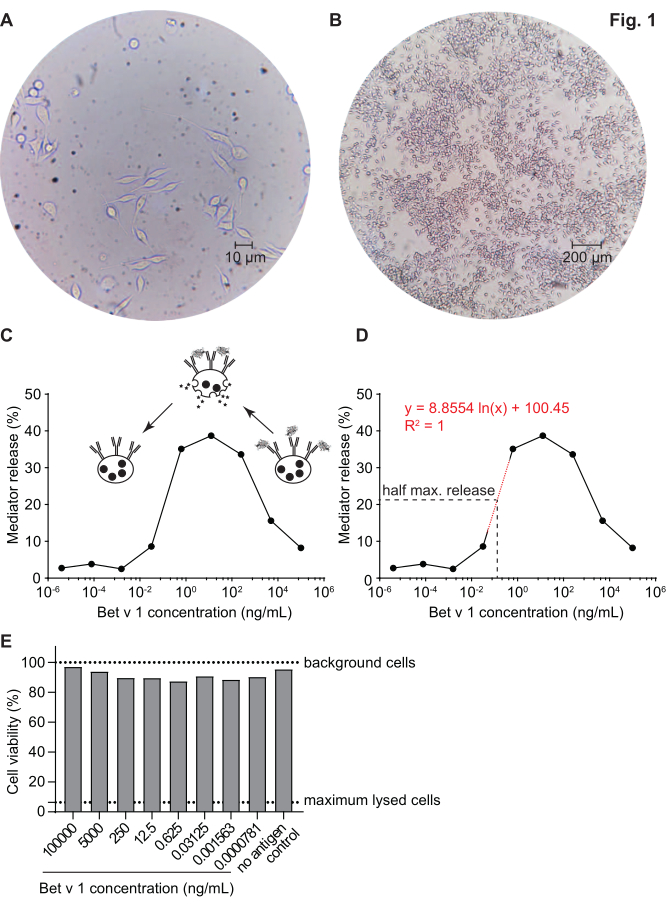
Figura 1:Células RBL humanizadas y una curva representativa en forma de campana de liberación de β-hexosafinanidasa inducida por reticulación de alérgenos IgE. Las células RBL son adherentes a los matraces de cultivo, lo que les da una forma de varilla mientras intentan adherirse (A). Un nivel ideal de confluencia para las células a cosechar no es más del 90% (B). Las células se muestran bajo aumento de 40x y 10x, respectivamente. Células que fueron sensibilizadas con suero humano de un individuo alérgico al polen de abedul que reacciona al desafío con Bet v 1 recombinante (rBet v 1), el principal alérgeno del polen de abedul (C). Como sustituto de la liberación del mediador, la actividad de la β-hexosafinaidasa se mide en los sobrenadantes celulares. La curva en forma de campana resulta de una ocupación monovalente de epítopos de antígenos en IgE debido al exceso de alérgeno, que inhibe competitivamente la reticulación alérgeno-IgE a altas concentraciones de antígenos. Otra explicación para la baja liberación a altas concentraciones de alérgenos es la inhibición de las vías intracelulares en presencia de exceso de antígeno. Para la determinación de la concentración de alérgenos necesaria para obtener la mitad de la liberación máxima, se utilizó una línea de regresión logarítmica basada en los valores experimentales que representan la parte lineal de la pendiente de la curva de liberación del mediador (D). La línea punteada roja representa la línea de regresión logarítmica utilizada para el cálculo. La fórmula de la línea de regresión se muestra en rojo. La liberación máxima de la mitad se define como: liberación máxima de la mitad = (valor de liberación mínima + valor de liberación máxima)/2. En el ejemplo, la liberación máxima media calculada fue del 20,6%. El suero humano representativo utilizado en este experimento se diluyó 1:20 para la incubación con células huRBL, y la concentración de antígenos utilizada para la estimulación varió de 100 μg / ml a 0,004 pg / ml de Bet v 1. Se realizó un ensayo de viabilidad celular, en este caso un ensayo MTT, con las células restantes después de la estimulación del antígeno para evaluar la influencia del suero sensibilizante, así como de la dilución del antígeno sobre la viabilidad celular y el recuento celular (E). Las células de fondo no tratadas y las células lisadas (lisis máxima) se muestran como línea punteada. Haga clic aquí para ver una versión más grande de esta figura.
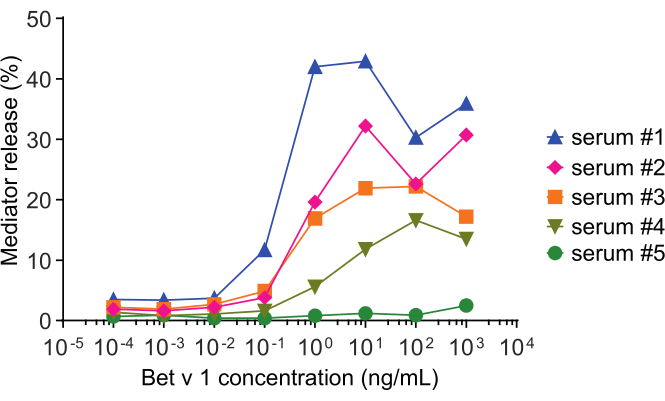
Figura 2: Curvas representativas de β-hexosafinaidasa por ciento de liberación de cinco sueros humanos diferentes. El mismo rango de concentración de antígenos de rBet v 1 se incubó con células huRBL que fueron sensibilizadas con sueros de diferentes individuos sensibilizados con polen de abedul. Existe una clara diferencia de porcentaje de liberación entre los diferentes pacientes correspondiente a la gravedad de sus síntomas. Observe que el paciente # 5 no es reactivo al alérgeno principal del polen de abedul Bet v 1. Los cinco sueros humanos utilizados para obtener estas curvas de liberación de mediadores se diluyeron igualmente 1:20 para la incubación con células huRBL. Haga clic aquí para ver una versión más grande de esta figura.
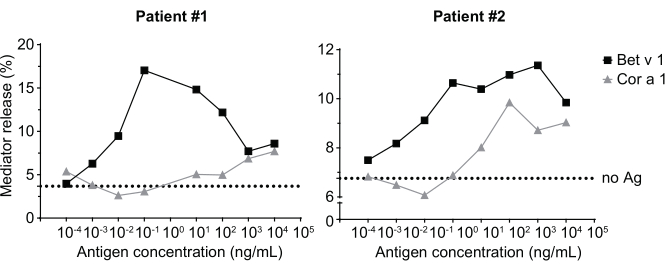
Figura 3: Reactividad cruzada de IgE derivada de sueros de polen de abedul sensibilizados a pacientes con el alérgeno homólogo de avellana Bet v 1 Cor a 1. Dos sueros representativos de pacientes sensibilizados al polen de abedul reaccionan fuertemente a Bet v 1 así como en menor grado al alérgeno homólogo Cor a 1. El paciente 2 muestra una reacción significativa a Cor a 1 y, por lo tanto, es probable que muestre síntomas de alergia oral al consumir avellanas, en comparación con el paciente 1, donde la liberación del mediador es casi insignificante. La línea punteada representa el control sin antígeno, que son células sensibilizadas con los sueros humanos pero no estimuladas con un alérgeno y, por lo tanto, sirve como indicación para la meseta / fondo de la señal inferior. Haga clic aquí para ver una versión más grande de esta figura.
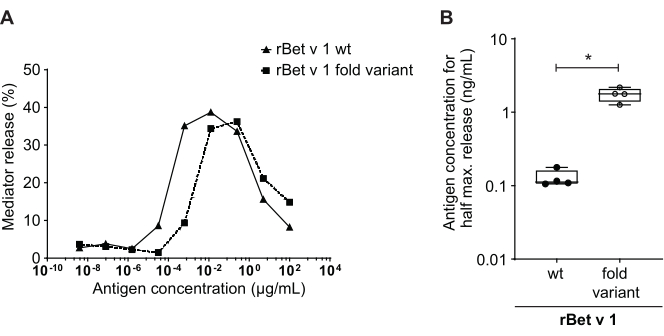
Figura 4: Comparación del porcentaje de liberación entre el tipo salvaje rBet v 1 y una variante de pliegue hipoalergénico. El mismo suero de un individuo sensibilizado con polen de abedul se incubó con rBet v 1 tipo salvaje (wt) y una variante de pliegue hipoalergénico del principal alérgeno del polen de abedul (A). A pesar de que la liberación de mediadores se observa en ambos antígenos, hay un claro cambio hacia concentraciones más altas de antígenos al comparar la variante de pliegue con el tipo salvaje rBet v 1 para la misma liberación porcentual. Una forma estándar de comparar la diferencia en el porcentaje de liberación de diferentes antígenos es calcular la concentración de antígeno necesaria para alcanzar la mitad de la liberación máxima (B). Esto generalmente se realiza en réplicas biológicas (pruebas del mismo rango de antígenos para cada alérgeno en diferentes sueros humanos). Por lo general, para sacar conclusiones significativas, la liberación del mediador se realiza con sueros de al menos 8 a 10 pacientes diferentes. Aquí se trazan los resultados de cuatro sueros diferentes como ejemplo. Se utilizó una prueba tpareada para el análisis estadístico. *p ≤ 0,05; **p ≤ 0,01; p ≤ 0,001; p ≤ 0,0001. Haga clic aquí para ver una versión más grande de esta figura.
| Posibles preguntas y solución de problemas | Solución |
| Variabilidad de ensayo a ensayo debido a la capacidad de respuesta celular alterada | Asegúrese de que el número del ciclo de paso celular no exceda de 20 a 30 pasajes. Haga existencias congeladas en los primeros pasajes para futuros experimentos. |
| Más bien se basan en réplicas biológicas (uso de diferentes sueros) que en técnicas. | |
| Los sueros contienen niveles bajos de IgE específica | Se puede utilizar una dilución sérica final más baja (es decir, 1:10) en lugar de 1:20. Por el contrario, los sueros que contienen altos niveles de IgE específica pueden diluirse aún más (1:30 o 1:40). |
| No hay suficientes células para realizar el ensayo | Asegúrese de que la confluencia en un matraz T-75 sea de alrededor del 50-90%. Paso de más matraces. |
| Efectos citotóxicos de los sueros, es decir, debido a la inactivación incompleta del complemento | Realizar un ensayo de viabilidad celular además del ensayo de liberación del mediador. Aumentar la concentración de Ag8 para evitar la inactivación incompleta del complemento. |
| Señal baja | Mejore la relación señal-ruido del ensayo diluyendo el tampón de 1x Tyrode en óxido de deuterio (D2O) en lugar de dH 2 O, outilizandosueros con niveles más altos de IgE específica para el alérgeno de interés. |
| El alérgeno no es estable en el tampón de Tyrode (por ejemplo, precipitación) | Realice pruebas de estabilidad en el búfer de Tyrode 1x antes del procedimiento de ensayo. No se recomienda la sustitución del búfer de Tyrode. |
| Problemas para encontrar la concentración inicial correcta para el alérgeno respectivo | Adaptación de la serie de dilución para cubrir la curva de liberación completa (más pasos de dilución, dilución 1:20 en lugar de 1:10). |
| Rendimiento deficiente del ensayo indicado por señal baja/nua | Evite los efectos citotóxicos de la estimulación de sueros o antígenos (por ejemplo, alérgenos enzimáticos). Lave y remoje las células con cuidado. Evite la exposición al aire durante demasiado tiempo y evite que las células se sequen. |
| ¿Cómo sé si se alcanza la meseta de la señal inferior? | Agregue controles "sin antígeno" a su placa. Estas son células sensibilizadas, que solo fueron estimuladas con 1x tampón de Tyrode pero sin un alérgeno. |
| ¿Necesito un control positivo además de los pozos de lisis máxima? | Como control positivo adicional, se puede usar una combinación de suero y antígeno que se sabe que causa degranulación o un anticuerpo anti-FcεR1. |
| ¿Cuántos pozos necesito? | Eso depende de su serie de titulación, la cantidad de antígenos y sueros que desea analizar. Planifique el diseño de las placas de 96 pozos de acuerdo con la cantidad de sueros / antígenos que va a probar. No olvide agregar los "controles sin antígenos", las células de fondo (no sensibilizadas, no estimuladas) así como los pozos de lisis máximos. |
| ¿Cuántos sueros debo analizar? ¿Y necesito réplicas? | Aunque el ensayo es bastante robusto, existe cierta variabilidad de ensayo a ensayo debido a la capacidad de respuesta celular alterada. Por lo tanto, se recomienda confiar más en réplicas biológicas (utilizando diferentes sueros) que en réplicas técnicas. Un mínimo de ocho sueros diferentes es suficiente para analizar los alérgenos. Sin embargo, como se muestra en la Fig. 4B, ya se pueden obtener resultados significativos utilizando menos sueros. |
Tabla 1: Solución de problemas.
Discusión
El ensayo de liberación de mediadores basado en células huRBL aquí descrito es un método robusto que se puede realizar e implementar fácilmente en cualquier laboratorio. El único requisito es que las células deben cultivarse en condiciones estériles. El ensayo se utiliza para evaluar la probabilidad de que un alérgeno o fuente alergénica evoque la reticulación de IgE y la degranulación de basófilos de los pacientes17. El ensayo se puede adaptar fácilmente a cualquier alérgeno o fuente alergénica siempre que se disponga del suero del paciente con un alto nivel de IgE específica, reconociendo el alérgeno de interés. Se recomienda realizar un ensayo de viabilidad celular además del ensayo de liberación del mediador para tener en cuenta cualquier posible efecto citotóxico que pueda resultar en un rendimiento deficiente del ensayo. Esto podría deberse a la inactivación incompleta del complemento de los sueros u otros efectos citotóxicos derivados del suero. Incluso el antígeno en sí, por ejemplo, debido a la actividad proteolítica / enzimática, puede dañar las células huRBL. Por lo general, estamos utilizando un ensayo de viabilidad celular con MTT (bromuro de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolio) para evaluar los posibles efectos citotóxicos. El ensayo se puede realizar fácilmente con las células huRBL que quedan después de que se recolectó y transfirió el sobrenadante celular (ver paso 6.3. del protocolo). En comparación con otros métodos inmunoquímicos, como elISA y western blotting, para determinar el potencial alergénico de alérgenos individuales o extractos complejos basados en la unión alérgeno-IgE, este ensayo puede detectar no solo la unión de IgE a un alérgeno, sino que también puede medir la funcionalidad de ambos, IgE humana y el alérgeno, para provocar la degranulación de basófilos mediados por IgE18. Por lo tanto, puede ayudar a estudiar la gravedad de los síntomas alérgicos ex vivo utilizando sueros de pacientes. Se informa que el ensayo es más consistente y eficiente que las pruebas clásicas de anafilaxia cutánea pasiva, ya que el ensayo utiliza las células RBL-2H3, que son relativamente fáciles de manejar y producen menos variabilidad en los resultados en comparación con las células primarias, como los mastocitos o los basófilos humanos19,20. Además de esto, el ensayo proporciona una buena representación de la actividad biológica de los alérgenos y puede estimar con precisión el contenido total de alérgenos en una muestra compleja dada3. Para solucionar problemas de ciertos pasos del protocolo, consulte la Tabla 1.
En cuanto a la aplicabilidad de esta versión del ensayo de liberación de mediadores, se ha utilizado principalmente con fines de investigación, pero también para la estandarización de extractos alergénicos en función de su actividad biológica. Esto incluye el análisis de diferentes lotes de soluciones SPT, solución de prueba de provocación, así como extractos utilizados para inmunoterapia específica de alérgenos; como se muestra para el polen, la caspa de gato, el ácaro del polvo doméstico y los extractos de maní, así como el veneno de abeja3,17,21. La técnica se puede aplicar especialmente en el diagnóstico de alergias alimentarias, ya que puede detectar incluso cantidades mínimas de componentes alergénicos en productos alimenticios complejos como cacahuetes, leche, trigo y huevos22. En este sentido, también se ha informado como una herramienta valiosa para la evaluación de la alergenicidad de los alérgenos de los alimentos de origen animal, como las tropomiosinas, y puede ayudar a distinguir los alérgenos potentes de los no alérgenos23. Como herramienta de investigación, el ensayo se utiliza para estudiar el impacto del procesamiento de alimentos, así como para evaluar la influencia de la unión del ligando a los alérgenos y su efecto sobre la alergenicidad24,25. Por ejemplo, se demostró que la unión de Bet v 1 a ligandos no afectaba a la reticulación alérgeno-IgE, aunque causó un aumento en su estabilidad térmica y proteolítica25. El ensayo se puede utilizar para comparar la reactividad del paciente con alérgenos menores y mayores, así como para investigar la reactividad cruzada de homólogos e isoformas de alérgenos, como se muestra en nuestro ejemplo utilizando Bet v 1 y el alérgeno alimentario homólogo Cor a 1 (Figura 3). En cuanto a las isoformas de alérgenos, se utilizó el ensayo de liberación de mediadores para identificar el alérgeno principal Amb a 1.01 como la isoforma reactiva a IgE más potente en el polen deambrosía (Ambrosia artemisiifolia). En comparación, las otras dos isoformas identificadas en extractos de polen de ambrosía, Amb a 1.02 y Amb a 1.03, mostraron una reactividad reducida a la IgE26de los pacientes.
En los últimos años, el ensayo se ha aplicado para estudiar posibles compuestos antialérgicos y nuevas variantes hipoalergénicas de alérgenos, ayudando en la identificación de candidatos adecuados para la inmunoterapia específica de alérgenos27,28. Otro enfoque novedoso es utilizar el ensayo para monitorear la eficacia del tratamiento en el curso de la inmunoterapia específica para alérgenos. En este sentido, nuestro grupo de investigación desarrolló un sistema de inhibición del ensayo huRBL, que se correlacionó bien con la reducción de la puntuación de síntomas del paciente durante la inmunoterapia específica del alérgeno29. El ensayo también se ha propuesto para estudiar los efectos inmunosupresores de TGFβ1 sobre la degranulación mediada por IgE inducida por alérgenos30.
Las limitaciones del ensayo son que a pesar de que las células huRBL poseen algunas características de mastocitos o basófilos, no imitan completamente la función natural de estas células efectoras. Por ejemplo, los mastocitos expresan ampliamente el receptor de reconocimiento de patrones Toll-like receptor 4 (TLR4), necesario para el reconocimiento de patógenos, mientras que es completamente deficiente en las células RBL-2H331. Debido a esta diferencia en la funcionalidad, el ensayo no imita completamente la situación de la vida real, lo que debe tenerse en cuenta al interpretar los datos. Además, dado que las células huRBL son células basófilas cancerosas, los cambios en las condiciones de cultivo y el cultivo prolongado pueden conducir a diferencias fenotípicas que conducen a resultados alterados entre diferentes laboratorios20. Otro aspecto es la elección de la concentración de alérgenos que debe tenerse en cuenta a la hora de adaptar este método, ya que las altas concentraciones de alérgenos pueden dar lugar a una degranulación no mediada por IgE debido a la presencia de altas cantidades de proteasas o endotoxinas18. Otras limitaciones son la dependencia de sueros humanos con niveles específicos de IgE relativamente altos (RAST clase 5-6), y la necesidad de sistemas de cultivo celular, que sigue siendo un obstáculo que debe superarse para implementar la técnica en la rutina clínica diaria.
Aparte de estas limitaciones, el ensayo huRBL representa una valiosa herramienta de investigación para el diagnóstico y tratamiento de enfermedades alérgicas y se puede utilizar en una amplia gama de aplicaciones.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer al Prof. Dr. Stefan Vieths del Departamento de Alergología Molecular, Paul-Ehrlich-Institut, Langen, Alemania, por proporcionar las células RBL humanizadas / transfectadas por FcεRI y por dar su consentimiento para escribir este documento de metodología de investigación. Queremos agradecer a la Prof. Dra. Fatima Ferreira por proporcionar excelentes comentarios. Además, nos gustaría agradecer al Prof. Dr. Ronald van Ree y al Dr. Jaap Akkerdaas del Departamento de Inmunología Experimental, Amsterdam University Medical Centers, ubicación AMC, Ámsterdam, Países Bajos, por dar su consentimiento para publicar datos representativos proporcionados en este documento de métodos, que se generaron en el curso del proyecto BM4SIT - innovaciones para la alergia (www.BM4SIT.eu). El trabajo de los autores ha sido apoyado por el Fondo Austriaco de Ciencia (Proyecto P32189), por el programa prioritario de la Universidad de Salzburgo Allergy-Cancer-BioNano Research Centre, por el programa de doctorado Immunity in Cancer and Allergy-ICA financiado por el Austrian Science Fund (FWF W01213), y por el proyecto BM4SIT (número de subvención 601763) del Séptimo Programa Marco fp7 de la Unión Europea.
Materiales
| Name | Company | Catalog Number | Comments |
| 4-Methylumbelliferyl N-acetyl-β-D-glucosaminide | Sigma | M2133 | |
| 96-well plate for huRBL cells (Nunc MicroWell 96-Well, Nunclon Delta-treated, flat-bottom microplate) | ThermoFisher Scientific | 167008 | |
| 96-well plate for substrate solution and cell supernatant (Greiner Bio-One non-treated 96-well microplates) | Fisher Scientific | 655101 | |
| Bovine serum albumin (BSA) | Sigma | 10735078001 | |
| Citric acid | Applichem | 131018 | |
| Dulbecco's phosphate-buffered saline (DPBS without calcium and magnesium) | Sigma | D8537 | |
| G418 | Sigma | A1720 | |
| Glycine | Applichem | A3707 | |
| Heat-inactivated fetal calf/bovine serum (FCSi) | Sigma | F0804 | |
| L-Glutamine (200 mM) | Sigma | G7513 | |
| Minimum Essential Medium Eagle with Alpha Modification, with ribonucleosides, deoxyribonucleosides and sodium bicarbonate, without L-glutamine, liquid, sterile-filtered, suitable for cell culture | Sigma | M8042 | |
| Opti-MEM reduced serum medium, GlutaMAX supplement | Gibco/ThermoFisher Scientific | 51985034 | |
| Penicillin-Streptomycin (10K units Pen. 10 mg/mL Strep.) | Sigma | P4333 | |
| Sodium chloride (NaCl) | Applichem | A2942 | |
| Sodium hydrogen carbonate (NaHCO3) | Applichem | 131638 | |
| Triton X-100 | Sigma | X100 | |
| Trypsin-EDTA | Sigma | 59418C | |
| Tyrode’s salt | Sigma | T2145 |
Referencias
- Curin, M., et al. Next-generation of allergen-specific immunotherapies: molecular approaches. Current Allergy and Asthma Reports. 18 (7), 39(2018).
- Okamoto-Uchida, Y., et al. Different results of IgE binding- and crosslinking-Based allergy tests caused by allergen immobilization. Biological and Pharmaceutical Bulletin. 39 (10), 1662-1666 (2016).
- Vogel, L., Lüttkopf, D., Hatahet, L., Haustein, D., Vieths, S. Development of a functional in vitro assay as a novel tool for the standardization of allergen extracts in the human system. Allergy. 60 (8), 1021-1028 (2005).
- Ocmant, A., et al. Basophil activation tests for the diagnosis of food allergy in children. Clinical and Experimental Allergy. 39 (8), 1234-1245 (2009).
- Platts-Mills, T. A. The role of immunoglobulin E in allergy and asthma. American Journal of Respiratory and Critical Care Medicine. 164 (8), Pt 2 1-5 (2001).
- Galli, S. J., Tsai, M. IgE and mast cells in allergic disease. Nature Medicine. 18 (5), 693-704 (2012).
- Lawrence, M. G., et al. Half-life of IgE in serum and skin: Consequences for anti-IgE therapy in patients with allergic disease. The Journal of Allergy and Clinical Immunology. 139 (2), 422-428 (2017).
- Draber, P., Halova, I., Polakovicova, I., Kawakami, T. Signal transduction and chemotaxis in mast cells. European Journal of Pharmacology. 778, 11-23 (2016).
- Peebles, R. S. Prostaglandins in asthma and allergic diseases. Pharmacology & Therapeutics. 193, 1-19 (2019).
- Cyphert, J. M., et al. Allergic inflammation induces a persistent mechanistic switch in thromboxane-mediated airway constriction in the mouse. American Journal of Physiology. Lung Cellular and Molecular Physiology. 302 (1), 140-151 (2012).
- Méndez-Enríquez, E., Hallgren, J. Mast cells and their progenitors in allergic asthma. Frontiers Immunology. 10, 821(2019).
- Demoly, P., Lebel, B., Arnoux, B. Allergen-induced mediator release tests. Allergy. 58 (7), 553-558 (2003).
- Yamaga, S., et al. Decreased intracellular histamine concentration and basophil activation in anaphylaxis. Allergology International. 69 (1), 78-83 (2020).
- Huang, L., et al. A rapid and sensitive assay based on particle analysis for cell degranulation detection in basophils and mast cells. Pharmacological Research. 111, 374-383 (2016).
- González-Pérez, R., Poza-Guedes, P., Barrios Del Pino, Y., Matheu, V., Sánchez-Machín, I. Evaluation of major mite allergens from European standardized commercial extracts for in vivo diagnosis: addressing the need for precision medicine. Clinical and Translational Allergy. 9, 14(2019).
- Focke, M., Marth, K., Valenta, R. Molecular composition and biological activity of commercial birch pollen allergen extracts. European Journal of Clinical Investigation. 39 (5), 429-436 (2009).
- Hoffmann, A., Vieths, S., Haustein, D. Biologic allergen assay for in vivo test allergens with an in vitro model of the murine type I reaction. The Journal of Allergy and Clinical Immunology. 99 (2), 227-232 (1997).
- Sun, N., Zhou, C., Zhou, X., Sun, L., Che, H. Use of a rat basophil leukemia (RBL) cell-based immunological assay for allergen identification, clinical diagnosis of allergy, and identification of anti-allergy agents for use in immunotherapy. Journal of Immunotoxicology. 12 (2), 199-205 (2015).
- Kaul, S., Hoffmann, A. Mediator release assay of rat basophil leukemia cells as alternative for passive cutaneous anaphylaxis testing (PCA) in laboratory animals. Altex. 18 (1), 55-58 (2001).
- Passante, E., Frankish, N. The RBL-2H3 cell line: its provenance and suitability as a model for the mast cell. Inflammation Research. 58 (11), 737-745 (2009).
- Kaul, S., et al. Mediator release assays based on human or murine immunoglobulin E in allergen standardization. Clinical and Experimental Allergy. 37 (1), 141-150 (2007).
- Huang, J., et al. Application of in vitro and in vivo models in the study of food allergy. Food Science and Human Wellness. 7 (4), 235-243 (2018).
- Klueber, J., et al. Homologous tropomyosins from vertebrate and invertebrate: Recombinant calibrator proteins in functional biological assays for tropomyosin allergenicity assessment of novel animal foods. Clinical and Experimental Allergy. 50 (1), 105-116 (2020).
- Zhang, T., et al. Different thermal processing effects on peanut allergenicity. Journal of the Science of Food and Agriculture. 99 (5), 2321-2328 (2019).
- Soh, W. T., et al. Multiple roles of Bet v 1 ligands in allergen stabilization and modulation of endosomal protease activity. Allergy. 74 (12), 2382-2393 (2019).
- Wolf, M., et al. Amb a 1 isoforms: Unequal siblings with distinct immunological features. Allergy. 72 (12), 1874-1882 (2017).
- Eichhorn, S., et al. Rational design, structure-activity relationship, and immunogenicity of hypoallergenic Pru p 3 variants. Molecular Nutrition & Food Research. 63 (18), 1900336(2019).
- Abd Rani, N. Z., et al. Mechanistic studies of the antiallergic activity of phyllanthus amarus Schum. and Thonn. and its compounds. Molecules. 26 (3), (2021).
- Huber, S., et al. Does clinical outcome of birch pollen immunotherapy relate to induction of blocking antibodies preventing IgE from allergen binding? A pilot study monitoring responses during first year of AIT. Clinical and Translational Allergy. 8 (1), 39(2018).
- Araujo, G. R., et al. TGFβ1 mimetic peptide modulates immune response to grass pollen allergens in mice. Allergy. 75 (4), 882-891 (2020).
- Passante, E., Frankish, N. Deficiencies in elements involved in TLR4-receptor signalling in RBL-2H3 cells. Inflammation Research. 59, Suppl 2 185-186 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados