Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Estudio del desarrollo de células dendríticas mediante la eliminación de genes mediados por ARN de horquilla corta en una línea de células madre y progenitoras hematopoyéticas in vitro
En este artículo
Resumen
Aquí proporcionamos un protocolo para el cribado de posibles factores de transcripción implicados en el desarrollo de células dendríticas (DC) mediante la transducción lentiviral de shRNA para obtener líneas celulares de derribo estables para la diferenciación in vitro de DC.
Resumen
Las células dendríticas (DC) son importantes células presentadoras de antígenos que conectan las respuestas inmunes innatas y adaptativas. Los DC son heterogéneos y se pueden dividir en DC convencionales (cDC) y DC plasmocitoides (pDC). Los cDC se especializan en presentar antígenos y activar células T naïve. Por otro lado, los pDC pueden producir grandes cantidades de interferones tipo I (IFN-I) durante la infección viral. La especificación de los DC ocurre en una etapa temprana de los progenitores de DC en la médula ósea (BM) y se define por una red de factores de transcripción (TF). Por ejemplo, los cDC expresan altamente ID2, mientras que los pDC expresan altamente E2-2. Dado que se están identificando cada vez más subconjuntos de DC, existe un creciente interés en comprender los TF específicos que controlan el desarrollo de DC. Aquí, establecemos un método para detectar TF críticos para la diferenciación de DC in vitro mediante la entrega de lentivirus portadores de ARN de horquilla corta (shRNA) en una línea de células madre y progenitoras hematopoyéticas inmortalizadas (iHSPC). Después de la selección y diferenciación in vitro , el potencial cDC y pDC de las líneas celulares de derribo estable se analiza mediante citometría de flujo. Este enfoque proporciona una plataforma para identificar genes que potencialmente gobiernan los destinos de DC de progenitores in vitro.
Introducción
Los DC son reguladores clave de la inmunidad innata y adaptativa1. Los DC se clasifican principalmente en dos poblaciones funcionalmente distintas, a saber, pDC y CDC. Además, los cDC comprenden dos subconjuntos, a saber, los cDC de tipo I y tipo II o cDC1 y cDC2, respectivamente2. Los pDC, que expresan BST2, Siglec-H y niveles intermedios de CD11c en ratones3,4, son las células que pueden secretar grandes cantidades de IFN-I durante la inflamación y la infección viral5. Debido a su robusta capacidad de producción de IFN-I, también se sospecha que desempeñan un papel clave en la progresión de enfermedades autoinmunes, incluido el lupus eritematoso sistémico (LES)6. Los cDC1s, definidos por la expresión superficial de XCR1, CD8a, CLEC9A y CD103 en ratones7, están especializados en la activación y polarización de células T citotóxicas CD8+ (CTL) a través de la presentación cruzada de antígenos, iniciando así la inmunidad tipo I en respuesta a patógenos intracelulares y cáncer8,9. Por otro lado, los cDC2s, que expresan CD11b y CD172α (también conocidos como Sirpα) tanto en humanos como en ratones, pueden activar las células T CD4+ y promover la respuesta inmune tipo II frente a alérgenos y parásitos10, así como modular la inmunidad tipo III tras el reconocimiento extracelular de bacterias y microbiota11,12.
La diversificación de los DC está determinada por un grupo de TF a partir de células madre y progenitoras hematopoyéticas (HSPC) en el BM. E2-2 (codificado por Tcf4) es un regulador maestro para la diferenciación y función de los pDC13,14. Por el contrario, el inhibidor de la unión al ADN 2 (ID2) impulsa la especificación de cDC e inhibe el desarrollo de pDC a través del bloqueo de la actividad de la proteína E15. Además, el desarrollo de cDC1 requiere IRF8 y BATF3, mientras que la diferenciación de cDC2 depende en gran medida de IRF416. Trabajos recientes han explorado la heterogeneidad de los pDCs17 y cDCs y su regulación transcripcional18. Debido a la complejidad de la red de CC, existe una necesidad insatisfecha de establecer una plataforma para identificar otros TF que controlen el desarrollo y la funcionalidad de los CONTROLADORES.
Aquí, utilizamos un iHSPC que se generó al expresar la translocación nuclear regulada por estrógenos de Hoxb8 en células BM (también conocidas como células Hoxb8-FL)19. Los iHSPC pueden proliferar y permanecer en una etapa indiferenciada en presencia de β-estradiol y ligando Flt3 (FL), mientras que comienzan a diferenciarse en diferentes tipos de DC en presencia de FL al retirar β-estradiol19. Sobre la base de esta característica, podemos derribar genes de interés en la etapa progenitora, seguido de examinar el efecto sobre la diferenciación in vitro de pDC y cDC. Por lo tanto, este método es una herramienta poderosa para descubrir los genes que regulan el desarrollo y la función de los DC.
Protocolo
El manejo del lentivirus se realiza según la regulación del Departamento de Salud y Seguridad Ambiental de la Facultad de Medicina de la Universidad Nacional de Taiwán.
1. Preparación de líneas celulares madre y progenitoras hematopoyéticas inmortalizadas (iHSPC)
- Mantener la línea celular iHSPC en medio RPMI 1640 completo que contenga 100 ng/mL FL y 1 μM β-estradiol.
- Pase las células en una proporción de 1:10 cada 3 días.
NOTA: Haga un medio RPMI 1640 completo complementando con suero bovino fetal (FBS) al 10%, 5 x 10-5 M de β-mercaptoetanol y 10 μg / ml de gentamicina. La FL murina recombinante también está disponible comercialmente.
2. Transducción lentiviral
- Placa iHSPC a una densidad de 1 x 105 células/pozo en placas de 12 pocillos en 1 mL de medio completo que contiene 100 ng/mL FL, 1 μM β-estradiol y 8 μg/mL de polibreno.
NOTA: La concentración de polibreno depende de los tipos de células y generalmente está en el rango de 4-8 μg / ml. - Agregue el lentivirus portador de shRNA en cada pocillo a una multiplicidad de infección (MOI) de 100.
NOTA: El vector lentiviral es pLKO.1-Puro con un marcador de selección de puromicina (Figura 1). Las secuencias objetivo de shRNAs contra LacZ, Tcf4 e Id2, respectivamente, se enumeran en la Tabla de Materiales. El MOI se define por el número de viriones que se agregan por célula durante la infección.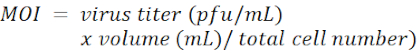
- Girar las placas a 1.100 x g durante 90 min a 37 °C.
NOTA: La infección de giro se lleva a cabo utilizando un rotor de cucharón oscilante. - Incubar la placa que contiene las células infectadas durante la noche a 37 °C en una incubadora.
NOTA: Si las células son sensibles al polibreno, actualice las células con el medio completo sin polibreno después de la infección por espín. - Refrescar las células con un medio completo que contenga 100 ng/ml fl y 1 μM β-estradiol 24 h después de la infección.
- Agregue 6 μg/ml de puromicina al medio para seleccionar las células infectadas después de 24 h adicionales.
NOTA: El vector lentiviral transducido generalmente tarda 48 h en expresar genes, incluido el gen resistente a la puromicina. Asegúrese de que la concentración de puromicina esté optimizada para cada línea celular. - Actualice el medio de selección que contiene 100 ng / ml FL, 1 μM β-estradiol y 6 μg / ml de puromicina cada 3 días y mantenga las células durante al menos una semana para expandir las células iHSPC transducidas de manera estable.
NOTA: La selección de puromicina generalmente surte efecto 48 h más tarde, y el período de selección depende de los tipos de células.
3. Medición de la eficiencia de derribo mediante transcripción inversa y PCR en tiempo real (RT-PCR)
- Extraiga el ARN total de 1 x 107 células iHSPC de derribo estables shLacZ, shTcf4 y shId2 utilizando un reactivo de extracción de ARN comercial y precipite EL ARN de la capa acuosa con isopropanol, seguido de lavar el precipitado de ARN con etanol al 75%.
- Disolver el ARN (~ 5 μg) con 5 μL de H2O tratado con DEPC y ajustar la concentración a 1 μg/μL.
- Tomar 1-3 μg de ARN, mezclar con H2O tratado con DEPC hasta un volumen final de 17,4 μL, añadir 1 μL de 1 unidad/μL de DNasa I libre de RNasa e incubar durante 20 min a 37 °C.
NOTA: Este paso consiste en digerir el ADN genómico en las muestras de ARN. - Añadir 1 μL de 20 mM de EDTA a las muestras de ARN, incubar a 65 °C durante 10 min para inactivar la DNasa I, y colocar las muestras de ARN inmediatamente a 4 °C.
- Añadir 11,6 μL de la mezcla de reacción que contiene 1 μL de cebadores oligo (dT) (45 μM), 6 μL de tampón de 5x 1ª hebra, 3 μL de dNTP (2 mM), 0,6 μL de inhibidor de la RNasa (50 Unidad/μL) y 1 μL de transcriptasa inversa (200 Unidad/μL) a las muestras de ARN e incubar a 40 °C durante 1 h.
- Detenga la reacción calentando a 70 °C durante 10 min y diluya la mezcla de reacción con 30 μL de H2O.
- Tome 2 μL de la mezcla de reacción RT diluida como una plantilla de ADN y la PCR la amplifique utilizando cebadores contra Tcf4 o Id2 (consulte la Tabla 1 para las condiciones del termociclador).
NOTA: Las secuencias de imprimación se incluyen en la Tabla de Materiales.
4. Diferenciación in vitro de las líneas celulares iHSPC de derribo estable
- Mantener el knockdown único estable de LacZ (shLacZ), Tcf4 (shTcf4) o Id2 (shId2) en iHSPC en medio completo que contenga 100 ng/mL de FL y 1 μM β-estradiol.
- Recolecte los iHSPC no diferenciados shLacZ, shTcf4 y shId2 en un tubo de 15 ml y centrífuga durante 5 minutos a 500 x g para granular las células.
- Deseche el sobrenadante y agregue 10 ml de PBS para lavar las células. Repita este paso dos veces.
- Resuspend y sembra las células iHSPC a una densidad de 2 x 105 células/ml en una placa de 12 pocillos en 1 mL de medio completo que contenga 100 ng/mL FL solamente.
- Agregue 1 ml de medio completo fresco que contenga 100 ng/ ml FL tres días después.
- Analizar las células diferenciadas (shLacZ, shTcf4 y shId2 iHSPCs) mediante citometría de flujo dos días después.
5. Análisis citométrico de flujo de los DC diferenciados
- Recolecte las células en tubos de 1,5 ml mediante el pipeteo de las celdas hacia arriba y hacia abajo 2-3 veces en la placa, y centrífuga durante 5 minutos a 500 x g a temperatura ambiente (RT).
NOTA: Los DC diferenciados in vitro se unirán ligeramente a las placas. El pipeteo suave ayudará a recuperar los DC de las placas. - Deseche el sobrenadante y resuspenda las células en 50 μL de tampón FACS. A continuación, agregue 50 μL de sobrenadante de hibridoma anti-CD16/32 e incube durante 5-10 minutos en hielo.
NOTA: El anticuerpo bloqueador Fc previene la unión inespecífica de anticuerpos a los receptores Fc que se expresan en algunas células mieloides y células B y está disponible comercialmente a través de varios proveedores. - Agregue anticuerpos conjugados con colorantes fluorescentes (0,04 μg por cada anticuerpo) directamente a las células e incube durante 15 minutos en hielo en la oscuridad. Los anticuerpos utilizados son APC/cy7 anti-ratón CD11c, FITC anti-ratón CD11b, y PE anti-ratón B220.
NOTA: Los pDC se definen como CD11c+CD11b-B220+, y los cDC se definen como CD11c+CD11b+B220-. - Lavar las células con 1 ml de tampón FACS y centrífuga durante 5 min a 500 x g a RT.
- Resuspendir las células en 100 μL de tampón FACS y analizarlas por citometría de flujo.
Resultados
Se muestra el mapa del vector lentiviral pLKO.1-Puro (Figura 1). Después de la administración de lentivirus que expresa shRNA contra LacZ (un control no dirigido), Tcf4 e Id2 en iHSPC, la eficiencia de derribo confirmada por RT-qPCR reveló que la expresión de Tcf4 se redujo en shTcf4 iHSPCs, en comparación con shLacZ iHSPCs (Figura 2A). Por otro lado, también se observó la disminución de la expresión...
Discusión
Los vectores de ARNt sh basados en lentivirus se utilizan a menudo para el silenciamiento de genes por transducción viral en las células y permiten una integración estable en el genoma del huésped. Sin embargo, es necesario considerar varias eficiencias de transducción en diferentes tipos de células, y se han adoptado varios enfoques para superar este problema.
El polibreno es un polímero policatiónico que puede neutralizar las cargas en la membrana celular, mejorando así la unión d...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos el apoyo técnico del Dr. Tz-Ling Chen. Agradecemos a la Instalación Central Nacional de ARNi (Academia Sinica, Taiwán) por proporcionar lentivirus shRNA (http://rnai.genmed.sinica.edu.tw). Este trabajo fue apoyado por el Ministerio de Ciencia y Tecnología de Taiwán (MOST 108-2320-B-002-037-MY3 y MOST 109-2320-B-002-054-MY3).
Materiales
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| APC/Cy7 anti-mouse CD11c Antibody | Biolegend | 117324 | (Clone: N418) |
| FITC anti-mouse/human CD11b Antibody | Biolegend | 101206 | (Clone: M1/70) |
| PE anti-mouse/human B220 Antibody | Biolegend | 103208 | (Clone: RA3-6B2) |
| Cell culture | |||
| 1.5 mL Micro tube | ExtraGene | TUBE-170-C | |
| 12-well tissue culture-treated plate | Falcon | 353043 | |
| Fetal bovine serum (FBS) | Corning | 35-010-CV | |
| RPMI 1640 medium | gibco | 11875-085 | |
| Reagent | |||
| β-estradiol | Sigma-Aldrich | E2758-250MG | |
| β-mercaptoethanol (β-ME) | Sigma-Aldrich | M6250 | |
| FACS buffer | home-made | Formula: 1xPBS+0.5 %FBS+0.1%NaN3 | |
| Flt3 ligand (FL) | home-made | ||
| Polybrene | Sigma-Aldrich | TR-1003-G | |
| Puromycin | Invivogen | ant-pr-1 | |
| TRIsure | BIOLINE | BIO-38032 | |
| shRNA (Taregt sequence/clone ID) | Company | ||
| shId2 (GCTTATGTCGAATGATAGCAA/TRCN0000054390) | The RNAi Consortium (TRC) | ||
| shLacZ (CGCGATCGTAATCACCCGAGT/TRCN0000072224) | The RNAi Consortium (TRC) | ||
| shTcf4 (GCTGAGTGATTTACTGGATTT/TRCN0000012094) | The RNAi Consortium (TRC) |
Referencias
- Steinman, R. M., Witmer, M. D. Lymphoid dendritic cells are potent stimulators of the primary mixed leukocyte reaction in mice. Proceedings of the National Academy of Sciences. 75 (10), 5132-5136 (1978).
- Guilliams, M., et al. Dendritic cells, monocytes and macrophages: a unified nomenclature based on ontogeny. Nature Reviews Immunology. 14 (8), 571-578 (2014).
- Blasius, A. L., Cella, M., Maldonado, J., Takai, T., Colonna, M. Siglec-H is an IPC-specific receptor that modulates type I IFN secretion through DAP12. Blood. 107 (6), 2474-2476 (2006).
- Swiecki, M., Colonna, M. Unraveling the functions of plasmacytoid dendritic cells during viral infections, autoimmunity, and tolerance. Immunology Reviews. 234 (1), 142-162 (2010).
- Liu, Y. -. J. IPC: Professional Type 1 interferon-producing cells and plasmacytoid dendritic cell precursors. Annual Review of Immunology. 23 (1), 275-306 (2005).
- Panda, S. K., Kolbeck, R., Sanjuan, M. A. Plasmacytoid dendritic cells in autoimmunity. Current Opinion in Immunology. 44, 20-25 (2017).
- Durai, V., Murphy, K. M. Functions of murine dendritic cells. Immunity. 45 (4), 719-736 (2016).
- Mashayekhi, M., et al. CD8α(+) dendritic cells are the critical source of interleukin-12 that controls acute infection by Toxoplasma gondii tachyzoites. Immunity. 35 (2), 249-259 (2011).
- Anderson, D. A., Dutertre, C. -. A., Ginhoux, F., Murphy, K. M. Genetic models of human and mouse dendritic cell development and function. Nature Reviews Immunology. 21 (2), 101-115 (2021).
- Plantinga, M., et al. Conventional and monocyte-derived CD11b(+) dendritic cells initiate and maintain T helper 2 cell-mediated immunity to house dust mite allergen. Immunity. 38 (2), 322-335 (2013).
- Persson, E. K., et al. IRF4 transcription-factor-dependent CD103(+)CD11b(+) dendritic cells drive mucosal T helper 17 cell differentiation. Immunity. 38 (5), 958-969 (2013).
- Kumamoto, Y., et al. CD301b+ dermal dendritic cells drive T helper 2 cell-mediated immunity. Immunity. 39 (4), 733-743 (2013).
- Cisse, B., et al. Transcription factor E2-2 is an essential and specific regulator of plasmacytoid dendritic cell development. Cell. 135 (1), 37-48 (2008).
- Grajkowska, L. T., et al. Isoform-specific expression and feedback regulation of E protein TCF4 control dendritic cell lineage specification. Immunity. 46 (1), 65-77 (2017).
- Jackson, J. T., et al. Id2 expression delineates differential checkpoints in the genetic program of CD8α+ and CD103+ dendritic cell lineages. The EMBO Journal. 30 (13), 2690-2704 (2011).
- Suzuki, S., et al. Critical roles of interferon regulatory factor 4 in CD11bhighCD8alpha- dendritic cell development. Proceedings of the National Academy of Science U. S. A. 101 (24), 8981-8986 (2004).
- Rodrigues, P. F., et al. Distinct progenitor lineages contribute to the heterogeneity of plasmacytoid dendritic cells. Nature Immunology. 19 (7), 711-722 (2018).
- Brown, C. C., et al. Transcriptional basis of mouse and human dendritic cell heterogeneity. Cell. 179 (4), 846-863 (2019).
- Redecke, V., et al. Hematopoietic progenitor cell lines with myeloid and lymphoid potential. Nature Methods. 10 (8), 795-803 (2013).
- Abe, A., Miyanohara, A., Friedmann, T. Polybrene increases the efficiency of gene transfer by lipofection. Gene Therapy. 5 (5), 708-711 (1998).
- Sorgi, F. L., Bhattacharya, S., Huang, L. Protamine sulfate enhances lipid-mediated gene transfer. Gene Therapy. 4 (9), 961-968 (1997).
- Kirkling, M. E., et al. Notch signaling facilitates in vitro generation of cross-presenting classical dendritic cells. Cell Reports. 23 (12), 3658-3672 (2018).
- Pearce, E. J., Everts, B. Dendritic cell metabolism. Nature Reviews. Immunology. 15 (1), 18-29 (2015).
- Wculek, S. K., Khouili, S. C., Priego, E., Heras-Murillo, I., Sancho, D. Metabolic Control of Dendritic Cell Functions: Digesting Information. Frontiers in Immunology. 10 (775), (2019).
- Saxton, R. A., Sabatini, D. M. mTOR signaling in growth, metabolism, and disease. Cell. 168 (6), 960-976 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados