Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Mediciones de transferencia de energía por resonancia de Förster en células vegetales vivas
En este artículo
Resumen
Se proporciona un protocolo para configurar un microscopio de barrido láser confocal estándar para mediciones de transferencia de energía de resonancia Förster in vivo , seguido de una evaluación de datos.
Resumen
Los experimentos de transferencia de energía de resonancia de Förster (FRET) basados en emisiones sensibilizadas se realizan fácilmente, pero dependen de la configuración microscópica. Los microscopios de barrido láser confocal se han convertido en un caballo de batalla para los biólogos. Los sistemas comerciales ofrecen una alta flexibilidad en el ajuste de potencia láser y la sensibilidad del detector y, a menudo, combinan diferentes detectores para obtener la imagen perfecta. Sin embargo, la comparación de datos basados en la intensidad de diferentes experimentos y configuraciones a menudo es imposible debido a esta flexibilidad. Los procedimientos amigables para los biólogos son una ventaja y permiten un ajuste simple y confiable de la configuración del láser y el detector.
Además, como los experimentos FRET en células vivas se ven afectados por la variabilidad en la expresión de proteínas y las relaciones donante-aceptor, los niveles de expresión de proteínas deben considerarse para la evaluación de datos. Aquí se describe un protocolo simple para mediciones FRET confiables y reproducibles, que incluye rutinas para la estimación de la expresión de proteínas y el ajuste de la intensidad del láser y la configuración del detector. La evaluación de los datos se realizará mediante calibración con una fusión de fluoróforos de eficiencia FRET conocida. Para mejorar la simplicidad, se han comparado los factores de corrección que se han obtenido en las células y mediante la medición de proteínas fluorescentes recombinantes.
Introducción
La transferencia de energía de resonancia de Förster ((F)RET) se observa típicamente mediante espectroscopia de fluorescencia, aunque el proceso en sí no se limita a ocurrir entre fluoróforos. El acoplamiento dipolo-dipolo subyacente simplemente requiere una molécula donante emisora de luz y un aceptor que absorba la luz. Esto se deriva de la superposición espectral requerida integral J de los espectros normalizados de emisión y absorbancia aceptora del donante1. Sin embargo, debido a que RET compite con la fluorescencia, la transferencia de energía se vuelve medible por alteraciones en la emisión de fluorescencia: RET induce el enfriamiento del donante y la emisión del aceptor sensibilizado.
El RET basado en fluoróforos se ha denominado transferencia de energía de resonancia de fluorescencia (FRET) para separarla de la transferencia de energía de resonancia de bioluminiscencia (BRET). RET depende en gran medida de la distancia entre el donante y el aceptor, que está ampliamente en el rango de 0.5-10 nm2 y, por lo tanto, en el mismo rango que las dimensiones de las proteínas y sus complejos. En segundo lugar, RET depende de la orientación dipolo-dipolo kappa al cuadrado. Combinado con el hecho de que la libertad rotacional de los fluoróforos unidos a proteínas puede ser descuidada debido al peso molecular y la lenta relajación rotacional, RET permite el análisis de alteraciones conformacionales3.
El llamado radio de Förster se basa en la integral de superposición espectral y el rango de longitud de onda de la superposición, de modo que los cromóforos que absorben la luz roja dan como resultado radios de Förster más largos que los tintes que absorben la luz azul. Como el rango dinámico de las mediciones FRET está limitado por 0.5 × R0 y 1.5 × R0, el par FRET ECFP-EYFP tiene un rango dinámico de 2.5-7.3 nm debido a su R0 de 4.9 nm4.
El brillo de un fluoróforo viene dado por el producto de su coeficiente de extinción molar y su rendimiento cuántico. Para las mediciones FRET, es ventajoso elegir fluoróforos de brillo casi similar. Esto mejora la detección del enfriamiento del donante y la emisión sensibilizada del aceptor. También favorece la calibración del sistema de microscopía. Al observar los pares FRET de proteínas cian y fluorescentes de uso frecuente, el menor brillo de las proteínas fluorescentes cian se vuelve obvio (Figura 1A).
Sin embargo, la vida útil del aceptor debe ser inferior a la vida útil del donante, lo que garantiza la disponibilidad del aceptor para la transferencia de energía. Si la vida del aceptante excede la vida del donante, el aceptor aún podría estar en el estado excitado cuando el donante se excita nuevamente. Las proteínas fluorescentes cian avanzadas como mTurquoise muestran una vida útil prolongada y, por lo tanto, contribuyen a una mayor probabilidad de FRET (Figura 1B). La probabilidad de FRET también depende del coeficiente de extinción molar del aceptor.
Protocolo
NOTA: Para el siguiente protocolo, se realizó la transfección transitoria de protoplastos, como se describió anteriormente12. A continuación se ofrece una breve descripción.
1. Transfección transitoria de protoplastos
- Cortar ~4 g de hojas sanas de Arabidopsis thaliana ecotipo Columbia en rodajas de 1 mm y transferirlas a 20 mL de solución enzimática (1,5% celulasa; 0,4% macerozima; 0,1% de albúmina sérica bovina Fracción V; 0,4 M de manitol; 20 mM KCl; 20 mM de ácido 2-(N-morpholino)etanosulfónico (MES), pH 5,7; 10 mM CaCl2).
- Infiltrar al vacío las rodajas de hoja seguido de una incubación con agitación durante 2 h a temperatura ambiente. Cosechar las células por centrifugación durante 3 min a 100 × g.
- Lavar los protoplastos con solución W5 (154 mM NaCl; 125 mM CaCl2; 5 mM KCl; 2 mM MES, pH 5.7) y resuspendirlos en solución MMG (0.4 M manitol; 15 mM MgCl2; 4 mM MES, pH 5.7).
- Realizar la transfección en un deslizamiento de 8 pocillos por choque osmótico en presencia de polietilenglicol (PEG) 4000. Mezclar 20 μL de la suspensión de protoplastos con 5 μL de ADN plásmido (5 μg/μL) y 25 μL de solución de PEG (0,2 M de manitol, 0,1 M de CaCl2, 40% de PEG 4000).
- Revertir el choque osmótico mediante un reajuste suave de las condiciones osmóticas.
NOTA: Además de la muestra de interés, se requiere la expresión de donante solo y aceptor solo para determinar el sangrado espectral del donante y el aceptor, respectivamente. Una proteína de fusión del donante y el aceptor también debe expresarse para fines de calibración. La expresión de la proteína fluorescente estuvo bajo el control de un promotor del virus del mosaico de la coliflor 35S (pCaMV35S). Para todas las mediciones, se utilizaron dos microscopios de barrido láser confocales (LSM1 y LSM2). LSM1 tiene dos tipos de detectores: para las mediciones FRET, la señal del donante fue detectada por un detector GaAsP, mientras que la emisión fret y del aceptor se registraron con un fotomultiplicador. LSM2 tiene dos fotomultiplicadores, que se utilizaron para la detección de emisión de donantes, FRET y aceptores.
2. Ajuste láser
NOTA: Aquí, se han aplicado líneas de 458 nm y 514 nm de un láser de iones de argón para el análisis FRET entre proteínas fluorescentes cian mejoradas (ECFP) y proteínas fluorescentes amarillas mejoradas (EYFP). Para la adquisición de datos reproducibles, ambas líneas se ajustaron a una intensidad similar. Esto se logró mediante un fotomultiplicador de transmisión o el modo de reflexión.
- Ajuste láser con un fotomultiplicador de transmisión
- Use un pozo vacío para el ajuste.
- Elija el modo de escaneo de línea y la vista de histograma.
- Disminuya la intensidad del láser al mínimo y ajuste la ganancia del detector al ruido de fondo detectable.
- Aumente la intensidad del láser en pasos del 0,5% y registre la señal correspondiente.
- Aplique la rutina para ambas líneas láser.
- Ajuste láser con modo de reflexión
- Use un pozo vacío para el ajuste.
- Aplique un filtro de reflexión, active el modo de reflexión, si está disponible.
- Asegúrese de que el rango de longitud de onda del detector cubra la longitud de onda del láser.
- Elija el modo de escaneo de línea y la vista de histograma.
- Disminuya la intensidad del láser al mínimo y ajuste la ganancia del detector al ruido de fondo detectable.
- Mueva el objetivo a la posición más baja.
- Mueva el objetivo hacia arriba hasta que el reflejo del deslizamiento sea visible.
- Aumente la intensidad del láser en pasos del 0,5% y registre la señal correspondiente.
- Aplique la rutina para ambas líneas láser.
- Evaluación de datos
- Tabular los datos y ordenarlos por intensidades de señal.
- Traza las intensidades de la señal contra la potencia relativa del láser.
- Elija intensidades láser que resulten en una intensidad de señal similar.
3. Ajuste de fotomultiplicadores
NOTA: Después del ajuste con láser, los fotomultiplicadores se ajustaron a las ganancias individuales para obtener una sensibilidad similar. Esta calibración se realizó con la línea láser de 514 nm, que se encuentra en el centro del rango de longitud de onda de interés.
- Use un pozo vacío para el ajuste.
- Aplique un filtro de reflexión y cambie al modo de reflexión si está disponible.
- Asegúrese de que el rango de longitud de onda del detector cubra la longitud de onda del láser (514 nm).
- Elija el modo de escaneo de línea y la vista de histograma.
- Disminuya la ganancia del detector a la mitad del máximo y ajuste la intensidad del láser al ruido de fondo detectable.
- Mueva el objetivo a la posición más baja.
- Mueva el objetivo hacia arriba hasta que el reflejo del deslizamiento sea visible.
- Aumente la ganancia del detector en pasos de 50 a 100 V y registre la señal correspondiente.
- Aplique los pasos 3.1 a 3.8 para ambos detectores.
- Evaluación de datos
- Grafique la intensidad contra la ganancia del detector para cada detector.
- Elija las ganancias individuales del detector para obtener una sensibilidad similar.
4. Adquisición de imágenes FRET
NOTA: Comience con la muestra de interés para configurar la adquisición de imágenes.
- Elija los filtros/espejos dicroicos apropiados, por ejemplo, un espejo dicroico doble MBS 458/514 para el par FRET ECFP/EYFP. Utilice el mismo espejo dicroico para todos los canales para permitir el escaneo línea por línea. Seleccione un objetivo de inmersión en agua para la obtención de imágenes de células vivas. Elija escaneo de 12 bits o 16 bits y velocidad de escaneo moderada.
- Definir el rango de detección, preferiblemente 470-510 nm para la detección del donante y 530-600 nm para la detección del aceptor/FRET en el caso de ECFP/EYFP. Cuando utilice un láser de diodo de 445 nm o 440 nm, utilice de 450 a 510 nm como rango de detección. En el caso de un divisor de haz acústico-óptico (AOBS), defina la detección del donante en el rango de 450 a 500 nm para evitar la detección de aceptores no deseados.
- Aplique la configuración del detector de acuerdo con 3.10.2.
- Aplique la configuración del láser de acuerdo con 2.3.2. Revise la intensidad del láser en función de la tabla de potencia láser obtenida, si es necesario. Asegúrese de que la relación señal-ruido cubra todo el rango dinámico de los detectores (intensidad que oscila entre 0 y 4095 para el escaneo de 12 bits).
- Mantenga constantes las intensidades del láser y las ganancias del detector. Utilice el diámetro estenopeico para el ajuste fino.
NOTA: Tenga en cuenta que los cambios en el diámetro estenopeico afectan la resolución espacial. - Realice las mediciones (tome imágenes de al menos 20 células).
5. Determinación de las correcciones de diafonía
NOTA: Las células que expresan solo el donante o el aceptor deben determinar el sangrado espectral del donante (DSBT) y el sangrado espectral del aceptor (ASBT), respectivamente. Mantenga la misma configuración descrita en la sección 4.
- Realizar mediciones FRET con células que expresan el fluoróforo del donante.
- Realice mediciones FRET con células que expresan el fluoróforo aceptor.
6. Calibración de las mediciones según Beemiller et al.13
NOTA: Se requieren células que expresen una fusión donante-aceptor de la eficiencia FRET conocida. Aquí, se ha utilizado una fusión ECFP-5 aa-EYFP con una eficiencia FRET de 0,464. Mantenga la misma configuración descrita en la sección 4.
- Realizar mediciones FRET con células que expresan la fusión donante-aceptor
7. Evaluación de datos
- Obtenga perfiles de línea de las celdas, asegurando que cada perfil no contenga más de una celda. Guarde los perfiles como archivos de texto.
- Importe los archivos de texto a una hoja de cálculo mediante la opción de importación de archivos de texto de la sección Datos .
- Lea los valores máximos aplicando la función Max .
- Enumere los valores obtenidos en una tabla, tenga una columna cada uno para la identificación de emisión del donante, la IF de emisión de FRET, la emisión de IA del aceptor y al menos cuatro conjuntos de datos: solo donante, solo aceptor, fusión donante-aceptor y medición.
NOTA: La excitación del donante también resulta en la excitación directa del aceptor y causa ASBT que se describe por el valor α. - Calcule los valores de α ASBT con el conjunto de datos de solo aceptor utilizando la ecuación (1).
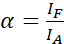 (1)
(1)
NOTA: Utilice la mediana de todos los valores α en las ecuaciones siguientes. El donante muestra un amplio espectro de emisión que da como resultado la diafonía de emisión con la emisión sensibilizada del aceptor. Este DSBT viene dado por el valor β. - Calcule los valores de β de sangrado espectral del donante con el conjunto de datos solo para donantes utilizando la ecuación (2).
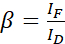 (2)
(2)
NOTA: Utilice la mediana de todos los valores de β en las siguientes ecuaciones. El factor de calibración ξ describe la relación lineal del enfriamiento del donante derivado de FRET y la emisión sensibilizada del aceptor. Utilice las medianas de 7,5 y 7,6 en las siguientes ecuaciones. - Calcule los factores de calibración ξ con el conjunto de datos de fusión donante-aceptor y su eficiencia FRET E (0.46) utilizando la ecuación (3).
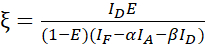 (3)
(3)
NOTA: Utilice la mediana de todos los valores ξ en las siguientes ecuaciones. - Calcular las eficiencias FRET del par de proteínas de interés utilizando las ecuaciones (4) y (5).
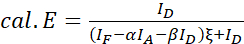 (4)
(4)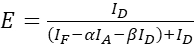 (5)
(5) - Estimar los efectos de la fuerza de expresión y/o la relación donante-aceptor: graficar la suma de ID, IF e IA contra las eficiencias de FRET. Realizar una regresión lineal; tenga en cuenta que cuanto más pronunciado es el gráfico y más alto es R2 , mayor es el impacto del nivel de expresión o mayor es la diferencia de abundancia de donante y aceptor.
Resultados
Ajuste del microscopio de barrido láser confocal
El ajuste láser reveló un aumento lineal de la emisión con el aumento de la intensidad del láser (Figura 2 y Tabla 1). Como era de esperar para los láseres de iones de argón, la emisión de la línea de 514 nm fue mucho mayor que la emisión de la línea de 458 nm, como lo demuestra una pendiente más pronunciada. Para experimentos posteriores, se eligió una potencia láser de 4,5% y 6,5% para la l?...
Discusión
El enfriamiento del donante y la emisión sensibilizada del aceptor se caracterizan por una relación lineal que permite el cálculo del FRET basado en el donante o el aceptor. Los factores correspondientes de linealidad se denominan factor G (donante a aceptor) o xi (aceptor a donante), que son valores recíprocos4. La medición de FRET entre proteínas fluorescentes por microscopía de fluorescencia a menudo requiere correcciones para DSBT y ASBT debido a los amplios espectros de absorción y em...
Divulgaciones
Nos aseguramos de que todos los autores hayan revelado todos y cada uno de los conflictos de intereses y no tengan intereses financieros en competencia.
Agradecimientos
Los experimentos se realizaron en la Plataforma de Tecnología de Microscopía de Luz (LiMiTec) de la Facultad de Biología de la Universidad de Bielefeld. Este trabajo ha sido financiado por la Universidad de Bielefeld.
Materiales
| Name | Company | Catalog Number | Comments |
| 8-well slides | Ibidi | 80821 | |
| Immersion oil Immersol W2010 | Zeiss | 444969-0000-000 | refraction index of water |
| LSM 1: AxioObserver with LSM 780 scan head, confocal laser scanning microscope | Zeiss | ||
| LSM 2: AxioObserver with LSM 5 scan head, confocal laser scanning microscope | Zeiss |
Referencias
- Lakowicz, J. R. . Principles of Fluorescent Spectroscopy. Third Edition. , (2006).
- Clegg, R. M. Förster resonance energy transfer- FRET what it is, why do it, and how it's done. Laboratory Techniques in Biochemistry and Molecular Biology. 33, 1-57 (2009).
- Vogel, S. S., Nguyen, T. A., vander Meer, B. W., Blank, P. S. The impact of heterogeneity and dark acceptor states on FRET: implications for using fluorescent protein donors and acceptors. PLoS ONE. 7, 49593 (2012).
- Müller, S. M., Galliardt, H., Schneider, J., Barisas, B. G., Seidel, T. Quantification of Förster resonance energy transfer by monitoring sensitized emission in living plant cells. Frontiers in Plant Science. 4, 413 (2013).
- Gadella, T. W. J., vander Krogt, G. N., Bisseling, T. GFP-based FRET-microscopy in living plant cells. Trends in Plant Science. 4, 287-291 (1999).
- Van Rheenen, J., Langeslag, M., Jalink, K. Correcting confocal acquisition to optimize imaging of fluorescence resonance energy transfer by sensitized emission. Biophysical Journal. 86, 2517-2529 (2004).
- Seidel, T., Golldack, D., Dietz, K. J. Mapping of C-termini of V-ATPase subunits by in vivo-FRET measurements. FEBS Letters. 579, 4374-4382 (2005).
- Seidel, T., Schnitzer, D., Golldack, D., Sauer, M., Dietz, K. J. Organelle-specific iso-enzymes of plant V-ATPase as revealed by in vivo-FRET. BMC Cell Biology. 9, 28 (2008).
- Schnitzer, D., Seidel, T., Sander, T., Golldack, D., Dietz, K. J. The cellular energization state affects peripheral stalk stability of plant vacuolar H+-ATPase and impairs vacuolar acidification. Plant Cell Physiology. 52, 946-956 (2011).
- Roshchina, V. V. Vital autofluorescence: application to the study of plant living cells. International Journal of Spectroscopy. 2012, 124672 (2012).
- Holtorf, S., Apel, K., Bohlmann, H. Comparison of different constitutive and inducible promoters for the overexpression of transgenes in Arabidopsis thaliana. Plant Molecular Biology. 29, 637-646 (1995).
- Seidel, T., et al. Colocalization and FRET-analysis of subunits c and a of the vacuolar H+-ATPase in living plant cells. Journal of Biotechnology. 112 (1-2), 165-175 (2004).
- Beemiller, P., Hoppe, A. D., Swanson, J. A. A phosphatidylinositol-3-kinase-dependent signal transition regulates ARF1 and ARF6 during FCγ receptor-mediated phagocytosis. PLoS Biology. 4, 162 (2006).
- Lambert, T. J. FPbase: a community-editable fluorescent protein database. Nature Methods. 16, 277-278 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados