Method Article
Cuantificación de la competencia interbacteriana utilizando imágenes de fluorescencia unicelular
En este artículo
Resumen
Este manuscrito describe un método para utilizar la microscopía de fluorescencia unicelular para visualizar y cuantificar la competencia bacteriana en el cocultivo.
Resumen
La competencia interbacteriana puede afectar directamente la estructura y función de los microbiomas. Este trabajo describe un enfoque de microscopía de fluorescencia que se puede utilizar para visualizar y cuantificar las interacciones competitivas entre diferentes cepas bacterianas a nivel de una sola célula. El protocolo descrito aquí proporciona métodos para enfoques avanzados en la preparación de diapositivas en microscopios de epifluorescencia vertical e invertida, técnicas de imágenes de células vivas y lapso de tiempo, y análisis cuantitativo de imágenes utilizando el software de código abierto FIJI. El enfoque en este manuscrito describe la cuantificación de las interacciones competitivas entre las poblaciones simbióticas de Vibrio fischeri midiendo el cambio en el área a lo largo del tiempo para dos cepas coincubadas que expresan diferentes proteínas fluorescentes a partir de plásmidos estables. Se describen métodos alternativos para optimizar este protocolo en sistemas de modelos bacterianos que requieren diferentes condiciones de crecimiento. Aunque el ensayo descrito aquí utiliza condiciones optimizadas para V. fischeri,este enfoque es altamente reproducible y puede adaptarse fácilmente para estudiar la competencia entre aislados cultivables de diversos microbiomas.
Introducción
Este artículo describe un método para cuantificar la competencia bacteriana a nivel de una sola célula utilizando microscopía de fluorescencia. La estructura y función de las comunidades microbianas a menudo está determinada por interacciones competitivas entre microbios, y en muchos casos caracterizar estas interacciones requiere observar diferentes cepas bacterianas en coincubación1,2,3,4,5,6,7,8 . Tradicionalmente, la competencia bacteriana se cuantifica a nivel poblacional contando las unidades formadoras de colonias (FFU) de cepas inhibidoras y diana antes y después de un período de coincubación2,9. Los mecanismos para la competencia microbiana están ampliamente distribuidos entre las bacterias y pueden depender de la difusión o del contacto célula-célula para inhibir las células diana10,11, 12,13, 14,15, 16,17,18,19.
Aunque las cepas bacterianas se observan a menudo en coincubación a nivel de población, este manuscrito describe un ensayo para la cuantificación unicelular de la competencia bacteriana. Además, este trabajo incluye sugerencias para adaptar el protocolo para el uso con otras especies bacterianas. Si bien las técnicas específicas de este artículo se utilizan para estudiar la competencia intraespecífica dependiente del contacto entre cepas de la bacteria simbiótica Vibrio fischeri20,21,22,pueden adaptarse para la competencia entre muchos organismos. Este artículo proporciona instrucciones para la configuración de diapositivas en microscopios verticales e invertidos, y todo el análisis se describe utilizando el software de código abierto FIJI23 para que el método pueda ser utilizado por investigadores con acceso a diferentes configuraciones de imágenes y programas de análisis. Dada la importancia de estudiar la competencia microbiana tanto a nivel poblacional como unicelular, este método será un recurso valioso para que los investigadores cuantifiquen las interacciones competitivas, particularmente aquellas que no tienen acceso a software de análisis propietario.
Protocolo
1. Optimización de cepas bacterianas
- Elija dos cepas bacterianas para ensayos de competencia bacteriana unicelular. Aquí, se utilizan dos cepas de V. fischeri: una cepa objetivo (ES11424) y una cepa inhibidora (MJ1125) que se sabe que mata la cepa objetivo utilizando el sistema de secreción tipo VI en el cromosoma II (T6SS2)1, que es un mecanismo de muerte dependiente del contacto.
- Determine los controles adecuados para el experimento. En este ejemplo, el control apropiado es incubar tanto las cepas inhibidoras mutantes de tipo salvaje como las de T6SS con la cepa objetivo para cuantificar el efecto de la matanza mediada por T6SS.
NOTA: Los controles adicionales pueden incluir una cepa objetivo que exprese los genes de inmunidad necesarios para prevenir la muerte dependiente de T6SS o una cepa mutante inhibidora que exprese copias de tipo salvaje de los genes mutados en trans para restaurar la actividad de T6SS1. - Cuando sea posible, transforme cepas con plásmidos estables que codifican genes para diferentes proteínas fluorescentes (por ejemplo, GFP o RFP) para distinguir visualmente los tipos de cepas en el microscopio. Aquí, la cepa inhibidora se etiqueta con un plásmido que codifica GFP (pVSV102), y la cepa objetivo se etiqueta con un plásmido codificante dsRed (pVSV208)26.
NOTA: Si no es posible utilizar plásmidos estables, se pueden introducir etiquetas fluorescentes en el cromosoma bacteriano para su visualización27,28. - Durante el período de optimización inicial, imagine cultivos clonales de las cepas marcadas debajo de cada uno de los filtros fluorescentes que se utilizarán durante el experimento para garantizar que las células solo sean visibles en el canal previsto. Por ejemplo, asegúrese de que una cepa marcada con GFP solo sea visible en el canal FITC.
2. Preparación de la almohadilla de agarosa
- Prepare la solución de almohadilla de agarosa disolviendo agarosa de baja fusión al 2% (p/v) en mPBS. Calentar la solución brevemente en el microondas y el vórtice hasta que la agarosa se disuelva por completo. Mantenga esta solución caliente colocándola en un baño de agua a 55 ° C hasta que esté lista para usar. Consulte la sección Discusión para obtener más información sobre la preparación de almohadillas de agarosa.
NOTA: Aquí, mPBS se preparó agregando 20 g / L NaCl al PBS estándar 1x. - Envuelva un trozo de cinta de laboratorio alrededor de un portaobjetos de vidrio cinco veces. Repita este proceso una segunda vez en la misma diapositiva para que la distancia entre las dos piezas de cinta sea ligeramente menor que el ancho de un cubreboquetes(Figura 1A). Por ejemplo, si se utilizan fundas de25 mm 2, los trozos de cinta deben estar espaciados aproximadamente 20 mm de separación.
NOTA: Si bien el número de veces que la cinta se envuelve alrededor de la diapositiva se puede modificar para ajustar el grosor de la almohadilla de agarosa, es importante que las capas de cinta estén a la misma altura en ambos lados de la diapositiva para que la almohadilla de agarosa permanezca plana. - Pipete la solución de agarosa tibia entre las dos piezas de cinta e inmediatamente cubra con una funda para que descanse sobre las piezas de cinta. Esto asegurará que la superficie de la almohadilla de agarosa permanezca plana. El volumen de solución de agarosa pipeteada en este paso debe ser suficiente para que la cubierta haga contacto con el líquido y expulse cualquier burbuja en la solución de agarosa. Para esta configuración en particular, 200 μL de agarosa caliente es suficiente.
- Deje que la almohadilla de agarosa se solidifique a temperatura ambiente durante al menos 1 h antes del ensayo de coincubación. El paso 2.2 producirá una almohadilla de agarosa de aproximadamente 20 mm2.
- Corte esta almohadilla de agarosa con una cuchilla de afeitar en cuatro almohadillas de 5 mm2 para usar para imágenes.
NOTA: Las almohadillas de agarosa se pueden hacer hasta una semana antes del experimento y almacenarse a 4 ° C en una placa de Petri vacía y estéril sellada con parapelícula para evitar el secado.
3. Preparar cepas para la co-incubación
- Raye cada cepa que se utilizará en el ensayo de coincubación de -80 °C en placas de agar LBS suplementadas con los antibióticos apropiados e incube durante la noche a 24 °C. Para este ejemplo, se utilizan tres cepas: la cepa inhibidora de tipo salvaje, el mutante del sistema de secreción tipo VI y la cepa objetivo.
- Al día siguiente, comience los cultivos nocturnos en duplicado biológico recogiendo dos colonias de cada cepa y resuspeniéndolas en medio LBS suplementado con los antibióticos apropiados e incube durante la noche a 24 ° C con agitación a 200 rpm.
- A la mañana siguiente, cada subcultivo se replica biológicamente 1:1000 en un medio LBS fresco sin antibióticos e incuba a 24 ° C con agitación durante 4-5 h o hasta que las células alcancen un OD600 de ~ 1.5.
NOTA: Es posible que sea necesario optimizar el momento de los pasos 3.1, 3.2 y 3.3 para diferentes especies bacterianas, ya que su tasa de crecimiento puede variar sustancialmente. Para este ensayo, se apuntó a que las células estuvieran en la fase logarít alta al comienzo del ensayo de coincubación.
4. Cepas bacterianas coincubadas
- A partir de cultivos de registro medio del paso 3.3, mida y registre la densidad óptica a 600 nm (OD600)para todas las muestras.
- Normalizar cada muestra a un OD600 = 1.0, que corresponde a aproximadamente 109 UFC/ml para V. fischeri,diluyendo el cultivo con medio LBS.
- Mezcle las dos cepas competidoras juntas en una proporción de 1:1 basada en el volumen agregando 30 μL de cada cepa normalizada a un tubo etiquetado de 1.5 mL. Vórtice el cultivo de cepa mixta durante 1-2 s.
NOTA: En algunos casos, puede ser apropiado mezclar cocultivos en diferentes proporciones. Por ejemplo, cuando una cepa crece mucho más rápido que la otra, puede ser necesario comenzar la cepa de crecimiento más lento con una ventaja numérica para observar la competencia. La optimización también puede ser necesaria si OD600 no corresponde a CFU/mL similar para ambas cepas. - Repita el paso 4.3 para cada réplica biológica y tratamiento. En el ejemplo que se muestra aquí, esto dará como resultado un total de cuatro tubos de cepa mixta: dos réplicas biológicas con la cepa inhibidora de tipo salvaje mezclada con la cepa objetivo y dos réplicas biológicas con la cepa mutante del sistema de secreción tipo VI mezclada con la cepa objetivo.
- Para garantizar que las células competidoras sean lo suficientemente densas para la muerte dependiente del contacto en la coincubación en la almohadilla de agar, concentre cada cultivo mixto 3 veces centrifugando el cultivo mixto en un tubo de centrífuga estándar de 1,5 ml durante 1 min a 21.130 x g,descartando el sobrenadante y resuspiendo cada pellet en un medio LBS de 20 μL. Repetir para cada muestra.
NOTA: Algunas células bacterianas son sensibles al daño por centrifugación a alto rcf; en tales casos, el cultivo mixto se puede centrifugar durante 3 min a 4600 x g29. Además, al cuantificar la competencia dependiente del contacto, es importante garantizar una densidad celular suficiente en el tobogán para observar la matanza. En este artículo, los tratamientos "abarrotados", donde se observa la muerte, tenían aproximadamente 10 células/20 μm2; consulte la sección Discusión para obtener más información.
5. Configuración de diapositivas
- Cuando use un microscopio vertical, coloque una almohadilla de agarosa de ~ 5 mm2 sobre un portaobjetos de vidrio estándar de 1 mm. Coloque 2 μL de un cultivo mixto en la almohadilla de agarosa y coloque un costizo # 1.5 (25 mm2) sobre el punto. Consulte la Figura 1B para ver un ejemplo.
- Cuando se utilice un microscopio invertido, detecte 2 μL de un cultivo mixto en el fondo de la cubierta #1.5 de una placa de Petri de 35 mm y coloque una almohadilla de agarosa de~5 mm 2 sobre el punto de coincubación. Coloque una funda circular de vidrio de 12 mm sobre la almohadilla de agarosa. Consulte la Figura 1C para ver un ejemplo.
- Repita los pasos 5.1 o 5.2, dependiendo de la configuración del microscopio utilizado, para los tres cultivos mixtos restantes, lo que dará como resultado cuatro diapositivas o platos para obtener imágenes.
- Permita que las diapositivas se asienten en la mesa de trabajo durante aproximadamente 5 minutos antes de continuar con el paso 6. Esto permite que las células se asienten en la almohadilla de agar y elimina el movimiento durante el proceso de obtención de imágenes.
6. Microscopía de fluorescencia
- Comience por enfocarse en las células utilizando luz blanca (contraste de fase o DIC) para minimizar los efectos del fotocolorante. Según el tamaño promedio de una sola célula bacteriana, use un objetivo de aceite de 60x o 100x.
- Ajuste el tiempo de exposición y la configuración de adquisición para cada canal para que las celdas sean visibles en el canal apropiado con una detección de fondo mínima.
NOTA: Es apropiado usar diferentes tiempos de exposición para diferentes canales, pero se debe usar el mismo tiempo de exposición en todas las réplicas biológicas y tratamientos para un canal determinado. - Para cada muestra, seleccione al menos cinco campos de visión (FOV) y adquiera imágenes en cada canal apropiado utilizando la configuración de adquisición del paso 6.2 (consulte ejemplos en la Figura 2). Guarde los puntos XY de cada FOV para que se pueda obtener una imagen del mismo FOV durante el punto de tiempo final. Es necesario obtener imágenes del mismo FOV en cada punto de tiempo para determinar la proporción de área ocupada por células diana o inhibidoras durante los pasos del análisis.
NOTA: En este ejemplo, la fluorescencia de GFP se detecta utilizando un filtro con una longitud de onda de excitación de 467 - 498 nm y un filtro de emisión de 513 - 556 nm y es de color verde falso. La fluorescencia de dsRed se detecta utilizando un filtro con una longitud de onda de excitación de 542 - 582 nm y un filtro de emisión de 603 - 678 nm y es magenta de color falso. - Después de 2 h, repita el paso 6.3 para cada muestra utilizando los puntos XY previamente guardados(Fig. 2).
NOTA: Es posible que sea necesario optimizar el momento de las imágenes posteriores para organismos con diferentes tasas de crecimiento o mecanismos competitivos.
7. Análisis de imágenes en FIJI
- Descargue e instale el software de procesamiento de imágenes FIJI utilizando las instrucciones que se encuentran aquí: https://imagej.net/Fiji/Downloads
- Abra FIJI e importe archivos de imagen para su análisis.
NOTA: En la mayoría de los casos. Los archivos TIFF se utilizarán para el análisis de imágenes, aunque algunos programas de adquisición de imágenes se exportarán utilizando tipos de archivos propietarios. FIJI puede reconocer la mayoría de los tipos de archivos propietarios y las imágenes se pueden importar y analizar de la siguiente manera. - Para cada imagen adquirida en los pasos 6.3 y 6.4, convierta la imagen a escala de grises, separe los canales y comience por el umbral (Ctrl + Mayús + T) y la creación de una máscara binaria de la imagen preprocesada(Figura 3A,B).
NOTA: Aquí, se utiliza la configuración de umbral predeterminada en FIJI. En algunos casos, puede ser necesario cambiar esa configuración, en cuyo caso se debe usar la misma configuración para todas las imágenes de ese experimento. - Establecer escala en la imagen (Analizar | Establecer escala) utilizando los valores apropiados para la configuración de microscopía23.
- Establecer medidas (Analizar | Establecer medidas) y seleccione Área.
NOTA: Se pueden agregar otras mediciones si son apropiadas para el experimento. Solo se requiere la medición del área del objeto para el análisis de ejemplo que se muestra aquí. - Analizar partículas (Analizar | Analizar partículas) utilizando la configuración predeterminada (Figura 3C). Si hay escombros en la muestra, puede ser necesario ajustar el tamaño o la circularidad para filtrar las partículas no celulares. Selecciona Mostrar | Esquemas para que el resultado de este análisis incluya un esquema numerado de todas las partículas analizadas(Figura 3D).
NOTA: Comparar el esquema de la Figura 3D con la imagen inicial es especialmente importante en el paso de optimización para garantizar que (1) se analicen todas las celdas y (2) que se excluyan los restos del análisis. - Exporte las mediciones del paso 7.4(Figura 3E)a un software de hoja de cálculo para su posterior análisis y gráficos.
- Repita los pasos 7.1 a 7.5 para todos los canales e imágenes adquiridos durante el experimento.
8. Cálculo del porcentaje del área objetivo inicial a lo largo del tiempo
- Para cada campo de visión analizado en la sección 7, asegúrese de que el archivo exportado contenga una medición de área individual para cada partícula que se analizó. Comenzando con el canal de fluorescencia de la cepa objetivo, calcule el área de partículas de suma para cada campo de visión individual. Para dos réplicas biológicas con cinco FOV cada una, esto debería resultar en diez áreas de suma por tratamiento en cada punto de tiempo.
- Calcule el porcentaje de área objetivo inicial a lo largo del tiempo para cada FOV utilizando la siguiente ecuación: (
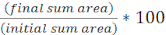 )
) - Repita este cálculo para todos los tratamientos y grafique el porcentaje del área objetivo inicial (resultado de la ecuación del paso 8.2) para cada tratamiento(Figura 4A).
- Determinar si hay un aumento neto en la población objetivo (que indica crecimiento), una disminución neta en la población objetivo (que indica muerte) o ningún cambio (que indica ningún crecimiento o muerte) para cada tratamiento.
NOTA: El porcentaje del área objetivo inicial con valores superiores a 100 indica un crecimiento objetivo neto, y los valores inferiores a 100 indican la muerte neta del objetivo. El porcentaje de los valores objetivo iniciales que se mantienen en 100 indican que no hay un cambio neto en la población objetivo. Consulte la discusión para los experimentos de seguimiento sugeridos.
9. Cálculo del porcentaje del área inicial del inhibidor a lo largo del tiempo
- Repita los pasos 8.1 a 8.3, esta vez utilizando las mediciones recogidas del canal de fluorescencia de la cepa inhibidora en la sección 7(Figura 4B).
- Determinar si hubo un aumento neto en la población de inhibidores (crecimiento); una disminución neta en la población de inhibidores (muerte), o ningún cambio para cada tratamiento. Los valores superiores a 100 indican el crecimiento neto del inhibidor, y los valores inferiores a 100 indican la muerte neta del inhibidor.
Resultados
Para visualizar y cuantificar las interacciones competitivas entre bacterias a nivel de una sola célula, se desarrolló y optimizó un protocolo para V. fischeri modificando nuestro ensayo bien establecido basado en UFC1,2. Este método utiliza plásmidos estables que codifican GFP y dsRed para distinguir visualmente diferentes cepas de V. fischeri. El resultado competitivo de estas interacciones se puede cuantificar analizando las imágenes adquiridas de este ensayo utilizando el software de código abierto FIJI. Como ejemplo, el siguiente experimento se realizó utilizando aislados de V. fischeri. Una cepa inhibidora albergaba un plásmido que codifica GFP, y una cepa objetivo albergaba un plásmido que codifica dsRed. Dado que el T6SS2 codificado por el inhibidor es un mecanismo de muerte dependiente del contacto, se incluyeron tratamientos en los que las células estaban abarrotadas (alto contacto célula-célula) o dispersadas (bajo contacto célula-célula) en una diapositiva para resaltar el impacto de la configuración experimental en los resultados finales de este ensayo. En los datos de la muestra, las cepas competidoras se mezclaron en una proporción de 1:1 y se incubaron en una almohadilla de agarosa durante 2 h, y se tomaron imágenes iniciales y finales (2 h). Como control, una cepa mutante T6SS2 también fue coincubada con la cepa objetivo tanto en condiciones de hacinamiento como de dispersión. Se prepararon y coincubaron cultivos de cada cepa como se describió anteriormente y se prepararon diapositivas como se muestra en la Figura 1.
La Figura 2 muestra imágenes representativas de microscopía de fluorescencia de cada tratamiento experimental con el mismo campo de visión fotografiado en un punto de tiempo inicial y final. Para cada tratamiento, un inhibidor de tipo salvaje o una cepa mutante T6SS que alberga un plásmido que codifica GFP se mezcló en una proporción de 1: 1 con la cepa objetivo que alberga un plásmido codificante dsRed. Durante un período de coincubación de 2 h con esta configuración experimental, las células V. fischeri en crecimiento pueden pasar por 1-2 divisiones(Figura 2;flechas grises). En la Figura 2A,el contacto célula-célula se forzó entre el objetivo y el inhibidor concentrando el cultivo mixto antes de detectarlo en el portaobjetos. Se observa que múltiples células diana se redondean y/o desaparecen en el transcurso de 2 h, de acuerdo con la eliminación de las células diana por el inhibidor (Figura 2; flechas blancas). Consulte la sección Discusión para obtener más información sobre la interpretación del redondeo o el liso de las celdas de destino. En la Figura 2B,la misma coincubación se detectó en un portaobjetos, esta vez sin concentrar el cultivo mixto para que las células permanecieran dispersas y hubiera un contacto mínimo entre las cepas en el portaobjetos. Aquí, no se observa que las células diana desaparezcan o se redondeen, lo que sugiere que la cepa objetivo no se inhibió en este tratamiento. La Figura 2C y la Figura 2D muestran los mismos tratamientos abarrotados y dispersos descritos anteriormente, esta vez utilizando un mutante T6SS como cepa inhibidora. No se observó que las células diana desaparecieran o se redondeen cuando se coincubaban con un mutante T6SS en condiciones de hacinamiento o dispersión, lo que sugiere nuevamente que el objetivo no se inhibió en ninguno de los tratamientos.
La Figura 3 muestra el flujo de trabajo de análisis FIJI utilizado para cuantificar la competencia en este protocolo. Se seleccionó una imagen representativa del canal de destino(Figura 3A)y se creó una máscara binaria utilizando la configuración de umbral predeterminada en FIJI(Figura 3B). La escala de la imagen se estableció adecuadamente para esta configuración de microscopía. Las partículas se analizaron utilizando el parámetro de tamaño = 0 - infinito, el parámetro de circularidad = 0.00 - 1.00, y se seleccionó Mostrar contornos (Figura 3C). Los resultados de este análisis de partículas se muestran como un contorno numerado de cada partícula(Figura 3D),y como una tabla con columnas para el número de partícula, el nombre de archivo (etiqueta) y el área de partícula en μm2 (área)(Figura 3E).
En la Figura 4,los datos obtenidos de la Figura 3E se grafican y analizan. En la Figura 4A,el porcentaje del área objetivo inicial en el punto de tiempo final se presenta para cada tratamiento de acuerdo con el paso 8.2. Si el porcentaje del área objetivo inicial es superior a 100, esto representa un aumento neto en el objetivo (es decir, el crecimiento) y se observa en condiciones en las que la población objetivo no se inhibe significativamente. Sin embargo, si el porcentaje del área objetivo inicial es inferior a 100, este resultado indica una disminución neta en el objetivo (es decir, la muerte) y se observa en condiciones en las que la población objetivo está significativamente inhibida. Cuando el objetivo fue coincubado con un inhibidor de tipo salvaje en condiciones de hacinamiento, los datos muestran una disminución neta en el área objetivo. Por el contrario, cuando el objetivo fue coincubado con un inhibidor de tipo salvaje en condiciones dispersas o un mutante T6SS en condiciones de hacinamiento o dispersión, los datos muestran un aumento neto en el área objetivo. El porcentaje del área objetivo inicial cuando el objetivo se coincubaba con un inhibidor de tipo salvaje en condiciones de hacinamiento fue inferior a 100 y significativamente más bajo que todos los demás tratamientos de acuerdo con un ANOVA unidireccional seguido de una prueba de comparaciones múltiples de Tukey en todos los tratamientos (p < 0,0001). Estos datos indican que la muerte celular objetivo depende de un T6SS funcional en el inhibidor y subraya la importancia de una configuración experimental que permita un contacto célula-célula suficiente, con el fin de detectar la muerte celular a partir de un mecanismo de muerte dependiente del contacto.
La Figura 4B presenta el porcentaje del área inicial del inhibidor en el punto de tiempo final para cada tratamiento. En este ejemplo, se observó un crecimiento neto de la cepa del inhibidor en todos los tratamientos. Sin embargo, el porcentaje del área inicial del inhibidor fue significativamente mayor cuando un inhibidor de tipo salvaje se coincuba con el objetivo en condiciones de hacinamiento en comparación con todos los demás tratamientos de acuerdo con un ANOVA unidireccional seguido de una prueba de comparaciones múltiples de Tukey en todos los tratamientos (p < 0,0001). Inicialmente, consideramos que el aumento neto en el área del inhibidor puede ser impulsado por el aumento en el espacio disponible para crecer a medida que se eliminan las células diana. Sin embargo, este mismo aumento en el crecimiento de inhibidores no se observó en los tratamientos dispersos, donde las células inhibidoras tenían espacio para crecer desde el comienzo de la coincubación. Alternativamente, este resultado podría sugerir que los nutrientes liberados de las células diana de liso permiten un mayor aumento en la población de inhibidores. Tomados en conjunto, estos resultados sugieren que la cepa inhibidora elimina el objetivo de una manera dependiente de T6SS solo cuando el alto contacto célula-célula es forzado por el hacinamiento de células en la diapositiva.
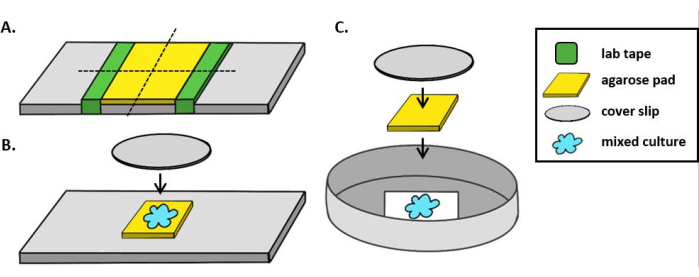
Figura 1: Preparación dela almohadilla de agarosa y configuración de diapositivas para ensayos de coincubación. (A) Configuración para hacer almohadillas de agarosa al 2%. Cinco capas de cinta de laboratorio (verde) se envuelven alrededor de un resbalón de cubierta en dos puntos separados aproximadamente por 20 mm. A continuación, la agarosa tibia al 2% en mPBS (amarillo) se pipetea entre los trozos de cinta e inmediatamente se cubre con un deslizamiento de cubiertade 25 mm 2 y se deja solidificar durante al menos 1 h a temperatura ambiente. Use una cuchilla de afeitar para cortar la almohadilla de agarosa en ~ 5 mm2 piezas y use pinzas para transferir la almohadilla a una nueva diapositiva para obtener imágenes. (B) Cuando se realicen imágenes en un microscopio vertical, coloque la almohadilla deagarosa de 5 mm 2 directamente sobre el portaobjetos, siga el cultivo mixto (azul) y un deslizamiento de cubierta circular # 1.5 de 12 mm. (C) Cuando se realicen imágenes en un microscopio invertido, detecte el cultivo mixto directamente sobre el fondo deslizante de la cubierta de vidrio # 1.5 de una placa de Petri de 35 mm, y coloque una almohadilla de agarosa en la parte superior del cultivo seguida de un segundo deslizamiento de cubierta circular de 12 mm para aplanar la almohadilla de agarosa. Haga clic aquí para ver una versión más grande de esta figura.
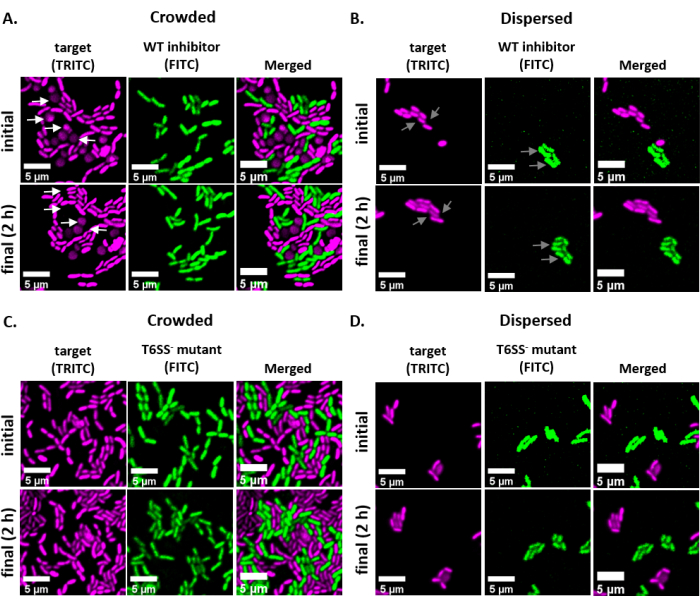
Figura 2: Imágenes de lapso de tiempo de puntos de coincubación en condiciones de hacinamiento o dispersión. (A) Imágenes representativas en puntos de tiempo iniciales y finales donde se concentró un cultivo mixto de objetivo e inhibidor de tipo salvaje 3x antes de la observación en el portaobjetos para forzar el contacto célula-célula entre cepas. Las flechas blancas en el canal TRITC indican ejemplos de células diana que se redondean o se lisan a lo largo del curso del experimento. (B) Imágenes representativas donde se detectó un cultivo mixto de inhibidor objetivo y de tipo salvaje sin concentrarse para que las células se dispersen y haya un contacto mínimo célula-célula entre cepas. Las flechas grises en los canales FITC y TRITC indican ejemplos de división celular a lo largo del curso del experimento. (C) Imágenes representativas donde el cultivo mixto de objetivo y T6SS- mutante se concentró 3 veces antes de la detección en la diapositiva para forzar el contacto célula-célula entre cepas. (D) Imágenes representativas donde se detectó un cultivo mixto de diana y T6SS- mutante sin concentrarse para que las células se dispersen y haya un contacto célula-célula mínimo entre cepas. Barras de escala = 5 μm y son consistentes en todas las imágenes; El canal TRITC es magenta de color falso, el canal FITC es de color verde falso. La deconvolución se realizó en todas las imágenes; se restó el fondo y el brillo/contraste se ajustó uniformemente en todas las imágenes. Haga clic aquí para ver una versión más grande de esta figura.
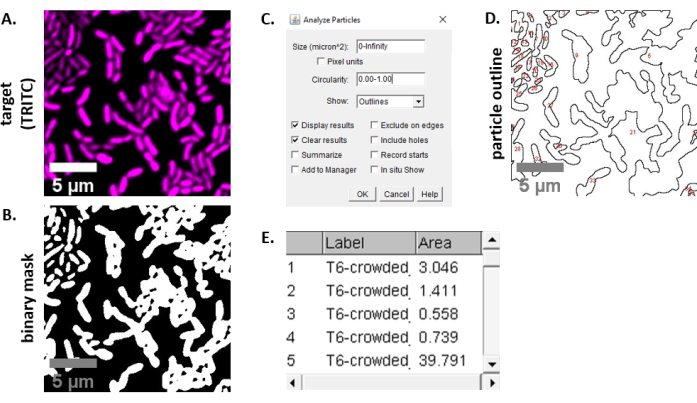
Figura 3: Flujo de trabajo de análisis FIJI. (A) Imagen representativa para el análisis. Este flujo de trabajo se repite para ambos canales en todos los campos de visión y muestras. Barras de escala = 5 μm y son consistentes en todas las imágenes; El canal TRITC es magenta de color falso, el canal FITC es de color verde falso. (B) Máscara binaria creada mediante el umbral de la imagen utilizando la configuración predeterminada en FIJI. (C) Ejemplo de ajustes para el análisis de partículas utilizados en este manuscrito. Rango de tamaño = 0 - infinito μm2; circularidad = 0.00 - 1.00; mostrar = contornos. (D) Esquema de partícula creado como resultado del análisis de partículas en (C). El contorno de la partícula en (D) debe compararse con la imagen original (A) para garantizar que todas las células fueron capturadas en el análisis de partículas. (E) Tabla de resultados creada como resultado del análisis de partículas en (C). El número de objeto (columna 1) corresponde a partículas individuales (una o más celdas) delineadas y etiquetadas en rojo en el panel (D). Etiqueta = nombre de archivo de la imagen analizada; Área = área total de partículas en μm2. Haga clic aquí para ver una versión más grande de esta figura.
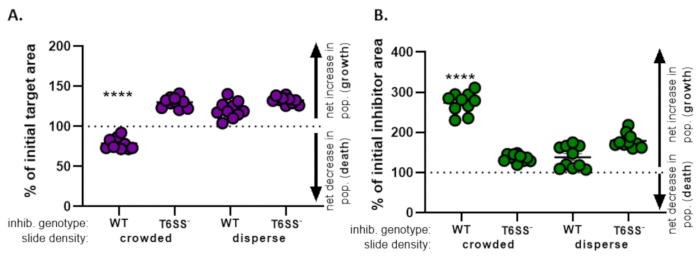
Figura 4: Datos de muestra para evaluar si se inhibe la cepa objetivo. El porcentaje de área inicial en el momento final apunta a la cepa objetivo (A) y la cepa inhibidora (B), a diferentes densidades celulares iniciales. La densidad de deslizamiento indica una densidad celular inicial que está abarrotada (alto contacto celular entre cepas) o más dispersa (bajo contacto celular entre cepas) como se describe en la Figura 2. El genotipo inhibidor indica que una cepa mutante de tipo salvaje o T6SS (T6SS-) fue coincubada con la cepa objetivo. Los asteriscos indican una diferencia significativa en el % de cambio comparando todos los tratamientos (ANOVA unidireccional seguido de una prueba de comparaciones múltiples de Tukey que compara todos los tratamientos; (p < 0,0001). La línea discontinua indica que no hay cambios netos en el área de deformación entre el punto de tiempo inicial y el final; un % de cambio > 100 indica un aumento neto (es decir, crecimiento) y un % de cambio < 100 indica una disminución neta (es decir, muerte celular). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El protocolo descrito anteriormente proporciona una poderosa herramienta para cuantificar y caracterizar la competencia interbacteriana a nivel de una sola célula. Este ensayo, que se desarrolló modificando nuestro ensayo de competencia basado en UFC en placas de agar1,2, permitió la visualización de la competencia de una sola célula entre aislados de V. fischeri y se proporcionan sugerencias para optimizar el método para una amplia gama de sistemas y configuraciones de microscopía. Aunque el método descrito aquí fue optimizado para el simbionte de órganos de luz V. fischeri,se puede modificar fácilmente para acomodar muchos microbios diversos y cultivables. Es importante tener en cuenta que los mecanismos competitivos pueden ser regulados por cualquier número de variables ambientales, incluyendo temperatura, salinidad y viscosidad30,31,32,33,34. Trabajos previos han confirmado que V. fischeri compite utilizando un Sistema de Secreción Tipo VI dependiente del contacto que está activo en superficies30,por lo que las condiciones descritas en este ensayo son adecuadas para estudiar la competencia entre las cepas de ejemplo. También es importante considerar la densidad inicial de células en la diapositiva al cuantificar la competencia bacteriana. Dado que a menudo se requiere contacto entre las células diana e inhibidoras para que ocurra la matanza, el cultivo mixto debe concentrarse de tal manera que se maximice el contacto célula-célula y las células permanezcan en un solo plano en el portaobjetos. Los cultivos celulares deben cultivarse a una densidad óptica similar (fase logarítrica media) y luego concentrarse para forzar el contacto en lugar de simplemente cultivar cultivos a una densidad óptica más alta debido a los cambios fisiológicos de las células en diferentes fases de crecimiento. En otros sistemas, es posible que sea necesario modificar las condiciones de cultivo y la configuración experimental para garantizar que el mecanismo competitivo esté activo y pueda detectarse en la condición de coincubación.
Las almohadillas de agarosa utilizadas en este ensayo proporcionan varios beneficios: proporcionan estabilización para que las células no se muevan libremente y evitan que el cultivo se seque en el transcurso del experimento. Además, si se requieren inductores químicos, como isopropil-β-D-tiogalactosido (IPTG), para el experimento, se pueden agregar fácilmente a la solución de agarosa. Sin embargo, es importante tener en cuenta que la preparación de agarosa probablemente deberá ajustarse para diferentes sistemas. En el ejemplo descrito anteriormente, la almohadilla de agarosa se preparó disolviendo agarosa al 2% (p/v) en 20 psu mPBS, que es la salinidad estándar utilizada en el medio de crecimiento V. fischeri. Además, en algunos casos puede ser necesario agregar una fuente de carbono a la almohadilla de agarosa para que las células crezcan y compitan en experimentos más largos. En tal caso, el mPBS en las almohadillas de agarosa se puede reemplazar con cualquier medio de crecimiento, aunque los nutrientes en el medio de crecimiento pueden venir con la compensación de fluorescencia de fondo adicional.
Sin un software de análisis de imágenes patentado, puede ser muy difícil obtener recuentos de células individuales cuando el contacto célula-célula es alto, lo que como mostramos aquí es necesario para observar la muerte dependiente del contacto. Este ensayo fue diseñado para proporcionar un método alternativo para la cuantificación que no se basa en recuentos de células individuales. En cambio, el área celular total para cada canal de fluorescencia se utiliza para cuantificar el grado de muerte entre cepas coincubadas. Dado que este método se basa en el área en lugar de en los recuentos de celdas individuales, la configuración de umbral predeterminada suele ser suficiente para delinear el área total de la celda. La precisión del umbral se puede verificar dividiendo el área total del objeto para un campo de visión representativo por el tamaño promedio de la célula para el organismo modelo y comparando este número de células estimado con un recuento manual de células para la misma imagen.
En coincubaciones entre un inhibidor y una cepa diana (no asesina), se predice el crecimiento neto del inhibidor. Como se ve en la Figura 4,el crecimiento del inhibidor puede ser significativamente mayor en los tratamientos donde se observa la muerte, en comparación con los tratamientos donde no se observa la muerte, tal vez porque los nutrientes liberados por el lisado de las células diana permiten que la cepa del inhibidor crezca más rápidamente. En el ejemplo que se muestra aquí, se observa la muerte neta del objetivo porque la competencia mediada por T6SS da como resultado la lisis de las células diana donde el objetivo se elimina físicamente. Sin embargo, es importante tener en cuenta que no todos los mecanismos competitivos resultan en la eliminación física de las células diana. Si un objetivo está incapacitado por una toxina que causa inhibición del crecimiento, el protocolo descrito aquí puede dar lugar a que la población objetivo visible permanezca estable a lo largo del tiempo a medida que las células diana ya no crecen, pero tampoco se lisan. En tal caso, sería apropiado comparar los resultados de este ensayo con pruebas de seguimiento de viabilidad de células diana, como el recubrimiento para unidades formadoras de colonias (FCU) o mediante la realización de ensayos de muertos vivos mediante tinción con yoduro de propidio o verde SYTOX35,36.
En comparación con los ensayos de coincubación que se basan en recuentos de UFC, este ensayo permite observar y cuantificar la estructura espacial de la competencia entre cepas y rastrear los cambios en la morfología de las células diana a lo largo del tiempo. Por ejemplo, se sabe que las células inhibidoras que matan usando un T6SS codifican proteínas del dominio LysM que degradan la pared celular objetivo, lo que resulta en el redondeo celular inicial y luegola lisis 13,que observamos en el ejemplo que se muestra en la Figura 2A. Además, este protocolo se puede utilizar para rastrear la competencia en alta resolución en escalas de tiempo muy cortas. En el ejemplo que se muestra aquí, se observa una disminución significativa en el área objetivo después de solo dos horas cuando las células están abarrotadas y el contacto célula-célula es forzado entre cepas(Figura 4). El análisis de imágenes aquí descrito también podría realizarse mediante microscopía confocal, lo que permitiría estudiar la competencia bacteriana in vivo o en biofilms complejos, sin interrumpir la distribución espacial de cepas coincubadas.
En resumen, el ensayo descrito aquí tiene como objetivo proporcionar un enfoque accesible y fácilmente modificado para visualizar y cuantificar la competencia bacteriana a nivel de una sola célula utilizando microscopía de fluorescencia. Este método se puede aplicar a diversos aislamientos bacterianos y se puede utilizar para visualizar la competencia bacteriana incluso en entornos complejos, como dentro de un huésped o una matriz de biopelícula.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
A.N.S fue apoyado por la subvención R35 GM137886 de NIGMS y S.N.S fue apoyado por el Programa de Becas para Graduados en Ciencias e Ingeniería de Defensa Nacional.
Materiales
| Name | Company | Catalog Number | Comments |
| 1.5 mL Microcentrifuge tube | Fisher | 05-408-129 | |
| 10 uL single channel pipette | |||
| 1000 uL single channel pipette | |||
| 20 uL single channel pipette | |||
| 200 uL single channel pipette | |||
| Agarose | Fisher | BP165-25 | Low melting agarose |
| Calculator | |||
| Cellvis 35 mm Dish | Fisher | NC0409658 | #1.5 cover glass bottom |
| Chloramphenicol | Sigma | C0378 | stock (20 mg/mL in Ethanol); final concentration in media (2 μg /mL LBS) |
| DAPI Nucleic Acid Stain | Fisher | EN62248 | optional (if not using stable plasmids) |
| FIJI image analysis sofware | ImageJ | https://imagej.net/Fiji/Downloads | open-source software |
| Fisherbrand Cover Glasses: Circles | Fisher | 12-545-81P | #1.5 cover glass; 12 mm diameter |
| Kanamycin Sulfate | Fisher | BP906-5 | stock (100 mg/mL in water, filter sterilize); final concentration in media (1 μg/mL LBS) |
| Lens Cleaning Tissue Paper | Fisher | S24530 | |
| Parafilm | Fisher | 13-374-12 | |
| Petri Plates | Fisher | FB0875713 | sterile with lid |
| Razor Blades | Fisher | S65921 | |
| Semi-micro Cuvettes | VWR | 97000-586 | |
| Spectrophotometer | |||
| SYBR Green Nucleic Acid Stain | Fisher | S7563 | optional (if not using stable plasmids) |
| Thermo Scientific Gold Seal Plain Microscope Slides | Fisher | 12-518-100B | |
| Thermo Scientific Richard-Allan Scientific Cover Glass | Fisher | 22-050-235 | #1.5 cover glass, 25 mm2 |
| Type F Immersion Oil | Fisher | NC0297589 | |
| Upright or inverted fluorescence microscope with camera and imaging software | Images in this article were acquired on a Nikon TI-2 inverted fluorescent microscope outfitted with an ORCA-Fusion Digital CMOS camera using NIS-Elements software. | ||
| Vortex | |||
| Water bath | Used to keep agarose warm prior to pipetting | ||
| LBS media | |||
| 1M Tris Buffer (pH ~7.5) | 50 mL 1 M stock buffer (62 mL HCl, 938 mL DI water, 121 g Trizma Base) | ||
| Agar Technical | Fisher | DF0812-17-9 | 15 g (Add only for plates) |
| DI water | 950 mL | ||
| Sodium Chloride | Fisher | S640-3 | 20 g |
| Tryptone | Fisher | BP97265 | 10 g |
| Yeast Extract | Fisher | BP9727-2 | 5 g |
| mPBS (marine PBS) | Phosphate buffered saline with marine salts added; used for making agarose pad | ||
| 10X PBS | Fisher | ICN1960454 | |
| Instant Ocean Sea Salt | Instant Ocean | SS1-160P | Adjust concentration to appropriate salinity; 20 psu used here |
| Sterile Vacuum Filter Units | Fisher | SCGVU01RE | Used to filter-sterilize mPBS |
| Vacuum pump | Used to filter-sterilize mPBS |
Referencias
- Speare, L., et al. Bacterial symbionts use a type VI secretion system to eliminate competitors in their natural host. Proceedings of the National Academy of Sciences. 115 (36), 8528-8537 (2018).
- Speare, L., Septer, A. N. Coincubation assay for quantifying competitive interactions between Vibrio fischeri isolates. Journal of Visualized Experiments. (149), e59759 (2019).
- Frost, I., et al. Cooperation, competition and antibiotic resistance in bacterial colonies. The ISME journal. 12 (6), 1582-1593 (2018).
- Stubbendieck, R. M., Vargas-Bautista, C., Straight, P. D. Bacterial communities: interactions to scale. Frontiers in Microbiology. 7, 1234 (2016).
- Souza, D. P., et al. Bacterial killing via a type IV secretion system. Nature Communications. 6 (1), 1-9 (2015).
- Anderson, M. C., Vonaesch, P., Saffarian, A., Marteyn, B. S., Sansonetti, P. J. Shigella sonnei encodes a functional T6SS used for interbacterial competition and niche occupancy. Cell Host and Microbe. 21 (6), 769-776 (2017).
- Basler, M., Ho, B., Mekalanos, J. Tit-for-tat: Type VI secretion system counterattack during bacterial cell-cell interactions. Cell. 152 (4), 884-894 (2013).
- Guillemette, R., Ushijima, B., Jalan, M., Häse, C. C., Azam, F. Insight into the resilience and susceptibility of marine bacteria to T6SS attack by Vibrio cholerae and Vibrio coralliilyticus. PloS One. 15 (1), 0227864 (2020).
- Hachani, A., Lossi, N. S., Filloux, A. A visual assay to monitor T6SS-mediated bacterial competition. Journal of Visualized Experiments. (73), e50103 (2013).
- Hibbing, M. E., Fuqua, C., Parsek, M. R., Peterson, S. B. Bacterial competition: surviving and thriving in the microbial jungle. Nature Reviews Microbiology. 8 (1), 15-25 (2010).
- Ruhe, Z. C., Low, D. A., Hayes, C. S. Bacterial contact-dependent growth inhibition. Trends in Microbiology. 21 (5), 230-237 (2013).
- Wood, D. W., Pierson, L. S. The phzI gene of Pseudomonas aureofaciens 30-84 is responsible for the production of a diffusible signal required for phenazine antibiotic production. Gene. 168 (1), 49-53 (1996).
- Smith, W. P., et al. The evolution of the type VI secretion system as a disintegration weapon. PLoS Biology. 18 (5), 3000720 (2020).
- Chen, L., Zou, Y., She, P., Wu, Y. Composition, function, and regulation of T6SS in Pseudomonas aeruginosa. Microbiological Research. 172, 19-25 (2015).
- Sana, T. G., Lugo, K. A., Monack, D. M. T6SS: The bacterial "fight club" in the host gut. PLoS Pathogens. 13 (6), 1006325 (2017).
- Basler, M. Type VI secretion system: secretion by a contractile nanomachine. Philosophical Transactions of the Royal Society B: Biological Sciences. 370 (1679), 20150021 (2015).
- Joshi, A., et al. Rules of engagement: the type VI secretion system in Vibrio cholerae. Trends in Microbiology. 25 (4), 267-279 (2017).
- Nadell, C. D., Drescher, K., Foster, K. R. Spatial structure, cooperation and competition in biofilms. Nature Reviews Microbiology. 14 (9), 589-600 (2016).
- Stubbendieck, R. M., Straight, P. D. Multifaceted interfaces of bacterial competition. Journal of Bacteriology. 198 (16), 2145-2155 (2016).
- Septer, A. N. The Vibrio-squid symbiosis as a model for studying interbacterial competition. Msystems. 4 (3), (2019).
- Tischler, A. H., Hodge-Hanson, K. M., Visick, K. L. Vibrio fischeri-squid symbiosis. eLS. , 1-9 (2019).
- Mandel, M. J., Dunn, A. K. Impact and influence of the natural Vibrio-squid symbiosis in understanding bacterial-animal interactions. Frontiers in Microbiology. 7, 1982 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Boettcher, K., Ruby, E. Depressed light emission by symbiotic Vibrio fischeri of the sepiolid squid Euprymna Scolopes. Journal of Bacteriology. 172 (7), 3701-3706 (1990).
- Doino, J. A., McFall-Ngai, M. J. A transient exposure to symbiosis-competent bacteria induces light organ morphogenesis in the host squid. The Biological Bulletin. 189 (3), 347-355 (1995).
- Dunn, A. K., Millikan, D. S., Adin, D. M., Bose, J. L., Stabb, E. V. New rfp-and pES213-derived tools for analyzing symbiotic Vibrio fischeri reveal patterns of infection and lux expression in situ. Applied and Environmental Microbiology. 72 (1), 802-810 (2006).
- Lambertsen, L., Sternberg, C., Molin, S. Mini-Tn7 transposons for site-specific tagging of bacteria with fluorescent proteins. Environmental Microbiology. 6 (7), 726-732 (2004).
- Koch, B., Jensen, L. E., Nybroe, O. A panel of Tn7-based vectors for insertion of the gfp marker gene or for delivery of cloned DNA into Gram-negative bacteria at a neutral chromosomal site. Journal of Microbiological Methods. 45 (3), 187-195 (2001).
- Peterson, B. W., Sharma, P. K., Van Der Mei, H. C., Busscher, H. J. Bacterial cell surface damage due to centrifugal compaction. Applied and Environmental Microbiology. 78 (1), 120-125 (2012).
- Speare, L., Smith, S., Salvato, F., Kleiner, M., Septer, A. N. Environmental viscosity modulates interbacterial killing during habitat transition. MBio. 11 (1), (2020).
- Salomon, D., Gonzalez, H., Updegraff, B. L., Orth, K. Vibrio parahaemolyticus type VI secretion system 1 is activated in marine conditions to target bacteria, and is differentially regulated from system 2. PloS One. 8 (4), 61086 (2013).
- Sana, T. G., et al. Salmonella Typhimurium utilizes a T6SS-mediated antibacterial weapon to establish in the host gut. Proceedings of the National Academy of Sciences. 113 (34), 5044-5051 (2016).
- Bachmann, V., et al. Bile salts modulate the mucin-activated type VI secretion system of pandemic Vibrio cholerae. PLoS Neglected Tropical Diseases. 9 (8), 0004031 (2015).
- Ishikawa, T., et al. Pathoadaptive conditional regulation of the type VI secretion system in Vibrio cholerae O1 strains. Infection and Immunity. 80 (2), 575-584 (2012).
- Johnson, M. B., Criss, A. K. Fluorescence microscopy methods for determining the viability of bacteria in association with mammalian cells. Journal of Visualized Experiments. (79), e50729 (2013).
- Stiefel, P., Schmidt-Emrich, S., Maniura-Weber, K., Ren, Q. Critical aspects of using bacterial cell viability assays with the fluorophores SYTO9 and propidium iodide. BMC Microbiology. 15 (1), 36 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados