Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Medición de la evolución temporal de materiales a nanoescala con flujo detenido y dispersión de neutrones de ángulo pequeño
En este artículo
Resumen
Este protocolo presenta el uso de un entorno de muestra de flujo detenido para mezclar rápidamente múltiples soluciones líquidas in situ durante una medición de dispersión de neutrones de ángulo pequeño y para estudiar procesos cinéticos en escalas de longitud nanométrica y escalas de segundo tiempo.
Resumen
Este documento presenta el uso de un entorno de muestra de dispersión de neutrones de ángulo pequeño (SANS) de flujo detenido para mezclar rápidamente muestras líquidas y estudiar procesos cinéticos a nanoescala en escalas de tiempo de segundos a minutos. El entorno de muestra de flujo detenido utiliza bombas de jeringa disponibles comercialmente para mezclar los volúmenes deseados de muestras líquidas que luego se inyectan a través de un mezclador dinámico en una celda de vidrio de cuarzo en aproximadamente 1 s. La adquisición de datos SANS con resolución temporal se sincroniza con la mezcla de muestras para seguir la evolución de la nanoestructura en solución después de la mezcla.
Para hacer el uso más eficiente del tiempo de haz de neutrones, utilizamos una serie de válvulas selectoras de flujo para cargar, enjuagar y secar automáticamente la celda entre mediciones, lo que permite la recopilación repetida de datos a través de múltiples inyecciones de muestras. Las inyecciones de muestras se repiten hasta que se recopilan suficientes estadísticas de dispersión de neutrones. La configuración de mezcla se puede programar para variar sistemáticamente las condiciones para medir la cinética en diferentes proporciones de mezcla, concentraciones de muestra, concentraciones de aditivos y temperaturas. El volumen mínimo de muestra requerido por inyección es de aproximadamente 150 μL, dependiendo de la longitud de la trayectoria de la celda de cuarzo.
Se presentan resultados representativos utilizando este entorno de muestra de flujo detenido para una cinética rápida de intercambio lipídico en presencia de un aditivo, ciclodextrina. Las vesículas intercambian lípidos externos (exteriores) en el orden de segundos e intercambian completamente los lípidos interiores y exteriores en cuestión de horas. La medición de la cinética de intercambio lipídico requiere una mezcla in situ para capturar los procesos más rápidos (segundos) y más lentos (minutos) y extraer las constantes de velocidad cinética. El mismo entorno de muestra también se puede utilizar para sondear el intercambio molecular en otros tipos de muestras líquidas como nanopartículas lipídicas, proteínas, surfactantes, polímeros, emulsiones o nanopartículas inorgánicas. La medición de las transformaciones estructurales a nanoescala y la cinética de los sistemas de intercambio o reacción proporcionará nuevos conocimientos sobre los procesos que evolucionan a nanoescala.
Introducción
La dispersión de neutrones de ángulo pequeño (SANS) proporciona una forma única de medir los tamaños, formas, interacciones y organización de varios materiales en escalas de longitud de ≈1 nm a ≈100 nm 1,2,3. Los instrumentos recientes, incluidos los instrumentos VSANS (dispersión de neutrones de ángulo muy pequeño) con espejos de enfoque, empujan los límites hacia la medición de escalas de longitud aún mayores hasta ≈1000 nm 4,5. En general, el contraste de dispersión único inherente a los métodos de dispersión de neutrones ofrece varias ventajas en la medición de la evolución temporal de estructuras a nanoescala, como la agregación de componentes en formulaciones farmacéuticas6, reacciones de reticulación y gelificación en sistemas poliméricos 7,8, en mesocristalización de proteínas de membrana9,10, degradación y despliegue de proteínas11,12 , y crecimiento de materiales a base de sílice13,14,15. El contraste de dispersión único hace que el SANS (TR-SANS) resuelto en el tiempo sea un complemento útil para otras mediciones basadas en flujo detenido.
Los métodos de mezcla de flujo detenido a menudo se implementan en la dispersión de rayos X de ángulo pequeño (SAXS)16,17,18,19,20,21, espectroscopia de fluorescencia 22,23,24,25,26 y dispersión de luz27,28,29,30, 31,32 experimentos para estudiar procesos cinéticos en escalas de tiempo de milisegundos. Una diferencia importante entre SANS y SAXS es que la dispersión de neutrones es una técnica de caracterización no destructiva, y como tal, SANS se puede utilizar para medir la misma muestra durante horas o incluso días sin daño por radiación ionizante a la muestra, lo que puede ocurrir durante experimentos de dispersión de rayos X de mayor flujo33. Como las mediciones repetidas de SANS no alterarán la estructura química de la molécula o muestra de la sonda, la evolución del tiempo puede estudiarse sin efectos de fotoblanqueo, por ejemplo, lo que puede complicar las mediciones cinéticas que dependen de la fluorescencia23,24. Además, SANS se puede utilizar para medir muestras altamente concentradas y ópticamente opacas que a menudo son difíciles de caracterizar con técnicas basadas en la luz, como la dispersión dinámica de la luz.
Además de proporcionar información estructural en la nanoescala, SANS se puede utilizar para sondear la composición local de estas estructuras a través de la variación en el contraste de densidad de longitud de dispersión de neutrones. La densidad de longitud de dispersión (SLD) de diferentes elementos varía aleatoriamente a través de la tabla periódica y varía con diferentes isótopos del mismo elemento. Un ejemplo comúnmente explotado es el hidrógeno (1H o H) y el deuterio (2H o D), que tienen longitudes de dispersión de neutrones muy diferentes. Por lo tanto, los materiales ricos en hidrógeno, como surfactantes, lípidos, proteínas, ARN, ADN y otros polímeros, se pueden distinguir de los disolventes deuterados que utilizan SANS sin cambiar significativamente las propiedades físicas del sistema. Sin embargo, es importante tener en cuenta que el intercambio H/D puede afectar la densidad, el enlace de hidrógeno y las temperaturas de transición de fase en la muestra. Sin embargo, la sensibilidad única de SANS a los materiales ricos en hidrógeno es especialmente útil en la investigación de materia blanda donde las muestras de interés tienen un menor contraste de dispersión y señal en técnicas basadas en rayos X como SAXS. La sustitución isotópica también hace que SANS sea una herramienta poderosa para estudiar la cinética de intercambio molecular en materiales ricos en hidrógeno simplemente mezclando moléculas marcadas con H y D. La sustitución isotópica es particularmente útil en sistemas donde los colorantes fluorescentes voluminosos son más grandes que las moléculas de surfactante o lípidos de interés y pueden influir en la cinética de intercambio34,35.
Las mediciones SANS resueltas en el tiempo son ventajosas porque la intensidad medida es una función del tiempo, la escala de longitud y el contraste SLD. Como tal, los experimentos TR-SANS pueden diseñarse para sondear los cambios dependientes del tiempo en las distribuciones espaciales y las composiciones de las muestras. Estas ventajas únicas de SANS han llevado a importantes conocimientos sobre los procesos cinéticos en muchos sistemas de materiales blandos, como tensioactivos 36,37,38, emulsiones 39,40,41, lípidos 34,42,43,44,45,46,47,48,49 ,50, y polímeros 51,52,53,54,55,56,57,58,59,60,61,62. La mayoría de los estudios TR-SANS se han centrado en escalas de tiempo de minutos a horas. Sin embargo, muchos procesos cinéticos de interés ocurren en la segunda escala de tiempo y son esenciales para comprender los mecanismos subyacentes. La captura de estos primeros puntos de tiempo requiere que las soluciones se mezclen rápidamente y se midan in situ, en las que la mezcla se sincroniza con la recopilación de datos durante la dispersión de luz de flujo detenido 27,28,29,30,31,32, fluorescencia 22,23,24,25,26 y rayos X 16,17,18,19,20,21 experimentos. Este trabajo describe el uso de un entorno de muestra diseñado para mezclar rápidamente múltiples muestras líquidas e inyectar la mezcla en una celda de vidrio de cuarzo para mediciones TR-SANS. El dispositivo de mezcla es una adaptación del dispositivo capilar rheoSANS63 recientemente desarrollado y utiliza múltiples bombas de jeringa y válvulas para controlar la mezcla de muestras y automatizar la limpieza celular. Al conectar las bombas de jeringa a una serie de válvulas selectoras de flujo, se pueden mezclar, medir, enjuagar y secar repetidamente múltiples flujos de entrada para facilitar las mediciones de TR-SANS en la escala de tiempo de segundos.
El procedimiento actual supone que las muestras de interés han sido identificadas y preparadas. Nos centramos en la configuración de mezcla in situ y los métodos para recopilar datos TR-SANS. Los datos de dispersión de neutrones se recopilaron en el instrumento VSANS en el Centro de Investigación de Neutrones (NCNR) del NIST; sin embargo, el procedimiento debe ser aplicable a otros instrumentos SANS. Los lectores interesados en implementar protocolos similares en otros instrumentos SANS deben consultar con los científicos locales del instrumento para determinar la configuración óptima del instrumento para maximizar el flujo de neutrones en la escala de longitud deseada y la escala de tiempo más relevante para los procesos cinéticos de interés. Los datos presentados aquí se recopilaron utilizando la configuración de "haz blanco" de alto flujo en VSANS para maximizar el recuento de neutrones en la pérdida de resolución espacial5. Los carros detectores se colocaron para cubrir un rango de vectores de dispersión (q), 0.005 Å-1 < q < 0.5 Å-1, correspondientes a escalas de longitud de ≈130 nm a ≈13 nm. El vector de dispersión se define como q = 4π/λ sin (θ/2) en el que λ es la longitud de onda del neutrón y θ es el ángulo de dispersión.
El dispositivo de mezcla de flujo detenido utilizado para las mediciones de TR-SANS consta de múltiples bombas, jeringas de enjuague, jeringas de muestra, selectores de flujo, así como un mezclador dinámico, celda de muestra y recipiente de muestra mixta, como se muestra en la Figura 1. Todas las rutas de fluidos sellados están ubicadas dentro de un recinto con aire acondicionado, que incluye las jeringas, válvulas, tubos de conexión, mezclador dinámico y celdas de muestra. Se utiliza un acondicionador de aire termoeléctrico programable para controlar la temperatura de la carcasa en el rango de 10 °C a 50 °C dentro de ±1 °C. Tenga en cuenta que parte del aislamiento de la carcasa se eliminó para mostrar las partes de trabajo del dispositivo. El gabinete del dispositivo de mezcla principal se coloca en una etapa de traslación en la línea de haz NG3 VSANS en el NCNR. La posición de la carcasa se ajusta utilizando la etapa de traslación para colocar la celda de muestra en la trayectoria del haz de neutrones (línea discontinua amarilla).

Figura 1: Un ejemplo de configuración para combinar la mezcla de flujo detenido y las mediciones de dispersión de neutrones de ángulo pequeño en la línea de luz VSANS en el Centro de Investigación de Neutrones del NIST. La configuración contiene cuatro bombas de jeringa, dos jeringas para enjuague con disolvente y dos jeringas para inyección de muestras, cuatro válvulas selectoras de bombas, dos válvulas selectoras mezcladoras, un mezclador dinámico, una celda de cuarzo de flujo continuo y un recipiente de muestra mixta. Los neutrones incidentes se dispersan de la muestra mezclada ubicada dentro de la celda de muestra. Se utiliza un recinto aislado con ventanas de cuarzo y una unidad termoeléctrica con aire acondicionado para controlar la muestra y todos los equipos a una temperatura constante. La línea discontinua amarilla muestra la trayectoria del haz de neutrones. Barra de escala = 10 cm. Haga clic aquí para ver una versión más grande de esta figura.
El dispositivo representado en la Figura 1 se configura con dos jeringas de muestra, dos jeringas de enjuague y una celda de muestra. Los diagramas de flujo correspondientes para los diferentes pasos del protocolo se ilustran en la Figura 2. Los volúmenes deseados de las dos muestras diferentes se inyectan en el mezclador y en la celda de muestra (Figura 2A). Una vez que se llena la celda de muestra, la válvula de interruptor de entrada (ISV) y la válvula de interruptor de salida (OSV) se cierran para aislar la celda de muestra del mezclador dinámico y evitar la difusión posterior de la muestra en la celda durante la recopilación de datos TR-SANS (Figura 2B). Antes del mezclador dinámico, el tubo de conexión varía en longitud de 10 cm a 1 m y no afecta el tiempo de retardo de mezcla. Sin embargo, las conexiones de tubería entre el mezclador dinámico y la celda de muestra afectarán el tiempo de retardo de mezcla y el volumen de inyección de muestra requerido. Los tubos de acero inoxidable precortados con 0,04 pulgadas (1 mm) de diámetro interior y 100 mm de longitud se utilizan para conectar el mezclador dinámico, las válvulas selectoras del mezclador (MSV1 y MSV2), y el ISV y OSV. El tubo fluorado con 1 mm de diámetro interior y 115 mm de longitud se utiliza para conectar el ISV y el OSV (o la salida del mezclador dinámico) a la celda de muestra. El volumen vacío total que influye en el tiempo de retardo de mezcla incluye el volumen vacío del mezclador (0,15 ml), el tubo entre la salida del mezclador y la entrada de la celda de muestra (0,09 ml) y el volumen de la celda de muestra (0,16 ml). En este ejemplo, el volumen total de vacío es de 0,4 ml. Los volúmenes de vacío interno de las válvulas son insignificantes en comparación con los volúmenes de vacío de tubos, mezcladores y celdas de muestra. Por ejemplo, las válvulas selectoras de baja presión empleadas (diámetro interior de 0,75 mm) contienen volúmenes vacíos aproximados de 4 μL, mientras que las válvulas selectoras de alta presión y las válvulas de conmutación (diámetro interior de 0,25 mm) contienen volúmenes vacíos aproximados de 0,5 μL.
Una vez completada la medición TR-SANS, la muestra se empuja fuera de la celda con disolvente, y el disolvente de enjuague se bombea repetidamente a través de la celda para extraer la muestra residual y limpiar la celda de muestra (Figura 2C). Tenga en cuenta que las jeringas de enjuague están conectadas a depósitos de disolventes más grandes (por ejemplo, agua y etanol) a través de valores de selector de bomba para garantizar que se disponga de volúmenes de disolvente adecuados para limpiar la celda de muestra entre series de medición. Las fuentes de solventes, las fuentes de muestras y los recipientes de muestras mixtas que contienen líquidos inflamables se colocan en un recinto separado sin equipo eléctrico para eliminar todas las fuentes de ignición posibles. Además, las tapas de botellas con bloqueo de vapor se utilizan para minimizar los vapores inflamables y la evaporación del solvente. Finalmente, la celda de muestra se seca con una corriente de gas nitrógeno para eliminar el disolvente de enjuague residual (Figura 2D). La presión de entrada de gas nitrógeno a la válvula selectora del mezclador se regula a aproximadamente 2 bar (0,2 MPa, presión manométrica) utilizando un regulador de presión manual ubicado en el cilindro de gas nitrógeno. Una vez que la celda de muestra está suficientemente limpia y seca, se inyecta una muestra recién mezclada en la celda de muestra para el siguiente ciclo de medición (repitiendo la mezcla e inyección ilustradas en el diagrama de flujo en la Figura 2A).
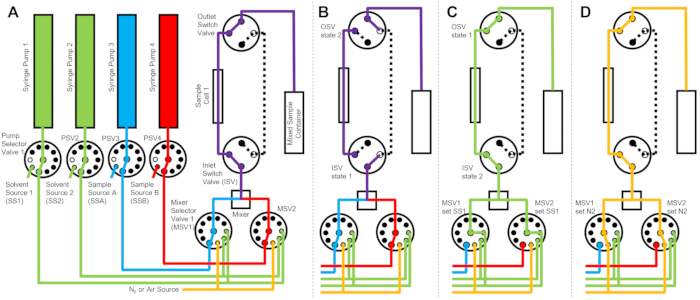
Figura 2: Ejemplo de diagrama de flujo utilizando una celda de muestra, dos muestras mezclando y dos solventes de enjuague para limpieza . (A) Mezcla de la muestra A (azul) y la muestra B (roja), y luego fluye la muestra mezclada (púrpura) en la celda de muestra. (B) Durante la recopilación de datos, el estado del dispositivo de flujo detenido donde las válvulas de conmutación ISV y OSV están cerradas para aislar la celda de muestra y evitar la difusión posterior de la muestra durante la recopilación de datos. (C) Los pasos de limpieza donde la celda de muestra se enjuaga con disolvente de enjuague de SS1 (verde) después de la recopilación de datos. (D) Etapa de secado donde la celda de muestra se seca con gas nitrógeno (naranja). Abreviaturas: PSV = válvula selectora de bomba; MSV = válvula selectora del mezclador; OSV = válvula de interruptor de salida; ISV = válvula de interruptor de entrada; SS1 = fuente de disolvente 1; SSA = fuente de muestra A; N2 = fuente de gas nitrógeno. Haga clic aquí para ver una versión más grande de esta figura.
La Figura 3 muestra diagramas de flujo para una versión ligeramente diferente en la que la configuración de mezcla se configura con dos celdas de muestra separadas conectadas a las mismas válvulas de conmutación (Figura 3A). Mientras que los datos de TR-SANS se recopilan en la celda de muestra 1, la celda de muestra 2 se enjuaga (Figura 3B) y se seca (Figura 3C). Cuando se completa la recopilación de datos para la celda de muestra 1, la válvula de interruptor de entrada dirige una muestra recién mezclada a la celda de muestra 2 para la recopilación de datos (Figura 3D). Mientras que los datos de TR-SANS se recopilan en la celda de muestra 2, la celda de muestra 1 se enjuaga y se seca (Figura 3E). Este proceso paralelo y alterno entre dos celdas de muestra minimiza el tiempo entre las inyecciones de muestra posteriores y maximiza el uso del tiempo de haz de neutrones.
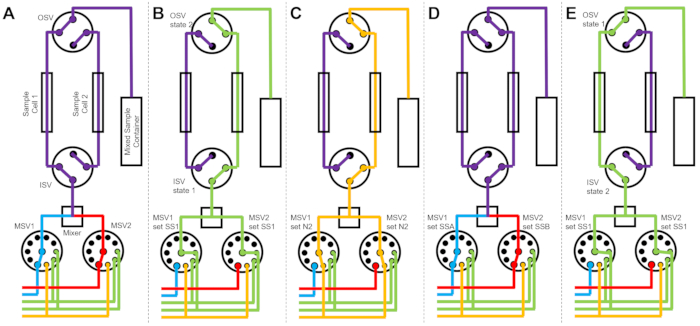
Figura 3: Ejemplo de diagrama de flujo utilizando dos celdas de muestra, dos muestras de mezcla y dos solventes de enjuague para la limpieza. (A) Mezclar la muestra A (azul) y la muestra B (roja) y luego hacer fluir la muestra mezclada (púrpura) en la celda de muestra 1. (B) El estado del dispositivo de flujo detenido durante la recopilación de datos en la celda de muestra 1 mientras la celda de muestra 2 se enjuaga con disolvente de SS1 (verde). (C) El estado del dispositivo de flujo detenido durante la recopilación de datos en la celda de muestra 1 mientras la celda de muestra 2 se seca con gas nitrógeno (naranja). (D) Una vez que se completa la recolección de datos de la celda de muestra 1, una nueva muestra (púrpura) se mezcla inmediatamente y fluye hacia la celda de muestra 2. (E) El estado del dispositivo de flujo detenido durante la recopilación de datos en la celda de muestra 2 mientras la celda de muestra 1 se enjuaga con disolvente de SS1 (verde). Mientras se mide una celda de muestra, la otra celda de muestra se limpia y se seca. El proceso de medición de flujo detenido alterna entre dos celdas de muestra para minimizar el tiempo entre las inyecciones posteriores de mezcla de muestras. Abreviaturas: PSV = válvula selectora de bomba; MSV = válvula selectora del mezclador; OSV = válvula de interruptor de salida; ISV = válvula de interruptor de entrada; SS1 = fuente de disolvente 1; SSA = fuente de muestra A; N2 = fuente de gas nitrógeno. Haga clic aquí para ver una versión más grande de esta figura.
A continuación se describe un protocolo paso a paso para conectar las bombas y las líneas de tubería, cebar el sistema, enjuagar y secar la celda de muestra e inyectar la muestra mezclada. Aunque la configuración de una sola celda se demuestra por simplicidad (Figura 2), la configuración modular flexible, el protocolo y los scripts se pueden modificar fácilmente para implementar más bombas de jeringa, válvulas, mezcladores o configuraciones de celdas de muestra, como la configuración de celda de dos muestras que se muestra en la Figura 3. Los datos representativos de la tasa de recuento de neutrones brutos recopilados a lo largo de los ciclos de inyección de mezcla y limpieza se muestran en la Figura 4, mientras que la cinética de intercambio lipídico medida a 3 temperaturas diferentes y la intensidad dispersa normalizada extraída correspondiente a la fracción de lípidos intercambiados se muestran en la Figura 5 y la Figura 6, respectivamente.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Configure e inicie el sistema de flujo detenido.
- Encienda todas las fuentes de alimentación de la bomba y mezcladores dinámicos con el interruptor de encendido.
- Inicie todas las bombas y válvulas en la interfaz gráfica de usuario (GUI) de control del sistema de flujo detenido introduciendo la ruta de configuración del dispositivo y utilizando los comandos bus=qmixbus. Bus(), bus.open(), bus.start(), pump=qmixpump. Pump(), pump.enable(), y valve=ViciMultiposSelector() (véase el ejemplo de código de iniciación disponible en un repositorio de código abiertoen línea 64).
- Calibre las bombas antes de colocar las jeringas con el comando pump.calibrate().
- Confirme que las válvulas están iniciadas y muévase al puerto selector correcto en el comando usando el comando valve.setPort() y valve.getPort().
- Asigne el tipo de jeringa que se utilizará para cada bomba utilizando el comando pump.set_syringe_param(A, B), en el que A es el diámetro interior del cilindro de la jeringa (mm) y B es la distancia máxima de carrera del pistón de la jeringa (mm).
- Conecte las jeringas de muestra a las bombas de jeringa.
- Después de asegurarse de que las bombas han sido calibradas, atornille los barriles de jeringa limpios a la conexión en la parte superior de la bomba (cabezal de montaje de jeringa).
- Cuando utilice jeringas de vidrio, asegúrese de que el cabezal de montaje de la jeringa esté aflojado antes de dispensar el volumen de llenado, de modo que la jeringa de vidrio no se rompa debido a la fuerza excesiva del pistón de la jeringa.
- Atornille el pistón de la jeringa a la conexión en la parte inferior de la bomba (cola de montaje en jeringa).
- Después de conectar el cilindro de la jeringa y el pistón de la jeringa a la bomba, dispense el volumen de llenado del tipo de jeringa utilizando la bomba de comando.empty(), que mueve el pistón de la jeringa a la parte superior del cilindro de la jeringa.
- Cuando utilice jeringas de vidrio, apriete el cabezal de montaje de la jeringa después de que se detenga el movimiento del pistón.
- Conecte el tubo a las fuentes de muestras y solventes, jeringas, válvulas, mezcladores, celdas de muestra y recipiente de muestras mixtas.
- Conecte el tubo de la bomba de jeringa a las válvulas selectoras de la bomba.
- Conecte el tubo de la válvula selectora de la bomba a las fuentes de muestra.
- Conecte el tubo de la válvula selectora de la bomba a las fuentes de disolvente de enjuague.
- Conecte el tubo de la válvula selectora de la bomba al tubo de la válvula selectora del mezclador.
- Conecte el tubo de la válvula selectora del mezclador a la fuente de gas nitrógeno.
- Conecte el tubo de la válvula selectora del mezclador a las entradas del mezclador.
- Conecte la salida del mezclador a la válvula del interruptor de entrada.
- Conecte la válvula del interruptor de entrada a la entrada de la celda de muestra.
- Conecte la salida de la celda de muestra a la válvula del interruptor de salida.
- Conecte la válvula del interruptor de salida al recipiente de muestras mixtas.
- Defina todas las conexiones de tuberías y válvulas realizadas (Paso 1.7) en la GUI de control del sistema de flujo detenido escribiendo las conexiones correspondientes del número de puerto realizadas a cada válvula (consulte el código de control de ejemplo en el repositorio de código abiertoen línea 64).
- Calcule el volumen vacío del tubo entre la entrada del mezclador y la salida de la celda de muestra, que define la cantidad mínima de muestra necesaria para llenar la celda de muestra para cada medición.
2. Cargue la muestra.
- Defina el volumen de llenado de muestra y el volumen de llenado de disolvente deseados en la GUI de control del sistema de flujo detenido escribiendo los números deseados (consulte el código de control de ejemplo en el repositorio de código abiertoen línea 64).
- Utilice el comando pump.aspirate () para extraer (aspirar) la muestra deseada y los volúmenes de disolvente de sus fuentes a las jeringas de muestra a través de las válvulas selectoras de la bomba.
NOTA: Al cargar por primera vez una jeringa vacía, habrá aire en la parte superior de la jeringa que debe purgarse para preparar el sistema con muestra y disolvente en el paso 3.
3. Prepara el sistema.
- Utilice el comando pump.dispense () para expulsar (dispensar) todo el aire de las jeringas, tuberías y válvulas. Asegúrese de que se dispense suficiente volumen de líquido de cada jeringa para eliminar completamente todo el aire de las jeringas, tubos y válvulas. Si las burbujas de aire son visibles dentro de cualquier tubo, continúe dispensando disolvente o muestra hasta que se retiren las burbujas.
- Una vez que se haya purgado el aire del sistema, realice al menos un procedimiento de inyección y enjuague de la muestra (sin recopilar datos de dispersión de neutrones).
- Haga clic para seleccionar la celda etiquetada Iniciar experimento de mezcla en la GUI de control.
- Con esta celda seleccionada activamente, haga clic en el botón Ejecutar (triángulo recto) ubicado en la parte superior de la GUI de control, o presione las teclas Mayús y Enter juntas en el teclado.
- Inspeccione visualmente la celda de muestra para confirmar que no hay burbujas de aire presentes.
- Si hay burbujas de aire, repita los pasos del protocolo 3.1 y 3.2 para purgar aún más el aire de las líneas de tubería.
- Si no hay burbujas de aire en la celda de muestra, continúe con el paso 4 para definir los pasos restantes del protocolo de experimento.
4. Defina el protocolo de mezcla de flujo detenido en el script del programa (consulte el ejemplo de código en el repositorio de código abiertoen línea 64).
- Introduzca el punto de ajuste de temperatura de la unidad de aire acondicionado programable (CA) que controla la temperatura de la carcasa aislada que rodea el dispositivo de flujo detenido.
- Mientras mantiene pulsado el botón de estrella de la unidad de control de CA, pulse las flechas hacia arriba y hacia abajo para cambiar la temperatura del punto de consigna. Alternativamente, escriba el punto de ajuste de temperatura deseado en la GUI de control y haga clic en Ejecutar.
- Espere 15-30 minutos para permitir que el interior del recinto se equilibre a la temperatura deseada antes de comenzar los experimentos cinéticos.
NOTA: El rango de temperatura accesible está actualmente entre 10 °C y 50 °C, y la estabilidad de temperatura es ± 1 °C.
- Introduzca todos los pasos de la secuencia de enjuague escribiendo los volúmenes, caudales, tiempos y número de repeticiones apropiados en la GUI de control.
- Defina el volumen de cada muestra a inyectar, que define el caudal total (Q).
- Defina el volumen de cada disolvente a inyectar durante el procedimiento de enjuague.
- Defina el tiempo de secado entre cada subpaso de enjuague (tseco).
- Defina el número de subpasos de enjuague.
- Definir los diferentes disolventes para los pasos de aclarado posteriores.
- Defina el número de repeticiones de enjuague a realizar después de cada medición (nenjuague).
- Defina el tiempo para secar completamente la celda de muestra y el mezclador, proporcionando una celda de muestra limpia para la posterior inyección de muestra (tdry_final).
- Defina todos los pasos de la secuencia de inyección de muestras escribiendo los volúmenes, caudales y tiempos apropiados en la GUI de control del sistema de flujo detenido.
- Definir el volumen de cada muestra a inyectar y el caudal.
- Calcule el tiempo de retardo (t retardo) a partir del volumen vacío (V vacío) y el caudal total (tretardo = V vacío/Q).
NOTA: El tiempo de retardo es el tiempo necesario para llenar la celda de muestra con la muestra mezclada. - Defina el tiempo de adquisición deseado para los datos TR-SANS de modo que se haya producido todo el proceso cinético de interés (tscatt).
- Establezca el tiempo de espera entre el final del experimento de dispersión y el comienzo de los ciclos de enjuague (tespera).
NOTA: Este tiempo de espera debe ser de al menos 100 s si se va a medir la transmisión de neutrones de la muestra antes de que se enjuague de la celda. La transmisión de la muestra es necesaria durante el procesamiento de datos para reducir los datos a intensidad absoluta. - Defina el número de ciclos de inyección a realizar con las secuencias de enjuague ejecutadas entre cada inyección que se definen en el paso 4.2 (nciclo).
- Calcule el tiempo total de un solo ciclo de recolección de datos de flujo detenido (ciclo t) utilizando la ecuación (1).
ciclo t = n× de enjuague (t retardo + tseco) + tdry_final +t retardo + tdispersión (1)
en el que nenjuague = número de repeticiones de aclarado (paso 4.2.6); t retardo = tiempo deretardo del dispositivo de flujo detenido (paso 4.3.2); tseco = tiempo de secado entre cada subpaso de enjuague (paso 4.2.3); tdry_final = tiempo para secar completamente la célula de muestra y el mezclador (paso 4.2.7); tscatt = tiempo de adquisición de datos TR-SANS deseado (paso 4.3.3)
5. Defina los parámetros de dispersión de neutrones de ángulo pequeño en la GUI de control del instrumento SANS.
- Determine las escalas de longitud y el rango q de interés para cada muestra.
- Defina la configuración del instrumento para cubrir el rango q de interés deseado, mientras maximiza el flujo de neutrones en la muestra.
- Establezca el tiempo total de adquisición de datos VSANS en la GUI de control del instrumento SANS en el tiempo de ciclo calculado en el paso 4.4 (tiempo de adquisición de datos de dispersión de neutrones =ciclo t).
- Ajuste el tiempo de medición de la transmisión de la muestra a 100 s en la GUI de control del instrumento SANS.
- Con la GUI de control de instrumentos SANS, active la recopilación de datos en modo de evento escribiendo GenerateEventModeData true en la línea de comandos.
6. Recopile mediciones de dispersión estándar para la reducción de datos antes de comenzar el experimento de flujo detenido para procesar los datos TR-SANS.
- Mide la dispersión de fondo.
- Asegúrese de que el obturador del instrumento local esté cerrado.
- Acople la muestra de haz bloqueada a la parte posterior de la abertura de la muestra, asegure el entorno del instrumento local y abra el obturador del instrumento local.
- Defina el tiempo de adquisición de datos de dispersión de haz bloqueado en el software y recopile datos de dispersión de haz bloqueado, contando durante la misma duración que el tiempo de adquisición de datos de dispersión más largo (tscatt).
- Una vez completada la recopilación de datos, cierre el obturador del instrumento y retire la muestra de haz bloqueada de la abertura de la muestra.
- Mida la dispersión de celdas vacías.
- Asegúrese de que la celda de muestra se haya enjuagado y secado completamente.
- Abra el obturador del instrumento local.
- Recopile la medición de transmisión de celda vacía durante 100 s.
- Recopile la medición de dispersión de celdas vacías, contando al menos el tiempo de adquisición más largo (tscatt).
7. Comience el experimento de flujo detenido.
- Inicie la recopilación de datos de dispersión de VSANS en modo de evento .
- Asegúrese de que el área del instrumento local esté segura y, a continuación, abra el obturador del haz de instrumentos local.
- Comience la recopilación de datos SANS utilizando el software de control de instrumentos SANS en la computadora del instrumento arrastrando y soltando las carreras deseadas en la cola de instrumentos.
NOTA: Para asegurarse de que se miden los primeros puntos de tiempo, comience la recopilación de datos antes de comenzar el experimento de mezcla de flujo detenido. Los datos se procesarán posteriormente en un paso posterior para tener en cuenta el tiempo de retraso (tdelay).
- Inicie el experimento de mezcla de flujo detenido en la GUI de control.
- Seleccione la celda del bloc de notas con la etiqueta Iniciar experimento de mezcla en la GUI de control del sistema de flujo detenido.
- Con esta celda seleccionada activamente, haga clic en el botón Ejecutar (triángulo recto) ubicado en la parte superior del programa de control del dispositivo de flujo detenido, o presione las teclas Mayús y Enter juntas en el teclado.
- Confirme que el protocolo de mezcla de flujo detenido definido en la sección 4 ha comenzado a funcionar.
- Agregue la medición de transmisión de 100 s a la cola de instrumentos VSANS después de la ejecución de dispersión utilizando la GUI de control de instrumentos SANS.
- Agregue una ejecución de medición de dispersión y una ejecución de medición de transmisión a la cola de instrumentos para cada ciclo de mezcla de flujo detenido restante(ciclo n - 1, paso 4.3.5) en la GUI de control de instrumentos SANS.
8. Procese y reduzca los datos para eliminar todos los fondos, corregir la sensibilidad del detector y corregir la transmisión de muestras.
- Descargue los archivos de datos de dispersión y los archivos de eventos asociados desde el servidor.
NOTA: Se generarán archivos de eventos de detector separados después de cada medición de VSANS, un archivo de eventos para cada carro de detector activo (por ejemplo, detector frontal, central y/o posterior). - Agrupe los datos de dispersión en las bandejas de tiempo deseadas mediante el comando events=Rebin(filename) seguido del comando e vents.do_rebinning(timebins), en el que el nombre de archivo de entrada corresponde al nombre del archivo de datos SANS deseado, ytimebins es una lista de los límites de la bandeja de tiempo deseada en segundos.
NOTA: Si los intervalos de tiempo de entrada se introducen como un solo número en lugar de una lista, los datos se agruparán en N número de contenedores con anchos de tiempo iguales, donde N son los intervalos de tiempo de entrada (consulte los scripts de software proporcionados por la línea de luz y el repositorio de código abierto en líneadisponible 64). - Reduzca los datos de dispersión agrupados utilizando el software proporcionado por la línea de luz65.
9. Analice los datos de TR-SANS.
- Calcule el tiempo de proceso de interés (tproceso) a partir de los tiempos de medición utilizando la ecuación (2).
tproceso = ti - tstop + tretardo (2)
Donde ti son los intervalos de tiempo de medición que comienzan después de que se detiene el flujo, tstop es el tiempo de medición inmediatamente cuando se detiene el flujo, y tdelay es el tiempo de retardo. - Trazar la intensidad dependiente de q I(q) en función del tiempo de proceso utilizando las bandejas de tiempo definidas en el paso 8.2 y elproceso t calculado en el paso 9.1.
NOTA: El tiempo de proceso accesible más temprano está restringido por elretraso t. Para medir puntos de tiempo de proceso anteriores, aumente el caudal total (Q) o disminuya el volumen de vacío total (vacío V). - Extraer los parámetros cinéticos de interés del cambio en I(q) en función del tiempo de proceso.
10. Finaliza el experimento.
- Apague el haz de neutrones cerrando el obturador del instrumento local.
- Realice una verificación de radiación utilizando un monitor de radiación proporcionado por la línea de luz antes de desconectar cualquier pieza, tubo o descargar cualquier muestra o recipiente de muestras mixtas.
- Transfiera las jeringas, el tubo y el recipiente de muestra mixta al departamento de física de la salud.
- Complete formularios de física de la salud y espere la evaluación por parte del personal de física de la salud.
Access restricted. Please log in or start a trial to view this content.
Resultados
Los datos representativos de neutrones que se muestran aquí miden la cinética de intercambio lipídico en presencia de metil-β-ciclodextrina (mβCD), un aditivo que cataliza el intercambio lipídico entre vesículas con la tasa de cambio (ke)66,67. Estudios previos de fluorescencia han demostrado que ke depende de la concentración de mβCD, y la vida media del proceso de intercambio es del orden de minutos68. Los ...
Access restricted. Please log in or start a trial to view this content.
Discusión
El procedimiento actual describe el dispositivo de mezcla y los pasos para realizar mediciones TR-SANS de flujo detenido. El dispositivo y el protocolo están optimizados para muestras líquidas de baja viscosidad donde las escalas de tiempo de interés son de ≈1 s a 5 min. Para escalas de tiempo superiores a 5 minutos, mezclar manualmente las muestras y cargarlas en celdas de dispersión estándar puede ser más fácil y deseable, especialmente para muestras, geles o pastas de alta viscosidad. El acceso a escalas de t...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
El acceso al NG3 VSANS fue proporcionado por el Centro de Dispersión de Neutrones de Alta Resolución, una asociación entre el Instituto Nacional de Estándares y Tecnología y la Fundación Nacional de Ciencias bajo el Acuerdo NO. DMR-2010792. M.H.L.N reconoce la financiación proporcionada por Mitacs Globalink (Canadá). La identificación de cualquier producto comercial o nombre comercial es para fomentar la comprensión y no implica el respaldo o la recomendación por parte del Instituto Nacional de Estándares y Tecnología.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Dynamic mixer | Analytical Scientific Instruments | 462-0150A | Magnetically coupled rotor, binary dynamic mixer assembly (ternary type available), 0.15 mL dead volume (larger dead volume available) |
| Fluoropolymer tubing | IDEX Health & Science | 1507L | PFA Tubing Natural 1/16 inch OD x 0.040 inch ID x 50 ft |
| Fluoropolymer 1/4-28 flangeless fittings | IDEX Health & Science | XP-245 | PFA flangeless fitting with ferrules, 1/4-28 threading, 1/16 inch OD tubing |
| Glass syringes | Hamilton Company | 81660 | Hamilton 1000 series syringes, 10 mL (81660), model 1010 C syr, 1/4"-28 thread termination, other volumes available |
| High-pressure flow selector valves | Vici Valco | C85X-1570EUTB | Vici 10 position selector valves, 15000 psi max, 0.25 mm bore, 1/16 inch OD tubing, 10-32 coned threaded ports, USB universal actuator |
| High-pressure switch valves | Vici Valco | C82X-1574EUHB | Vici 4 port switch valves, 15000 psi max, 0.25 mm bore, 1/16 inch OD tubing, 10-32 coned threaded ports, USB universal actuator |
| High-pressure syringes | Cetoni | A2019000358 | 3 mL stainless steel syringe, 510 bar max, 21 mL/min flow rate max |
| Low-pressure flow selector valves | Vici Valco | C25-3180EUHB | Vici 10 position selector valves, max 250 psi liquid, 0.75 mm bore, 1/16 inch OD tubing, 1/4-28 threaded ports, USB universal actuator |
| neMESYS high-pressure syringe pumps | Cetoni | A3921000103 | Max force 2600 N |
| neMESYS mid-pressure syringe pumps | Cetoni | A3921000131 | Max force 1000 N |
| Power supply | Cetoni | A3921000127 | Base 600, supplies power for up to 4 high pressure pumps |
| Quartz flow-through sample cell | Starna Scientific | 3-2.30-Q-1/TC | Quartz micro flow cells, 2 mm path length (1 mm available), 2 mm by 2 mm by 30 mm internal dimension |
| Quartz windows | Technical Glass Products | NA | GE 124 Clear fused quartz ground and polished plates, 11.75 inch by 23.75 inch by 0.375 inch thick |
| Stainless steel 10-32 coned compression fittings | IDEX Health & Science | U-321X, U-320X | 316 stainless steel ferrule (U-321X) and nut (U-320X) -Valco type, 10-32 coned, for 1/16 inch OD stainless steel tubing |
| Stainless steel tubing | IDEX Health & Science | U-102 | Stainless Steel Tubing 1/16 inch OD x 0.020 inch ID, 10 cm, various precut lengths available |
| Syringe pump control software | Cetoni | T6000000004 | QmixElements software for nemesys pumps, QmixSDK software development kit |
| Thermoelectric air conditioner | EIC Solutions | AAC-140C-4XT-HC | Thermoelectric air conditioner mounted on insulated enclosure to control the pump, valve, mixer, and sample temperature |
| T-slot railing | McMaster-Carr | 47065T103 | Aluminum t-slotted railing (1.5 inch by 1.5 inch) cut to various lengths |
| Vapor locking bottle caps | Cole-Parmer | EW-12018-02 | Four 304 SS port inserts, 1/4"-28 threads, GL45 bottle cap size, PTFE body, SS threads, PP collar |
Referencias
- Melnichenko, Y. B., Wignall, G. D. Small-angle neutron scattering in materials science: Recent practical applications. Journal of Applied Physics. 102 (2), 021101(2007).
- Grillo, I. Small-angle neutron scattering and applications in soft condensed matter. Soft Matter Characterization. Borsali, R., Pecora, R. , Springer. Dordrecht. (2008).
- Hollamby, M. J. Practical applications of small-angle neutron scattering. Physical Chemistry Chemical Physics. 15 (26), 10566-10579 (2013).
- Pipich, V., Fu, Z. KWS-3: Very small angle diffractor with focusing mirror. Journal of large-scale research. 1, 31(2015).
- Kline, S. 2019 NCNR Annual Report, Special Publication (NIST SP). , National Institute of Standards and Technology. Gaithersburg, MD. (2019).
- Gilbert, P. H., et al. Preservative induced polysorbate 80 micelle aggregation. Journal of Pharmaceutical Sciences. 10 (6), 2395-2404 (2021).
- Terashima, T., et al. In situ and time-resolved small-angle neutron scattering observation of star polymer formation via arm-linking reaction in ruthenium-catalyzed living radical polymerization. Macromolecules. 43 (19), 8218-8232 (2010).
- Hashimoto, K., Fujii, K., Nishi, K., Shibayama, M. Ion gel network formation in an ionic liquid studied by time-resolved small-angle neutron scattering. The Journal of Physical Chemistry B. 122 (40), 9419-9424 (2018).
- Conn, C. E., et al. Membrane protein structures in lipid bilayers; small-Angle neutron scattering with contrast-matched bicontinuous cubic phases. Frontiers in Chemistry. 8, 619470(2021).
- van't Hag, L., et al. Protein-eye view of the in meso crystallization mechanism. Langmuir. 35 (25), 8344-8356 (2019).
- Mahieu, E., et al. Observing protein degradation by the PAN-20S proteasome by time-resolved neutron scattering. Biophysical Journal. 119 (2), 375-388 (2020).
- Ibrahim, Z., et al. Time-resolved neutron scattering provides new insight into protein substrate processing by a AAA+ unfoldase. Scientific Reports. 7 (1), 40948(2017).
- Hollamby, M. J., et al. Growth of mesoporous silica nanoparticles monitored by time-resolved small-angle neutron scattering. Langmuir. 28 (9), 4425-4433 (2012).
- Blin, J. L., Impéror-Clerc, M. Mechanism of self-assembly in the synthesis of silica mesoporous materials: in situ studies by X-ray and neutron scattering. Chemical Society Reviews. 42 (9), 4071-4082 (2013).
- Impéror-Clerc, M., Grillo, I., Khodakov, A. Y., Durand, D., Zholobenko, V. L. New insights into the initial steps of the formation of SBA-15 materials: an in situ small angle neutron scattering investigation. Chemical Communications. 8, 834-836 (2007).
- Narayanan, T., Rüter, A., Olsson, U. SAXS/WAXS investigation of amyloid-β(16-22) peptide nanotubes. Frontiers in Bioengineering and Biotechnology. 9, 654349(2021).
- Angelov, B., et al. DNA/Fusogenic lipid nanocarrier assembly: millisecond structural dynamics. The Journal of Physical Chemistry Letters. 4 (11), 1959-1964 (2013).
- Amann, M., et al. Kinetic pathways for polyelectrolyte coacervate micelle formation revealed by time-resolved synchrotron SAXS. Macromolecules. 52 (21), 8227(2019).
- Varga, Z., Wacha, A., Bóta, A. Osmotic shrinkage of sterically stabilized liposomes as revealed by time-resolved small-angle X-ray scattering. Journal of Applied Crystallography. 47 (1), 35-40 (2014).
- Panine, P., Finet, S., Weiss, T. M., Narayanan, T. Probing fast kinetics in complex fluids by combined rapid mixing and small-angle X-ray scattering. Advances in Colloid and Interface Science. 127 (1), 9-18 (2006).
- Grillo, I. Applications of stopped-flow in SAXS and SANS. Current Opinion in Colloid & Interface Science. 14 (6), 402-408 (2009).
- Gomez-Hens, A., Perez-Bendito, D. The stopped-flow technique in analytical chemistry. Analytica Chimica Acta. 242, 147-177 (1991).
- Patel, J. T., Belsham, H. R., Rathbone, A. J., Friel, C. T. Use of stopped-flow fluorescence and labeled nucleotides to analyze the ATP turnover cycle of kinesins. Journal of Visualized Experiments: JoVE. (92), e52142(2014).
- Biro, F. N., Zhai, J., Doucette, C. W., Hingorani, M. M. Application of stopped-flow kinetics methods to investigate the mechanism of action of a DNA repair protein. Journal of Visualized Experiments: JoVE. (37), e1874(2010).
- Raney, K. D., Sowers, L. C., Millar, D. P., Benkovic, S. J. A fluorescence-based assay for monitoring helicase activity. Proceedings of the National Academy of Sciences of the United States of America. 91 (14), 6644-6648 (1994).
- Roder, H., Maki, K., Cheng, H. Early events in protein folding explored by rapid mixing methods. Chemical reviews. 106 (5), 1836-1861 (2006).
- Milon, A., et al. Osmotic swelling of unilamellar vesicles by the stopped-flow light scattering method. Influence of vesicle size, solute, temperature, cholesterol and three α,ω-dihydroxycarotenoids. Biochimica et Biophysica Acta (BBA) - Biomembranes. 859 (1), 1-9 (1986).
- Gast, K., Nöppert, A., Müller-Frohne, M., Zirwer, D., Damaschun, G. Stopped-flow dynamic light scattering as a method to monitor compaction during protein folding. European Biophysics Journal. 25 (3), 211-219 (1997).
- Antoun, A., Pavlov, M. Y., Tenson, T., Ehrenberg, M. M. Ribosome formation from subunits studied by stopped-flow and Rayleigh light scattering. Biological Procedures Online. 6, 35-54 (2004).
- Zhu, Z., Armes, S. P., Liu, S. pH-Induced micellization kinetics of ABC triblock copolymers measured by stopped-flow light scattering. Macromolecules. 38 (23), 9803-9812 (2005).
- Ye, J., et al. Comparative study of temperature-induced association of cyclic and linear poly(N-isopropylacrylamide) chains in dilute solutions by laser light scattering and stopped-flow temperature jump. Macromolecules. 41 (12), 4416-4422 (2008).
- Liu, X., et al. Early stage kinetics of polyelectrolyte complex coacervation monitored through stopped-flow light scattering. Soft Matter. 12 (44), 9030-9038 (2016).
- Garman, E. F., Weik, M. X-ray radiation damage to biological samples: recent progress. Journal of Synchrotron Radiation. 26 (4), 907-911 (2019).
- Garg, S., Porcar, L., Woodka, A. C., Butler, P. D., Perez-Salas, U. Noninvasive neutron scattering measurements reveal slower cholesterol transport in model lipid membranes. Biophysical Journal. 101 (2), 370-377 (2011).
- Marquardt, D., et al. 1H NMR shows slow phospholipid flip-flop in gel and fluid bilayers. Langmuir. 33 (15), 3731-3741 (2017).
- Egelhaaf, S. U., Olsson, U., Schurtenberger, P. Time-resolved SANS for surfactant phase transitions. Physica B: Condensed Matter. 276-278, 326-329 (2000).
- Tabor, R. F., Eastoe, J., Grillo, I. Time-resolved small-angle neutron scattering as a lamellar phase evolves into a microemulsion. Soft Matter. 5 (10), 2125-2129 (2009).
- Gradzielski, M., Bergmeier, M., Hoffmann, H., Müller, M., Grillo, I. Vesicle gel formed by a self-organization process. The Journal of Physical Chemistry B. 104 (49), 11594-11597 (2000).
- Lee, Y. -T., Li, D. S., Pozzo, L. D. Kinetic analysis of ultrasound-induced oil exchange in oil-in-water emulsions through contrast variation time-resolved small-sngle neutron scattering. Langmuir. 35 (47), 15204-15213 (2019).
- Lee, Y. -T., Pozzo, L. D. Contrast-variation time-resolved small-angle neutron scattering analysis of oil-exchange kinetics between oil-in-water emulsions stabilized by anionic surfactants. Langmuir. 35 (47), 15192-15203 (2019).
- Roger, K., Olsson, U., Schweins, R., Cabane, B. Emulsion ripening through molecular exchange at droplet contacts. Angewandte Chemie International Edition. 54 (5), 1452-1455 (2015).
- Nakano, M., Fukuda, M., Kudo, T., Endo, H., Handa, T. Determination of Interbilayer and Transbilayer Lipid Transfers by Time-Resolved Small-Angle Neutron Scattering. Physical Review Letters. 98 (23), 238101(2007).
- Nakano, M., et al. Flip-flop of phospholipids in vesicles: kinetic analysis with time-resolved small-angle neutron scattering. The Journal of Physical Chemistry B. 113 (19), 6745-6748 (2009).
- Nguyen, M. H. L., et al. Methanol accelerates DMPC flip-flop and transfer: A SANS study on lipid dynamics. Biophysical Journal. 116 (5), 755-759 (2019).
- Nguyen, M. H. L., et al. Peptide-induced Lipid flip-flop in asymmetric liposomes measured by small angle neutron scattering. Langmuir. 35 (36), 11735-11744 (2019).
- Nguyen, M. H. L., et al. Time-resolved SANS reveals pore-forming peptides cause rapid lipid reorganization. New Journal of Chemistry. 45 (1), 447-456 (2021).
- Xia, Y., et al. Effects of nanoparticle morphology and acyl chain length on spontaneous lipid transfer rates. Langmuir. 31 (47), 12920-12928 (2015).
- Xia, Y., et al. Morphology-induced defects enhance lipid transfer rates. Langmuir. 32 (38), 9757-9764 (2016).
- Maric, S., et al. Time-resolved small-angle neutron scattering as a probe for the dynamics of lipid exchange between human lipoproteins and naturally derived membranes. Scientific Reports. 9 (1), 7591(2019).
- Nielsen, J. E., Bjørnestad, V. A., Pipich, V., Jenssen, H., Lund, R. Beyond structural models for the mode of action: How natural antimicrobial peptides affect lipid transport. Journal of Colloid and Interface Science. 582, 793-802 (2021).
- Willner, L., Poppe, A., Allgaier, J., Mokenbusch, M., Richter, D. TIme-resolved SANS for the determintioan of unimer exchange kinetics in block copolymer micelles. Europhysics Letters. 55 (5), 667(2001).
- Lund, R., Willner, L., Stellbrink, J., Lindner, P., Richter, D. Logarithmic chain-exchange kinetics of diblock copolymer micelles. Physical Review Letters. 96 (6), 068302(2006).
- Lund, R., Willner, L., Richter, D., Dormidontova, E. E. Equilibrium chain exchange kinetics of diblock copolymer micelles: Tuning and logarithmic relaxation. Macromolecules. 39 (13), 4566-4575 (2006).
- Lund, R., Willner, L., Richter, D. Kinetics of block copolymer micelles studied by small-angle scattering methods. in Controlled Polymerization and Polymeric Structures. Advances in Polymer Science. Abe, A., Lee, K. S., Leibler, L., Kobayashi, S. , Springer. Cham. 51(2013).
- Choi, S. -H., Lodge, T. P., Bates, F. S. Mechanism of molecular exchange in diblock copolymer micelles: hypersensitivity to core chain length. Physical Review Letters. 104 (4), 047802(2010).
- Choi, S. -H., Bates, F. S., Lodge, T. P. Molecular exchange in ordered diblock copolymer micelles. Macromolecules. 44 (9), 3594-3604 (2011).
- Lu, J., Bates, F. S., Lodge, T. P. Chain exchange in binary copolymer micelles at equilibrium: confirmation of the independent chain hypothesis. ACS Macro Letters. 2 (5), 451-455 (2013).
- Lu, J., Bates, F. S., Lodge, T. P. Remarkable effect of molecular architecture on chain exchange in triblock copolymer micelles. Macromolecules. 48 (8), 2667-2676 (2015).
- Kelley, E. G., et al. Size evolution of highly amphiphilic macromolecular solution assemblies via a distinct bimodal pathway. Nature Communications. 5 (1), 3599(2014).
- Murphy, R. P., Kelley, E. G., Rogers, S. A., Sullivan, M. O., Epps, T. H. Unlocking chain exchange in highly amphiphilic block polymer micellar systems: influence of agitation. ACS Macro Letters. 3 (11), 1106-1111 (2014).
- Schantz, A. B., et al. PEE-PEO block copolymer exchange rate between mixed micelles is detergent and temperature activated. Macromolecules. 50 (6), 2484-2494 (2017).
- Lantz, K. A., et al. Cavitation enables switchable and rapid block polymer exchange under high-χN conditions. Macromolecules. 51 (17), 6967-6975 (2018).
- Murphy, R. P., et al. Capillary RheoSANS: measuring the rheology and nanostructure of complex fluids at high shear rates. Soft Matter. 16 (27), 6285-6293 (2020).
- Stopped Flow Sans. usnistgov. , Available from: https://github.com/usnistgov/stopped-flow-sans (2021).
- Kline, S. Reduction and analysis of SANS and USANS data using IGOR Pro. Journal of Applied Crystallography. 39 (6), 895-900 (2006).
- Doktorova, M., et al. Preparation of asymmetric phospholipid vesicles for use as cell membrane models. Nature Protocols. 13 (9), 2086-2101 (2018).
- Huang, Z., London, E. Effect of cyclodextrin and membrane lipid structure upon cyclodextrin-lipid interaction. Langmuir. 29 (47), 14631-14638 (2013).
- Sugiura, T., Ikeda, K., Nakano, M. Kinetic analysis of the methyl-β-cyclodextrin-mediated intervesicular transfer of pyrene-labeled phospholipids. Langmuir. 32 (51), 13697-13705 (2016).
- Scott, H. L., et al. On the mechanism of bilayer separation by extrusion, or why your LUVs are not really unilamellar. Biophysical Journal. 117 (8), 1381-1386 (2019).
- Dicko, C., et al. NUrF-Optimization of in situ UV-vis and fluorescence and autonomous characterization techniques with small-angle neutron scattering instrumentation. Review of Scientific Instruments. 91 (7), 075111(2020).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados