Method Article
Preparación de muestras mediante fresado por haz de iones focalizado correlativo en 3D para tomografía crioelectrónica de alta resolución
En este artículo
Resumen
Aquí, presentamos una línea para el fresado de haces de iones enfocados correlativos en 3D para guiar la preparación de muestras celulares para la tomografía crioelectrónica. La posición 3D de las proteínas de interés marcadas con fluorescencia se determina primero mediante criofluorescencia y luego se dirige a la molienda. El protocolo es adecuado para células de mamíferos, levaduras y bacterias.
Resumen
La criotomografía electrónica (crio-ET) se ha convertido en el método de elección para investigar la ultraestructura celular y los complejos moleculares en su estado nativo, congelado-hidratado. Sin embargo, la crio-ET requiere que las muestras sean lo suficientemente delgadas como para no dispersar ni bloquear el haz de electrones incidente. En el caso de muestras celulares gruesas, esto se puede lograr mediante la molienda de haz de iones criofocalizada (FIB). Este protocolo describe cómo apuntar a sitios celulares específicos durante la molienda de FIB utilizando un enfoque correlativo 3D, que combina datos de microscopía de fluorescencia tridimensional con información del microscopio electrónico de barrido FIB. Con esta técnica, los eventos y estructuras celulares raros pueden ser dirigidos con alta precisión y visualizados a resolución molecular utilizando microscopía electrónica de criotransmisión (crio-TEM).
Introducción
El fresado por haz de iones focalizado permite la preparación de muestras biológicas delgadas a partir de muestras criofijadas sin los problemas comúnmente asociados con los cortes mecánicos, como marcas de cuchillas y artefactos de compresión1. Cuando se combina con la criotomografía electrónica, la molienda FIB permite estudios biológicos de alta resolución de la morfología celular y la determinación de la estructura de los complejos macromoleculares directamente desde el interior de las células con una resolución subnanométrica 2,3,4. Si bien las especies abundantes, como los ribosomas, se encuentran fácilmente en las láminas FIB cortadas al azar, muchos procesos celulares se basan en la colocalización de varios complejos o se localizan en sitios específicos dentro de la célula. En consecuencia, se requiere una focalización eficiente para no perder la característica biológica de interés durante el proceso de molienda y limitarse a golpes aleatorios. Por lo tanto, es necesario un enfoque correlativo que combine los datos del microscopio electrónico de barrido (SEM)-FIB y un microscopio óptico de criofluorescencia (FLM). Si bien es posible omitir la correlación inicial y combinar los datos de FLM y crio-ET solo después de la adquisición de TEM5,6, el fresado por haz de iones enfocados guiado por fluorescencia permite una selección precisa del área de molienda de antemano, lo que resulta en una adquisición de datos más eficiente. Desde su concepción7, la aplicación de la molienda de FIB correlacionada en 3D en estudios biológicos había sido limitada hasta que recientemente informamos de la identificación de un nuevo compartimento líquido-líquido separado en fase (LLPS) en levadura utilizando esta técnica8.
Aquí se describe un protocolo generalizado de microscopía óptica y electrónica correlacionada con criomielitis en 3D (CLEM), que se puede utilizar para estudiar una amplia variedad de muestras que van desde bacterias hasta células de levadura y mamíferos. Si bien los experimentos se realizaron utilizando un determinado conjunto de instrumentos, los pasos individuales no están vinculados a un hardware específico y pueden transferirse fácilmente a otros sistemas como una extensión de los protocolos existentes 3,5. En la Tabla de Materiales y en la Tabla 1 se proporciona una lista de los equipos probados y los ajustes sugeridos. Los cuatro pasos clave de la tubería son (1) la preparación de la muestra, (2) la localización de las características de interés mediante criofluorescencia, (3) el fresado de haz de iones focalizado correlacionado en 3D y (4) la localización de las estructuras objetivo para la adquisición de datos de crio-ET en las láminas en el microscopio electrónico de criotransmisión (Figura 1).
Protocolo
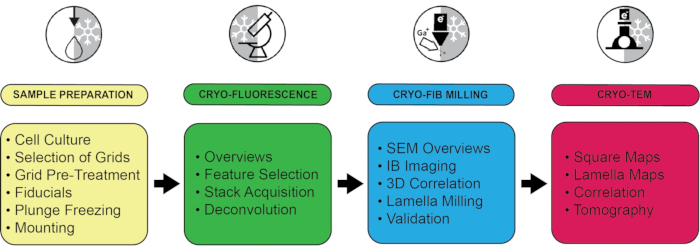
Figura 1: Resumen del flujo de trabajo con una selección de pasos críticos. Todo el protocolo se divide en cuatro etapas según el equipo utilizado: Preparación de la muestra, incluida la congelación por inmersión, la criofluorescencia, la molienda por haz de iones criofocalizada y la criomicroscopía electrónica. Para cada paso, se destacan varios puntos clave. Haga clic aquí para ver una versión más grande de esta figura.
1. Cultivo celular y congelación por inmersión de rejillas
- Cultive las células de su elección y optimice las estrategias de etiquetado y tratamiento a temperatura ambiente antes de pasar a los crioexperimentos. Las dianas de interés se marcan mediante fusiones de proteínas fluorescentes o tinción en vivo (p. ej., Halo-Tag, LysoTracker, BODIPY, tinción de anticuerpos vivos, etc.). Si se necesita tratamiento con agentes químicos o biológicos (moléculas pequeñas, medios especiales, siRNA, etc.) para investigar el proceso biológico de interés, optimice las condiciones (p. ej., tiempo, concentración) utilizando imágenes de FLM de células vivas.
- Asegúrese de que los sitios de interés se puedan localizar con éxito por encima del fondo en un número suficiente de células utilizando configuraciones de imágenes que coincidan lo más posible con las condiciones criogénicas posteriores (es decir, NA, tiempo de exposición, etc.).
- Selección y preparación de rejillas
- Seleccione cuadrículas con el tamaño y el espaciado de los agujeros adecuados para las celdas y los marcadores de referencia utilizados (consulte el paso 1.3.1). No utilice una película continua sin agujeros, ya que esto podría dar lugar a un exceso de tampón residual después de la transferencia y, por lo tanto, reducir la eficiencia de la vitrificación y dificultar la detección de perlas de referencia. Para un contacto prolongado de las células con las rejillas, asegúrese de que el soporte de la rejilla y el material de la película sean biocompatibles.
- Limpie con plasma las rejillas crio-EM para hacerlas más hidrófilas. Para su uso en cultivos celulares adherentes, esterilice las rejillas después de la limpieza con plasma con radiación UV durante 20 minutos en una campana de flujo laminar. Opcionalmente, las rejillas pueden ser pretratadas con compuestos que ayudan con la adhesión celular, como la poli-L-lisina o la concanavalina A, como se describe a continuación.
NOTA: En general, las siguientes combinaciones de rejilla/muestra se han utilizado con éxito en el flujo de trabajo correlativo de crio-FIB: Levadura: Cu o Au, malla 200, película de carbono R1/4 o SiO2 , recubierta opcionalmente con concanavalina A; Escherichia coli: Cu o Au, malla 200, carbono R1/4 o película de SiO2 ; Chlamydomonas reinhardtii: Cu o Au, malla 200, película de carbono R1/2 o R1/4 o SiO2 ; HeLa: Au, malla 200, película R1/4 SiO2 , recubierta con poli-L-lisina; HEK293: Au, malla 200, película R1/4 SiO2 , recubierta con poli-L-lisina. - Recubrimiento de concanavalina A para mejorar la adhesión de las células de levadura:
- Preparar una solución de recubrimiento de 1 mg/ml de concanavalina A en tampón HEPES de 10 mM con 100 μM de CaCl2, pH 8,5. Coloque una gota (50 μL) de la solución de recubrimiento y dos gotas de agua destilada por separado sobre un trozo de película de parafina.
- Recoja la rejilla limpia con plasma con pinzas de fuerza inversa e insértela con cuidado en la gota de la solución de recubrimiento, evitando movimientos perpendiculares a la rejilla para evitar daños a la película.
- Después de ~ 5 s de incubación, lave la rejilla dos veces insertándola en las gotas de agua de manera similar. Finalmente, seca el exceso de líquido aplicando un papel de filtro en la parte posterior de la rejilla y deja que la rejilla se seque por completo antes de soltarla de las pinzas. Use las rejillas secas para congelar por inmersión.
- Recubrimiento de poli-L-lisina para cultivo en suspensión y células adherentes:
- Prepare una solución de recubrimiento de 1 mg/ml de poli-L-lisina en tampón de borato de sodio 0,1 M, pH 8,5.
- Coloque las rejillas limpiadas con plasma en un plato adecuado para el cultivo celular y esterilícelas durante 20 minutos con radiación UV.
- Agregue suavemente suficiente solución de recubrimiento para cubrir todas las rejillas e incube a 37 °C durante al menos 2 h. Aspire el líquido y lave suavemente las rejillas dos veces con PBS antes de sembrar las células hasta la concentración deseada.
- Preparación de celdas y cuentas de referencia
NOTA: Se requieren cordones de referencia para el registro 3D de los datos de fluorescencia con imágenes tomadas en el microscopio FIB/SEM para permitir el fresado FIB correlativo en 3D.- Elija perlas reconocibles en todas las modalidades de obtención de imágenes, es decir, FLM, SEM e IB (diámetro recomendado de 0,5 a 1 μm), pero asegúrese de que no eclipsen la estructura celular objetivo durante la obtención de imágenes de fluorescencia para que sea más fácil diferenciar las perlas y la característica biológica de interés. Elimine los conservantes citotóxicos en las perlas de referencia (p. ej., NaN3) según las instrucciones del fabricante.
NOTA: Para facilitar la distinción entre las características biológicas de interés y las fiduciales, es útil que los espectros de emisión de fluorescencia se superpongan solo parcialmente para que las señales puedan distinguirse en función de las diferencias de intensidad en los canales FLM. - Si se utiliza el cultivo en suspensión, se cultivan las células hasta una densidad adecuada (p. ej., levadura OD 600 = 0,8, E. coli OD 600 = 0,8-1,0, C. reinhardtii 1500 células/μL) y realizar los tratamientos necesarios para el experimento, como el cambio de medio, la adición de productos químicos, la inanición, etc. Fije las rejillas limpiadas con plasma a unas pinzas según sea necesario para el método de inmersión (manual/automático) y aplique 4 μL de la suspensión celular mezclada con ~1 x 105 perlas/μL de suspensión de perlas de referencia al lado de la película de las rejillas.
NOTA: Determine la dilución óptima de las células y los fiduciales en los experimentos de valoración (por ejemplo, comprobando el crio-FLM o FIB/SEM, véase más abajo). Sin embargo, para la mayoría de las células cultivadas en suspensión, una concentración final de ~1 x 105 perlas/μL de las perlas de referencia de 1 μm (dilución 1:20 del stock; consulte la Tabla de materiales para obtener más detalles) ha demostrado ser un buen punto de partida. - Si se utiliza un cultivo adherente, limpie con plasma y esterilice las rejillas utilizando radiación UV para el cultivo aséptico. Si es necesario, recubra previamente las rejillas con compuestos que ayuden a la adhesión celular (p. ej., poli-l-lisina, fibronectina, laminina; consulte el paso 1.2.2). Siembre y cultive células en las rejillas en placas de cultivo normales o placas con subdivisiones para rejillas.
- Tratar las muestras según sea necesario para el experimento y mantener las células en condiciones óptimas hasta la congelación por inmersión (p. ej., 37 °C/5% de CO2 para HEK/HeLa). Retire con cuidado las rejillas de la placa de cultivo y fíjelas a las pinzas de inmersión. Aplique 4 μL del medio de cultivo mezclado con fiduciales (1 x 105 perlas/μL para fiduciales de 1 μm) en el lado de la célula.
- Elija perlas reconocibles en todas las modalidades de obtención de imágenes, es decir, FLM, SEM e IB (diámetro recomendado de 0,5 a 1 μm), pero asegúrese de que no eclipsen la estructura celular objetivo durante la obtención de imágenes de fluorescencia para que sea más fácil diferenciar las perlas y la característica biológica de interés. Elimine los conservantes citotóxicos en las perlas de referencia (p. ej., NaN3) según las instrucciones del fabricante.
- Congele las células mediante un procedimiento de congelación manual o automatizado. Si es posible, solo seque la rejilla desde el lado opuesto a las celdas para evitar dañar mecánicamente las celdas (Figura 2A). En los sistemas de inmersión automatizados de dos brazos, logre esto colocando una hoja de politetrafluoroetileno (por ejemplo, teflón) en lugar de papel secante en la almohadilla frente a las células. Transfiera las rejillas a cajas de almacenamiento y manténgalas en nitrógeno líquido (lN2) hasta su uso.
PRECAUCIÓN: lN2 y otros criógenos pueden causar daños graves en los ojos y la piel. Use equipo de protección personal (EPP) y trabaje solo en un espacio bien ventilado para evitar la acumulación de concentraciones peligrosas de N2 .
NOTA: Todos los pasos posteriores deben llevarse a cabo mejor en la fase líquida de lN2 para evitar la contaminación de la celda y las superficies laminares, ya que esto podría complicar el procesamiento posterior. Reduzca el contacto con los cristales de hielo flotantes utilizando siempre nitrógeno líquido limpio (por ejemplo, un filtro para eliminar el hielo flotante), eliminando los pasos de transferencia innecesarios y, si es posible, trabajando en un entorno con humedad controlada. - Monte y recorte las rejillas congeladas por inmersión en AutoGrids con recorte y las celdas hacia arriba (Figura 2A) para la posterior obtención de imágenes de criofluorescencia y fresado FIB. Para garantizar la alineación adecuada de las muestras en el TEM, la dirección de fresado debe ser ortogonal al eje de inclinación de la crio-ET. En consecuencia, coloque las marcas de orientación (por ejemplo, grabado LÁSER o puntos de marcador removibles) en AutoGrids antes de recortar para ayudar con esta alineación (Figura 2A).
- Cribar la calidad de la rejilla (Figura 2B) en el crio-FLM y FIB/SEM. Optimice la densidad celular, el tiempo de transferencia y la fuerza para obtener una distribución uniforme de las células y las perlas. Utilice imágenes de luz reflejada en un microscopio de criofluorescencia o utilice el crio-FIB-SEM para asegurarse de que tanto las células como las perlas de referencia sean claramente visibles (Figura 2B, flechas blancas).
- Si es necesario, repita la inmersión en mejores condiciones, por ejemplo, variando la concentración celular y/o el tiempo de transferencia. Una vez que se hayan encontrado los parámetros de inmersión adecuados, no repita el cribado en cuadrícula para cada nueva ronda de experimentos.

Figura 2: Cribado de rejillas adecuadas utilizando SEM e IB . (A) Las marcas de orientación deben colocarse en las Rejillas automáticas perpendiculares a la dirección de fresado para simplificar la carga correcta en el TEM. Las celdas se montan boca arriba en el AutoGrid ensamblado. (B) Después de la congelación por inmersión, las rejillas se inspeccionan en el SEM para evaluar y optimizar las condiciones de inmersión: a) No debe haber demasiadas celdas por rejilla. Para las celdas HeLa, por ejemplo, no use más de 1-4 celdas por cuadrado. Para células más pequeñas, como Saccharomyces cerevisiae (que se muestra aquí), se ha encontrado que los grupos de 4 a 6 células son útiles. b) Las cuentas de referencia (flechas blancas) deben ser claramente visibles y no debe haber demasiado tampón alrededor de las celdas. Haga clic aquí para ver una versión más grande de esta figura.
2. Microscopía óptica de criofluorescencia
- Para cada cuadrícula, adquiera una visión general en fluorescencia (campo amplio) y contraste de interferencia diferencial (DIC) o modo reflejado y seleccione cuadrados de cuadrícula adecuados con señal de fluorescencia. Elija campos de visión que contengan tanto las celdas de interés como un número suficiente de marcadores de referencia (6-12).
- Asegúrese de que las celdas y las cuentas estén distribuidas uniformemente, no demasiado densas y hacia el centro de cada cuadrado. Elija solo cuadrados accesibles tanto para el instrumento FIB-SEM como para TEM, es decir, aquellos que estén al menos a tres cuadrados del borde de la cuadrícula en cuadrículas de malla 200 (Figura 3A, dentro del círculo rojo).
- En cada uno de los cuadrados de cuadrícula seleccionados, adquiera una pila fluorescente con un paso de enfoque apropiado para la deconvolución posterior, es decir, <1/2 del límite de resolución axial. Si es posible, utilice objetivos de alta apertura numérica (NA) para aumentar el recuento de fotones y la precisión de la localización.
- En un microscopio confocal con objetivo NA 0.9, adquiera pilas con un tamaño de paso de 300 nm, sobremuestreando el valor de Nyquist. Registre varias pilas de colores si es necesario (Figura 2B). Guarde las rejillas bajo lN2 hasta su uso posterior.
NOTA: Para determinar el tamaño óptimo del paso, elija los valores calculados por el software de control del microscopio o utilice herramientas en línea9. Compruebe si hay sangrado de señal entre canales, ya que un sangrado excesivo es perjudicial para los experimentos de colocalización. Sin embargo, algunos pueden ser ventajosos para corregir las aberraciones cromáticas en pilas multicolores.
- En un microscopio confocal con objetivo NA 0.9, adquiera pilas con un tamaño de paso de 300 nm, sobremuestreando el valor de Nyquist. Registre varias pilas de colores si es necesario (Figura 2B). Guarde las rejillas bajo lN2 hasta su uso posterior.
- Desconvolucionar pilas utilizando el softwareapropiado 10,11 y volver a cortarlas7 si se requiere un tamaño de píxel isótropo. La deconvolución, al igual que a temperatura ambiente, limpia la señal FLM y puede mejorar la precisión de la localización (Figura 3C).

Figura 3: Selección de cuadrados para la adquisición de pilas de FLM y mejora de los datos mediante deconvolución. (A) Vista general de una cuadrícula sumergida con células de levadura que expresan eGFP-Ede1 (verde) y mCherry-Atg8 (magenta). Elija posiciones con una buena distribución de cuentas y celdas, pero evite los bordes de la cuadrícula (sombreados en rojo). Los recuadros indican las posiciones con buenas distribuciones celulares donde se tomaron las pilas de fluorescencia. (B) Proyección de intensidad máxima (MIP) de la pila multicolor tomada en el cuadrado de recuadro amarillo (desde A) después de la deconvolución. La deconvolución de las pilas FLM limpia significativamente las señales de fondo no deseadas y ayuda a localizar las cuentas en z con mayor precisión, como se desprende de los ajustes gaussianos antes (C) y después de la deconvolución (D) (los ajustes se realizaron en 3DCT y se muestran para la cuenta marcada con 1). Las imágenes muestran vistas MIP ampliadas del canal rojo (excitación: 552 nm, emisión: 585-650 nm). Haga clic aquí para ver una versión más grande de esta figura.
3. Fresado de haz de iones enfocado
- Cargue las rejillas en el instrumento crio-FIB-SEM y utilice las marcas de recorte y/o de orientación para asegurar la orientación adecuada para su posterior colocación en el TEM (Figura 2A). Asegúrese de que la dirección de fresado sea perpendicular al eje de inclinación del TEM.
- Utilizar un sistema de inyección de gas (GIS; CpMePtMe3) en las posiciones de la etapa predefinidas por la configuración FIB-SEM para recubrir las rejillas con una capa organometálica protectora. No aplique demasiado, ya que esto podría interferir con la localización de la cuenta de referencia en el TEM más adelante. Utilice un recubridor de plasma para aplicar platino metálico para reducir la carga de la muestra.
NOTA: Si no se dispone de ajustes para el recubrimiento GIS, se pueden encontrar fácilmente realizando rondas sucesivas de recubrimiento corto (~2 s), seguidas de fresado FIB. Asegúrese de que la muestra aún se pueda cortar con éxito a corrientes medias (~ 100 pA) sin franjas aparentes de la capa organometálica protectora alrededor de los bordes de las láminas. Tanto el tiempo como la distancia de la aguja SIG (con respecto a la muestra) son parámetros importantes a tener en cuenta. No utilice la aguja GIS a temperatura ambiente (es decir, 45 °C), sino lo más fría posible para proporcionar un recubrimiento uniforme (25-27 °C). - Registre una descripción general de la cuadrícula SEM y realice una correlación 2D con las vistas generales de FLM para encontrar los cuadrados de la cuadrícula para los que se han grabado pilas fluorescentes. Inspeccione manualmente ambas vistas o utilice varios paquetes de software 7,10,12 para encontrar los cuadrados de la cuadrícula. En este caso, la atención se centra en la caja de herramientas de correlación 3D (3DCT)7, que utiliza la transformación de cuerpo rígido 3D con escalado isotrópico entre vistas. Un excelente tutorial sobre las funciones de las 3DCT está disponible en línea13.
- Seleccione y marque al menos cuatro posiciones correspondientes, por ejemplo, puntos de referencia como barras de cuadrícula o agujeros en la película de soporte, tanto en la vista general de la cuadrícula FLM como en la SEM (clic derecho) y calcule la transformación entre los puntos marcados (correlación).
- A continuación, coloque los marcadores en el centro de los cuadrados de cuadrícula correspondientes para los que se han adquirido pilas FLM y prediga su posición en la vista SEM (correlacionar; Figura 4A).
- Para cada cuadrado de cuadrícula correlacionado, tome una imagen de haz de iones (IB) de baja corriente (≤10 pA) en el ángulo de fresado FIB elegido (10°-25° para una lanzadera de preinclinación de 45°). Seleccione un campo de visión (es decir, posición y ampliación) que coincida con los datos de fluorescencia. Para 200 cuadrículas de malla, adquiera datos de fluorescencia y FIB/SEM para contener cuadrados de cuadrícula individuales, incluidas las barras de cuadrícula (consulte la Figura 3A y la Figura 4A).
NOTA: El fresado debe realizarse en un ángulo lo más bajo posible para evitar perder un rango angular significativo durante la crio-ET y para permitir la identificación de un número suficiente de cordones de referencia. Por ejemplo: con una inclinación de la platina de 17°, una inclinación previa de la lanzadera de 45° y una inclinación de la viga FIB de 52° en relación con la plomada, la inclinación previa de la lámina es de 10°, lo que casi cumple con el rango angular preferido de ±60° en el TEM al inclinarse de -50° a +70°, el máximo de muchos crioporta TEM. - Tome una imagen SEM del mismo cuadrado para ayudar con la identificación de las perlas correspondientes en la vista de fluorescencia y haz de iones.
- Realice el registro de la pila FLM 3D desconvolucionada y la vista del haz de iones 2D para cada posición con el 3DCT como se describe en los siguientes pasos (Figura 4B).
- Cargue la pila FLM 3D recortada correspondiente y la vista de haz de iones (IB) en 3DCT.
NOTA: Los datos de fluorescencia multicolor se pueden cargar como hasta tres archivos de pila de un solo canal separados. - Seleccione 4 perlas de referencia en los datos de fluorescencia y haga clic con el botón derecho en la lista de posiciones para determinar su posición 3D mediante el ajuste gaussiano de la señal en x, y y z. Seleccione las cuentas correspondientes en la imagen IB y realice una correlación 3D inicial (correlación).
- Agregue de forma iterativa más perlas en la imagen de fluorescencia, refine su posición 3D y prediga su posición en la vista IB para agregar rápidamente más perlas al registro y comprobar la precisión de la correlación. En 3DCT, se proporcionan valores de error cuadrático medio (RMSE) para evaluar la consistencia de la correlación7.
- Asegúrese de que los valores RMSE sean pequeños y del orden de la precisión de localización (~300 nm). Para determinar la precisión de la correlación, omita deliberadamente algunas perlas de referencia claramente identificables tanto en la fluorescencia como en el haz de iones durante el paso de registro. Para ello, compruebe su ubicación predicha frente a la real en la imagen del haz de iones. Si la posición predicha difiere significativamente de la real, repita la correlación inicial con un nuevo conjunto de fiduciales.
NOTA: La correlación de 6-8 cuentas ha demostrado ser suficiente para el registro preciso de las pilas de FLM y las vistas de IB. Sin embargo, agregar más fiduciales (hasta 12-15) en un amplio rango de valores z (por ejemplo, seleccionando cuentas en la barra de la cuadrícula o en cuadrados vecinos) puede mejorar la precisión de la correlación.
- Asegúrese de que los valores RMSE sean pequeños y del orden de la precisión de localización (~300 nm). Para determinar la precisión de la correlación, omita deliberadamente algunas perlas de referencia claramente identificables tanto en la fluorescencia como en el haz de iones durante el paso de registro. Para ello, compruebe su ubicación predicha frente a la real en la imagen del haz de iones. Si la posición predicha difiere significativamente de la real, repita la correlación inicial con un nuevo conjunto de fiduciales.
- Seleccione las señales celulares objetivo, ajuste su posición 3D en la pila FLM y aplique la transformación para predecir las posiciones objetivo en la vista IB (Figura 4B).
NOTA: Cualquier entrada en la lista de posiciones de FLM, que no tenga una contraparte en la lista IB, se tratará como una señal a predecir.
- Cargue la pila FLM 3D recortada correspondiente y la vista de haz de iones (IB) en 3DCT.
- Para cada cuadrado correlacionado, transfiera las posiciones predichas de las características de interés al instrumento FIB-SEM y coloque los patrones de fresado de láminas (Figura 4C). Transfiera posiciones manualmente (por ejemplo, midiendo la distancia a puntos de referencia visibles, como celdas o cuentas de referencia) o utilice la automatización y las secuencias de comandos como se implementó, por ejemplo, en SerialFIB14. Si hay varias señales por celda, coloque los patrones para incluir tantos puntos de interés (POI) como sea posible en la misma lámina para aumentar el rendimiento.
- Primero desbaste y luego muele finamente las láminas hasta un espesor final de 150-250 nm. Evite los pasos (p. ej., cortes de alivio de tensión15) que causen flacidez de la lámina y, por lo tanto, resulten en el movimiento de la característica real de interés con respecto a las pilas de FLM adquiridas previamente. Utilice procedimientos de fresado manuales3 o automatizados14,16,17,18 FIB. Con cualquiera de los métodos, asegúrese de que la característica de interés permanezca en el centro de la lámina adelgazándola simétricamente desde la parte superior e inferior.
- Para evaluar la precisión del fresado de cada lámina, realice el mismo registro que en el paso 3.4. Sin embargo, esta vez, utilice la imagen final de IB después del fresado FIB y compruebe si las posiciones predichas de las características de interés están contenidas dentro de la lámina final. Alternativamente, superponga las proyecciones giradas de las pilas FLM, obtenidas de la salida de 3DCT y los scripts personalizados19, con la imagen IB final (Figura 4C, inserto pequeño).

Figura 4: Procedimiento de fresado FIB correlativo en 3D . (A) La correlación 2D-2D de las vistas generales de FLM (izquierda) y SEM (derecha) de la cuadrícula se utiliza para ubicar los cuadrados de la cuadrícula en los que se tomaron pilas fluorescentes anteriormente. (B) Para cada cuadrado seleccionado, después del registro 3D-2D de las posiciones fiduciales correspondientes en 3DCT (cuadros de colores), se seleccionan las posiciones de las características biológicas de interés en los datos de FLM. Sobre la base de la predicción de las posiciones correspondientes en la imagen del haz de iones (círculos rojos), se seleccionan los sitios para la preparación de las láminas. (C) Las imágenes de microscopio electrónico de barrido (SEM) y de haz de iones (IB) se utilizan para mantener el objetivo centrado durante el fresado. Se ha encontrado que los espesores finales de 150-250 nm son adecuados para el procesamiento posterior. Haga clic aquí para ver una versión más grande de esta figura.
4. TEM correlativo
- Cargue las rejillas en el TEM, asegurándose de que la orientación de las láminas (como se desprende de las marcas de recorte u orientación) sea perpendicular al eje de inclinación.
NOTA: Los microscopios de diferentes fabricantes se pueden controlar utilizando varios softwares, por ejemplo, Tomo5, TOM o SerialEM20. Aquí, la atención se centra en esto último. - Adquiera montajes de cuadrícula y vistas generales para cada cuadrado de cuadrícula que contenga láminas. Asegúrese de que el aumento y el tiempo de exposición sean adecuados para visualizar las perlas de referencia en las imágenes TEM sin aumentar significativamente la dosis total de electrones. Adquiera mapas TEM (montajes) de alta resolución de cada lámina.
- El registro y el 3D-2D correlacionan la pila de FLM con el cuadrado de la cuadrícula TEM y las vistas generales de las láminas en 3DCT. Utilice el mismo procedimiento descrito en el paso 3.6 seleccionando las posiciones de perlas correspondientes en las imágenes de fluorescencia (x, y, z - ajuste gaussiano) y del microscopio electrónico de transmisión. A continuación, selecciona las posiciones de interés en los canales FLM y transfiérelas a los resúmenes de TEM. Si es necesario, utilice un procedimiento de dos pasos que comprenda una primera correlación entre FLM y TEM de bajo aumento, y una segunda de TEM de bajo a alto aumento (Figura 5).
- Transfiera posiciones manualmente (midiendo las distancias a los puntos de referencia), las herramientas de registro y mapeo disponibles en SerialEM20 o software externo como CorRelator21.
- Configure y ejecute la serie de inclinación en posiciones correlacionadas. Utilice un aumento, un desenfoque y una dosis total adecuados (consulte la Tabla de Materiales y la Tabla 1 para obtener más detalles). Inicie la adquisición en la preinclinación determinada por la laminilla (véase también la nota en el paso 3.4) y utilice un esquema de inclinación simétricade dosis 22. Utilice la adquisición manual o por lotes.

Figura 5: Localización de posiciones correlacionadas en el TEM. Después de un fresado FIB correlacionado en 3D exitoso y la transferencia al microscopio electrónico de transmisión, se realiza un registro 3D-2D para cada cuadrado fresado entre las cuentas de referencia (cajas de colores) en las pilas de FLM y las descripciones generales de TEM para localizar sitios potenciales para crio-ET (círculos rojos). A continuación, se pueden adquirir vistas generales de láminas de mayor aumento (zoom-in) para configurar los tomografías con mayor precisión. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
El protocolo proporciona un recorrido por la tubería utilizada para descubrir el depósito de proteína endocítica (END) que contiene el dominio EH y depende de la proteína endocitosis 1 (Ede1) y su degradación y atrapamiento en cuerpos autofágicos8. El END es un compartimento líquido-líquido separado en fase en S. cerevisiae, que amortigua una variedad de proteínas involucradas en la endocitosis mediada por clatrina (CME) después de eventos endocíticos fallidos. Uno de sus principales componentes es Ede1, que funciona como componente de CME y como receptor de autofagia selectiva para la degradación de este nuevo compartimento de LLPS. En consecuencia, se utilizó una fusión de EGFP de Ede1 (EGFP-Ede1) bajo el control del promotor de alcohol deshidrogenasa (ADH) para visualizar los END, ya que la sobreexpresión de Ede1 interfiere con las primeras etapas de la endocitosis y, por lo tanto, induce constitutivamente LLPS.
En una rejilla congelada por inmersión con células de levadura que sobreexpresan EGFP-Ede1 y marcadores de referencia de 1 μm, se seleccionaron cinco posiciones para la adquisición de la pila de FLM en el canal GFP (Figura 6A; TFS Corrsight; modo confocal, tamaño de paso de enfoque de 300 nm, rango de 10 μm). La cuadrícula se transfirió al instrumento FIB (Quanta 3D FEG), y se identificaron los cuadrados de la cuadrícula para los que se habían adquirido pilas FLM mediante la realización de una correlación 2D-2D de las vistas generales de la cuadrícula de fluorescencia y SEM (comparar el paso 3.2).
Para cada uno de los cuadrados elegidos, las imágenes del haz de iones se tomaron a una corriente baja (10 pA, aumento de 1200x) y las posiciones fiduciales correspondientes se registraron en 3DCT. Después de seleccionar las posiciones con la característica biológica de interés y ajustar su posición 3D dentro de la pila de FLM, la transformación encontrada se aplicó a las posiciones END putativas, y se seleccionaron los sitios para la preparación de las láminas (Figura 6B). En los ejemplos que se muestran aquí se utilizó una viga FIB inclinada 11° con respecto a la superficie de la rejilla (45° pre-inclinación de la lanzadera FIB; 18° inclinación de la etapa). Se transfirieron las posiciones de interés y se dibujaron manualmente los patrones de FIB (Figura 6D) midiendo la distancia de las posiciones predichas en relación con los puntos de referencia prominentes en la imagen de FIB (por ejemplo, agujeros, contaminaciones de hielo, cuentas de referencia). La precisión del registro se evaluó omitiendo deliberadamente las perlas que podían identificarse claramente en la imagen FLM e IB, y luego comparando sus posiciones reales y predichas en la vista del haz de iones (por ejemplo, el diamante en la Figura 6B, C). Se encontró que la correlación para el cuadrado que se muestra en la Figura 6C era precisa (es decir, la posición predicha de las posiciones de las cuentas de FLM coincidía perfectamente con su ubicación IB correspondiente y 3DCT informó valores RMSE de subpíxeles para el registro). Por lo tanto, las láminas se cortaron en las posiciones predichas (Sitio B) y se fresaron finamente hasta un espesor de ~ 200 nm (desplazamiento final del patrón).
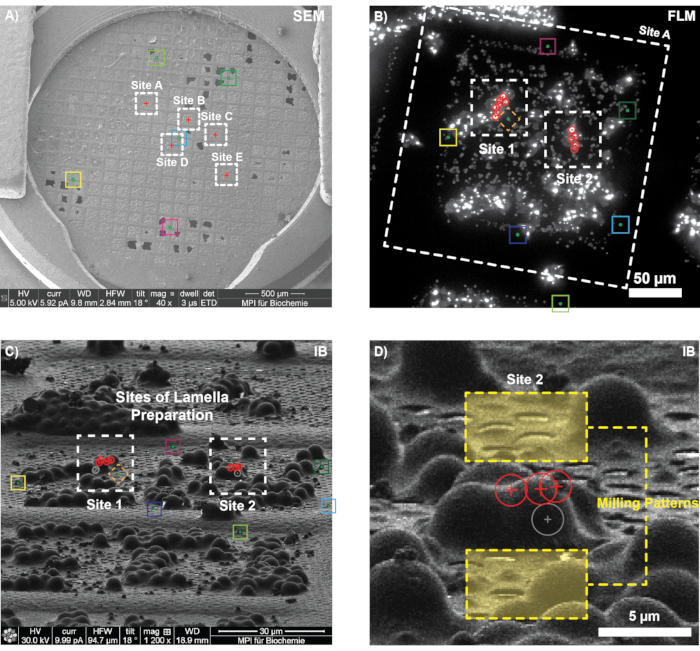
Figura 6: Resultados representativos de la focalización correlativa 3D de los depósitos de proteínas endocíticas (END) en levaduras. (A) Visión general SEM de la rejilla antes de la fresa. Los recuadros de colores indican los cuadrados de la cuadrícula para los que se tomaron pilas de fluorescencia de antemano. (B-C) Correlación 3D en un cuadrado de cuadrícula. Después de registrar varias cuentas fiduciales correspondientes (cajas de colores) en los datos de FLM (B, que se muestra aquí como proyección de máxima intensidad) y la imagen del haz de iones (C), se verificó la precisión del registro 3D mediante la predicción de la posición de la cuenta indicada con el diamante. A continuación, se predijeron las posiciones de la señal objetivo (círculos rojos) en la vista del haz de iones para dos posibles sitios de fresado. (D) Ampliación del sitio B que muestra las posiciones predichas de tres puntos de destino (círculos rojos) y los patrones de fresado iniciales (cuadros amarillos). Se predijo que un cuarto punctum de fluorescencia sería mucho más bajo que los otros puncta y, por lo tanto, no se dirigiría durante la molienda (círculo gris). Haga clic aquí para ver una versión más grande de esta figura.
Después de un exitoso fresado FIB y la transferencia de la rejilla al microscopio electrónico de criotransmisión (Titan Krios operaba a 300 kV y estaba equipado con un detector de electrones directos Gatan K2 y un filtro de energía Bioquantum), se registró una descripción general de la rejilla en SerialEM y se utilizó para localizar cuadrados con láminas. Para cada lámina, se adquirieron imágenes generales y los datos de FLM se registraron en 3DCT (3D-2D) utilizando los cordones de referencia correspondientes. A continuación, se predijeron las posiciones de las características biológicas de interés (Figura 7A) utilizando la transformación calculada a partir de las cuentas de referencia. Se cosieron las vistas generales de las láminas registradas con mayor aumento y se correlacionaron los sitios de interés utilizando puntos de referencia claramente visibles (por ejemplo, cuentas de referencia). Alternativamente, los resúmenes clásicos de CLEM se pueden producir en varios softwares10,12.
Con base en la correlación, se encontraron cuatro sitios potenciales para la adquisición de tomografías para la lámina que se muestra en la Figura 7A. Sin embargo, esto también incluye una posición que no fue seleccionada durante el fresado FIB correlacionado en 3D (comparar Figura 6D; círculo gris) y una posición bloqueada por contaminación de hielo (Figura 7; cuadros grises). En consecuencia, solo se pudieron registrar tomografías para dos posiciones (Figura 7B). En general, se logró un éxito de correlación de ~75%, es decir, se encontraron láminas que sobrevivieron a la transferencia a las estructuras TEM y END en los sitios predichos (12 sitios correlacionados). Después de la reconstrucción de la tomografía, la segmentación y la coincidencia de plantillas, las estructuras END individuales se pueden visualizar dentro de su contexto nativo (Figura 7C, D). Esto incluye el retículo endoplásmico (RE) fenestrado que rodea el END, las gotas de lípidos que ocasionalmente entran en contacto y los ribosomas, que se excluyen del compartimento LLPS. En conjunto, esto muestra cómo la molienda FIB correlativa en 3D puede proporcionar información a nivel molecular de procesos biológicos raros de células intactas.
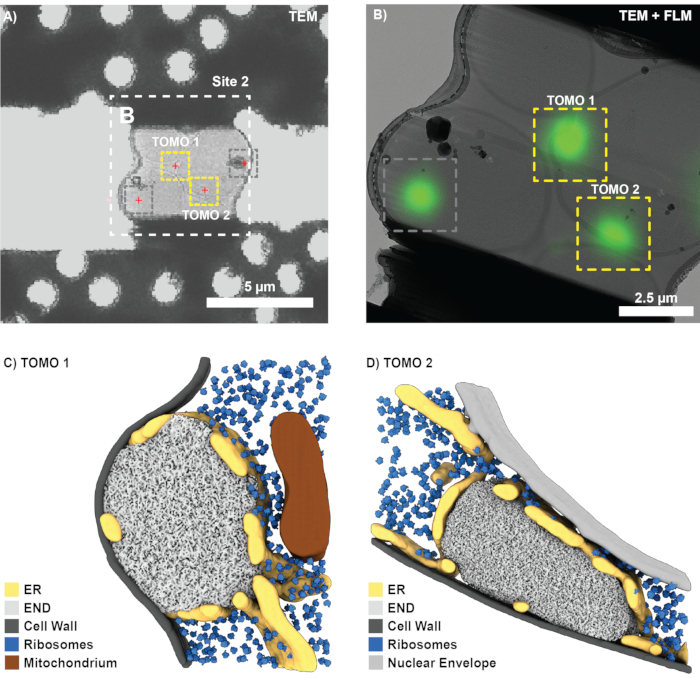
Figura 7: Resultados representativos para visualizar el END con crio-ET. (A) La visión general de TEM de bajo aumento del sitio de molienda que se muestra en la Figura 6 se puede correlacionar fácilmente con la proyección de intensidad máxima de FLM (Figura 6B) para localizar características biológicas de interés (cruces rojas). (B) En un segundo paso, se puede correlacionar una vista de mayor aumento (cosida) y se configuran las posiciones para la adquisición de tomografías (cuadros amarillos). Se ignoraron las ubicaciones resultantes de la señal fuera del plano (cuadro gris, comparar la Figura 6D). (C-D) Utilizando este enfoque de FIB correlativo en 3D, el depósito de proteína endocítica (END) se puede visualizar en su entorno nativo. Se pueden identificar y visualizar estructuras como el retículo endoplásmico (RE), los ribosomas, las membranas y las gotas de lípidos. Haga clic aquí para ver una versión más grande de esta figura.
| Configuración del limpiador de plasma | |||
| Limpiador de plasma Harrick PDG-3XG : | Estabilización por radiofrecuencia: "HI", 30 s; Plasma de N2 | ||
| Ajustes del émbolo | |||
| TFS Vitrobot Mk IV: | 100% de humedad; fuerza de transferencia = 8; tiempo de borrado = 10 s; tiempo de espera 0 s; (esto debería funcionar para la mayoría de las células en suspensión y adherentes) | ||
| Posiciones y horarios de FIB GIS | |||
| Quanta 3D FEG: | Inclinación = 0, Rotación = -180, Posición Z = 13,5, Consigna de temperatura =26,15°, Tiempo = 8 s | ||
| TFS Scios: | Inclinación = 0, Rotación = -180, Posición Z = 9,8, Consigna de temperatura = 28° C, Tiempo = 7 s | ||
| TFS Aquilos 1: | Posición predefinida por software, Punto de ajuste de temperatura = 28°, Tiempo = 7 s | ||
| TFS Aquilos 2: | Posición predefinida por software, Punto de ajuste de temperatura = 28°, Tiempo = 7 s | ||
| Configuración del recubridor por pulverización catódica FIB | |||
| Sistema de quórum: | En la cámara de preparación del quórum: 10 mA, 40 s | ||
| TFS Scios: | 10 W, 500 V, 250 mA, 0,2 mbar, 15 s | ||
| TFS Aquilos 1: | 1 kV, 10 mA, 10 Pa, 15 s | ||
| TFS Aquilos 2: | 1 kV, 10 mA, 10 Pa, 15 s | ||
| Adquisición de tomografías | |||
| Titán Krios Gi2 | Cámara K2, filtro de energía Gatan Bioquantum | ||
| Ranura de 20 eV; esquema de inclinación simétrica de la dosis (Hagen) con pasos de 2°; desde +10° (preinclinación de la lámina) hasta +70° y -50° | |||
| Titán Krios Gi4 | Halcón 4; Filtro de energía Selectris X | ||
| Ranura de 10 eV; esquema de inclinación simétrica de la dosis (Hagen) con pasos de 2°; desde +10° (preinclinación de la lámina) hasta +70° y -50° | |||
| Adquisición de FLM | |||
| Corrsight (modo confocal) | Objetivo: Zeiss EC Plan-Neofluar 40×/0.9 NA Pol; Parámetros de adquisición de pila: tamaño de píxel x-y = 161,25 nm, tamaño de paso z = 300 nm. | ||
| Leica SP8 Cryo-Confocal | Objetivo: Leica HCX PL APO 50x / 0.90 CLEM; Parámetros de adquisición de pila: tamaño de píxel x-y = 84 nm, tamaño de paso z = 300 nm. | ||
Tabla 1: Lista de equipos probados y configuraciones sugeridas.
Discusión
1. Pasos críticos en el protocolo
La optimización de los parámetros de cultivo celular y de inmersión de la red es fundamental para este flujo de trabajo. Al comienzo de un proyecto, vale la pena invertir tiempo para optimizar las estrategias de etiquetado, la distribución de células y cordones de referencia, y probar diferentes parámetros de preparación y transferencia de la cuadrícula. Trabajar con una muestra congelada por inmersión óptima facilitará significativamente el procesamiento posterior.
Como para cualquier experimento TEM, se requieren muestras vítreas. Para las células de mamíferos grandes como HeLa, son preferibles 1-2 células por cuadrado de cuadrícula, pero las células aún pueden ser vítreas a mayor densidad. Opcionalmente, la vitrificación puede mejorarse en células de mamíferos (p. ej., HEK293, HeLa) incubándolas con glicerol al 2,5-10% (v/v) añadido al medio de cultivo 10 min antes de sumergir23. Si se dispone de él, se puede utilizar un patrón de cuadrícula para asegurar una perfecta colocación y distribución de las células, mejorando así la vitrificación y la posterior correlación24.
Si bien se pueden seleccionar celdas específicas durante el flujo de trabajo, muy pocas celdas que muestren la característica biológica de interés reducirán significativamente el rendimiento general. Para mejorar la correlación en las células POI positivas, se deben utilizar fluoróforos suficientemente brillantes. Esto es especialmente importante a nivel de expresión endógena. Descubrimos que, en condiciones criogénicas, mVenus a menudo funcionaba mejor que EGFP debido a su mayor brillo25 y al cambio hipsocrático, lo que lo mantiene adecuado para configuraciones de filtros GFP estándar en condiciones criogénicas26. En el caso de estructuras de objetivos no puntuales, también debe tenerse en cuenta el equilibrio entre la longitud de onda y la precisión de localización (límite de difracción de Abbe).
La correlación 3D eficiente también requiere que las rejillas sean mecánicamente estables y se manejen con mucho cuidado. Si bien se pueden usar rejillas estándar de oro o cobre con soporte de carbono, la tasa de éxito puede aumentar significativamente mediante el uso de películas de SiO2 más rígidas según el proyecto. Sin embargo, aún no se ha determinado de manera concluyente si (a) la estabilidad mecánica o (b) la coincidencia de los coeficientes de expansión térmica (sustrato vs. película) para reducir las arrugas criogénicas27, es el factor más crucial para una correlación 3D exitosa. Además, para recoger rejillas frágiles de Au, se pueden utilizar platos recubiertos de polidimetilsiloxano5.
Además de garantizar la estabilidad de la muestra, es necesaria una elección cuidadosa de los parámetros de imagen de FLM para obtener pilas de fluorescencia de alta calidad que sean adecuadas para una orientación óptima durante la molienda FIB. En este sentido, también se aconseja probar diferentes técnicas de eliminación de ruido28 o deconvolución en los datos de FLM, ya que puede mejorar considerablemente la localización de las señales fiduciales y celulares. Al correlacionar la señal de fluorescencia con las imágenes FIB-SEM, es importante un buen muestreo de perlas de referencia. Deben estar bien distribuidos alrededor de las células y posiblemente a diferentes alturas z. También es una buena práctica validar la consistencia de la correlación comprobando las posiciones predichas frente a las reales de las cuentas que se dejaron deliberadamente fuera del modelo fiducial, pero que se pueden correlacionar claramente a simple vista. Los valores RMSE de 3DCT también deben tenerse siempre en cuenta para comprobar la coherencia del registro.
Dado que la deposición de material molido y agua residual de la cámara FIB-SEM (es decir, la recontaminación) aumenta el espesor efectivo de las láminas al agregar material amorfo a ambos lados de la misma, mantener las láminas finamente molidas en el microscopio durante un tiempo prolongado generalmente reduce la calidad de los datos TEM debido a eventos adicionales de dispersión de electrones. En consecuencia, el fresado se realiza con mayor frecuencia en dos pasos: primero, todas las posiciones se fresan aproximadamente (es decir, a aproximadamente 800 nm) y luego finamente (a ~ 150-250 nm), y la rejilla se descarga inmediatamente después de que se haya completado la última lámina. Sin embargo, se puede lograr un mejor éxito de correlación procesando las posiciones de interés de manera específica por sitio, realizando así un fresado de desbaste y fino en la misma lámina directamente una después de la otra, ya que esto no deja tiempo para la flexión o la deformación. Esto, sin embargo, reduce el número máximo de láminas que se pueden producir por rejilla en función de la tasa de recontaminación del sistema. Para una velocidad de 20 nm/h, se producen 4-6 láminas en 1-1,5 h.
El movimiento de toda la rejilla o de las láminas fresadas en bruto >300 nm dará lugar a una correlación deficiente o infructuosa (véanse también las limitaciones que se analizan a continuación). Por lo tanto, debe comprobarse regularmente, por ejemplo, comparando las imágenes IB antes, durante y después del fresado FIB. Los sitios que muestran un movimiento significativo (>300 nm) deben descartarse. Optimice la preparación de la muestra (es decir, la elección del tipo de rejilla, la densidad celular y los parámetros de inmersión; consulte la sección 1 del protocolo) y la estrategia de molienda para evitar estos movimientos. La flexión de las láminas se puede reducir significativamente mediante el fresado en el sitio como se describe en el paso 3.6 y la reducción del ancho de la lámina. Como se mencionó anteriormente, si bien los cortes de alivio de tensión15 se han diseñado para reducir la flexión de la lámina, a menudo dan como resultado un movimiento concertado de la lámina desacoplada, lo que evita efectivamente la correlación. Se pueden utilizar sistemas FLM integrados para resolver este problema.
2. Modificaciones y problemas del método
Se recomienda encarecidamente realizar una caracterización exhaustiva de la muestra en imágenes de células vivas antes de pasar a criocondiciones. La optimización de las muestras celulares, los esquemas de tratamiento y saber qué tipo de señal esperar antes de entrar en el flujo de trabajo criogénico puede mejorar sustancialmente su tasa de éxito.
En el flujo de trabajo que se presenta aquí, se utiliza un microscopio de fluorescencia independiente con una etapa criogénica para obtener imágenes de las muestras, seguido de una transferencia de las rejillas al microscopio de haz de iones enfocado. Sin embargo, se ha probado en sistemas en los que se integra un microscopio de fluorescencia en la cámara FIB-SEM, por lo que no se requiere transferencia de muestras para adquirir imágenes de fluorescencia 29,30,31. Con estos sistemas integrados, se pueden obtener imágenes de las posiciones de interés durante y después del fresado FIB para comprobar la presencia de la señal de fluorescencia objetivo sin aumentar el riesgo de contaminación de las láminas finales. Sin embargo, es importante tener en cuenta los parámetros ópticos de los microscopios utilizados, ya que, por ejemplo, un objetivo de NA bajo limitará la precisión con la que se pueden localizar las perlas de referencia y las señales de destino. No obstante, las configuraciones integradas de FLM también ayudarán a tratar mejor las ligeras deformaciones de las rejillas y láminas, ya que las pilas de FLM se pueden actualizar continuamente y comparar con las vistas actualizadas de SEM e IB.
Como alternativa a la obtención de imágenes de fluorescencia de las láminas entre el fresado FIB y la adquisición de datos TEM, se puede utilizar la correlación post-TEM para verificar la correcta colocación y fresado de las láminas 5,6.
Durante todos los pasos del flujo de trabajo correlativo, pero especialmente durante TEM, se recomienda crear una superposición de los datos de fluorescencia proyectados en las imágenes FIB-SEM/TEM. Estas vistas clásicas de CLEM ayudan a comprender de forma más intuitiva qué parte de las células está contenida dentro de las láminas. Esto también sirve como una comprobación de cordura útil para verificar la precisión de la correlación.
3. Limitaciones del método
El enfoque FIB correlativo en 3D requiere muestras que se puedan suministrar con cuentas de referencia. En consecuencia, este método está actualmente restringido a las rejillas congeladas por inmersión. En el caso de las muestras (tejidos) congeladas a alta presión (HPF), actualmente solo se pueden realizar correlaciones 2D-2D. Potencialmente, los marcadores fiduciales internos (p. ej., orgánulos, gotas lipídicas teñidas) podrían ser una solución a este problema32,33. La tasa de éxito de la correlación final depende de muchos factores, incluida la calidad de la muestra, la configuración de la microscopía de fluorescencia, el grosor de la lámina y el tamaño de la estructura objetivo. Se estima que la precisión de la correlación utilizando el enfoque de registro 3D descrito está en el rango de 200-300 nm en la imagen final de IB, lo que corresponde aproximadamente al espesor típico de las láminas fresadas por FIB7. En consecuencia, las estructuras celulares mucho más pequeñas que esto serán difíciles de atacar en la actualidad. Además, el movimiento excesivo en el sitio de fresado (>300 nm) también reduce la precisión de la correlación, un problema que potencialmente se puede abordar con configuraciones FLM integradas en instrumentos FIB / SEM. En cualquier caso, las láminas que presenten una fuerte deformación o flexión durante el fresado deben excluirse del flujo de trabajo posterior.
En general, las imágenes de criofluorescencia están actualmente limitadas por el criterio de difracción de Abbe. Con una aplicación más rutinaria (y comercialización) de los métodos crio-FLM superresueltos, podría ser posible una orientación más precisa de las estructuras celulares, especialmente cuando se integra en el FIB/SEM para su operación sobre la marcha.
4. Importancia del método
Especialmente en comparación con las técnicas no dirigidas y de post-correlación, el enfoque de fresado FIB correlacionado en 3D permite la selección de posiciones adecuadas antes del paso TEM que consume tiempo y recursos. De este modo, permite una recopilación de datos y una planificación de proyectos más eficientes. Además, los datos de fluorescencia correlacionados añaden una capa de información que puede ser crucial para interpretar los tomogramas y para integrar los resultados de la crio-ET en proyectos multiescala, especialmente cuando se trata de conjuntos de proteínas no estructurados o demasiado pequeños para la coincidencia de plantillas y el promedio de subtomogramas.
5. Importancia y posibles aplicaciones futuras
En combinación con flujos de trabajo avanzados como la crio-elevación de muestras de HPF 34,35, el crio-FIB-SEM volumen 36 y las imágenes de fluorescencia de superresolución 26,37,38,39, la preparación de lamelas dirigida en 3D ofrece la posibilidad no solo de diseccionar procesos biológicos en células aisladas, sino también de hacer que las muestras de tejidos y pacientes sean accesibles para la molienda FIB y la tomografía crioelectrónica. Como tal, permitirá la disección de procesos patológicos a alta resolución y, por lo tanto, será un componente integral hacia una biopsia a nanoescala.
Divulgaciones
Los autores declaran no tener conflictos de intereses.
Agradecimientos
Agradecemos a Inga Wolf por su apoyo a la infraestructura informática, a Florian Beck por su apoyo computacional y a Oda H. Schiøtz por la lectura crítica del manuscrito. La financiación se proporcionó en parte a través de una beca Alexander von Humboldt para retornados a Philipp S. Erdmann y una beca a largo plazo EMBO ALTF 764-2014 para Florian Wilfling. Anna Bieber recibió el apoyo de una beca de doctorado del Boehringer Ingelheim Fonds.
Materiales
| Name | Company | Catalog Number | Comments |
| Autogrids | Thermo Fisher Scientific / Homemade | 1036173 (no cutout), 1205101 (with cutout) | |
| C-rings | Thermo Fisher Scientific | 1036171 | |
| Corrsight with cryo module | Thermo Fisher Scientific | FLM Alternative 1 | |
| Dynabeads MyOne COOH | Thermo Fisher Scientific | 65011 | recommended 1 µm fiducial beads |
| EM Grids R1/4 SiO2 | Quantifoil | N1-S13nAu20-01 | |
| Falcon 4 camera w. post-column Selectris X energy filter | Thermo Fisher Scientific | Camera/Filter Alternative 1 | |
| FIB Aquilos 1 | Thermo Fisher Scientific | FIB Alternative 1 | |
| FIB Aquilos 2 | Thermo Fisher Scientific | FIB Alternative 2 | |
| FIB Quanta 3D FEG | Thermo Fisher Scientific | FIB Alternative 3 | |
| FIB Scios | Thermo Fisher Scientific | FIB Alternative 4 | |
| K2 summit camera w. post-column energy filter 968 Quantum K2 | Gatan | Camera/Filter Alternative 2 | |
| Leica TCS SP8 with cryo module | Thermo Fisher Scientific | FLM Alternative 2 | |
| Plasma Cleaner PDC-3XG | Harrick | ||
| Teflon Sheet (0.25 mm) | plastx24.de | 11645 | Cut to same dimensions as filter paper |
| TEM Titan Krios XFEG 300 kV Gi2 | Thermo Fisher Scientific | TEM Alternative 1 | |
| TEM Titan Krios XFEG 300 kV Gi4 | Thermo Fisher Scientific | TEM Alternative 2 | |
| THUNDER Imager EM Cryo CLEM | Thermo Fisher Scientific | FLM Alternative 3 | |
| Vitrobot Mark IV | Thermo Fisher Scientific | alternativevly, use manaual plunger | |
| Whatman filter paper | Sigma Aldrich | 10311807 | 55 mm diamater; needs to be cut to fit the Vitrobot |
Referencias
- Beck, M., Baumeister, W. Cryo-Electron tomography: Can it reveal the molecular sociology of cells in atomic detail. Trends in Cell Biology. 26 (11), 825-837 (2016).
- Plitzko, M., Villa, E., Schaffer, M., Baumeister, W. Opening windows into the cell focused-ion-beam milling for cryo-electron tomography. Current Opinion in Structural Biology. 23, 771-777 (2013).
- Schaffer, M., et al. Optimized cryo-focused ion beam sample preparation aimed at in situ structural studies of membrane proteins. Journal of Structural Biology. 197 (2), 73-82 (2017).
- Tegunov, D., Xue, L., Dienemann, C., Cramer, P., Mahamid, J. Multi-particle cryo-EM refinement with M visualizes ribosome-antibiotic complex at 3.5 Å in cells. Nature Methods. 18 (2), 186-193 (2021).
- Klein, S., Wachsmuth-Melm, M., Winter, S. L., Kolovou, A., Chlanda, P. Cryo-correlative light and electron microscopy workflow for cryo-focused ion beam milled adherent cells. Methods in Cell Biology. 162, 273-302 (2021).
- Klein, S., et al. Post-correlation on-lamella cryo-CLEM reveals the membrane architecture of lamellar bodies. Communications Biology. 4 (1), 1-12 (2021).
- Arnold, J., et al. Site-Specific Cryo-focused ion beam sample preparation guided by 3D correlative microscopy. Biophysical Journal. 110 (4), 860-869 (2016).
- Wilfling, F., et al. A selective autophagy pathway for phase-separated endocytic protein deposits. Molecular Cell. 80 (5), 764-778 (2020).
- . Scientific volume imaging, Nyquist calculator Available from: https://svi.nl/NyquistCalculator (2021)
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- de Chaumont, F., et al. Icy: an open bioimage informatics platform for extended reproducible research. Nature Methods. 9 (7), 690-696 (2012).
- . 3DCT Available from: https://3dct.semper.space/ (2021)
- Klumpe, S., et al. A modular platform for streamlining automated cryo-FIB workflows. bioRxiv. , 444745 (2021).
- Wolff, G., et al. Mind the gap: Micro-expansion joints drastically decrease the bending of FIB-milled cryo-lamellae. Journal of Structural Biology. 208 (3), 0 (2019).
- Buckley, G., et al. Automated cryo-lamella preparation for high-throughput in-situ structural biology. Journal of Structural Biology. 210 (2), 107488 (2020).
- Tacke, S., et al. A streamlined workflow for automated cryo focused ion beam milling. bioRxiv. , 963033 (2020).
- Zachs, T., et al. Fully automated, sequential focused ion beam milling for cryo-electron tomography. eLife. 9, e52286 (2020).
- . tools3dct Available from: https://github.com/hermankhfung/tools3dct (2021)
- Mastronarde, D. N. Automated electron microscope tomography using robust prediction of specimen movements. Journal of Structural Biology. 152 (1), 36-51 (2005).
- Yang, J. E., Larson, M. R., Sibert, B. S., Shrum, S., Wright, E. R. CorRelator: Interactive software for real-time high precision cryo-correlative light and electron microscopy. Journal of Structural Biology. 213 (2), 107709 (2021).
- Hagen, W. J. H., Wan, W., Briggs, J. A. G. Implementation of a cryo-electron tomography tilt-scheme optimized for high resolution subtomogram averaging. Journal of Structural Biology. 197 (2), 191-198 (2017).
- Bäuerlein, F. J. B., et al. In situ architecture and cellular interactions of polyQ inclusions. Cell. 171 (1), 179-187 (2017).
- Toro-Nahuelpan, M., et al. Tailoring cryo-electron microscopy grids by photo-micropatterning for in-cell structural studies. Nature Methods. 17 (1), 50-54 (2020).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nature Methods. 2 (12), 905-909 (2005).
- Kaufmann, R., et al. Super-resolution microscopy using standard fluorescent proteins in intact cells under cryo-conditions. Nano Letters. 14 (7), 4171-4175 (2014).
- Booy, F. P., Pawley, J. B. Cryo-crinkling: what happens to carbon films on copper grids at low temperature. Ultramicroscopy. 48 (3), 273-280 (1993).
- Krull, A., Buchholz, T. O., Jug, F. Noise2void-Learning denoising from single noisy images. Proceedings of the IEEE Computer Society Conference on Computer Vision and Pattern Recognition. 2019, 2124-2132 (2019).
- Gorelick, S., et al. PIE-scope, integrated cryo-correlative light and FIB/SEM microscopy. eLife. 8, 1-15 (2019).
- . Delmic METEOR Available from: https://www.delmic.com/en/products/cryo-solutions/meteor (2021)
- . iFLM Available from: https://assets.thermofisher.com/TFS-Assets/MSD/Datasheets/iflm-aquilos-datasheet-ds0366.pdf (2021)
- Mahamid, J., et al. Liquid-crystalline phase transitions in lipid droplets are related to cellular states and specific organelle association. Proceedings of the National Academy of Sciences of the United States of America. 116 (34), 16866-16871 (2019).
- Scher, N., Rechav, K., Paul-Gilloteaux, P., Avinoam, O. In situ fiducial markers for 3D correlative cryo-fluorescence and FIB-SEM imaging. iScience. 24 (7), 102714 (2021).
- Mahamid, J., et al. A focused ion beam milling and lift-out approach for site-specific preparation of frozen-hydrated lamellas from multicellular organisms. Journal of Structural Biology. 192, 262-269 (2015).
- Schaffer, M., et al. A cryo-FIB lift-out technique enables molecular-resolution cryo-ET within native Caenorhabditis elegans tissue. Nature Methods. 16 (8), 757-762 (2019).
- Wu, G. -. H., et al. Multi-scale 3D cryo-correlative microscopy for vitrified cells. Structure. 28 (11), 1231-1237 (2020).
- Liu, B., et al. Three-dimensional super-resolution protein localization correlated with vitrified cellular context. Scientific Reports. 5, 13017 (2015).
- Weisenburger, S., Jing, B., Renn, A., Sandoghdar, V. Cryogenic localization of single molecules with angstrom precision. SPIE NanoScience + Engineering. 8815, (2013).
- Tuijtel, M. W., Koster, A. J., Jakobs, S., Faas, F. G. A., Sharp, T. H. Correlative cryo super-resolution light and electron microscopy on mammalian cells using fluorescent proteins. Scientific Reports. 9 (1), 1-11 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados