Method Article
Protocolos optimizados de muestreo óseo para la recuperación de ADN antiguo de restos arqueológicos
En este artículo
Resumen
El protocolo presenta una serie de protocolos de mejores prácticas para la recolección de polvo óseo de ocho ubicaciones de muestreo anatómico recomendadas (ubicaciones específicas en un elemento esquelético dado) a través de cinco elementos esqueléticos diferentes de individuos medievales (radiocarbono fechado en un período de ca. 1040-1400 CE, rango calibrado 2-sigma).
Resumen
Los métodos presentados aquí buscan maximizar las posibilidades de recuperación de ADN humano de restos arqueológicos antiguos al tiempo que limitan el material de muestra de entrada. Esto se hizo apuntando a lugares de muestreo anatómico previamente determinados para producir las mayores cantidades de ADN antiguo (ADNa) en un análisis comparativo de la recuperación de ADN en todo el esqueleto. Investigaciones anteriores han sugerido que estos protocolos maximizan las posibilidades de recuperación exitosa del ADN humano y patógeno antiguo de restos arqueológicos. Los rendimientos de ADN fueron evaluados previamente por Parker et al. 2020 en una amplia encuesta de preservación de ADNa a través de múltiples elementos esqueléticos de 11 individuos recuperados del cementerio medieval (datado por radiocarbono en un período de alrededor de (ca.) 1040-1400 CE, rango calibrado 2-sigma) en Krakauer Berg, un asentamiento medieval abandonado cerca de Peißen, Alemania. Estos ocho puntos de muestreo, que abarcan cinco elementos esqueléticos (pars petrosa, molares permanentes, vértebras torácicas, falange distal y astrágalo) produjeron con éxito ADN humano antiguo de alta calidad, donde los rendimientos fueron significativamente mayores que el promedio general en todos los elementos e individuos. Los rendimientos fueron adecuados para su uso en los análisis genéticos poblacionales más comunes aguas abajo. Nuestros resultados apoyan el uso preferencial de estos lugares de muestreo anatómico para la mayoría de los estudios que involucran el análisis de ADN humano antiguo de restos arqueológicos. La implementación de estos métodos ayudará a minimizar la destrucción de preciosos especímenes arqueológicos.
Introducción
El muestreo de restos humanos antiguos con fines de recuperación y análisis de ADN es inherentemente destructivo 1,2,3,4. Las muestras en sí mismas son especímenes preciosos y la preservación morfológica debe preservarse siempre que sea posible. Como tal, es imperativo que las prácticas de muestreo se optimicen para evitar la destrucción innecesaria de material irremplazable y maximizar la probabilidad de éxito. Las técnicas actuales de mejores prácticas se basan en una pequeña cohorte de estudios limitados a estudios forenses5,6, estudios de especímenes antiguos donde el desarrollo de un muestreo óptimo no es el objetivo directo del estudio7, o estudios dedicados que utilizan restos no humanos8 o dirigidos a una selección muy pequeña de lugares de muestreo anatómico (utilizados aquí para denotar un área específica de un elemento esquelético del cual el polvo óseo, para su uso en análisis de ADN aguas abajo, se generó)9,10. Los protocolos de muestreo presentados aquí fueron optimizados en el primer estudio sistemático a gran escala de preservación de ADN a través de múltiples elementos esqueléticos de múltiples individuos11. Todas las muestras provienen de elementos óseos recuperados de 11 individuos excavados en el cementerio de la iglesia del asentamiento medieval abandonado de Krakauer Berg cerca de Peißen, Sajonia-Anhalt, Alemania (ver Tabla 1 para datos demográficos detallados de la muestra) y, como tal, pueden necesitar modificaciones para su uso con muestras fuera de este rango geográfico / temporal.
| Individual | Sexo | Edad estimada de muerte | 14 Fechas C (CE, Cal 2-sigma) |
| KRA001 | Masculino | 25-35 | 1058-1219 |
| KRA002 | Hembra | 20-22 | 1227-1283 |
| KRA003 | Masculino | 25 | 1059-1223 |
| KRA004 | Masculino | 15 | 1284-1392 |
| KRA005 | Masculino | 10-12 | 1170-1258 |
| KRA006 | Hembra | 30-40 | 1218-1266 |
| KRA007 | Hembra | 25-30 | 1167-1251 |
| KRA008 | Masculino | 20 | 1301-1402 |
| KRA009 | Masculino | Desconocido | 1158-1254 |
| KRA010 | Masculino | 25 | 1276-1383 |
| KRA011 | Hembra | 30-45 | 1040-1159 |
Tabla 1: Sexo determinado genéticamente, edad estimada de muerte determinada arqueológicamente y datación por radiocarbono (14C Cal 2-sigma) para los 11 individuos muestreados. Esta tabla ha sido adaptada de Parker, C. et al. 202011.
Estos protocolos permiten una generación relativamente sencilla y eficiente de polvo óseo a partir de ocho ubicaciones de muestreo anatómico a través de cinco elementos esqueléticos (incluida la pars petrosa) con contaminación limitada de ADN inducida por laboratorio. De estos cinco elementos esqueléticos, se ha determinado que siete lugares de muestreo anatómico encontrados en cuatro elementos esqueléticos son alternativas viables al muestreo destructivo de la pirámide petrosa11,12. Estos incluyen el cemento, la dentina y la cámara pulpar de los molares permanentes; hueso cortical recogido de la muesca vertebral superior, así como del cuerpo de las vértebras torácicas; hueso cortical derivado de la superficie inferior del mechón apical y el eje de las falanges distales; y el hueso cortical denso a lo largo de la porción exterior del tali. Si bien existen varios métodos ampliamente aplicados para el muestreo de la pars petrosa 4,12,13,14, dentina y la cámara de la pulpa dental 1,2,15, los métodos publicados describen la generación exitosa de polvo óseo a partir del cemento 16 , el cuerpo vertebral, la muesca vertebral inferior y el astrágalo pueden ser difíciles de obtener. Como tal, aquí demostramos protocolos de muestreo optimizados para la pirámide petrosa (paso 3.1); cemento (paso 3.2.1), dentina (paso 3.2.2) y pulpa dental (paso 3.2.3) de molares adultos; hueso cortical del cuerpo vertebral (paso 3.3.1) y arco vertebral superior (paso 3.3.2); la falange distal (paso 3.4); y el astrágalo (paso 3.5) para hacer más accesible el uso efectivo de estos elementos esqueléticos tanto para el ADN como para la investigación forense.
Protocolo
Toda la investigación presentada en este documento se realizó de acuerdo con las pautas establecidas por el Instituto Max Planck para la Ciencia de la Historia Humana, Jena, Alemania, para trabajar con restos humanos antiguos. Antes de realizar cualquier paso de este protocolo, asegúrese de cumplir con todos los requisitos éticos locales / estatales / federales relacionados con la obtención de permiso para el estudio científico y el uso de restos humanos para el muestreo destructivo en su área. Todos los procedimientos/almacenamiento de productos químicos deben realizarse de acuerdo con las directrices de seguridad institucionales individuales.
1. Consideraciones antes del procesamiento de muestras
- Trate las muestras con cuidado, ya que los restos antiguos son un recurso irreplicable y finito (por ejemplo, el muestreo debe ser lo menos derrochador posible, y todos los restos deben devolverse a sus respectivos y legítimos proveedores si es posible).
- Realice todos los pasos en un entorno de sala limpia, preferiblemente en una instalación dedicada al ADN antiguo17,18,19. Use equipo de protección personal (EPP) que consista en monos microporosos estériles con capucha, guantes estériles (dos pares), máscara quirúrgica, gafas protectoras y botas estériles o zapatos antideslizantes con cubiertas estériles (consulte la Tabla de materiales). Cambie los guantes con frecuencia, especialmente entre muestras.
- Limpie y desinfecte minuciosamente todos los equipos y superficies con lejía/solución de descontaminación de ADN/etanol e irradiación UV (longitud de onda: 254 nm) siempre que sea posible (por ejemplo, brocas, taladros, vises/abrazaderas, etc.). Finalmente, se recomienda encarecidamente tomar descansos ergonómicos regulares (cada 2-3 h si es posible) para evitar el agotamiento excesivo debido al ambiente de la sala limpia.
NOTA: Todos los restos óseos deben documentarse adecuadamente (por ejemplo, fotografiados, pesados y, si es posible, escaneados por micro-TC, imágenes en 3D, etc.) antes del muestreo (los protocolos para la documentación apropiada no están cubiertos en este manuscrito). Todos los protocolos de muestreo pueden pausarse entre las iteraciones de muestreo y las muestras pueden almacenarse indefinidamente en un ambiente seco y estéril con temperatura controlada (25 °C).
2. Tratamiento previo
- Descontaminar todos los lugares de muestreo anatómico antes de la generación de polvo óseo para minimizar el riesgo de contaminación18.
NOTA: La eficacia de la lejía y/o la eliminación de superficies (ver NOTA en el paso 3.3.2 para los pasos de eliminación de superficies) para la descontaminación de muestras sigue siendo un tema de debate entre los investigadores de ADNa 8,19,20,21,22,23,24,25 ya que ambos pueden influir en los rendimientos generales de ADN, especialmente en muestras altamente degradadas. Como tal, los siguientes pasos se consideran opcionales y se incluyen aquí, ya que se utilizaron en todas las muestras para generar los resultados representativos presentados en este documento. Se recomienda que el uso de estos protocolos de pretratamiento se determine caso por caso en función de la aplicación molecular, la edad, la rareza y el nivel de degradación morfológica de cada conjunto de muestras.- Realice todas las muestras en una sala limpia dedicada bajo una campana de reacción en cadena de la polimerasa (PCR) equipada con luz UV o un gabinete de bioseguridad con el flujo de aire apagado. Extienda papel de aluminio estéril a través de la mesa de trabajo para atrapar cualquier polvo / fragmento de hueso perdido.
- Asegúrese de que todos los fragmentos óseos se recuperen (para su repatriación) antes de desechar la lámina. Cambie la lámina entre el tratamiento de cada elemento esquelético. Deseche la lámina usada en una bolsa/recipiente de riesgo biológico esterilizable en autoclave.
- Retire la mayor cantidad posible de suciedad/detritus sueltos de los lugares de muestreo anatómico limpiando suavemente el área con una toallita estéril seca sin pelusa (consulte la Tabla de materiales). Deseche las toallitas en bolsas o recipientes de riesgo biológico esterilizables en autoclave.
- Descontamine la superficie limpia limpiando con una toallita estéril humedecida con lejía comercial diluida (~0.01% v / v, diluido con agua ultrapura libre de DNasa / RNasa) y deje incubar durante 5 min. Deseche las toallitas en bolsas o recipientes de riesgo biológico esterilizables en autoclave.
PRECAUCIÓN: La lejía es un producto químico altamente corrosivo y reactivo; por lo tanto, deben tomarse las precauciones de seguridad adecuadas antes de su uso. - Retire la mayor cantidad posible de lejía residual del lugar de muestreo anatómico con una toallita estéril humedecida con agua ultrapura libre de DNasa/RNasa. Deseche las toallitas en bolsas o recipientes de riesgo biológico esterilizables en autoclave.
- Exponga todos los lugares de muestreo anatómico limpios a la radiación UV durante 30 minutos (longitud de onda: 254 nm) y luego deje que se sequen completamente a temperatura ambiente. Asegúrese de que los lugares de muestreo anatómico estén completamente secos antes de proceder con el muestreo o regresar al almacenamiento no solo para facilitar la generación de polvo óseo, sino también para evitar una mayor degradación de la muestra (por ejemplo, moho).
PRECAUCIÓN: La exposición a la radiación UV puede ser perjudicial para los ojos. - Pasar inmediatamente al muestreo o almacenar los elementos óseos en un ambiente estéril seco y con temperatura controlada (25 °C).
3. Generación de polvo óseo
NOTA: Los siguientes protocolos están destinados a su uso en la extracción de ADN siguiendo el protocolo26 de Dabney et al. 2019.
- Muestreo de pars petrosa
NOTA: Este protocolo está adaptado de los procedimientos descritos en Pinhasi et al. 20194 y se presenta aquí para facilitar su uso. Este protocolo no representa el método actual y menos destructivo para el muestreo de pars petrosa. Como tal, se recomienda utilizar el protocolo descrito por Sirak et al. 201713 o Orfanou et al. 202014 para muestras cuya preservación morfológica sea de máxima importancia.- Realice todas las tomas de muestras en una sala limpia dedicada bajo una campana de PCR equipada con luz UV o un gabinete de bioseguridad (longitud de onda: 254 nm) con el flujo de aire apagado. Extienda papel de aluminio estéril a través de la mesa de trabajo para atrapar cualquier polvo / fragmento de hueso perdido.
- Asegúrese de que todos los fragmentos óseos y la mayor cantidad de polvo posible se recuperen (para la repatriación) antes de desechar el papel de aluminio. Cambie la lámina entre cada muestreo. Deseche la lámina usada en una bolsa/recipiente de riesgo biológico esterilizable en autoclave.
- Asegure el elemento seco y descontaminado con una abrazadera o tornillo esterilizado.
- Corte la pars petrosa por la mitad a lo largo del surco petroso superior (ver Figura 1) usando una sierra de joyero estándar equipada con una hoja de 0.6 mm (ver Tabla de materiales) a velocidad media para evitar el sobrecalentamiento (ver NOTA debajo del paso 3.1.6).
PRECAUCIÓN: La pars petrosa es muy densa y, como tal, puede ser difícil de cortar. Tenga cuidado de mantener el elemento firmemente sujeto para evitar lesiones. Deseche las hojas de sierra rotas en el recipiente de los objetos punzantes apropiados. - Retire las porciones petrosas de la abrazadera. Recupere y guarde cualquier material suelto / excedente.
- Coloque el papel de pesaje en un bote de pesaje estéril
- Sostenga la parte petrosa sobre el papel de pesaje, corte el lado inclinado hacia la bandeja de pesaje. Perfore el hueso cortical denso entre el canal facial y el antro mastoideo (parece más brillante que el material circundante, consulte la Figura 1) utilizando un taladro dental equipado con una broca de calibre pequeño (consulte la Tabla de materiales) y ajustado a velocidad media, torsión media para producir polvo óseo.
NOTA: La perforación / corte debe hacerse en ráfagas cortas a velocidades bajas a medias para evitar el sobrecalentamiento del hueso y potencialmente destruir / dañar el ADN. Como anécdota, cuando la porción densa del petroso comienza a sobrecalentarse, se puede observar un olor descrito como tocino de cocción. Deje de taladrar/aserrar inmediatamente y deje que el hueso descanse hasta que se enfríe lo suficiente antes de reanudarlo. - Repita la perforación hasta que se recojan aproximadamente 50-100 mg de polvo en el papel de pesaje, medido con una balanza adjunta con una precisión de al menos 0,01 mg (consulte la Tabla de materiales).
NOTA: Siempre que sea posible, se sugiere reunir 100 mg de polvo óseo para permitir dos extracciones de ADN replicadas de 50 mg cada una. Sin embargo, esto no siempre es posible debido a la limitación de las ubicaciones de muestreo anatómico en sí (por ejemplo, la falange distal, la cámara de la pulpa dental) o la necesidad de preservación morfológica. Para otros lugares, como el cemento, considerablemente menos de 50 mg del material puede estar disponible. Sin embargo, se ha demostrado que el cemento, la cámara de la pulpa dental y la falange distal producen ADN endógeno significativo 11,27,28, a pesar de la menor entrada inicial de polvo óseo del proceso de extracción. - Transfiera el polvo del papel de pesaje a un tubo de bloqueo seguro de 2 ml etiquetado como de baja unión para su extracción o almacenamiento. Almacenar las muestras a -20 °C, indefinidamente.
- Almacene el hueso restante/exceso de polvo en un ambiente estéril seco y con temperatura controlada (25 °C) hasta que se pueda completar la devolución/repatriación.
- Deseche todos los residuos en bolsas o recipientes de riesgo biológico esterilizables en autoclave. Esterilizar/descontaminar todo el equipo reutilizable (por ejemplo, abrazaderas, brocas, taladros, sierras, etc.) utilizando lejía/solución de descontaminación de ADN/etanol y exposición UV (longitud de onda: 254 nm), según corresponda, entre cada muestreo.
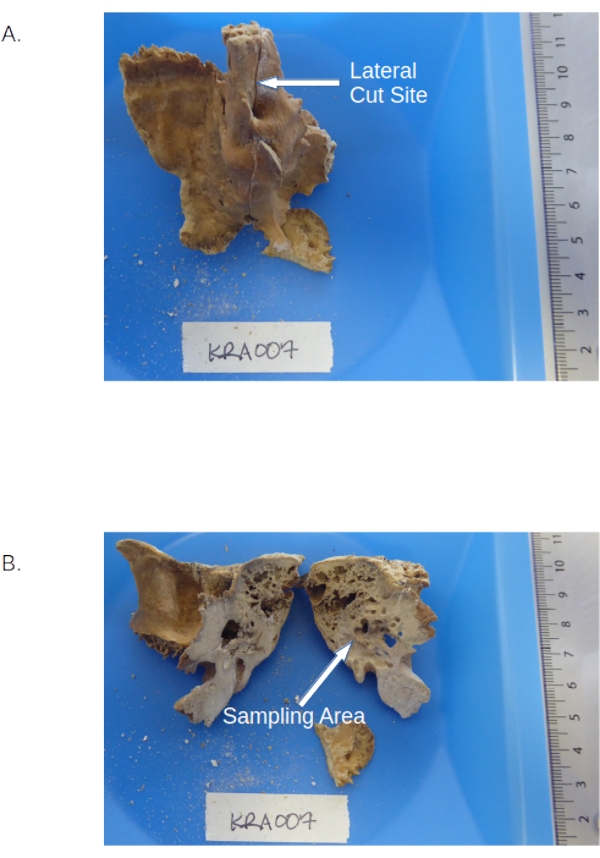
Figura 1: Hueso temporal incluyendo la pars petrosa. (A) Muestra de precorte que muestre las ubicaciones de la pirámide petrosa y el surco petrosa. (B) Porción petrosa post-corte resaltando las áreas densas a perforar. Haga clic aquí para ver una versión más grande de esta figura.
- Muestreo de molares permanentes
NOTA: Para el muestreo de molares permanentes, preseleccionar in situ molares con raíces fusionadas e idealmente sin caries, grietas en el esmalte o desgaste excesivo para obtener mejores resultados. Retire cualquier muestra de cálculo dental y guárdela a -20 °C para posibles análisis futuros del microbioma oral (procedimiento no cubierto aquí).- Muestreo del cemento
- Realice todas las tomas de muestras en una sala limpia dedicada bajo una campana de PCR equipada con luz UV o un gabinete de bioseguridad (longitud de onda: 254 nm) con el flujo de aire apagado. Extienda papel de aluminio estéril a través de la mesa de trabajo para atrapar cualquier polvo / fragmento de hueso perdido.
- Asegúrese de que todos los fragmentos óseos y la mayor cantidad de polvo posible se recuperen (para su repatriación) antes de desechar el papel de aluminio. Cambie la lámina entre cada muestreo. Deseche la lámina usada en una bolsa/recipiente de riesgo biológico esterilizable en autoclave.
- Coloque una hoja de papel de pesaje en una bandeja de pesaje estéril.
- Sujete/asegure el molar descontaminado por el esmalte, con la raíz hacia abajo, sobre una bandeja de pesaje utilizando una abrazadera de mano, como una llave ajustable (consulte la Tabla de materiales).
- Equipe un taladro dental con una rueda de corte circular con bordes de diamante. Con el taladro ajustado a un ajuste de velocidad / par medio, toque ligeramente el borde de la broca hasta la raíz en un ángulo de aproximadamente -20 °.
- Raspa hacia abajo en la bandeja para quitar/recoger el material amarillo más externo de la raíz (cemento). Detenga la recolección cuando el material más claro (blanco) de la dentina se haga visible.
NOTA: Es importante hacer coincidir la dirección de rotación de la broca de corte en relación con la bandeja de recolección para evitar que el polvo se aerosolice y potencialmente desperdicie la muestra al perder la bandeja por completo. El cemento es particularmente rico en ADN; Sin embargo, los rendimientos típicos del material son mucho menores que otros lugares de muestreo anatómico (~7-20 mg)11,27,28. - Registre la masa de polvo recolectado en papel de pesaje utilizando una balanza cerrada con una precisión de al menos 0,01 mg (consulte la Tabla de materiales).
- Transfiera el polvo del papel de pesaje a un tubo de bloqueo seguro y de baja unión de 2 ml para su extracción. Conservar a -20 °C, indefinidamente.
- Muestreo de la cámara pulpar
- Después de que se haya recolectado el cemento (si se desea), seccionar el molar a lo largo de la unión cemento-esmalte usando una sierra de joyero para quitar la corona (ver Figura 2).
- Coloque una nueva hoja de papel de pesaje en una bandeja de pesaje nueva.
- Fije la sección de la corona en una abrazadera o tornillo de mano, sobre la bandeja de pesaje. Mantenga el lado cortado inclinado hacia abajo y perfore / raspe el material como primera pasada con un taladro dental equipado con una broca de perforación de calibre pequeño (consulte la Tabla de materiales) a lo largo de los bordes de la cámara de pulpa dentro de la parte de la corona (consulte la figura 2).
NOTA: Solo el primer paso del interior de la cámara pulpar debe recolectarse y etiquetarse como material pulpar (rendimiento típico de 5-15 mg), cualquier cosa más profunda en el diente se considera dentina. - Gire el diente con la parte inferior hacia abajo, golpee la abrazadera con un martillo y recoja el polvo liberado en el papel de pesaje.
- Registre el peso del polvo recogido en el papel de pesaje utilizando una balanza adjunta con una precisión de al menos 0,01 mg (consulte la Tabla de materiales).
- Transfiera el polvo del papel de pesaje a un tubo de bloqueo seguro de 2 ml de baja unión para su extracción. Conservar a -20 °C, indefinidamente.
- Muestreo de la dentina
- Coloque una nueva hoja de papel de pesaje en una bandeja de pesaje nueva.
- Sujete la sección de la corona sobre la bandeja de pesaje (según el paso 3.2.2.3), perfore y recoja otros 50-100 mg de dentina medidos utilizando una balanza cerrada con una precisión de 0,01 mg (ver Tabla de materiales) desde el interior de la cámara pulpar de la misma manera para un muestreo adicional de dentina (ver Figura 2).
- Transfiera el polvo óseo del papel de pesaje a un tubo de bloqueo seguro de 2 ml de baja unión para su extracción. Conservar a -20 °C, indefinidamente.
- Almacene las piezas dentales restantes/el exceso de polvo en un ambiente estéril seco y con temperatura controlada (25 °C) hasta que se pueda completar la devolución/repatriación.
- Deseche todos los residuos en bolsas o recipientes de riesgo biológico esterilizables en autoclave. Esterilice / descontamine todo el equipo reutilizable (por ejemplo, abrazaderas, brocas, taladros, sierras, etc.) utilizando lejía / solución de descontaminación de ADN / etanol y exposiciones UV (longitud de onda: 254 nm) según corresponda, entre cada muestreo.
- Muestreo del cemento
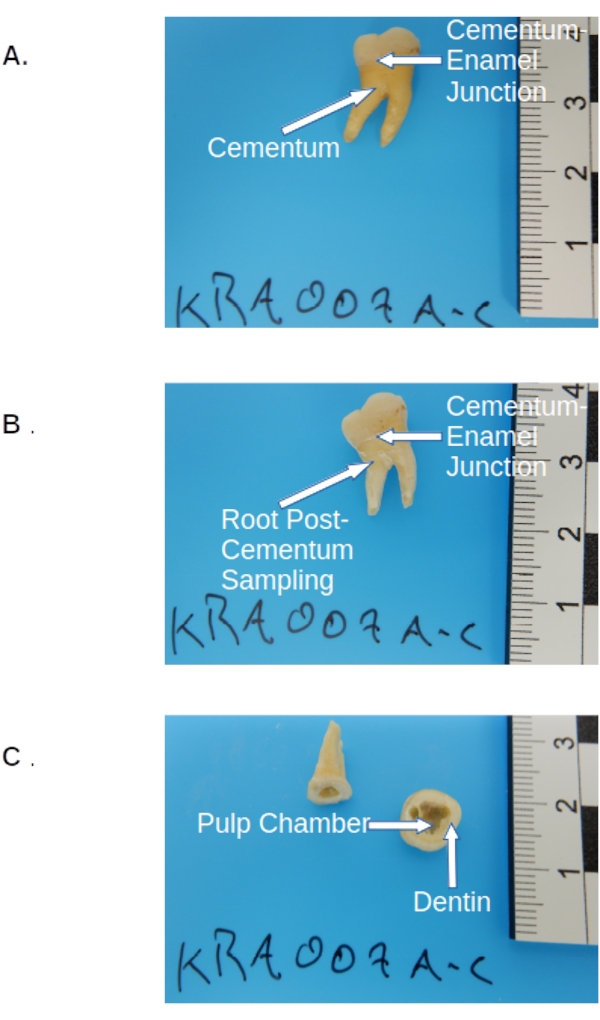
Figura 2: Premuestreo molar permanente. (A) Molar pretratado antes del muestreo, mostrando corona, cemento (capa amarillenta de la raíz) y el sitio de corte en la unión cemento-esmalte. (B) La misma colección molar post-cemento, mostrando el sitio de corte en la unión cemento-esmalte. (C) Postcorte molar y muestreo que muestra las ubicaciones de muestreo anatómico para la cámara de la pulpa dental y la dentina dentro de la corona. Haga clic aquí para ver una versión más grande de esta figura.
- Muestreo de las vértebras torácicas
- Muestreo del cuerpo vertebral
- Realice todas las tomas de muestras en una sala limpia dedicada bajo una campana de PCR equipada con luz UV o un gabinete de bioseguridad (longitud de onda: 254 nm) con el flujo de aire apagado. Extienda papel de aluminio estéril a través de la mesa de trabajo para atrapar cualquier polvo / fragmento de hueso perdido.
- Asegúrese de que todos los fragmentos óseos y la mayor cantidad de polvo posible se recuperen (para su repatriación) antes de desechar el papel de aluminio. Cambie la lámina entre cada muestreo. Deseche la lámina usada en una bolsa/recipiente de riesgo biológico esterilizable en autoclave.
- Coloque una pequeña hoja de papel de pesaje en una bandeja de pesaje estándar.
- Asegure las vértebras con una pinza o una visera de mano, con el cuerpo vertebral hacia afuera.
- Sostenga las vértebras sobre la bandeja de pesaje con el cuerpo vertebral inclinado hacia abajo. Usando un taladro dental equipado con una broca de perforación de calibre pequeño (consulte la Tabla de materiales) ajustada a un par alto de baja velocidad, perfore a lo largo del borde más externo (inferior y superior) del hueso cortical que rodea el tejido interno esponjoso del cuerpo vertebral (consulte la figura 3).
- Raspa la broca contra la capa cortical sobre una bandeja de ponderación estándar hasta que se recojan 50-100 mg de material, medido con una balanza cerrada con una precisión de 0,01 mg (ver Tabla de materiales).
- Transfiera el polvo óseo del papel de pesaje a un tubo de bloqueo seguro y de baja unión de 2 ml para su extracción. Conservar a -20 °C, indefinidamente.
- Muestreo del arco vertebral superior
NOTA: Este paso es opcional. Retire y deseche la capa más externa del hueso cortical del arco vertebral superior utilizando un taladro dental equipado con una broca de perforación de calibre pequeño (ver Tabla de materiales) raspándola a lo largo de la superficie19. Esto no se sugiere para el muestreo del cuerpo vertebral, ya que la capa de hueso cortical es generalmente muy delgada y es probable que se agote por completo por este proceso (ver NOTA en la sección 2).- Coloque una pequeña hoja de papel de pesaje en una bandeja de pesaje estándar.
- Asegure las vértebras en una abrazadera / tornillo de mano con el proceso vertebral hacia afuera, aspecto superior hacia abajo.
- Mientras sostiene las vértebras, aspecto superior hacia abajo, sobre una bandeja de pesaje, perfore hacia arriba en el centro de la muesca en forma de V formada por la fusión del proceso espinoso con las laminillas (ver Figura 3) usando un taladro dental con una broca de calibre pequeño (ver Tabla de materiales) ajustada a baja velocidad y alto torque.
- Deje de perforar cuando haya una caída notable en la resistencia. Cambie ligeramente la posición de perforación y repita hasta que se recojan 50-100 mg de polvo óseo, medido con una balanza cerrada con una precisión de 0,01 mg (consulte la Tabla de materiales).
- Transfiera el polvo óseo del papel de pesaje a un tubo de baja unión de 2 ml para su extracción. Conservar a -20 °C, indefinidamente.
- Almacene el hueso restante/exceso de polvo en un ambiente estéril seco y con temperatura controlada (25 °C) hasta su devolución/repatriación.
- Deseche todos los residuos en bolsas o recipientes de riesgo biológico esterilizables en autoclave. Esterilice / descontamine todo el equipo reutilizable (por ejemplo, abrazaderas, brocas, taladros, sierras, etc.) utilizando lejía/solución de descontaminación de ADN/etanol y exposición UV (longitud de onda: 254 nm), según corresponda, entre cada muestreo.
- Muestreo del cuerpo vertebral

Figura 3: Ubicaciones de muestreo anatómico del hueso cortical del cuerpo vertebral y del arco vertebral superior de la vértebra torácica. Haga clic aquí para ver una versión más grande de esta figura.
- Muestreo de la falange distal
NOTA: Este paso es opcional. Retire y deseche la capa más externa del hueso cortical del eje y/o del mechón apical utilizando un taladro dental equipado con una broca de perforación de pequeño calibre raspándola a lo largo de la superficie19. Esto puede no ser posible para muestras con hueso cortical excesivamente delgado o restos juveniles (ver NOTA en la sección 2).- Realice todas las tomas de muestras en una sala limpia dedicada, bajo una campana de PCR equipada con luz UV o un gabinete de bioseguridad (longitud de onda UV: 254 nm) con el flujo de aire apagado. Extienda papel de aluminio estéril a través de la mesa de trabajo para atrapar cualquier polvo / fragmento de hueso perdido.
- Asegúrese de que todos los fragmentos óseos y la mayor cantidad de polvo posible se recuperen (para su repatriación) antes de desechar el papel de aluminio. Cambie la lámina entre cada muestreo. Deseche la lámina usada en una bolsa/recipiente de riesgo biológico esterilizable en autoclave.
- Coloque una pequeña hoja de papel de pesaje en una bandeja de pesaje estándar.
- Asegure la muestra en abrazadera/tornillo de mano, lado superior hacia arriba.
- Sostenga la muestra sobre la bandeja de pesaje, recoja el polvo óseo del hueso cortical del lado inferior del mechón apical y el eje perforando a través de las capas densas más externas (véase la figura 4) utilizando un taladro dental equipado con una broca de perforación de calibre pequeño (consulte la Tabla de materiales).
- Deje de perforar cuando haya una marcada disminución de la resistencia, ya que esto significa un material más ligero y esponjoso. Repita este proceso, irradiando hacia afuera desde la perforación inicial hasta que se recojan al menos 50-100 mg de polvo óseo, medido con una balanza cerrada con una precisión de 0,01 mg (consulte la Tabla de materiales).
- Transfiera el polvo óseo del papel de pesaje a un tubo de bloqueo seguro de 2 ml de baja unión para su extracción. Conservar a -20 °C, indefinidamente.
- Almacene el hueso restante/exceso de polvo en un ambiente estéril seco y con temperatura controlada (25 °C) hasta su devolución/repatriación.
- Deseche todos los residuos en bolsas o recipientes de riesgo biológico esterilizables en autoclave. Esterilizar/descontaminar todo el equipo reutilizable (p. ej., abrazaderas, brocas, taladros, sierras, etc.) utilizando lejía/solución de descontaminación de ADN/exposición al etanol y a los rayos UV, según corresponda, entre cada muestreo.
NOTA: Para muestras más pequeñas (por ejemplo, muestras juveniles) puede haber considerablemente menos de los 50-100 mg de hueso cortical sugeridos disponibles para la muestra. Sin embargo, incluso en cantidades bajas, se ha demostrado que esta ubicación de muestreo anatómico es particularmente rica en ADN11.

Figura 4: Falange distal que muestra las ubicaciones del hueso cortical denso a lo largo del eje y el lado inferior del mechón apical. Haga clic aquí para ver una versión más grande de esta figura.
- Muestreo del astrágalo
- Realice todas las tomas de muestras en una sala limpia dedicada bajo una campana de PCR equipada con luz UV o un gabinete de bioseguridad (longitud de onda: 254 nm) con el flujo de aire apagado. Extienda papel de aluminio estéril a través de la mesa de trabajo para atrapar cualquier polvo / fragmento de hueso perdido.
- Asegúrese de que todos los fragmentos óseos y la mayor cantidad de polvo posible se recuperen (para su repatriación) antes de desechar el papel de aluminio. Cambie la lámina entre cada muestreo. Deseche la lámina usada en una bolsa/recipiente de riesgo biológico esterilizable en autoclave.
- Coloque una pequeña hoja de papel de pesaje en una bandeja de pesaje estándar.
- Asegure la muestra en una abrazadera/tornillo de mano, cúpula hacia arriba.
- Sostenga el astrágalo, la cúpula hacia arriba y la superficie medial hacia el colector, sobre la bandeja de pesaje. Raspa el hueso cortical del cuello del astrágalo a una profundidad de ~1 mm (ver Figura 5) usando un taladro dental con una broca de calibre bajo (ver Tabla de materiales) ajustada a baja velocidad y alto torque.
- Cambie ligeramente la posición de perforación y repita hasta que se recojan aproximadamente 50-100 mg de polvo óseo, medido con una balanza cerrada con una precisión de 0,01 mg (consulte la Tabla de materiales).
- Transfiera el polvo óseo del papel de pesaje a un tubo de baja unión de 2 ml para su extracción. Conservar a -20 °C, indefinidamente.
- Almacene el hueso restante/exceso de polvo en un ambiente estéril seco y con temperatura controlada (25 °C) hasta que se pueda completar la devolución/repatriación.
- Deseche todos los residuos en bolsas o recipientes de riesgo biológico esterilizables en autoclave. Esterilizar/descontaminar todo el equipo reutilizable (por ejemplo, abrazaderas, brocas, taladros, sierras, etc.) utilizando lejía/solución de descontaminación de ADN/etanol y exposición UV (longitud de onda: 254 nm), según corresponda, entre cada muestreo.
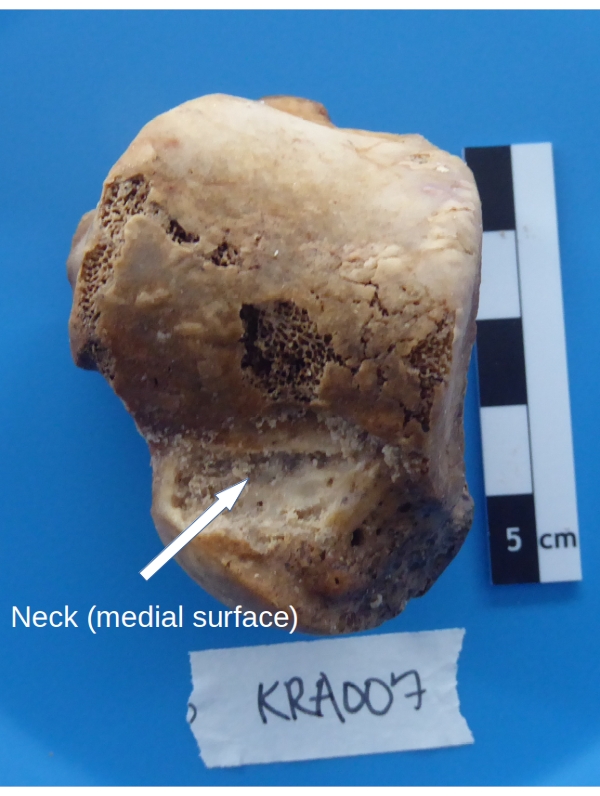
Figura 5: Área de muestreo del astrágalo para la recuperación del hueso cortical. Haga clic aquí para ver una versión más grande de esta figura.
NOTA: El astrágalo tiene muy poco hueso cortical (una capa externa delgada). El material no solo debe recogerse de la superficie, sino también de la capa densa subyacente de hueso esponjoso.
Resultados
En un estudio separado 11, se extrajo ADN del polvo óseo generado a partir de cada ubicación de muestreo anatómico en11 individuos, utilizando un protocolo estándar de extracción de ADN optimizado para fragmentos cortos de tejido calcificado2. Luego se produjeron bibliotecas monocatenarias28 y se secuenciaron en un HiSeq 4000 (extremo pareado de 75 pb) a una profundidad de ~ 20,000,000 lecturas por muestra. Los datos de secuencia resultantes se evaluaron para determinar el contenido de ADN humano endógeno utilizando la tubería EAGER29 (configuración de BWA: longitud de semilla de 32, penalización de desajuste de 0.1, filtro de calidad de mapeo de 37). Todos los resultados representativos se informan utilizando las mismas métricas que Parker et al. 202011 para mayor coherencia. Las bibliotecas de las porciones en polvo de la pars petrosa produjeron, en promedio, ADN endógeno más alto que cualquiera de los otros 23 lugares de muestreo anatómico estudiados (Figura 6A-B). Los siete lugares de muestreo anatómico adicionales presentados en este protocolo (el cemento, el primer paso de la cámara de la pulpa dental y la dentina de los molares permanentes; el hueso cortical del cuerpo vertebral y el arco vertebral superior de la vértebra torácica; el hueso cortical del mechón apical de la falange distal; y el hueso cortical del cuello del astrágalo) produjeron los siguientes rendimientos más altos (sin significación estadística entre estos lugares de muestreo anatómico; Figura 6A-B; Archivo complementario 1: DNAPreCap endógeno). Todas estas ubicaciones alternativas produjeron consistentemente rendimientos de ADN adecuados para los análisis genéticos de poblaciones estándar, como los análisis mitocondriales y los análisis de polimorfismo de nucleótido único (SNP). Las tasas de duplicación en las bibliotecas derivadas de todas las ubicaciones de muestreo anatómico fueron bajas (factores de conglomerado < 1,2 en promedio, calculado como la relación entre todas las lecturas de mapeo y lecturas de mapeo únicas, Tabla 2; Archivo complementario 1: ClusterFactor), lo que indica que todas las bibliotecas examinadas eran de muy alta complejidad. Del mismo modo, las estimaciones promedio de contaminación por ADN humano exógeno fueron bajas, con un promedio de < 2% (contaminación del cromosoma X en hombres, n = 7, según lo informado por la tubería ANGSD30) en todos los lugares de muestreo anatómico, excepto en el arco vertebral superior (contaminación promedio estimada: 2.11%, con una muestra eliminada como valor atípico; KRA005: 19,52%, véase el cuadro 2; Archivo complementario 1: Xcontaminación). La longitud promedio del fragmento (después de filtrar para eliminar todas las lecturas < 30 pb) fue más baja en el material recolectado de la cámara de la pulpa dental y la dentina, sin variación significativa entre otras ubicaciones de muestreo anatómico (55.14 pb y 60.22 pb, respectivamente, en comparación con una mediana promedio de 62.87, valores de p por pares < 0.019, Tabla 2; Archivo complementario 1: AvgFragLength). Además, los dientes y las vértebras torácicas contienen múltiples ubicaciones de muestreo anatómico donde se observó una alta recuperación endógena de ADN, lo que las hace particularmente adecuadas como alternativas a la pars petrosa.
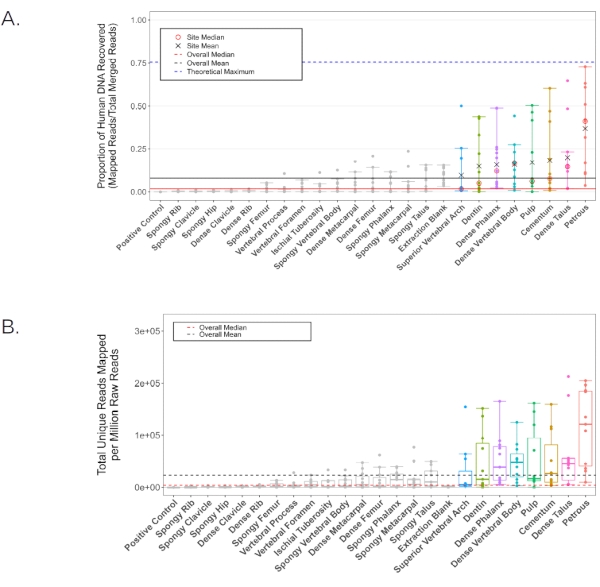
Figura 6: Contenido de ADN humano para todas las muestras examinadas. Las líneas negras representan la media general, mientras que las líneas rojas representan la mediana (sólido: proporción de ADN humano, discontinuo: lecturas humanas mapeadas por millón de lecturas generadas). Los lugares de muestreo anatómico individuales con una proporción promedio de ADN humano superior a la media general (8,16%) se colorean en todos los análisis. (A) La proporción de lecturas que se asignan al genoma de referencia hg19. La línea discontinua azul representa el máximo teórico dados los parámetros de mapeo de la tubería (generados usando Gargammel31 para simular una distribución aleatoria de 5,000,000 lecturas del genoma de referencia hg19 con daño simulado). Las medias individuales (X negra) y las medianas (círculo rojo) se informan para aquellas muestras con una proporción promedio de ADN humano más alta que la media general. Los intervalos de confianza indican los límites superior e inferior, excluidos los valores atípicos estadísticos. (B) El número de lecturas únicas que se asignan al genoma de referencia hg19 por millón de lecturas de esfuerzo de secuenciación (75 pb de final pareado). Los intervalos de confianza indican los límites superior e inferior, excluidos los valores atípicos estadísticos. Esta figura ha sido adaptada de Parker, C. et al. 202011. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 2: Niveles promedio de duplicación (lecturas de mapeo/lecturas únicas), longitudes promedio y mediana de fragmentos y estimaciones de contaminación del cromosoma X para todas las ubicaciones de muestreo anatómico. Error notificado como el error estándar de la media. Esta tabla ha sido adaptada de Parker, C. et al. 202011.
| Lugar de muestreo | Factor de duplicación promedio (# lecturas asignadas /# lecturas asignadas únicas) | Longitud media del fragmento en pb | Proporción media estimada de contaminación por el cromosoma X |
| Pirámide de Petrous | 1.188 ± 0.006 | 65,40 ± 1,36 | 0,000 ± 0,003 |
| Cementum | 1.197 ± 0.028 | 67,28 ± 1,76 | 0,011 ± 0,003 |
| Dentina | 1.188 ± 0.061 | 60,22 ± 2,37 | 0,002 ± 0,007 |
| Pulpa | 1.179 ± 0.024 | 55,14 ± 2,90 | 0,013 ± 0,006 |
| Falange distal | 1.191 ± 0.049 | 65,95 ± 1,08 | 0,013 ± 0,005 |
| Cuerpo vertebral | 1.194 ± 0.037 | 66,14 ± 1,03 | 0,008 ± 0,003 |
| Arco vertebral superior | 1,19 ± 0,017 | 63,02 ± 1,23 | 0,021 ± 0,009* |
| Astrágalo | 1.198 ± 0.010 | 68,20 ± 1,24 | 0,011 ± 0,003 |
| *Muestra KRA005 eliminada como valor atípico en 0.1952 |
Disponibilidad del código
Todos los programas de análisis y módulos R utilizados en los análisis de este manuscrito están disponibles gratuitamente de sus respectivos autores. Todo el código R personalizado está disponible a pedido.
Disponibilidad de datos
Todos los datos brutos utilizados en el cálculo de resultados representativos están disponibles gratuitamente en el repositorio de datos ENA del Archivo Europeo de Nucleótidos (número de acceso PRJ-EB36983) o en materiales complementarios de Parker, C. et al.11.
Archivo complementario 1. Haga clic aquí para descargar este archivo.
Discusión
La práctica actual en genética de poblaciones humanas antiguas es tomar muestras preferentemente de la pars petrosa (paso 2.1) siempre que sea posible. Sin embargo, la pars petrosa puede ser una muestra difícil de obtener, ya que es muy valorada para una miríada de evaluaciones esqueléticas (por ejemplo, historia poblacional32, estimación de la edad fetal al morir33 y determinación del sexo34), y, históricamente, el muestreo de la pars petrosa para el análisis de ADN puede ser altamente destructivo3,4 (incluido el protocolo presentado aquí, aunque los nuevos protocolos mínimamente invasivos13,14 han sido ampliamente adoptados para aliviar esta preocupación). Esto se ve agravado por el hecho de que, hasta hace muy poco, no se había intentado un estudio sistemático a gran escala de la recuperación del ADN humano a través del esqueleto11, lo que dificulta encontrar una estrategia de muestreo adecuada cuando la pirámide petrosa no está disponible.
Los protocolos presentados aquí ayudan a aliviar ese desafío al proporcionar un conjunto de procedimientos optimizados para el muestreo de ADN de restos óseos arqueológicos / forenses, incluida la pars petrosa, así como siete ubicaciones alternativas de muestreo anatómico en cuatro elementos esqueléticos adicionales. Todos los pasos críticos incluidos están destinados a minimizar la posibilidad de pérdida/daño del ADN debido a un muestreo ineficiente (pasos 2.1.6 y 3.2.1.3) o al sobrecalentamiento de las muestras durante la perforación / corte (paso 3.1.6). Además, se ha observado a lo largo del protocolo que puede ser necesario modificar/omitir los pasos previos al tratamiento para garantizar el mejor rendimiento en muestras altamente degradadas. También debe tenerse en cuenta que incluso entre los elementos seleccionados presentados aquí, quedan varias técnicas de muestreo alternativas posibles (particularmente para la pars petrosa13,14), así como un amplio espacio para una mayor optimización de los lugares de muestreo anatómico subexplotados presentados aquí (es decir, el astrágalo: paso 2.5 y las vértebras: paso 2.3).
También es importante tener en cuenta que estos protocolos han sido diseñados y probados utilizando restos antiguos juveniles-adultos de alta calidad (buena preservación morfológica) para fines de análisis endógenos de ADN humano. Los resultados presentados pueden no extenderse a materiales más altamente degradados, otros contextos de preservación, restos infantiles, restos no humanos o estudios de patógenos o el microbioma, ya que aún se necesita una mayor exploración del uso de estos protocolos en contextos adicionales. Además, los elementos esqueléticos alternativos presentados aquí (los dientes, las vértebras, la falange distal y los tali) pueden ser difíciles de asignar a un solo individuo entre los restos mezclados, lo que requiere un muestreo de múltiples elementos para garantizar un origen único. A pesar de estas limitaciones, hacer que estos protocolos estén ampliamente disponibles puede ayudar a aliviar parte de la heterogeneidad que rodea la selección y el procesamiento de muestras al proporcionar un marco generalizado y cuantitativamente optimizado para su uso en una amplia gama de futuros estudios de ADNa / forenses en restos humanos.
Divulgaciones
Los autores no tienen conflictos de intereses que informar.
Agradecimientos
Los autores desean agradecer al personal de laboratorio del Instituto Max Planck para la Ciencia de la Historia Humana por su ayuda en el desarrollo e implementación de estos protocolos. Este trabajo no habría sido posible sin el aporte y el arduo trabajo del Dr. Guido Brandt, la Dra. Elizabeth Nelson, Antje Wissegot y Franziska Aron. Este estudio fue financiado por la Sociedad Max Planck, el Consejo Europeo de Investigación (ERC) bajo el programa de investigación e innovación Horizonte 2020 de la Unión Europea bajo los acuerdos de subvención No 771234 - PALEoRIDER (WH, ABR) y Starting Grant No. 805268 CoDisEASe (a KIB).
Materiales
| Name | Company | Catalog Number | Comments |
| #16 Dental Drill Bit | NTI | H1-016-HP | example drilling bit |
| 0.6 mm scroll saw blade | Fisher Scientific | 50-949-097 | blade for Jewellers Saw |
| 22mm diamond cutting wheel | Kahla | SKU 806 104 358 514 220 | Dremel cutting attachment |
| Commercial Bleach | Fisher Scientific | NC1818018 | |
| Control Company Ultra-Clean Supreme Aluminum Foil | Fisher Scientific | 15-078-29X | |
| DNA LoBind Tubes (2 mL) | Eppendorf | 22431048 | |
| Dremel 225-01 Flex Shaft Attachment | Dremel | 225-01 | Dremel flexible extension |
| Dremel 4300 Rotary Tool | Dremel | 4300 | Example drill |
| Dremel collet and nut kit | Dremel | 4485 | Adapters for various Dremel tool attachments/bits |
| Eagle 33 Gallon Red Biohazard Waste Bag | Fisher Scientific | 17-988-501 | |
| Eppendorf DNA LoBind 2 mL microcentrifuge tube | Fisher Scientific | 13-698-792 | |
| Ethanol (Molecular Biology Grade) | Millipore Sigma | 1.08543 | |
| FDA approved level 2 Surgical Mask | Fisher Scientific | 50-206-0397 | PPE |
| Fisherbrand Comfort Nitrile Gloves | Fisher Scientific | 19-041-171X | PPE |
| Fisherbrand Safety Glasses | Fisher Scientific | 19-130-208X | PPE |
| Granger Stationary Vise | Fisher Scientific | NC1336173 | benchtop vise |
| Invitrogen UltraPure DNase/Rnase free distilled water | Fisher Scientific | 10-977-023 | |
| Jewellers Saw | Fisher Scientific | 50-949-231 | |
| Kimwipes | Sigma-Aldritch | Z188956 | |
| Labconco Purifier Logic Biosafety cabinet | Fisher Scientific | 30-368-1101 | |
| LookOut DNA Erase | Millipore Sigma | L9042-1L | |
| Medium weighing boat | Heathrow Scientific | HS120223 | |
| MSC 10pc plier/clamp set | Fisher Scientific | 50-129-5352 | Miscellaneous clamps/vise grips for securely holding samples while drilling/cutting |
| Sartorius Quintix Semi-Micro Balance | Fisher Scientific | 14-560-019 | enclosed balance |
| Tyvek coveralls with hood | Fisher Scientific | 01-361-7X | PPE |
| Weigh paper | Heathrow Scientific | HS120116 |
Referencias
- Adler, C. J., Haak, W., Donlon, D., Cooper, A. Survival and recovery of DNA from ancient teeth and bones. Journal of Archaeological Science. 38 (5), 956-964 (2011).
- Dabney, J., Meyer, M. Extraction of highly degraded DNA from ancient bones and teeth. Ancient DNA: Methods and Protocols. , 25-29 (2019).
- Palsdottir, A. H., Bläuer, A., Rannamäe, E., Boessenkool, S., Hallsson, J. Not a limitless resource: ethics and guidelines for destructive sampling of archaeofaunal remains. Royal Society Open Science. 6 (10), 191059 (2019).
- Pinhasi, R., Fernandes, D. M., Sirak, K., Cheronet, O. Isolating the human cochlea to generate bone powder for ancient DNA analysis. Nature Protocols. 14 (4), 1194-1205 (2019).
- Latham, K. E., Miller, J. J. DNA recovery and analysis from skeletal material in modern forensic contexts. Forensic Sciences Research. 4 (1), 51-59 (2019).
- Mundorff, A. Z., Bartelink, E. J., Mar-Cash, E. DNA preservation in skeletal elements from the World Trade Center disaster: Recommendations for mass fatality management. Journal of Forensic Sciences. 54 (4), 739-745 (2009).
- Gamba, C., et al. Genome flux and stasis in a five millennium transect of European prehistory. Nature Communications. 5 (1), 1-9 (2014).
- Alberti, F., et al. Optimized DNA sampling of ancient bones using Computed Tomography scans. Molecular Ecology Resources. 18 (6), 1196-1208 (2018).
- Hansen, H. B., et al. Comparing ancient DNA preservation in petrous bone and tooth cementum. PLoS ONE. 12 (1), 0170940 (2017).
- Sirak, K., et al. Human auditory ossicles as an alternative optimal source of ancient DNA. Genome Research. 30 (3), 427-436 (2020).
- Parker, C., et al. A systematic investigation of human DNA preservation in medieval skeletons. Scientific Reports. 10 (1), 18225 (2020).
- Pinhasi, R., et al. Optimal ancient DNA yields from the inner ear part of the human petrous bone. PLoS ONE. 10 (6), 0129102 (2015).
- Sirak, K. A., et al. A minimally-invasive method for sampling human petrous bones from the cranial base for ancient DNA analysis. BioTechniques. 62 (6), 283-289 (2017).
- . Minimally-invasive sampling of pars petrosa (os temporale) for ancient DNA extraction. protocols.io Available from: https://www.protocols.io/view/minimally-invasive-sampling-of-pars-petrosa-os-tem-bqd8ms9w (2020)
- Damgaard, P. B., et al. Improving access to endogenous DNA in ancient bones and teeth. Scientific Reports. 5 (1), 1-12 (2015).
- Harney, &. #. 2. 0. 1. ;., et al. A minimally destructive protocol for DNA extraction from ancient teeth. Genome Research. 31 (3), 472-483 (2021).
- Cooper, A., Poinar, H. N. Ancient DNA: Do it right or not at all. Science. 289 (5482), 1139 (2000).
- Llamas, B., et al. From the field to the laboratory: Controlling DNA contamination in human ancient DNA research in the high-throughput sequencing era. STAR: Science & Technology of Archaeological Research. 3 (1), 1-14 (2017).
- Llamas, B., et al. From the field to the laboratory: Controlling DNA contamination in human ancient DNA research in the high-throughput sequencing era. STAR: Science & Technology of Archaeological Research. 3 (1), 1-14 (2017).
- Boessenkool, S., et al. Combining bleach and mild predigestion improves ancient DNA recovery from bones. Molecular Ecology Resources. 17 (4), 742-751 (2017).
- García-Garcerà, M., et al. Fragmentation of contaminant and endogenous DNA in ancient samples determined by shotgun sequencing; Prospects for human palaeogenomics. PLoS ONE. 6 (8), 24161 (2011).
- Malmström, H., et al. More on contamination: The use of asymmetric molecular behavior to identify authentic ancient human DNA. Molecular Biology and Evolution. 24 (4), 998-1004 (2007).
- Basler, N., et al. Reduction of the contaminant fraction of DNA obtained from an ancient giant panda bone. BMC Research Notes. 10, 754 (2017).
- Kemp, B. M., Smith, D. G. Use of bleach to eliminate contaminating DNA from the surface of bones and teeth. Forensic Science International. 154 (1), 53-61 (2005).
- Korlević, P., et al. Reducing microbial and human contamination in DNA extractions from ancient bones and teeth. BioTechniques. 59 (2), 87-93 (2015).
- Dabney, J., Meyer, M. Extraction of highly degraded DNA from ancient bones and teeth. Methods in Molecular Biology. 1963, 25-29 (2019).
- Hansen, H. B., et al. Comparing ancient DNA preservation in petrous bone and tooth cementum. PLoS ONE. 12 (1), 0170940 (2017).
- Gansauge, M. -. T., et al. Single-stranded DNA library preparation from highly degraded DNA using T4 DNA ligase. Nucleic Acids Research. 45 (10), 79 (2017).
- Peltzer, A., et al. EAGER: efficient ancient genome reconstruction. Genome Biology. 17 (1), 60 (2016).
- Korneliussen, T. S., Albrechtsen, A., Nielsen, R. ANGSD: analysis of next generation sequencing data. BMC Bioinformatics. 15, 356 (2014).
- Renaud, G., Hanghøj, K., Willerslev, E., Orlando, L. Gargammel: A sequence simulator for ancient DNA. Bioinformatics. 33 (4), 577-579 (2017).
- Ponce de León, M. S., et al. Human bony labyrinth is an indicator of population history and dispersal from Africa. Proceedings of the National Academy of Sciences of the United States of America. 115 (16), 4128-4133 (2018).
- Nagaoka, T., Kawakubo, Y. Using the petrous part of the temporal bone to estimate fetal age at death. Forensic Science International. 248, 188 (2015).
- Norén, A., Lynnerup, N., Czarnetzki, A., Graw, M. Lateral angle: A method for sexing using the petrous bone. American Journal of Physical Anthropology. 128 (2), 318-323 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados