Method Article
Dispositivos electrónicos orgánicos flexibles para la terapia de campo eléctrico pulsado del glioblastoma
En este artículo
Resumen
Este trabajo describe el desarrollo de electrodos interdigitados flexibles para su implementación en modelos 3D de tumores cerebrales, a saber, cultivo in vitro , modelo in ovo y modelo murino in vivo . El método propuesto se puede utilizar para evaluar los efectos de los campos eléctricos pulsados en tumores en diferentes niveles de complejidad.
Resumen
El glioblastoma es difícil de erradicar con terapias oncológicas estándar debido a su alto grado de invasividad. Los tratamientos bioeléctricos basados en campos eléctricos pulsados (PEF) son prometedores para mejorar la eficiencia del tratamiento. Sin embargo, dependen de electrodos rígidos que causan daños agudos y crónicos, especialmente en tejidos blandos como el cerebro. En este trabajo, se utilizó electrónica flexible para administrar PEF a los tumores y la respuesta biológica se evaluó con microscopía fluorescente. Los electrodos de oro interdigitados en un sustrato delgado y transparente de parileno-C se recubrieron con el polímero conductor PEDOT: PSS, lo que resultó en un dispositivo adaptable y biocompatible. Los efectos de los PEF sobre los tumores y su microambiente se examinaron utilizando varios modelos biológicos. Primero, se cultivaron monocapas de células de glioblastoma en la parte superior de los electrodos para investigar fenómenos in vitro. Como paso intermedio, se desarrolló un modelo in ovo donde se injertaron esferoides tumorales diseñados en la membrana embrionaria de una codorniz. Debido a la ausencia de un sistema inmune, esto condujo a tumores altamente vascularizados. En esta etapa temprana del desarrollo, los embriones no tienen sistema inmunológico y los tumores no se reconocen como cuerpos extraños. Por lo tanto, pueden desarrollarse rápidamente mientras desarrollan sus propios vasos del sistema vascular embrionario existente, lo que representa un valioso modelo de cáncer en 3D. Finalmente, se evaluó la administración de electrodos flexibles de PEF en un organismo completo con un sistema inmune funcional, utilizando un modelo de ratón de ortoinjerto singénico (intracraneal). Los esferoides tumorales se injertaron en el cerebro de ratones transgénicos multifluorescentes antes de la implantación de dispositivos de electrodos orgánicos flexibles. Una ventana craneal sellada permitió obtener imágenes multifotónicas del tumor y su microambiente durante el tratamiento con PEF durante un período de varias semanas.
Introducción
El glioblastoma multiforme (GBM) es un tumor altamente invasivo y, por lo tanto, difícil de erradicar con tratamientos estándar como la resección, la radioterapia y la quimioterapia. A pesar de los tratamientos multimodales, el pronóstico sigue siendo muy malo y la mayoría de los pacientes experimentan progresión de la enfermedad dentro de 1 año del diagnóstico 1,2. Recientemente, el desarrollo de tratamientos bioeléctricos ha demostrado un gran potencial para mejorar las terapias existentes. Estas terapias utilizan la administración de campos eléctricos pulsados (PEF), generalmente en una sola sesión de tratamiento, para interrumpir la integridad de la membrana celular y el microambiente de los tumores. Esta alteración de la membrana celular, también conocida como electroporación, puede ser reversible o irreversible dependiendo de la intensidad del campo eléctrico y el número de pulsos. La electroporación irreversible (IRE) se aplica como una técnica de ablación tisular no térmica en la que los pulsos eléctricos causan daños fatales a las membranas celulares que conducen a la muerte celular3. La electroporación reversible se aplica en la electroquimioterapia (TEC), una técnica establecida que consiste en la administración de PEF en combinación con medicamentos de quimioterapia para mejorar la captación de fármacos en las células cancerosas4. Además, estudios recientes demostraron la electroporación de calcio como una alternativa a la TEC con alta eficiencia para el tratamiento del cáncer, que también es barata e induce menos efectos secundarios5. A pesar de estos avances prometedores, los PEF se aplican generalmente utilizando electrodos metálicos rígidos que se sabe que causan daño a los tejidos blandos6. El cerebro es particularmente sensible a tales dispositivos invasivos donde el desajuste mecánico induce inflamación y cicatrización astroglial7.
En este contexto, se presenta un sistema flexible de administración de PEF en combinación con modelos 3D de tumores de glioblastoma, desde la microfabricación hasta un modelo murino. Los electrodos conformados se fabrican con procesos estándar de microfabricación de película delgada, incluido el uso de materiales blandos y biocompatibles como el parileno-C, el oro y PEDOT: PSS 8,9. Se utiliza un diseño de electrodo interdigitado para cubrir una gran área de superficie mientras se mantiene una transparencia adecuada para la obtención de imágenes entre los dedos del electrodo10. Para el modelo tumoral, se producen esferoides 3D de células de glioblastoma que expresan un reportero de fluorescencia codificado genéticamente utilizando una variación del método de placa de 96 pocillos de recubrimiento líquido11. Los esferoides son injertados en la membrana corioalantoidea de un embrión de codorniz, resultando en un modelo in ovo que ha sido ampliamente utilizado para estudiar angiogénesis o toxicología farmacológica12,13. Los tumores pueden ser injertados y vascularizados por la vasculatura del embrión en ausencia de un sistema inmune en esta etapa del desarrollo embrionario12. Luego se colocan electrodos flexibles en la parte superior del tumor vascularizado para estudiar el efecto de la administración de PEF en el esferoide y su vasculatura. Finalmente, estos efectos se investigan en un organismo vivo completo, incluyendo el microambiente tumoral y el sistema inmune, mediante la implantación de esferoides diseñados en el parénquima cerebral de modelos murinos14. Se colocan electrodos flexibles en la parte superior del sitio de inserción y la craneotomía se sella con una ventana de vidrio, lo que permite repetir imágenes de dos fotones durante varias semanas.
Estos métodos serán útiles para las personas interesadas en diversos dominios que van desde la ingeniería microelectrónica hasta las aplicaciones oncológicas. El protocolo de microfabricación se puede utilizar y adaptar para cualquier aplicación que requiera electrodos metálicos de película delgada recubiertos con PEDOT:PSS. Además, los modelos biológicos desarrollados para la evaluación de tratamientos eléctricos antitumorales serán de interés general para la investigación de la diferenciación de la respuesta celular, vascular e inmune a los materiales implantados.
Protocolo
Todos los procedimientos experimentales se realizaron de acuerdo con la legislación francesa y de conformidad con la Directiva del Consejo de la Comunidad Europea del 24 de noviembre de 1986 (86/609 / CEE) para el cuidado y uso de animales de laboratorio. La investigación en animales fue autorizada por la Dirección Departamental de Servicios Vétérinaires des Bouches-du-Rhône y aprobada por el comité ético de Provenza Costa Azul (Apafis # 22689-2019100414103054).
1. Microfabricación de dispositivos flexibles (Figura 1)
- Limpieza de los portaobjetos de vidrio
- El vidrio sónico se desliza en solución jabonosa al 2% durante 15 min. Enjuáguelos con agua.
- Sonicar de nuevo en una mezcla de 80% de acetona pura y 20% de isopropanol puro durante 15 min.
PRECAUCIÓN: Estos disolventes son nocivos e inflamables. Use equipo de protección personal (EPP) y manéjelo debajo de una campana extractora. - Enjuague las diapositivas con isopropanol y séquelas con una pistola de aire comprimido.
NOTA: Asegúrese de que la acetona no se seque sobre los sustratos durante todo el proceso.
- Patrones de electrodos de oro (Figura 1A)
- Depositar una capa de 3 μm de parileno-C (PaC) con un sistema de deposición de parileno (Figura 1Aa).
- Coloque los portaobjetos de vidrio limpios en la cámara de deposición. Rocíe jabón en el enfriador, déjelo secar e insértelo en la trampa fría designada del sistema de deposición. Este antiadhesivo facilita la fácil eliminación de PaC del enfriador después de la deposición.
PRECAUCIÓN: La PaC es un irritante y representa un peligro para la salud. Use guantes mientras lo manipula. - Pesar 6 g de PaC en un bote de aluminio y colocarlo en el horno. Evacue la máquina (P = 10 mTorr) e inicie la deposición con los siguientes parámetros:Enfriador T = -100 °C,Horno T = 690 °C,Vaporizador T = 175 °C yCámara T = 135 °C.
- Cuando termine la deposición y la temperatura del vaporizador esté por debajo de 40 °C, apague el enfriador, el vaporizador y el horno. Ventile la máquina y recoja las muestras.
- Coloque los portaobjetos de vidrio limpios en la cámara de deposición. Rocíe jabón en el enfriador, déjelo secar e insértelo en la trampa fría designada del sistema de deposición. Este antiadhesivo facilita la fácil eliminación de PaC del enfriador después de la deposición.
- Activar la superficie de las muestras mediante tratamiento con plasma oxigenado durante 30 s (100 W, 50 sccm).
- Centrifugar las muestras tratadas con plasma con una fotorresistencia negativa a 1.000 x g durante 40 s. Colocar las muestras en una placa caliente a 110 °C durante 2 min (Figura 1Ab).
PRECAUCIÓN: La solución fotorresistente es inflamable y causa irritación; Use EPP y manéjelo debajo de una campana extractora. - Coloque un filtro i-line en la línea de luz del alineador de contacto de banda ancha UV y exponga la fotorresistencia a través de una máscara que presenta el diseño de electrodo interdigitado (Figura 1Ac).
NOTA: Los electrodos interdigitados con un espacio de 50 o 250 μm se diseñaron utilizando un editor de diseño y las fotomáscaras se encargaron a una empresa que produce fotomáscaras de poliéster mediante fototrazado láser. - Hornea las muestras anteriores a 110 °C en una placa caliente durante 3 minutos y déjalas enfriar a temperatura ambiente durante 5 minutos. Sumerja las muestras en un revelador sin iones metálicos durante 3 minutos para eliminar la fotorresistencia no expuesta. Enjuague las muestras con agua y séquelas con una pistola de aire comprimido (Figura 1Ad).
PRECAUCIÓN: La solución para desarrolladores es irritante; use EPP y mango debajo de una campana extractora. - Activar la superficie de las muestras mediante tratamiento con plasma oxigenado durante 60 s (100 W, 50 sccm).
- Deposite una capa de adhesión de 20 nm de cromo y una capa de oro de 300 nm con un evaporador térmico de la siguiente manera (Figura 1Ae).
- Ventile la máquina evaporadora y recorte las muestras (boca abajo) en la placa redonda superior con tornillos metálicos. Llena los crisoles dedicados, respectivamente, con cromo y oro. Selle y evacúe la máquina para alcanzar una presión inferior a 5,10-6 Torr. Inicie la rotación del portamuestras.
- Seleccione el crisol que contiene cromo y aumente lentamente la corriente que lo atraviesa hasta alcanzar una tasa de deposición de 0,2 Å·s-1 . Abra el obturador y espere hasta que se depositen 20 nm de cromo. Cierre el obturador y reduzca lentamente la corriente hasta 0 mA.
- Seleccione el crisol que contiene oro y aumente lentamente la corriente que lo atraviesa hasta alcanzar una tasa de deposición de 0,2 Å·s-1 . Abra el obturador para evaporar oro, espere hasta que se depositen 10 nm de oro y luego aumente la tasa de deposición a 1.5 Å·s-1 hasta que se depositen aproximadamente 300 nm. Cierre el obturador y reduzca lentamente la corriente a 0 mA.
- Deje que las muestras se enfríen a temperatura ambiente durante 15 minutos después de la deposición. Detenga la rotación del portamuestras, ventile la máquina y recoja las muestras.
- Sumerja las muestras en un vaso de precipitados con acetona. Coloque el vaso de precipitados en una placa de agitación ajustada a 110 rpm durante 15 minutos para levantar la fotorresistencia. Enjuague las muestras con isopropanol y séquelas con una pistola de aire comprimido (Figura 1Af).
- Activar la superficie de las muestras mediante tratamiento con plasma oxigenado durante 30 s (100 W, 50 sccm).
- Depositar una capa de aislamiento de 3 μm de PaC con un sistema de deposición de parileno (véase el paso 1.2.1) (Figura 1Ag).
- Depositar una capa de 3 μm de parileno-C (PaC) con un sistema de deposición de parileno (Figura 1Aa).
- Apertura del contorno (Figura 1B)
- Centrifugar las muestras con una fotorresistencia positiva a 600 x g durante 35 s. Colóquelo en una placa caliente a 110 °C durante 2 min (Figura 1Ba).
PRECAUCIÓN: La solución fotorresistente es inflamable y causa irritación; use EPP y mango debajo de una campana extractora. - Asegúrese de que no haya ningún filtro i-line en la línea de luz del alineador de contacto de banda ancha UV y exponga la fotorresistencia a través de una máscara que muestre el contorno del dispositivo con un alineador de contacto de banda ancha UV (Figura 1Bb).
- Sumerja las muestras en un revelador sin iones metálicos durante 4 minutos para eliminar la fotorresistencia expuesta. Enjuague las muestras con agua y séquelas con una pistola de aire comprimido (Figura 1Bc).
- Grabar el contorno a través de las dos capas de PaC con un grabador iónico reactivo (160 W, 22 min, O2: 50 sccm, CF4: 10 sccm) (Figura 1Bd).
- Retire la fotorresistencia restante con acetona, enjuague con isopropanol y seque las muestras con una pistola de aire comprimido.
- Centrifugar las muestras con una fotorresistencia positiva a 600 x g durante 35 s. Colóquelo en una placa caliente a 110 °C durante 2 min (Figura 1Ba).
- PEDOT:Recubrimiento PSS (Figura 1C)
- Estérese una solución de jabón al 2% a 70 x g durante 35 s (Figura 1Ca).
- Depositar una capa de sacrificio de 3 μm de PaC con un sistema de deposición de parileno (véase el paso 1.2.1) (Figura 1Cb).
- Fotorresistencia positiva spin-coat a 600 x g durante 35 s. Colocar las muestras en una placa caliente a 110 °C durante 2 min (Figura 1Cc).
- Asegúrese de que no haya ningún filtro i-line en la línea de luz del alineador de contacto de banda ancha UV y exponga la fotorresistencia a través de una máscara que muestre la superficie activa de los electrodos (Figura 1Cd).
- Sumerja las muestras en un revelador sin iones metálicos durante 4 minutos para eliminar la fotorresistencia expuesta. Enjuague las muestras con agua y séquelas con una pistola de aire comprimido (Figura 1Ce).
- Grabar el PaC con un grabador iónico reactivo para abrir la superficie activa de los electrodos (160 W, 24 min, O2: 50 sccm, CF4: 10 sccm). Verifique con un microscopio que no haya PaC residual en la superficie activa (Figura 1Cf).
- Retire la fotorresistencia restante con acetona, enjuague con isopropanol y seque las muestras con una pistola de aire comprimido.
- Activar la superficie de las muestras mediante tratamiento con plasma oxigenado durante 90 s (100 W, 50 sccm).
- Mezcle una dispersión comercial de PEDOT:PSS químicamente polimerizado con 5 vol% de etilenglicol (EG) y 0.1 % en volumen de ácido dodecilbenceno sulfónico (DBSA). Sonicate durante 15 min. Agregue 1% en peso de (3-gliciloxipropil) trimetilsiloxano (GOPS) y sonicate durante 5 min. Filtrar la solución a través de un filtro de 1,2 μm.
PRECAUCIÓN: EG es un irritante y representa un peligro para la salud. DBSA es un irritante y corrosivo. GOPS es corrosivo. Use el EPP adecuado y manipule estos productos químicos debajo de una campana extractora.
NOTA: El volumen total depende del número de muestras. Para 10 portaobjetos de vidrio estándar, prepare al menos 20 ml que correspondan a las siguientes cantidades: 18,78 ml de PEDOT:PSS, 1 ml de EG, 20 μL de DBSA y 200 μL de GOPS. - Estirar cuatro capas de solución PEDOT:PSS a 150 x g durante 35 s. Después de la deposición de cada capa, hornear las muestras a 110 °C durante 60 s en una placa caliente y enfriarlas a temperatura ambiente durante 5 minutos antes de girar la siguiente capa (Figura 1Cg).
- Retire la capa de PaC sacrificial sumergiendo las muestras en agua (Figura 1Ch).
- Hornear las muestras a 140 °C durante 1 h.
- Sumerja las muestras en agua desionizada durante 30 minutos para eliminar el jabón restante y los compuestos de bajo peso molecular en la película PEDOT:PSS y para separar las muestras del sustrato de vidrio (Figura 1Ci).
- Conexiones y embalaje (Figura 1D)
- Deposite una capa delgada de pintura acrílica sobre una película de poliimida que esté recubierta con cobre (Figura 1Da). Utilice un aerosol para obtener una capa homogénea de pintura (Figura 1Db).
- Modelar la pintura acrílica con un láser (75 kHz, 7 W, 1 paso láser, 400 mm·s-1) para obtener dos almohadillas de contacto rectangulares (5 mm x 15 mm; espacio de 1,5 mm) (Figura 1Dc).
- Grabado húmedo del cobre con cloruro férrico saturado al 30% (p/v) (FeCl3) en agua durante 15 min a 40 °C (Figura 1Dd).
PRECAUCIÓN: FeCl3 es un irritante y corrosivo; Manéjelo con guantes debajo de una campana extractora. - Pelar la pintura acrílica con acetona frotándola ligeramente con un paño (Figura 1De).
- Corte la película de poliimida estampada en formas rectangulares (15 mm x 30 mm) con un láser (15 kHz, 10 W, 30 pasadas láser, 130 mm·s-1) (Figura 1Df).
- Dispensar pasta de plata con una máquina dispensadora de tres ejes a una presión de tres bar con una aguja de 330 μm de diámetro (5 m·min-1) (Figura 1Dg).
PRECAUCIÓN: La pasta de plata es un irritante; mango con guantes. - Alinee y fije la sonda PaC con la película de poliimida bajo un microscopio binocular utilizando pinzas (Figura 1Dh).
NOTA: Las marcas de alineación se pueden modelar en el paso 1.5.2 para facilitar el posicionamiento de la sonda en las almohadillas de contacto. - Hornear a 140 °C durante 2 h en el horno.
- Coloque una cinta de protección de poliimida de 1 cm2 en las almohadillas de contacto (Figura 1Di).
- Sumerja la interfaz donde la sonda PaC y la película de poliimida están conectadas en PDMS (Figura 1Dj).
- Hornear durante 2 h a 50 °C.
- Retire la cinta de protección para abrir las almohadillas de contacto (Figura 1Dk).
NOTA: La microfabricación de dispositivos in vitro es similar, pero se deben omitir los pasos 1.2.1, 1.3 y 1.5.
2. Generación de línea celular estable GCaMP6f de glioblastoma
- Producción de lentivirus
- En un matraz de 75 cm², cultivar una línea celular derivada de HEK 293T optimizada para la producción de lentivirus en 10 ml de medio de águila modificada (DMEM) de Dulbecco que contenga 4,5 g· L-1 de glucosa, L-glutamina, piruvato de sodio y bicarbonato de sodio y suplementado con suero fetal bovino (FBS) libre de tetraciclina al 10%, 100 unidades·mL-1 de penicilina y 100 μg·mL-1 de estreptomicina durante al menos 3 días hasta la confluencia del 80%.
- Retirar el medio del matraz. Enjuague suavemente las células con 10 ml de solución salina tamponada con fosfato (PBS).
- Añadir 1 ml de solución de tripsina/EDTA al 0,25% e incubar el matraz durante 5 min a 37 °C.
PRECAUCIÓN: La solución de tripsina/EDTA representa un peligro para la salud; use EPP y mango debajo de una campana extractora. - Añadir 8 mL de medio de cultivo. Enjuague suavemente la suspensión celular.
- Contar las células y la placa 4 x 106 células en una placa de Petri en 8 ml de medio de cultivo.
- Al día siguiente, diluir 25 μg del plásmido que contiene el gen GCaMP6f y un marcador de selección que confiere resistencia a la puromicina en un volumen total de 600 μL de agua. Agréguelo a un tubo de reactivo de transfección. Vortex durante 10 s a 3.000 rpm e incubar el tubo a temperatura ambiente durante 10 min para permitir la producción de nanopartículas.
- Agregue el contenido del tubo gota a gota sobre el cultivo de células T HEK 293 y moleste suavemente a mano. Incubar las células a 37 °C durante al menos 4 h.
- Reemplace los medios que contienen complejos de nanopartículas con medios nuevos y devuelva las células a 37 ° C.
- Tres días después, recoja el sobrenadante y centrifugar a 500 x g durante 10 minutos para eliminar los desechos celulares. Recoja la fase líquida que contiene partículas virales.
NOTA: La producción del virus en el sobrenadante puede confirmarse mediante una prueba cuantitativa de títulos lentivirales y puede almacenarse a -80 °C durante al menos 2 años.
- Transducción de células de glioblastoma
- En un matraz de 75 cm², cultivar células de glioblastoma en 10 ml de DMEM que contengan 1 g· L-1 de glucosa, L-glutamina, piruvato de sodio y bicarbonato de sodio y suplementado con FBS libre de tetraciclina al 10%, 100 unidades·mL-1 de penicilina y 100 μg·mL-1 de estreptomicina durante al menos 4 días.
- Desechar el medio y añadir el sobrenadante obtenido en el paso 2.1.9 en las células diana.
- Añadir 5 μg·mL-1 de bromuro de hexadimetrina en el medio para mejorar la transducción. Incubar durante 6 h a 37 °C. Reemplace el medio con 10 ml de medio fresco.
PRECAUCIÓN: El bromuro de hexadimetrina es un irritante. Manéjelo con guantes.
- Generación de una línea celular estable
- Dos o tres días después de la transducción, añadir 10 ml de DMEM que contenga 1 g· L-1 de glucosa, L-glutamina, piruvato de sodio y bicarbonato de sodio, 10% FBS, 100 unidades·mL-1 de penicilina, 100 μg·mL-1 de estreptomicina y suplementado con puromicina para matar las células no transducidas. Cultivo de células en este medio durante al menos 3 días.
PRECAUCIÓN: La puromicina es un irritante; Manéjelo con guantes.
NOTA: La sensibilidad de las células a la puromicina debe probarse antes de la transducción mediante el cultivo de células en su medio recomendado que contienen diferentes concentraciones de puromicina. Un día después, revise las células con un microscopio. Elija la concentración adecuada en la que la mayoría de las células están muertas pero pocas siguen vivas, para asegurarse de que el antibiótico no sea demasiado tóxico y pueda matar también las células transfectadas. - Retire el medio y enjuague las células con 10 ml de PBS.
- Añadir 1 ml de solución de tripsina/EDTA al 0,25% e incubar el matraz durante 5 min a 37 °C.
- Añadir 8 mL de medio de cultivo. Enjuague suavemente la suspensión celular.
- Recoja 100 μL de suspensión celular y mida la concentración celular con un contador celular. Aspire 50 μL de suspensión celular en un contador de celdas automatizado de mano con un sensor de 60 μm.
- Semilla 1 célula/pocillo en una placa de 96 pocillos. Por ejemplo, para una concentración de 1 x 10 3 células por ml, agregue 1 / (1 x 103), es decir, 0.001 ml de suspensión celular por pocillo. Siembra cada pozo para aumentar las posibilidades de éxito. Completar con medio de cultivo para alcanzar un volumen total de 200 μL por pocillo.
- Un día después, encuentre cada pocillo que contenga una celda y verifique su fluorescencia (λexc = 490 nm y λem = 530 nm). Marque los pocillos que contienen una sola celda transfectada. Continúe el crecimiento durante unos días hasta que el pozo sea casi confluente.
- Deseche el medio y enjuague las células con 200 μL de PBS. Añadir 100 μL de solución de tripsina/EDTA al 0,25% e incubar la placa de 96 pocillos durante 5 min a 37 °C.
- Añadir 100 μL de medio y enjuagar suavemente la suspensión celular. Transfiera la suspensión celular en una placa de Petri. Agregue 5 ml de medio y deje que las células crezcan durante unos días hasta que la placa de Petri sea casi confluente.
- Deseche el medio y enjuague las células con 5 ml de PBS. Añadir 1 ml de solución de tripsina/EDTA al 0,25% e incubar la placa de Petri durante 5 min a 37 °C.
- Agregue 6 ml de medio y enjuague suavemente la suspensión celular. Transfiera la suspensión celular a un matraz T25. Continuar el crecimiento durante unos días hasta que el matraz sea casi confluente.
- Deseche el medio y enjuague las células con 5 ml de PBS. Añadir 1 ml de solución de tripsina/EDTA al 0,25% e incubar el matraz T25 durante 5 min a 37 °C. Añadir 7 ml de DMEM que contenga 1 g· L-1 de glucosa, L-glutamina, piruvato de sodio y bicarbonato de sodio, y suplementado con 10% de FBS, 100 unidades·mL-1 de penicilina y 100 μg·mL-1 de estreptomicina. Enjuague suavemente la suspensión celular.
- Dividir la suspensión celular en cuatro matraces T25 (2 ml por matraz) y añadir 5 ml de medio a cada matraz. Deje que las células crezcan durante unos días hasta que los matraces sean casi confluentes.
- Repita el paso 2.3.12 para tres matraces y conserve el último matraz para el paso 3.1.3. Transfiera la suspensión celular en un tubo cónico de 15 ml y centrifugar a 150 x g durante 5 min. Deseche el sobrenadante y vuelva a suspender el pellet celular en 900 μL. Mezcle suavemente las células para mantener una suspensión celular homogénea.
- Transfiera la suspensión celular a viales de almacenamiento criogénico. Añadir 100 μL de dimetilsulfóxido. Colocar los crioviales a -80 °C durante la noche. Transfiera células congeladas a nitrógeno líquido para otros experimentos.
NOTA: La eficiencia de la transfección puede evaluarse añadiendo 5 μM de sal de ionomicina cálcica en el medio y comprobando el aumento inducido de fluorescencia bajo un microscopio de fluorescencia (λexc = 490 nm y λem = 530 nm).
- Dos o tres días después de la transducción, añadir 10 ml de DMEM que contenga 1 g· L-1 de glucosa, L-glutamina, piruvato de sodio y bicarbonato de sodio, 10% FBS, 100 unidades·mL-1 de penicilina, 100 μg·mL-1 de estreptomicina y suplementado con puromicina para matar las células no transducidas. Cultivo de células en este medio durante al menos 3 días.
3.3D modelos
- Cultivo de esferoides
- Prepare una solución de agarosa al 1% (p/v) en agua desionizada (DI).
- Añadir 100 g de agarosa en polvo en 100 ml de agua DI y calentar la solución en un horno de microondas hasta que todo el polvo se disuelva. Revuelva la solución regularmente para evitar grumos. Autoclave la solución durante 20 min a 120 °C.
- Una vez recuperado del autoclave, agregue 75 μL de solución de agarosa por pocillo en una placa de 96 pocillos cuidadosamente. Deposítelo en el lado del pozo para formar un menisco, lo que resulta en un fondo redondo no adherente. Deje que se solidifique durante 15 minutos a temperatura ambiente.
- Separar las células (paso 2.3.12) del matraz obtenido en el paso 2.3.14.
- Añadir 10.000 células por pocillo de células de glioblastoma y completar hasta alcanzar un volumen total de 150 μL por pocillo con DMEM que contiene 1 g· L-1 de glucosa, L-glutamina, piruvato de sodio y bicarbonato de sodio, y suplementado con 10% de suero fetal bovino (FBS), 100 unidades·mL-1 de penicilina y 100 μg·mL-1 de estreptomicina.
- Incubar las células a 37 °C sin mover la placa durante 3 días. Luego, reemplace la mitad de los medios con medios nuevos cada 2 días con una pipeta multicanal hasta que se realicen más experimentos. Mantenga la punta de la pipeta en la parte superior del pocillo para evitar daños en la agarosa o en el propio esferoide.
NOTA: El tamaño de los esferoides depende del número de células sembradas y de la línea celular, por lo que debe adaptarse en función de los experimentos.
- Prepare una solución de agarosa al 1% (p/v) en agua desionizada (DI).
- El modelo in ovo
- Coloque los huevos fertilizados de codorniz japonesa (C. japonica) en una incubadora (37 °C y 57% de humedad) en bandejas con un rotador automático que gira los huevos cada 2 h. Este día se considera Día del Embrión (DE) 0.
- Lave los botes de pesaje de plástico colocándolos en etanol al 70% (p/v). Saque los botes de pesaje y séquelos bajo una campana extractora.
NOTA: A partir de este punto, los experimentos no se realizan en condiciones estériles. Sin embargo, se requieren condiciones limpias para evitar el desarrollo de moho en los embriones. - En ED3, abra suavemente los huevos con una pinza con puntas delgadas prelavadas con etanol al 70% (p/v). Vierta el embrión en un bote de pesaje de plástico, cúbralo con otro bote de pesaje y colóquelo en una incubadora humidificada estándar a 37 °C durante 3 días.
- En ED6, hacer una pequeña incisión en la membrana corioalantoidea (CAM) con una aguja de 23 G.
- Usando una pipeta, coloque un esferoide de 7 días en la incisión y devuelva el embrión a la incubadora durante 3 días, hasta que se realicen más experimentos.
NOTA: Se puede inyectar un tinte fluorescente en el ojo del embrión para visualizar los vasos sanguíneos. - El día del experimento, coloque la sonda flexible sobre el tumor vascularizado usando un micromanipulador.
- El in vivo modelo
NOTA: Esta parte del protocolo está adaptada de la publicada anteriormente en referencia14. Se utilizaron ratones adultos fluorescentes multicolor AMU-Neuroinflam (B6.Cg-Tg(Thy1-CFP)23Jrs(Ly6a-EGFP)G5Dzk(Itgax-EYFP)1Mnz/FD); estos ratones presentan etiquetado de una subpoblación de Thy1+ neuronas por expresión transgénica de ECFP, marcaje de LyzM periférico+ células inflamatorias por expresión transgénica de EGFP y etiquetado de un subtipo de microglía que expresa EYFP bajo el control de Cd11c+. En resumen, los animales son ligeramente sedados con isoflurano al 1,5% durante 2 minutos antes de cualquier tratamiento o inyección. Antes de la cirugía, los animales son anestesiados con ketamina (120 mg/kg; IP) y xilazina (12 mg/kg; IP). Luego, el gel de lidocaína al 3% se aplica localmente para aliviar cualquier dolor en los oídos asociado con la fijación del soporte estereotáctico. Luego, se administra una solución de bupivacaína al 0,25% en el sitio quirúrgico para aliviar cualquier dolor debido a la craneotomía. Una vez preparado el ratón para la cirugía, se realizó una craneotomía de 4 mm de diámetro según referencia14. Con una aguja de 26 G, se hizo un orificio en la duramadre en el medio de la craneotomía y se inyectó el esferoide tumoral con el sistema de inyección descrito en la referencia14. Además, como se describe aquí, se colocó un electrodo flexible en el esferoide tumoral GCamp6 o DsRed antes de sellar la craneotomía con una ventana de vidrio.- Coloque una gota de solución salina tamponada con fosfato (DPBS) de Dulbecco para que cubra la craneotomía. Coloque el electrodo flexible en la gota de DPBS y coloque suavemente la parte posterior de la sonda con almohadillas de contacto en la parte posterior del ratón (Figura 4B).
NOTA: Use guantes estériles y una técnica de "solo punta". Cambie los guantes si entra en contacto con una superficie no estéril. Proporcione soporte térmico durante este procedimiento. - Toque la gota de DPBS con un pequeño trozo de papel para absorber DPBS hasta que la sonda pueda colocarse plana sobre la duramadre y seguir la curvatura del cerebro. Asegúrese de que una pequeña capa de DPBS permanezca debajo de los electrodos sin escapar del lado del electrodo. Esto asegura una barrera contra el derrame de pegamento durante los siguientes pasos.
NOTA: Esterilice todo el equipo antes de usarlo. - Coloque una pequeña gota de adhesivo de silicona sobre la sonda y cúbrala con un vidrio de cubierta redonda de 5 mm. Empuje el vidrio de la cubierta hacia abajo hasta que la silicona se distribuya uniformemente y la distancia entre el vidrio de la cubierta y la sonda sea mínima. Empuje el vidrio de la cubierta hacia abajo durante otros 30 s para que la silicona pueda solidificarse.
- Para asegurar el vidrio de la cubierta, aplique rápidamente superglue en sus lados y empújelo hacia abajo hasta que el pegamento se cure a sólido.
- Usando un palillo de dientes, aplique superglue en el cuello de la sonda teniendo cuidado de que el superglue se dibuje debajo del cuello para proporcionarle un soporte estable.
- Cubra el cráneo con cemento dental para construir una tapa crónica. Tenga especial cuidado de cubrir solo los bordes del vidrio de la cubierta.
- Levante la parte posterior de la sonda y aplique cemento debajo del cuello de la sonda. Coloque la sonda sobre el cemento antes de que se cure. Empuje suavemente el cuello de la sonda con pinzas romas para que su superficie esté al mismo nivel que la del vidrio de la cubierta y no en el camino del objetivo del microscopio durante el experimento.
- Cubra la parte superior del cuello de la sonda con no más de 1,5 mm de capa de cemento dental para lograr una sujeción firme de la sonda. Construya un pozo de cemento que presente una cresta de 1,5 mm a una distancia de 1-2 mm alrededor del vidrio de la cubierta para crear un recipiente para el fluido de inmersión para la obtención de imágenes de dos fotones (Figura 4C).
- Después de que el cemento se haya curado, aplique analgésicos postquirúrgicos de buprenorfina (0,05 mg / kg, 0,1 ml por 10 g de peso corporal por vía subcutánea) y mantenga al animal en un ambiente cálido hasta que se despierte. Esto incluye la proximidad a una bombilla infrarroja, así como envolver al animal en una toalla de papel.
NOTA: Coloque un termómetro al nivel del ratón para controlar la temperatura. - Caracterizar la impedancia en el rango de 1-10 kHz utilizando un potenciostato.
- Deje que el animal se recupere de la cirugía durante al menos 10 días. Administrar medicamentos antiinflamatorios inmediatamente después de la cirugía y continuar monitoreando el estado del animal para proporcionar una analgesia postoperatoria adecuada.
- Coloque una gota de solución salina tamponada con fosfato (DPBS) de Dulbecco para que cubra la craneotomía. Coloque el electrodo flexible en la gota de DPBS y coloque suavemente la parte posterior de la sonda con almohadillas de contacto en la parte posterior del ratón (Figura 4B).
4. Suministro de campo eléctrico pulsado (PEF) e imágenes
- Coloque las muestras bajo un microscopio de fluorescencia. En el caso de los modelos 3D, los tumores solo se pueden observar desde la parte superior.
NOTA: Para el modelo in ovo , los experimentos se realizaron bajo un microscopio de epifluorescencia (pero también es posible con un microscopio de dos fotones), mientras que los experimentos en el modelo in vivo se realizaron bajo un microscopio de dos fotones (Figura 6). - Conecte un generador de impulsos a las almohadillas de contacto de los dispositivos, utilizando conectores de pin pogo (in vitro) o pinzas de cocodrilo (in ovo e in vivo) (Figura 4A). Establezca los parámetros deseados (número de pulsos, voltaje, duración del pulso, frecuencia) y aplique PEF haciendo funcionar el generador (Figura 4A). Mida la fluorescencia simultáneamente para observar los efectos de los PEF en tiempo real.
Resultados
Este protocolo permite la aplicación a dos modelos de glioblastoma en los que se integra un sistema flexible de administración de PEF. Después de los pasos de microfabricación y empaquetado, los electrodos flexibles se caracterizan en solución salina mediante espectroscopia de impedancia electroquímica (EIS) para evaluar y validar su rendimiento. Los electrodos recubiertos con PEDOT:PSS muestran las regiones típicas dominadas capacitivas y resistivas separadas por una frecuencia de corte, mientras que los electrodos no recubiertos muestran solo un comportamiento capacitivo (Figura 2).
Se utiliza una variación del método de placa de 96 pocillos de recubrimiento líquido para hacer crecer tumores 3D hechos de células de glioblastoma transfectadas que expresan de manera estable un reportero de calcio intracelular fluorescente. El crecimiento de los esferoides se puede observar con un microscopio de campo claro (Figura 3; ED 0). Se necesitan al menos 2 o 3 días para obtener esferoides esféricos y densos, dependiendo de la línea celular y del número de células sembradas.
En el modelo in ovo , los esferoides se injertan en la membrana corioalantoidea de un embrión de codorniz (Figura 3; ED 6). El éxito del injerto puede evaluarse mediante microscopía de fluorescencia unos días más tarde, ya que las células vivas tienen calcio intracelular y, por lo tanto, son fluorescentes (Figura 3; ED 9). La vascularización del tumor se puede observar bajo un microscopio de fluorescencia mediante la inyección de un tinte fluorescente en los vasos sanguíneos (Figura 3; ED9). Sin embargo, es posible que no siempre sea posible visualizar los vasos sanguíneos dentro del tumor, ya que el esferoide es muy denso. Los electrodos interdigitados flexibles se colocan encima del tumor vascularizado (Figura 3; ED 9) y conectado a un generador de pulsos. La sonda debe colocarse suavemente para evitar el sangrado del embrión; De lo contrario, el tinte fluorescente puede propagarse, lo que obstruye cualquier observación por imágenes. La entrega correcta del pulso al entorno biológico se puede verificar midiendo la corriente que pasa a través del circuito. La obtención de imágenes de estos modelos in ovo permite monitorizar en tiempo real el efecto de los PEFs sobre el calcio intracelular en un tumor de glioblastoma 3D, así como la vasoconstricción inducida sobre la vasculatura del tumor, evitando cualquier influencia de otros tipos celulares, incluido el sistema inmune15.
El estudio del efecto de la PEF sobre el glioblastoma también se puede realizar en un modelo más completo y predictivo. De hecho, el modelo in vivo descrito anteriormente14 consiste en injertar un tumor de glioblastoma 3D en el parénquima cerebral de un ratón (Figura 4). El sitio de inyección del tumor está tapado por una hemiperla de gel de dextrano reticulada, para recapitular las limitaciones biofísicas fisiológicas durante el crecimiento del tumor. Aunque se describe en la referencia14, vale la pena volver a enfatizar que es de vital importancia que la hemiperla de dextrano esté precisamente superpegada a la duramadre; De lo contrario, el tumor puede escapar a través de la duramadre abierta y cubrir completamente el cerebro, lo que hace que la imagen sea imposible. Para cualquier imagen crónica, el crecimiento interno del tejido que tiene lugar a medida que la ventana craneal sana plantea una barrera seria, ya que el nuevo tejido no es transparente y hace que las imágenes sean borrosas o inutilizables. Por lo tanto, después de insertar y pegar la hemiperla, las paredes laterales de la ventana craneal abierta deben sellarse con una capa delgada de superglue meticulosamente colocada alrededor de la pared de la cavidad, sin dejar que el superglue se deslice o fluya hacia la duramadre. Cuando la sonda flexible se coloca en la parte superior del sitio de inyección del tumor, no pueden permanecer burbujas debajo de la sonda, por dos razones. En primer lugar, las imágenes no pueden continuar cuando hay burbujas presentes. En segundo lugar, las burbujas sirven como aislantes, cambiando así las propiedades de estimulación eléctrica. Después de tomar las precauciones descritas anteriormente, la craneotomía se sella con una ventana de vidrio cementada al cráneo para permitir imágenes crónicas durante semanas. Como el tumor consiste en células que expresan GCaMP o DsRed, la inyección se puede confirmar con un microscopio de fluorescencia. La impedancia electroquímica de los electrodos debe medirse para validar el rendimiento después de la implantación. En comparación con la impedancia en solución salina, se espera un aumento de la impedancia in vivo a frecuencias superiores a 100 Hz debido a la presencia de un entorno biológico (Figura 5). El parénquima neural vascularizado y la infiltración tumoral se pueden observar y caracterizar a través del sustrato transparente durante semanas mediante microscopía de dos fotones (Figura 6). El uso de animales transgénicos que expresan proteínas fluorescentes en células de interés (células inmunes y neuronas) puede, por ejemplo, permitir la demostración del proceso inflamatorio mínimo inducido por la implantación de electrodos solos (Figura 6A) o mostrar la presencia de microglía y monocitos 26 días después de la implantación de un electrodo estimulado por PEF implantado sobre un tumor GBM en crecimiento (Figura 6B1 ). En este último caso, se encontraron tanto células derivadas de monocitos periféricos como células microgliales residentes en el cerebro alrededor y dentro del tumor (Figura 6B2). El día de la entrega de PEF, las almohadillas de contacto de los electrodos flexibles se pueden conectar al generador de impulsos, directamente bajo el microscopio de dos fotones. En general, este modelo se puede utilizar para investigar el efecto de los tratamientos bioeléctricos a lo largo del tiempo utilizando varios tipos de células involucradas en el desarrollo de tumores cerebrales, hasta una profundidad de alrededor de 500 μm.
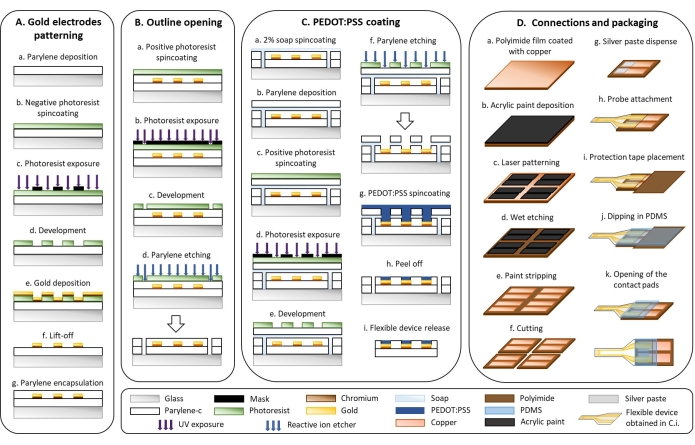
Figura 1: Microfabricación de electrodos flexibles . (A) Modelado de electrodos de oro y sustrato de Parylene C. (B) Apertura del contorno. (C) Recubrimiento PEDOT:PSS. (D) Conexiones y embalaje. Haga clic aquí para ver una versión más grande de esta figura.
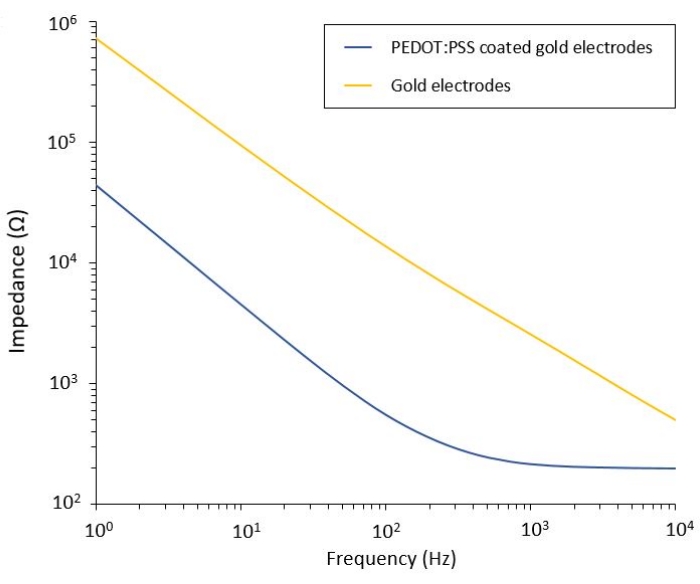
Figura 2: Espectroscopia de impedancia electroquímica de electrodos de oro flexibles y electrodos fríos recubiertos con PEDOT:PSS en una solución salina. Haga clic aquí para ver una versión más grande de esta figura.
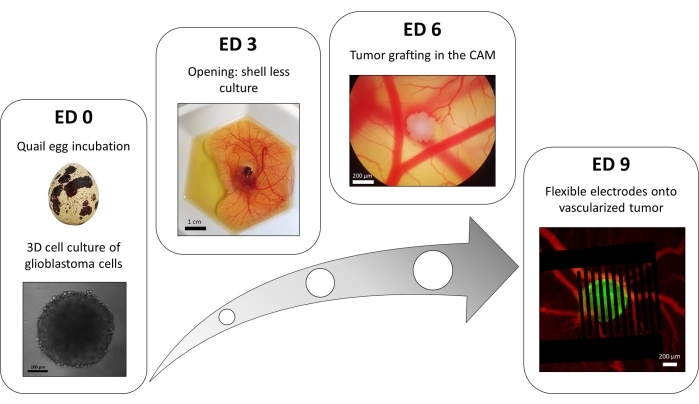
Figura 3: El modelo in ovo del glioblastoma. ED 0: Esferoide observado con un microscopio de campo claro. ED 3: Cultivo sin cáscara de un embrión de codorniz 3 días después de la apertura. ED 6: Tumor implantado en la CAM observado con un microscopio de campo claro. ED 9: Dispositivo flexible colocado sobre el tumor vascularizado (tumor en verde y vasos sanguíneos en rojo). Haga clic aquí para ver una versión más grande de esta figura.
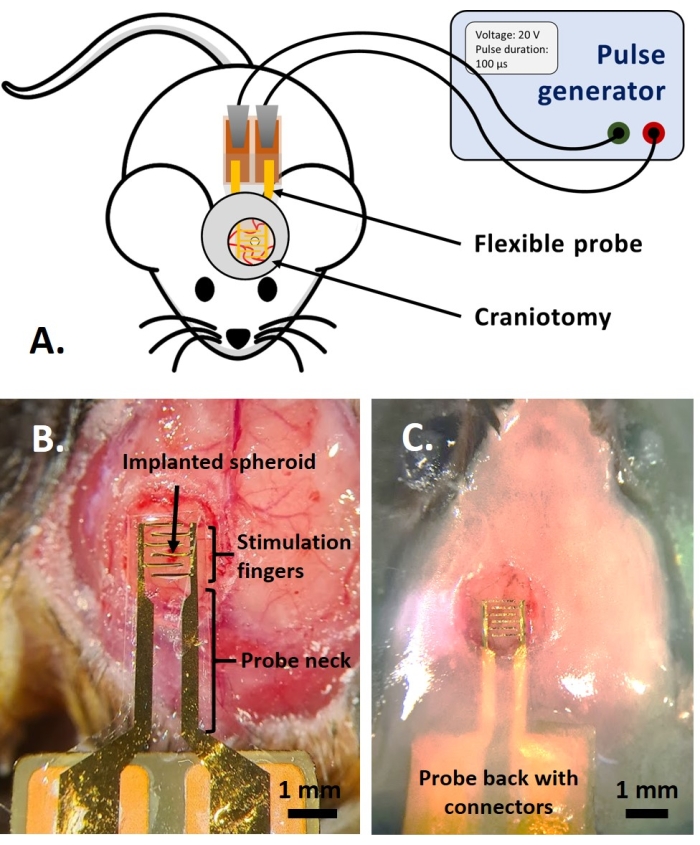
Figura 4: La aplicación in vivo. (A) Esquema para experimentos in vivo. (B) Colocación de la sonda antes de la aplicación de vidrio de cubierta y resina acrílica. (C) Implantación completa de la sonda. Haga clic aquí para ver una versión más grande de esta figura.
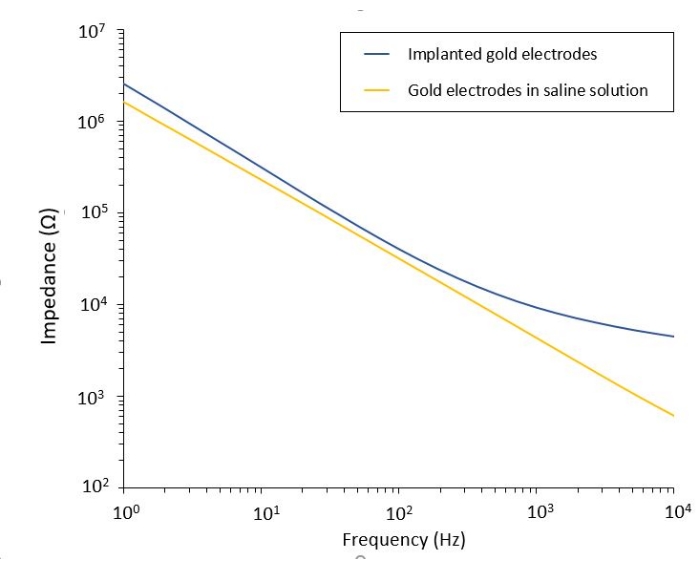
Figura 5: Espectroscopia de impedancia electroquímica de electrodos de oro flexibles en una solución salina en comparación con una sonda implantada. Haga clic aquí para ver una versión más grande de esta figura.
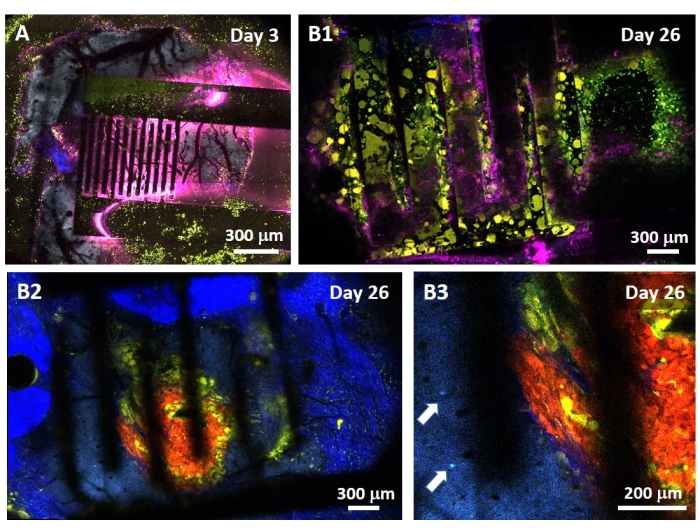
Figura 6: Imágenes intravitales multiespectrales de dos fotones a través de electrodos . (A) Imagen en mosaico de la superficie cerebral sana en un ratón control multifluorescente AMU-Neuroinflam 3 días después de la implantación del electrodo. El cian muestra la arborización dendrítica de las neuronas piramidales de la capa 5, el verde muestra granulocitos y monocitos reclutados, y el amarillo muestra microglía activada y células dendríticas. El rosa muestra difusión infrarroja debido a la acumulación de calor. (B1) Imagen similar a la de A , pero 26 días después de la implantación del esferoide tumoral 200 μm de profundidad dentro de la corteza seguida inmediatamente por la implantación del electrodo. Tenga en cuenta la acumulación de células inmunes verdes y amarillas. (B2) Imagen similar a la de B1 pero 100 μm por debajo de la superficie de los electrodos. Nótese la presencia de arborización dendrítica neuronal azul en la periferia de la masa tumoral roja infiltrada por la microglía amarilla y las células dendríticas. El azul profundo muestra una segunda señal armónica del colágeno peritumoral. (B3) Vista ampliada de B2 que muestra la presencia de somas interneuronales (indicados por flechas) en las proximidades del tumor. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El enfoque descrito en este trabajo permite que los modelos de tumores cerebrales con un sistema integrado de administración de PEF estudien el efecto de los PEF en diferentes niveles de organización biológica. El protocolo de microfabricación consiste en procesos estándar de película delgada, que proporcionan un alto grado de libertad en el diseño de electrodos que se puede adaptar a la aplicación específica. A veces, un paso adicional de recocido térmico puede ser útil al final de la fabricación, para reducir la flexión de los electrodos que se produjo durante la fabricación.
El uso de una línea celular estable de glioblastoma que expresa un indicador de calcio fluorescente evita todas las complicaciones relacionadas con la administración y retención del colorante, especialmente en tumores 3D que son muy densos16. De hecho, se observa un alto nivel de expresión durante un largo período en comparación con los indicadores químicos estándar de calcio fluorescente17. Este protocolo puede ser aplicado a varias líneas celulares, ya que es comúnmente utilizado para la obtención de imágenes de la actividad neuronal11. Aquí se utilizaron líneas celulares humanas y murinas (U87 y Gl261 para la implantación en ratones inmunodeficientes o inmunocompetentes, respectivamente). De hecho, estudios recientes mostraron que la línea celular U87 es diferente de la de las células originales, ya que muchas mutaciones fueron adquiridas durante años de cultivo celular, afectando la reproducción experimental18. El método utilizado para la preparación de tumores 3D es de alto rendimiento, reproducible, y permite la generación de esferoides de un tamaño específico dependiendo de la línea celular, el número de células en la siembra y el tiempo de crecimiento19. Sin embargo, estos esferoides son densos, lo que presenta una desventaja cuando se obtienen imágenes en el núcleo del tumor.
El modelo in ovo es útil como primer enfoque para estudiar el efecto de la FPE en tumores 3D y su vasculatura, sin interacciones con otros tipos de células que están presentes en el cerebro. Este modelo es barato, rápido, de alto rendimiento y plantea menos problemas éticos que los modelos animales. Es importante mantener la integridad del embrión durante todo el experimento, ya que podría afectar su supervivencia y la calidad de la imagen. Se debe tener especial cuidado al abrir el huevo de codorniz, para evitar daños en la membrana embrionaria. El injerto y la colocación de los electrodos flexibles también deben realizarse con cuidado, para evitar sangrados que podrían matar al embrión. La inyección de colorante fluorescente en los vasos sanguíneos permite la visualización simultánea de las células tumorales y la vascularización con microscopía de fluorescencia. La inyección intraocular debe realizarse con cuidado para evitar que el tinte se filtre en el líquido embrionario, lo que podría causar una fluorescencia residual en el fondo que degrada la calidad de la imagen. Este modelo también se puede utilizar para seguir la absorción de fármacos, ya que permite el acceso al sistema circulatorio. Sin embargo, los experimentos están limitados por el tiempo de supervivencia de 12 días del embrión, lo que permite 7 días de observación, que es significativamente más corto que el modelo in vivo 21.
El modelo de tumor cerebral in vivo se puede monitorear durante 4 a 5 semanas antes de que los animales alcancen un punto final experimental ético determinado por una pérdida repentina de peso del 20%. Es bien tolerado y permanece en su lugar si la cola de conexión del electrodo no es demasiado larga. De lo contrario, los animales tienden a rayar el conector giratorio, que en última instancia podría romperse, lo que impide la conexión posterior al estimulador. Sin embargo, este período de 4 semanas es valioso para cubrir las diferentes etapas del desarrollo del glioblastoma. Al comparar las densidades de células tumorales en el mismo volumen de interés en diferentes intervalos de tiempo, se puede observar la evolución de la cinética de crecimiento tumoral. En particular, se observó un mayor crecimiento tumoral en el momento del cambio inmune22. Un estudio similar en presencia de un electrodo estimulante informaría sobre el efecto de la FPE sobre la tasa de proliferación tumoral y la sensibilidad tumoral a la eliminación inmune. En comparación con el modelo in ovo , el modelo in vivo puede verse como un modelo preclínico valioso para estudiar el impacto de las células inmunes en la progresión tumoral y su contribución al efecto terapéutico de la FPE. Este protocolo está adaptado de un artículo anterior con la adición de un dispositivo de electrodo flexible en el tumor antes de colocar una ventana craneal14. Tanto los tratamientos bioeléctricos agudos como los crónicos de los tumores pueden caracterizarse por observaciones directas y posteriores con microscopía de dos fotones, dado que se espera que la estimulación inicial induzca la muerte celular y desencadene una desregulación duradera de la respuesta inmune.
Las conexiones de la sonda flexible son fácilmente accesibles bajo el microscopio de dos fotones. Por lo tanto, los parámetros de estimulación eléctrica se pueden ajustar en tiempo real en función del efecto observado en el tejido neural y / o las células objetivo, de manera similar a cómo un médico realizaría procedimientos intervencionistas mientras observa imágenes de resonancia magnética o tomografía computarizada de su paciente. Una consideración final es la importancia de sellar cuidadosamente el electrodo en el cerebro con superglue y pegamento de silicona para prevenir el crecimiento del tejido.
En conclusión, el protocolo descrito aquí representa un modelo innovador para estudiar el efecto de la terapia PEF con electrodos de polímeros orgánicos flexibles para modelos tumorales de glioblastoma. Los dos modelos exhiben diferentes niveles de complejidad, de modo que los efectos celulares, vasculares o inmunes se pueden separar para una mejor comprensión de los mecanismos de acción. Los electrodos superficiales conformes reducen el daño iatrogénico al tiempo que permiten la interrupción del microambiente tumoral, desencadenando vasoconstricción o desregulación del calcio intracelular15.
Divulgaciones
Los autores declaran que no tienen intereses financieros contrapuestos.
Agradecimientos
El trabajo aquí reportado fue apoyado por la Agencia Nacional de Investigación de Francia (ANR-18-CE19-0029). Los autores agradecen calurosamente a S.M. Bardet por su contribución a la generación de una línea celular GCaMP6f estable y a D. O'Connor por su ayuda con el modelo in ovo .
Materiales
| Name | Company | Catalog Number | Comments |
| (3-Glycidyloxypropyl)trimethoxysilane | Sigma | 440167 | GOPS |
| 0.25% Trypsin-EDTA (1X) | Gibco | 25200-056 | |
| 4-Dodecylbenzenesulfonic acid | Sigma | 44198 | DBSA |
| 96-well plate | Falcon | 353075 | |
| Acetone | Technic | 530 | |
| Acrylic resin | Fischer scientific | NC1455685 | |
| agarose | Sigma | A9539 | |
| autoclave | Tuttnauer | 3150 EL | |
| AZ 10XT | Microchemicals | Positive photoresist | |
| AZ 826 MIF Developer | Merck | 10056124960 | Metal-ion-free developer for the negative photoresist |
| AZ Developer | Merck | 10054224960 | Metal-ion-free developer for the positive photoresist |
| AZ nLof 2070 | Microchemicals | Negative photoresist | |
| Buprenorphine | Axience | ||
| Carprofen | Rimadyl | ||
| Centrifuge Sorvall Legend X1R | Thermo Scientific | 75004260 | |
| CMOS camera Prime 95B | Photometrics | ||
| CO2 incubator HERAcell 150i | Thermo scientific | ||
| DAC board | National Instruments | USB 6259 | |
| Déco spray Pébéo | Cultura | 3167860937307 | Black acrylic paint |
| Dextran Texas Red 70.000 | Thermofisher | D1830 | |
| Die bonding paste "Epinal" | Hitachi | EN-4900GC | Silver paste |
| Dimethyl sulfoxide | Sigma | D2438 | |
| Dispensing machine | Tianhao | TH-2004C | |
| Dulbecco’s Modified Eagle’s Medium + GlutaMAX™-I | Gibco | 10567-014 | |
| Dulbecco's Modified Eagle's Medium | Sigma | D6429 | |
| Egg incubator COUVAD'OR 160 | lafermedemanon.com | ||
| Ethylene glycol | Carl Roth | 6881.1 | |
| Fertilized eggs of Japanese quail | Japocaille | ||
| Fetal Bovine Serum | VWR | S181BH | |
| Flask | Greiner | 658170 | |
| Fluorescence macroscope | Leica MZFLIII | ||
| Gl261 | DSMZ | ACC 802 | |
| Gold pellets - Dia 3 mm x 6 mm th | Neyco | ||
| Handheld automated cell counter | Millipore | PHCC00000 | |
| Heating and drying oven | Memmert | UF110 | |
| Hexadimethrine Bromide Sequa-brene | Sigma | S2667 | |
| hot plate Delta 6 HP 350 | Süss Microtec | ||
| Illumination system pE-4000 | CoolLed | ||
| Infrared tunable femtosecond laser (Maï-Taï) | Spectra Physics (USA) | ||
| Ionomycin calcium salt | Sigma | I3909 | |
| Kapton tape SCOTCH 92 33x19 | 3M | Polyimide protection tape | |
| Lab made pulse generator | |||
| Labcoter 2 Parylene Deposition system PDS 2010 | SCS | ||
| Lenti-X 293 T cell line | Takara Bio | 63218 | HEK 293T-derived cell line optimized for lentivirus production |
| Lenti-X GoStix Plus | Takara Bio | 631280 | Quantitative lentiviral titer test |
| Mask aligner MJB4 | Süss Microtec | ||
| Micro-90 Concentrated cleaning solution | International Products | M9050-12 | |
| Microscope slides 76 x 52 x 1 mm | Marienfeld | 1100420 | |
| Needles 30G | BD Microlance 3 | 304000 | |
| PalmSens4 potentiostat | PalmSens | ||
| parylene-c : dichloro-p-cyclophane | SCS | 300073 | |
| PCB Processing Tanks | Mega Electronics | PA104 | |
| PEDOT:PSS Clevios PH 1000 | Heraeus | ||
| penicillin / streptomycin | Gibco | 15140-122 | |
| Petri dish | Falcon | 351029 | |
| pGP-CMV-GCaMP6f | Addgene | 40755 | plasmid |
| Phosphate Buffer Saline solution | Thermofisher | D8537 | |
| Plasma treatment system PE-100 | Plasma Etch | ||
| PlasmaLab 80 Reactive Ion Etcher | Oxford Instruments | ||
| Plastic mask | Selba | ||
| Plastic weigh boat 64 x 51 x 19 mm | VWR | 10770-454 | |
| Poly-dimethylsiloxane: SYLGARD 184 Silicone Elastomer Kit | Dow chemicals | 1673921 | |
| Polyimide copper film 60 µm (Kapton) | Goodfellow | IM301522 | |
| Propan-2-ol | Technic | 574 | |
| Protolaser S | LPKF | ||
| puromycin | Gibco | A11103 | |
| Round cover glass 5 mm diameter | Fischer scientific | 50-949-439 | |
| Scepter Sensors - 60 µm | Millipore | PHCC60050 | |
| Silicone adhesive Kwik-Sil | World Precision Instruments | ||
| spin coater | Süss Microtec | ||
| Spin Coater | Laurell | WS-650 | |
| Super glue | Office depot | ||
| tetracycline-free fœtal bovine Serum | Takara Bio | 631105 | |
| Thermal evaporator Auto 500 | Boc Edwards | ||
| Two-photon microscope | Zeiss LSM 7MP | ||
| U87-MG | ATCC | HTB-14 | Human glioblastoma cells |
| Ultrasonic cleaner | VWR | ||
| Vortex VTX-3000L | LMS | VTX100323410 | |
| Xfect single shots reagent | Takara Bio | 631447 | Transfection reagent |
Referencias
- Koshy, M., et al. Improved survival time trends for glioblastoma using the SEER 17 population-based registries. Journal of Neuro-Oncology. 107 (1), 207-212 (2012).
- Davis, M. E. Glioblastoma: Overview of disease and treatment. Clinical Journal of Oncology Nursing. 20, 2-8 (2016).
- Edd, J. F., Horowitz, L., Davalos, R. V., Mir, L. M., Rubinsky, B. In vivo results of a new focal tissue ablation technique: irreversible electroporation. IEEE transactions on Bio-Medical Engineering. 53 (7), 1409-1415 (2006).
- Breton, M., Mir, L. M. Microsecond and nanosecond electric pulses in cancer treatments. Bioelectromagnetics. 33 (2), 106-123 (2012).
- Frandsen, S. K., et al. Direct therapeutic applications of calcium electroporation to effectively induce tumor necrosis. Cancer Research. 72 (6), 1336-1341 (2012).
- Lee, J. H., Kim, H., Kim, J. H., Lee, S. -. H. Soft implantable microelectrodes for future medicine: prosthetics, neural signal recording and neuromodulation. Lab on a Chip. 16 (6), 959-976 (2016).
- Lee, H., Bellamkonda, R. V., Sun, W., Levenston, M. E. Biomechanical analysis of silicon microelectrode-induced strain in the brain. Journal of Neural Engineering. 2 (4), 81-89 (2005).
- Fattahi, P., Yang, G., Kim, G., Abidian, M. R. A review of organic and inorganic biomaterials for neural interfaces. Advanced Materials. 26 (12), 1846-1885 (2014).
- Lecomte, A., Degache, A., Descamps, E., Dahan, L., Bergaud, C. In vitro and in vivo biostability assessment of chronically-implanted Parylene C neural sensors. Sensors and Actuators B: Chemical. 251, 1001-1008 (2017).
- Dijk, G., Ruigrok, H. J., O'Connor, R. P. PEDOT:PSS-coated stimulation electrodes attenuate irreversible electrochemical events and reduce cell electropermeabilization. Advanced Materials Interfaces. 8 (19), 2100214 (2021).
- Chen, T. -. W., et al. Ultra-sensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Ribatti, D. Chapter 5 Chick embryo chorioallantoic membrane as a useful tool to study angiogenesis. International Review of Cell and Molecular Biology. 270, 181-224 (2008).
- Valdes, T. I., Kreutzer, D., Moussy, F. The chick chorioallantoic membrane as a novel in vivo model for the testing of biomaterials. Journal of Biomedical Materials Research. 62 (2), 273-282 (2002).
- Ricard, C., Stanchi, F., Rougon, G., Debarbieux, F. An orthotopic glioblastoma mouse model maintaining brain parenchymal physical constraints and suitable for intravital two-photon microscopy. Journal of Visualized Experiments: JoVE. (86), e51108 (2014).
- Lefevre, M. C. Integrating flexible electronics for pulsed electric field delivery in a vascularized 3D glioblastoma model. npj Flexible Electronics. 5, 19 (2021).
- Perry, J. L., Ramachandran, N. K., Utama, B., Hyser, J. M. Use of genetically-encoded calcium indicators for live cell calcium imaging and localization in virus-infected cells. Methods. 90, 28-38 (2015).
- Blömer, U., et al. Highly efficient and sustained gene transfer in adult neurons with a lentivirus vector. Journal of Virology. 71 (9), 6641-6649 (1997).
- Lenting, K., Verhaak, R., ter Laan, M., Wesseling, P., Leenders, W. Glioma: experimental models and reality. Acta Neuropathologica. 133 (2), 263-282 (2017).
- Hickman, J. A., et al. Three-dimensional models of cancer for pharmacology and cancer cell biology: Capturing tumor complexity in vitro/ex vivo. Biotechnology Journal. 9 (9), 1115-1128 (2014).
- Tay, S. L. M., Heng, P. W. S., Chan, L. W. The CAM-LDPI method: a novel platform for the assessment of drug absorption. Journal of Pharmacy and Pharmacology. 64 (4), 517-529 (2012).
- Kundeková, B., Máčajová, M., Meta, M., Čavarga, I., Bilčík, B. Chorioallantoic Membrane Models of Various Avian Species: Differences and Applications. Biology. 10 (4), 301 (2021).
- Ricard, C., et al. Phenotypic dynamics of microglial and monocyte-derived cells in glioblastoma-bearing mice. Scientific Reports. 6 (1), 26381 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados