Method Article
Sondas de amarre de medidor de tensión para cuantificar la mecánica y la adhesión de la integrina mediada por el factor de crecimiento
En este artículo
Resumen
TGT surface es una plataforma innovadora para estudiar la diafonía factor de crecimiento-integrina. El diseño flexible de la sonda, la especificidad del ligando de adhesión y la modulación precisa de las condiciones de estimulación permiten evaluaciones cuantitativas sólidas de la interacción EGFR-integrina. Los resultados destacan a EGFR como un mecanismo de integrina de ajuste "mecano-organizador", que influye en el ensamblaje de la adhesión focal y la propagación celular.
Resumen
Los organismos multicelulares se basan en las interacciones entre los receptores de membrana y los ligandos afines en la matriz extracelular circundante (ECM) para orquestar múltiples funciones, incluida la adhesión, proliferación, migración y diferenciación. Las fuerzas mecánicas pueden transmitirse desde la célula a través del receptor de adhesión integrina a los ligandos en el ECM. La cantidad y la organización espacial de estas fuerzas generadas por las células pueden ser moduladas por los receptores del factor de crecimiento, incluido el receptor del factor de crecimiento epidérmico (EGFR). Las herramientas actualmente disponibles para cuantificar los cambios mediados por la diafonía en la mecánica celular y relacionarlos con las adherencias focales, la morfología celular y la señalización son limitadas. Se han empleado sensores de fuerza molecular basados en ADN conocidos como ataduras de medidor de tensión (TGT) para cuantificar estos cambios. Las sondas TGT son únicas en su capacidad para modular el umbral de fuerza subyacente e informar las fuerzas del receptor de escala piconewton en toda la superficie de la célula adherente a una resolución espacial limitada por difracción. Las sondas TGT utilizadas aquí se basan en la disociación irreversible de un dúplex de ADN por fuerzas de ligando receptor que generan una señal fluorescente. Esto permite cuantificar la tensión acumulativa de integrina (historial de fuerza) de la célula. Este artículo describe un protocolo que emplea TGT para estudiar el impacto de EGFR en la mecánica de la integrina y la formación de adherencia. El ensamblaje de la plataforma de detección mecánica TGT se detalla sistemáticamente y se describe el procedimiento para obtener imágenes de fuerzas, adherencias focales y propagación celular. En general, la capacidad de modular el umbral de fuerza subyacente de la sonda, el ligando de adhesión y el tipo y la concentración del factor de crecimiento empleado para la estimulación hacen de esta una plataforma robusta para estudiar la interacción de diversos receptores de membrana en la regulación de las fuerzas mediadas por integrina.
Introducción
Las células tienen la capacidad intrínseca de detectar, generar y responder a las fuerzas mecánicas, lo que lleva a cambios en el fenotipo celular y la remodelación del microambiente local 1,2. Las fuerzas juegan un papel crucial en la regulación de muchos aspectos del comportamiento celular, incluyendo la adhesión, la migración, la proliferación, la diferenciación y la cicatrización de heridas 3,4. Las aberraciones en el intercambio mecánico bidireccional entre una célula y el microambiente pueden conducir a estados enfermos, incluido el cáncer5. Numerosos receptores de membrana están involucrados en el mantenimiento de la homeostasis de la matriz celular; de estos, las integrinas y el receptor del factor de crecimiento epidérmico (EGFR) tienen una sinergia robusta 6,7. Clásicamente, las integrinas establecen el vínculo mecánico entre el microambiente y el citoesqueleto intracelular, mientras que el EGFR regula el crecimiento, la proliferación y la supervivencia celular 8,9. EGFR es una diana terapéutica muy estudiada, centrada en la regulación de afuera hacia adentro que facilita la señalización intracelular. La diafonía EGFR-integrina se ha establecido genética y bioquímicamente para regular la progresión de múltiples enfermedades, incluido el cáncer10,11. Si bien los estudios indican la existencia de interacción EGFR-integrina, los resultados se atribuyen a las vías de señalización lejos de la membrana plasmática 7,12,13,14. El impacto de EGFR, u otros factores de crecimiento, en la mecánica celular permanece en gran medida inexplorado en parte debido a la falta de herramientas para medir las fuerzas celulares y los resultados de la señalización. El desafío radica en identificar herramientas apropiadas para estudiar la comunicación entre estos paradigmas de señalización paralela y cuantificar sus contribuciones específicas a la mecánica celular.
Se han desarrollado varios enfoques para medir las fuerzas generadas por los receptores de adhesión celular, y el lector se dirige a revisiones en profundidad de estas técnicas15,16. Brevemente, la microscopía de fuerza de tracción y la detección de matrices de micropilares se basan en la deformación de un sustrato subyacente para inferir fuerzas de nanonewton (nN), un orden de magnitud más que las fuerzas de receptores individuales17,18. Las técnicas de molécula única, incluidas la AFM y las pinzas ópticas, son sensibles a las fuerzas de piconewton (pN) de una sola proteína, pero miden solo un receptor a la vez y no ofrecen una buena (o ninguna) resolución espacial. Las sondas de tensión molecular basadas en ADN y las sondas de amarre de medidor de tensión (TGT) ofrecen resolución de fuerza de pN con resolución espacial limitada por difracción (o mejor), lo que les da un papel único en el estudio de las fuerzas de una sola célula19,20 de diversos tipos de células, incluidos fibroblastos, células cancerosas, plaquetas y células inmunes 21,22,23,24 . Mientras que las sondas de tensión molecular tienen un elemento de "resorte" extensible, ideal para imágenes en tiempo real, las sondas TGT se rompen irreversiblemente, dejando atrás una "historia de fuerza" fluorescente. Los TGT modulan adicionalmente el umbral de tensión del sustrato subyacente; se puede utilizar una serie de sondas con composiciones químicas similares pero diferentes fuerzas de ruptura, o tolerancias de tensión (Ttol), para cuantificar la tensión mínima requerida para la formación de adhesión focal y la propagación celular. Las sondas TGT consisten en dos cadenas de ADN complementarias, una anclada a la superficie y la otra que presenta un ligando a la célula. Si un receptor se une al ligando y ejerce una fuerza mayor que la Ttol de la sonda, las hebras se separarán. Ttol se define como la fuerza constante necesaria para romper el 50% de las sondas en un intervalo de 2 s en condiciones ideales. En las sondas TGT de "encendido", un quencher en la hebra superior se puede separar de un fluoróforo en la hebra inferior. Sólo cuando la sonda TGT se haya roto, presumiblemente por fuerzas mayores o iguales a Ttol, se generará una señal fluorescente. Las sondas TGT también se pueden fijar, lo que permite una fácil manipulación de los sistemas biológicos y pruebas de múltiples afecciones. Por estas razones, se utilizaron sondas TGT en este trabajo.
Se emplearon sondas TGT para estudiar cómo la adhesión celular dependiente de integrina y las fuerzas mecánicas son moduladas por EGFR21 activado. Este trabajo estableció a EGFR como un "mecano-organizador", afinando la organización de la adhesión focal y la generación de tensión. Además, se encontró que la estimulación de EGF influyó en la distribución y madurez de las adherencias focales y mejoró la propagación celular. Este enfoque podría usarse en estudios futuros para investigar cómo los factores de crecimiento influyen en las fuerzas mecánicas en la progresión y dinámica del tumor. Si bien se establece el papel de la diafonía EGFR-integrina en la regulación de la transición epitelial a mesenquimal, el papel de las fuerzas mecánicas en este proceso sigue siendo poco explorado10.
Aquí, se presenta un protocolo detallado para estos experimentos que cubre la síntesis y el ensamblaje de 56 sondas TGT pN, la generación de superficies TGT en cubiertas de vidrio, la aplicación de células Cos-7 en la superficie TGT y la estimulación con EGF, fijación y tinción de células con faloidina y un anticuerpo anti-paxillin, fluorescencia de reflexión interna total (TIRF) de alta resolución e imágenes de microscopía de contraste de interferencia de reflexión (RICM), y cuantificación de imágenes. Este protocolo, aunque escrito para investigar la estimulación EGF de las células Cos-7, es fácilmente adaptable para muchos experimentos basados en TGT. Diferentes ligandos, Ttol, tipos de células, parámetros de estimulación, proteínas marcadas después de la fijación y análisis cuantitativo se pueden sustituir fácilmente, lo que hace que este protocolo sea robusto y ampliamente útil.
Protocolo
1. Preparación de oligonucleótidos TGT
NOTA: Los detalles de la síntesis de la sonda de oligonucleótidos se describen aquí. Tenga en cuenta que algunas modificaciones y pasos de purificación se pueden subcontratar para la síntesis personalizada.
- Activar la amina primaria del péptido ciclo[Arg-Gly-Asp-D-Phe-Lys(PEG-PEG)] con el enlazador azide-NHS descrito por Zhang et al22 mezclando en una proporción de 1:1,5 (100:150 nmoles) en un volumen final de 10 μL dimetilformamida. Añadir 0,1 μL de la base orgánica trietilamina e incubar durante 12 h a 4° C.
- Purificar el producto mediante HPLC en fase inversa utilizando 0,1 M TEAA (disolvente A) y 100% acetonitrilo (disolvente B) con un caudal de 1 ml/ min y la condición inicial de disolvente B al 10% se establece en un gradiente de 0,5%/min. Combine los picos eluidos (absorbancia a 203 nm) y verifique mediante espectrometría de masas MALDI-TOF. El producto es cRGDfK-azide.
- Para generar la hebra superior de TGT, combine cRGDfK-azide y alkyne-21-BHQ2 oligonucleotide (hebra superior de TGT: 5Hexynyl/GTGAAATACCGCACAGATGCG/3BHQ_2) en una proporción de 2:1 (͂200 μM: 100 μM) en 100 μL de 1x salina tamponada con fosfato (PBS) con ascorbato de sodio de 5 mM y Cu-THPTA preformado de 0,1 μM. Deje que la reacción continúe durante un mínimo de 4 h a temperatura ambiente (RT) o durante la noche a 4 °C.
- Procese la mezcla a través del gel desalinizante P2 para eliminar el exceso de colorante, subproductos, disolvente orgánico y reactivos no reaccionados. Prepare la columna de centrífuga con 650 μL de gel P2 prehidratado girándola hacia abajo a 18.000 x g durante 1 min. Deseche el líquido de flujo y agregue la mezcla de reacción. Girar de nuevo a 18.000 x g durante 1 min y recoger el flujo. Llevar la mezcla de reacción a un volumen final de 300 μL con agua ultrapura.
NOTA: Prehidratar el gel P2 con agua durante 6 h. - Purificar la mezcla de reacción desalinizada mediante HPLC de fase inversa. Los disolventes orgánicos utilizados para esta purificación incluyen 0,1 M TEAA en H2O (disolvente A) y 100% MeCN (disolvente B, o la fase móvil).
- Antes de inyectar la mezcla, equilibre la columna con una condición inicial de 10% disolvente B con un gradiente de 1%/min. Ajuste el caudal a 1 ml/min. Inyecte la mezcla de reacción en el bucle de HPLC con una aguja de inyección de 500 μL.
- Recolecte el producto visualizando el pico de absorción a 260 nm para el ADN y 560 nm para el quencher BHQ2. Seque el producto eluido durante la noche en un concentrador centrífugo al vacío.
- Emplear la sustitución nucleófila para acoplar la hebra inferior de TGT al éster Cy3B-NHS como se describe en Ma et. al25. Mezclar 100 μM de la hebra inferior de 56 pN TGT (5Biosg/TTTTTT/iUniAmM/CGCATCTGTGCGGTATTTCACTTT) con 50 μg de éster Cy3B-NHS predisuelto en 10 μL de DMSO. Ajuste el pH de esta mezcla a 9 con bicarbonato de sodio de 0,1 M y lleve el volumen final a 100 μL con 1x PBS. Incubar la mezcla de reacción durante la noche en RT.
- Purifique la mezcla secuencialmente utilizando filtración en gel P2 y HPLC de fase inversa para separar reactivos, sales y disolventes orgánicos no reaccionados (descritos en los pasos 1.4 y 1.5).
- Estimar la concentración de los conjugados oligonucleótido-colorante purificados registrando su absorbancia a 260 nm utilizando un espectrofotómetro.
- Caracterizar los productos purificados mediante espectrometría de masas MALDI-TOF. Disolver el exceso de ácido 3-hidroxipicolínico en disolvente TA50 (50:50 v/v acetonitrilo y 0,1% TFA en ddH2O) para preparar la matriz MALDI fresca. Los pesos moleculares estimados y medidos para los productos etiquetados son: cRGDfK-1-BHQ2 - 8157.9 (calculado), 8160.1 (encontrado); Cy3B etiquetado 56 pN TGT - 10272.7 (calculado), 10295.8 (encontrado).
- Disuelva las hebras superior e inferior por separado en agua libre de nucleasa a una concentración entre 30-50 μM. Use puntas de pipeta sin DNasa para evitar la contaminación de la existencia. Conservar a 4 °C para aplicaciones a corto plazo o a -20 °C para aplicaciones a largo plazo. La estabilidad de los oligonucleótidos no se ve afectada por los ciclos repetidos de congelación-descongelación.
2. Preparación de la superficie
Día 1:
- Coloque las cubiertas de vidrio de 25 mm (hasta 8) en un estante de politetrafluoroetileno. Coloque el bastidor en un vaso de precipitados de borosilicato de 50 ml que contenga 40 ml de etanol a prueba de 200. Cubra el vaso de precipitados con película de parafina para evitar que entre agua y sonice a una frecuencia de funcionamiento de 35 kHz durante 10-15 min a RT (Figura 1A).
- Llene un vaso de precipitados de 50 ml con 40 ml de solución de piraña recién preparada mezclando ácido sulfúrico y peróxido de hidrógeno en una proporción de 3: 1 en un vaso de precipitados pyrex. Revuelva con una pipeta de vidrio. Transfiera el bastidor de la cubierta al vaso de precipitados e incube durante 30 minutos a RT en la campana de humos para grabar la superficie de la cubierta (Figura 1B).
NOTA: Use EPP completo, incluyendo una bata de laboratorio, guantes y gafas, y trabaje en la campana de humos químicos. Agregue peróxido de hidrógeno al ácido lentamente para evitar el sobrecalentamiento de la solución. - Después del grabado, use pinzas para transferir el estante de la cubierta a un vaso de precipitados con agua ultrapura. Repita este paso seis veces a intervalos de 15 s para neutralizar completamente el ácido (Figura 1C).
NOTA: Deje la solución de Piraña en la campana de humos químicos durante la noche antes de desecharla en el contenedor de desechos ácidos. - Inspeccione visualmente las cubiertas para asegurarse de que las superficies se vean limpias sin patrones ni partículas de polvo en la superficie del vidrio. Repita los pasos 2.1 a 2.4 si se detectan patrones o polvo.
NOTA: Pruebe la hidrofilia superficial sumergiendo las cubiertas tratadas en agua y retirándolas verticalmente. El agua en los cubrebocas tratados retrocede como una hoja uniforme para formar los anillos de Young en comparación con los cubrebocas no tratados que forman parches. - Transfiera la rejilla de la cubierta a un vaso de precipitados con etanol a prueba de 200 y lávela dos veces durante 15 s para equilibrar las superficies con disolvente orgánico. Transfiera el bastidor de cubiertas a una solución de etanol a prueba de 200 con APTES al 3% durante 1 h en RT para silanizar las cubiertas (Figura 1D). Cubra el vaso de precipitados con película de parafina.
NOTA: Los parámetros de deposición de APTES varían según el método de limpieza de la superficie, el contenido de agua del disolvente, la concentración de APTES, los tiempos de incubación y la temperatura para el recocido. - Sumerja el bastidor en un vaso de precipitados limpio con una solución de etanol a prueba de 200. Repita este lavado tres veces durante 15 s cada una (Figura 1E).
- Seque las cubiertas utilizando gas nitrógeno (N2) con baja presión de salida. Coloque los cubrehojas en un plato de poliestireno de 10 cm con un trozo de película de parafina colocado plano dentro de él. Asegúrese de que las cubiertas estén secas y separadas (Figura 1F).
- Añadir 100 μL de solución de biotina NHS de 2 mg/ml en DMSO a cuatro fundas colocadas sobre película de parafina. Coloque un "sándwich" con las otras cuatro fundas en la parte superior (dos fundas orientadas una hacia la otra con la solución de funcionalización en el medio) e incube el plato durante la noche a 4 ° C (Figura 1G).
NOTA: A 4 °C, el reactivo NHS es más estable, lo que facilita la funcionalización uniforme de la superficie. Además, el sándwich conserva reactivos. Evite agregar un exceso de solución en el sándwich, ya que puede filtrarse y hacer que las cubiertas se resbalen.
Día 2:
- Retire el plato de 4 °C y separe las fundas intercaladas. Oriente los resbalones en el bastidor con la superficie recubierta una frente a la otra como se muestra en la Figura 2A. Lávelos con una solución de etanol a prueba de 200 tres veces durante 15 s cada una. Secar con gas N2 y colocarlos en un plato nuevo con una película de parafina en su interior.
NOTA: Orientar los cubrehojas como se indica ayuda a identificar la superficie funcionalizada. - Lave los cubrehojas con 1 ml de 1x PBS tres veces para equilibrarlos de nuevo a la fase acuosa. Añadir 800 μL de albúmina sérica bovina (BSA) al 0,1% en 1x PBS (p/v) a cada una de las cubiertas e incubar en RT durante 30 min para pasivar la superficie y bloquear la unión no específica de los reactivos de funcionalización posteriores (Figura 2B).
- Después de la incubación, lave los cubrehojas tres veces con 1 ml de 1x PBS. Agregue 800 μL de 1 μg/ml de estreptavidina en 1x PBS a RT durante 45-60 min para funcionalizar los cobertores (Figura 2C).
NOTA: Conserve un cubrehojas sin estreptavidina para verificar la eficiencia de pasivación (opcional). Añadir10 nM moléculas biotiniladas e imagen utilizando condiciones experimentales. Esta intensidad de la superficie debe estar cerca del ruido oscuro de la cámara. - Simultáneamente con el paso 2.11, ensamble las sondas TGT (parte superior: hebra inferior en relación molar 1:1) a una concentración final de 50 nM en 100 μL de 1 M NaCl en un tubo de PCR utilizando un termociclizador. Disociar las hebras a 95 °C durante 5 min, y recocir gradualmente reduciendo la temperatura a 25 °C y manteniéndola durante 25 min (Figura 2D). Evite la exposición prolongada de las sondas TGT a la luz.
- Después de la incubación de estreptavidina, use 1x PBS para lavar las fundas tres veces. Agregue 100 μL de las sondas TGT preensambladas a cuatro de las cubiertas y haga sándwiches usando las 4 cubiertas restantes con el lado funcionalizado frente a las sondas (ocho superficies requieren cuatro tubos de sondas TGT hibridadas). Cubra con papel de aluminio e incube durante 1 h en RT para permitir la unión de la sonda a la superficie (Figura 2E).
- Después de la incubación, separe los sándwiches y lave los cubrehojas con 1x PBS tres veces. Las superficies TGT ya están listas para la obtención de imágenes. Ensamble cuidadosamente las cubiertas en cámaras de imágenes prelimpiadas y agregue 1x PBS para mantener las superficies hidratadas (Figura 2F).
NOTA: Apretar demasiado las cámaras agrietará la superficie. Evitar el secado de las superficies.
3. Preparación celular y tinción
- Para investigar el efecto de la estimulación del factor de crecimiento epidérmico (EGF) sobre la mecánica, la adhesión y la propagación celular de Cos-7, tripsinize las células Cos-7 con Tripsina-EDTA al 0,05% durante 2 min. Neutralizar la tripsina lavando con HBSS y centrifugando a 800 x g durante 5 min. Repita el paso de neutralización una vez más.
- Células de placa a una densidad de 4 x 104 celdas en las superficies TGT ensambladas en el Medio Águila Modificada (DMEM) de Dulbecco suplementado con 50 ng / ml de EGF o DMEM sin EGF. Permita que las células se propaguen durante 60 min a 37 °C con 5% de CO2 en una incubadora de cultivo celular (Figura 3A).
NOTA: Las células se incuban en DMEM sin suero para evitar la estimulación de los factores de crecimiento. El EGF se diluye en ácido acético de 10 mM para hacer un caldo de 1 mg/ml. Se utiliza a 50 ng/mL en DMEM para experimentos de imagen. - Después de la incubación, lave las células tres veces con 1x PBS y fije con 2 ml de paraformaldehído al 4% durante 12 min a RT (Figura 3B).
NOTA: Todos los pasos de incubación se realizan en un agitador rotativo a ~ 35 rpm para una propagación uniforme de las soluciones. Proteja las superficies TGT de la luz cubriéndolas hasta que estén listas para la obtención de imágenes. - Aspire el fijador y lave los cubrehojas cinco veces con 1x PBS a intervalos de 5 min a RT. Opcionalmente, incube los coverslips con 50 mM NH4Cl en 1x PBS durante 30 min a 37 °C para apagar la autofluorescencia asociada al paraformaldehído y lave tres veces con 1x PBS a intervalos de 5 min (Figura 3B).
- Agregue Buffer A (1x PBS, 5% de suero normal de caballo, 5% de suero de cabra normal, 1% de BSA, 0.025% de Tritón X-100) e incube durante 30 min a 37 ° C para bloquear y permeabilizar las células. Lavar tres veces con 1x PBS a intervalos de 5 minutos (Figura 3B).
- Coloque las cámaras de imágenes con fundas en un recipiente de humedad. Diluir el anticuerpo anti-paxillin primario (marcador de adhesión focal) a 1:250 en tampón de bloqueo (1x PBS, 5% de suero normal de caballo, 5% de suero normal de cabra, 1% de BSA, 0.005% tritón x-100). Incubar con 200 μL de solución primaria de anticuerpos por cápsula durante 2 h a 37 °C (Figura 3B).
NOTA: No deje que las superficies se sequen. - Lave los cubrehojas cinco veces con 1x PBS a intervalos de 5 minutos y devuélvalos al recipiente de humedad. Etiquetar las células simultáneamente con una mezcla de colorante conjugado de cabra anti-conejo anticuerpo secundario en dilución 1:800 y faloidina conjugada con colorante (actina) a 1:400 dilución en 200 μL de tampón de bloqueo por funda. Incubar a 37 °C durante 60 min (Figura 3B).
- Lave las superficies cinco veces con 1x PBS a intervalos de 5 minutos y guárdelas a 4 °C hasta que esté lista para la obtención de imágenes (Figura 3B).
NOTA: Muestras de imágenes dentro de los 3 días posteriores a la preparación de la superficie para evitar la degradación de la señal.
4. Adquisición de imágenes
- Utilice un objetivo de inmersión en aceite 60x con una alta apertura numérica (1.49) en un microscopio invertido con excitación TIRF 488, 561 y 647, excitación RICM, un sistema de enfoque perfecto y una cámara digital.
- Agregue aceite al objetivo, limpie la parte inferior de la cubierta de la cámara de muestra y coloque la muestra en el escenario. Concéntrese en una célula y enganche el enfoque perfecto.
- Coloque el microscopio en el modo de imágenes RICM con excitación por epifluorescencia y un cubo de filtro GFP con el filtro de emisión eliminado. Alinee el RICM cerrando y centrando el diafragma de apertura de epi-iluminación.
- Coloque el microscopio en modo TIRF con excitación láser y un cubo de filtro TIRF de cuatro pasos. Enfoca el láser de 488 nm a un pequeño punto en el techo de la habitación y aumenta el ángulo de incidencia hasta más allá del ángulo crítico mientras monitoreas la fluorescencia en la cámara en modo en vivo. Observe una reducción brusca en la fluorescencia de fondo y un solo plano de enfoque cuando se supere el ángulo crítico.
NOTA: TIRF excita una región delgada (~ 100 nm) más cercana a la interfaz muestra-cubierta, destacando las sondas TGT abiertas y las adherencias focales, al tiempo que elimina la fluorescencia fuera de foco desde el interior de la célula. Si TIRF no está disponible, se puede usar epifluorescencia; sin embargo, las relaciones señal-ruido serán más bajas. - Identifique las células para obtener imágenes utilizando el modo "en vivo" de la cámara utilizando RICM.
- Adquirir la imagen RICM y las imágenes TIRF de actina (640 nm ex), tensión de integrina (561 nm ex) y paxillin (488 nm ex). Obtener imágenes secuencialmente utilizando un tiempo de exposición de 200 ms.
NOTA: El tiempo de exposición depende de muchos factores, incluido el objetivo, la potencia del láser, los filtros de emisión y la sensibilidad de la cámara. La señal debe ser al menos 2 veces mayor que el fondo. El fondo es de alrededor de 1000 UA, por lo que la señal debe ser de al menos 2000-3000 UA. - Repita 4.4-4.5 durante al menos 30 celdas. Cambie los cubrehojas, el enfoque y repita 4.4-4.5.
5. Análisis de datos
NOTA: Realice análisis cuantitativos de imágenes utilizando el software fiji y el análisis utilizando software de estadísticas.
- Abra el conjunto de imágenes de una celda.
- Cree una máscara del área de celda (máscara RICM) trazando el límite de la celda en la imagen RICM mediante la herramienta de selección a mano alzada ImageJ. Guarde la región de interés (ROI) en el administrador de ROI (Analizar herramientas de > > administrador de ROI) (Figura 4A1,2).
- Elija un área representativa fuera de la celda en la imagen de tensión de integrina y dibuje un ROI de al menos 200 x 200 píxeles. Excluya cualquier otra célula o residuo fluorescente del ROI. Mida la fluorescencia de fondo en el ROI utilizando la herramienta de medición (Analizar > Medir) (Figura 4A3).
- Reste la fluorescencia media de fondo obtenida en el paso 5.2 de la imagen de tensión (Proceso > Matemáticas > Restar) (Figura 4A4).
- Utilice la máscara RICM establecida en el paso 5.2 para definir la señal de tensión dentro de la huella celular (gestor de ROI > Seleccionar > Aplicar máscara > Editar > Borrar exterior) (Figura 4A5).
- Cree una máscara de umbral para la imagen de tensión utilizando el método de Huang para el umbral automático (> Ajustar > umbral) (Figura 4A6). Asegúrese de que la máscara de umbral represente mejor el área para la tensión de integrina generada. Como regla general, establezca el umbral en 2 veces la fluorescencia media de fondo.
- Cree una selección de la máscara de tensión con umbral (Editar > Selección > Crear) (Figura 4A7).
- Transfiera la máscara seleccionada a la imagen de tensión generada en el paso 5.4 y mida la intensidad integrada de las sondas abiertas (gestor de ROI > Seleccionar (máscara de tensión) > Analizar > medir > RawIntDen) (Figura 4C).
- Mida el área de propiedades morfométricas de la celda, la circularidad y la relación de aspecto desde la máscara RICM (gestor de ROI > Seleccionar (máscara RICM) > Aplicar máscara > Analizar > medir) (Figura 4B).
- Mida la densidad de ruptura mecánica, definida como el porcentaje de la huella celular con sondas rotas seleccionando la imagen de la máscara de tensión y aplicando la máscara RICM (gestor de ROI > Select (RICM Mask) > Analyze > Measure > %Area) (Figura 4C).
- Exporte las mediciones para su posterior análisis y visualización en software de estadísticas.
- Repita 5.1-5.11 para cada celda.
Resultados
Se utilizaron sondas TGT activadas para investigar el efecto del receptor del factor de crecimiento epidérmico activado por ligando (EGFR) en la mecánica celular mediada por integrina y la formación de adhesión en células Cos-721. Las sondas presentan el ligando cíclico Arg-Gly-Asp-Phe-Lys (cRGDfK)21,23,25,26, que es selectivo para el heterodímero de integrina αVβ3 con sólo una pequeña afinidad por las integrinas α5β1 27,28,29,30. La sonda TGT comprende un ADN dúplex funcionalizado en una superficie de cubierta de vidrio a través de la hebra inferior utilizando la unión biotina-estreptavidina. La hebra superior muestra el ligando de integrina y está disponible para unirse al receptor de integrina cognado en la membrana celular (Figura 5A). La hebra inferior está etiquetada con un fluoróforo y la hebra superior con un atenuador, lo que lleva a una fluorescencia de fondo mínima cuando el TGT dúplex está intacto. Si una integrina se une al ligando y aplica una fuerza con una magnitud mayor que la Tde la sonda, el dúplex de ADN se separará dando lugar a la fluorescencia (Figura 5A). Cualquier sonda TGT que no haya sido rota por una fuerza mecánica permanecerá no fluorescente. Esta fluorescencia de encendido selectivo de fuerza permite el mapeo sistemático y cuantitativo de las fuerzas generadas por integrina a escala pN a resolución limitada por difracción. Las sondas TGT modulan adicionalmente el umbral de tensión del sustrato.
Aquí se muestra un ejemplo representativo de una superficie TGT con un Ttol de 56 pN. Las células Cos-7 fueron chapadas en esta superficie TGT con o sin estimulación EGF para estudiar el impacto de la activación EGFR con estimulación de ligandos en la adhesión celular y la mecánica de integrina (Figura 5A, B). Las células se incubaron con o sin EGF en las superficies de TGT durante 60 minutos, fijas e inmunoteñidas para mostrar la distribución de adhesión focal (paxillin) y la organización del citoesqueleto (F-actina) (Figura 5B). Luego, se tomaron imágenes de las células utilizando microscopía RICM y TIRF. Como se ve claramente en la imagen RICM, la propagación de células Cos-7 en la superficie TGT de 56 pN se mejoró significativamente con la estimulación de EGF en comparación con la estimulación sin estimulación. Esto se cuantificó para 50 células en cada condición midiendo el tamaño de la región de contacto célula-sustrato a partir de la imagen RICM (Figura 5C). La estimulación con EGF dio como resultado una morfología más circular, representativa de las células Cos-7 que se propagan y crecen en su entorno fisiológico natural (Figura 5D). La fluorescencia de las sondas abiertas también es mayor con la estimulación de EGF como se observa en la imagen de fluorescencia de tensión. La intensidad integrada de las sondas abiertas, que es proporcional al número de sondas abiertas, fue mucho mayor con la estimulación del EGF en comparación con la no (Figura 5B,E). Esta es una representación de todos los compromisos receptor-ligando donde las integrinas aplicaron una fuerza mayorque T tol (56 pN).
La tinción con paxillin mostró que la distribución, el número, la maduración (tamaño) y la organización de las adherencias focales también se vieron afectadas por la estimulación del EGF. Las adherencias focales en células estimuladas por EGF parecían más maduras y orientadas radialmente en comparación con ningún control de EGF. La organización citoesquelética de la F-actina también se mejoró con la estimulación del EGF, según lo evaluado por la tinción de faloidina (Figura 5B). Estas evaluaciones cualitativas se realizaron mediante la comparación visual de imágenes de ambos grupos de tratamiento. Se puede hacer un análisis cuantitativo de la adhesión focal, pero está más allá del alcance de este protocolo. En este experimento, la superficie TGT proporcionó una plataforma para detallar sistemáticamente el efecto de la activación de EGFR en la propagación celular, la mecánica de integrinas y la formación de adhesión focal.
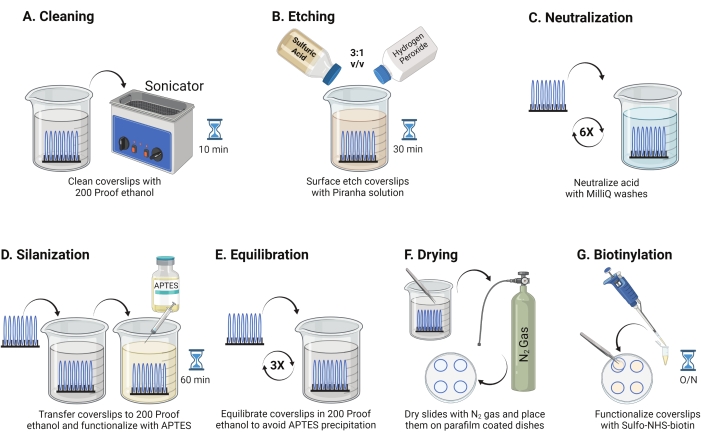
Figura 1: Esquema para el día 1 de la preparación de la superficie TGT. (A) Limpie las cubiertas. (B) Grabar la superficie de la cubierta. (C) Neutralizar la solución de Piraña. (D) Silanizar la superficie para hacer grupos de aminas reactivas. (E) Equilibrar los recubiertos a la fase orgánica. (F) Seque los cubrehojas con un gas inerte. (G) Biotinilar los grupos aminas de superficie. Haga clic aquí para ver una versión más grande de esta figura.
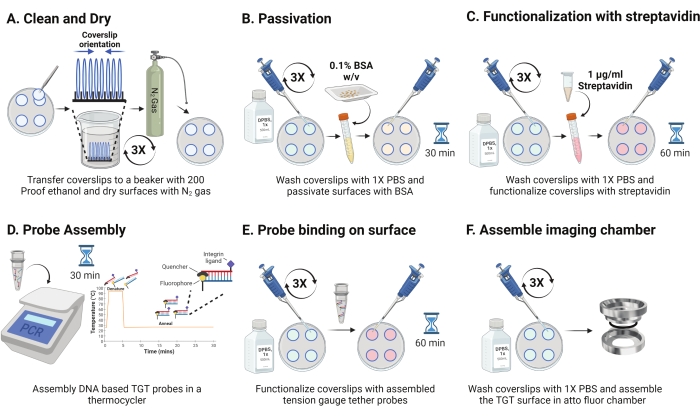
Figura 2: Esquema para el Día 2 de la preparación de la superficie TGT. (A) Limpie y seque las cubiertas para eliminar cualquier biotina residual del día anterior. (B) Pasivar con BSA para evitar la unión inespecífica del reactivo en pasos posteriores. (C) Funcionalizar las cubiertas con estreptavidina. (D) Hibridar las sondas en un termociclador. (E) Aplicar las sondas sintetizadas a los coverslips (F) Ensamblar el coverslip en la cámara de imágenes celulares. Haga clic aquí para ver una versión más grande de esta figura.
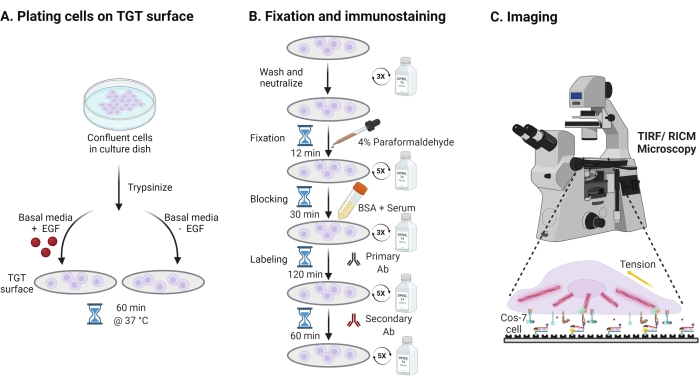
Figura 3: Flujo de trabajo general que destaca los pasos generales en toda la configuración experimental. (A) Proceso para el desprendimiento celular y el recubrimiento en la superficie TGT en medios basales (DMEM) con o sin estimulación EGF. (B) Diagrama de flujo de los pasos involucrados en la fijación e inmuno-tinción post-fijación y propagación en la superficie TGT. (C) Después de la tinción, las células se visualizan en un microscopio de fluorescencia invertida con microscopía RICM y TIRF. Haga clic aquí para ver una versión más grande de esta figura.
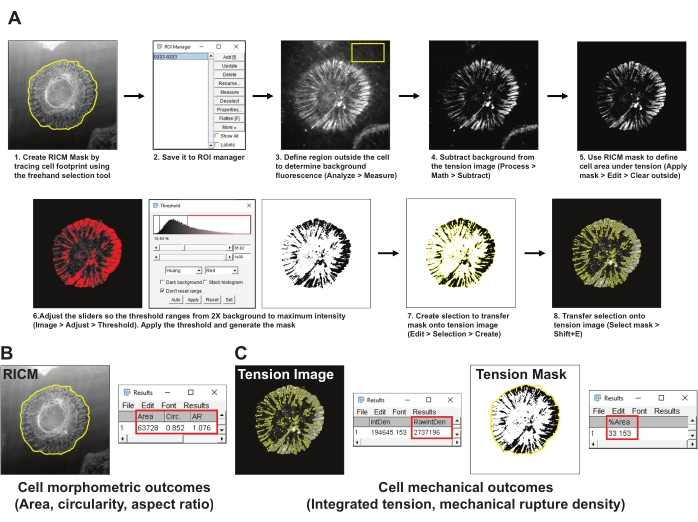
Figura 4: Ejemplo de procesamiento de datos y análisis cuantitativo. (A) Desglose paso a paso de la tubería de análisis empleada en Fiji (ImageJ) para riCM y cuantificación de imágenes de tensión. (B) Un ejemplo representativo de los resultados morfométricos celulares analizados utilizando la tubería anterior. (C) Ejemplos representativos de resultados mecánicos celulares analizados utilizando la tubería antes mencionada. Haga clic aquí para ver una versión más grande de esta figura.
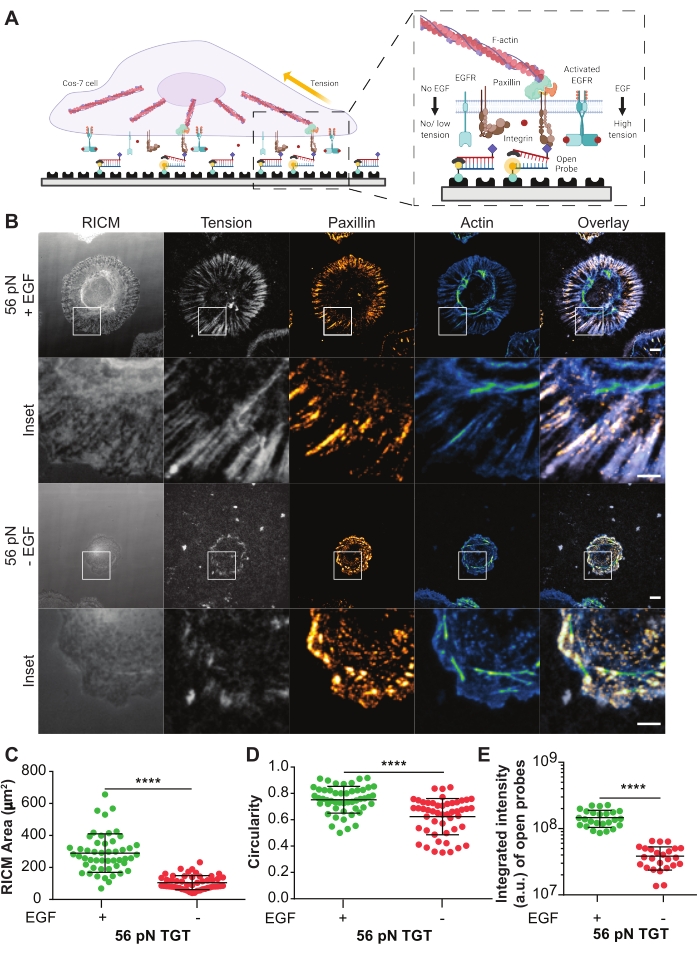
Figura 5: Datos de ejemplo de un experimento TGT. (A) Diagrama que destaca la zona de contacto en la interfaz de superficie membrana celular-TGT. El recuadro proyecta integrinas interactuando con su ligando cognado cRGDfK con (derecha) o sin (izquierda) estimulación EGF. (B) Imágenes RICM y TIRF de células Cos-7 diseminadas en la superficie TGT de 56 pN. Las imágenes se obtienen 60 min post-chapado con o sin estimulación EGF. Las imágenes individuales de RICM (según lo adquirido), tensión de integrina (escala de grises), paxillin (naranja caliente) y F-actina (azul-verde) se muestran con superposiciones para ambas condiciones de estimulación. Barra de escala: 10 μm. El recuadro destaca un ROI (región de interés) ampliado que detalla la colocalización de la tensión de integrina generada en los sitios de formación de adhesión marcados por paxillin, y la organización citoesquelética subcelular subyacente marcada por actina. Barra de escala: 5 μm. (C-E) Diagramas de dispersión para el área de propagación (huella celular RICM) (C), circularidad (D) y tensión integrada (E) para células Cos-7 con o sin estimulación EGF. Las barras indican la media ± s.d. Las diferencias entre los grupos se evaluaron estadísticamente con la prueba t de Student; P < 0,0001. n = 50 células en tres experimentos independientes. Haga clic aquí para ver una versión más grande de esta figura.
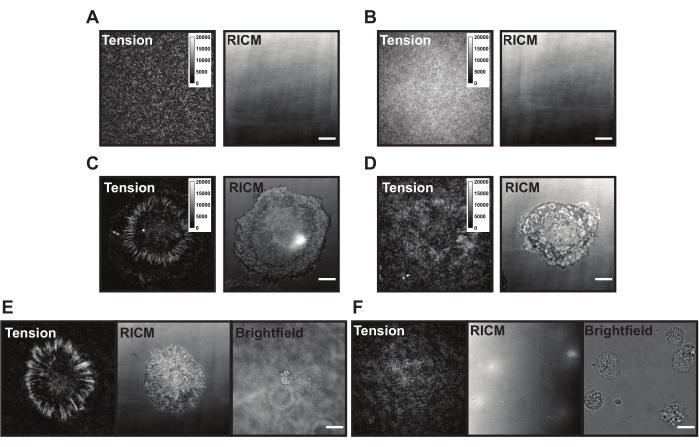
Figura 6: Ejemplo de superficies TGT con diferentes problemas posibles. (A) Imágenes de tensión y RICM de una superficie TGT ideal con sonda ensamblada apagada antes de la adhesión celular. (B) Imágenes de tensión y RICM de una superficie TGT donde la sonda TGT carece de la hebra superior (quencher). La imagen de tensión muestra una fluorescencia uniforme del fluoróforo abierto en la hebra inferior. (C) Imágenes de tensión y RICM para células diseminadas sobre una superficie TGT ideal. (D) Imágenes de tensión y RICM para células diseminadas en una superficie TGT mal hecha con pasivación limitada o sonda degradada. (E) Las imágenes de tensión, RICM y campo brillante para células chapadas en una superficie ideal con ligando cRGDfK que indica que las interacciones cRGDfK-integrina son vitales para la unión celular y la generación de tensión. (F) Imágenes de tensión, RICM y campo brillante para células chapadas en una superficie sin ligando cRGDfK en el TGT. Si bien las células son visibles en la imagen de campo brillante, no se observa ninguna unión celular o tensión de integrina generada. Barra de escala: 10 μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Con el procedimiento detallado paso a paso descrito anteriormente, se pueden preparar superficies TGT para cuantificar la morfología celular y la tensión de integrina generada por las células adherentes durante la unión y propagación celular después del tratamiento con EGF. El sencillo diseño y síntesis de la sonda y la preparación de la superficie, junto con la configuración experimental simple, proporcionaron una plataforma estable para estudiar la interacción de EGFR e integrinas. En general, los resultados validan que la activación dependiente de ligandos de EGFR mejora la propagación celular, ajusta las propiedades de soporte de fuerza de los receptores de integrina y promueve la organización y maduración de la adhesión focal. Los resultados obtenidos utilizando sondas TGT apoyan la hipótesis general de que los factores de crecimiento, como el EGFR, actúan como 'mecano-organizadores', aumentando la cantidad y la organización espacial de la tensión de la integrina y regulando la orientación y la mecánica de las adherencias focales.
Tras la aplicación en la superficie TGT, las células aterrizan, se unen y se propagan a medida que los receptores de integrina (αVβ3) detectan y se unen al ligando cRGDfK. Al hacerlo, las sondas TGT pueden romperse mecánicamente, generando fluorescencia en el sitio de compromiso del ligando. La lectura es el "historial de fuerza" acumulativo de la célula que interactúa con la superficie. Hay algunos problemas comunes con las superficies TGT que pueden estar presentes durante estos experimentos. La alta fluorescencia de fondo de la superficie (Figura 6A, B), la apariencia irregular de la superficie, la falla de las células para generar señal de tensión (Figura 6C, D) y la falla de las células para propagarse (Figura 6E, F) pueden deberse a deficiencias técnicas con la sonda TGT o la síntesis de superficie. Las soluciones a estos problemas comunes se presentan en la Tabla 1.
El diseño sencillo de las sondas TGT proporciona a los biólogos celulares una poderosa herramienta para estudiar los resultados específicos de la señalización del factor de crecimiento-integrina de forma aislada sin interferencia de otros receptores de la superficie celular al proporcionar solo ligandos y estimulaciones específicos. Además, las sondas TGT permiten la investigación del umbral de tensión que subraya los receptores individuales de integrina durante la adhesión celular a sensibilidad pN. Los enfoques alternativos no informan las fuerzas ejercidas por receptores individuales con alta resolución espacial en muestras fijas31. La microscopía de fuerza de tracción solo es sensible a las fuerzas nN, un orden de magnitud más alto que las fuerzas aplicadas por los receptores de integrina individuales15, y las sondas de tensión molecular miden las fuerzas de pN, pero debido a que son reversibles, no resisten robustamente la fijación. Por estas razones, las sondas TGT son una herramienta atractiva para estudiar la mecánica de las interacciones factor de crecimiento-integrina.
Hay varios matices técnicos asociados con las sondas TGT que deben considerarse antes de diseñar un experimento. La imagen de tensión es una instantánea en el tiempo, que representa el historial de fuerza y no un indicador de las uniones receptor-ligando en un punto de tiempo dado. Dado que la generación de señales depende de la separación de la sonda, la fluorescencia TGT resulta de sondas abiertas que no están bajo tensión activa por la unión receptor-ligando. Esto significa que la lectura de la tensión de integrina obtenida en la superficie TGT es de naturaleza histórica y acumulativa que representa donde había fuerzas mayores que Ttol; no se reportan las localizaciones de las fuerzas actuales del ligando receptor menor que Ttol 19,32. Debido a que la ruptura de TGT resulta en la terminación de la unión receptor-ligando, la propagación celular se debe a interacciones integrina-ligando que experimentan fuerzas más bajas que Ttol. Por lo tanto, el usuario debe tener cuidado al definir el tiempo posterior al recubrimiento para estimar los resultados mecánicos asociados con las adherencias basadas en integrinas. Finalmente, el significado de Ttol debe ser considerado. Las sondas TGT empleadas aquí tienen un Ttol de 56 pN, donde Ttol es la fuerza constante necesaria para romper el 50% de las sondas cuando se aplica durante 2 s. Al considerar sistemas biológicos complicados, los TGT probablemente experimentan una gradación de fuerza heterogénea y diversa con diferentes dependencias de tiempo. Si los TGT se rompen por fuerzas mayores que Ttol, la fluorescencia sería una subestimación de la tensión total. Alternativamente, las fuerzas por debajo de Ttol aplicadas durante períodos más largos pueden romper un número similar de sondas que las fuerzas de umbral alto aplicadas para tiempos más cortos. Ambos escenarios pueden dar lugar a la misma lectura de intensidad de fluorescencia, lo que dificulta la resolución de la magnitud o dinámica de tensión exacta utilizando sondas TGT33,34.
En general, las evaluaciones de la tensión de la integrina con la estimulación del factor de crecimiento deben realizarse cuidadosamente mediante el diseño de experimentos con controles internos, la comparación de los perfiles de propagación en otras superficies recubiertas de matriz, la realización de evaluaciones paralelas de la fluorescencia de TGT en las células en presencia o ausencia de estimulación del factor de crecimiento y el uso de TGT con diferentes Ttol . Los TGT permiten cuantificar el papel de la señalización del factor de crecimiento en la regulación de la mecánica de los receptores de integrina, la dinámica de adhesión focal y la propagación celular. Este protocolo se puede utilizar como plantilla para muchos experimentos basados en TGT utilizando sondas con diferentes Ttol, diferentes ligandos, diferentes tipos de células o diferentes condiciones de estimulación. Cualquier proteína de interés se puede etiquetar después de la fijación, y se puede implementar cualquier tipo de análisis cuantitativo de imágenes. Como tal, presentamos una plantilla para numerosos experimentos TGT.
El uso de sondas TGT no se limita al estudio de integrinas, sino que se puede extender a una amplia gama de receptores de membrana celular en diferentes tipos de células mediante la modificación del ligando. Las sondas TGT se han utilizado para investigar el papel de las fuerzas en la regulación de varias cascadas de señalización de receptores, incluida la identificación del papel mecánico de la mecánica de receptores Notch en el desarrollo embrionario y la neurogénesis35, las fuerzas que median la identificación e internalización de antígenos por receptores de células B36, y la capacidad de corrección mecánica de los receptores de superficie de células T para detectar cambios en las fuerzas para aumentar la fuerza y la especificidad de la transferencia deseñales 37 . Juntos, estos hallazgos resaltan el inmenso potencial de las sondas TGT en una variedad de entornos experimentales.
Divulgaciones
Los autores declaran que no hay conflictos de intereses.
Agradecimientos
Los autores desean reconocer a los miembros del laboratorio Mattheyses por sus fructíferas discusiones y críticas. Reconocemos el financiamiento a A.L.M. de NSF CAREER 1832100 y NIH R01GM131099.
Materiales
| Name | Company | Catalog Number | Comments |
| (3-Aminopropyl)triethoxysilane | Millipore Sigma | 440140 | Surface Preparation |
| 3-hydroxypicolinic acid (3-HPA) | Millipore Sigma | 56197 | Maldi-TOF-MS matrix |
| Acetic Acid, Glacial | Fisher Scientific | A38S | Diluting EGF |
| Acetonitrile (HPLC) | Fisher Scientific | A998SK | Oligonucleotide Preparation |
| Alexa Fluor 488 Phalloidin | Cell Signaling Technology | 8878S | Immunocytochemistry |
| Ammonium Chloride | Fisher Scientific | A687 | Immunocytochemistry |
| Anti-Paxillin antibody [Y113] | Abcam | ab32084 | Immunocytochemistry |
| BD Syringes only with Luer-Lok | BD bioscience | 309657 | Surface Preparation |
| Bio-Gel P-2 | Bio-Rad | 1504118 | Oligonucleotide Preparation |
| Bovine Serum Albumin (BSA) Protease-free Powder | Fisher Scientific | BP9703100 | Surface Preparation |
| Cos-7 cells | ATCC | CRL-1651 | Cell Culture, Passage numbers 11-20 |
| Coverslip Mini-Rack, for 8 coverslips | Fisher Scientific | C14784 | Surface Preparation |
| c(RGDfK(PEG-PEG)), PEG=8-amino-3,6-dioxaoctanoic acid | Vivitide | PCI-3696-PI | Oligonucleotide Preparation |
| Cy3B NHS ester | GE Healthcare | PA63101 | Oligonucleotide Preparation |
| Dimethylformamide | Millipore Sigma | PHR1553 | Oligonucleotide Preparation |
| DMEM with L-Glutamine, 4.5g/L Glucose and Sodium Pyruvate | Fisher Scientific | MT10013C | Cell Culture |
| Epidermal Growth Factor human EGF | Millipore Sigma | E9644 | Cell Culture |
| Ethanol, 200 proof (100%) | Fisher Scientific | 22032601 | Surface Preparation |
| Falcon Standard Tissue Culture Dishes | Fisher Scientific | 08-772E | Surface Preparation |
| Fetal Bovine Serum | Fisher Scientific | 10-438-026 | Cell Culture |
| Flurobrite DMEM | Fisher Scientific | A1896701 | Cell Culture |
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 647 | Invitrogen | A-21244 | Immunocytochemistry |
| Goat Serum | Fisher Scientific | 16-210-064 | Immunocytochemistry |
| Hank’s balanced salts (HBSS) | Fisher Scientific | 14-170-161 | Cell Culture |
| Horse Serum | Fisher Scientific | 16050130 | Immunocytochemistry |
| Hydrogen Peroxide | Fisher Scientific | H325-500 | Surface Preparation |
| Nanosep MF centrifugal devices | Pall laboratory | ODM02C35 | Oligonucleotide Preparation |
| NHS-azide | Fisher Scientific | 88902 | Oligonucleotide Preparation |
| Nitrogen Gas Cylinder | Airgas | Surface Preparation | |
| No. 2 round glass coverslips - 25 mm | VWR | 48382-085 | Surface Preparation |
| Parafilm M Laboratory Film | Fisher Scientific | 13-374-10 | Surface Preparation |
| Paraformaldehyde 16% | Fisher Scientific | 50-980-487 | Immunocytochemistry |
| PBS, 1X | Fisher Scientific | 21-030-CV | Surface Preparation/Immunocytochemistry |
| Penicillin-Streptomycin (5,000 U/mL) | Fisher Scientific | 15-070-063 | Cell Culture |
| PYREX Low Form Griffin Beakers | Fisher Scientific | 02-540G | Surface Preparation |
| Sodium Ascorbate | Fisher Scientific | 18-606-310 | Oligonucleotide Preparation |
| Sodium Bicarbonate | Fisher Scientific | S233 | Oligonucleotide Preparation |
| Sodium Chloride | Fisher Scientific | BP358 | Surface Preparation |
| Streptavidin | Fisher Scientific | 434301 | Surface Preparation |
| Sulfo-NHS-LC-Biotin | Fisher Scientific | 21335 | Surface Preparation |
| Sulfuric Acid | Fisher Scientific | A300-500 | Surface Preparation |
| TEAA | Fisher Scientific | NC0322726 | Oligonucleotide Preparation |
| Triethylamine | Millipore Sigma | 471283 | Oligonucleotide Preparation |
| Trifluoroacetic Acid (TFA) | Fisher Scientific | PI28901 | Oligonucleotide Preparation |
| THPTA | Fisher Scientific | NC1296293 | Oligonucleotide Preparation |
| Triton X 100 Detergent Surfact Ams Solution | Fisher Scientific | 85111 | Immunocytochemistry |
| Water, DNA Grade, DNASE, Protease free | Fisher Scientific | BP24701 | Oligonucleotide Preparation |
| Equipment | |||
| Agilent AdvanceBio Oligonucleotide C18 column, 4.6 x 150 mm, 2.7 μm | Agilent | 653950-702 | Oligonucleotide Preparation |
| High-performance liquid chromatography | Agilent | 1100 | Oligonucleotide Preparation |
| Low Speed Orbital Shaker | Fisher Scientific | 10-320-813 | Immunocytochemistry |
| Matrix-assisted laser desorption/ ionization time-of-flight mass spectrometer (MALDI-TOF-MS) | Voyager STR | Oligonucleotide Preparation | |
| Molecular Probes Attofluor Cell Chamber | Fisher Scientific | A7816 | Surface Preparation |
| Nanodrop 2000 UV-Vis Spectrophotometer | Thermo Fisher | Oligonucleotide Preparation | |
| Nikon Eclipse Ti inverted microscope | pe Nikon | Microscopy | |
| Nikon Perfect Focus System | Nikon | Microscopy | |
| NIS Elements software | Nikon | Microscopy | |
| ORCA-Flash4.0 V3 Digital CMOS camera | Hamamatsu | Microscopy | |
| Quad band TIRF 405/488/561/647 cube | CHROMA | Microscopy | |
| RICM Cube | CHROMA | Microscopy | |
| SOLA v-nIR Light Engine | Lumencor | Microscopy | |
| Thermo Forma Steri Cycle 370 CO2 Incubator | Fisher Scientific | Cell Culture | |
| VWR 75D Ultrasonic Cleaner | VWR | 13710 | Surface Preparation |
| Data Analysis | Use | ||
| Fiji (Image J) | https://imagej.net/software/fiji/downloads | Quantitative Analysis | |
| Graph Pad Prism | Graph Pad | Statistical Analysis | |
| Oligo name | 5'modification/ 3' modification | Sequence (5' to 3') | Use |
| Alkyne-21-BHQ2 | 5' Hexynyl/ 3' BHQ_2 | GTGAAATACCGCACAGATGCG | Top strand TGT probe |
| 56 pN TGT | 5' Biosg/TTTTTT/iUniAmM | CGCATCTGTGCGGTATTTCACTTT | Bottom strand TGT probe |
| 12 pN TGT | 5' AmMC6/ 3' BioTEG | CGCATCTGTGCGGTATTTCACTTT | Bottom strand TGT probe |
Referencias
- Lim, C. -. G., Jang, J., Kim, C. Cellular machinery for sensing mechanical force. BMB Reports. 51 (12), 623-629 (2018).
- Moraes, C., Sun, Y., Simmons, C. A. (Micro)managing the mechanical microenvironment. Integrative Biology. 3 (10), 959-971 (2011).
- Vogel, V., Sheetz, M. P. Mechanical forces matter in health and disease. From Cancer to Tissue Engineering. Nanotechnology. , 233-303 (2010).
- Wang, J. H. C., Li, B. Mechanics rules cell biology. BMC Sports Science, Medicine and Rehabilitation. 2 (1), 16 (2010).
- Moeendarbary, E., Harris, A. R. Cell mechanics: principles, practices, and prospects. Wiley Interdisciplinary Reviews: Systems Biology and Medicine. 6 (5), 371-388 (2014).
- Streuli, C. H., Akhtar, N. Signal co-operation between integrins and other receptor systems. Biochemical Journal. 418 (3), 491-506 (2009).
- Chiasson-MacKenzie, C., McClatchey, A. I. EGFR-induced cytoskeletal changes drive complex cell behaviors: The tip of the iceberg. Science Signaling. 11 (515), (2018).
- Kechagia, J. Z., Ivaska, J., Roca-Cusachs, P. Integrins as biomechanical sensors of the microenvironment. Nature Reviews Molecular Cell Biology. 20 (8), 457-473 (2019).
- De Luca, A., et al. The role of the EGFR signaling in tumor microenvironment. Journal of Cellular Physiology. 214 (3), 559-567 (2008).
- Javadi, S., Zhiani, M., Mousavi, M. A., Fathi, M. Crosstalk between Epidermal Growth Factor Receptors (EGFR) and integrins in resistance to EGFR tyrosine kinase inhibitors (TKIs) in solid tumors. European Journal of Cell Biology. 99 (4), 151083 (2020).
- Eliceiri, B. P. Integrin and growth factor receptor crosstalk. Circulation Research. 89 (12), 1104-1110 (2001).
- Dan, L., Jian, D., Na, L., Xiaozhong, W. Crosstalk between EGFR and integrin affects invasion and proliferation of gastric cancer cell line, SGC7901. OncoTargets and Therapy. 5, 271-277 (2012).
- Giancotti, F. G., Tarone, G. Positional control of cell fate through joint integrin/receptor protein kinase signaling. Annual Reviews: Cell and Developmental Biology. 19, 173-206 (2003).
- Ricono, J. M., et al. Specific cross-talk between epidermal growth factor receptor and integrin alphavbeta5 promotes carcinoma cell invasion and metastasis. Cancer Research. 69 (4), 1383-1391 (2009).
- Polacheck, W. J., Chen, C. S. Measuring cell-generated forces: a guide to the available tools. Nature Methods. 13 (5), 415-423 (2016).
- Hang, X., et al. Nanosensors for single cell mechanical interrogation. Biosensors and Bioelectronics. 179, 113086 (2021).
- Style, R. W., et al. Traction force microscopy in physics and biology. Soft Matter. 10 (23), 4047-4055 (2014).
- Schoen, I., Hu, W., Klotzsch, E., Vogel, V. Probing cellular traction forces by micropillar arrays: contribution of substrate warping to pillar deflection. Nano Letters. 10 (5), 1823-1830 (2010).
- Ma, V. P. -. Y., Salaita, K. DNA Nanotechnology as an Emerging Tool to Study Mechanotransduction in Living Systems. Small. 15 (26), 1900961 (2019).
- Kim, Y., Kim, K. A., Kim, B. C. Double-stranded DNA force sensors to study the molecular level forces required to activate signaling pathways. Journal of the Korean Physical Society. 78 (5), 386-392 (2021).
- Rao, T. C., et al. EGFR activation attenuates the mechanical threshold for integrin tension and focal adhesion formation. Journal of Cell Sciences. 133 (13), (2020).
- Zhang, Y., Ge, C., Zhu, C., Salaita, K. DNA-based digital tension probes reveal integrin forces during early cell adhesion. Nature Communications. 5, 5167 (2014).
- Liu, Y., et al. DNA-based nanoparticle tension sensors reveal that T-cell receptors transmit defined pN forces to their antigens for enhanced fidelity. Proceedings of the National Academy of Sciences of the United States of America. 113 (20), 5610-5615 (2016).
- Zhang, Y., et al. Platelet integrins exhibit anisotropic mechanosensing and harness piconewton forces to mediate platelet aggregation. Proceedings of the National Academy of Sciences of the United States of America. 115 (2), 325-330 (2018).
- Ma, V. P. -. Y., et al. Mechanically induced catalytic amplification reaction for readout of receptor-mediated cellular forces. Angewandte Chemie International Edition. 55 (18), 5488-5492 (2016).
- Wang, X., Ha, T. Defining single molecular forces required to activate integrin and notch signaling. Science. 340 (6135), 991-994 (2013).
- Chen, Y., Lee, H., Tong, H., Schwartz, M., Zhu, C. Force regulated conformational change of integrin αVβ3. Matrix Biology. 60-61, 70-85 (2017).
- Kantlehner, M., et al. Surface coating with cyclic RGD peptides stimulates osteoblast adhesion and proliferation as well as bone formation. ChemBioChem. 1 (2), 107-114 (2000).
- Kapp, T. G., et al. A comprehensive evaluation of the activity and selectivity profile of ligands for RGD-binding integrins. Scientific Reports. 7, 39805 (2017).
- Kok, R. J., et al. Preparation and functional evaluation of RGD-modified proteins as alpha(v)beta(3) integrin directed therapeutics. Bioconjugate Chemistry. 13 (3), 128-135 (2002).
- Li, I. T. S., Ha, T., Chemla, Y. R. Mapping cell surface adhesion by rotation tracking and adhesion footprinting. Scientific Reports. 7 (1), 44502 (2017).
- Wang, Y., et al. Force-activatable biosensor enables single platelet force mapping directly by fluorescence imaging. Biosensors and Bioelectronics. 100, 192-200 (2018).
- Murad, Y., Li, I. T. S. Quantifying molecular forces with serially connected force sensors. Biophysical Journal. 116 (7), 1282-1291 (2019).
- Yasunaga, A., Murad, Y., Li, I. T. S. Quantifying molecular tension-classifications, interpretations and limitations of force sensors. Physical Biology. 17 (1), 011001 (2019).
- Luca, V. C., et al. Notch-Jagged complex structure implicates a catch bond in tuning ligand sensitivity. Science. 355 (6331), 1320-1324 (2017).
- Spillane, K. M., Tolar, P. B cell antigen extraction is regulated by physical properties of antigen-presenting cells. The Journal of Cell Biology. 216 (1), 217-230 (2017).
- Brockman, J. M., Salaita, K. Mechanical proofreading: a general mechanism to enhance the fidelity of information transfer between cells. Frontiers in Physics. 7, 14 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados