Method Article
Organoides intestinales caninos en un sistema de soporte permeable de doble cámara
En este artículo
Resumen
Aquí, presentamos un protocolo que describe el cultivo de organoides intestinales caninos en un sistema de soporte permeable de doble cámara. Se describe la siembra de organoides en los soportes permeables, el mantenimiento de la monocapa y los experimentos posteriores de permeabilidad al fármaco.
Resumen
El sistema de soporte permeable se utiliza típicamente junto con líneas celulares bidimensionales tradicionales (2D) como una herramienta in vitro para evaluar la permeabilidad oral de nuevos candidatos a fármacos terapéuticos. Sin embargo, el uso de estas líneas celulares convencionales tiene limitaciones, como la expresión alterada de uniones estrechas, la diferenciación celular parcial y la ausencia de receptores nucleares clave. A pesar de estas deficiencias, los modelos Caco-2 y MDCK son ampliamente aceptados y validados para la predicción de la permeabilidad oral humana in vivo .
Los perros son un modelo traslacional relevante para la investigación biomédica debido a sus similitudes en la anatomía gastrointestinal y la microflora intestinal con los humanos. En consecuencia, y en apoyo del desarrollo paralelo de fármacos, es muy deseable la elaboración de una herramienta in vitro eficiente y precisa para predecir las características de permeabilidad de los fármacos in vivo tanto en perros como en humanos. Tal herramienta podría ser el sistema organoide intestinal canino, caracterizado por estructuras epiteliales tridimensionales (3D) autoensambladas derivadas de células madre adultas.
El (1) Protocolo de Siembra de Apoyo Permeable describe los métodos experimentales para disociar y sembrar organoides caninos en los insertos. El aislamiento, el cultivo y la cosecha de organoides caninos se han descrito previamente en un conjunto separado de protocolos en este número especial. Los métodos para el mantenimiento general de la monocapa organoide intestinal canina se discuten a fondo en el (2) Protocolo de mantenimiento de monocapa. Además, este protocolo describe métodos para evaluar la integridad estructural de la monocapa a través de mediciones de resistencia eléctrica transepitelial (TEER) y microscopía de luz. Finalmente, el (3) Protocolo Experimental de Permeabilidad describe las tareas que preceden directamente a un experimento, incluida la validación in vitro de los resultados experimentales.
En general, el modelo organoide canino, combinado con una tecnología de cultivo celular de doble cámara, supera las limitaciones asociadas con los modelos experimentales 2D, mejorando así la fiabilidad de las predicciones de la aparente permeabilidad oral de los candidatos a fármacos terapéuticos tanto en el paciente canino como en el humano.
Introducción
Los sistemas de soporte permeables se utilizan típicamente para determinar la permeabilidad aparente de los candidatos a fármacos terapéuticos a través de la barrera epitelial intestinal 1,2. También se pueden emplear para evaluar la secreción celular3, la migración celular4 y la toxicidad del fármaco5. Los ensayos de permeabilidad oral de fármacos in vitro son un paso clave en el proceso de descubrimiento y desarrollo de fármacos2, con candidatos a fármacos individuales que se prueban en la etapa temprana del ciclo de vida de I+D de fármacos6. El sistema de soporte permeable es un aparato de cultivo celular de doble cámara que consiste en un inserto con una membrana semiporosa colocada en una placa multipocillo. Este sistema permite el acceso directo a los lados apical y basolateral de una célula-monocapa cultivada en el inserto7. La monocapa utilizada en estos sistemas se deriva típicamente de células epiteliales gastrointestinales (por ejemplo, la línea celular de adenocarcinoma colorrectal humano Caco-2)8. Los cultivos celulares crecen en un estado polarizado imitando la microarquitectura natural de las células epiteliales intestinales, lo que permite una mayor diferenciación celular, microanatomía similar y función7. Los detalles del inserto de soporte permeable se pueden encontrar en la Figura 1. La siembra de los insertos con cultivos celulares 2D, tradicionalmente utilizados para evaluar la permeabilidad intestinal a fármacos, es relativamente asequible y fácil de cultivar9. Estos sistemas presentan varias limitaciones importantes, incluyendo su limitada capacidad para predecir el metabolismo intestinal de los candidatos a fármacos terapéuticos10,11. Esto es cierto para todos los mecanismos de absorción de fármacos, ya sea la absorción pasiva a través de las uniones estrechas entre las células epiteliales, la absorción transepitelial activa a través del eflujo o los transportadores de captación (por ejemplo, glicoproteína P, transportador de monocarboxilato 1) y los fármacos que son metabolizados por los enterocitos.
Los perros comparten un ambiente común y una dieta con los humanos12. La anatomía intestinal canina y la composición del microbioma se parecen mucho a la de los humanos13, lo que se ha atribuido a la domesticación y las dietas compartidas en los últimos 36.000 años14. Desafortunadamente, estas similitudes también pueden ser causas / desencadenantes comunes para el desarrollo de la enfermedad. Los perros desarrollan morbilidades crónicas similares a las de los humanos, como obesidad15, enfermedad inflamatoria intestinal16, adenocarcinoma colorrectal17, tumor del estroma gastrointestinal (GIST)18 y varias otras patologías asociadas con su longevidad relativa19. En consecuencia, los organoides caninos pueden utilizarse con éxito para la investigación traslacional inversa de estas enfermedades multifactoriales crónicas en el espíritu de la Iniciativa One Health20.
Las células Caco-2 son las líneas celulares más utilizadas para los ensayos de absorción oral de fármacos21. Estas células se consideran actualmente el modelo "estándar de oro" para los ensayos de permeabilidad intestinal in vitro 2,22,23. La línea celular Caco-2 expresa transportadores de eflujo y captación que se encuentran en el tracto intestinal humano, aunque a diferentes niveles de expresión 24,25,26. Las células Caco-2 también son ampliamente utilizadas como modelos para determinar si un fármaco es un sustrato o inhibidor de los transportadores de eflujo intestinal22,27. Aunque las células Caco-2 son de origen colónico, imitan a una célula de enterocito. Desafortunadamente, las células Caco-2 solo representan un tipo de célula de la capa epitelial del intestino delgado9, que no logra recapitular la compleja composición del tipo de célula epitelial intestinal con precisión. Por ejemplo, las células caliciformes dedicadas a la producción de moco están ausentes de los cultivos con Caco-2, de modo que las interacciones moco-fármaco no pueden evaluarse sin el cocultivo con otras líneas celulares28. Además, los cultivos de Caco-2 no expresan varios de los receptores nucleares importantes típicamente presentes en el intestino, como el receptor pregnano X (PXR), el receptor X esteroide (SXR) y el receptor constitutivo de androstano (CAR)29. En consecuencia, los cultivos de Caco-2 no logran modelar la inducción de transportadores de fármacos y enzimas por ciertos fármacos que son inductores de estos receptores (por ejemplo, rifampicina)30.
La tecnología de organoides intestinales 3D aborda algunas de estas limitaciones19. Los organoides son construcciones autoensambladas derivadas de células madre adultas que se pueden establecer a partir de muestras de tejido cosechadas mediante técnicas microinvasivas20. Las células madre pluripotentes inducidas por el hombre se están empleando para los modelos de permeabilidad intestinal31,32. Los organoides caninos proporcionan una alternativa relevante a los organoides humanos porque la investigación con células madre humanas está restringida por cuestiones éticas33. Además, los organoides caninos proporcionan un sistema in vitro para explorar la permeabilidad de los medicamentos caninos, el metabolismo, el transporte activo y las interacciones medicamentosas. Para abordar esta brecha tecnológica, se ha descrito el crecimiento consistente y confiable de organoides intestinales caninos en un sistema de soporte permeable34. Un ensayo de permeabilidad con organoides intestinales caninos puede predecir potencialmente la permeabilidad intestinal canina y el metabolismo de moléculas de fármacos pequeños en comparación con los ensayos utilizados actualmente (Caco-2). La confirmación de estas características fundamentales presta este novedoso sistema in vitro para futuros trabajos que exploren el impacto potencial de los inductores en el metabolismo intracelular y el transporte activo.
Los organoides caninos están compuestos por todos los tipos de células típicamente presentes en la capa epitelial del intestino. Desde un punto de vista funcional y microanatómico, replican de forma fiable el entorno de la capa epitelial del intestino canino19,35. Además, la presencia de moco, transportadores de fármacos y enzimas específicos de los perros, y la diferenciación celular general en los organoides intestinales caninos es comparable a lo que se ve in vivo en los perros34. Por lo tanto, los organoides pueden aislarse de pacientes veterinarios enfermos y utilizarse para modelar el efecto de diversos procesos de enfermedad (por ejemplo, inflamación intestinal crónica) sobre la permeabilidad a los medicamentos orales caninos19,36. El sistema organoide intestinal canino también se puede utilizar en otros entornos que no sean experimentos de permeabilidad a las drogas. Estas estructuras 3D también se pueden aislar de pacientes enfermos como lo describieron previamente Chandra et al. para la enfermedad inflamatoria intestinal, el adenocarcinoma colorrectal y el tumor del estroma gastrointestinal19.
El Protocolo de Siembra de Soporte Permeable describe métodos para establecer cultivos de organoides intestinales caninos en los insertos. Este primer protocolo describe métodos para disociar cultivos organoides caninos establecidos chapados en la matriz de membrana extracelular. Además, el prerecubrimiento de los insertos con colágeno I y la matriz de membrana extracelular se discute en este protocolo. La incrustación de organoides caninos en los insertos de soporte permeables también se describe en detalle.
El segundo protocolo es el Protocolo de Mantenimiento monocapa, que incluye el mantenimiento general de organoides caninos 3D chapados en un inserto. La frecuencia y los volúmenes de los medios organoides utilizados para refrescar el cultivo, y las formas de prevenir el daño del cultivo celular, se presentan en este segundo protocolo, junto con los métodos experimentales para evaluar la confluencia de la monocapa epitelial.
Finalmente, el Protocolo Experimental de Permeabilidad se centra en las formas de determinar si los organoides 3D intestinales caninos en un ensayo de permeabilidad están listos para su uso experimental y los pasos de verificación necesarios antes de realizar cualquier experimento. Esta sección también describe la configuración y la ejecución exitosa de un experimento de permeabilidad, junto con la incubación y el muestreo de candidatos a fármacos terapéuticos en las cámaras del cultivo monocapa. También se discute el uso del isotiocianato de fluoresceína de baja permeabilidad (FITC-dextran) para monitorear la integridad de la monocapa. Finalmente, se describe un método de evaluación in vitro para validar los resultados después de la conclusión de un experimento. Los experimentos de permeabilidad son un tema extremadamente vasto y están muy bien resumidos por Hubatsch et al.37. El flujo de trabajo de los protocolos se resume en la Figura 2.
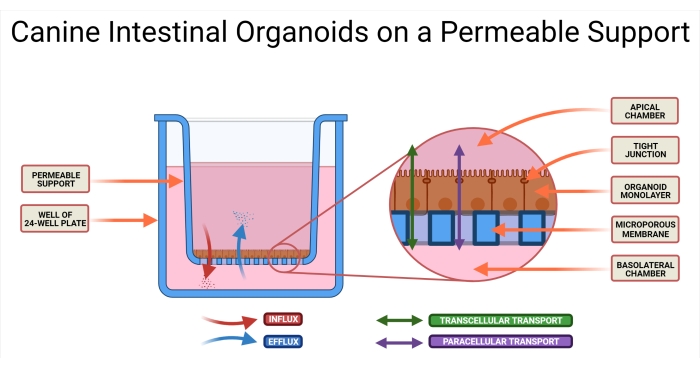
Figura 1: Organoides intestinales caninos en un sistema de soporte permeable. El inserto de soporte permeable se coloca en un pozo de una placa de 24 pocillos. La membrana microporosa permite la siembra de organoides intestinales caninos disociados, y estas células eventualmente formarán una monocapa organoide 2D. Esta tecnología permite el acceso a los lados AP y BL de la monocapa. El medio organoide se introduce en las cámaras AP y BL del soporte permeable. Se ilustra la absorción (AP→BL) y la secreción (BL→AP) del fármaco candidato, así como dos posibles modos de transporte de fármacos. Abreviaturas: AP = apical; BL = basolateral. Haga clic aquí para ver una versión más grande de esta figura.
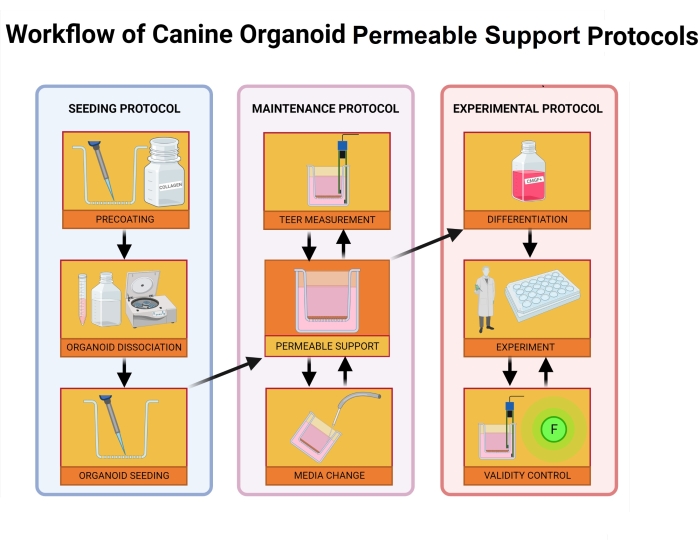
Figura 2: Flujo de trabajo de protocolos de soporte permeable a organoides caninos. El inserto de soporte permeable se recubre previamente con una mezcla de la matriz de membrana extracelular y colágeno I y se incuba durante 1 h. Durante el proceso de incubación, el cultivo de organoides se disocia. Las células organoides individuales se siembran en el inserto, el medio en la cámara basolateral se agrega inmediatamente después de la siembra, mientras que el medio a la cámara apical se agrega 24 h después de que concluye el proceso de siembra. El mantenimiento y el monitoreo de los organoides incluyen cambios regulares en el medio, mediciones del valor TEER y microscopía de luz para evaluar la integridad de la monocapa. Antes del experimento, los organoides deben diferenciarse eliminando el inhibidor de ROCK y GSKiβ de los medios. Los valores de TEER se miden el día del experimento, y la monocapa organoide se inspecciona a través de microscopía de luz para detectar daños en las células. El medio se intercambia por un tampón apropiado y se incuba antes del experimento. El ensayo FITC-dextran se utiliza durante los experimentos de permeabilidad intestinal39 como marcador de integridad monocapa. Las mediciones de TEER se toman después del experimento, y la microscopía de luz validará los resultados después de 24 h. Abreviaturas: TEER = resistencia eléctrica transepitelial; ROCK = quinasa asociada a rho; GSKiβ = glucógeno sintasa quinasa beta; F = fluorescencia. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
La investigación fue aprobada y realizada de conformidad con el Comité Institucional de Cuidado y Uso de Animales de la Universidad Estatal de Iowa (IACUC-19-337; IACUC-18-065; IACUC-19-017). La siguiente sección (pasos 1.1-1.3) describe el Protocolo de Siembra de Soporte Permeable, y los procedimientos se resumen en la Figura 3.
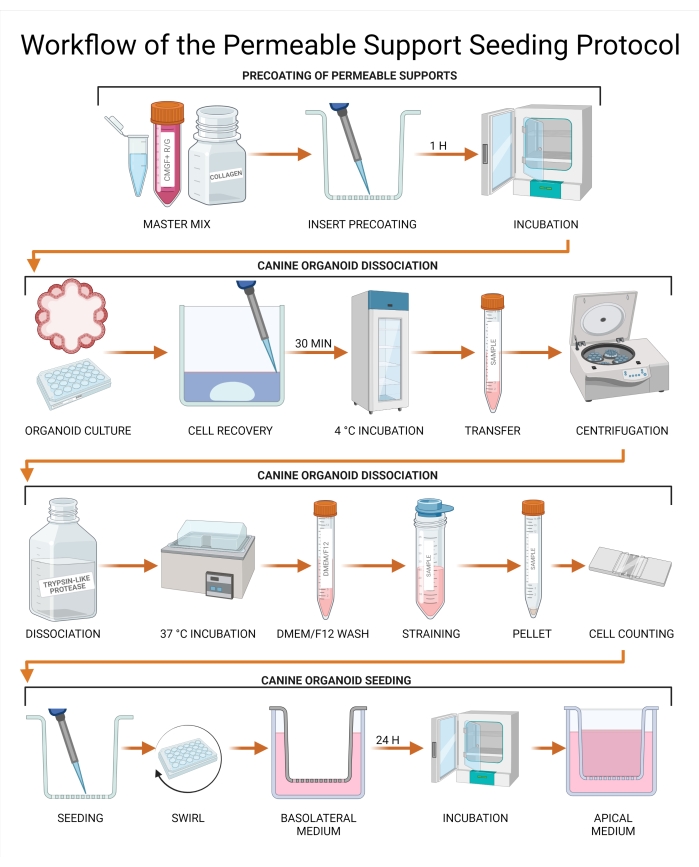
Figura 3: Flujo de trabajo del protocolo de siembra de soporte permeable. Los insertos de soporte permeables se recubren previamente con una combinación de CMGF + R / G, colágeno I y la matriz de membrana extracelular y posteriormente se incuban. Los medios del cultivo organoide canino se aspiran y se reemplazan con una solución de recuperación celular, seguida de una incubación de 30 minutos a 4 ° C. El cultivo se transfiere posteriormente a un tubo, y la disociación organoide se realiza utilizando proteasa similar a la tripsina. Los organoides no disociados se eliminan por el paso a través de un colador para lograr una suspensión de una sola célula, y la concentración celular se determina utilizando un hemocitómetro o un contador celular automatizado. Las células se siembran en un inserto de soporte permeable, y CMGF + R / G se agrega a la cámara basolateral. El cultivo se incuba durante 24 h, y el líquido restante se retira de la cámara apical y se reemplaza con CMGF + R / G. Abreviaturas: ROCK = quinasa asociada a rho; GSKiβ = glucógeno sintasa quinasa beta; CMGF + R/G = Medio completo con factores de crecimiento potenciados con inhibidor de ROCK y GSKiβ. Haga clic aquí para ver una versión más grande de esta figura.
1. Protocolo de siembra de soporte permeable
- Prerecubrimiento de los insertos de soporte permeables
- Preparar medio completo con factores de crecimiento potenciados con inhibidor de la proteína quinasa asociada a Rho (ROCK) e inhibidor de la glucógeno sintasa quinasa-beta (GSKiβ) (CMGF + R/G) según la información de la Tabla 1.
- Prepare un cubo de hielo y comience a descongelar la matriz de membrana extracelular en hielo. Coloque una placa de 24 pocillos que contenga el número necesario de insertos en la incubadora para precalentarla. Recoge el colágeno I de la cola de rata (3 mg/ml) y colócalo sobre hielo mientras lo proteges de la luz. Recoge CMGF + R/G y colócalo sobre hielo.
- Calcule el número total de insertos y espacios en blanco necesarios para el experimento, manteniendo a un lado 100 μL de la solución de recubrimiento para cada inserto.
NOTA: Prepare más solución de recubrimiento de la necesaria; se recomienda preparar al menos un 15% más de lo necesario. - En un tubo de 15 ml, mezcle CMGF + R / G con la matriz de membrana extracelular (1%) y colágeno I (1%) y mezcle suavemente pipete.
- Cubra cada inserto de poliéster con 100 μL de la solución de recubrimiento y coloque los insertos en la incubadora (37 °C; atmósfera de 5% co2 ) durante 1 h.
- Después de la incubación, aspire cuidadosamente la solución de recubrimiento de cada inserto usando un aspirador de vacío o una pipeta P1000, teniendo cuidado de no molestar el filtro de inserción. Coloque una placa precubierta en la incubadora para mantenerla caliente.
- Disociación organoide canina
NOTA: Use organoides caninos que hayan sido cultivados durante al menos cuatro días. Antes de comenzar la disociación, consulte Gabriel et al.38 para determinar cuándo una muestra es sana, densa y suficiente para la experimentación. Se recomienda disociar un pocillo extra de organoides para cada procedimiento de recubrimiento de pozos. Además, se recomienda aumentar el número deseado de insertos en ~ 20% para tener en cuenta el crecimiento desigual de organoides o el daño causado por una manipulación inadecuada. Si planea usar FITC-dextran, prepare pozos adicionales.- Prepare un cubo de hielo y un vial de 1x material frío Advanced DMEM/F12 en el gabinete de bioseguridad.
- Coloque la matriz de membrana extracelular sobre hielo para comenzar a descongelarse, sumergiéndola en hielo para protegerla contra la descongelación rápida y evitar la solidificación. Coloque una caja de puntas de pipeta (P200) en el congelador para el recubrimiento de la matriz de membrana extracelular.
- Prechill una centrífuga refrigerada a 4 °C.
- Mueva CMGF+ R/G del congelador/refrigerador a un baño de agua a 37 °C. Evite la exposición directa a la luz cuando sea posible.
- Retire todo el medio de la placa de 24 pocillos con cultivo de organoides para un número apropiado de pocillos (1 pocillo de una placa de 24 pocillos por 2-4 insertos) teniendo cuidado de no perturbar la matriz de membrana extracelular.
NOTA: El volumen puede variar dependiendo del sistema de conteo de celdas utilizado. - Agregue 0.5 ml de solución de recuperación celular prechilled por pocillo para disolver las cúpulas de matriz de membrana extracelular.
- Incubar la placa en el frigorífico (4 °C) durante 30 min.
- Pipetear la suspensión, recoger todos los organoides y la matriz de membrana extracelular disuelta, y transferirlos a un tubo de 15 ml.
- Centrifugar (700 × g durante 5 min a 4 °C) y retirar el sobrenadante hasta que el nivel alcance la marca de 0,5 mL, asegurándose de no molestar al pellet.
- Añadir 1 ml de proteasa similar a la tripsina e incubar en el baño de agua a 37 °C durante 8 min. Mueva el tubo varias veces durante el período de incubación para mezclar las células.
- Transfiera el tubo con la muestra a un gabinete de bioseguridad y agregue lentamente 7 ml de DMEM / F12 avanzado preenrollado para inactivar la proteasa similar a la tripsina y detener la disociación celular.
- Prewet un colador celular de 40 μm con 1 mL de DMEM/F12 Avanzado. Pipetee suavemente la mezcla y filtre la suspensión; pipeta adicional Advanced DMEM/F12 para enjuagar el colador.
- Centrifugar el tubo (700 × g durante 5 min a 4 °C) y retirar el sobrenadante. No moleste el pellet.
- Resuspend el pellet celular en ~50-100 μL de medio de cultivo (CMGF+ R/G) por cada pocillo de organoides que se disoció.
- Cuente una submuestra de la suspensión (~ 10 μL) utilizando un hemocitómetro o una máquina apropiada y determine el número total de células en la suspensión.
- Siembra de organoides caninos
- Diluya o concentre la suspensión celular para obtener una concentración celular de ~75,000 células por ml.
- Sembra 100 μL de la suspensión en cada inserto usando puntas prerecubiertas de BSA (1%) para evitar la adhesión celular durante la transferencia. Agregue un inserto recubierto como un espacio en blanco libre de células sin que crezca ningún organoide mientras sigue recibiendo cambios regulares en los medios.
- Gire suavemente la placa en un movimiento circular durante ~ 30 s para dispersar las células sembradas a través del inserto. Confirme mediante microscopía de luz la distribución uniforme de las células.
- Añadir 700 μL de CMGF + R/G a la cámara basolateral y colocar la placa en la incubadora (37 °C; atmósfera de 5% CO2 ) durante 24 h.
- Después de 24 h, retire suavemente la suspensión celular de la cámara apical y reemplácela con 200 μL de CMGF + R / G. Devuelva la placa a la incubadora.
2. Protocolo de mantenimiento monocapa de células organoides
NOTA: La siguiente sección (pasos 2.1-2.2) describe el protocolo de mantenimiento de la monocapa de células organoides. El flujo de trabajo de los procedimientos presentados en este protocolo se resume en la Figura 4. En la Tabla suplementaria 1 se presenta una tabla para tomar notas que puede ayudar con la estandarización de las mediciones del valor TEER.

Figura 4: Flujo de trabajo del mantenimiento de la cultura de soporte permeable. Los valores de TEER se miden mediante electrodos (sondas) y un medidor de voltios/ohmios. Las sondas deben esterilizarse químicamente con alcohol al 70% antes de insertarlas en los pozos. Se miden los insertos de células en blanco y organoides y se calculan los valores de TEER. El medio se actualiza posteriormente en las cámaras apical y basolateral, y el cultivo de organoides caninos en el inserto se visualiza mediante microscopía de luz. Los desgarros en el cultivo de organoides o en la membrana microporosa se observan y manejan de acuerdo con el protocolo. Abreviatura: TEER = resistencia eléctrica transepitelial. Haga clic aquí para ver una versión más grande de esta figura.
- Medición del valor TEER
NOTA: Las mediciones del valor TEER se realizan utilizando un medidor epitelial de voltios/ohmios con accesorio de palillo. Consulte las instrucciones de uso del fabricante. Los valores TEER proporcionan información sobre la integridad de la monocapa organoide canina.- Tome mediciones del valor TEER en cada día alternativo durante el crecimiento del cultivo celular.
- Mueva el medidor epitelial de voltios/ohmios y sus electrodos al gabinete de bioseguridad. Esterilizar químicamente los electrodos en alcohol al 70% antes de su uso. Establezca la función en Ohmios. Espere al menos un minuto hasta que los electrodos se sequen.
- Antes de realizar la primera medición, inserte el electrodo de alambre en el puerto y encienda la alimentación. Asegúrese de que el medidor muestre 1,000 Ω con el inserto del electrodo de alambre en lugar de medir los palillos. Si este no es el caso, ajuste el dispositivo.
- Inserte los electrodos en la cámara apical y basolateral del inserto sin celda (en blanco), de modo que la cámara apical contenga el electrodo más corto y la cámara basolateral contenga el electrodo más largo (como se ve en la Figura 4). No toque la membrana, pero al mismo tiempo, asegúrese de que los electrodos estén sumergidos en el medio.
- Espere unos segundos hasta que el valor se estabilice y anote el valor en un libro de laboratorio. Mida las monocapas organoides caninas restantes, asegurándose de esterilizar los electrodos con un 70% de alcohol al medir diferentes muestras. Tenga cuidado de no tocar la monocapa organoide con el electrodo.
- Después de tomar las mediciones, esterilice los electrodos con alcohol al 70% por última vez. Asegúrese de protegerlos de los daños causados por una manipulación inadecuada y guárdelos de acuerdo con las instrucciones del fabricante.
- Calcule los valores TEER para cada pozo utilizando Eq (1), donde lamuestra R y Ren blanco son los valores ohmios (Ω) de los pozos monocapa y en blanco, respectivamente, y el área (cm²) es la del inserto.
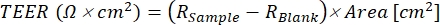 (1)
(1)
- Mantenimiento monocapa
NOTA: Revise el plan de cambio medio recomendado en la Tabla 2.- Usando pipetas Pasteur desechables estériles de 9" y un aspirador de vacío, aspire suavemente el medio desde las cámaras apical y luego basolateral. Incline la placa para ver claramente la superficie media. Evite aspirar demasiado cerca de la membrana microporosa en la cámara apical para evitar daños a la monocapa celular.
NOTA: Utilice una nueva pipeta Pasteur cuando se mueva entre muestras. Las pipetas también son un posible reemplazo para este procedimiento. - Agregue lentamente CMGF + R / G usando pipetas P1000 con el objetivo de una pared de la cámara apical o basolateral. Realice el cambio de medio en la cámara apical con mucho cuidado para evitar dañar la monocapa.
- Revise los pocillos cada dos días bajo un microscopio de luz, evaluando la salud del cultivo y monitoreando los desgarros en la monocapa organoide o la membrana microporosa. Utilice la microscopía de contraste de fase para resaltar los detalles del cultivo.
NOTA: En el caso de los desgarros de monocapa organoide canina, a la monocapa se le da tiempo para recuperarse y volver a crecer. En el caso de desgarros de membrana microporosa, el pozo debe excluirse del experimento.
- Usando pipetas Pasteur desechables estériles de 9" y un aspirador de vacío, aspire suavemente el medio desde las cámaras apical y luego basolateral. Incline la placa para ver claramente la superficie media. Evite aspirar demasiado cerca de la membrana microporosa en la cámara apical para evitar daños a la monocapa celular.
Tabla 2: Recomendación de cambio de medios para cultivos de organoides. CMGF+ R/G se cambia en la cámara apical y basolateral de los pozos cada dos días en todos los días alternativos. El período de cultivo más largo durante el fin de semana exige un mayor volumen de medio en las cámaras basolateral y apical, que se aplica un viernes por la tarde y se cambia el lunes. Abreviaturas: ROCK = quinasa asociada a rho; GSKiβ = glucógeno sintasa quinasa beta; CMGF + R/G = Medio completo con factores de crecimiento potenciados con inhibidor de ROCK y GSKiβ. Haga clic aquí para descargar esta tabla.
3. Protocolo experimental de permeabilidad
NOTA: La siguiente sección (pasos 3.1-3.5) describe el Protocolo Experimental de Permeabilidad. El flujo de trabajo del protocolo experimental para medir la permeabilidad in vitro de un fármaco se resume en la Figura 5.
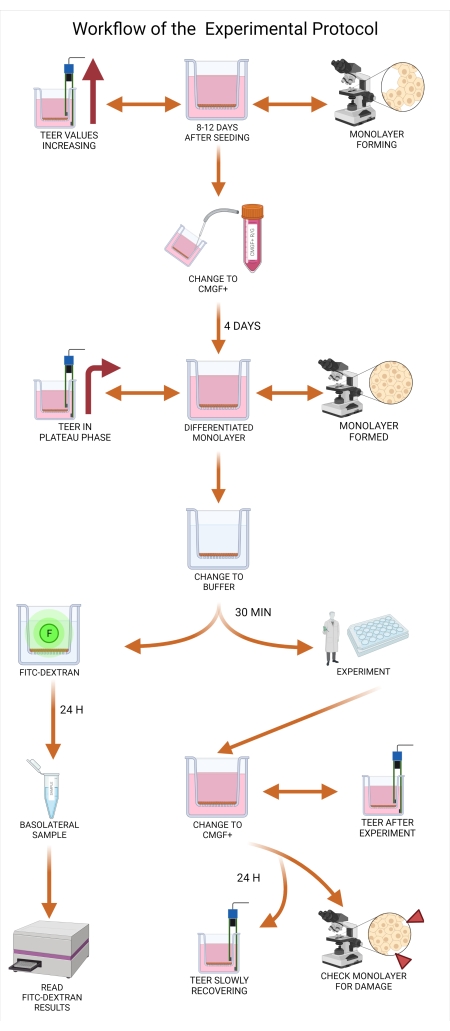
Figura 5: Flujo de trabajo del protocolo experimental. El medio organoide debe cambiarse de CMGF + R / G a CMGF + entre ocho y doce días después de sembrar los insertos, lo que permite la diferenciación celular. Después de cambiar el medio (tanto apical como basolateral) a CMGF +, los valores de TEER aún deberían estar aumentando, con la monocapa organoide canina casi alcanzando la confluencia. Al menos cuatro días después de que el medio se cambia a CMGF +, se evalúa la preparación de las monocapas. Cuando la monocapa está completamente formada y los valores de TEER alcanzan una fase de meseta (típicamente entre 1.500 y 2.500 Ω.cm2), el medio se intercambia por el tampón de transporte durante 30 minutos para permitir que la monocapa se ajuste al nuevo entorno. En el momento 0 min del experimento, se realiza el ensayo FITC-dextran y se recoge la muestra basolateral de 20 min. Los resultados se analizan posteriormente en un lector de placas. Después del experimento, el contenido de la cámara apical y basolateral se cambia nuevamente a CMGF +, y se toman lecturas de valores TEER. Las monocapas se incuban durante 24 h, y la integridad de la monocapa se evalúa a través de mediciones TEER repetidas. Abreviaturas: TEER = resistencia eléctrica transepitelial; ROCK = quinasa asociada a rho; GSKiβ = glucógeno sintasa quinasa beta; CMGF + R/G = Medio completo con factores de crecimiento potenciados con inhibidor de ROCK y GSKiβ; CMGF+ = Medio completo con factores de crecimiento pero sin inhibidor de ROCK o GSKiβ; FITC = isotiocianato de fluoresceína; F = fluorescencia. Haga clic aquí para ver una versión más grande de esta figura.
- Evaluación de la preparación de la monocapa de organoides
NOTA: Este paso ocurre de 8 a 14 días después de la siembra.- Revise la monocapa al menos cada dos días bajo el microscopio de luz (use contraste de fase para visualizar la integridad de la monocapa). Continúe con el siguiente paso cuando la monocapa celular esté completamente formada sin huecos o signos aparentes de desgarros.
- Cambiar el medio organoide de CMGF+ R/G a CMGF+ (excluyendo el inhibidor de ROCK y GSKiβ de la composición del medio). Se recomienda cambiar el medio al menos cuatro días antes del experimento.
NOTA: Este paso permitirá la diferenciación adecuada de la monocapa organoide. - Continúe midiendo los valores de TEER aproximadamente cada dos días. Cuando los valores de TEER comiencen a estabilizarse en aproximadamente 1.500 a 2.000 Ω × cm² (Figura 6), mida los valores de TEER todos los días.
NOTA: Este estado estacionario se puede mantener durante aproximadamente 2-3 días, que es la ventana de tiempo óptima para realizar pruebas de permeabilidad (generalmente en los días 11 a 13). Los valores de TEER de meseta pueden oscilar ligeramente en función de la localización intestinal de los organoides, la temperatura de medición, la raza, la edad y el estado de la enfermedad del perro. - Programe el ensayo de permeabilidad del fármaco inmediatamente para evitar una rápida disminución en los valores de TEER o el crecimiento excesivo de la monocapa organoide a múltiples capas celulares.
- Preparación para el experimento
NOTA: Los agitadores de incubadora se pueden usar durante el experimento para evitar los efectos de la capa de agua sin agitar. Mida los valores de TEER a temperaturas constantes.- El día del experimento, mida los valores de TEER y confirme que los valores alcanzaron un estado estacionario y no están disminuyendo rápidamente.
- Elija las mejores monocapas (a través de microscopía de luz y valores TEER) entre el exceso de insertos del 20% para realizar el experimento.
- Observe las monocapas bajo un microscopio de luz y excluya las monocapas organoides incompletas, rotas o crecidas.
- Prepare el tampón de transporte y ajuste su pH a los valores deseados.
NOTA: La composición del búfer experimental difiere según la configuración experimental. Un tampón de uso frecuente está compuesto por la Solución Salina Equilibrada de Hank (HBSS), glucosa (12.5 mM) y ácido 4-(2-hidroxietil)-1-piperazinatenosulfónico (HEPES, 25 mM). Esta composición asegura la viabilidad del cultivo de organoides durante un experimento. - Aspire cuidadosamente el medio desde las cámaras apical y basolateral de los pozos seleccionados.
- Añadir 200 μL de tampón de transporte a la cámara apical y 800 μL a la cámara basolateral.
NOTA: El tampón de transporte debe agregarse primero a la cámara apical y luego a la cámara basolateral para evitar el desprendimiento de la monocapa de la membrana microporosa. - Coloque la placa en la incubadora (37 °C; atmósfera de 5% de CO2 ) durante 30 min para equilibrar.
NOTA: Las monocapas organoides caninas ya están listas para el experimento de permeabilidad a la droga.
- Diseño experimental típico-solución de concentración de IgY
NOTA: El diseño experimental y el diseño pueden cambiar dependiendo de la pregunta de investigación. La permeabilidad de la inmunoglobulina Y (IgY) a través de una monocapa organoide se utiliza en el protocolo como ejemplo y puede ser modificada. El término cámara donante se refiere a la cámara donde se aplica inicialmente el medicamento, mientras que la cámara receptora se refiere a la cámara que acepta el medicamento de la cámara donante. Un experimento típico recoge muestras en las cámaras receptoras durante 2 h (por ejemplo, 15, 30, 60, 90, 120 min).- Preparar la solución de IgY (fármaco o soluto de elección) disolviéndola en el tampón de transporte hasta la concentración final deseada. Prepare más solución de medicamento de la necesaria.
NOTA: Los medicamentos con baja solubilidad acuosa pueden disolverse primero en un disolvente orgánico (por ejemplo, etanol, DMSO) antes de agregarlos al tampón. La concentración final del disolvente debe ser inferior al 1% para no dañar la monocapa celular. - Retire el tampón de la cámara donante (ya sea apical o basolateral) de cada pozo.
- Añadir la solución igY (solución farmacológica) a todas las cámaras donantes. Utilice la solución restante como la solución donante de tiempo 0 para la medición de la concentración inicial del fármaco.
- En los puntos de tiempo requeridos, retire 50 μL de la cámara receptora y colóquelo en un tubo etiquetado. En el último punto de tiempo, retire una muestra de la cámara donante. Al final del experimento, transfiera las alícuotas del donante y del receptor a un congelador de -20 °C.
NOTA: Si se necesitan muchos puntos de tiempo, se puede reemplazar el búfer en la cámara receptora, pero debe tenerse en cuenta en el cálculo de la permeabilidad aparente. La concentración en la cámara receptora no debe alcanzar más del 10% de la cámara donante al final del experimento para mantener las condiciones del sumidero44.
- Preparar la solución de IgY (fármaco o soluto de elección) disolviéndola en el tampón de transporte hasta la concentración final deseada. Prepare más solución de medicamento de la necesaria.
- Control de calidad monocapa de células organoides
NOTA: La solución de FITC-dextrano se puede utilizar para confirmar la integridad de la monocapa durante el experimento. FITC-dextran se utiliza como ejemplo de un ensayo de integridad monocapa. Otros incluyen Lucifer amarillo, PEG-4000, manitol radiomarcado e inulina44.- En el tiempo 0 min, aspirar el contenido de la cámara apical y sustituir con 250 μL de solución de FITC-dextrano (5 mg/mL, 4 kDa) por triplicado para cada grupo experimental.
NOTA: No exponga FITC-dextran a la luz. - Después de 20 minutos, retire el tampón de la cámara basolateral.
- Mida la intensidad de fluorescencia de la muestra basolateral utilizando un lector de placas de fluorescencia (use una curva de calibración; excitación establecida en 485 nm y valor de emisión en 528 nm).
NOTA: Laaplicación P de FITC también se puede calcular utilizando el método descrito en la discusión. - Después de que concluya el experimento, aspire cuidadosamente el exceso de amortiguación de las cámaras apical y basolateral.
- Añadir 200 μL de CMGF+ en la cámara apical y 700 μL en la cámara basolateral.
- Mida los valores de TEER en los pozos individuales.
- Coloque la placa en la incubadora (37 °C; atmósfera de 5% CO2 ) durante 24 h.
- Si corresponde, después de 24 h, mida los valores de TEER para evaluar el posible daño a la monocapa durante la parte de control de calidad del experimento. Utilice la microscopía de luz para visualizar la integridad de la monocapa organoide canina.
- En el tiempo 0 min, aspirar el contenido de la cámara apical y sustituir con 250 μL de solución de FITC-dextrano (5 mg/mL, 4 kDa) por triplicado para cada grupo experimental.
- Fijación de monocapas de celda para análisis posterior
- Preparar la solución de Formalina-Ácido Acético-Alcohol (FAA, composición en la Tabla 1).
- Retire el tampón de transporte o CMGF+ de las cámaras apical y basolateral utilizando una pipeta P1000 o pipetas Pasteur desechables estériles de 9" y un aspirador de vacío.
- Llene las cámaras apical y basal con FAA.
- Después de 24 h, aspire el FAA y reemplácelo con etanol al 70%.
- Envuelva la placa con una película de laboratorio flexible para evitar la evaporación y proceda a bloquear la preparación.

Figura 6: Valores de TEER en todos los grupos experimentales. Los valores de TEER se midieron en cinco grupos de monocapas organoides intestinales caninas. Tres grupos estaban compuestos por enteroides yeyunales caninos, y dos grupos consistían en colonoides. Cada grupo incluyó de 12 a 22 réplicas. Los valores de TEER para cultivos enteroides yeyunales se muestran desde el día 4 hasta el día 14, y los cultivos colonoides se muestran desde el día 4 hasta el día 12 (las mediciones terminaron cuando la monocapa organoide alcanzó valores de estado estacionario, lo que indica que la monocapa estaba lista para uso experimental). Las barras de error expresan el SEM de las mediciones. Abreviatura: TEER = resistencia eléctrica transepitelial. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Los procedimientos operativos estándar para el cultivo de organoides caninos se describieron anteriormente33, y el Protocolo de Organoides Caninos también se ha discutido en detalle en este número especial38. Los organoides intestinales caninos cultivados en soportes permeables fueron fijos e incrustados en parafina para examinar la microanatomía de la monocapa y las poblaciones celulares. El proceso de incrustación de parafina fue discutido previamente por Gabriel et al.38. Se ha realizado una tinción de rutina (hematoxilina y eosina), y se utilizó la técnica de tinción azul alciano para detectar células caliciformes en la monocapa organoide canina (ver Figura 7).
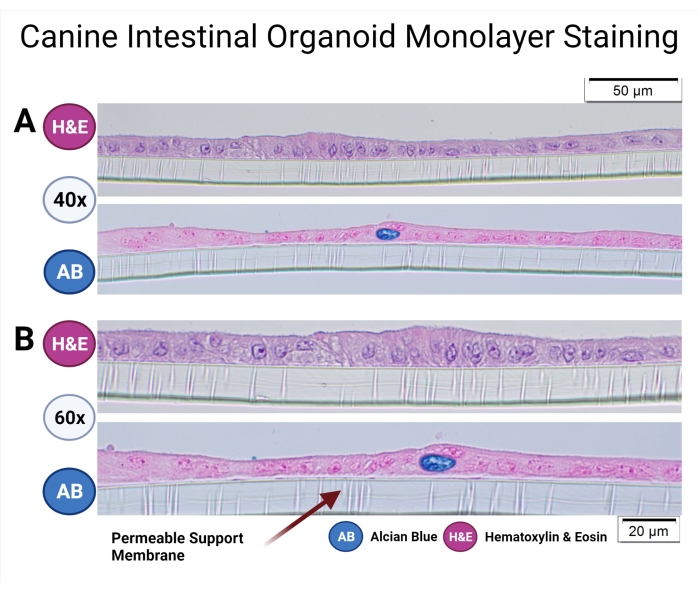
Figura 7: Tinción monocapa organoide intestinal canina. Los organoides intestinales caninos de origen colónico en el soporte permeable han sido incrustados en parafina y teñidos con H&E y AB. Se tomaron imágenes representativas utilizando microscopía de luz a un aumento de 40x (A) y 60x (B). La tinción de H&E revela una monocapa epitelial columnar, y las microvellosidades en la parte apical de las células se pueden observar a un aumento de 60x. La tinción AB revela aún más la presencia de células caliciformes (azul oscuro) en la monocapa organoide intestinal canina. Barras de escala = 20 μm (A), 50 μm (B). Abreviaturas: H&E = hematoxilina y eosina; AB = Azul alciano. Haga clic aquí para ver una versión más grande de esta figura.
El cultivo de organoides en el soporte permeable debe cultivarse durante 10 a 14 días para estar listo para un experimento de permeabilidad. La microscopía de luz se utiliza junto con las mediciones del valor de TEER para confirmar la preparación del cultivo de organoides para las pruebas de permeabilidad de los candidatos a fármacos. En la Figura 8 se presentan imágenes microscópicas de luz representativas de diferentes monocapas organoides intestinales caninas de animales sanos y enfermos.

Figura 8: Microscopía monocapa organoide intestinal canina. Imágenes de monocapas en crecimiento vistas bajo microscopía de luz. Las monocapas organoides derivadas de donantes sanos están representadas por cultivos enteroides yeyunales (10x; 40x) y colonoides (20x; 40x). Las monocapas organoides de donantes enfermos están representadas por enteroides duodenales (5x; 10x) e ileales (5x; 10x) derivados de un paciente canino diagnosticado con PLE. Ambos cultivos organoides PLE son ejemplos de aislamiento celular inadecuado durante la siembra de organoides, y estos cultivos no pudieron usarse para ensayos de permeabilidad a fármacos debido a la presencia de organoides 3D. Los ejemplos de desviaciones de la formación adecuada de monocapa, como los desgarros monocapa (5x), son causados por la manipulación descuidada de las muestras biológicas. El cultivo prolongado de organoides (10x; 20x) es causado por el mantenimiento prolongado de los organoides en el inserto cuando los organoides comienzan a parecerse a su estructura 3D original. A modo de comparación, se presentan imágenes de líneas celulares 2D tradicionales en los soportes permeables utilizados comúnmente para estudios de permeabilidad de fármacos (MDCK-10x; 40x, y Caco-2-10x; 20x). Abreviaturas: PLE = enteropatía perdedora de proteínas; MDCK = Riñón canino de Madin-Darby. Barras de escala = 500 μm (5x), 200 μm (10x), 100 μm (20x), 50 μm (40x). Haga clic aquí para ver una versión más grande de esta figura.
Las monocapas organoides también se fijaron en glutaraldehído al 3% paraformaldehído-3% en solución salina tamponada con fosfato (PBS). Se utilizó microscopía electrónica de transmisión (TEM) para caracterizar la ultraestructura del cultivo de organoides en los soportes permeables. Las estructuras microanatómicas de microvellosidades y uniones estrechas se pueden ver en la Figura 9.

Figura 9: Imágenes TEM de monocapas organoides intestinales caninas sanas. Tem se utilizó para revelar la microarquitectura celular de las monocapas organoides yeyunales (A), ileales (B) y colónicas (C). La membrana microporosa del inserto de soporte permeable está marcada con una flecha amarilla. La presencia de microvellosidades (flecha azul) y uniones estrechas (flecha roja) se delinea en las imágenes. Abreviatura: TEM = Microscopía electrónica de transmisión. Barras de escala = 5 μm (A), 2 μm (B, C). Haga clic aquí para ver una versión más grande de esta figura.
Tanto las mediciones TEER como la microscopía de luz deben realizarse para garantizar que el sistema esté listo para las pruebas de permeabilidad. El ensayo está listo para su uso cuando TEER alcanza un estado estacionario, mientras que la microscopía de luz ayudará a excluir el daño o el crecimiento excesivo de los organoides. En la Figura 6 se presenta un resumen de las mediciones típicas de TEER de cinco grupos que consisten en enteroides y colonoides yeyunales caninos.
Tabla 1: Composición de medios organoides y FAA. La composición completa de CMGF+, CMGF+ R/G y FAA se resume en esta tabla. Abreviaturas: ROCK = quinasa asociada a rho; GSKiβ = glucógeno sintasa quinasa beta; CMGF + R/G = Medio completo con factores de crecimiento potenciados con inhibidor de ROCK y GSKiβ; CMGF+ = Medio completo con factores de crecimiento pero sin inhibidor de ROCK o GSKiβ; FAA = formalina-ácido acético-alcohol; EGF = factor de crecimiento epidérmico. Esta tabla está adaptada de 38. Haga clic aquí para descargar esta tabla.
Tabla suplementaria 1: Tabla para la toma de notas sobre el organoide canino el sistema de soporte permeable. Abreviaturas: TEER = resistencia eléctrica transepitelial; ROCK = quinasa asociada a rho; GSKiβ = glucógeno sintasa quinasa beta; CMGF + R/G = Medio completo con factores de crecimiento potenciados con inhibidor de ROCK y GSKiβ; CMGF+ = Medio completo con factores de crecimiento pero sin inhibidor de ROCK o GSKiβ. Haga clic aquí para descargar esta tabla.
Discusión
Los cultivos de organoides intestinales caninos en el aparato de soporte permeable son un concepto único que conecta los ensayos tradicionales de permeabilidad a fármacos40 con un novedoso modelo canino in vitro 41. Se pueden usar y evaluar diferentes tipos de organoides intestinales caninos en función del objetivo del experimento con ajustes mínimos. Se recomienda probar múltiples concentraciones del fármaco de interés en 3-4 pocillos por grupo. Las concentraciones pueden basarse en la concentración intestinal esperada de la droga. Además, el uso de investigaciones previas puede ayudar a determinar los puntos de tiempo apropiados para el diseño del estudio. Se debe hacer la documentación adecuada del diseño del estudio para aumentar la replicabilidad y ayudar en la solución de problemas.
Esta tecnología tiene varias limitaciones debido a la novedad del método42, principalmente debido a la falta de estandarización en el diseño experimental y la ejecución del protocolo en todos los laboratorios. Esta falta de estandarización ha sido reconocida por otros grupos43, y los Protocolos De Monocapa Organoide 3D Canina conducirán a la reproducibilidad entre laboratorios e introducirán la estandarización a este sistema. Los enfoques estandarizados para el análisis de datos mejoran la replicabilidad y pueden fortalecer los resultados de las pruebas preliminares de drogas utilizando los organoides caninos en el sistema de soportes permeables en diferentes laboratorios. El modelo organoide 3D canino también carece de conjuntos de datos que comparen los valores in vitro de Papp de los medicamentos modelo con su absorción intestinal in vivo humana o canina conocida, al igual que las células Caco-2 44,45,46. Una vez que se han generado dichos datos, este modelo de organoides caninos se puede utilizar para evaluar la permeabilidad intestinal durante el desarrollo del fármaco.
Es crucial que se tenga cuidado al sembrar los organoides en el sistema de soporte permeable para sembrar una densidad lo suficientemente alta de células adecuadamente disociadas. Los valores TEER del sistema son más fiables y reproducibles cuando se cultivan en monocapas estrictas. El cultivo prolongado de las monocapas puede conducir a un aumento exponencial de los valores de TEER que se alejan más de los valores fisiológicos del intestino. Las secciones de H&E de tales estructuras 3D muestran varias capas de células una encima de la otra con estructuras alteradas de enterocitos más cerca de la membrana.
Después de la expansión exitosa de la monocapa organoide intestinal canina, los resultados se pueden analizar de la misma manera que los ensayos tradicionales de células 2D mediante el cálculo del coeficiente de permeabilidad aparente (Papp) de un fármaco fórmula44. El valorde la aplicación P (véase Eq (2)) describe la velocidad de transporte a través de la monocapa celular47.
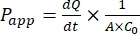 (2)
(2)
Es 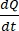 la pendiente inicial de la concentración frente a la curva de tiempo (por ejemplo, nmol/s). A es el área del inserto (cm2), y C0 es la concentración inicial del fármaco o compuesto en la cámara donante37. El reconocimiento confiable de la integridad de la monocapa es una parte crucial del ensayo de permeabilidad que requiere estandarización. Se recomiendan mediciones de microscopía de luz y TEER para evaluar organoides caninos en un sistema de soporte permeable y ayudar a determinar el momento correcto del experimento. Además, se pueden utilizar marcadores de permeabilidad molecular cero (por ejemplo, FITC-dextrano, amarillo Lucifer, PEG-400) para evaluar funcionalmente la integridad de la monocapa organoide. Se debe prestar atención si el compuesto probado se ve afectado por un transportador. La glicoproteína P (P-gp) se utiliza como un ejemplo común de bomba de eflujo. Se debe generar una relación de eflujo (aplicación P, aplicación BL-AP / P, AP-BL) con comparación con un sustrato de sonda P-gp bien conocido.
la pendiente inicial de la concentración frente a la curva de tiempo (por ejemplo, nmol/s). A es el área del inserto (cm2), y C0 es la concentración inicial del fármaco o compuesto en la cámara donante37. El reconocimiento confiable de la integridad de la monocapa es una parte crucial del ensayo de permeabilidad que requiere estandarización. Se recomiendan mediciones de microscopía de luz y TEER para evaluar organoides caninos en un sistema de soporte permeable y ayudar a determinar el momento correcto del experimento. Además, se pueden utilizar marcadores de permeabilidad molecular cero (por ejemplo, FITC-dextrano, amarillo Lucifer, PEG-400) para evaluar funcionalmente la integridad de la monocapa organoide. Se debe prestar atención si el compuesto probado se ve afectado por un transportador. La glicoproteína P (P-gp) se utiliza como un ejemplo común de bomba de eflujo. Se debe generar una relación de eflujo (aplicación P, aplicación BL-AP / P, AP-BL) con comparación con un sustrato de sonda P-gp bien conocido.
La microscopía de luz (simple o mejorada con contraste de fase) es un método invaluable para verificar la integridad de la monocapa 2D o 3D y el inserto del filtro mientras se evalúa el posible crecimiento excesivo celular. La Figura 7 puede servir como una guía para reconocer cultivos sanos de células organoides intestinales caninas. Los valores de TEER son una medida importante de la formación de uniones intercelulares y la diferenciación de los cultivos de organoides en un epitelio intestinal intacto. Los organoides intestinales caninos se diferencian en enterocitos y células caliciformes (Figura 6). Estas células productoras de moco permiten el estudio de las interacciones fármaco-moco, lo que ha sido difícil de lograr utilizando cultivos celulares 2D tradicionales48. La presencia de células enteroendocrinas ha sido confirmada previamente en organoides intestinales caninos por Chandra et al.33.
Se proporciona una caracterización adicional de las monocapas organoides caninas derivadas de organoides yeyunales, ileales y colónicos utilizando TEM. Las imágenes TEM muestran la microarquitectura celular, incluidas las uniones estrechas y la formación de microvellosidades, lo que ilustra aún más la complejidad y la utilidad de estos modelos organoides en medicina traslacional. Con base en los resultados experimentales, los cultivos de organoides en el soporte permeable estuvieron listos para la experimentación entre los días 11 y 13 después de la siembra (Figura 9). Los valores de TEER en este punto de tiempo oscilaron entre 1.500 y 2.500 Ω.cm2. La fase de meseta de los valores TEER dura una ventana de tiempo muy limitada en la que el experimento debe iniciarse antes de que los valores TEER comiencen a disminuir lentamente. Los valores de TEER también pueden ser una parte crucial de la visualización de resultados experimentales importantes, ya que algunos medicamentos o excipientes de productos farmacéuticos pueden interactuar con la monocapa (por ejemplo, uniones estrechas), lo que puede afectar en gran medida las lecturas de valores de TEER. Esto por sí solo puede servir como datos para un experimento.
Los organoides intestinales caninos en un aparato de cultivo celular de doble cámara se pueden aplicar en campos distintos de la permeabilidad oral a los medicamentos debido a la arquitectura única de la monocapa celular resultante. Por ejemplo, se pueden utilizar en la investigación microbiológica (por ejemplo, el impacto de la alteración de la flora microbiana gastrointestinal), estudios de absorción viral, interacciones fármaco-fármaco y mecanismos de transporte de fármacos49. La cámara donante generalmente se llena con el medicamento de prueba o compuesto de elección, y las alícuotas de la cámara receptora se toman en varios puntos de tiempo. Estas alícuotas se pueden analizar utilizando cromatografía líquida de alto rendimiento, espectrometría de masas, ensayo de inmunoabsorción ligado a enzimas u otras técnicas para determinar la cantidad y la velocidad por la cual el soluto penetra a través de la monocapa.
Estos estudios requieren una monocapa intacta para evaluar la permeabilidad del fármaco con precisión. Esto generalmente requiere el cultivo de monocapas en exceso de las necesarias para dar cuenta de los pozos inutilizables. Las monocapas de células organoides también se pueden usar para medir la absorción viral, ya sea desde el lado apical o basal de una monocapa, con lecturas que incluyen ensayos de inmunofluorescencia que utilizan anticuerpos para detectar la absorción celular del virus. Finalmente, se pueden aplicar múltiples medicamentos (es decir, sustrato e inhibidor) a la cámara donante para identificar las interacciones medicamentosas basadas en transportadores.
Sobre la base de las observaciones actuales, estos métodos no solo serán aplicables a los organoides caninos en insertos de cultivo, sino que también serán adecuados para otras especies veterinarias y sistemas de órganos, con modificaciones menores necesarias para adaptarse mejor a la especie o modelo de órgano de elección. Los protocolos para el crecimiento de organoides intestinales caninos tuvieron que ajustarse en función de las propiedades únicas del cultivo. Por lo tanto, el protocolo se puede ajustar a otra especie, pero requerirá cambios sutiles en el protocolo. Las modificaciones pueden comenzar con cambios en la densidad de siembra celular y expandirse a cambios en la composición de los medios para diferenciar adecuadamente los organoides de interés.
La estandarización, la documentación detallada de los procedimientos experimentales y el monitoreo consistente de las monocapas celulares son prácticas cruciales necesarias en los ensayos de soporte permeable y no se limitan al sistema canino. Estas posibles modificaciones de especies u órganos son fundamentales para documentar e informar sobre nuevos avances en el campo. Este modelo tiene varias limitaciones, por ejemplo, sus requisitos de costos, la variabilidad entre laboratorios y los datos limitados sobre la capacidad de predecir la absorción intestinal in vivo. Los perros, en algunos casos, poseen diferentes transportadores de drogas y enzimas metabolizadoras que los humanos50.
Además, el sistema organoide canino debe probarse en una variedad de otros aparatos de doble cámara de otros fabricantes para determinar la idoneidad de dicho modelo (por ejemplo, se debe determinar la idoneidad de diferentes composiciones de membranas filtrantes). Otra desventaja es que la parte del experimento de permeabilidad a la droga del manuscrito es menos descriptiva que las partes anteriores. Esto es causado por un exceso de información en este campo. El objetivo de esta parte del manuscrito era describir estos métodos de una manera modificable sin cortar los bordes de las piedras angulares de estos experimentos. Hubatsch et al.37 han recogido información más detallada sobre los experimentos de permeabilidad. Además, los insertos permeables se pueden utilizar en experimentos de cocultivo, migración celular y ensayo de invasión4.
En conclusión, los organoides intestinales caninos en aparatos de cultivo de doble cámara tienen el potencial de ser utilizados en una amplia gama de aplicaciones, incluidos los campos biomédicos y la medicina traslacional, por nombrar algunos. Los protocolos crean varias estrategias para planificar un experimento y promover la confiabilidad de los datos entre laboratorios para modelos organoides en todo el campo de la biología.
Divulgaciones
K. Allenspach es cofundador de LifEngine Animal Health y 3D Health Solutions. Se desempeña como consultora para Ceva Animal Health, Bioibérica, LifeDiagnostics, Antech Diagnostics, Deerland Probiotics y Mars. J.P. Mochel es cofundador de LifEngine Animal Health y 3D Health Solutions y se desempeña como consultor para Ceva Animal Health y Ethos Animal Health. Este artículo refleja los puntos de vista de los autores y no debe interpretarse como que representa el respaldo, la opinión o las políticas de la Administración de Alimentos y Medicamentos. Otros autores no tienen ningún conflicto de intereses que declarar.
Agradecimientos
Queremos expresar nuestra gratitud a los empleados del Laboratorio de Diagnóstico Veterinario de la Universidad Estatal de Iowa, a saber, Haley Lambert, Emily Rahe, Rosalyn Branaman, Victoria Green y Jennifer Groeltz-Thrush, por el procesamiento oportuno de las muestras. También nos gustaría agradecer a Jodi Smith y Bethann Valentine por proporcionar material para los experimentos de permeabilidad. También queremos agradecer a David Díaz-Reganon por su ayuda con la Figura 9. A excepción de la Figura 6, todas las figuras se crearon en BioRender.com. Los autores desean agradecer el apoyo de la Startup de la Facultad, el Premio ISU VPR Miller, el Premio ISU VPR Miller y el premio NSF SBIR a ISU # 1912948.
Materiales
| Name | Company | Catalog Number | Comments |
| Organoid media | |||
| ROCK inhibitor (Y-27632) | EMD Millipore Corp. | SCM 075 | |
| [Leu15]-Gastrin I human | Sigma | G9145-.5MG | |
| A-83-01 | PeproTech | 9094360 | |
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| B27 supplement | Gibco | 17504-044 | |
| FBS | Corning | 35-010-CV | |
| Glutamax | Gibco | 35050-061 | glutamine substitute |
| HEPES | VWR Life Science | J848-500ML | |
| Human R-Spondin-1 | PeproTech | 120-38-500UG | |
| Murine EGF | PeproTech | 315-09-1MG | |
| Murine Noggin | PeproTech | 250-38-250UG | |
| Murine Wnt-3a | PeproTech | 315-20-10UG | |
| N2 supplement | Gibco | 17502-048 | |
| N-Acetyl-L-cysteine | Sigma | A9165-25G | |
| Nicotinamide | Sigma | N0636-100G | |
| Primocin | InvivoGen | ant-pm-1 | |
| SB202190 (P38 inhibitor) | Sigma | S7067-25MG | |
| Stemolecule CHIR99021 (GSK3β) | Reprocell | 04-0004-base | |
| TMS (trimethoprim sulfate) | Sigma | T7883-5G | |
| Reagents | |||
| Acetic Acid, Glacial | Fisher Chemical | A38-500 | |
| alpha-D(+)-Glucose, 99+%, anhydrous | Acros Organics | 170080010 | |
| Cell Recovery Solution | Corning | 354253 | |
| Collagen I, Rat Tail 3 mg/mL | Gibco | A10483-01 | |
| FITC-CM-Dextran | Millipore Sigma | 68059-1G | |
| Formaldehyde (37%) | Fisher Chemical | F79P-4 | |
| Glutaraldehyde solution | Sigma | G5882 | |
| HBSS (1x) | Gibco | 14025-076 | |
| Matrigel Matrix For Organoid Culture | Corning | 356255 | Extracellular Membrane Matrix |
| Paraformaldehyde, 97% | Alfa Aesar | A11313 | |
| PBS, 1x (Phosphate-Buffered Saline) | Corning | 21-040-CM | |
| TrypLE Express | Gibco | 12604-021 | Trypsin-like Protease |
| Materials and Equipment | |||
| 15 mL Centrifuge Tube | Corning | 430766 | |
| 9" Pasteur Pipets | Fisherbrand | 13-678-6B | |
| Corning Transwell 6.5 mm Polyester Membrane Inserts Preloaded in 24-Well Culture Plates, Pore Size: 0.4 µm, Sterile | Corning | 3470 | Permeable Support |
| Millicell ERS (Probes) | Millipore Sigma | MERSSTX01 | |
| Millicell ERS-2 Voltohmmeter | Millipore Sigma | MERS00002 | |
| Panasonic incubator | Panasonic | MCO-170ML-PA | |
| Parafilm M Wrapping Film | Bemis Company Inc | PM996/EMD | Flexible Laboratory Film |
| Tissue Culture Plate 24 wells | Fisherbrand | FB012929 |
Referencias
- Ghaffarian, R., Muro, S. Models and methods to evaluate transport of drug delivery systems across cellular barriers. Journal of Visualized Experiments JoVE. (80), e50638 (2013).
- Youhanna, S., Lauschke, V. M. The Past, present and future of intestinal in vitro cell systems for drug absorption studies. Journal of Pharmaceutical Sciences. 110 (1), 50-65 (2021).
- Belic, S., et al. Comparative analysis of inflammatory cytokine release and alveolar epithelial barrier invasion in a transwell®bilayer model of mucormycosis. Frontiers in Microbiology. 3204, 3204 (2019).
- Justus, C. R., Leffler, N., Ruiz-Echevarria, M., Yang, L. V. In vitro cell migration and invasion assays. Journal of Visualized Experiments: JoVE. (88), e51046 (2014).
- Rönkkö, S., Vellonen, K. S., Järvinen, K., Toropainen, E., Urtti, A. Human corneal cell culture models for drug toxicity studies. Drug Delivery and Translational Research. 6 (6), 660-675 (2016).
- Dahlgren, D., Lennernäs, H. Intestinal permeability and drug absorption: predictive experimental, computational and in vivo approaches. Pharmaceutics. 11 (8), 411 (2019).
- Schoultz, I., Keita, &. #. 1. 9. 7. ;. V. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9 (8), 1909 (2020).
- Hilgers, A. R., Conradi, R. A., Burton, P. S. Caco-2 cell monolayers as a model for drug transport across the intestinal mucosa. Pharmaceutical Research. 7 (9), 902-910 (1990).
- Natoli, M., Leoni, B. D., D’Agnano, I., Zucco, F., Felsani, A. Good Caco-2 cell culture practices. Toxicology in Vitro. 26 (8), 1243-1246 (2012).
- Kapałczyńska, M., et al. 2D and 3D cell cultures – a comparison of different types of cancer cell cultures. Archives of Medical Science. 14 (4), 910-919 (2018).
- Sun, H., Chow, E. C. Y., Liu, S., Du, Y., Pang, K. S. The Caco-2 cell monolayer: Usefulness and limitations. Expert Opinion on Drug Metabolism and Toxicology. 4 (4), 395-411 (2008).
- Chandler, M., et al. Obesity and associated comorbidities in people and companion animals: a One Health perspective. Journal of Comparative Pathology. 156 (4), 296-309 (2017).
- Coelho, L. P., et al. Similarity of the dog and human gut microbiomes in gene content and response to diet. Microbiome. 6 (1), 72 (2018).
- Galeta, P., Lázničková-Galetová, M., Sablin, M., Germonpré, M. Morphological evidence for early dog domestication in the European Pleistocene: New evidence from a randomization approach to group differences. Anatomical Record. 304 (1), 42-62 (2021).
- Kleinert, M., et al. Animal models of obesity and diabetes mellitus. Nature Reviews Endocrinology. 14 (3), 140-162 (2018).
- Allenspach, K., Wieland, B., Gröne, A., Gaschen, F. Chronic enteropathies in dogs: Evaluation of risk factors for negative outcome. Journal of Veterinary Internal Medicine. 21 (4), 700-708 (2007).
- Wang, J., et al. Proliferative and invasive colorectal tumors in pet dogs provide unique insights into human colorectal cancer. Cancers. 10 (9), 330 (2018).
- Gillespie, V., Baer, K., Farrelly, J., Craft, D., Luong, R. Canine gastrointestinal stromal tumors: Immunohistochemical expression of CD34 and examination of prognostic indicators including proliferation markers Ki67 and AgNOR. Veterinary Pathology. 48 (1), 283-291 (2011).
- Chandra, L., et al. Derivation of adult canine intestinal organoids for translational research in gastroenterology. BMC Biology. 17 (1), 33 (2019).
- Schneider, B., et al. Model-based reverse translation between veterinary and human medicine: the One Health initiative. CPT: Pharmacometrics and Systems Pharmacology. 7 (2), 65-68 (2018).
- Artursson, P., Palm, K., Luthman, K. Caco-2 monolayers in experimental and theoretical predictions of drug transport. Advanced Drug Delivery Reviews. 22 (1-2), 67-84 (1996).
- Balimane, P. V., Han, Y. H., Chong, S. Current industrial practices of assessing permeability and P-glycoprotein interaction. AAPS Journal. 8 (1), 1-13 (2006).
- Sambuy, Y., et al. The Caco-2 cell line as a model of the intestinal barrier: Influence of cell and culture-related factors on Caco-2 cell functional characteristics. Cell Biology and Toxicology. 21 (1), 1-26 (2005).
- Calcagno, A. M., Ludwig, J. A., Fostel, J. M., Gottesman, M. M., Ambudkar, S. V. Comparison of drug transporter levels in normal colon, colon cancer, and caco-2 cells: Impact on drug disposition and discovery. Molecular Pharmaceutics. 3 (1), 87-93 (2006).
- Hilgendorf, C., et al. Expression of thirty-six drug transporter genes in human intestine, liver, kidney, and organotypic cell lines. Drug Metabolism and Disposition. 35 (8), 1333 (2007).
- Seithel, A., Karlsson, J., Hilgendorf, C., Björquist, A., Ungell, A. L. Variability in mRNA expression of ABC- and SLC-transporters in human intestinal cells: Comparison between human segments and Caco-2 cells. European Journal of Pharmaceutical Sciences. 28 (4), 291-299 (2006).
- Volpe, D. A. Transporter assays as useful in vitro tools in drug discovery and development. Expert Opinion on Drug Discovery. 11 (1), 91-103 (2016).
- Hoffmann, P., et al. Caco-2/HT29-MTX co-cultured cells as a model for studying physiological properties and toxin-induced effects on intestinal cells. PLoS ONE. 16 (10), 257824 (2021).
- Sun, H., Chow, E. C. Y., Liu, S., Du, Y., Pang, K. S. The Caco-2 cell monolayer: Usefulness and limitations. Expert Opinion on Drug Metabolism and Toxicology. 4 (4), 395-411 (2008).
- Thummel, K. E., et al. Transcriptional control of intestinal cytochrome P-4503A by 1α,25-dihydroxy vitamin D3. Molecular Pharmacology. 60 (6), 1399-1406 (2001).
- Kodama, N., et al. Characteristic analysis of intestinal transport in enterocyte-like cells differentiated from human induced pluripotent stem cells. Drug Metabolism and Disposition. 44 (10), 1662-1667 (2016).
- Akazawa, T., et al. Application of intestinal epithelial cells differentiated from human induced pluripotent stem cells for studies of prodrug hydrolysis and drug absorption in the small intestine. Drug Metabolism and Disposition: The Biological Fate of Chemicals. 46 (11), 1497-1506 (2018).
- Lo, B., Parham, L. Ethical issues in stem cell research. Endocrine Reviews. 30 (3), 204-213 (2009).
- Ambrosini, Y. M., et al. Recapitulation of the accessible interface of biopsy-derived canine intestinal organoids to study epithelial-luminal interactions. PLoS ONE. 15 (4), 0231423 (2020).
- Zdyrski, C., et al. Su124 homology directed repair in canine duodenal enteroids to mimic the wild-type P-glycoprotein mutation. Gastroenterology. 160 (6), 625 (2021).
- Nantasanti, S., et al. Disease modeling and gene therapy of copper storage disease in canine hepatic organoids. Stem Cell Reports. 5 (5), 895-907 (2015).
- Hubatsch, I., Ragnarsson, E. G. E., Artursson, P. Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers. Nature Protocols. 2 (9), 2111-2119 (2007).
- Gabriel, V., et al. Standardization and maintenance of 3D canine hepatic and intestinal organoid cultures for use in biomedical research. Journal of Visualized Experiments: JoVE. (179), e63515 (2022).
- Frost, T. S., Jiang, L., Lynch, R. M., Zohar, Y. Permeability of epithelial/endothelial barriers in transwells and microfluidic bilayer devices. Micromachines. 10 (8), 533 (2019).
- van Breemen, R. B., Li, Y. Caco-2 cell permeability assays to measure drug absorption. Expert Opinion on Drug Metabolism and Toxicology. 1 (2), 175-185 (2005).
- Huch, M., Knoblich, J. A., Lutolf, M. P., Martinez-Arias, A. The hope and the hype of organoid research. Development. 144 (6), 938-941 (2017).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Olivatti, T. O. F., Alcantara, G. P., Lemos, A. C. C. E., Silva, M. G., Miot, H. A. Standardization of organoid culture for evaluation of melanogenesis induced by UVB, UVA and visible light. Anais Brasileiros de Dermatologia. 95 (1), 46-51 (2020).
- Volpe, D. A., et al. Classification of drug permeability with a Caco-2 cell monolayer assay. Clinical Research and Regulatory Affairs. 24 (1), 39-47 (2007).
- Chen, C., Ma, M. G., Fullenwider, C. L., Chen, W. G., Sadeque, A. J. M. Biopharmaceutics permeability classification of lorcaserin, a selective 5-hydroxytryptamine 2C agonist: Method suitability and permeability class membership. Molecular Pharmaceutics. 10 (12), 4739-4745 (2013).
- Jarc, T., et al. Demonstrating suitability of the Caco-2 cell model for BCS-based biowaiver according to the recent FDA and ICH harmonised guidelines. Journal of Pharmacy and Pharmacology. 71 (8), 1231-1242 (2019).
- Newby, D., Freitas, A. A., Ghafourian, T. Decision trees to characterise the roles of permeability and solubility on the prediction of oral absorption. European Journal of Medicinal Chemistry. 90, 751-765 (2015).
- Navabi, N., McGuckin, M. A., Lindén, S. K. Gastrointestinal cell lines form polarized epithelia with an adherent mucus layer when cultured in semi-wet interfaces with mechanical stimulation. PLoS ONE. 8 (7), 68761 (2013).
- Puschhof, J., et al. Intestinal organoid cocultures with microbes. Nature Protocols. 16 (10), 4633-4649 (2021).
- Martinez, M. N., Mochel, J. P., Neuhoff, S., Pade, D. Comparison of canine and human physiological factors: understanding interspecies differences that impact drug pharmacokinetics. The AAPS Journal. 23 (3), 59 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados