Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Herramientas microfluídicas para sondear las interacciones fúngico-microbianas a nivel celular
En este artículo
Resumen
Debido a la opacidad del suelo, las interacciones entre sus microbios constituyentes no se pueden visualizar fácilmente con resolución celular. Aquí, se presentan dos herramientas microfluídicas, que ofrecen nuevas oportunidades para investigar las interacciones fúngico-microbianas. Los dispositivos son versátiles y fáciles de usar, lo que permite un alto control espaciotemporal e imágenes de alta resolución a nivel celular.
Resumen
Los hongos filamentosos son habitantes exitosos del suelo y desempeñan un papel importante en los ecosistemas del suelo, como en la descomposición de la materia orgánica e inorgánica, así como en la regulación de los niveles de nutrientes. Allí también encuentran numerosas oportunidades para interactuar con una variedad de otros microbios como bacterias u otros hongos. Sin embargo, estudiar las interacciones fúngicas a nivel celular puede ser un desafío debido a la naturaleza similar a una caja negra del suelo. Se están desarrollando nuevas herramientas microfluídicas para el estudio de las interacciones fúngicas; se destacan dos plataformas diseñadas para estudiar las interacciones bacteriano-fúngico y fúngico-fúngico. Dentro de estos microcanales, las interacciones fúngico-microbianas se pueden monitorear en entornos físico-químicos controlados a una resolución temporal y espacial más alta de lo que era posible anteriormente. La aplicación de estas herramientas ha producido numerosos conocimientos biológicos novedosos, como la observación de la unión polar bacteriana a las hifas o la revelación de antagonismos fúngicos-fúngicos no caracterizados. Una característica clave de estas metodologías se refiere a la facilidad de uso de esta herramienta por parte de no expertos, que produce tecnologías altamente traducibles para su uso en laboratorios de microbiología.
Introducción
El suelo es un entorno excepcionalmente diverso que contiene una gran cantidad de microorganismos que son fundamentales para los ciclos de carbono y fósforo 1,2. Los hongos filamentosos son un componente importante de numerosos ecosistemas como descomponedores de materia orgánica e inorgánica y pueden mejorar la nutrición de las plantas a través de la formación de relaciones simbióticas 3,4. Dentro del suelo, los hongos interactúan dinámicamente con multitud de microbios como otros hongos5, bacterias6, virus7 y nematodos8. Estas interacciones tienen consecuencias significativas para la salud del suelo y las plantas. Sin embargo, debido a la falta de sistemas experimentales apropiados capaces de obtener imágenes de microorganismos que interactúan con alta resolución, muchos permanecen indefinidos.
Las investigaciones sobre las interacciones bacteriano-fúngicas (BFI) y las interacciones fúngico-fúngicas (FFI) tienen aplicaciones valiosas en una variedad de campos, incluidos los antimicrobianos en medicina y los agentes de control biológico en la agricultura. Por ejemplo, el hongo Coprinopsis cinerea produce el péptido copsina, que se ha demostrado que exhibe actividad antibacteriana contra el patógeno humano Listeria monocytogenes9. Del mismo modo, el compuesto derivado de hongos, griseofulvina, es ampliamente utilizado como tratamiento para las infecciones fúngicas humanas y, además, es capaz de inhibir el crecimiento del hongo patógeno de plantas Alternaria solani10,11. También se ha demostrado que varias cepas de la bacteria habitada en el suelo Bacillus subtilis son agentes de control biológico efectivos del patógeno fúngico de las plantas Rhizoctonia solani12,13. Sin embargo, debido a las limitaciones asociadas con las metodologías tradicionales, los BFI y los FFIs son poco conocidos a nivel de células individuales.
Los estudios convencionales suelen explorar BFI y FFIs a macroescala utilizando placas de agar con dos o más especies en confrontación. Su interacción se evalúa midiendo las tasas de crecimiento y la producción de metabolitos de las especies enfrentadas 14,15,16; sin embargo, esta metodología solo se resuelve a nivel de colonia. Para estudiar las interacciones a nivel celular, los inoculantes bacterianos y fúngicos se pueden cultivar en portaobjetos de microscopio de vidrio recubiertos con agar que luego se toman imágenes bajo un microscopio17. Sin embargo, puede ser difícil seguir a una sola hifa usando portaobjetos de microscopio debido a la falta de confinamiento, lo que significa que las imágenes de lapso de tiempo son más difíciles de obtener. Además, la oportunidad de confinar espacialmente otros microorganismos dentro de regiones definidas del micelio fúngico o crear entornos químicos definidos que puedan ser perturbados, por ejemplo, no es posible en tales configuraciones. La naturaleza de "caja negra" del suelo también se suma a la complejidad de estudiar las interacciones fúngico-microbianas a nivel de células individuales18. Al observar especies que interactúan lejos de la increíble diversidad del microbioma del suelo, se puede evaluar la forma exacta en que los miembros individuales interactúan. Por lo tanto, existe una necesidad continua de plataformas versátiles que permitan imágenes de alta resolución de una sola célula de BFI y FFIs.
Las tecnologías microfluídicas, los llamados sistemas de laboratorio en un chip, proporcionan una plataforma ideal para el estudio de BFI y FFIs a nivel de células individuales. El campo de la microfluídica, originado a partir de tecnologías desarrolladas para el análisis químico y la microelectrónica, ha sido adoptado por las ciencias biológicas19. Las tecnologías microfluídicas regulan pequeños volúmenes de fluidos dentro de una red a medida de canales miniaturizados, que tienen al menos una dimensión en la escala micrométrica, y su uso en la investigación biológica se está expandiendo20. En particular, se han desarrollado dispositivos microfluídicos para examinar el crecimiento de hongos filamentosos 21,22,23,24,25,26,27,28,29,30. Un beneficio del uso de esta tecnología es que el confinamiento de las hifas y la distribución de nutrientes dentro de los microcanales se asemeja más a la estructura del ambiente del suelo que los métodos convencionales de agar31. Recientemente, se han utilizado plataformas microfluídicas para investigar las interacciones entre neutrófilos humanos y patógenos fúngicos32, bacterias y raíces de plantas33, así como hongos y nematodos34,35.
Una de las muchas ventajas de usar microfluídica para estudiar las interacciones microbianas incluye el control específico del entorno del microcanal. Por ejemplo, los regímenes de flujo laminar se pueden explotar para generar gradientes de concentración definidos, lo cual es especialmente útil cuando se examina la quimiotaxis bacteriana36. Otra ventaja es que la naturaleza transparente del poli(dimetilsiloxano) (PDMS), un polímero elastomérico biocompatible y económico comúnmente utilizado en la fabricación de dispositivos microfluídicos, facilita la obtención de imágenes de alta resolución de células individuales utilizando microscopía de campo brillante y fluorescencia37. Del mismo modo, el confinamiento de microbios dentro de microcanales significa que se pueden realizar experimentos de lapso de tiempo que rastrean células individuales, lo que permite registrar y cuantificar las respuestas celulares individuales37. Por último, como los dispositivos microfluídicos pueden diseñarse para ser fáciles de usar, pueden ser fácilmente empleados por no expertos38.
Fomentar el conocimiento de las interacciones entre los microorganismos que habitan en el suelo es importante para mejorar las prácticas de gestión sostenible de los ecosistemas que mantienen la biodiversidad y para mitigar el impacto del cambio climático en los entornos terrestres39. Por lo tanto, el desarrollo de nuevas herramientas microfluídicas es fundamental para ampliar la comprensión de los hongos y sus interacciones a nivel celular. El protocolo aquí se centrará en dos dispositivos microfluídicos producidos para el estudio de los BFIs40 y FFIs41 como se representa en la Figura 1.

Figura 1: Representación visual y esquemática de los dispositivos de interacción bacteriano-fúngica (BFI) e interacción fúngico-fúngico (FFI ). (A) Imagen del dispositivo BFI. Se coloca un tapón micelial en la entrada de un extremo de los microcanales para permitir el crecimiento hifal en el dispositivo. La entrada bacteriana está en el extremo opuesto. Barra de escala = 5 mm. (B) Visión general esquemática del dispositivo BFI, que representa el posicionamiento de las entradas bacterianas y la dirección del crecimiento hifal a través de los microcanales de interacción. Los canales tienen 10 μm de profundidad, 100 μm de ancho y 7 mm de largo, con 28 canales de observación en total. (C) Ensayo de confrontación en placa de agar entre Coprinopsis cinerea y Bacillus subtilis NCIB 3610, barra de escala = 20 mm (izquierda). Imágenes de microscopía que muestran la interacción entre C. cinerea y B. subtilis NCIB 3610 dentro del microcanal (centro y derecho), es decir, la unión polar de las bacterias a las hifas fúngicas. Barra de escala = 25 μm (centro) y 10 μm (derecha). (D) Imagen del dispositivo FFI unido a una placa de Petri con fondo de vidrio, inoculada dualmente con tapones miceliales. Barra de escala = 1 cm. (E) Descripción general esquemática del dispositivo FFI. Se introducen dos tapones inoculantes de hongos en las entradas en cada extremo del dispositivo, lo que permite la exploración hifal de los microcanales. Los canales de control están conectados a una sola entrada de hongos y tienen un canal sin salida, lo que evita las interacciones entre los hongos de prueba. Los canales de interacción conectan ambas entradas de hongos y permiten interacciones hifales entre los sujetos de prueba dentro del microcanal. Cada canal de interacción consta de 18 secciones en forma de diamante, que miden una longitud total de 8,8 mm (490 x 430 μm por diamante), 10 μm de profundidad y tienen una región de conexión entre cada diamante de 20 μm. Los tipos de canales están duplicados, barras de escala = 1 mm. (F) Zona de interacción entre dos frentes hifales que se acercan, creciendo desde extremos opuestos del canal de interacción interconectado. Imagen de microscopía de contraste de fase, barra de escala = 250 μm. Los paneles de esta figura han sido modificados a partir de Stanley et al., 2014 (A-C)40 y Gimeno et al., 2021 (D-F)41. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
NOTA: Un resumen de los procedimientos descritos en este protocolo se muestra visualmente en la Figura 2.
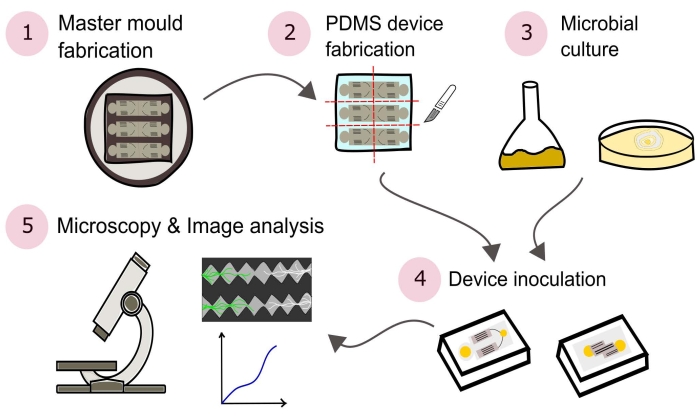
Figura 2: Representación esquemática de la metodología presentada que consta de cinco secciones principales detalladas en este protocolo. Los diseños de dispositivos se crean utilizando software de diseño asistido por computadora (CAD) y un molde maestro fabricado con fotolitografía (1). Esto se utiliza para fundir poli(dimetilsiloxano) (PDMS), que luego se corta en cubitos en losas y se une a placas de Petri con fondo de vidrio para formar los dispositivos microfluídicos (2). Los microbios que se incluirán en el estudio se cultivan (3) y se utilizan para inocular los dispositivos (4). Las interacciones se estudian mediante microscopía y se cuantifican mediante técnicas de análisis de imágenes (5). Haga clic aquí para ver una versión más grande de esta figura.
1. Fabricación de moldes maestros
- Producción de fotomáscaras
- Genere diseños de dispositivos microfluídicos utilizando software de diseño asistido por computadora (CAD). Las dimensiones de los dispositivos presentados se dan en la Figura 1 y más detalles sobre las características específicas de diseño se enumeran exhaustivamente en las respectivas publicaciones40,41.
- Exporte el archivo de diseño CAD utilizando un formato apropiado (por ejemplo, .dwg, .dxf). Imprima una máscara de fotolitografía de película enviando el archivo de diseño CAD exportado a un proveedor comercial para su impresión.
- Fotolitografía
NOTA: Los siguientes pasos deben llevarse a cabo dentro de un entorno libre de polvo y controlado por la luz, como una campana de flujo laminar o una instalación de sala limpia. Las condiciones experimentales proporcionadas aquí se dan como una guía y deben optimizarse internamente. Los autores recomiendan buscar formación específica y consultar los protocolos establecidos42.- Preparar una oblea de silicio de 100 mm horneándola en un horno a 200 °C durante 2 h. Spin-coat la oblea de silicio con fotorresistente SU-8 2010, con el objetivo de un espesor objetivo de 10 μm, utilizando las siguientes condiciones: 500 rpm durante 10 s (aceleración 100 rpm/s) y 3.000 rpm durante 45 s (aceleración 300 rpm/s).
PRECAUCIÓN: La fotorresistencia su-8 es peligrosa, tenga cuidado al manipular y evite la inhalación y el contacto con la piel. Es inflamable, potencialmente cancerígeno y tóxico para el medio ambiente. - Hornea la oblea de silicio recubierta a 95 °C durante 2,5 min (horneado suave). Exponga la fotorresistencia a la luz ultravioleta (UV), utilizando la máscara de fotolitografía de película y una dosis de energía de 140 mJ / cm2 a una longitud de onda de 365 nm utilizando un alineador de máscara.
- Hornea la oblea de silicio recubierta a 95 °C durante 3,5 min (horneado posterior a la exposición). Sumerja y agite la oblea de silicio en la solución de revelado durante 3 minutos para revelar las estructuras microfabricadas eliminando la fotorresistente no expuesta.
PRECAUCIÓN: La solución de desarrollador puede ser inflamable, tome las precauciones adecuadas al manipular y almacenar. - Enjuague con solución de reveladora fresca durante 10 s. Enjuague con alcohol isopropílico durante 10 s y seque al aire. Use aire comprimido filtrado para asegurarse de que las estructuras estén completamente secas. Mida la altura de las estructuras SU-8, por ejemplo, utilizando un perfilómetro.
- Silanizar cada molde maestro con 50 μL de clorotrimetilsilano aplicando una presión de vacío de 50 mbar durante 2 h. Los autores señalan que no se consideró necesaria la resilanización del molde maestro.
PRECAUCIÓN: El clorotrimetilsilano es una sustancia peligrosa. Use el equipo de protección personal (EPP) adecuado y manipule con cuidado. Evite el contacto con la piel y los ojos y evite la inhalación. Mantener alejado de fuentes de ignición y uso en un área bien ventilada.
- Preparar una oblea de silicio de 100 mm horneándola en un horno a 200 °C durante 2 h. Spin-coat la oblea de silicio con fotorresistente SU-8 2010, con el objetivo de un espesor objetivo de 10 μm, utilizando las siguientes condiciones: 500 rpm durante 10 s (aceleración 100 rpm/s) y 3.000 rpm durante 45 s (aceleración 300 rpm/s).
2. Fabricación del dispositivo
NOTA: Los siguientes pasos deben llevarse a cabo dentro de un entorno libre de polvo, como una campana de flujo laminar.
- Preparación de losas de poli(dimetilsiloxano) (PDMS)
- Prepare aproximadamente 40 g de PDMS mezclando bien la base y el agente de curado en una proporción de 10: 1 usando una espátula en un vaso de plástico limpio. Desgasifica la mezcla para eliminar todas las burbujas de aire colocando el vaso de plástico que contiene el PDMS en una cámara de vacío (presión de vacío = 50 mbar) durante 1 h.
- Asegure el molde maestro en un soporte de plástico con cinta transparente. Limpie con aire filtrado comprimido para eliminar cualquier partícula de polvo.
NOTA: Alternativamente, el papel de aluminio se puede dar forma alrededor de una placa de Petri de vidrio, y luego se puede usar para albergar el molde maestro y contener el PDMS43. - Vierta la mezcla PDMS en el centro del molde maestro, asegurándose de que esté en una superficie nivelada, y deje que se asiente.
NOTA: La mezcla PDMS debe verterse lo más cerca posible de la superficie del molde maestro y mantener un flujo continuo para minimizar la introducción de burbujas de aire. Las burbujas de aire se pueden eliminar dirigiendo aire comprimido sobre la burbuja o sacándolas con una aguja fina. - Cubra el molde maestro con una tapa de plástico para evitar que las partículas de polvo se asienten en la superficie del PDMS. Transfiera el molde maestro a un horno y cure durante la noche a 70 °C.
- Retira el molde maestro del horno y deja enfriar. Despegue el PDMS curado del molde maestro y el marco de plástico, teniendo cuidado de evitar dañar el molde maestro / PDMS.
- Coloque cinta transparente sobre los microcanales grabados en relieve en el PDMS para mantener una superficie libre de polvo. Asegúrese de que la cinta se retire antes de la unión.
- Corte el PDMS en losas (es decir, si se incluyen varios dispositivos en el diseño en el molde maestro, muchos se pueden fabricar a partir de una sola fundición) según lo designado por el diseño utilizando una guillotina montada o una cuchilla de afeitar. Al cortar la abertura lateral de la losa PDMS de BFI, asegúrese de que los microcanales estén completamente abiertos (Figura 1A). Para la losa FFI PDMS, asegúrese de que cada esquina esté recortada para que pueda encajar en la placa de Petri con fondo de vidrio que se muestra en la Figura 1D.
- Perfore los orificios de entrada / salida deseados de acuerdo con el diseño del dispositivo. Utilice un cortador de precisión para perforar orificios de entrada de 3,18 mm y 4,75 mm para los dispositivos BFI y FFI ejemplares, respectivamente.
- Unión de losas PDMS para crear dispositivos
NOTA: Los siguientes pasos de lavado (2.2.1-2.2.2) utilizan un limpiador ultrasónico lleno de agua purificada (ddH2O) a 37 kHz. El lavado de las losas PDMS ayuda a mejorar la unión exitosa44 y reduce el riesgo de contaminación. Para manipular las losas PDMS, use pinzas limpias y levante con los orificios de entrada para evitar daños en los microcanales o la superficie del dispositivo.- Sumergir las losas PDMS en 0,5 M NaOH y sonicar durante 5 min. Enjuague con ddH2O estéril. Transfiera las losas de PDMS a una solución de etanol al 70% y sonicato durante 5 min. Enjuague con ddH estéril20.
- Sumergir las losas PDMS en ddH2O estéril y sonicar durante 5 min. Retire las losas PDMS del ddH2O estéril, séquelas con aire comprimido filtrado y colóquelas en una placa de Petri cuadrada estéril.
- Coloque la placa de Petri cuadrada que contiene las losas PDMS en un horno a 70 °C durante 1 h para que se seque. Retirar del horno y dejar enfriar en un ambiente libre de polvo. Limpie cualquier polvo de la superficie de las losas PDMS con cinta adhesiva y/o aire comprimido filtrado.
- Active las superficies de las losas PDMS y las placas de Petri con fondo de vidrio para unirlas utilizando un limpiador de plasma con los siguientes ajustes: presión de vacío 0,75 mbar, potencia 50%, tiempo de recubrimiento 1 min. Coloque las superficies a activar (y posteriormente unidas) mirando hacia arriba en el limpiador de plasma.
- Retire las losas PDMS y las placas de Petri con fondo de vidrio del limpiador de plasma y únase colocando suavemente las superficies activadas en contacto conforme entre sí. Unir las losas BFI y FFI PDMS a las placas de Petri con fondo de vidrio de 35 mm y 50 mm de diámetro (espesor de vidrio 0,17 mm), respectivamente.
NOTA: Tenga cuidado de no aplicar demasiada presión al unirse, ya que esto puede provocar el colapso de los microcanales. - Compruebe si la unión es exitosa simplemente tratando de sacar la losa PDMS de la placa de Petri con fondo de vidrio con pinzas. Visualice los dispositivos a ojo o utilizando microscopía genérica para garantizar que no se colapsen las entradas de inoculación o los microcanales.
NOTA: Para condiciones saturadas (es decir, condiciones saturadas de agua y / o ricas en nutrientes), incluya el paso 2.2.7 del protocolo. Si se requieren condiciones insaturadas de agua, continúe con el paso 2.2.8. Los dispositivos se pueden llenar con agua o medios. - Llene los dispositivos inmediatamente después de la unión mediante pipeteo de 100 μL de la solución deseada para el dispositivo BFI (entrada bacteriana y abertura lateral) o 30 μL de medio en cada entrada (60 μL en total) para el dispositivo FFI. Si hay burbujas de aire presentes, estas se disiparán alrededor de 10 minutos después del llenado, ya que el PDMS es poroso.
- Agregue ddH2O estéril (~100-200 μL) en la placa de Petri para mantener la humedad.
3. Cultivo microbiano
NOTA: Los siguientes pasos proporcionan un procedimiento microbiológico general para el cultivo de hongos y bacterias y deben llevarse a cabo en condiciones estériles (es decir, utilizando una llama o un gabinete de seguridad microbiológica) apropiado para el nivel de contención requerido para los microbios deseados. Se dan ejemplos específicos al final de cada sección para una especie de interés.
- Cultura fúngica
- Prepare el medio de cultivo deseado complementado con agar. Autoclave el medio a 121 °C durante 15 min. Deje que el medio se enfríe a 50 °C y vierta en placas de Petri de 9 cm de diámetro, manteniendo condiciones estériles.
- Use un barrenador de corcho para quitar un tapón de agar de 4 mm de diámetro que contiene micelio de una colonia de caldo de nevera de la cepa fúngica deseada para activar el aislado. Esto se lleva a cabo para garantizar un crecimiento estandarizado y vigoroso del hongo antes de la inoculación del dispositivo.
NOTA: Los microbios también se pueden activar a partir de un stock de glicerol, es decir, aislados de hongos almacenados en tapones de agar en solución de glicerol al 50% a -70 °C41. - Coloque el lado del tapón con micelio en contacto con la superficie del agar en el centro de la placa de Petri no ininoculada. Reemplace la tapa en la parte superior de la placa de Petri y selle antes de incubar a la temperatura adecuada para la cepa deseada durante la cantidad de tiempo requerida, por lo general, alrededor de 3 a 4 días.
NOTA: Ejemplo de condiciones de cultivo para Trichoderma rossicum: Agar de extracto de malta, incubado a 25 °C en la oscuridad durante 48 h.
- Cultivo bacteriano
- Extraiga el aislado bacteriano deseado de la cepa de origen (por ejemplo, cepa de glicerol o colonia única de la placa de agar) en una placa de agar para lograr colonias bacterianas individuales y garantizar que no haya contaminación45. Selle la placa con película.
- Incubar a una temperatura y duración específica para el aislado de interés hasta que se observen colonias individuales.
- Prepare el caldo de cultivo deseado. Por ejemplo, agregue 10 g de triptona, 10 g de NaCl y 5 g de extracto de levadura por 1 L de ddH2O para preparar el medio LB para el cultivo de B. subtilis. Autoclave el medio a 121 °C durante 15 min.
- Deje que el medio se enfríe a temperatura ambiente. Agregue el medio a un matraz de cultivo estéril dentro de un ambiente estéril.
- Toque una sola colonia bacteriana de la placa de agar usando un lazo de inoculación estéril. Transfiera el bucle inoculado al medio de cultivo estéril tocando brevemente el líquido con el bucle.
- Selle el matraz con una tapa o lámina estéril, y colóquelo dentro de una incubadora de agitación durante la noche utilizando los ajustes apropiados para la especie seleccionada.
NOTA: Ejemplo de condiciones de cultivo para B. subtilis: i) cultivo líquido - crecimiento aeróbico a 37 °C a 200 rpm en medio LB y ii) cultivo en placa - temperatura ambiente en placa LB agar. Consulte los documentos FFI/BFI40,41 para obtener más detalles sobre el cultivo de diferentes cepas de hongos.
4. Inoculación del dispositivo
NOTA: Los siguientes pasos deben llevarse a cabo dentro de una campana de flujo laminar utilizando equipos estériles.
- Inoculación fúngica
- Use un barrenador de corcho esterilizado (ø = 4 mm) para quitar un tapón de agar de la colonia en la periferia de un cultivo de 3 días de antigüedad (paso 3.1). Asegúrese de que el frente hifal en crecimiento permanezca intacto.
- Introduzca el tapón en la entrada de hongos, con el micelio hacia abajo, con la dirección de crecimiento del frente hifal orientado hacia las aberturas del microcanal para fomentar la infiltración hifal de los canales.
- Repita los pasos 4.1.1-4.1.2 para la segunda especie de hongos (si utiliza el dispositivo FFI), introduciendo el enchufe en la entrada opuesta. Si utiliza el dispositivo BFI, omita este paso y continúe con el paso 4.1.4.
- Selle la placa de Petri con una película transparente e incube a 25-28 ° C en la oscuridad hasta que comiencen las imágenes. Determine el tiempo de incubación previo a la obtención de imágenes en función del evento biológico previsto que se observará, por ejemplo, las confrontaciones entre hongos y hongos y la tasa de crecimiento de las especies incluidas dentro del dispositivo.
- Inoculación bacteriana
- Diluya las bacterias de un cultivo nocturno (paso 3.2) en una proporción de 1:25 utilizando el mismo medio de cultivo que se detalla en el paso 3.2.3. Cultivo durante 3 h a 37 °C.
- Lavar las bacterias mediante cultivo de peletización con una centrífuga a 2000 x g durante 10 min. Deseche el sobrenadante y resuspenda las células en el volumen deseado de solución de cloruro de sodio al 0,9% p/v.
- Centrifuga de nuevo para obtener un pellet. Deseche el sobrenadante y resuspenda las células en medio líquido (por ejemplo, C. cinerea medio mínimo a un OD600 de 1). Optimizar el valor de OD600 para la cepa bacteriana en cuestión.
- Retire el dispositivo BFI de la incubadora y ábralo en un ambiente estéril. Pipete 10 μL de suspensión en la entrada bacteriana.
NOTA: Optimice los tiempos exactos de inoculación para las interacciones bacteriano-fúngicas en cuestión. Por ejemplo, introducir bacterias en el dispositivo BFI 18 h después de la inoculación fúngica si se utiliza C. cinerea. - Selle la placa de Petri con una película transparente e incube a 25 °C en la oscuridad hasta que comiencen las imágenes. Guarde el dispositivo en posición vertical.
5. Microscopía y análisis de imágenes
- Microscopia
NOTA: El investigador debe seleccionar el método apropiado de imágenes acorde con la naturaleza del experimento que se llevará a cabo, por ejemplo, una epifluorescencia de campo amplio invertido o microscopía confocal. Aquí se ha proporcionado una descripción general, ya que los detalles específicos dependerán de los atributos de la configuración de microscopía elegida.- Encienda la computadora del microscopio, el cuerpo principal del microscopio (si corresponde), la cámara, la incubadora con temperatura controlada y la(s) fuente(s) de luz. Asegúrese de que el microscopio se ha configurado correctamente, por ejemplo, la iluminación Köhler se ha aplicado correctamente para una iluminación uniforme de la muestra. Inicie el paquete de software de imágenes.
NOTA: Cuando se utiliza una incubadora de temperatura controlada, es importante permitir que la temperatura del microscopio se equilibre durante varias horas antes de comenzar un experimento. - Monte el dispositivo microfluídico en el inserto del escenario. Asegúrese de que el dispositivo esté bien asegurado, es decir, con cinta, para evitar que se desaloje el dispositivo durante el movimiento de la etapa activa.
- Adquiera imágenes de los dispositivos inoculados, por ejemplo, experimentos de un solo punto o de lapso de tiempo. Las especificaciones de imagen completas relevantes para los experimentos realizados con los dispositivos BFI y FFI se proporcionan en las respectivas publicaciones antes mencionadas40,41.
NOTA: Las imágenes de campo brillante se adquirieron mediante el uso de microscopía de contraste de fase para visualizar la proliferación de hifales a través de los canales de crecimiento utilizando software de enfoque automático y lentes de objetivo de 10x, 0.30 NA (apertura numérica) o 20x de aumento, 0.45 NA. La excitación de las proteínas fluorescentes reporteras se logró utilizando un motor de luz de diodo emisor de luz de alta potencia con longitudes de onda específicas para el fluoróforo. - Exporte imágenes a un formato adecuado para el procesamiento posterior de imágenes. Por ejemplo, .tiff.
- Encienda la computadora del microscopio, el cuerpo principal del microscopio (si corresponde), la cámara, la incubadora con temperatura controlada y la(s) fuente(s) de luz. Asegúrese de que el microscopio se ha configurado correctamente, por ejemplo, la iluminación Köhler se ha aplicado correctamente para una iluminación uniforme de la muestra. Inicie el paquete de software de imágenes.
- Análisis de imágenes
NOTA: Los autores recomiendan Fiji46 como una herramienta para el análisis de imágenes, pero hay otros paquetes de software disponibles. Los siguientes son ejemplos de análisis de imágenes realizados utilizando Fiji de las publicaciones de dispositivos BFI y FFI presentadas. Estos pasos son específicos de una Mac y pueden diferir ligeramente si se usa una PC.- Mediciones de la tasa de crecimiento de Hyphal
NOTA: Este método fue utilizado en el manuscrito BFI40 para medir las tasas de crecimiento de las hifas individuales.- Descargue, instale y ejecute Fiji. Importe la secuencia de imágenes de un experimento de lapso de tiempo seleccionando Archivo > Importar > Secuencia de imágenes. Localice la carpeta donde se almacenan los datos y seleccione Abrir. En la ventana Opciones de secuencia , seleccione Preferencias y, a continuación, Aceptar.
- Seleccione el icono Línea recta en la barra de herramientas principal. Coloque el comienzo de la línea recta en la punta de la punta hifal en crecimiento haciendo clic y luego arrastrando concomitantemente el cursor a otro punto dentro de la ventana. Aparecerá una línea amarilla con tres cuadros que indican el principio, el punto medio y el final de la línea.
- Desplácese al siguiente fotograma de la secuencia de imágenes manteniendo presionada la tecla Ctrl y >. Coloque el extremo de la línea recta en la punta de la hifa en crecimiento seleccionando y arrastrando el cuadro cuadrado a la posición correcta.
- Mantenga presionadas las teclas Ctrl y M para medir la longitud de la línea en píxeles. Aparecerá una ventana Resultados con los datos medidos. Defina los datos que se muestran en la ventana Resultados de la siguiente manera: haga clic en la ventana Resultados y, a continuación, seleccione Resultados > Establecer mediciones.
- Vaya al siguiente fotograma de la secuencia de imágenes manteniendo presionada la tecla Ctrl y, a continuación, >. Coloque el comienzo de la línea recta en la punta de la hifa en crecimiento seleccionando y arrastrando el cuadro cuadrado a la posición correcta.
- Mantenga presionada la tecla Ctrl y luego M para medir la longitud de la línea en píxeles. Aparecerá una ventana Resultados con los datos medidos.
- Repita los pasos 5.2.1.5-5.2.1.6 hasta que termine de medir el crecimiento de la hifa en píxeles.
- Seleccione todos los datos en la ventana Resultados . Copie y pegue en otro programa de software, por ejemplo, una hoja de cálculo, para procesar los datos. Traza el crecimiento hifal (en píxeles o micrómetros) en función del tiempo y calcula las tasas de crecimiento promedio. Realizar al menos tres réplicas biológicas por experimento.
- Mediciones de intensidad de fluorescencia
NOTA: Este método se utilizó en la publicación41 de la FFI para evaluar el cambio en la intensidad de fluorescencia en hifas de Fusarium graminearum 8/1-wt-GFP al contacto con Clonostachys rosea 016 en función del tiempo.- Descargue, instale y ejecute Fiji. Importe la secuencia de imágenes de un experimento de lapso de tiempo seleccionando Archivo > Importar > secuencia de imágenes. Localice la carpeta donde se almacenan los datos y seleccione Abrir. En la ventana Opciones de secuencia , seleccione Preferencias y, a continuación, Aceptar.
- Especifique una región de interés (ROI) para medir la intensidad de fluorescencia absoluta de una hifa utilizando la herramienta rectangular, ubicada en la barra de herramientas principal. El tamaño del cuadrado se puede definir exactamente de la siguiente manera: Editar > Selección > Especificar; el ROI también se puede guardar para futuras referencias en el Administrador de ROI seleccionando Editar > Selección > Agregar al Administrador.
- Mida la intensidad absoluta de fluorescencia (valor gris medio) dentro del ROI definido para cada imagen en toda la secuencia o pila de imágenes de la siguiente manera: > Pilas de imágenes > Pila de medidas. La ventana Resultados se abrirá automáticamente una vez que se hayan procesado todas las imágenes de la pila.
NOTA: Los datos que se muestran en la ventana Resultados se pueden definir de la siguiente manera: haga clic en la ventana Resultados y luego seleccione Resultados > Establecer mediciones. Asegúrese de que se ha seleccionado Valor gris medio. - Seleccione todos los datos en la ventana Resultados . Copie y pegue en otro programa de software, por ejemplo, una hoja de cálculo, para trazar las intensidades de fluorescencia absolutas del ROI especificado en función del tiempo.
- Repita los pasos 5.2.2.2-5.2.2.4 para recopilar mediciones de intensidad de fluorescencia absoluta para cada ROI, es decir, en la hifa de interés, junto a la hifa de interés o dentro del canal de control correspondiente.
- Calcule las intensidades de fluorescencia relativas apropiadas en unidades arbitrarias (UA), por ejemplo, dividiendo la intensidad de fluorescencia absoluta del ROI [hifa de interés] por la intensidad de fluorescencia absoluta del ROI [canal de control]. Consulte la publicación41 de la FFI para obtener detalles más específicos.
- Realizar al menos tres réplicas biológicas por experimento y trazar las intensidades relativas de fluorescencia en función del tiempo.
- Mediciones de la tasa de crecimiento de Hyphal
Resultados
Se presentan resultados representativos de los dispositivos ejemplares BFI40 y FFI41. Las mediciones de la tasa de crecimiento hifal se pueden obtener fácilmente utilizando estos dispositivos en combinación con técnicas básicas de microscopía. La Figura 3A-B ilustra las interacciones bacteriano-fúngicas entre C. cinerea hyphae y B. subtilis NCIB 3610. La presencia de B. subtilis...
Discusión
Este artículo presenta un protocolo para el estudio de las interacciones fúngico-microbianas utilizando microfluídica de canal. Los autores tienen como objetivo demostrar la versatilidad de estos dispositivos y fomentar la adaptación para adaptarse a los intereses del investigador. Utilizando los dispositivos ejemplares BFI y FFI, las interacciones fúngico-microbianas se pueden estudiar con más detalle de lo que se podía acceder anteriormente. Al eliminar la complejidad de fondo y la heterogeneidad del suelo, mode...
Divulgaciones
Los autores no declaran intereses contrapuestos.
Agradecimientos
Reconocemos el apoyo financiero del Departamento de Bioingeniería del Imperial College de Londres y The Leverhulme Trust (Referencia de la subvención de investigación: RPG-2020-352).
Materiales
| Name | Company | Catalog Number | Comments |
| Agar | Difco Laboratories | 214010 | Used to solidify culture medium for bacterial and fungal cultivation within Petri dishes |
| Aluminum foil | Fisher Scientific Ltd | 11759408 | |
| AutoCAD 2021 | Autodesk, USA | ||
| Autoclave (VX-75) | Systec | ||
| Centrifuge (5810R) | Eppendorf | ||
| Chlorotrimethysilane | Merck Life Sciences | 386529 | CAUTION: Chlorotrimethylsilane is a hazardous substance. Wear appropriate PPE and handle with care. Avoid contact with skin and eyes and prevent inhalation. Keep away from sources of ignition and use in a well-ventilated area. |
| Cork borer | SLS | COR1000 | |
| Developer solution (mr-Dev 600) | Microresist Technologies | CAUTION: mr-Dev 600 developer solution is flammable | |
| Erlenmeyer flasks | VWR | 214-1108 | e.g. 200 mL; choose size to suit your exact needs |
| Ethanol (70% v/v) | Fisher Scientific Ltd | E/0650DF/15 | Diluted from 99.8% (Analytical Reagent Grade) |
| Fiji | ImageJ | Exemplar software package for imaging processing | |
| Filtered, compressed air | Available as standard in most labs. Altervatively, an oil-free compressor with air regulator can be used. | ||
| Flat-headed wafer tweezers | SLS | INS5026 | |
| Forceps | Fisher Scientific Ltd | 10008051 | Bent, sharp |
| Glass bottom petri dish | World Precision Instruments | FD35-100 | 35 mm |
| Glass bottom petri dish | World Precision Instruments | FD5040-100 | 50 mm |
| Glass crystallisation dishes | VWR | 216-1865 | Used for washing of PDMS slabs |
| Glass crystallisation dishes | VWR | 216-1866 | Used in the development of master moulds |
| Glass media bottles | Fisher Scientific Ltd | 15456113 | e.g. 250 mL; choose size to suit your exact needs |
| Glass syringe (Hamilton) | Fisher Scientific Ltd | 10625251 | Used for dispensing chlorotrimethylsilane |
| Hot plate (HP 160 III BM) | SAWATEC | ||
| Inoculation loop | VWR | COPA175CS01 | |
| Isopropyl alcohol | Sigma-Aldrich | W292907 | |
| Laminar flow hood | Air Science (PCR) | Exemplar laminar flow hood used for device fabrication | |
| LB medium | Fisher Scientific Ltd | BP9723-500 | Exemplar nutrient broth for bacterial overnight culture |
| Light emitting diode light engine (LedHUB) | Omicron-Laserage Laserprodukte GmbH | Exemplar light source that can be used for imaging fungal-microbial interactions (fluorescence) | |
| MA6 Ultraviolet mask aligner | Suss Microtec | ||
| Malt extract | VWR | 84618 | Used to make exemplar fungal culture medium (Malt extract agar) |
| Mask Writer | Applied Materials | 4700DP | Example of a mask writer which can be used to print photo-mask for photolithography |
| Master mould plastic mount | 3D-printed bespoke holder manufactured in-house | ||
| Microbiological safety cabinet (BioMat2) | Contained Air Solutions | Exemplar MSC used for microbial culture and device inoculation | |
| Milli-Q purified water | Available as standard in biology labs. | ||
| NaOH | Fisher Scientific Ltd | BP359-500 | |
| NIS-Elements Advanced Research imaging software | Nikon | Exemplar software package for image acquisition | |
| NIS-Elements Free Viewer | Nikon | Exemplar software package for viewing acquired images | |
| Oven (Binder BD115) | Fisher Scientific Ltd | 15602126 | Used for curing poly(dimethylsiloxane)(PDMS) |
| Oven (CLO-2AH-S) | KOYO | Used for preparing silicon wafers | |
| Parafilm | Bemis | HS234526B | transparent film |
| Petri dishes, square sterile | Fisher Scientific Ltd | 11708573 | 120.5 mm |
| Petri dishes, sterile | Fisher Scientific Ltd | 15370366 | 90 mm |
| Photolithography mask | Micro Lithography Services Ltd. UK | ||
| Plasma cleaner (Zepto) | Diener Electronic | 100012601 | |
| Plastic cup | Semadeni | 8323 | |
| Plastic spatula | Semadeni | 3340 | |
| Portable precision balance (OHAUS Scout) | Fisher Scientific Ltd | 15519631 | Used for weighing PDMS, media components etc. |
| Precision cutter | Syneo | HS1251135P1183 | Cutting edge diameter: 3.18 mm |
| Precision cutter | Syneo | HS1871730P1183S | Cutting edge diameter: 4.75 mm |
| Profilometer | Bruker | Dektak XT-stylus | |
| Razor blades | Häberle Labortechnik | 9156110 | |
| Refridgerator | Haden | 4-6 °C | |
| Retiga R1 CCD camera | Qimaging | Exemplar camera that can be used for imaging fungal-microbial interactions | |
| Scotch magic tape | Office Depot | 3969954 | 19 mm invisible tape; clear tape |
| Shaking incubator (Cole-Parmer SI500) | Fisher Scientific Ltd | 10257954 | |
| Silicon wafer | Inseto | 100 mm | |
| Soda lime glass plate | Inseto | 125 mm x 125 mm x 2 mm. Used to hold photolithography mask in mask aligner | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Spincoater | SAWATEC | SM-180-BM | |
| SU-8 2010 photoresist | MicroChem | CAUTION: SU-8 photoresist is hazardous, take care when handling and prevent inhalation and contact with skin. Flammable, potentially carcinogenic and toxic to the environment. | |
| Sylgard 184 elastomer kit | VWR | 634165S | Used for the preparation of poly(dimethylsiloxane)(PDMS) devices |
| Temperature controlled incubator | Okolab | Exemplar incubator that can be used for imaging fungal-microbial interactions | |
| Ti2-E inverted epifluorescence microscope | Nikon | MEA54000 | Exemplar microscope that can be used for imaging fungal-microbial interactions |
| Ultrasonic cleaner S-Line | Fisher Scientific Ltd | FB15050 | |
| Vacuum desiccator | Fisher Scientific Ltd | 10528861 | Silianisation and PDMS degassing should be conducted in separate desiccators |
| x10/0.3 NA CFI Plan Fluor DL objective lens | Nikon | MRH20105 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
| x20/0.45 NA CFI Plan Fluor DL objective lens | Nikon | MRH48230 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
Referencias
- Zhu, Y. -. G., Miller, R. M. Carbon cycling by arbuscular mycorrhizal fungi in soil-plant systems. Trends in Plant Science. 8 (9), 407-409 (2003).
- Dai, Z., et al. Long-term nutrient inputs shift soil microbial functional profiles of phosphorus cycling in diverse agroecosystems. The ISME Journal. 14 (3), 757-770 (2020).
- Op De Beeck, M., et al. Regulation of fungal decomposition at single-cell level. The ISME Journal. 14 (4), 896-905 (2020).
- Bender, S. F., et al. Symbiotic relationships between soil fungi and plants reduce N2O emissions from soil. The ISME Journal. 8 (6), 1336-1345 (2014).
- Dullah, S., et al. Melanin production and laccase mediated oxidative stress alleviation during fungal-fungal interaction among basidiomycete fungi. IMA Fungus. 12 (1), 33 (2021).
- Deveau, A., et al. Bacterial-fungal interactions: ecology, mechanisms and challenges. FEMS Microbiology Reviews. 42 (3), 335-352 (2018).
- Bian, R., et al. Facilitative and synergistic interactions between fungal and plant viruses. Proceedings of the National Academy of Sciences of the United States of America. 117 (7), 3779-3788 (2020).
- Jiang, X., Xiang, M., Liu, X. Nematode-trapping fungi. Microbiology Spectrum. 5 (1), (2017).
- Essig, A., et al. a novel peptide-based fungal antibiotic interfering with the peptidoglycan synthesis. Journal of Biological Chemistry. 289 (50), 34953-34964 (2014).
- Tang, H. -. Y., Zhang, Q., Li, H., Gao, J. -. M. Antimicrobial and allelopathic metabolites produced by Penicillium brasilianum. Natural Product Research. 29 (4), 345-348 (2015).
- Bai, Y. -. B., et al. Antifungal activity of griseofulvin derivatives against phytopathogenic fungi In vitro and In vivo and three-dimensional quantitative structure-activity relationship analysis. Journal of Agricultural and Food Chemistry. 67 (22), 6125-6132 (2019).
- Solanki, M. K., et al. Characterization of antagonistic-potential of two Bacillus strains and their biocontrol activity against Rhizoctonia solani in tomato. Journal of Basic Microbiology. 55 (1), 82-90 (2015).
- Jamali, H., Sharma, A., Srivastava, A. K. Biocontrol potential of Bacillus subtilis RH5 against sheath blight of rice caused by Rhizoctonia solani. Journal of Basic Microbiology. 60 (3), 268-280 (2020).
- Válková, H., Novotný, &. #. 2. 6. 8. ;., Malachová, K., Šlosarčíková, P., Fojtík, J. Effect of bacteria on the degradation ability of Pleurotus ostreatus. Science of The Total Environment. 584-585, 1114-1120 (2017).
- Leyva-Rojas, J. A., Coy-Barrera, E., Hampp, R. Interaction with soil bacteria affects the growth and amino acid content of Piriformospora indica. Molecules. 25 (3), 572 (2020).
- Dullah, S., et al. Fungal interactions induce changes in hyphal morphology and enzyme production. Mycology. 12 (4), 279-295 (2021).
- Marfetán, J. A., Romero, A. I., Folgarait, P. J. Pathogenic interaction between Escovopsis weberi and Leucoagaricus sp.: mechanisms involved and virulence levels. Fungal Ecology. 17, 52-61 (2015).
- Cortois, R., De Deyn, G. B. The curse of the black box. Plant and Soil. 350 (1), 27-33 (2012).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (7101), 368-373 (2006).
- Sackmann, E. K., Fulton, A. L., Beebe, D. J. The present and future role of microfluidics in biomedical research. Nature. 507 (7491), 181-189 (2014).
- Hanson, K. L., et al. Fungi use efficient algorithms for the exploration of microfluidic networks. Small. 2 (10), 1212-1220 (2006).
- Held, M., Edwards, C., Nicolau, D. V. Probing the growth dynamics of Neurospora crassa with microfluidic structures. Fungal Biology. 115 (6), 493-505 (2011).
- Thomson, D. D., et al. Contact-induced apical asymmetry drives the thigmotropic responses of Candida albicans hyphae. Cellular Microbiology. 17 (3), 342-354 (2015).
- Lee, K. K., Labiscsak, L., Ahn, C. H., Hong, C. I. Spiral-based microfluidic device for long-term time course imaging of Neurospora crassa with single nucleus resolution. Fungal Genetics and Biology. 94, 11-14 (2016).
- Asenova, E., Lin, H. Y., Fu, E., Nicolau, D. V., Nicolau, D. V. Optimal fungal space searching algorithms. IEEE Transactions on NanoBioscience. 15 (7), 613-618 (2016).
- Soufan, R., et al. Pore-scale monitoring of the effect of microarchitecture on fungal growth in a two-dimensional soil-like micromodel. Frontiers in Environmental Science. 6, (2018).
- Uehling, J. K., et al. Microfluidics and metabolomics reveal symbiotic bacterial-fungal interactions between Mortierella elongata and Burkholderia include metabolite exchange. Frontiers in Microbiology. 10, 2163 (2019).
- Millet, L. J., et al. Increasing access to microfluidics for studying fungi and other branched biological structures. Fungal Biology and Biotechnology. 6 (8), 1-14 (2019).
- Baranger, C., Fayeulle, A., Le Goff, A. Microfluidic monitoring of the growth of individual hyphae in confined environments. Royal Society Open Science. 7 (8), 191535 (2020).
- Aleklett, K., Ohlsson, P., Bengtsson, M., Hammer, E. C. Fungal foraging behaviour and hyphal space exploration in micro-structured Soil Chips. The ISME Journal. 15 (6), 1782-1793 (2021).
- Aleklett, K., et al. Build your own soil: exploring microfluidics to create microbial habitat structures. The ISME Journal. 12 (2), 312-319 (2018).
- Ellett, F., Jorgensen, J., Frydman, G. H., Jones, C. N., Irimia, D. Neutrophil interactions stimulate evasive hyphal branching by Aspergillus fumigatus. PLOS Pathogens. 13 (1), 1006154 (2017).
- Massalha, H., Korenblum, E., Malitsky, S., Shapiro, O. H., Aharoni, A. Live imaging of root-bacteria interactions in a microfluidics setup. Proceedings of the National Academy of Sciences of the United States of America. 114 (17), 4549-4554 (2017).
- Schmieder, S. S., et al. Bidirectional propagation of signals and nutrients in fungal networks via specialized hyphae. Current Biology. 29 (2), 217-228 (2019).
- Tayyrov, A., Stanley, C. E., Azevedo, S., Künzler, M. Combining microfluidics and RNA-sequencing to assess the inducible defensome of a mushroom against nematodes. BMC Genomics. 20 (1), 243 (2019).
- Stanley, C. E., Grossmann, G., Casadevall i Solvas, X., deMello, A. J. Soil-on-a-Chip: microfluidic platforms for environmental organismal studies. Lab on a Chip. 16 (2), 228-241 (2016).
- Stanley, C. E., vander Heijden, M. G. A. Microbiome-on-a-Chip: new frontiers in plant-microbiota research. Trends in Microbiology. 25 (8), 610-613 (2017).
- Ortseifen, V., Viefhues, M., Wobbe, L., Grünberger, A. Microfluidics for biotechnology: bridging gaps to foster microfluidic applications. Frontiers in Bioengineering & Biotechnology. 8, 589074 (2020).
- Jansson, J. K., Hofmockel, K. S. The soil microbiome-from metagenomics to metaphenomics. Current Opinion in Microbiology. 43, 162-168 (2018).
- Stanley, C. E., et al. Probing bacterial-fungal interactions at the single cell level. Integrative Biology (Camb). 6 (10), 935-945 (2014).
- Gimeno, A., et al. A versatile microfluidic platform measures hyphal interactions between Fusarium graminearum and Clonostachys rosea in real-time. Communications Biology. 4 (1), 262 (2021).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Analytical Chemistry. 70 (23), 4974-4984 (1998).
- Stanley, C. E., et al. Fabrication and use of the dual-flow-RootChip for the imaging of Arabidopsis roots in asymmetric microenvironments. Bio-protocol. 8 (18), 3010 (2018).
- Choi, C. -. H., Lee, H., Weitz, D. A. Rapid patterning of PDMS microfluidic device wettability using syringe-vacuum-induced segmented flow in nonplanar geometry. ACS Applied Materials & Interfaces. 10 (4), 3170-3174 (2018).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. (63), e3064 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Harting, R., et al. Pseudomonas strains induce transcriptional and morphological changes and reduce root colonization of Verticillium spp. Frontiers in Microbiology. 12, 652468 (2021).
- Boenisch, M. J. . Structural and molecular characterisation of the penetration process of Fusarium graminearum during Fusarium head blight infection. , (2013).
- Eynck, C., Koopmann, B., Grunewaldt-Stoecker, G., Karlovsky, P., von Tiedemann, A. Differential interactions of Verticillium longisporum and V. dahliae with Brassica napus detected with molecular and histological techniques. European Journal of Plant Pathology. 118 (3), 259-274 (2007).
- Ghanem, N., Stanley, C. E., Harms, H., Chatzinotas, A., Wick, L. Y. Mycelial effects on phage retention during transport in a microfluidic platform. Environmental Science & Technology. 53 (20), 11755-11763 (2019).
- Alrifaiy, A., Lindahl, O. A., Ramser, K. Polymer-based microfluidic devices for pharmacy, biology and tissue engineering. Polymers. 4 (3), 1349-1398 (2012).
- Duncombe, T. A., Tentori, A. M., Herr, A. E. Microfluidics: reframing biological enquiry. Nature Reviews Molecular Cell Biology. 16 (9), 554-567 (2015).
- Hoelzle, D., et al. Microfluidic device design, fabrication, and testing protocols. Protocol Exchange. , (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados