Method Article
Reacciones catalíticas en nanopartículas de platino estabilizadas con aminas y libres de ligandos apoyadas en titania durante la hidrogenación de alquenos y aldehídos
En este artículo
Resumen
Este protocolo muestra un método conveniente para comparar las propiedades catalíticas de los catalizadores de platino soportados, sintetizados por deposición de coloides de tamaño nanométrico o por impregnación. La hidrogenación del ciclohexeno sirve como una reacción modelo para determinar la actividad catalítica de los catalizadores.
Resumen
Los ligandos como las aminas se utilizan en el enfoque de síntesis coloidal para proteger las nanopartículas de platino (Pt NP) de la aglomeración. Normalmente, los ligandos como las aminas se eliminan mediante diversos procedimientos de pretratamiento antes de su uso en catálisis heterogénea, ya que las aminas se consideran un veneno catalizador. Sin embargo, a menudo se descuida una posible influencia beneficiosa de estos modificadores de superficie en las reacciones de hidrogenación, que se conoce de las especies espectadoras en superficies metálicas.
Por lo tanto, se utilizaron nanopartículas de Pt estabilizadas con aminas soportadas por titania (P25) sin ningún tratamiento previo para dilucidar una posible influencia del ligando en las reacciones de hidrogenación en fase líquida. La actividad catalítica de nanopartículas de Pt estabilizadas con aminas de dos tamaños diferentes se investigó en un reactor de tanque de agitación de doble pared a 69 °C a 130 °C y 1 atm de presión de hidrógeno. La conversión de ciclohexeno a ciclohexano se determinó por cromatografía de gases (GC) y se comparó con partículas de Pt libres de ligando. Todos los catalizadores se verificaron antes y después de la reacción mediante espectroscopia electrónica de transmisión (TEM) y espectroscopia de fotoelectrones de rayos X (XPS) para detectar posibles cambios en el tamaño, la forma y la capa del ligando. La hidrogenación del ciclohexeno en fase líquida reveló una mayor conversión para las nanopartículas de Pt estabilizadas con aminas en titania que las partículas libres de ligando. La hidrogenación de 5-metilfurfural (5-MF) se eligió para una reacción de prueba adicional, ya que la hidrogenación de aldehídos α, β insaturados es más compleja y exhibe varias vías de reacción. Sin embargo, XPS y espectroscopia infrarroja (IR) demostraron que 5-MF actúa como veneno catalizador en las condiciones de reacción dadas.
Introducción
Los catalizadores en el tamaño de unos pocos átomos individuales hasta nanopartículas más grandes con altas relaciones superficie-volumen y tamaños definidos son materiales prometedores para una amplia gama de reacciones catalizadas heterogéneas, como la hidrogenación, la deshidrogenación y las reacciones fotocatalíticas1. Las nanopartículas de platino son ampliamente utilizadas en procesos industriales, debido a la alta actividad para la hidrogenación de olefinas. Además, las nanopartículas de platino son catalizadores prometedores para la hidrogenación selectiva de cetonas α,β-insaturadas y aldehídos 1,2,3,4. Aquí, varios parámetros como el tamaño, la forma y el soporte pueden afectar las propiedades catalíticas 1,5,6.
El tamaño influye en la morfología de las nanopartículas, especialmente en el rango de 1 a 5 nm7. Específicamente, el tamaño influye en los sitios de adsorción disponibles (por ejemplo: bordes, escalones o terrazas) y, por lo tanto, en la superficie catalíticamente activa, lo que influye aún más en la actividad catalítica 7,8,9. Además, el soporte es capaz de interactuar con el metal. Estas interacciones varían y van desde procesos de transferencia de carga o derrame hasta un cambio en la morfología o encapsulación de nanopartículas 6,10. Si bien el efecto del tamaño, la forma y el soporte sobre las propiedades catalíticas es bien conocido, un posible efecto de los adsorbatos no directamente involucrados en la reacción, las llamadas moléculas espectadoras o modificadores de superficie, está menos evolucionado 1,5,6,11. En el caso de un enfoque coloidal para la preparación del catalizador, utilizando nanopartículas metálicas coloidales que posteriormente se depositan sobre el soporte, los ligandos estabilizan las nanopartículas y, por lo tanto, pueden influir potencialmente en la reacción.
La gran ventaja de la síntesis coloidal es que las nanopartículas de cierto tamaño y forma pueden ser producidas de una manera específica ayudando a controlar el rendimiento catalítico a través de la ruta de síntesis12,13,14. La función del ligando es controlar el tamaño, la forma y la morfología de las nanopartículas. Sin embargo, los ligandos similares a las aminas a menudo se consideran veneno catalizador, ya que los ligandos bloquean los sitios de adsorción disponibles15,16. Por lo tanto, para aumentar la actividad catalítica de los catalizadores, los ligandos se eliminan comúnmente mediante tratamiento previo, por ejemplo, calcinación o descomposición inducida por luz UV17,18.
Esto contrasta con la catálisis homogénea, donde los ligandos son esenciales para estabilizar los complejos de metales de transición y ajustar su reactividad15,19. La interacción entre ligando y reactivo permite controlar la quimioselectividad, regioselectividad y estereoselectividad de la reacción catalizada homogéneamente. Dado que la separación de catalizadores homogéneos de los productos no es trivial, los catalizadores heterogéneos son más comunes, aunque son menos selectivos y surge la pregunta de si los ligandos también tienen un efecto positivo en la catálisis heterogénea.
Un enfoque prometedor para los ligandos en catálisis heterogénea es el uso de monocapas autoensamblables que contienen tioles aromáticos y alifáticos para mejorar la selectividad para la hidrogenación de aldehídos α,β-insaturados y ácidos grasos poliinsaturados en nanopartículas de Pt y Pd. La mejora de la selectividad se basa en varios efectos. Las interacciones específicas entre el reactivo y el modificador, el bloqueo selectivo de ciertos sitios activos no deseados, así como los efectos estéricos y electrónicos juegan un papel en la mejora de la selectividad20,21,22,23. Se hace una distinción entre ligandos y espectadores. Los espectadores no participan, pero influyen en la reacción por efectos estéricos, mientras que los ligandos están involucrados en las reacciones24,25. Un espectador puede formarse durante una reacción catalítica o por procesos químicos previos11,26.
La elección de un ligando y disolvente adecuados para una hidrogenación en fase líquida exitosa es una tarea desafiante. El disolvente debe tener una alta solubilidad tanto para el hidrógeno como para el reactivo. Además, no debe haber reacciones posteriores o secundarias con el disolvente, lo que puede reducir la selectividad de la reacción. Un ligando apropiado debe tener una fuerte adsorción en los sitios de adsorción seleccionados para evitar la desorción del ligando en condiciones de reacción, pero la actividad catalítica todavía está presente. Idealmente, el ligando bloquea los sitios de adsorción, que favorecen las reacciones secundarias o dirigen la selectividad de la reacción por las demandas estéricas del ligando y por las interacciones con el reactivo15,21.
Este trabajo aclara si los efectos estéricos y electrónicos de la dodecilamina (DDA) influyen en la hidrogenación del ciclohexeno y el 5-metilfurfural (5-MF) o no. El DDA no interactúa directamente con los reactivos, lo que implica una hidrogenación dirigida por el espectador. El 5-MF, un derivado no tóxico del furfural, se utilizó como un reactivo más complejo y comercialmente interesante, en comparación con la hidrogenación del ciclohexeno. La hidrogenación selectiva del furfural, un producto secundario de la producción de biopetróleo, y los derivados del furfural son de interés industrial, ya que estos compuestos pueden obtenerse de la biomasa y representan componentes de partida prometedores para la producción de varios productos químicos finos27,28.
Sin embargo, la hidrogenación selectiva es un desafío, ya que la hidrogenación de los dobles enlaces de carbono y el grupo carbonilo están compitiendo. Termodinámicamente, la hidrogenación de los dobles enlaces de carbono se ve favorecida contra la hidrogenación del grupo carbonilo29.
Protocolo
1. Síntesis de nanopartículas Pt/DDA (1,6 nm)
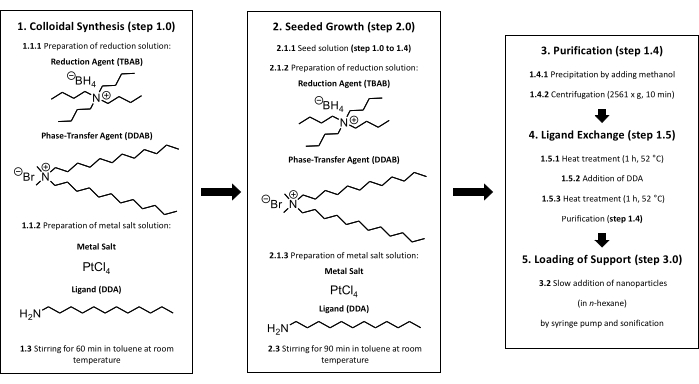
Figura 1: Síntesis coloidal de nanopartículas de Pt soportadas. Al principio, se debe realizar una síntesis coloidal (paso 1). Después de añadir la solución reductora a la solución salina metálica, la solución se agita a temperatura ambiente durante 60 min (paso 1.3). A partir de aquí, dos formas diferentes son posibles. Para obtener nanopartículas más grandes, se necesita un crecimiento sembrado (paso 2). Después de añadir la sal metálica y la solución reductora a la solución de semillas, la solución se agita a temperatura ambiente durante 90 min (paso 2.3). Después de terminar la síntesis (paso 1 o paso 2), se debe realizar una purificación (paso 1.4). Para evitar impurezas como los haluros en la superficie, es necesario un intercambio de ligandos (paso 1.5). Las nanopartículas de Pt se calientan durante 60 min a 52 °C en tolueno, se añade una cantidad adicional de DDA a la solución y la solución se calienta durante otros 60 min a 52 °C (pasos 1.5.1 a 1.5.3). Titania se puede cargar con nanopartículas realizando el paso 3. El tamaño de partícula es verificado por TEM después de la purificación, el intercambio de ligandos y la carga del soporte. Haga clic aquí para ver una versión más grande de esta figura.
NOTA: El enfoque de síntesis coloidal se muestra en la Figura 1 y los pasos experimentales se describen en la siguiente sección.
- Preparar soluciones para la síntesis de nanopartículas
- Para la preparación de la solución de reducción, disolver 25,4 mg del agente reductor borohidruro de tetrabutilamonio (TBAB) y 46,3 mg del agente de transferencia de fase didodecildimetilamonio bromuro (DDAB) en 1 ml de tolueno a temperatura ambiente en un vidrio laminado de 10 ml.
PRECAUCIÓN: TBAB puede conducir a la cauterización al contacto con la piel. DDAB conduce a la cauterización al contacto con la piel y es perjudicial para la inhalación. El tolueno es ligeramente inflamable y puede dañar el sistema nervioso central y los órganos. La DDA puede provocar cauterización al contacto con la piel y puede causar daño a los órganos si se ingiere o si ingresa a las vías respiratorias. Por lo tanto, realice la síntesis debajo de la campana extractora y use guantes y gafas. - Para la preparación de la solución salina metálica, disolver 8,5 mg del precursor cloruro de platino (IV) (PtCl 4) en 2,5 ml de tolueno a temperatura ambiente en un vaso de borde laminado de 10 ml al principio y añadir 185,4 mg del ligando dodecilamina (DDA) después de la disolución de PtCl4. Evite la descomposición de los productos químicos higroscópicos mediante el almacenamiento fuera del recipiente de almacenamiento y disuelva directamente los productos químicos en un disolvente. Use solo productos químicos frescos.
PRECAUCIÓN: El DDA es muy tóxico para la vida acuática. PtCl4 puede conducir a la cauterización al contacto con la piel y es tóxico si se ingiere. Por lo tanto, realice la síntesis debajo de la campana extractora y use guantes y gafas. Mantener alejado de posibles fuentes de ignición. Evite la liberación al medio ambiente. TBAB puede conducir a la cauterización al contacto con la piel. DDAB conduce a la cauterización al contacto con la piel y es perjudicial para la inhalación. - Sonicar ambas soluciones a temperatura ambiente durante 1-2 min en un baño ultrasónico a una frecuencia de 35 kHz. PtCl4 es escasamente soluble en tolueno. La solución salina metálica aparece ligeramente amarilla después de la sonificación, mientras que la solución de reducción sigue siendo incolora.
- Para la preparación de la solución de reducción, disolver 25,4 mg del agente reductor borohidruro de tetrabutilamonio (TBAB) y 46,3 mg del agente de transferencia de fase didodecildimetilamonio bromuro (DDAB) en 1 ml de tolueno a temperatura ambiente en un vidrio laminado de 10 ml.
- Inicio de la reacción
- Añadir la solución salina metálica completa (1 ml) con una pipeta accionada por inmersión (1.000 μL) con una punta desechable en un matraz de cuello redondo de 10 ml.
NOTA: Los fenómenos de mezcla pueden influir en el crecimiento de las partículas. - Agregue el volumen completo (1 ml) de la solución reductora a la solución de sal metálica mediante inyección de choque para obtener una distribución de tamaño estrecha. Utilice una pipeta accionada por inmersión (1.000 μL) con una punta desechable mientras agita la solución durante la adición con una barra agitadora magnética.
- Añadir la solución salina metálica completa (1 ml) con una pipeta accionada por inmersión (1.000 μL) con una punta desechable en un matraz de cuello redondo de 10 ml.
- Deje que la solución de reacción se agite durante 60 minutos en condiciones ambientales.
NOTA: El inicio de la reacción se puede reconocer por burbujas de gas y un cambio de color de la mezcla de reacción de amarillo a gris oscuro. La reducción del precursor de Pt y el crecimiento de nanopartículas de Pt son procesos rápidos14. La solución se agita durante 60 minutos para garantizar que se complete el proceso de crecimiento de las nanopartículas de Pt. - Purificación de la solución de nanopartículas
- Purificar las nanopartículas de Pt por precipitación y centrifugación a temperatura ambiente. Para ello, transfiera la solución de reacción completa con una pipeta accionada por inmersión (1.000 μL) con una punta desechable, a un tubo de centrífuga de 80 ml y agregue 14 ml de metanol.
PRECAUCIÓN: El metanol es altamente inflamable y tóxico si se ingiere o inhala y entra en contacto con la piel. Mantener alejado de posibles fuentes de ignición. Agregue el metanol a la solución de reacción debajo de una campana extractora mientras usa guantes y gafas. - Centrifugar a 2.561 x g durante 10 min a temperatura ambiente. Deseche la solución después de la centrifugación.
- Resuelva el residuo de nanopartículas añadiendo 3 ml de tolueno con una pipeta accionada por inmersión con una punta desechable (1.000 μL). Las nanopartículas deben estar en el rango de tamaño de 1,3 nm a 2 nm después de esta rutina de síntesis14.
- Transfiera la solución de nanopartículas del paso 1.4.3 a un vidrio de borde laminado (10 ml) para su uso posterior.
- Purificar las nanopartículas de Pt por precipitación y centrifugación a temperatura ambiente. Para ello, transfiera la solución de reacción completa con una pipeta accionada por inmersión (1.000 μL) con una punta desechable, a un tubo de centrífuga de 80 ml y agregue 14 ml de metanol.
- Realice un intercambio de ligandos para eliminar residuos de síntesis como cloruro o bromuro como se describe a continuación.
- Transfiera 3 ml de las nanopartículas de Pt purificadas en tolueno a un matraz de cuello redondo de 100 ml y llénelo con tolueno hasta un volumen final de 50 ml. Caliente la solución a 52 °C y mantenga la temperatura durante 60 minutos mientras agita la solución con una barra agitadora magnética.
- Disolver 185,4 mg de DDA en 2,5 ml de tolueno en un vidrio de borde laminado de 10 ml a temperatura ambiente y añadir esta solución con una pipeta accionada por inmersión (1.000 μL) con una punta desechable a la solución de Pt/DDA (1,5 nm) tratada térmicamente a 52 °C.
- Calentar y agitar la solución durante otros 60 minutos a 52 °C. Realice una purificación como se describió anteriormente en el paso 1.4, pero disuelva las nanopartículas de Pt en 3 ml de n-hexano en lugar de 3 ml de tolueno.
PRECAUCIÓN: El n-hexano es un líquido y vapor altamente inflamable. El n-hexano causa irritación de la piel y puede causar daño a los órganos si se inhala. El n-hexano es tóxico para la vida acuática y se sospecha que daña la fertilidad. Por lo tanto, realice la síntesis debajo de la campana extractora y use guantes y gafas. Mantener alejado de posibles fuentes de ignición. Evite la liberación al medio ambiente.
NOTA: Utilice n-hexano para ayudar a la evaporación del disolvente (consulte el siguiente paso). - Evapore el disolvente en el armario de humos durante la noche a temperatura ambiente y presión ambiente y pese las nanopartículas de Pt al día siguiente.
NOTA: El pesaje de las nanopartículas de Pt es crucial para determinar la cantidad de titania, que es necesaria para una carga de soporte definida (consulte el paso 3).
2. Síntesis de nanopartículas de Pt más grandes (Pt/DDA (2,4 nm)) mediante un proceso de crecimiento mediado por semillas
- Preparar las soluciones para la síntesis de nanopartículas.
- Disolver las nanopartículas de Pt/DDA (1,6 nm) previamente fabricadas en 50 ml de tolueno en un matraz de cuello redondo de 100 ml a temperatura ambiente.
- Prepare la solución de reducción disolviendo 370,5 mg de DDAB y 200,5 mg de TBAB en 10 ml de tolueno a temperatura ambiente en un vidrio laminado de 20 ml por separado.
- Disuelva 68,0 mg de PtCl4 en 10 ml de tolueno en un vidrio de borde laminado de 20 ml y agregue 1438,1 mg de DDA posteriormente. Use esto como una solución de sal metálica. Evite la descomposición de los productos químicos higroscópicos mediante el almacenamiento fuera del recipiente de almacenamiento y disuelva directamente los productos químicos en un disolvente.
- Sonicar ambas soluciones hechas en los pasos 2.1.2 y 2.1.3 a temperatura ambiente durante 1-2 min en el baño ultrasónico a una frecuencia ultrasónica de 35 kHz.
- Extraiga ambas soluciones cada una en una jeringa desechable de 20 ml con una aguja y, si es necesario, retire el aire de la jeringa.
- Para iniciar la reacción, añadir las soluciones adicionales de precursor y reducción de los pasos 2.1.2 y 2.1.3 muy lenta y continuamente utilizando una bomba de jeringa (0,1 ml/min) a la solución de semilla del paso 2.1.1 para evitar la formación de nanocables o una segunda nucleación14. Revuelva la solución de semilla a temperatura ambiente usando una barra de agitación magnética mientras agrega el precursor y la solución reductora.
- Revuelva la solución de nanopartículas durante otros 90 minutos a temperatura ambiente después de la adición de los reactivos. Realizar una purificación como se describe en el paso 1.4 pero disolver las nanopartículas de Pt en 3 mL de n-hexano en lugar de 3 mL de tolueno. Evaporar el disolvente durante la noche a temperatura ambiente y presión ambiente y pesar las nanopartículas de Pt al día siguiente.
3. Deposición de nanopartículas de Pt sobre titania (Pt/DDA/P25)
- Dispersar P25 en n-hexano (2 mg/ml) a temperatura ambiente en un vaso de precipitados de tamaño adecuado mediante un baño ultrasónico a una frecuencia ultrasónica de 35 kHz.
NOTA: La cantidad de óxido depende del peso de las nanopartículas fabricadas secas. - Preparar una solución de nanopartículas de las partículas previamente fabricadas (1 mg/ml en n-hexano) y añadir esta solución al P25 disperso a temperatura ambiente utilizando una jeringa desechable (20 ml) con aguja a un caudal de 0,016 ml/min utilizando una bomba de jeringa.
NOTA: La adsorción de nanopartículas en el óxido se hace visible por un cambio de color de la solución de gris a incoloro. - Seque el polvo cargado en condiciones ambientales durante la noche en el armario de humos y posteriormente durante 10 minutos al vacío (0,01 mbar).
4. Síntesis de nanopartículas de Pt soportadas por titania libre de aminas por impregnación
- Llene 1,000 mg de titania (P25) en un plato de cristalización (50 mL) y agregue agua hasta que P25 esté cubierto.
- Disolver 3 g de ácido cloroplatínico hexahidratado (H2PtCl 6 ·6 H2O) en 20 ml de agua destilada y añadir la solución acuosa al P25 presentado con una pipeta volumétrica de 20 ml.
PRECAUCIÓN: El ácido cloroplatínico hexahidratado puede provocar cauterización cuando entra en contacto con la piel y es tóxico si se ingiere. Por lo tanto, realice la síntesis debajo de la campana extractora y use guantes y gafas.
NOTA: La cantidad de ácido cloroplatínico varía dependiendo de las cargas de nanopartículas deseadas del soporte oxidódico. - Calentar y mantener la solución a 75 °C agitando con una barra magnética durante 4 h hasta que la solución sea viscosa. Secar la solución en la fuente de cristalización durante 1 d a 130 °C en un horno en condiciones atmosféricas.
- Realizar una calcinación en un horno con temperatura programada en condiciones atmosféricas. Llenar el polvo del paso 4.3 en un crisol de porcelana. Calentar hasta 400 °C en 30 min y mantener la temperatura durante 4 h. Enfríe la muestra a temperatura ambiente sin usar una rampa de temperatura.
- Realizar una reducción del catalizador en un horno tubular. Calentar a 180 °C con una rampa de temperatura de 4 °C/min y mantener la temperatura durante 1,5 h bajo un flujo continuo de hidrógeno. Compruebe si hay un flujo continuo de hidrógeno con un contador de burbujas.
5. Hidrogenaciones en fase líquida
- Preparar el reactor de doble pared para las mediciones catalíticas.
- Llene la camisa calefactora con el medio calefactor deseado. Utilice éter diisopropílico para una temperatura de funcionamiento de 69 °C en el reactor.
NOTA: En los archivos suplementarios figura una lista de otros medios calefactores usados (véase el cuadro suplementario S1). - Llene el reactor de tanque agitado con 120 ml de tolueno y el catalizador sintetizado (1 mg / ml). Desgasifica el reactor del tanque de agitación aplicando un vacío de alrededor de 360 mbar.
- Elimine el oxígeno purgando. Coloque un globo de goma, lleno de hidrógeno de 1 atm, encima del condensador de reflujo y enjuague el reactor del tanque de agitación con hidrógeno. Repita el proceso de purga cinco veces.
- Comience a calentar y agitar el tanque del reactor con una barra de agitación magnética bajo atmósfera de hidrógeno.
- Llene la camisa calefactora con el medio calefactor deseado. Utilice éter diisopropílico para una temperatura de funcionamiento de 69 °C en el reactor.
- Iniciar la reacción catalítica
NOTA: Antes de realizar un ensayo catalítico, se comprobó la posible hidrogenación del disolvente en las condiciones de reacción, pero no fue así (véanse la figura suplementaria S1 y el cuadro suplementario S2). El cromatograma de gases de la figura suplementaria S1 muestra picos adicionales, que pueden atribuirse a las contaminaciones en el tolueno, ya que también están presentes en una muestra de tolueno tomada del recipiente de almacenamiento (véanse la figura suplementaria S2 y la tabla suplementaria S3).- Inyecte el reactivo, en este caso, 1 ml de ciclohexeno, con una jeringa desechable con una aguja a través del tabique de goma con una estabilidad térmica y disolvente específica después de alcanzar una temperatura constante. Tome 1 ml de muestras con una jeringa desechable cada 10 minutos.
- Utilice un filtro de jeringa (tamaño de poro: 0,2 μm) para separar el catalizador de la solución de reacción y llene el líquido en un vial de muestreador automático que se selle correctamente después.
NOTA: En lugar de un filtro de jeringa, también es posible la centrifugación para eliminar el catalizador.
PRECAUCIÓN: El ciclohexeno es un líquido y vapor altamente inflamable. El ciclohexeno es dañino si se ingiere y tóxico cuando entra en contacto con la piel. Por lo tanto, realice la síntesis debajo de la campana extractora y use guantes y gafas. - Pruebe el efecto de envenenamiento del 5-metilfurfural. Preparar el reactor del tanque de agitación como se describe en el paso 5.1.
NOTA: 5-MF no muestra ninguna conversión en los catalizadores de Pt soportados (ver Tabla Suplementaria S4 y Figura Suplementaria S3). Si se produce un efecto de envenenamiento, se puede verificar agregando 5-MF a la reacción de hidrogenación del ciclohexeno. - Para probar el efecto de envenenamiento de 5-MF en las nanopartículas de Pt, proceda de la siguiente manera: primero, inyecte 5-MF (5 mmol) al catalizador presentado en tolueno y deje que la mezcla se agite durante 120 minutos.
- Añadir ciclohexeno con una jeringa desechable en una proporción molar de 1:1 y 1:10 a 5-MF. Para determinar el proceso de reacción, tome muestras de 1 ml con una jeringa desechable con una aguja cada 10 minutos.
- Utilice un filtro de jeringa (tamaño de poro: 0,2 μm) para separar el catalizador de la solución de reacción y llene el líquido en un vial de muestreador automático que se selle correctamente después.
NOTA: En lugar de un filtro de jeringa, también se podría hacer una centrifugación para eliminar el catalizador.
- Analizar los productos por GC. Utilice una columna con las siguientes especificaciones: longitud = 50 m, película = dimetilpolisiloxano, espesor de la película = 0,5 μm, diámetro interior = 0,2 mm. Aplique una temperatura del inyector de 200 °C con una relación dividida de 40:1.
- Comience con una temperatura de columna de 40 ° C y mantenga la temperatura durante 6 min. Calentar de 40 °C a 180 °C con una rampa de temperatura de 15 °C/min. Medir con un caudal de hidrógeno de 0,6 mL/min y una temperatura de 300 °C para el detector FID.
- Inyecte las muestras en el GC. Asigne los picos a las diferentes sustancias comparándolas con las normas de referencia (véanse el cuadro suplementario S5 y la figura suplementaria S4).
- Evaluar los cromatogramas de gases utilizando el método del 100%. Calcule la cantidad porcentual de cada compuesto dividiendo el área pico medida para este compuesto por la suma de todas las áreas de pico.
6. Preparación para mediciones TEM
- Cargue las muestras en una rejilla de cobre de malla 300 recubierta con formvar y carbón.
- Para cargar la rejilla con nanopartículas de Pt desnudas, extraer 0,1 ml de la solución purificada de nanopartículas de Pt en n-hexano y diluir la solución extraída añadiendo 2 ml de n-hexano en un vidrio de borde laminado (10 ml). Transfiera 8,5 μL de la solución diluida a la rejilla con una pipeta accionada por inmersión (10 μL) con una punta desechable y deje secar la rejilla durante la noche a temperatura ambiente a presión ambiente.
- Para cargar la rejilla con polvos, sumerja la rejilla con mucho cuidado en el polvo para evitar que la rejilla se dañe y elimine el exceso de polvo por una corriente de aire creada por una pipeta Pasteur (longitud: 145 mm, diámetro interior: 1,5 mm) con una bola de pipeta (diámetro: 94 mm).
- Coloque la rejilla en un portamuestras de cartucho TEM. Introduzca el portamuestras en la columna TEM. Siga el procedimiento operativo estándar para manejar el microscopio electrónico de transmisión.
- Tome fotografías a un voltaje de aceleración de 80 keV con un aumento de 250.000 e importe las imágenes a un software de edición de imágenes.
- Determine la silueta de nanopartículas por el umbral de contraste de las imágenes, para el análisis de las imágenes con el software de edición de imágenes. El software de análisis de imágenes asume un contorno esférico de las partículas.
- Elimine las partículas superpuestas y las partículas que se encuentran en los bordes de la imagen, que pueden falsificar la distribución del tamaño de partícula, borrando estas partículas con las herramientas de dibujo integradas del software. Para identificar partículas superpuestas, compare la imagen procesada (paso 6.4) con la imagen original.
- Utilice las herramientas de software integradas para el análisis del tamaño de partícula. Mida el tamaño de las nanopartículas de Pt soportadas manualmente con las herramientas integradas del software. Analice manualmente las nanopartículas de Pt soportadas, ya que la baja diferencia de contraste entre las nanopartículas y el soporte no permite un análisis automático por parte del software.
7. Mediciones XPS de muestras sintetizadas
- Prepare una oblea de silicio para las mediciones XPS de nanopartículas desnudas sumergiendo la oblea en un vidrio de borde enrollado (10 ml) lleno de acetona y sonicar la oblea durante 1 minuto a una frecuencia de 35 kHz. Repita el procedimiento con 2-propanol.
- Cubra el fragmento de oblea de silicio limpio y seco con una solución concentrada de nanopartículas de Pt purificadas en n-hexano mediante fundición por gota con una micropipeta. Seque la oblea durante la noche a temperatura ambiente y presión ambiente bajo una campana extractora. Fije la muestra al portamuestras utilizando cinta adhesiva.
NOTA: No se determinó el tamaño de la gota, ni se colocó ningún tamaño de gota específico en las obleas. El volumen de la solución extraído en la micropipeta se seleccionó para que la gota no se desbordara. La humectación uniforme de las obleas o de los gránulos KBr (ver paso 8.3) es difícil debido a los efectos de secado del disolvente. - Prepare un soporte de muestra de hueso para polvos sumergiendo el soporte de muestra en un vidrio de borde laminado (10 ml) con acetona y sonicar el soporte de muestra durante 1 minuto a una frecuencia ultrasónica de 35 kHz. Repita el procedimiento con 2-propanol.
- Llene la muestra en el hoyo del portamuestras limpio y secado. Coloque una película transparente limpia entre el sello y la muestra para evitar contaminaciones y presione la muestra con el sello.
- Para identificar un posible efecto de envenenamiento por 5-MF después de la hidrogenación, prepare una película de Pt cubierta con 5-MF como muestra de referencia.
- Limpie una parte de la oblea de silicio sumergiendo la oblea en un vidrio de borde enrollado (10 ml) con acetona y sonicar la oblea durante 1 minuto (frecuencia ultrasónica: 35 kHz). Repita el procedimiento con 2-propanol. Cubra la oblea de silicio limpia con una película de Pt de 10 nm utilizando un sistema de pulverización catódica de Pt asistido por argón. Para operar el sistema de pulverización catódica sigue los procedimientos estándar proporcionados en el manual del usuario.
- Disuelva 1 mmol de 5-MF en 2,5 ml de tolueno en un vaso de borde enrollado (10 ml). Mojar la película de Pt con 5-MF mediante fundición por gota con una micropipeta y secar la muestra durante la noche a temperatura ambiente y presión ambiente bajo una campana extractora.
- Introduzca la muestra en la cámara de análisis XPS. Comience la medición utilizando los siguientes parámetros: fuente de radiación: Al E(Kα) = 1486.8 eV (monocromática), tamaño del punto: 650 μm, energía de paso: 40 eV, tiempo de permanencia: 100 ms, tamaño del paso de energía: 0.05 eV, número de escaneos: 10 para espectros detallados de Pt4f y N1s; 5 para los espectros detallados de C1 y O1, compensación de carga por arma de inundación Ar.
- Después de terminar las mediciones, cargue los espectros en un software con herramientas integradas para aplicar un fondo y ajustar las diferentes señales. Ajuste las señales con un fondo de Shirley y curvas gaussianas-lorentzianas con una relación de Gauss Lorentz de 30. Agregue un relaves a las curvas gaussianas-lorentzianas para señales metálicas de platino. Haga referencia a todas las señales medidas a la señal C1s adventicia medida a 284,8 eV para compensar los efectos de carga30.
8. Mediciones FT-IR
- Preparar nanopartículas Pt/DDA (1,6 nm) y Pt/5-MF para las mediciones FT-IR. Para la síntesis de nanopartículas Pt/5-MF realizar una síntesis con intercambio de ligandos con 5-MF en lugar de DDA (pasos 1.0 a 1.5.3). Para la purificación de las nanopartículas Pt/5-MF después del intercambio de ligandos, utilice n-hexano en lugar de metanol para la precipitación de las nanopartículas de Pt. Resolver las nanopartículas de Pt purificadas en 1 mL de metanol.
- Preparar pellets de bromuro de potasio (KBr) de aproximadamente 1 mm de espesor utilizando una prensa hidráulica. Pestle KBr, que se almacenó en condiciones libres de agua, antes de llenar la prensa. Presione los pellets con una presión de 10 bar durante 15 min.
- Cubra los gránulos KBr mediante fundición por gota con la solución de las nanopartículas de Pt purificadas varias veces mediante el uso de una micropipeta. Deje que el pellet se seque entre cada gota para evitar que el líquido gotee sobre los bordes del pellet. Secar el pellet KBr a temperatura ambiente y presión ambiente durante 2 h bajo una campana extractora.
- Realice las mediciones FT-IR.
- Para medir un fondo, coloque un pellet KBr sin recubrimiento en el soporte de muestra IR. Utilice una resolución de 1 cm-1 y un tiempo de medición de 60 min.
- Coloque un pellet KBr cargado en el portamuestras y utilice los mismos parámetros descritos en el paso 8.4.1.
- Utilice las herramientas de software integradas para restar los espectros de fondo de los espectros de muestra y realizar una corrección manual de línea base.
- Utilice un programa de química cuántica ab initio para los cálculos de frecuencia de modos vibracionales. Realice los cálculos utilizando el funcional de densidad PBE0 y el conjunto básico 6-311G*. Utilice los cálculos teóricos como una guía aproximada para la asignación de bandas de absorción.
Resultados
Aquí se presentan los resultados de la síntesis y las pruebas catalíticas de diferentes nanopartículas de Pt. En primer lugar, las nanopartículas de Pt sintetizadas, así como las partículas soportadas en P25 se caracterizaron por TEM por su forma y tamaño. Además, su composición química, por ejemplo, los estados de oxidación de los diferentes elementos y su entorno químico fue investigada por XPS. Posteriormente, se verificó el rendimiento catalítico de las nanopartículas de Pt soportadas para la hidrogenación de alquenos, aquí se utilizó ciclohexeno y aldehídos como el 5-MF. Como la hidrogenación de aldehídos no muestra ninguna conversión bajo las condiciones de reacción utilizadas, se realizaron estudios sistemáticos adicionales para dilucidar una posible intoxicación superficial de las nanopartículas de Pt.
Caracterización de los catalizadores
El tamaño y la forma de las nanopartículas de Pt, así como las partículas soportadas en P25, fueron comprobados por TEM, ya que el tamaño y la forma de las partículas pueden influir en la actividad catalítica31. Las imágenes TEM en la Figura 2 revelan que las nanopartículas de Pt exhiben una forma cuasi-esférica directamente después de la síntesis coloidal (Figura 2A). El tamaño y la forma siguen siendo los mismos después del intercambio de ligandos con DDA (Figura 2B). Sin embargo, las partículas más grandes (Figura 2C), sintetizadas por el crecimiento de cristales, tienen una forma más asimétrica y muestran formas parcialmente trípodas y elipsoidales. Después de la deposición de Pt/DDA (1,6 nm) en titania (Figura 2B) no se produjo ningún cambio en el tamaño y la forma (Figura 2D). El tamaño y la forma del catalizador de platino libre de amina Pt/P25 (2,1 nm), sintetizado por impregnación (Figura 2E) está en el mismo rango en comparación con las nanopartículas de platino, sintetizadas por la síntesis coloidal.
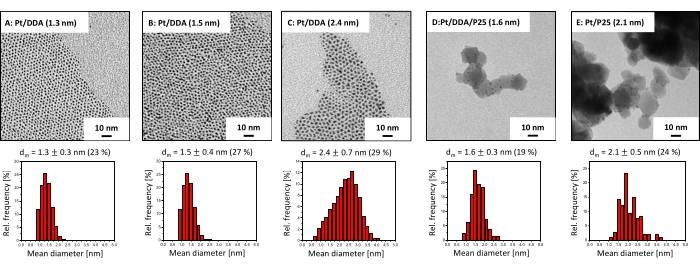
Figura 2: Imágenes TEM e histogramas de tamaño de nanopartículas de platino estabilizadas con aminas y catalizadores de platino soportados por titania. Se muestran las imágenes TEM (en la parte superior) y los histogramas de tamaño (en la parte inferior) de (A) sintetizado (Pt/DDA (1,3 nm)), (B) después del intercambio de ligandos con DDA (Pt/DDA (1,5 nm)), (C) después del crecimiento sembrado (Pt/DDA (2,4 nm)), (D) después de la deposición en titania (Pt/DDA/P25 (1,6 nm)), y (E) nanopartículas de platino libres de amina soportadas en titania (Pt/P25 (2,1 nm)). Las imágenes TEM se grabaron utilizando un voltaje de aceleración de 80 eV. Haga clic aquí para ver una versión más grande de esta figura.
XPS se utilizó para obtener información química sobre las especies de adsorbato de superficie. Se caracterizaron las nanopartículas de Pt antes y después del intercambio de ligandos, así como las nanopartículas de Pt después de la deposición en titania y las nanopartículas de Pt libres de aminas. Los espectros de XP se muestran en la Figura 3. El espectro Pt4f de las nanopartículas Pt/DDA (1,3 nm) se discutirá primero (Figura 3, espectro superior). El espectro Pt4f muestra dos señales a 71.5 eV y 74.8 eV debido a la división espín-órbita, que tienen una relación de área específica de 4: 3. La señal Pt4f7/2 a 71,5 eV se puede asignar a nanopartículas Pt (1,3 nm) y se desplaza hacia arriba en 0,4 eV en comparación con 71,1 eV para Pt32 a granel. Sin embargo, la energía de enlace medida concuerda bien con las nanopartículas Pt/DDA (1,3 nm) en una película de oro33. La diferencia en la energía de enlace entre el Pt a granel y las nanopartículas pequeñas de Pt/DDA puede explicarse por un efecto de tamaño.
Ligeros cambios de la señal Pt en 0,2 eV después del intercambio de ligandos sin cambio en el tamaño de las partículas de platino se encuentra dentro de la precisión de medición de la energía de enlace. Si bien no se puede observar ninguna diferencia después de la deposición en titania, los espectros de XP de Pt / P25 (2.1 nm) sintetizados por el método de impregnación muestran un desplazamiento descendente del pico Pt4f 7/2 en 0.6 eV en comparación con Pt / DDA / P25 (1.6 nm) y un cambio descendente de0.2 eV en comparación con Pt32 a granel. Se observan especies adicionales a energías de enlace más altas, que pueden atribuirse a las especies oxidadas Pt2+ y Pt4+ 34. El pico Pt4f 5/2 de Pt 0 y el pico Pt4f7/2 de Pt4+ tienen una energía de enlace similar con74.2 eV y 75.0 eV y, por lo tanto, se superponen entre sí.
En la región C1s, surgen tres señales entre 289.0 eV y 284.0 eV en todos los espectros mostrados. Todos los espectros de XP están referenciados al carbono adventicio a 284.8 eV30. La asignación de las señales a diferentes especies de carbono es difícil. Se espera que el carbono alfa de la amina surja a 285.4 eV y 285.6 eV35,36. Sin embargo, la señal puede cambiar debido a los efectos de carga, de modo que la señal se puede superponer con átomos de carbono en las proximidades al oxígeno. Las señales entre 286.3 eV y 289.0 eV pueden asignarse al carbono unido al oxígeno37. Posiblemente, una contaminación con dióxido de carbono o una reacción superficial sometida de los ligandos conduce a la formación de ambas especies de carbono38.
El espectro detallado N1s de las nanopartículas pequeñas de Pt preparadas (Figura 3, espectro superior) exhibe tres especies diferentes de nitrógeno a 402.6 eV, 399.9 eV y 398.2 eV. La señal a 402.6 eV puede asignarse a un compuesto de amonio 39, mientras que la señal a399.9 eV corresponde al ligando de amina adsorbida33. La presencia de bromuro (Br3d5/2 a 68.2 eV) en los espectros Pt4f y las especies de amonio en los espectros detallados N1s se deben al uso de DDAB como agente de transferencia de fase. Sin embargo, una formación por humedad o autooxidación de la amina no puede ser excluida aquí35. La especie adicional a 398.2 eV se desplaza a energías de enlace más bajas en comparación con la señal de amina y posiblemente aparece de acuerdo con una interacción amina-superficie. Varias especies, por ejemplo oligómeros y amidas han sido asignadas a esa señal35,40. Además, las aminas pueden sufrir reacciones de desprotonación en superficies de Pt(111), lo que puede ser la razón de la especie adicional41,42. Al realizar un intercambio de ligandos, el compuesto de amonio se puede eliminar, mientras que las especies adicionales de superficie de amina todavía están presentes en la superficie de platino. Curiosamente, la señal de amina muestra casi la misma energía de enlace observada para las nanopartículas de Pt antes del intercambio de ligandos, mientras que las especies adicionales se desplazan en 0,3 eV para reducir las energías de enlace después de la deposición en titania. La posición de las especies adicionales de amina superficial puede explicarse por una interacción más fuerte con la superficie que puede ocurrir en dos escenarios. Por un lado, la amina podría estar todavía presente después de la deposición en P25, pero no en contacto directo con la superficie de Pt. Por otro lado, el soporte ya reveló una señal en esta posición en el espectro de detalle N1s, que puede estar relacionada con impurezas (ver Figura Suplementaria S5). Lo más probable es que se deriven de la producción de P25 o del procedimiento de limpieza utilizado en la industria43, aunque no se puede excluir completamente una contaminación por residuos en la cámara de análisis del espectrómetro o de la atmósfera. Esto también explica la presencia de amina para el Pt/P25 libre de ligando (2,1 nm).
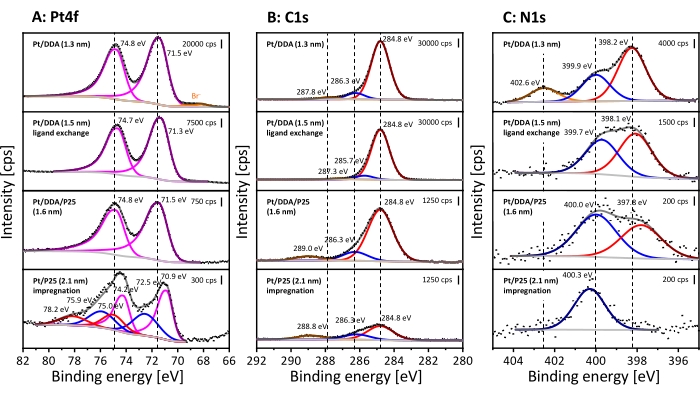
Figura 3: Análisis XPS de nanopartículas coloidales de Pt/DDA y catalizadores soportados por titania. Se muestran los espectros detallados Pt4f (A), los espectros detallados C1s (B) y los espectros detallados N1s (C). Los espectros de XP apilados representan Pt/DDA (1,3 nm) antes del intercambio de ligandos (mostrado en la parte superior), Pt/DDA (1,5 nm) después del intercambio de ligandos (abajo), Pt/DDA/P25 (1,6 nm) después de la deposición en titania y Pt/P25 (2,1 nm) sintetizados por impregnación (mostrados en la parte inferior). Las líneas punteadas muestran la intensidad medida, las líneas grises claras muestran el fondo restado y las líneas grises oscuras muestran la suma de todas las especies ajustadas. Las líneas de colores muestran la única especie ajustada. Los espectros detallados de Pt4f revelan especies metálicas Pt4f7/2 y Pt4f5/2 (magenta) y Pt2+ (azul) y Pt4+ (rojo) oxidadas. Las líneas naranjas muestran la presencia de bromuro (Br-3d 5/2 y Br-3d 3/2). Tres especies diferentes de carbono están presentes en los espectros detallados C1s, que son de color rojo, azul y naranja. Sin embargo, una asignación a especies individuales es difícil. Los espectros detallados de N1 revelan amonio (naranja), amina (azul) y una especie adicional de superficie de amina (rojo). Los espectros se midieron con la fuente de radiación Al Kα (monocromática) (energía de paso: 40 eV, tamaño del paso de energía: 0,05 eV y número de escaneos: 10) y se hizo referencia a la señal alifática C1s a 284,8 eV30. Haga clic aquí para ver una versión más grande de esta figura.
Ensayos catalíticos
Después de la caracterización con TEM y XPS, el rendimiento de hidrogenación de las nanopartículas de Pt soportadas por titania se probó considerando la hidrogenación de ciclohexeno como la reacción modelo. La comparación con nanopartículas sintetizadas por impregnación debe dilucidar una posible influencia de los ligandos sobre la hidrogenación. Para eso, la reacción se llevó a cabo en un reactor de tanque de agitación de doble pared bajo atmósfera de hidrógeno. El tolueno, que se utilizó como disolvente, no se hidrogenó en condiciones de reacción (véase la figura suplementaria S1). La Figura 4 muestra la conversión de ciclohexeno dependiendo del tiempo de reacción para Pt/DDA/P25 antes (1,3 nm) y después del intercambio de ligandos (1,6 nm), para partículas más grandes Pt/DDA/P25 (2,4 nm) y Pt/P25 libres de aminas (2,1 nm).
El catalizador Pt/DDA/P25 sintetizado (1,3 nm) sin procedimiento de intercambio de ligandos (paso 1,5) exhibe una conversión de ciclohexeno de hasta el 56% después de un tiempo de reacción de 60 min, mientras que las partículas de Pt/DDA (1,6 nm) en las que se realizó un intercambio de ligandos, convierten el ciclohexeno hasta un 72% después del mismo tiempo de reacción. Las partículas libres de ligando muestran una conversión notablemente menor del 35% en comparación con las partículas estabilizadas con aminas en las mismas condiciones. Este resultado es muy prometedor ya que el catalizador libre de aminas no exhibe ningún ligando, lo que podría bloquear parcialmente la superficie de platino a excepción del disolvente adsorbido. Las diferentes actividades de los catalizadores se discutirán más adelante. Además, también se probaron nanopartículas Pt/DDA estabilizadas con aminas más grandes (2,4 nm) en ttania, sintetizadas por crecimiento decristales 14 y se compararon con partículas más pequeñas de Pt/DDA en titania (1,6 nm) con idéntica carga de peso (0,1 % en peso). La conversión de ciclohexeno sobre las partículas más pequeñas de Pt/DDA (1,6 nm) en un 72% es ligeramente mejor que la conversión sobre las partículas más grandes de Pt/DDA (2,4 nm) en un 67%. Aquí, no se pudo observar un efecto de tamaño significativo para la hidrogenación del ciclohexeno sobre las nanopartículas de Pt estabilizadas con aminas (1,6 nm y 2,4 nm). Este resultado está de acuerdo con los resultados de la literatura para la hidrogenación de ciclohexeno sobre nanopartículas de Pt libres de ligandos de diferentes tamaños, indicando que la hidrogenación del ciclohexeno no depende del tamaño44. Dado que las pequeñas partículas de Pt en titania (1,6 nm) mostraron los mejores resultados, estas partículas se tuvieron en cuenta para experimentos posteriores.
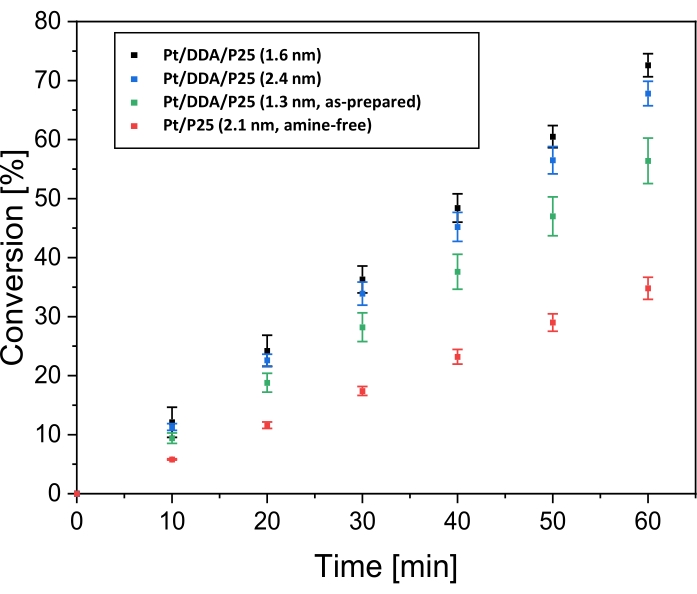
Figura 4: Conversión en el tiempo para la hidrogenación de ciclohexeno sobre catalizadores de platino soportados por titania. Se muestran las gráficas de conversión a lo largo del tiempo para la hidrogenación de ciclohexeno a 69 °C y 1 bar de presión de hidrógeno en tolueno sobre Pt/DDA/P25 (1,6 nm; puntos negros), sobre Pt/DDA/P25 (2,4 nm; puntos azules), sobre Pt/DDA/P25 sintetizado (1,3 nm; puntos verdes) y Pt/P25 libre de aminas (2,1 nm; puntos rojos). La hidrogenación se llevó a cabo en un reactor de tanque de agitación de doble pared. Las barras de error representan el error estándar calculado. Cada serie de mediciones se llevó a cabo tres veces. Haga clic aquí para ver una versión más grande de esta figura.
La hidrogenación exitosa del ciclohexeno muestra que la solubilidad del hidrógeno en tolueno es suficiente en las condiciones de reacción para el examen de hidrogenaciones en fase líquida.
Después de probar la actividad catalítica de los catalizadores de Pt para la hidrogenación del ciclohexeno, también se investigó la hidrogenación de 5-MF, ya que el 5-MF es un derivado del furfural, que se puede obtener de la biomasa y es un material de partida prometedor para la producción de varios productos químicos finos27. Las nanopartículas de Pt estabilizadas y libres de aminas se probaron en un rango de temperatura de reacción de 70 °C a 130 °C. Además del tolueno, el 2-propanol también se utilizó como disolvente. Además, la hidrogenación se realizó en condiciones libres de disolventes. Sin embargo, no se ha observado ninguna conversión para ninguno de los catalizadores en estas condiciones.
Comprobación de la inhibición del sustrato
Como no se observó ninguna conversión de 5-MF en fase líquida en el cromatograma de gases (ver Figura Suplementaria S3), se realizaron investigaciones adicionales sobre la influencia de 5-MF en la conversión de ciclohexeno. Estos experimentos se realizaron para revelar si 5-MF o una especie superficial de 5-MF, así como posibles productos de reacción, actúan como veneno catalizador en estas condiciones. Anteriormente, Pt/DDA/P25 (1,6 nm) exhibía la conversión más alta, por lo que este catalizador se utilizó en esta reacción. La conversión de ciclohexeno con una cantidad creciente de 5-MF dependiendo del tiempo de reacción se presenta en la Figura 5.
Como ya se mostró en el capítulo anterior, la conversión de ciclohexeno fue del 72% después de un tiempo de reacción de 60 min y en ausencia de 5-MF. Después de agregar la misma cantidad de 5-MF, la tasa de conversión de ciclohexeno disminuye al 30%. Una mayor cantidad de 5-MF en la relación de 10: 1 con respecto al ciclohexeno conduce a una disminución adicional en la conversión, hasta el 21%. Como conclusión, un bloqueo de los sitios de superficie activos por 5-MF se vuelve más probable. Esto correspondería a una inhibición de las nanopartículas de Pt soportadas por titania por el reactivo. Sin embargo, la hidrogenación todavía es posible con un exceso de 5-MF.
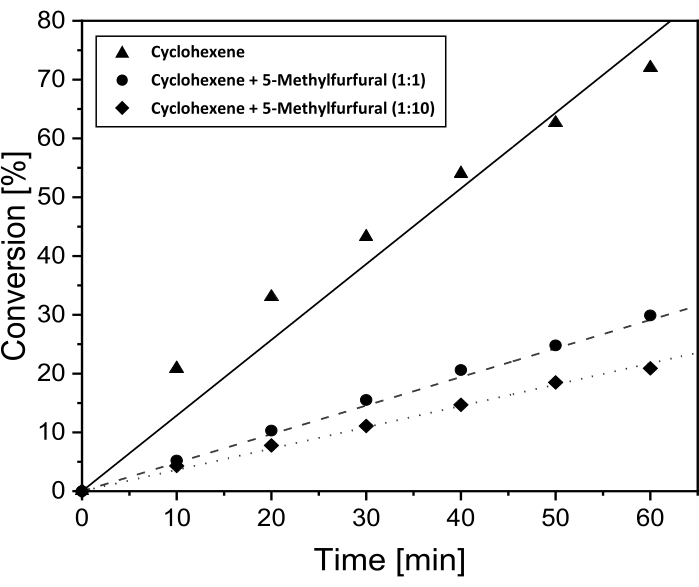
Figura 5: Conversión a lo largo del tiempo para la hidrogenación de ciclohexeno con adición de 5-MF para la prueba de los efectos de envenenamiento. Gráficos de conversión a lo largo del tiempo para la hidrogenación de ciclohexeno sobre Pt/DDA/P25 (1,6 nm) sin adición de 5-MF (línea continua) y con adición de 5-MF en la relación de volumen de 1:1 (línea discontinua) y 1:10 (línea punteada) al ciclohexeno. La hidrogenación se realizó a 69 °C y 1 bar de presión de hidrógeno en tolueno utilizando un reactor de tanque de agitación de doble pared. Haga clic aquí para ver una versión más grande de esta figura.
Para demostrarlo, el catalizador fue analizado por TEM y XPS antes y después de la reacción, como se describió anteriormente. Dado que las imágenes TEM no revelan ningún cambio, sólo los espectros XP se discutirán a continuación (para las imágenes TEM ver Figura Suplementaria S6). Los espectros de XP medidos se muestran en la Figura 6. Los espectros se compararán con 5-MF adsorbidos en una película de Pt para distinguir entre una intoxicación por 5-MF o una especie de reacción.
Aquí solo se resumen las cosas más importantes, ya que los espectros XP del catalizador antes del uso se discutieron anteriormente. El espectro detallado de Pt4f revela dos señales que aparecen a 74.8 eV (Pt4f 5/2) y a 71.5 eV (Pt4f7/2). Ambos pueden ser asignados a las nanopartículas de Pt. Como se mencionó anteriormente, la asignación de las especies en el espectro C1s puede ser difícil debido a los efectos de carga, que pueden conducir a señales superpuestas del carbono alfa y los átomos de carbono en las proximidades del oxígeno. Sin embargo, los cambios estructurales en la capa del ligando, por ejemplo, un reemplazo de DDA, deberían conducir a cambios en las intensidades relativas entre las señales. Además, la región N1s también muestra dos señales correspondientes a aminas (400.0 eV) y otras especies de superficie (397.8 eV).
Después de la reacción, se pueden observar muchos cambios en XPS, aunque TEM no revela ningún cambio en la forma y el tamaño de las partículas. Las señales de Pt se desplazan en 0,6 eV para reducir las energías de enlace después de la hidrogenación. El espectro detallado C1s revela las mismas tres señales que ya se discutieron. Sin embargo, la señal a 289.0 eV cambia en 0.7 eV a energías de enlace más bajas en contraste con el catalizador no utilizado. Todos los espectros están referenciados a la señal a 284.8 eV. Se debe tener en cuenta que la relación entre el carbono adventicio y las especies de energía de enlace más alta cambia de 1: 0.2: 0.1 a 1: 0.4: 0.3 después de la hidrogenación. Por lo tanto, la cantidad relativa de átomos de carbono en las proximidades al oxígeno aumenta, lo que indica que el 5-metilfurfural puede adsorber en la superficie del platino.
Si bien no se ve ningún cambio en los espectros detallados de N1s, la cantidad de nitrógeno disminuye después del uso. Sobre la base de las señales C1s, N1s y Pt4f se determinó la relación nitrógeno/carbono y nitrógeno/platino. La relación carbono/nitrógeno aumenta de 13:1 a 27:1, mientras que la relación nitrógeno/platino muestra una disminución de un factor similar de 1,2:1 a 0,6:1 después de la hidrogenación. Esto puede ser causado por un intercambio parcial del DDA con 5-MF e indica además un bloqueo de la superficie por 5-MF.
El desplazamiento descendente de las señales de Pt después de la reacción puede explicarse por una densidad de carga creciente en las nanopartículas de Pt. Posiblemente, las interacciones metal-soporte pueden ocurrir bajo condiciones de reacción, lo que puede conducir a un cambio descendente por una transferencia de electrones desde el soporte hacia el metal45,46,47. Otra posibilidad es que el 5-MF adsorbido podría causar un cambio descendente debido a un efecto donante. Sin embargo, la película Pt cubierta con 5-MF muestra el comportamiento opuesto en la señal Pt 4f. Aquí, las señales se desplazan en 0,8 eV a energías de enlace más altas en comparación con el Pt / DDA / P25 sintetizado (1.6 nm). La adsorción de hidrógeno en platino también puede conducir a cambios en la energía de enlace de la señal Pt4f, como ya se ha demostrado para una superficie Pt(111) mediante mediciones XPS de presión ambiente48. El desplazamiento para el monocristal es de 0,4 eV. Aquí, se observa un cambio descendente de 0,7 eV. Una posible explicación es que las partículas son más sensibles que el material a granel a los cambios electrónicos y toda la partícula puede estar completamente saturada con hidrógeno. El cambio de las especies de carbono de 289.0 eV a 288.3 eV después de la exposición a 5-MF indica la presencia de una nueva especie de carbono que contiene un enlace carbono-oxígeno. Dado que la película Pt cubierta por 5-MF muestra la misma especie, esta señal puede atribuirse al grupo aldehído de 5-MF. Sin embargo, la especie a 286.3 eV antes y después del uso del catalizador se desplaza hacia arriba en 0.5 eV en comparación con las especies de carbono a 285.8 eV del 5-MF en una película de Pt. Los efectos de carga, así como el grosor de la película de 5-MF pueden conducir a un cambio en la energía de enlace, por lo que, como ya se mencionó, una discusión de esta especie es difícil.
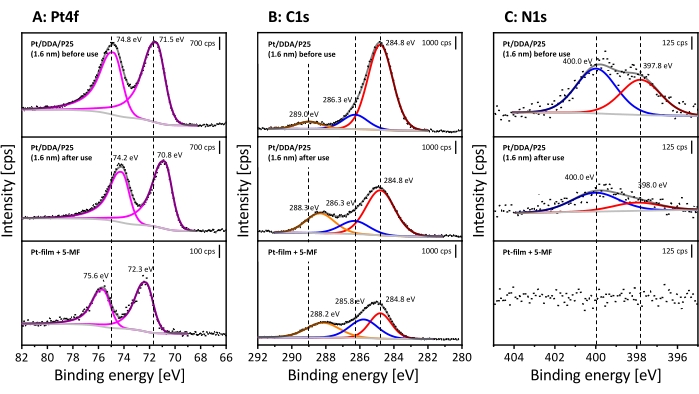
Figura 6: Prueba de envenenamiento superficial después de la hidrogenación de 5-MF en fase líquida utilizando XPS. Se muestran los espectros detallados de la señal Pt4f (A), la señal C1s (B) y la señal N1s (C). Los espectros XP apilados representan Pt/DDA/P25 (1,6 nm) antes de su uso (en la parte superior) y después de la hidrogenación de 5-MF puro (en el medio). A modo de comparación, una película de Pt cubierta con 5-MF se muestra en la parte inferior. Todos los espectros se midieron con una fuente de radiación Al Kα (monocromática) (energía de paso: 40 eV, tamaño de paso de energía: 0,05 eV y número de escaneos: 10). Todos los espectros están referenciados en la señal alifática C1s a 284.8 eV30. Haga clic aquí para ver una versión más grande de esta figura.
Para obtener más información sobre el efecto de envenenamiento y distinguir entre un envenenamiento por 5-MF y posibles especies de superficie, se realizó espectroscopia infrarroja por transformada de Fourier (FT-IR). Aquí, los espectros FT-IR de nanopartículas de Pt antes y después de agregar 5-MF al catalizador se compararon con DDA puro y 5-MF como referencia. Para asignar las bandas emergentes se realizó una comparación con cálculos teóricos y experimentos de la literatura. Los espectros FT-IR medidos en la región de 3500 cm-1 a 700 cm-1 se muestran en la Figura 7. Todas las bandas observadas se enumeran adicionalmente con una asignación a un modo de vibración en el cuadro suplementario S6 y el cuadro suplementario S7.
La región entre 2.500 cm-1 y 1.300 cm-1 no se consideró, ya que numerosas bandas de absorción de agua y dióxido de carbono de la atmósfera fuertemente superpuestas obstruyen esta región. Desafortunadamente, esta región también exhibe algunas bandas de absorción analíticamente útiles, como la banda de vibración de valencia carbonilo de un aldehído aromático, que se espera que surja entre 1715 cm-1 y 1695 cm-1 49,50. En primer lugar, se discutirán las bandas específicas y su asignación a las vibraciones moleculares correspondientes de DDA y 5-MF. Posteriormente, estos espectros se compararán con los espectros FT-IR medidos de las nanopartículas de Pt antes y después de ponerse en contacto con 5-MF. El ligando DDA muestra bandas fuertes en el rango de 2.851 cm-1 a 2.954 cm-1 que pueden asignarse a las vibraciones de estiramiento simétricas y asimétricas de los grupos metilo y metileno. La banda intensa y aguda a 3331 cm-1 resulta de la vibración de estiramiento N-H del grupo amina49,51. Esta banda se puede tomar para monitorear la situación de unión de DDA en la superficie de Pt. En números de onda más bajos, surgen muchas bandas. Sin embargo, una asignación a vibraciones moleculares específicas es complicada debido a la interferencia de diferentes vibraciones para formar vibraciones combinatorias y de marco. La comparación con la literatura 49,50,51 y los cálculos teóricos sugieren que las bandas de absorción en la región de 1.158 cm-1 a 1,120 cm-1 resultan de vibraciones del marco. La banda a 1.063 cm-1, así como la banda a 790 cm-1 se pueden asignar al grupo amina. A 1.063 cm-1 surge la vibración de estiramiento C-N, mientras que las bandas a 790 cm-1 corresponden a una combinación de modos de movimiento y torsión del grupo amina. Además, la vibración oscilante del CH2 conduce a una banda de absorción característica a 720 cm-149. Desafortunadamente, no hay más asignación posible para varias bandas entre 1.090 cm-1 y 837 cm-1. Estas bandas pueden ser el resultado de vibraciones combinatorias del marco C-C. Sin embargo, tales vibraciones no son muy sensibles a los cambios ambientales, por ejemplo, las vibraciones del grupo amina y, por lo tanto, pueden descuidarse.
5-MF muestra bandas a 3.124 cm-1 y 2.994 cm-1, que son causadas por las vibraciones de estiramiento C-H del anillo. La banda a 2.933 cm-1 se correlaciona con la vibración de estiramiento C-H del grupo metilo52. Otras bandas surgen entre 1.211 cm-1 y 800 cm-1. Las vibraciones combinatorias del anillo aromático con el grupo metilo y la vibración en el plano C-H conducen a bandas de absorción a 1.023 cm-1 y 947 cm-1, mientras que la banda a 800 cm-1 se asigna a la vibración C-H fuera del plano 52,53. Las bandas de 1.151 cm-1 y 929 cm-1 también fueron observadas en la literatura para furfural, pero no fueron asignadas a ningún modo vibratorio54.
Las investigaciones sobre las nanopartículas Pt/DDA revelan que la vibración de estiramiento N-H desaparece, mientras que las vibraciones de estiramiento C-H de la cadena alquilo no se ven afectadas. La desaparición de esta banda puede explicarse por la regla de selección de superficie metálica, según la cual no se pueden observar vibraciones paralelas a la superficie. Alternativamente, esto también puede sugerir una ruptura del enlace N-H después de la adsorción en la superficie, lo que explicaría la segunda especie en XPS a energías de enlace ligeramente más bajas que la amina libre. Otra posibilidad es que la banda se vuelva potencialmente más débil debido a las restricciones del sitio de adsorción y, por lo tanto, no se detecte debido a una mala relación señal-ruido. Del mismo modo, tampoco se pueden observar las bandas más débiles en la región de la huella digital.
Después del intercambio de ligandos de las nanopartículas Pt/DDA con 5-MF en condiciones de reacción, la región del número de onda por encima de 2.500 cm-1 puede exhibir dos bandas muy débiles a 2.924 cm-1 y 2.851 cm-1, que coincidirían con los modos de vibración de DDA. Las bandas adicionales correspondientes a 5-MF surgen a 1.101 cm-1, 1.053 cm-1, 1.022 cm-1, 955 cm-1, 819 cm-1 y 798 cm-1. La diferencia significativa entre los espectros antes y después de la adición de 5-MF refuerza aún más las conclusiones anteriores de un intercambio de DDA con 5-MF. Las disminuciones de intensidad de las bandas de absorción previamente fuertes de 5-MF, así como los fuertes cambios de las vibraciones que involucran la vibración C-H en el plano del anillo (3,124 cm-1, 2,994 cm-1, 1,023 cm-1 y 947 cm-1) pueden explicarse por una geometría de adsorción del anillo aromático casi paralela a la superficie y las reglas de selección de superficie metálica relacionadas.
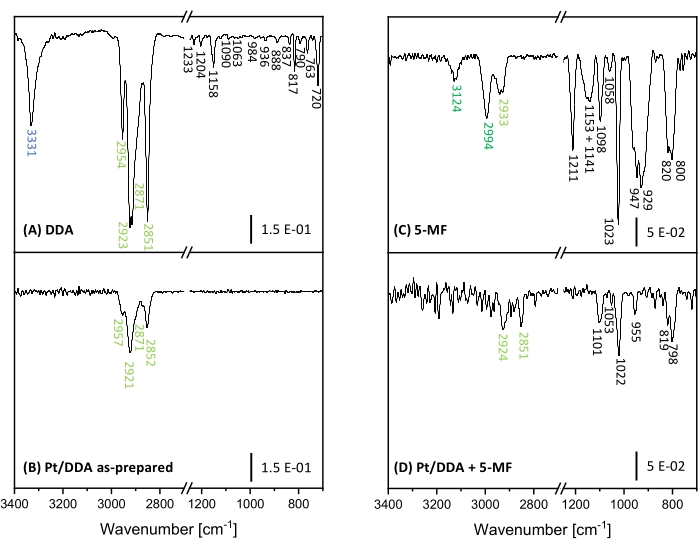
Figura 7: Espectros FT-IR de nanopartículas Pt y referencias para la prueba de envenenamiento. Se muestran los espectros FT-IR de las nanopartículas DDA (A) y Pt/DDA (1,3 nm) (B) en el lado izquierdo. Las nanopartículas puras de 5-MF (C) y Pt/DDA, que se manipularon en condiciones de reacción con 5-MF (D) puras, se muestran en el lado derecho. Haga clic aquí para ver una versión más grande de esta figura.
Cuadro complementario S1: Medios de calentamiento para reacciones de hidrogenación. Se enumeran los puntos de ebullición de diferentes medios de calentamiento. El éter diisopropílico se utilizó para la hidrogenación del ciclohexeno. Dado que 5-MF no mostró ninguna conversión a 69 °C, se probaron medios de calentamiento con puntos de ebullición más altos. Haga clic aquí para descargar esta tabla.
Figura suplementaria S1: Cromatograma de gases del ensayo de hidrogenación de tolueno. El cromatograma de gases muestra tolueno, que se manipuló en condiciones de reacción bajo hidrógeno de 1 atm a 69 °C con Pt/DDA/P25 (1,6 nm) como catalizador. Esta prueba examinó una posible hidrogenación del tolueno. Se tomó una muestra después de 60 min. No se pudo observar hidrogenación del disolvente en condiciones de reacción. Las contaminaciones están marcadas con * y están presentes en el tolueno (véase la figura suplementaria S2). Haga clic aquí para descargar este archivo.
Tabla complementaria S2: Tiempos de retención de tolueno y contaminaciones en el cromatograma de gases para el ensayo de hidrogenación. La muestra se tomó a 69 °C después de 60 min de tiempo de reacción con Pt/DDA/P25 (1,6 nm) como catalizador. El muestreo se realizó con una jeringa de 1 mL a través de un tabique. Las contaminaciones están marcadas con * y están presentes en el tolueno (véase la figura suplementaria S2). Haga clic aquí para descargar esta tabla.
Figura complementaria S2: Cromatograma de gases del tolueno. El cromatograma de gases muestra tolueno, que ha sido revisado para detectar posibles contaminaciones. Las contaminaciones están marcadas con * y también estaban presentes en otros cromatogramas de gases. Haga clic aquí para descargar este archivo.
Tabla suplementaria S3: Tiempos de retención de tolueno y contaminaciones en el cromatograma de gases para el tolueno. Se tomó una muestra de tolueno del contenedor de almacenamiento y se verificó si había posibles contaminaciones. Las contaminaciones están marcadas con * y están presentes en el tolueno (véase la figura suplementaria S2). Haga clic aquí para descargar esta tabla.
Figura complementaria S3: Cromatograma de gases para hidrogenación de 5-MF después de 60 min. La muestra se tomó a 69 °C después de 60 min de tiempo de reacción con Pt/DDA/P25 (1,6 nm) como catalizador. El muestreo se realizó con una jeringa de 1 mL a través de un tabique. Haga clic aquí para descargar este archivo.
Tabla suplementaria S4: Tiempos de retención de sustancias en el cromatograma de gases para la hidrogenación de 5-MF. La muestra se tomó a 69 °C después de 60 min de tiempo de reacción con Pt/DDA/P25 (1,6 nm) como catalizador. Haga clic aquí para descargar esta tabla.
Figura complementaria S4: Cromatograma de gases de posibles productos. Esta muestra contiene posibles productos y subproductos para la hidrogenación de 5-metilfurfural en tolueno. Las contaminaciones están marcadas con * y están presentes en el tolueno (véase la figura suplementaria S2). Haga clic aquí para descargar este archivo.
Tabla complementaria S5: Tiempos de retención de posibles productos. Esta tabla contiene posibles productos y subproductos para la hidrogenación de 5-metilfurfural en tolueno. Las contaminaciones están marcadas con * y están presentes en el tolueno (véase la figura suplementaria S2). Haga clic aquí para descargar esta tabla.
Figura complementaria S5: Recorte del espectro de estudio de titania (P25). Solo se muestra una parte del estudio de titania pura (P25), en la que se encuentran los picos de impurezas. Las impurezas resultan de la producción de titania o del proceso de limpieza en la industria44. El espectro se midió con la fuente de radiación Al Kα (monocromática) (energía de paso: 200 eV, tamaño del paso de energía: 1 eV y número de escaneos: 2) No se hace referencia a este espectro. Haga clic aquí para descargar este archivo.
Figura suplementaria S6: Imágenes TEM e histogramas de tamaño de nanopartículas de platino estabilizadas con aminas antes y después de la hidrogenación de 5-metilfurfural. Se muestran las imágenes TEM (en la parte superior) y los histogramas de tamaño (en la parte inferior). La imagen TEM de la izquierda muestra nanopartículas de platino (Pt/DDA/P25 (1,6 nm)) antes de la hidrogenación. La imagen TEM de la derecha muestra las nanopartículas de platino (Pt/DDA/P25 (1,6 nm)) después de la hidrogenación. Las imágenes TEM se grabaron utilizando un voltaje de aceleración de 80 eV. Haga clic aquí para descargar este archivo.
Cuadro suplementario S6: Modos vibracionales de espectros FT-IR de nanopartículas DDA y Pt/DDA. Se enumeran todas las bandas, que se observaron en ambas mediciones y se muestran en la Figura 7. Las bandas de absorción que no se pudieron asignar a ningún modo vibratorio están marcadas con un signo de guión (-). Haga clic aquí para descargar esta tabla.
Cuadro suplementario S7: Modos vibracionales de espectros FT-IR de nanopartículas 5-MF y Pt/5-MF . Se enumeran todas las bandas, que se observaron en ambas mediciones y se muestran en la Figura 7. Las bandas de absorción que no se pudieron asignar a ningún modo vibratorio están marcadas con un signo de guión (-). Haga clic aquí para descargar esta tabla.
Discusión
Las nanopartículas de Pt tapadas con DDA se sintetizaron con éxito en dos tamaños y formas diferentes12,14. Las nanopartículas pequeñas de Pt (1,6 nm) muestran una forma casi esférica, mientras que las partículas más grandes (2,4 nm) son más asimétricas exhibiendo estructuras parcialmente trípode o elipsoidales. Las posibilidades son limitadas para obtener nanopartículas de platino cuasiesféricas más grandes, ya que se produce una formación de estructuras alargadas al aumentar aún más el tamaño de las partículas por crecimiento sembrado14. El tamaño y la forma de las partículas también pueden verse influenciados por el ligando, el tiempo de reacción y la temperatura. Además del DDA, otros ligandos pueden ser utilizados en la síntesis, pero el agente tapante influye en el crecimiento y, por lo tanto, en el tamaño y la forma de las nanopartículas, como ya se ha demostrado para la síntesis de nanopartículas de oro39. Después de agregar la solución reductora a la solución de sal metálica, la solución se agita durante 60 minutos (90 minutos para la síntesis de partículas más grandes) para garantizar que se complete el proceso de crecimiento de las nanopartículas de Pt. El transporte de monómeros a la superficie de la partícula puede ser un factor limitante. Además, la temperatura puede influir en el radio crítico, que describe el tamaño mínimo de partícula requerido, en el que las semillas son estables en solución. Al aumentar la temperatura, el radio crítico disminuye, lo que resulta en una formación más rápida de semillas y, en consecuencia, una disminución más rápida de la concentración de monómeros55. Después de la síntesis, todavía se pueden observar impurezas de amonio y bromuro en XPS que pueden eliminarse realizando un intercambio de ligandos con DDA. Además, todas las nanopartículas sintetizadas se depositaron en polvos P25 sin ningún cambio en la forma, el tamaño o la pérdida del ligando. A modo de comparación, se generó un catalizador de Pt libre de ligando utilizando el método de impregnación, que exhibe un tamaño de nanopartícula de Pt de 2,1 nm y una forma casi esférica. XPS revela además que no solo las especies metálicas de Pt estaban presentes en la superficie, sino también las especies oxidadas. Esto indica que en ausencia de ligandos de amina las nanopartículas de platino interactúan con el soporte, lo que puede resultar en una encapsulación parcial del metal en el soporte10. Como consecuencia, las partículas pierden parcialmente su capacidad de dividir el hidrógeno56. Sin embargo, dicha encapsulación se ve favorecida por la reducción a alta temperatura del precursor de la sal metálica. La temperatura utilizada aquí para la reducción (180 °C) está muy por debajo de las mencionadas en la literatura para la encapsulación (600 °C)57. Otra explicación más probable sería una reducción incompleta de la fuente de Pt utilizada. Sin embargo, ambas explicaciones resultan en una desactivación parcial del catalizador.
En la literatura, ligandos como aminas o amoníaco a menudo se consideran veneno catalizador en la comprensión clásica de catálisis heterogénea15,16. Sin embargo, las investigaciones sobre la hidrogenación en fase líquida del ciclohexeno demuestran que Pt/DDA/P25 sigue siendo catalíticamente activo y mostró una conversión aún mayor en comparación con el catalizador libre de aminas. Se sabe que las aminas bloquean sistemáticamente los sitios de adsorción en terrazas en Pt(111)11,58. Los resultados en la literatura ya han demostrado que este prometedor efecto de selección de sitios activos de ligandos puede ser utilizado para mejorar la selectividad para la hidrogenación de acetileno en corrientes ricas en etileno mediante la dilución de los sitios de adsorción59. Este efecto de selección de sitio activo también se observó para la unión de tioles en Pd(111)22,23. Para la hidrogenación del ciclohexeno, estos sitios ya están bloqueados por aminas, sin embargo, todavía están disponibles centros de reacción altamente activos y poco coordinados. Además del efecto de selección de sitio del ligando, también se debe prestar atención a otras propiedades del ligando. Al seleccionar el ligando, se debe tener cuidado para asegurar que el ligando estabiliza las partículas durante la síntesis y las protege de la aglomeración. Además, el ligando debe exhibir una fuerte adsorción en la superficie metálica y una estabilidad térmica suficientemente alta para que el ligando no se desorbe o descomponga en condiciones de reacción. Los resultados muestran que, en general, el PDD parece ser adecuado para este enfoque catalítico. No se pudo observar ningún efecto de tamaño en la reacción del modelo. Curiosamente, el catalizador que contenía nanopartículas de Pt que no se sometieron a un intercambio de ligandos exhibió una conversión menor (50%) que las partículas de Pt depositadas en P25 después del intercambio de ligandos (72%). Por lo tanto, un bloqueo de sitios activos por compuestos iónicos puede tener que ser considerado bajo estas condiciones. Realizar un intercambio de ligandos es crucial para aumentar la actividad de las nanopartículas de platino mediante la eliminación de compuestos iónicos coadsorbidos como el bromuro y el amonio, como muestra XPS antes y después del intercambio de ligandos.
Además, la influencia de las especies de superficie de aminas adicionales en la actividad catalítica de las nanopartículas de platino sigue siendo ambigua, ya que esta especie puede servir potencialmente como una fuente de hidrógeno localizada adicional. Los espectros XP y FT-IR parecen indicar una abstracción de hidrógeno del grupo amina por platino que conduce a una especie de superficie amina adicional. Esto ofrece la oportunidad de servir hidrógeno adicionalmente al hidrógeno disuelto en tolueno, lo que puede afectar la actividad catalítica. Aquí se puede excluir un efecto donante de hidrógeno del tolueno, ya que no se sabe que el tolueno se deshidrogene a baja presión de hidrógeno y temperatura60. Sin embargo, la influencia de la extracción de hidrógeno en la actividad catalítica aún necesita ser investigada más a fondo. La hidrogenación de acetofenona en nanopartículas de platino modificadas con l-prolina ya ha demostrado que el grupo amina puede acelerar la hidrogenación mediante una transferencia de hidrógeno de la amina al reactivo15. Por lo tanto, se debe considerar una posible influencia de la amina y las especies de superficie en la hidrogenación.
A pesar del uso exitoso de nanopartículas Pt/DDA para la hidrogenación de alquenos simples, no se pudo observar ningún recambio para el reactivo más exigente 5-MF. Por lo tanto, se pueden discutir diferentes posibilidades para esto a continuación: una explicación sería que no se produce ninguna reacción debido a la baja temperatura de reacción y la presión del hidrógeno. La temperatura de reacción se limitó a 160 °C. Como el análisis termogravimétrico mostró que la desorción del ligando y la descomposición de nanopartículas de Pt/DDA de tamaños comparables tienen lugar a estas temperaturas13. Debido al reactor utilizado, no se podían usar presiones superiores a 1 atm de hidrógeno. La menor presión de hidrógeno en contraste con los experimentos de la literatura podría ser la razón por la cual la hidrogenación de compuestos carbonílicos, como 5-MF, no fue factible. Varios estudios han demostrado además que las interacciones de soporte metálico fuerte (SMSI) son cruciales para la selectividad de la hidrogenación en fase gaseosa del furfural61,62,63. El SMSI conduce a la formación de O-vacantes, lo que permite la adsorción de furfural a través del grupo carbonilo en la superficie de titania. Se forma un furfuril-oxi-intermedio que puede ser hidrogenado. Sin embargo, esta hipótesis es contrarrestada por el hecho de que, en contraste con los experimentos en fase gaseosa, no se pudo encontrar evidencia de una influencia de SMSI para la hidrogenación en fase líquida de furfural en metanol. Las partículas de platino en diferentes óxidos (MgO,CeO2 y Al2O3) habían mostrado propiedades catalíticas comparables64. Esto indica que la hidrogenación podría tener lugar sometiéndose a diferentes mecanismos en la fase líquida y gaseosa, lo que debe investigarse más a fondo. El efecto SMSI de las partículas de Pt y el soporte solo se observaron para el catalizador libre de ligando, que tampoco muestra ninguna conversión de 5-MF en las condiciones de reacción utilizadas. Por lo tanto, un impacto del efecto SMSI parece poco probable. Como el envenenamiento del catalizador por 5-MF o un intermediario de superficie parece más probable bajo las condiciones de reacción aplicadas, los catalizadores se analizaron más a fondo antes y después del intercambio de ligandos con 5-MF en condiciones de reacción por XPS y FT-IR. Estas mediciones confirmaron la hipótesis de envenenamiento por catalizador por 5-MF ya que ambos métodos muestran una disminución en los picos correspondientes a la amina en la superficie de Pt. La espectroscopia FT-IR sugiere además que 5-MF actúa como veneno catalítico ya que aparecen bandas en la región del número de onda por debajo de 1.200 cm-1, que son consistentes con las bandas asignadas a 5-MF. Se sugiere una geometría de adsorción casi plana teniendo en cuenta las reglas de selección de superficie. En la Figura 8 se muestra un dibujo esquemático para la reestructuración superficial propuesta.
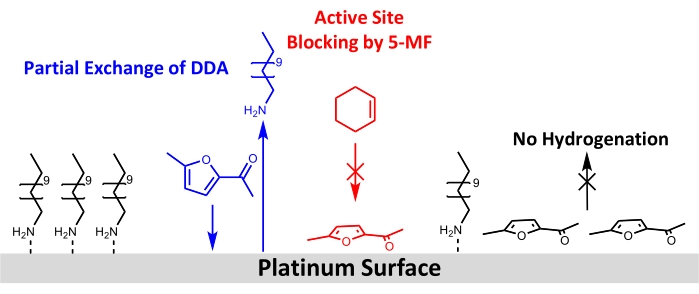
Figura 8: Dibujo esquemático de cambios estructurales mediante la adición de 5-MF a la hidrogenación de ciclohexeno en la superficie de nanopartículas de platino estabilizadas con aminas. Los resultados de FT-IR y XPS muestran un intercambio parcial de DDA por 5-MF en la superficie de platino y bloqueo de sitios activos para la hidrogenación de ciclohexeno. Los resultados de los datos de FT-IR sugieren una adsorción del anillo de 5-MF casi paralelo a la superficie. Haga clic aquí para ver una versión más grande de esta figura.
Para concluir, las nanopartículas de Pt con tapa de amina en P25 son candidatos prometedores para nuevos catalizadores de hidrogenación, ya que las nanopartículas de Pt muestran una conversión más alta que el catalizador libre de ligando en la reacción del modelo. Sin embargo, no se observó conversión de 5-MF en ninguno de los catalizadores. Esto resulta de la intoxicación del Pt por el reactivo y no por el ligando, como a menudo se considera en la literatura en las condiciones de reacción investigadas. Para futuras aplicaciones, se necesita una mayor comprensión de la influencia de los ligandos en el comportamiento de adsorción de los reactivos y su interacción con las nanopartículas metálicas. Una síntesis coloidal es un enfoque prometedor además de los métodos de impregnación y calcinación para la fabricación de catalizadores heterogéneos, ya que esto permite la síntesis de nanopartículas en tamaño y forma definidos. Dado que el enfoque de síntesis coloidal permite el uso de diferentes ligandos, por ejemplo, aminas, amidas, tioles o alcoholes, las nanopartículas de Pt con otros ligandos deben investigarse y compararse. Esto ofrece la posibilidad de utilizar ligandos, que muestran una interacción ligando-reactivo específica, como las interacciones π-π para controlar la geometría de adsorción y, por lo tanto, también la selectividad de la reacción. Este enfoque podría utilizarse para la hidrogenación selectiva de cetonas y aldehídos α,β-insaturados, como ya se ha demostrado para la hidrogenación del cinamaldehído21. Además, controlar la estereoselectividad en reacciones catalizadas heterogéneas sigue siendo una tarea difícil; Sin embargo, se podría utilizar un ligando quiral apropiado para controlar la quiralidad del producto como en reacciones catalizadas homogéneas. Además de las interacciones ligando-reactivo, el efecto estabilizador de los ligandos podría usarse para proteger las nanopartículas metálicas de la fuerte interacción de soporte metálico. La fuerte interacción de soporte metálico reduciría la quimisorción de hidrógeno por encapsulación de las partículas con una capa de óxido. Para una mejor comprensión de la influencia de los ligandos, XPS y FT-IR pueden proporcionar información útil sobre el efecto de envenenamiento selectivo y los modos de unión de los ligandos. Además, el CO se considerará como una molécula sensora para identificar los sitios superficiales disponibles de la nanopartícula Pt. Además, el comportamiento de adsorción y las posibles reacciones superficiales de ligandos y reactivos se pueden investigar en monocristales de Pt en condiciones de vacío ultra alto para obtener una comprensión fundamental de los procesos superficiales. Con todo, los ligandos en catálisis heterogénea pueden ofrecer un nuevo enfoque catalítico, que se puede utilizar para controlar la actividad y la selectividad de una reacción catalizada además del tamaño de partícula y los efectos de soporte. Por lo tanto, la forma tradicional de pensar para la catálisis heterogénea de ligandos como veneno catalizador debe ser reconsiderada.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Gracias a Edith Kieselhorst y Erhard Rhiel por el apoyo en el TEM y a Carsten Dosche por el apoyo en el XPS. Gracias a Stefan Petrasz por su apoyo con el cromatógrafo de gases. Se reconoce la financiación del dispositivo XPS por DFG (INST: 184/144-1FUGG) y la financiación de DFG-RTG 2226.
Materiales
| Name | Company | Catalog Number | Comments |
| 2-propanol | Sigma Aldrich | 59300-2.5L | puriss. p. a., ACS reagent, >99.8% |
| 4-methyl-2-pentanol | Carl Roth | 4371.2 | purity: >99%, for synthesis |
| 5-methylfurfural | Sigma Aldrich | 137316-100G | ReagentPlus, 99 % |
| acetone | Sigma Aldrich | 32201-2,5L-M | puriss. p. a., ACS reagent, >99.5% |
| cannula | B Braun | 4665643 | diameter: 0.80 mm, length: 120 mm |
| CasaXPS | Casa Software | software, version 2.3.15 | |
| centrifuge | Heraeus | model: Multifuge 1s | |
| centrifuge tube | Schott Duran | 163-9315026 | volume: 80 mL, diameter: 44 mm, length: 100 mm |
| chloroplatinic acid hexahydrate | Merck | 8073400001 | amount of platinum: 40 % |
| column | Agilent Technologies | 19091 S-001 | model: HP-PONA, film: dimethyl polysiloxane, film thickness: 0.2 µm, length: 50 m |
| CRYSTAL 17 | CRYSTAL Theoretical Chemistry Group Torino | software, version: v1.0.2 | |
| crystallizing dish | volume: 50 mL | ||
| cyclohexene | Acros Organics | 154840010 | purity: 99 % |
| desposable syringe | Henke Sass Wolff | Norm-Ject, volume: 1, 2, 5 mL | |
| didodecyldimethylammonium bromide | Acros Organics | 407120250 | purity: 99 % |
| diisopropyl ether | Carl Roth | T899.1 | purity: 98%, for synthesis |
| dodecyl amine | Sigma Aldrich | D222208-500ML | purity: 98 % |
| double walled tank reactor | processed by glass blower | Standard ground glass joint sleeves: 2 x 14/23, 1 x 19/26, 1 x 29/32, reactor volume: 150 mL, material: quartz glas, with outer heating jacket | |
| Fourier-transform infrared spectrometer | Bruker | model: Equinox 55 | |
| rubber balloon | Deutsch & Neumann | 163-7652667 | volume: 4 L, material: latex, |
| gaschromatograph | Agilent Technologies | model: 7820A | |
| HP-PONA-column | Agilent Technologies | 19091S-001 | length: 50 m, film thickness: 0.5 µm, inner diameter: 0.2 mm |
| hydrogen | Air Liquide | P0231L50R2A001 | purity: 5.0 |
| ImageJ | Wayne Rasband | software, version 1.52 | |
| methanol | Sigma Aldrich | 32213-2,5L-M | puriss. p. a., ACS reagent, >99.8% |
| n-hexane | VWR Chemicals | 24577298 | purity: 99 % |
| Opus | Bruker | software, version 5.5 | |
| pasteur pipette | Brand | 747715 | material: glass, length: 145 mm, inside diameter: 1 mm |
| pipette ball | Technikplaza | 89005517 | diameter: 94 mm, material: PVC |
| platinum(IV) chloride | Acros Organics | 195400010 | purity: 99 % |
| plunge operated pipette | LLG Lab Logistics Group | 9.280 005 | volume: 100-1000 µL |
| plunge operated pipette | LLG Lab Logistics Group | 9.280 001 | volume: 0.5-10 µL |
| potassium bromide | Carl Roth | 9252.1 | purity: >98% |
| reflux condenser | neoLab | LZ-1197 | length: 160 mm, NS 14/23 |
| rolled rim glass | VWR Chemicals | 548-0625 | volume: 10 mL |
| round neck flask | Carl Roth | HY50.1 | volume: 10 mL, NS 14/23 |
| rubber septum | Carl Roth | EE04.1 | material: silicone, NS 14/23 |
| syringe filter | Agilent Technologies | 5190-5267 | Captiva Econofilter, pore size 0.2 µm, PTFE menbrane |
| syringe pump | Landgraf Laborsysteme HLL | 106720180 | model: LA180A |
| TEM grid | Plano | diameter: 3.05 mm, 300 mesh, covered with formvar and coal | |
| temperature programmed oven | Nabertherm | model: L5, voltage: 230 V, power: 2.4 kW, controler: C6 | |
| tetrabutylammonium borohydride | Sigma Aldrich | 230170-10G | purity: 98 % |
| three neck round bottom flask | Carl Roth | KY19.1 | volume: 100 mL, NS 14/23, 14/23 |
| Titania P25 | Acros Organics | 384292500 | purity: 99 % |
| toluene | VWR Chemicals | 32249-1L-M | puriss. p. a., ACS reagent, >99.7% |
| transition piece | Carl Roth | with core and stop cock, straight tubing olive, 29/32 | |
| transmission electron microscope | Zeiss | model: 900N | |
| ultrasonic bath | Bandelin | 305 | model: RK 156, volume: 6 L |
| volumetric pipette | Brand | 29718 | volume: 50 mL |
| X-ray photoelectron spectrometer | Thermo Fisher | model: ESCALAB 250 xi |
Referencias
- Liu, L., Corma, A. Metal catalysts for heterogeneous catalysis: From single atoms to nanoclusters and nanoparticles. Chemical Reviews. 118 (10), 4981-5079 (2018).
- Zakarina, N., Bekturov, E. Platinum nanoparticles stabilized by polyvinylpyrrolidone for hydrogenation. Chinese Journal of Catalysis. 29 (11), 1165-1168 (2008).
- Rioux, R. M., et al. Monodisperse platinum nanoparticles of well-defined shape: synthesis, characterization, catalytic properties and future prospects. Topics in Catalysis. 39 (3-4), 167-174 (2006).
- Ikeda, S., et al. Ligand-free platinum nanoparticles encapsulated in a hollow porous carbon shell as a highly active heterogeneous hydrogenation catalyst. Angewandte Chemie. 118 (42), 7221-7224 (2006).
- Mostafa, S., et al. Shape-dependent catalytic properties of Pt nanoparticles. Journal of the American Chemical Society. 132 (44), 15714-15719 (2010).
- van Deelen, T. W., Hernández Mejía, C., de Jong, K. P. Control of metal-support interactions in heterogeneous catalysts to enhance activity and selectivity. Nature Catalysis. 2 (11), 955-970 (2019).
- Rioux, R. M., Hsu, B. B., Grass, M. E., Song, H., Somorjai, G. A. Influence of particle size on reaction selectivity in cyclohexene hydrogenation and dehydrogenation over silica-supported monodisperse Pt particles. Catalysis Letters. 126 (1-2), 10-19 (2008).
- Somorjai, G. A., Carrazza, J. Structure sensitivity of catalytic reactions. Industrial & Engineering Chemistry Fundamentals. 25 (1), 63-69 (1986).
- Somorjai, G. A. Surface science. Science. 201 (4355), 489-497 (1978).
- Fu, Q., Wagner, T. Interaction of nanostructured metal overlayers with oxide surfaces. Surface Science Reports. 62 (11), 431-498 (2007).
- Siemer, M., Tomaschun, G., Klüner, T., Christopher, P., Al-Shamery, K. Insights into spectator-directed catalysis: CO adsorption on amine-capped platinum nanoparticles on oxide supports. ACS Applied Materials & Interfaces. 12 (24), 27765-27776 (2020).
- Jana, N. R., Peng, X. Single-phase and gram-scale routes toward nearly monodisperse Au and other noble metal nanocrystals. Journal of the American Chemical Society. 125 (47), 14280-14281 (2003).
- Fenske, D., et al. Colloidal synthesis of pt nanoparticles: on the formation and stability of nanowires. Langmuir. 24 (16), 9011-9016 (2008).
- Osmić, M., Kolny-Olesiak, J., Al-Shamery, K. Size control and shape evolution of single-twinned platinum nanocrystals in a room temperature colloidal synthesis. CrystEngComm. 16 (42), 9907-9914 (2014).
- Schrader, I., Warneke, J., Backenköhler, J., Kunz, S. Functionalization of platinum nanoparticles with L-proline: simultaneous enhancements of catalytic activity and selectivity. Journal of the American Chemical Society. 137 (2), 905-912 (2015).
- Maxted, E. B., Biggs, M. S. The catalytic toxicity of nitrogen compounds. Toxicity of ammonia and of amines. Journal of the Chemical Society. , 3844-3847 (1957).
- Aliaga, C., et al. Sum frequency generation and catalytic reaction studies of the removal of organic capping agents from Pt nanoparticles by UV−Ozone treatment. The Journal of Physical Chemistry C. 113 (15), 6150-6155 (2009).
- Comotti, M., Li, W. -. C., Spliethoff, B., Schüth, F. Support effect in high activity gold catalysts for CO oxidation. Journal of the American Chemical Society. 128 (3), 917-924 (2006).
- Gorin, D. J., Sherry, B. D., Toste, F. D. Ligand effects in homogeneous Au catalysis. Chemical Reviews. 108 (8), 3351-3378 (2008).
- Kahsar, K. R., Schwartz, D. K., Medlin, J. W. Selective hydrogenation of polyunsaturated fatty acids using alkanethiol self-assembled monolayer-coated Pd/Al2O3 catalysts. ACS Catalysis. 3 (9), 2041-2044 (2013).
- Kahsar, K. R., Schwartz, D. K., Medlin, J. W. Control of metal catalyst selectivity through specific noncovalent molecular interactions. Journal of the American Chemical Society. 136 (1), 520-526 (2014).
- Pang, S. H., Schoenbaum, C. A., Schwartz, D. K., Medlin, J. W. Directing reaction pathways by catalyst active-site selection using self-assembled monolayers. Nature Communications. 4, 2448 (2013).
- Schoenbaum, C. A., Schwartz, D. K., Medlin, J. W. Controlling the surface environment of heterogeneous catalysts using self-assembled monolayers. Accounts of Chemical Research. 47 (4), 1438-1445 (2014).
- Grimes, R. N. Small carborane ligands as spectators and as players. Journal of Organometallic Chemistry. 581 (1-2), 1-12 (1999).
- Crabtree, R. H. Multifunctional ligands in transition metal catalysis. New Journal of Chemistry. 35 (1), 18-23 (2011).
- Dostert, K. -. H., O'Brien, C. P., Ivars-Barceló, F., Schauermann, S., Freund, H. -. J. Spectators control selectivity in surface chemistry: Acrolein partial hydrogenation over Pd. Journal of the American Chemical Society. 137 (42), 13496-13502 (2015).
- Hu, L., et al. Catalytic conversion of biomass-derived carbohydrates into fuels and chemicals via furanic aldehydes. RSC Advances. 2 (30), 11184 (2012).
- Pushkarev, V. V., Musselwhite, N., An, K., Alayoglu, S., Somorjai, G. A. High structure sensitivity of vapor-phase furfural decarbonylation/hydrogenation reaction network as a function of size and shape of Pt nanoparticles. Nano Letters. 12 (10), 5196-5201 (2012).
- Liao, X. -. M., Pitchon, V., Cuong, P. -. H., Chu, W., Caps, V. Hydrogenation of cinnamaldehyde over bimetallic Au–Cu/CeO2 catalyst under a mild condition. Chinese Chemical Letters. 28 (2), 293-296 (2017).
- Fang, D., He, F., Xie, J., Xue, L. Calibration of binding energy positions with C1s for XPS results. Journal of Wuhan University of Technology-Materials Science Edition. 35 (4), 711-718 (2020).
- Heiz, U., Landman, U. . Nanocatalysis: With 14 tables. , (2008).
- Nyholm, R., Berndtsson, A., Martensson, N. Core level binding energies for the elements Hf to Bi (Z=72-83). Journal of Physics C: Solid State Physics. 13 (36), 1091-1096 (1980).
- Fu, X., Wang, Y., Wu, N., Gui, L., Tang, Y. Surface modification of small platinum nanoclusters with alkylamine and alkylthiol: An XPS study on the influence of organic ligands on the Pt 4f binding energies of small platinum nanoclusters. Journal of Colloid and Interface Science. 243 (2), 326-330 (2001).
- Ono, L. K., Yuan, B., Heinrich, H., Cuenya, B. R. Formation and thermal stability of platinum oxides on size-selected platinum nanoparticles: Support effects. The Journal of Physical Chemistry C. 114 (50), 22119 (2010).
- Bachmann, P., et al. Dehydrogenation of the Liquid Organic Hydrogen Carrier System Indole/Indoline/Octahydroindole on Pt(111). The Journal of Physical Chemistry C. 122 (8), 4470-4479 (2018).
- Mudiyanselage, K., Trenary, M. Adsorption and thermal decomposition of N-methylaniline on Pt(111). Surface Science. 603 (21), 3215-3221 (2009).
- Briggs, D., Beamson, G. Primary and secondary oxygen-induced C1s binding energy shifts in x-ray photoelectron spectroscopy of polymers. Analytical Chemistry. 64 (15), 1729-1736 (1992).
- Huang, M., Adnot, A., Suppiah, S., Kaliaguine, S. XPS observation of surface interaction between H2 and CO2 on platinum foil. Journal of Molecular Catalysis A: Chemical. 104 (2), 131-137 (1995).
- Mohrhusen, L., Osmić, M. Sterical ligand stabilization of nanocrystals versus electrostatic shielding by ionic compounds: a principle model study with TEM and XPS. RSC Advances. 7 (21), 12897-12907 (2017).
- Otero-Irurueta, G., et al. Adsorption and coupling of 4-aminophenol on Pt(111) surfaces. Surface Science. 646, 5-12 (2015).
- Erley, W., Xu, R., Hemminger, J. C. Thermal decomposition of trimethylamine on Pt(111): spectroscopic identification of surface intermediates. Surface Science. 389 (1-3), 272-286 (1997).
- Bridge, M. E., Somers, J. The adsorption of methylamine on Pt(111). Vacuum. 38 (4-5), 317-320 (1988).
- Chen, X., Mao, S. S. Titanium dioxide nanomaterials: synthesis, properties, modifications, and applications. Chemical Reviews. 107 (7), 2891-2959 (2007).
- Madon, R. J., O'Connell, J. P., Boudart, M. Catalytic hydrogenation of cyclohexene: Part II. Liquid phase reaction on supported platinum in a gradientless slurry reactor. American Institute of Chemical Engineers Journal. 24 (5), 904-911 (1978).
- Pan, C. -. J., et al. Tuning/exploiting Strong Metal-Support Interaction (SMSI) in heterogeneous catalysis. Journal of the Taiwan Institute of Chemical Engineers. 74, 154-186 (2017).
- Lewera, A., Timperman, L., Roguska, A., Alonso-Vante, N. Metal–support interactions between nanosized Pt and metal oxides (WO 3 and TiO 2 ) studied using X-ray photoelectron spectroscopy. The Journal of Physical Chemistry C. 115 (41), 20153-20159 (2011).
- Ohyama, J., Yamamoto, A., Teramura, K., Shishido, T., Tanaka, T. Modification of metal nanoparticles with TiO2 and metal−support interaction in photodeposition. ACS Catalysis. 1 (3), 187-192 (2011).
- Zhong, J. -. Q., et al. Synchrotron-based ambient pressure X-ray photoelectron spectroscopy of hydrogen and helium. Applied Physics Letters. 112 (9), 91602 (2018).
- Günzler, H., Gremlich, H. -. U. . IR-Spektroskopie: Eine Einführung. , (2003).
- Hesse, M., Meier, H., Zeeh, B. . Spektroskopische Methoden in der organischen Chemie: 114 Tabellen. , (2012).
- Ripmeester, M., Duford, D. A., Yuan, S. Understanding the behaviour of dodecylamine as a model cationic collector in oil sands tailings dewatering applications using a novel FTIR based method. The Canadian Journal of Chemical Engineering. 98 (7), 1471-1482 (2020).
- Erdogdu, Y., Sertbakan, T. R., Güllüoğlu, M. T., Yurdakul, &. #. 3. 5. 0. ;., Güvenir, A. FT-IR and Raman spectroscopy and computation of 5-Methylfurfural. Journal of Applied Spectroscopy. 85 (3), 517-525 (2018).
- Kiss, &. #. 1. 9. 3. ;. I., Machytka, D., Bánki, J., Gál, M. Spectroscopic study of the conformational isomerism of 2-formylfuran derivatives. Journal of Molecular Structure. 197, 193-202 (1989).
- Allen, G., Bernstein, H. J. Internal rotation: VIII. The infrared and Raman spectra of furfural. Canadian Journal of Chemistry. 33 (6), 1055-1061 (1955).
- Thanh, N. T. K., Maclean, N., Mahiddine, S. Mechanisms of nucleation and growth of nanoparticles in solution. Chemical Reviews. 114 (15), 7610-7630 (2014).
- Tauster, S. J., Fung, S. C., Garten, R. L. Strong metal-support interactions. Group 8 noble metals supported on titanium dioxide. Journal of the American Chemical Society. 100 (1), 170-175 (1978).
- Beck, A., et al. The dynamics of overlayer formation on catalyst nanoparticles and strong metal-support interaction. Nature Communications. 11 (1), 3220 (2020).
- Sobota, M., et al. Ligand effects in SCILL model systems: site-specific interactions with Pt and Pd nanoparticles. Advanced Materials. 23 (2223), 2617-2621 (2011).
- Altmann, L., et al. Impact of organic ligands on the structure and hydrogenation performance of colloidally prepared bimetallic PtSn nanoparticles. ChemCatChem. 5 (7), 1803-1810 (2013).
- Modisha, P. M., Ouma, C. N. M., Garidzirai, R., Wasserscheid, P., Bessarabov, D. The prospect of hydrogen storage using liquid organic hydrogen carriers. Energy & Fuels. 33 (4), 2778-2796 (2019).
- Baker, L. R., et al. Furfuraldehyde hydrogenation on titanium oxide-supported platinum nanoparticles studied by sum frequency generation vibrational spectroscopy: acid-base catalysis explains the molecular origin of strong metal-support interactions. Journal of the American Chemical Society. 134 (34), 14208-14216 (2012).
- Kijeński, J., Winiarek, P., Paryjczak, T., Lewicki, A., Mikołajska, A. Platinum deposited on monolayer supports in selective hydrogenation of furfural to furfuryl alcohol. Applied Catalysis A: General. 233 (1-2), 171-182 (2002).
- Kijeński, J., Winiarek, P. Selective hydrogenation of α,β-unsaturated aldehydes over Pt catalysts deposited on monolayer supports. Applied Catalysis A: General. 193 (1-2), 1-4 (2000).
- Taylor, M. J., et al. Highly selective hydrogenation of furfural over supported Pt nanoparticles under mild conditions. Applied Catalysis B. 180, 580-585 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados